Extraction Optimization and Analysis on Properties of Protein on Peony Seed Meal
-
摘要: 本研究通过碱溶酸沉法对牡丹籽粕中的蛋白进行提取。选取料液比、pH、时间和温度进行单因素研究,结合响应面法优化获得最佳提取工艺,并对蛋白的物化特性进行分析。确定最佳工艺条件:料液比1:25 g/mL,pH10.6,温度55 ℃,时间130 min时,蛋白得率为23.81%±0.04%。在此条件下获得的牡丹籽粕蛋白中含有18种氨基酸;蛋白的持水性和持油性分别为3.72和3.67 g/g;起泡性和泡沫稳定性在pH2~4时均明显降低,pH4时最小,pH6~10之间时,起泡性持续增加,泡沫稳定性明显上升后略有下降;乳化性和乳化稳定性随pH增大而增加,与粒径和Zeta电位所反映的结果相符。本研究为牡丹籽粕蛋白的工业化生产和综合利用提供了理论依据。Abstract: In this study, an alkali solution and acid precipitation method were used to extract protein from peony seed meal. Solid-liquid ratio, pH, time, and temperature were selected to carry out a single-factor study and combined with the response surface method to optimize the optimal extraction process. The optimum process conditions were determined: The protein yield reached 23.81%±0.04% when the ratio of solid to liquid was 1:25 g/mL, pH10.6, the temperature was 55 ℃, and time was 130 min. The peony seed meal protein obtained under these conditions contained 18 kinds of amino acids. The water and oil retention of peony seed meal protein was 3.72 g/g and 3.67 g/g, respectively. Foamability and foam stability decreased significantly at pH2~4, and the lowest was at pH4. Between pH6 and 10, foamability continued to increase, while foam stability increased significantly and then decreased slightly. With the increase in pH, the emulsification and emulsification stability increased. The results were consistent with the variation trend of particle size and Zeta potential. This study provided a theoretical basis for the industrial production and comprehensive utilization of peony seed meal protein.
-
牡丹(Paeonia suffruticosa Andr.)为芍药属多年生木本经济植物,具有重要的观赏和药用价值,且作为经济作物在全世界范围内栽培[1-3]。牡丹广泛种植于我国山东、河南、四川、陕西等地,随着牡丹种植面积和牡丹籽油产量的不断增加,产生了大量的牡丹籽粕。作为牡丹籽油加工过程中的副产物,牡丹籽粕重量约占牡丹籽仁的67%,主要含有蛋白质、多糖、黄酮、萜类和微量元素等,其中蛋白质含量达26.98%,具有开发新资源蛋白质的潜在价值[4-6]。牡丹籽粕目前主要被用作饲料和肥料,其中的蛋白未得到有效利用,造成了一定程度的资源浪费。牡丹籽粕蛋白含量丰富且具有良好的乳化特性、持水性和持油性等[7]。不同蛋白质结构上存在的差异可能是引起其功能特性发生改变的直接因素[8]。王青等[9]以超声波辅助提取法结合响应面法确定牡丹籽粕中的蛋白工艺为:47 ℃、pH11.5、料液比1:35 g/mL、提取150 min时蛋白质提取率93.12%。鹿杰等[10]采用醇提-碱提酸沉-闪蒸热处理法结合正交实验确定了牡丹籽蛋白的最佳提取工艺:50 ℃、3.5 h、NaOH浓度0.008 mol/L、料液比1:25 g/mL、pH4.0时提取率为51.62%±0.34%。同时,研究发现牡丹籽粕蛋白在泡沫稳定性和乳化稳定性方面均优于大豆分离蛋白[10-11]。但鲜有通过响应面法确定牡丹籽粕蛋白的最佳提取工艺并对蛋白的特性进行较为全面分析评价的文章。因此,对牡丹籽粕蛋白结构和功能性质开展研究,将有助于牡丹籽粕蛋白的合理加工与利用。
本研究以牡丹籽粕为蛋白来源,基于单因素实验并结合响应面法优化确定蛋白的最佳提取工艺,并对牡丹籽粕蛋白的氨基酸组成、持水性和持油性,以及不同pH条件下的粒径、Zeta电位、起泡性、泡沫稳定性、乳化性和乳化稳定性进行测定,从而实现对提取得到的蛋白进行结构和功能性质分析,旨在为牡丹籽粕蛋白的工业化生产及牡丹资源的综合开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
凤丹牡丹籽粕(蛋白含量28.68%) 山东菏泽谷雨牡丹生物科技有限公司提供;酪蛋白(总氮≥13.5%) 北京索莱宝科技有限公司;石油醚、硫酸铜、酒石酸钾钠、氢氧化钠、浓盐酸、四氯化碳 分析纯,天津凯通化学试剂有限公司。
Mastersizer 2000激光粒度分散仪 英国马尔文公司;Adventurer电子天平 奥豪斯国际贸易(上海)有限公司;ST2100 pH计 奥豪斯仪器(常州)有限公司;SHA-B数显恒温振荡器 常州天瑞仪器有限公司;T18高速分散机 德国IKA公司;UV-5100B紫外可见分光光度计 上海元析仪器有限公司;FD-304真空冷冻干燥机 济南骏德仪器有限公司;LC-20AT高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 脱脂牡丹籽粕的制备
牡丹籽粕粉碎后过40目筛,经石油醚脱脂,备用。
1.2.2 牡丹籽粕蛋白等电点的测定
称取10.0 g牡丹籽粕,加入 pH10 的 NaOH 溶液 150 mL,30 ℃ 磁力搅拌60 min,5000 r/min离心10 min后取上清液,用1 mol/L的HCl溶液调节上清液pH至3.0、3.5、4.0、4.5、5.0、5.5,5000 r/min离心10 min,在595 nm处测定上清液吸光值A,根据吸光度值确定牡丹籽粕蛋白的等电点[11-12]。
1.2.3 牡丹籽粕蛋白提取
配制双缩脲试剂[13],备用。取1.0 g脱脂牡丹籽粕于50 mL离心管中,并按照一定比例加入不同pH的NaOH溶液,采用恒温摇床在不同温度下提取不同时间,5000 r/min离心15 min后取上清液用1 mol/L HCl调节pH至3.5,5000 r/min离心15 min,所得沉淀物即为粗蛋白。经50 ℃恒温干燥后用25 mL双缩脲试剂溶解,取1 mL溶解后组分、1 mL四氯化碳和3 mL双缩脲试剂混匀,定容至5 mL,采用紫外分光光度计于560 nm处测定吸光度值,计算牡丹籽粕蛋白得率[14-15]。
1.2.4 单因素实验
按照1.2.3进行牡丹籽粕蛋白质的提取与测定,以牡丹籽粕蛋白的得率为考察指标,单因素变量实验水平设计见表1。
表 1 单因素变量实验水平设计Table 1. Factor level of single factor variable design实验设计 料液比(g/mL) pH 温度(℃) 时间(min) 1 1:15、1:20、1:25、1:30、1:35 10 40 30 2 1:25 8、9、10、11、12 40 30 3 1:25 11 40 70、90、110、130、150 4 1:25 11 40、45、50、55、60 130 1.2.5 响应面试验
根据单因素实验结果,选取对蛋白得率影响最大的三个水平,料液比(A)、pH(B)和温度(C)为响应因子,以牡丹籽粕蛋白得率为响应值,建立三因素三水平的Box-Behnken试验,如表2所示。
表 2 响应面试验分析因素与水平Table 2. Response surface test analysis factors and levels水平 因素 料液比(g/mL) pH 温度(℃) −1 1:20 10 50 0 1:25 11 55 1 1:30 12 60 1.2.6 牡丹籽粕蛋白得率的计算
1.2.6.1 标准曲线的绘制
准确称取酪蛋白1.0 g,滴加0.1 mol/L NaOH溶液溶解,定容至100 mL,得到10 mg/mL标准溶液,备用,取酪蛋白标准液0.0、0.2、0.4、0.6、0.8、1.0 mL于试管中,去离子水补齐至1 mL,加入1 mL四氯化碳和3 mL双缩脲试剂混匀,室温下反应30 min,560 nm波长下测定吸光度值。以稀释后酪蛋白含量(0、0.4、0.8、1.2、1.6、2.0 mg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线[16]。确定标准曲线方程y=0.3084x+0.0081,R2=0.9944。
1.2.6.2 蛋白得率的计算
W(%)=m1m2×100 式中:m1:用线性回归方程计算出蛋白的质量,g;m2:样品的质量,g。
1.2.7 牡丹籽粕蛋白物化特性的测定
通过优化后的工艺进行牡丹籽粕蛋白的提取,对提取得到的蛋白置于真空冷冻干燥机中,冷冻干燥后进行特性研究。
1.2.7.1 牡丹籽粕蛋白氨基酸组成的测定
色氨酸测定方法参照GB 18246-2000,其他氨基酸测定方法参考赵璇[17]的方法并稍作修改。取0.1~0.2 g冷冻干燥后样品,按照体积比1:1加入10 mL HCl,封口,110 ℃下水解22 h,定容至25 mL。取10 μL干燥剂(甲醇:水:三乙胺=4:4:2),氮气吹干加入20 μL衍生剂(甲醇:水:三乙胺:异硫氰酸苯酯=1:7:1:1),衍生30 min后氮气吹干,加入200 μL缓冲盐溶液(0.071%磷酸氢二钠,10%磷酸+乙腈(95%+5%)pH7.4),高效液相色谱进行测定。高效液相色谱工作条件:岛津LC-20AT;色谱柱Waters X-Bridge C18(250 mm×4.6 mm, 5 μm);柱温:36 ℃;流速:1.0 mL/min;检测波长:254 nm;进样量:10 μL;流动相:0.1 mol/L;乙酸钠水溶液+乙腈=93+7(A)和乙腈+水=4+1(B);洗脱条件0~7 min,2%~5%(B),7~20 min,5%~40%(B),20.01~26.0 min,90%(B)。
1.2.7.2 牡丹籽粕蛋白持水性测定
取0.5 g蛋白加入30 mL去离子水混匀,4000 r/min离心15 min,弃上清,对比前后重量变化,计算牡丹籽粕蛋白的持水性[18]:
持水性(g/g)=m2−m1m0 式中:m0:蛋白质量,g;m1:离心管质量,g;m2:离心后离心管和剩余物的质量,g。
1.2.7.3 牡丹籽粕蛋白持油性测定
取0.5 g蛋白加入30 mL稻米油混匀,4000 r/min离心15 min,弃去油层,对比前后重量变化,计算牡丹籽粕蛋白的持油性[19]:
持油性(g/g)=m2−m1m0 式中:m0:蛋白质量,g;m1:离心管质量,g;m2:离心后离心管和剩余物的质量,g。
1.2.7.4 不同pH条件下粒径和Zeta电位的测定
将冻干样品溶于蒸馏水中,配制成1 mg/mL溶液,25 ℃磁力搅拌1 h,4 ℃条件下保存12 h。调节pH至2.0、4.0、6.0、8.0、10.0,测定不同pH条件下的Zeta电位[20-22]。
1.2.7.5 不同pH条件下起泡性和泡沫稳定性测定
取1.0 g蛋白加去离子水溶解,容量瓶定容至500 mL,取25 mL,用0.1 mol/L的NaOH和HCl调节pH至2.0、4.0、6.0、8.0、10.0,匀浆3 min,计算起泡性(F0)和泡沫稳定性(F1)[23-25]:
F0(%)=V030×100 F1(%)=Vt30×100 式中:F0:起泡性,%;F1:泡沫稳定性,%;V0:泡沫体积,mL;Vt:25 ℃条件下放置30 min后泡沫的体积,mL。
1.2.7.6 不同pH条件下乳化性及乳化稳定性测定
取0.5 g蛋白溶解,容量瓶定容至500 mL,取10 mL,用0.1 mol/L的NaOH和HCl调节pH至2.0、4.0、6.0、8.0、10.0,分别加入10 mL稻米油,快速搅拌1 min,1200 r/min离心5 min,测定蛋白的乳化性。离心后样品80 ℃下,水浴加热30 min,完全冷却后再次在1200 r/min离心5 min,计算乳化性及乳化稳定性[26]:
乳化性(%)=被乳化层高度离心管中的样液总高度×100 乳化稳定性(%)=保持乳化层高度原乳化层高度×100 1.3 数据处理
单因素实验均重复3次,分别采用Design Expert 11、Origin 2017软件进行响应面数据统计分析和绘图,采用SPSS 25.0软件进行显著性分析,P<0.05表示差异性显著。
2. 结果与分析
2.1 牡丹籽粕蛋白等电点的测定
不同pH下牡丹籽粕蛋白提取的上清液吸光度见图1。结果发现,在pH3.0~3.5时牡丹籽粕蛋白溶液的吸光度降低,在pH3.5~5.5时逐渐升高,并在pH3.5时达最小值0.034,表明此时上清液中蛋白含量最低,蛋白沉淀较为完全。由此选取pH3.5为牡丹籽粕蛋白的等电点,作为后续进行蛋白沉降的pH条件,该结果与宋艳秋等[11]的测定结果一致。
2.2 牡丹籽粕蛋白提取的单因素实验
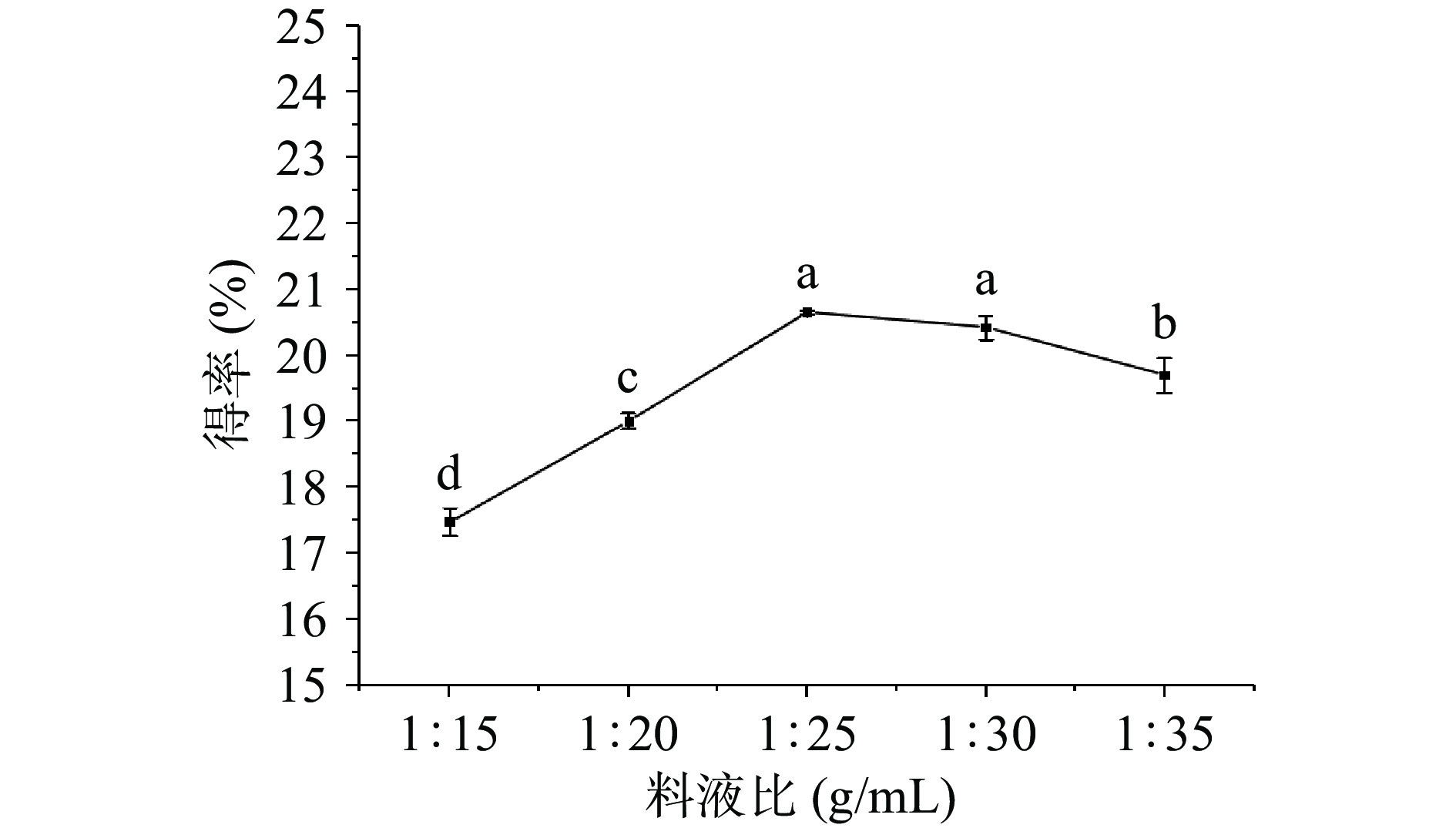
2.2.1 料液比对牡丹籽粕蛋白得率的影响
由图2可知,蛋白得率呈现先增加后减少的趋势,当料液比为1:25 g/mL时得率达到峰值20.66%。料液比较低时,体系粘度过高,提取溶剂不易渗入,蛋白成分难以渗出,因此得率较低,随着料液比增加,提取溶剂可以充分与牡丹籽粕进行接触[27],蛋白得率显著提高(P<0.05)。料液比大于1:25 g/mL时,蛋白浓度降低,分子充分膨胀,将提取得到的溶液调至等电点pH3.5时,溶解在上清液中的蛋白数量增多,导致得率下降[28]。
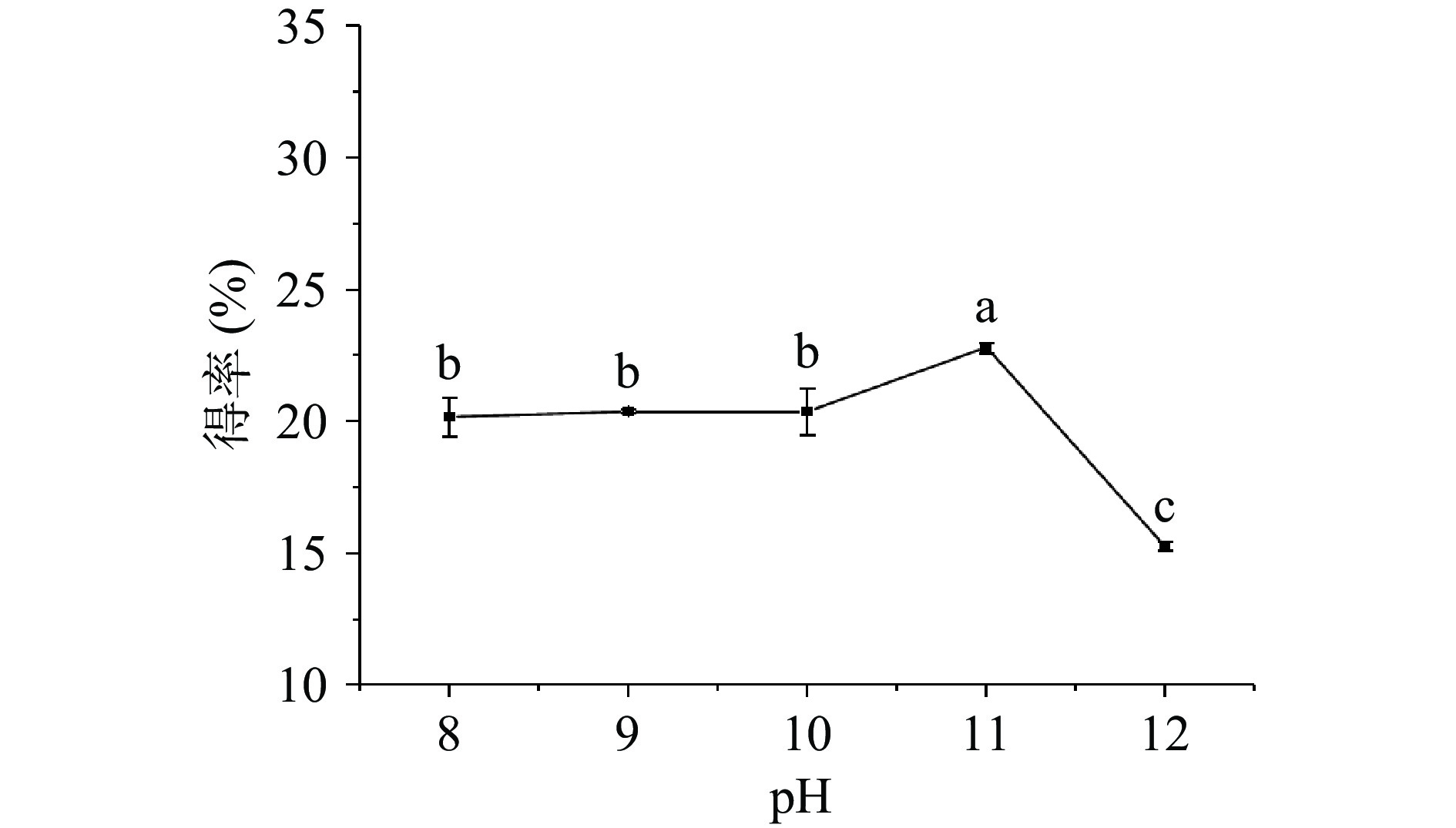
2.2.2 pH对牡丹籽粕蛋白得率的影响
由图3所示,得率在pH8~10范围内变化不明显,在pH10~11时显著升高(P<0.05),在pH11时达到最高22.83%。碱性条件使蛋白分子表面带有同种电荷,蛋白-蛋白之间斥力增加,同时蛋白质表面亲水基团暴露,与水分子的结合能力增强,从而起到增加溶解度的作用[29-30]。当pH大于11时,较高的碱性条件会导致蛋白变性,得率下降,溶液颜色变深[31]。
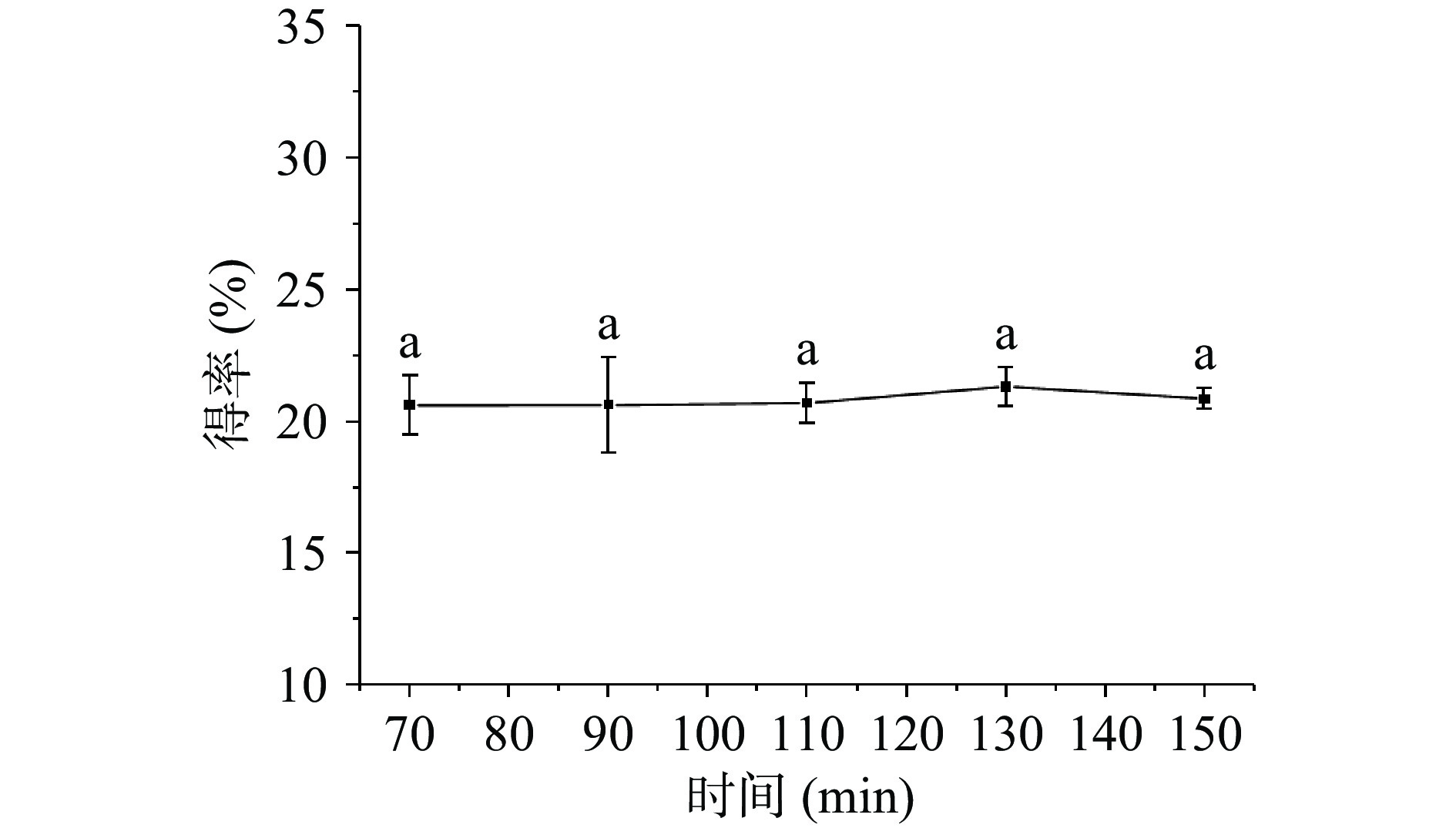
2.2.3 时间对牡丹籽粕蛋白得率的影响
如图4所示,随提取时间的增加,蛋白得率先缓慢增加后减小,在130 min时达到最高21.35%。蛋白得率增加是因为经过一定时间的提取后,牡丹籽粕充分溶胀,有利于蛋白的提取[32]。该因素对蛋白得率有一定的影响,但由于得率变化幅度较小,因此可以作为次要因素考虑,不作为响应面优化的参数。此外,随着提取时间的延长,蛋白可能发生聚合沉淀,在离心过程中与不溶物一起被去除,导致得率降低[33]。
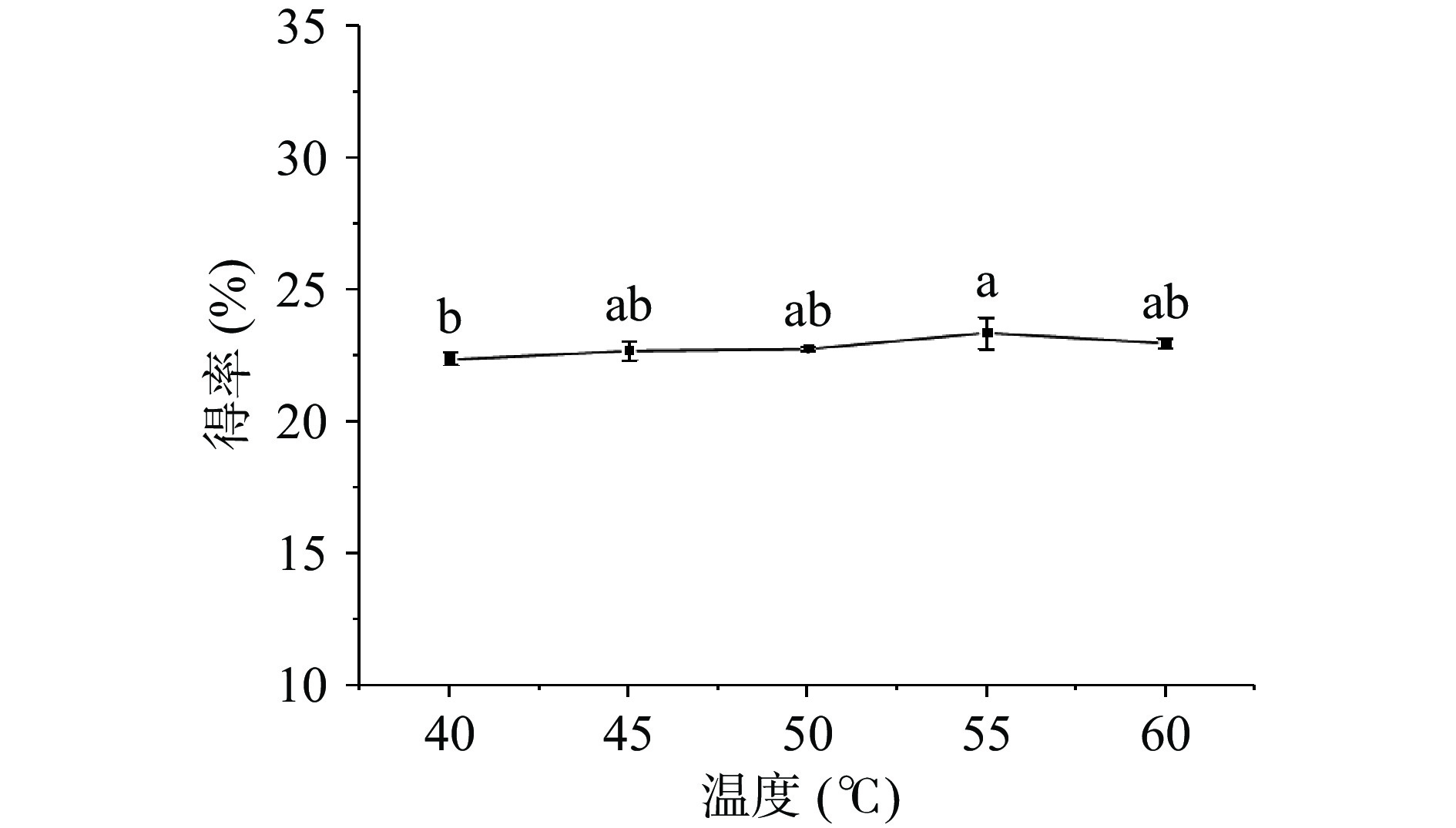
2.2.4 温度对牡丹籽粕蛋白得率的影响
由图5可知,蛋白得率在40~55 ℃之间与温度变化呈正比,在55 ℃时达到最高22.75%。随温度的升高,分子的移动速度加快,传质速率加快,溶解度增加,溶液黏度降低,从而使得蛋白得率增加,当温度继续增加至60 ℃时,高温会导致蛋白活性降低同时引起蛋白热变性,使蛋白得率降低[34]。
2.3 响应面试验结果
2.3.1 响应面试验的建立及方差分析
响应面试验方案及结果见表3,方差分析见表4。基于单因素实验结果,采用Design Export 11统计分析软件设计出3因素3水平的响应分析试验,通过二次多元回归拟合,得到牡丹籽粕蛋白得率Y与料液比(A)、pH(B)、温度(C)3个因素之间的二次回归方程:Y=23.61+0.3625A−1.77B−0.0525C+0.4475AB−0.1775AC−0.0725BC−1.02A2−2.10B2−0.1103C2。模型决定系数R2=0.9943,校正后决定系数R2Adj=0.9869,说明该回归方程拟合程度较好,且可信度较高,能够利用此模型对牡丹籽粕蛋白的得率进行预测。
表 3 响应面试验结果Table 3. Response surface test results试验号 A 料液比 B pH C 温度 Y 得率(%) 1 −1 0 1 22.45 2 −1 1 0 17.73 3 −1 0 −1 22.04 4 −1 −1 0 22.29 5 0 0 0 23.38 6 0 1 −1 19.89 7 0 −1 1 23.06 8 0 0 0 23.78 9 0 0 0 23.61 10 0 0 0 23.71 11 0 1 1 19.48 12 0 −1 −1 23.18 13 0 0 0 23.56 14 1 1 0 19.6 15 1 −1 0 22.37 16 1 0 −1 22.87 17 1 0 1 22.57 表 4 回归模型方差分析Table 4. Regression model variance analysis来源 平方和 自由度 均方 F值 P值 差异性 模型 51.40 9 5.71 134.63 <0.0001 ** A 料液比 1.05 1 1.05 24.78 0.0016 ** B pH 25.20 1 25.20 594.20 <0.0001 ** C 温度 0.0221 1 0.0221 0.5198 0.4943 AB 0.8010 1 0.8010 18.88 0.0034 ** AC 0.1260 1 0.1260 2.97 0.1284 BC 0.0210 1 0.0210 0.4957 0.5042 A2 4.34 1 4.34 102.31 <0.0001 ** B2 18.48 1 18.48 435.76 <0.0001 ** C2 0.0512 1 0.0512 1.21 0.3084 残差 0.2969 7 0.0424 失拟项 0.2027 3 0.0676 2.87 0.1677 不显著 绝对误差 0.0943 4 0.0236 总和 51.70 16 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 由表4可知,在碱液提取牡丹籽粕蛋白得过程中,回归模拟一次项A、B,交互项AB,二次项A2、B2对蛋白得率影响极显著(P<0.01),一次项C,交互项AC、BC和二次项C2对蛋白得率影响不显著(P>0.05),可将其删除。最终确定回归模型为Y=23.61+0.3625A−1.77B+0.4475AB−1.02A2−2.10B2。提取因素对牡丹籽粕蛋白得率的影响为:pH>料液比>温度。
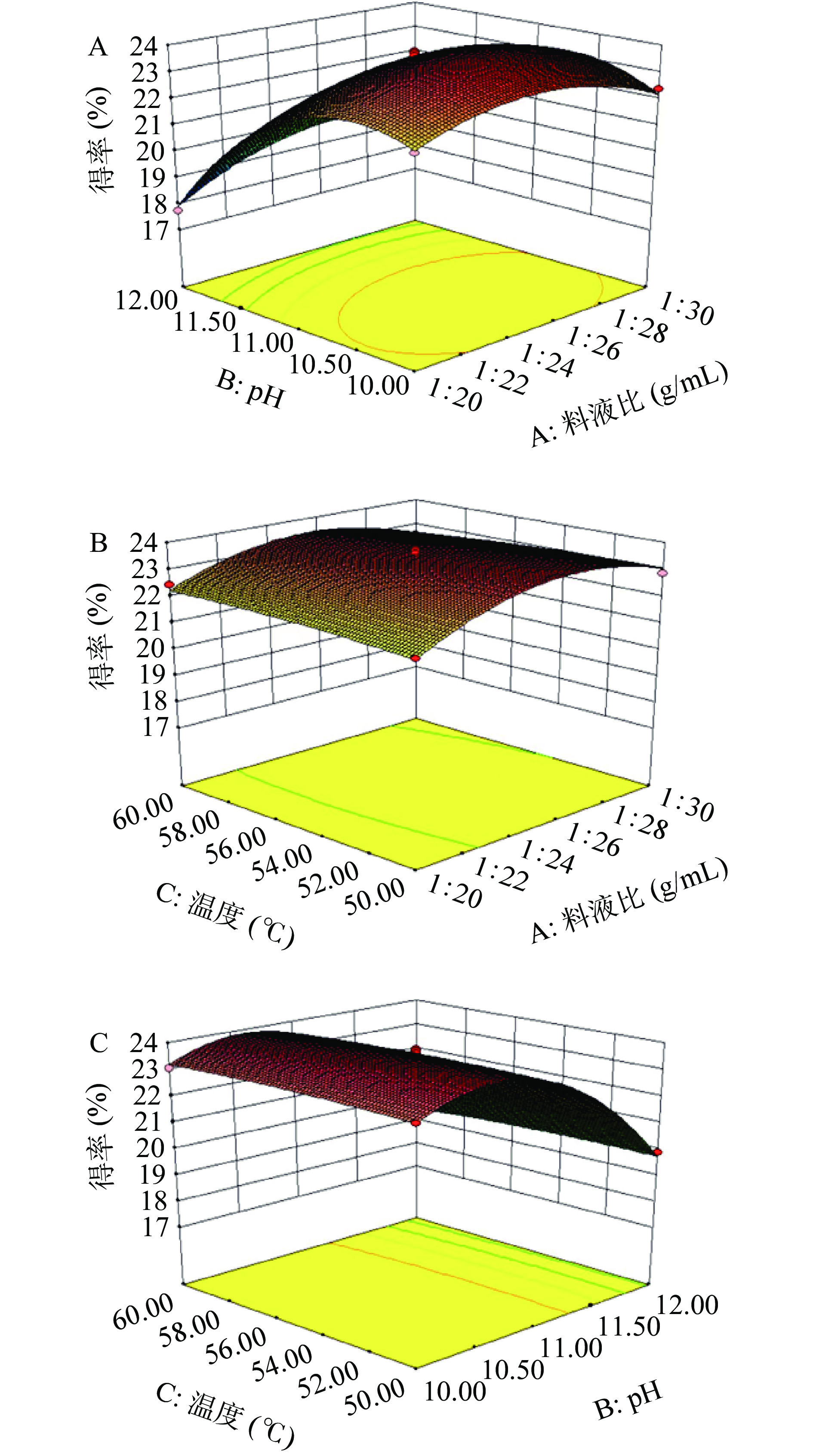
2.3.2 响应面结果分析
蛋白得率受各因素交互作用影响结果见图6。响应面图的坡度越陡峭,表明两因素的交互作用越强,越平缓则表明交互作用越弱。等高线密集呈椭圆形表明两因素交互作用影响大[35]。图6A表明,等高线密集且呈椭圆形,说明料液比和pH的交互作用对蛋白得率的影响显著,当固定反应pH为最优时,随着料液比的增加,蛋白得率变化不明显,证明料液比对得率的影响小于pH,与单因素实验一致;图6B表明,当固定料液比为最优时,反应温度对蛋白得率影响不明显,因此确定料液比对蛋白得率的影响大于温度;图6C表明,当固定反应pH不变时,蛋白得率随温度变化不明显,说明pH对蛋白得率的影响大于温度。
2.3.3 回归模型验证
通过Design Expert 11软件分析提取因素对得率的影响,经过优化得牡丹籽粕中蛋白最佳的提取条件为:料液比1:25.53 g/mL,pH10.59,温度54.06 ℃,蛋白得率达到最大值24.00%。考虑到实际生产的便捷性,选择料液比1:25 g/mL,pH10.6,温度55 ℃进行验证,实测得率为23.81%±0.04%。可达到预测值的99.2%,表明采用响应面优化得到的工艺模型稳定性好,可行性高。
2.4 蛋白溶液特性的测定
2.4.1 氨基酸组成及含量
由表5可知,牡丹籽粕蛋白中共含有18种氨基酸,种类齐全,比例合理,种类多于丁东源等[36]检测到的16种氨基酸。人体所需的8种必需氨基酸和婴儿所必需的组氨酸在该牡丹籽粕蛋白中均被检出。必需氨基酸中亮氨酸含量最高,为6.53%±0.07%。亮氨酸可以通过促进糖异生来调节血糖水平,在低热量的条件下有助于保持较轻的体重[37]。谷氨酸在总氨基酸中的含量最高,为22.79%±0.30%,该氨基酸有助于提高新生儿发育时期的免疫功能[38]。本研究中牡丹籽粕中亮氨酸和谷氨酸的含量与昝丽霞等[39]试验结果一致。
表 5 牡丹籽粕蛋白的氨基酸组成及含量Table 5. Amino acid composition and content of peony seed meal protein氨基酸 缩写 样品含量(%) 天冬氨酸 Asp 9.00±0.26 谷氨酸 Glu 22.79±0.30 丝氨酸 Ser 4.39±0.04 甘氨酸 Gly 4.16±0.01 组氨酸 His 1.77±0.03 精氨酸 Arg 6.78±0.13 苏氨酸* Thr 2.45±0.04 丙氨酸 Ala 3.91±0.00 脯氨酸 Pro 3.86±0.18 酪氨酸 Tyr 2.55±0.06 缬氨酸* Val 4.87±0.06 蛋氨酸* Met 1.06±0.04 胱氨酸 Cyr 1.16±0.04 异亮氨酸* Ile 3.53±0.08 亮氨酸* Leu 6.53±0.07 苯丙氨酸* Phe 3.19±0.11 赖氨酸* Lys 1.79±0.08 色氨酸* Trp 0.63±0.01 总量 84.42 注:*表示必需氨基酸。 2.4.2 牡丹籽粕蛋白持水性与持油性
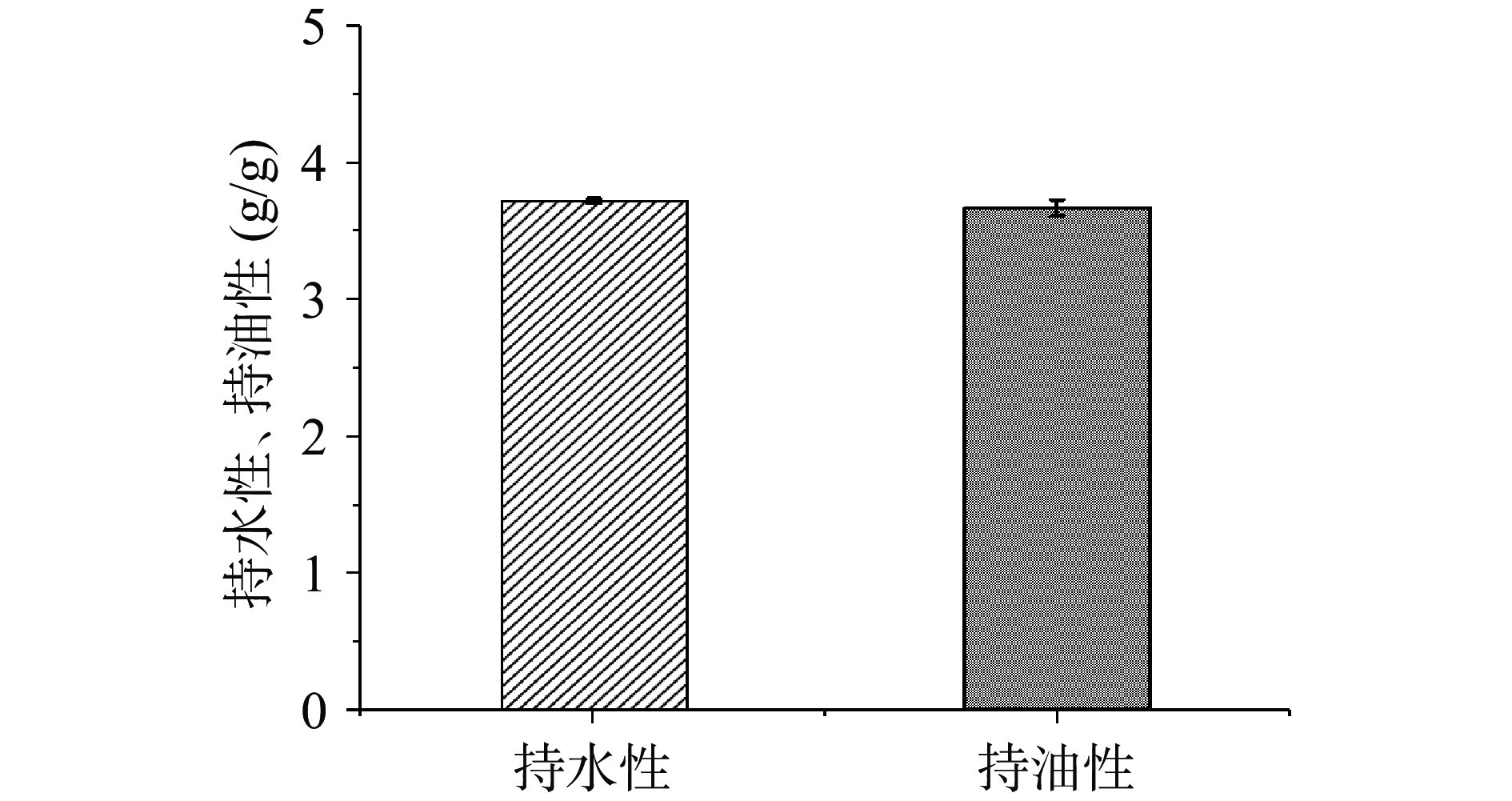
由图7可知,牡丹籽粕蛋白的持水性为3.72 g/g,持油性为3.67 g/g,高于采用超临界CO2萃取脱脂后得到的牡丹籽粕蛋白的持水性(1.99 g/g)和持油性(2.65 g/g)[11]。当持水能力在1.49~4.72 g/g之间,认为该产品可以改善食品粘度,牡丹籽粕蛋白持水性和持油性高于碱溶酸沉法制备的芝麻饼粕蛋白的持水性(0.8807 g/g)和持油性(2.12 g/g)[40-41]。
2.4.3 不同pH条件下蛋白溶液的粒径
由图8可知,蛋白粒径在pH4时最大,为2129 nm。等电点左右,净电荷接近零,静电斥力最小,蛋白伸展程度较大,发生解聚,疏水基团和其它活性残基暴露程度提高,加速了蛋白的聚集速度,进而产生了较大聚集体,粒径最大,在远离等点处均减小[42]。当溶液pH2时,液滴带正电荷,其排斥力较大,相互之间不发生凝聚,粒径减小,溶液稳定性高[43]。pH增加,蛋白表面带负电的电荷数量增多,斥力增强,导致分子不易聚集,使得平均粒径呈整体呈下降趋势,显著提高了溶液的稳定性[43-44]。
2.4.4 不同pH条件下蛋白溶液的Zeta电位
溶液的pH会影响蛋白分子的离子化程度,改变蛋白表面基团的构象,引起Zeta电位的改变[44]。如图9结果显示,pH2时带正电荷,pH6~10时带负电荷。Zeta电位为负值说明蛋白表面带负电荷的氨基酸数量多于带正电荷的氨基酸。pH4时基本不带电荷,因为pH4与牡丹籽粕蛋白的等电点相近,蛋白在等电点附近通过疏水相互作用、二硫键的展开和聚集形成不可逆的颗粒聚集,导致蛋白的溶解性最小[45]。当pH在8~10时Zeta电位的绝对值明显增加,意味着该状态下颗粒相互排斥,没有絮凝的趋势,溶液体系越稳定[46]。
2.4.5 蛋白起泡性及泡沫稳定性
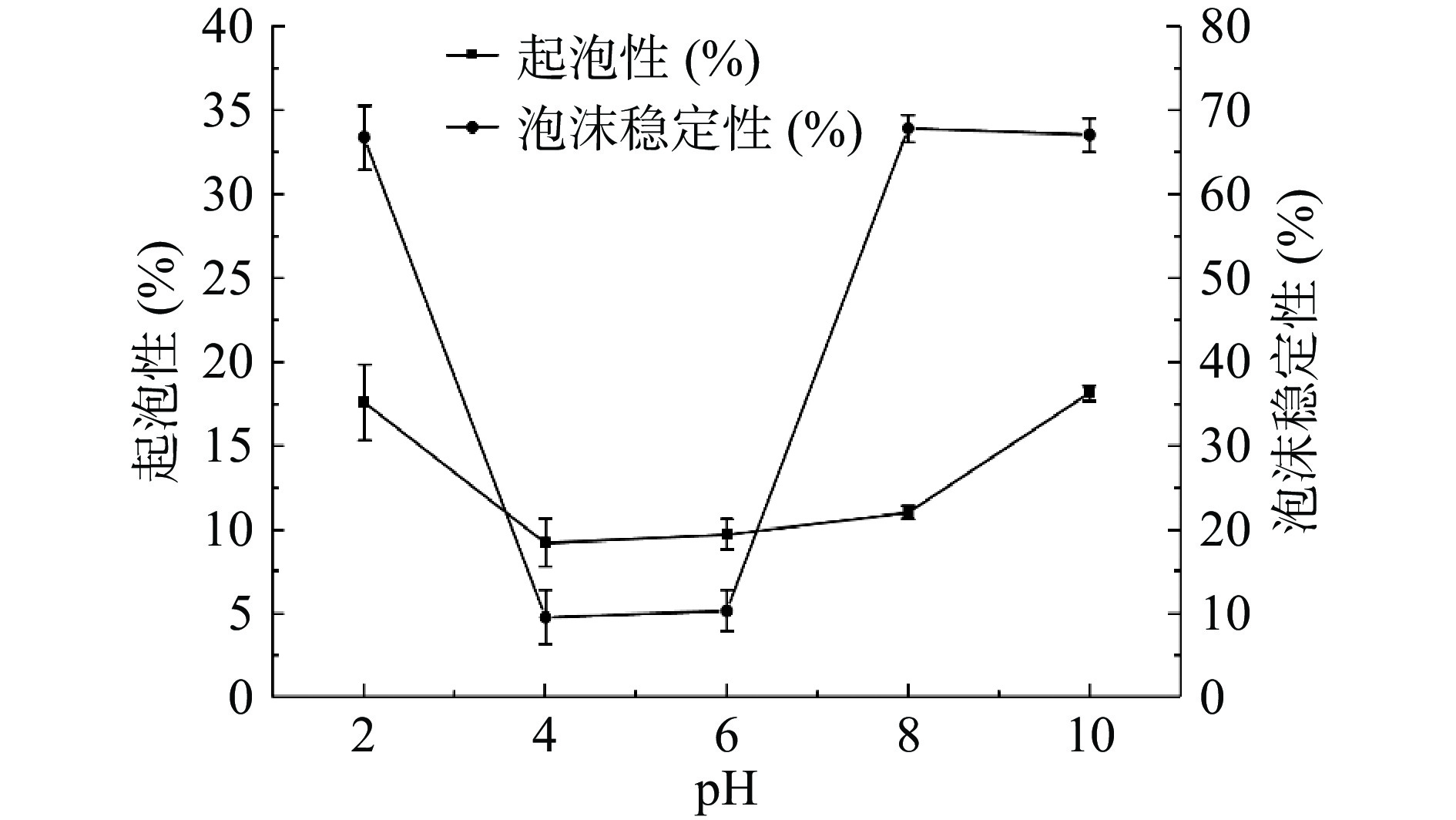
起泡是蛋白重要的功能特性,通常以起泡性和泡沫稳定性来衡量[8]。由图10所示,起泡性和泡沫稳定性在pH2~4时均呈下降趋势。在pH4时,蛋白的起泡性和泡沫稳定性均为最小,分别为9.20%和9.53%。蛋白的起泡性与可溶性蛋白有关,等电点处可溶性蛋白的浓度低,从而导致起泡性降低[47]。两者在pH4~6和偏碱性条件下均有所增加。pH升高,蛋白表面负电荷数目增多,分子间斥力和表面疏水性增大,从而提高了蛋白的起泡性[48]。较好的起泡性有利于蛋白在空气-水界面扩散,包裹空气颗粒,进而促进泡沫的形成[49]。酸性或碱性环境中存在的电荷和化学基团会影响蛋白的柔性,或者吸附在界面上从而对蛋白的吸附造成影响[50]。等电点附近由于蛋白分子之间发生相互作用,使得蛋白在气液界面上变厚变硬,从而使得泡沫稳定性变差[51]。在远离等电点处,蛋白暴露出更多的疏水区域可以提高泡沫的稳定性[52]。
2.4.6 蛋白乳化性及乳化稳定性
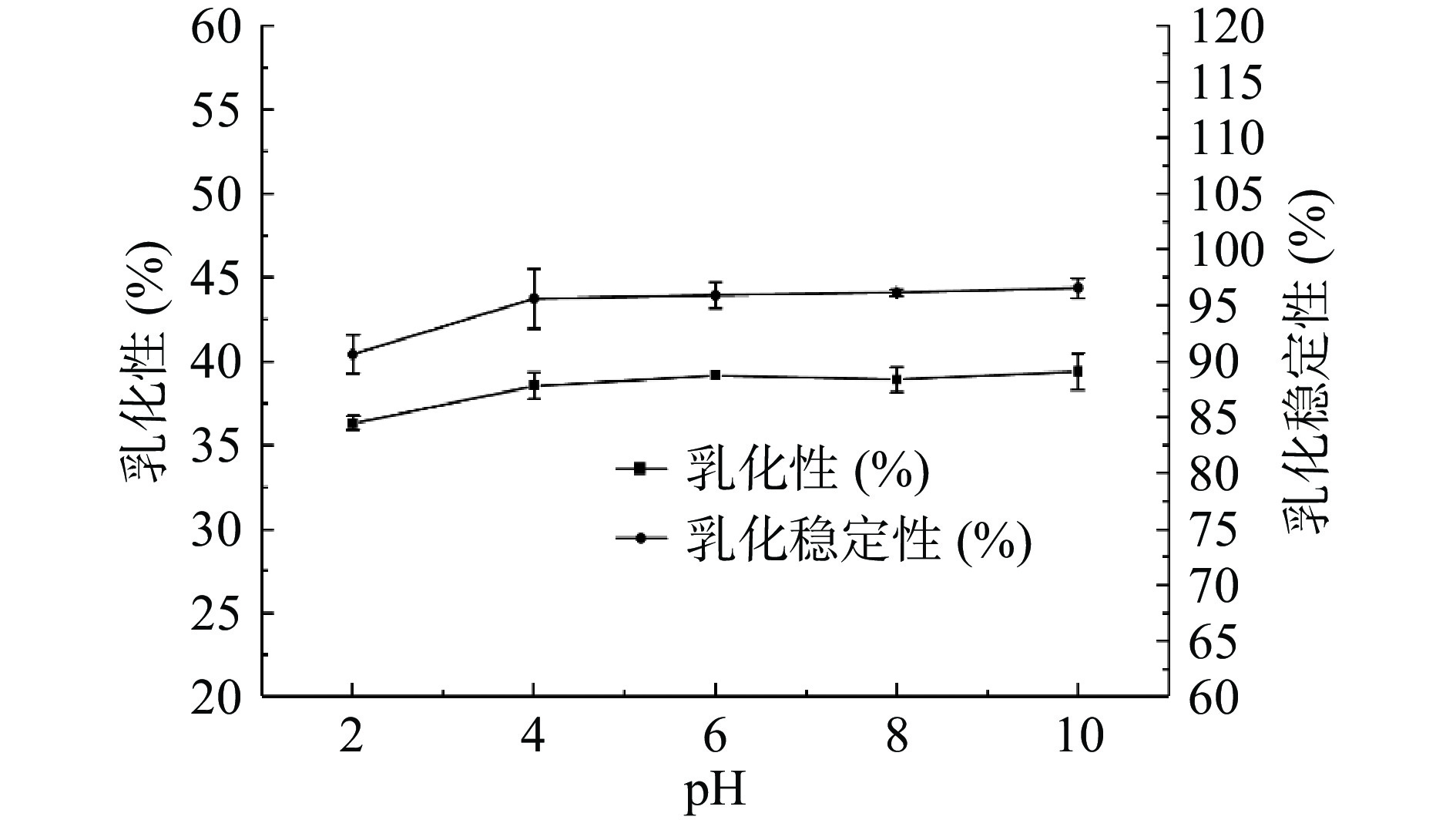
蛋白乳化性是指蛋白促进油滴在水中形成乳状液,并使之保持稳定的特性[53]。由图11可知,乳化性及乳化稳定性均随pH的增大而增大。等电点附近,静电斥力减弱,蛋白的溶解性变差,使得在O/W界面上吸附的蛋白减少,界面薄膜的稳定性被破坏,从而降低了乳化性和乳化稳定性[54-55]。在酸碱作用下,蛋白远离等电点,结构松散,有利于O/W界面的快速吸附,从而防止了合并作用的发生,提高了蛋白的乳化性和乳化稳定性[55-56]。
3. 结论
本研究以牡丹籽油加工过程中产生的牡丹籽粕为研究对象,结合响应面试验优化提取工艺,确定在料液比1:25 g/mL,pH10.6,温度55 ℃,提取130 min时,蛋白得率最高为23.81%±0.04%。牡丹籽粕蛋白中含有18种氨基酸,谷氨酸含量高达22.79%±0.30% 。牡丹籽粕蛋白的持水性和持油性分别为3.72 g/g和3.67 g/g,其粒径在等电点处最大为2129 nm,Zeta电位在蛋白等电点左右为零,在远离等电点处蛋白的起泡性、泡沫稳定性、乳化性、乳化稳定性均有所增加。本文旨在为牡丹籽粕蛋白的提取提供理论依据,同时为牡丹籽粕蛋白在食品工业中应用范围的拓宽提供参考,进而实现牡丹籽粕废弃率的降低。
-
表 1 单因素变量实验水平设计
Table 1 Factor level of single factor variable design
实验设计 料液比(g/mL) pH 温度(℃) 时间(min) 1 1:15、1:20、1:25、1:30、1:35 10 40 30 2 1:25 8、9、10、11、12 40 30 3 1:25 11 40 70、90、110、130、150 4 1:25 11 40、45、50、55、60 130 表 2 响应面试验分析因素与水平
Table 2 Response surface test analysis factors and levels
水平 因素 料液比(g/mL) pH 温度(℃) −1 1:20 10 50 0 1:25 11 55 1 1:30 12 60 表 3 响应面试验结果
Table 3 Response surface test results
试验号 A 料液比 B pH C 温度 Y 得率(%) 1 −1 0 1 22.45 2 −1 1 0 17.73 3 −1 0 −1 22.04 4 −1 −1 0 22.29 5 0 0 0 23.38 6 0 1 −1 19.89 7 0 −1 1 23.06 8 0 0 0 23.78 9 0 0 0 23.61 10 0 0 0 23.71 11 0 1 1 19.48 12 0 −1 −1 23.18 13 0 0 0 23.56 14 1 1 0 19.6 15 1 −1 0 22.37 16 1 0 −1 22.87 17 1 0 1 22.57 表 4 回归模型方差分析
Table 4 Regression model variance analysis
来源 平方和 自由度 均方 F值 P值 差异性 模型 51.40 9 5.71 134.63 <0.0001 ** A 料液比 1.05 1 1.05 24.78 0.0016 ** B pH 25.20 1 25.20 594.20 <0.0001 ** C 温度 0.0221 1 0.0221 0.5198 0.4943 AB 0.8010 1 0.8010 18.88 0.0034 ** AC 0.1260 1 0.1260 2.97 0.1284 BC 0.0210 1 0.0210 0.4957 0.5042 A2 4.34 1 4.34 102.31 <0.0001 ** B2 18.48 1 18.48 435.76 <0.0001 ** C2 0.0512 1 0.0512 1.21 0.3084 残差 0.2969 7 0.0424 失拟项 0.2027 3 0.0676 2.87 0.1677 不显著 绝对误差 0.0943 4 0.0236 总和 51.70 16 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 表 5 牡丹籽粕蛋白的氨基酸组成及含量
Table 5 Amino acid composition and content of peony seed meal protein
氨基酸 缩写 样品含量(%) 天冬氨酸 Asp 9.00±0.26 谷氨酸 Glu 22.79±0.30 丝氨酸 Ser 4.39±0.04 甘氨酸 Gly 4.16±0.01 组氨酸 His 1.77±0.03 精氨酸 Arg 6.78±0.13 苏氨酸* Thr 2.45±0.04 丙氨酸 Ala 3.91±0.00 脯氨酸 Pro 3.86±0.18 酪氨酸 Tyr 2.55±0.06 缬氨酸* Val 4.87±0.06 蛋氨酸* Met 1.06±0.04 胱氨酸 Cyr 1.16±0.04 异亮氨酸* Ile 3.53±0.08 亮氨酸* Leu 6.53±0.07 苯丙氨酸* Phe 3.19±0.11 赖氨酸* Lys 1.79±0.08 色氨酸* Trp 0.63±0.01 总量 84.42 注:*表示必需氨基酸。 -
[1] ZHANG X X, ZHANG Y L, NIU L X, et al. Chemometric classification of different tree peony species native to China based on the assessment of major fatty acids of seed oil and phenotypic characteristics of the seeds[J]. Chemistry & Biodiversity,2017,14(1):e1600111.
[2] LI C, DU H, WANG L, et al. Flavonoid composition and antioxidant activity of tree peony (Paeonia section Moutan) yellow flowers[J]. Journal of Agricultural and Food Chemistry,2009,57(18):8496−8503. doi: 10.1021/jf902103b
[3] GAO L L, LI Y Q, WANG Z S, et al. Physicochemical characteristics and functionality of tree peony (Paeonia suffruticosa Andr.) seed protein[J]. Food Chemistry,2018,240:980−988. doi: 10.1016/j.foodchem.2017.07.124
[4] 刘玉军, 索俊玲, 孙志强, 等. 牡丹籽活性成分及综合开发利用研究进展[J]. 食品与药品,2020,22(4):321−324. [LIU Y J, SUO J L, SUN Z Q, et al. Progress in active components and comprehensive utilization of peony seeds[J]. Food and Drug,2020,22(4):321−324. doi: 10.3969/j.issn.1672-979X.2020.04.016 [5] 刘东彦, 石晓峰, 沈薇, 等. HPLC法同时测定紫斑牡丹籽粕中4个成分的含量[J]. 中药材,2019,42(11):2607−2610. [LIU D Y, SHI X F, SHEN W, et al. Simultaneous determination of four components in seed meal of Paeonia viola by HPLC[J]. Journal of Chinese Medicinal Materials,2019,42(11):2607−2610. doi: 10.13863/j.issn1001-4454.2019.11.026 [6] 徐玥, 张存劳, 杨耿, 等. 碱提酸沉法提取牡丹籽饼中蛋白质的研究[J]. 中国油脂,2019,44(8):28−30,40. [XU Y, ZHANG C L, YANG G, et al. Extraction of protein from peony seed cake by alkali extraction and acid precipitation method[J]. China Oils and Fats,2019,44(8):28−30,40. [7] 盖晴晴. 水酶法提取牡丹籽油工艺改进及水相蛋白特性研究[D]. 无锡: 江南大学, 2020 GAI Q Q. Process improvement on aqueous enzymatic extraction of peony seed oil and investigation[D]. Wuxi: Jiangnan University, 2020.
[8] LO B, KASAPIS S, FARAHNAKY A. Lupin protein: Isolation and techno-functional properties: A review[J]. Food Hydrocolloids,2021,112:106318. doi: 10.1016/j.foodhyd.2020.106318
[9] 王青, 孙金月, 刘超, 等. 响应曲面法优化提取牡丹籽粕蛋白的工艺及应用研究[J]. 食品工业,2017,38(1):117−121. [WANG Q, SUN J Y, LIU C, et al. Study on protein extraction technology from peony seed meals optimized by response surface methodology[J]. The Food Industry,2017,38(1):117−121. [10] 鹿杰, 黄志强, 邱敏, 等. 牡丹籽蛋白的制备工艺及其性质研究[J]. 粮食与油脂,2022,35(5):97−102. [LU J, HUANG Z Q, QIU M, et al. Study on the preparation technology and properties of peony seed protein[J]. Cereals & Oils,2022,35(5):97−102. doi: 10.3969/j.issn.1008-9578.2022.05.023 [11] 宋艳秋, 吴苏喜, 肖志红. 牡丹籽蛋白的制备工艺优化及功能性质评价[J]. 中国油脂,2015,40(7):26−30. [SONG Y Q, WU S X, XIAO Z H. Extraction optimization and evaluation on functional properties of peony seed protein[J]. China Oils and Fats,2015,40(7):26−30. doi: 10.3969/j.issn.1003-7969.2015.07.006 [12] 李加兴, 房惠芳, 陈选, 等. 牡丹籽粕蛋白提取工艺优化及其等电点分析[J]. 食品与机械,2014,30(3):147−150. [LI J X, FANG H F, CHEN X, et al. Optimization on extraction and analysis of isoelectric point condition of protein from peony seed dreg[J]. Food & Machinery,2014,30(3):147−150. [13] 张立娟, 姜瞻梅, 姚雪琳, 等. 双缩脲法检测大豆分离蛋白中蛋白质的研究[J]. 食品工业科技,2008(7):241−242. [ZHANG L J, JIANG Z M, YAO X L, et al. Detecting of protein in soybean isolated protein by biure method[J]. Science and Technology of Food Industry,2008(7):241−242. doi: 10.13386/j.issn1002-0306.2008.07.063 [14] 张俊杰, 郭晨, 刘毅飞, 等. 响应面法优化卡布里鹰嘴豆蛋白提取工艺[J]. 食品工业科技,2018,39(17):167−172. [ZHANG J J, GUO C, LIU Y F, et al. Optimization of extraction technology of Kabuli chickpea protein by response surface methodology[J]. Science and Technology of Food Industry,2018,39(17):167−172. doi: 10.13386/j.issn1002-0306.2018.17.028 [15] 庞庭才, 胡上英, 甘红, 等. 响应面分析法优化红菇蛋白质提取工艺[J]. 食品工业,2015,36(4):186−190. [PANG T C, HU S Y, GAN H, et al. Optimization of extraction technology of protein from Russula by using response surface methodology[J]. The Food Industry,2015,36(4):186−190. [16] 程涛, 孙艳波, 李健. 双缩脲法测定乳中酪蛋白含量[J]. 中国乳品工业,2000,28(3):33−35. [CHENG T, SUN Y B, LI J. Determination of casein content in milk by biuret’s method[J]. China Dairy Industry,2000,28(3):33−35. [17] 赵璇. 洋葱蛋白及多肽的制备及其体外抗氧化活性评价[J]. 中国调味品,2020,45(2):112−115. [ZHAO X. Preparation of onion protein and peptides and evaluation of their antioxidant activity in vitro[J]. China Condiment,2020,45(2):112−115. doi: 10.3969/j.issn.1000-9973.2020.02.025 [18] AHMEDNA M, PRINYAWIWATKUL W, RAO R M. Solubilized wheat protein isolate: Functional properties and potential food applications[J]. Journal of Agricultural and Food Chemistry,1999,47(4):1340−1345. doi: 10.1021/jf981098s
[19] TOMOTAKE H, SHIMAOKA I, KAYASHITA J, et al. Physicochemical and functional properties of buckwheat protein product[J]. Journal of Agricultural and Food Chemistry,2002,50(7):2125−2129. doi: 10.1021/jf011248q
[20] CRUZ N, CAPELLAS M, HERNÁNDEZ M, et al. Ultra high pressure homogenization of soymilk: Microbiological, physicochemical and microstructural characteristics[J]. Food Research International,2007,40(6):725−732. doi: 10.1016/j.foodres.2007.01.003
[21] XUE F, ZHU C, LIU F, et al. Effects of high-intensity ultrasound treatment on functional properties of plum (Pruni domesticae Semen) seed protein isolate[J]. Journal of the Science of Food and Agriculture,2018,98(15):5690−5699. doi: 10.1002/jsfa.9116
[22] 何胜华, 王永辉, 邓乾春. 胶束化和碱溶酸沉提取羽扇豆蛋白的物化特性[J]. 食品科学,2022,43(8):36−43. [HE S H, WANG Y H, DENG Q C. Physicochemical properties of lupin proteins extracted by micellization or alkali dissolution followed by acid precipitation[J]. Food Science,2022,43(8):36−43. [23] PIRES C, TEIXEIRA B, CARDOSO C, et al. Cape hake protein hydrolysates prepared from alkaline solubilised proteins pre-treated with citric acid and calcium ions: Functional properties and ACE inhibitory activity[J]. Process Biochemistry,2015,50(6):1006−1015. doi: 10.1016/j.procbio.2015.03.010
[24] 张娅妮, 阮晓惠, 陈浩, 等. 核桃蛋白的酶解工艺优化及产物特性研究[J]. 中国油脂,2021,46(10):18−23. [ZHANG Y N, RUAN X H, CHEN H, et al. Optimization of enzymatic process and product properties of walnut protein[J]. China Oils and Fats,2021,46(10):18−23. doi: 10.19902/j.cnki.zgyz.1003-7969.200702 [25] 林栋, 张爱民, 王绍校, 等. 赤小豆蛋白的提取工艺优化及其功能性质[J]. 中国食品添加剂,2022,33(1):75−82. [LIN D, ZHANG A M, WANG S X, et al. Extraction optimization and functional properties of protein isolates from red bean (Vigna umbellate)[J]. China Food Additives,2022,33(1):75−82. [26] 吕凯波, 吕述权, 朱家乐. 不同提取方式对红花籽粕蛋白提取率及其功能特性的影响[J]. 食品科技,2020,45(7):249−254. [LÜ K B, LÜ S Q, ZHU J L. Effects of different extraction methods on extraction yield and functional properties of protein from safflower seed meal[J]. Food Science and Technology,2020,45(7):249−254. doi: 10.13684/j.cnki.spkj.2020.07.042 [27] 黄浩, 秦高一鑫, 陈贵堂, 等. 响应面法优化黄芪下脚料蛋白提取工艺[J]. 食品工业科技,2017,38(23):170−176. [HUANG H, QIN G Y X, CHEN G T, et al. Optimization of protein extraction astragali radix waste by response surface methodology[J]. Science and Technology of Food Industry,2017,38(23):170−176. doi: 10.13386/j.issn1002-0306.2017.23.032 [28] 周丽卿. 鹰嘴豆多肽的制备及其改性研究[D]. 杨凌: 西北农林科技大学, 2012 ZHOU L Q. Study on the preparation and modification of chickpea peptide[D]. Yangling: Northwest A & F University, 2012.
[29] 廖灿杰, 杨宏, 王玉栋, 等. 响应面法优化番木瓜籽蛋白质提取工艺[J]. 食品研究与开发,2020,41(1):147−154. [LIAO C J, YANG H, WANG Y D, et al. Optimization of Carica papaya L. seed protein extraction using response surface methodology[J]. Food Research and Development,2020,41(1):147−154. doi: 10.12161/j.issn.1005-6521.2020.01.023 [30] 曾晓房, 于新, 林宏文, 等. 响应面法优化山毛豆蛋白质提取工艺[J]. 食品研究与开发,2012,33(6):53−56. [ZENG X F, YU X, LIN H W, et al. Optimize the extraction technology of tephrosia vogelii protein by response surface methodology[J]. Food Research and Development,2012,33(6):53−56. doi: 10.3969/j.issn.1005-6521.2012.06.015 [31] 赵玉红, 林洋, 张智, 等. 碱溶酸沉法提取黑木耳蛋白质研究[J]. 食品研究与开发,2016,37(16):32−36. [ZHAO Y H, LIN Y, ZHANG Z, et al. Optimization of alkali extraction of protein from auricularia auricula[J]. Food Research and Development,2016,37(16):32−36. doi: 10.3969/j.issn.1005-6521.2016.16.009 [32] 刘柏华, 殷钟意, 郑旭煦, 等. 超声波对牡丹籽粕蛋白质碱提取工艺及氨基酸组成的影响[J]. 食品与发酵工业,2015,41(9):215−219. [LIU B H, YIN Z Y, ZHENG X X, et al. Effect of ultrasound on alkali extraction and amino acid composition of peony seed meal protein[J]. Food and Fermentation Industries,2015,41(9):215−219. doi: 10.13995/j.cnki.11-1802/ts.201509041 [33] 林莉, 董玮, 林彩霞, 等. 脱脂油茶饼中蛋白质提取工艺[J]. 中国食品添加剂,2021,32(11):59−66. [LIN L, DONG W, LIN C X, et al. Extraction technology of protein from defatted camellia[J]. China Food Additives,2021,32(11):59−66. doi: 10.19804/j.issn1006-2513.2021.11.009 [34] ZHANG B, CUI Y, YIN G, et al. Alkaline extraction method of cottonseed protein isolate[J]. Mod Appl Sci,2009,3(3):77−82.
[35] MURALIDHAR R V, CHIRUMAMILA R R, MARCHANT R, et al. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J]. Biochemical Engineering Journal,2001,9(1):17−23. doi: 10.1016/S1369-703X(01)00117-6
[36] 丁东源, 李海波, 梁锐, 等. 牡丹籽粗蛋白提取工艺优化[J]. 粮食与油脂,2021,34(4):96−99. [DING D Y, LI H B, LIANG R, et al. Optimizing extraction technology of crude protein from peony seed[J]. Cereals & Oils,2021,34(4):96−99. doi: 10.3969/j.issn.1008-9578.2021.04.023 [37] LI F, YIN Y, TAN B, et al. Leucine nutrition in animals and humans: mTOR signaling and beyond[J]. Amino Acids,2011,41(5):1185−1193. doi: 10.1007/s00726-011-0983-2
[38] VAN SADELHOFF J H J, WIERTSEMA S P, GARSSEN J, et al. Free amino acids in human milk: A potential role for glutamine and glutamate in the protection against neonatal allergies and infections[J]. Frontiers in Immunology,2020,11:1007. doi: 10.3389/fimmu.2020.01007
[39] 昝丽霞, 陈君红, 韩豪, 等. 油用牡丹籽粕营养成分分析研究[J]. 粮食与油脂,2019,32(9):45−47. [ZAN L X, CHEN J H, HAN H, et al. Analysis of nutrient compositions of peony seed meal[J]. Cereals & Oils,2019,32(9):45−47. doi: 10.3969/j.issn.1008-9578.2019.09.012 [40] ALETOR O, OSHODI A A, IPINMOROTI K. Chemical composition of common leafy vegetables and functional properties of their leaf protein concentrates[J]. Food Chemistry,2002,78(1):63−68. doi: 10.1016/S0308-8146(01)00376-4
[41] 王振斌, 王玺, 马海乐, 等. 芝麻饼粕蛋白质的理化和功能性质研究[J]. 中国粮油学报,2014,29(11):30−35. [WANG Z B, WANG X, MA H L, et al. Physicochemical and functional properties of sesame cake protein[J]. Journal of the Chinese Cereals and Oils Association,2014,29(11):30−35. [42] 高晓莉, 王丽丽, 刘丽娅, 等. pH值和温度对燕麦蛋白溶解与聚集特性的影响[J]. 核农学报,2020,34(11):2492−2498. [GAO X L, WANG L L, LIU L Y, et al. Effects of pH and temperature on the solubility and aggregation of oat protein[J]. Journal of Nuclear Agricultural Sciences,2020,34(11):2492−2498. doi: 10.11869/j.issn.100-8551.2020.11.2492 [43] TIAN W L, LEI L L, ZHANG Q, et al. Physical stability and antimicrobial activity of encapsulated cinnamaldehyde by self‐emulsifying nanoemulsion[J]. Journal of Food Process Engineering,2016,39(5):462−471. doi: 10.1111/jfpe.12237
[44] 朱建宇, 赵城彬, 江连洲, 等. 碱性条件下大豆11S球蛋白溶液的性质和分子结构[J]. 中国食品学报,2019,19(7):85−92. [ZHU J Y, ZHAO C B, JIANG L Z, et al. Solution properties and molecular structure of 11S glycinin at alkaline condition[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(7):85−92. doi: 10.16429/j.1009-7848.2019.07.012 [45] 贾润红. pH对糖基化花生蛋白乳化特性的影响[J]. 粮食与油脂,2021,34(3):107−110. [JIA R H. Effect of pH on emulsification of glycosylated peanut protein[J]. Cereals & Oils,2021,34(3):107−110. doi: 10.3969/j.issn.1008-9578.2021.03.027 [46] SHI X, GUO S. Effect of diluent type on analysis of zeta potential of colloid particles of soymilk protein[J]. Transactions of the Chinese Society of Agricultural Engineering,2016,32(7):270−275.
[47] 肖连冬, 程爽, 李杰. 大豆分离蛋白起泡性和乳化性影响因素的研究[J]. 中国酿造,2014,33(4):83−86. [XIAO L D, CHENG S, LI J. Influence factors of foaming properties and emulsifying properties of soybean protein isolate[J]. China Brewing,2014,33(4):83−86. doi: 10.3969/j.issn.0254-5071.2014.04.020 [48] 冯凌凌, 熊犍, 李琳, 等. pH值对SPC功能性和结构的影响[J]. 食品科学,2006,27(5):129−133. [FENG L L, XIONG J, LI L, et al. pH effects on functional properties and structure of SPC[J]. Food Science,2006,27(5):129−133. doi: 10.3321/j.issn:1002-6630.2006.05.025 [49] KHALID E K, BABIKER E E, TINAY A H E L. Solubility and functional properties of sesame seed proteins as influenced by pH and/or salt concentration[J]. Food Chemistry,2003,82(3):361−366. doi: 10.1016/S0308-8146(02)00555-1
[50] 何希强, 肖怀秋, 王穗萍. 豌豆蛋白质起泡性与乳化性研究初探[J]. 粮油食品科技,2008,16(3):50−52, 54. [HE X Q, XIAO H Q, WANG S P. Studies on foaming and emulsifying properties of pea protein[J]. Science and Technology of Cereals, Oils and Foods,2008,16(3):50−52, 54. doi: 10.3969/j.issn.1007-7561.2008.03.018 [51] 吴兴雨, 姚玥, 孙丰梅. 不同提取方法及因素对亚麻蛋白功能性质的影响[J]. 中国酿造,2020,39(11):192−198. [WU X Y, YAO Y, SUN F M. Effect of different extraction methods and factors on functional properties of flax protein[J]. China Brewing,2020,39(11):192−198. doi: 10.11882/j.issn.0254-5071.2020.11.037 [52] 范三红, 贾槐旺, 张锦华, 等. 不同提取方法对紫苏籽粕蛋白功能性质的影响[J]. 中国调味品,2021,46(12):61−69. [FAN S H, JIA H W, ZHANG J H, et al. Effects of different extraction methods on the functional properties of perilla seed meal protein[J]. China Condiment,2021,46(12):61−69. doi: 10.3969/j.issn.1000-9973.2021.12.011 [53] 王棐, 张文斌, 杨瑞金, 等. 藜麦蛋白质的提取及其功能性质研究[J]. 食品科技,2018,43(2):228−234. [WANG F, ZHANG W B, YANG R J, et al. Extraction and functional properties of quinoa protein isolates[J]. Food Science and Technology,2018,43(2):228−234. doi: 10.13684/j.cnki.spkj.2018.02.043 [54] 张艺玮, 任静, 张舒, 等. pH对微波改性薏米蛋白功能特性的影响[J]. 中国调味品,2021,46(9):48−52. [ZHANG Y W, REN J, ZHANG S, et al. Effect of pH on functional properties of microwave-modified coix seed protein[J]. China Condiment,2021,46(9):48−52. doi: 10.3969/j.issn.1000-9973.2021.09.009 [55] 李超, 蒲彪, 罗松明, 等. pH和NaCl浓度对花椒籽仁分离蛋白乳化性的影响[J]. 食品与发酵工业,2017,43(6):92−97. [LI C, PU B, LUO S M, et al. Emulsifying properties of Zanthoxylum bungeanum maxim seed kernel protein isolate: effect of pH and NaCl concentration[J]. Food and Fermentation Industries,2017,43(6):92−97. doi: 10.13995/j.cnki.11-1802/ts.201706015 [56] XI C, KANG N, ZHAO C, et al. Effects of pH and different sugars on the structures and emulsification properties of whey protein isolate-sugar conjugates[J]. Food Bioscience,2020,33:100507. doi: 10.1016/j.fbio.2019.100507
-
期刊类型引用(1)
1. 王化田,董卓凡,李亮,冯涛,宋诗清,孙敏,姚凌云. 牡丹籽粕蛋白的提取工艺优化及其性质研究. 食品工业科技. 2023(19): 217-224 .  本站查看
本站查看
其他类型引用(3)





 下载:
下载:










 下载:
下载:
