Progress in Optical and Electrochemical Sensors for Detection of Quinolone Antibiotics in Food
-
摘要: 食品中喹诺酮类抗生素的残留危害食品安全,已经引起广泛关注。基于纳米材料制备的传感器具有实时分析、低检测限和分析所需的样品量小等多种优势,是目前喹诺酮类抗生素的现场检测技术研究的热点。本文介绍了荧光、比色、表面增强拉曼散射(SERS)、免疫层析(ICA)等光学传感器和基于不同纳米材料的电化学传感器在喹诺酮类抗生素检测中的应用,比较和分析了不同类型传感器的特点。并对量子点、上转换纳米粒子等纳米材料在光学传感器中的应用,以及碳纳米材料、金属纳米材料和氧化还原介质等在电化学传感器中的应用进行了综述并提出了展望,以期为食品中抗生素的检测和传感器的发展提供新的思路。Abstract: Quinolone antibiotic residues present a high risk for food safety and have gained widespread attention. Nanomaterials based sensors have the advantages of on-site application, sensitivity, and small sample volume requirement and has attracted significant interest in on-site detection technology research for quinolone antibiotics. This paper introduces the application of optical sensors including fluorescence, colorimetry, SERS, ICA and electrochemical sensors based on diverse nanomaterials in quinolone antibiotics detection and summarizes the characteristics of diverse sensors. The application of nanomaterials including quantum dots and upconversion in optical sensors, as well as those of carbon and metal nanomaterials and redox media in electrochemical sensors are reviewed and evaluated. The objective of this work is to provide new concepts for antibiotics detection in food and the development of sensors.
-
Keywords:
- quinolone antibiotics /
- optical /
- electrochemical /
- sensors /
- nanomaterials
-
喹诺酮类抗生素是一类含有与化合物4-喹诺酮相关的双环核心结构的抗生素[1]。五十年来,喹诺酮类抗生素因其高效力、广谱活性、良好的生物利用度而备受青睐[2],因其对革兰氏阳性和阴性细菌具有广谱杀菌活性,被广泛用于治疗动物的细菌感染。然而,大量的喹诺酮类药物通过动物的排泄物排放到环境中并在自然环境中广泛流行,残留于淡水、沿海水和废水中,通过食物或饮用水到达人类[3],对人体产生多种不利影响,如引起血糖异常、增加动脉血管破裂风险、诱发精神疾病等。一份有机蔬菜中喹诺酮类抗生素污染评价显示:在39份有机蔬菜中,诺氟沙星(Norfloxacin,NOR)和恩诺沙星(Enrofloxacin,ENR)检出率高达100% [4]。为保障食品安全,2015年原农业部发布公告,规定洛美沙星、培氟沙星(Pefloxacin)、氧氟沙星(Ofloxacin,OFL)、诺氟沙星等4种抗生素禁止在食品动物中使用。2019年发布的食品安全国家标准GB 31650-2019规定动物肌肉组织中的恩诺沙星与环丙沙星之和最大残留限量为100 µg/kg [5]。
面对喹诺酮类抗生素残留引发的食品安全风险,需要足够灵敏的分析技术来监测和确定生物样品中的抗生素含量。目前已有几种较成熟的检测方法,如高效液相色谱[6-7]、酶联免疫吸附[8-10]和毛细管电泳[11-13]等。但这些方法检测时间长、需要复杂的前处理步骤、昂贵的设备和专业的操作,无法满足现场检测和现代食品安全风险控制快速反应的要求[14]。因此,针对食品中喹诺酮类抗生素残留的现场检测,快速、灵敏的新型传感方法是目前的研究热点。
传感器最主要的特征是其特异性和灵敏性。特异性受靶标和传感器组分之间有效耦合反应的影响,而灵敏度主要受靶标受体、靶标分子固定程序和转导方法的影响[15]。提高传感器灵敏度最重要的方法之一是应用纳米材料,金纳米粒子(Gold nanoparticles,AuNPs)、上转换纳米粒子 (Upconversion nanoparticles,UCNPs)、量子点 (Quantum dot,QDs)、碳纳米管(Carbon nanotubes,CNT)等纳米材料常用于传感器的修饰[16-18]。本文重点介绍用于检测食品样品中喹诺酮类抗生素残留的传感器的最新进展,对不同检测喹诺酮类抗生素的传感器,包括光学方法,如荧光、比色、表面增强拉曼散射(Surface-enhanced Raman scattering,SERS)和免疫层析(Immunochromatography assay,ICA),以及电化学方法进行了总结与分析。
1. 喹诺酮类抗生素的光学传感器检测方法
光信号具有灵敏度高、抗干扰能力强、稳定性好、噪声低等优点。因此,光学传感器在生物检测方面表现出良好的性能。根据检测方法的不同,可以将光学传感器进行以下分类:荧光、比色、SERS和ICA。
1.1 基于荧光的喹诺酮类抗生素检测传感器
随着新型荧光材料的发展,荧光分析已经成为最常见的光学检测技术,因其灵敏度高、操作简单而广泛用于生物测定和生物传感器的设计[19]。荧光传感器通常利用荧光共振能量转移(Fluorescence resonance energy transfer,FRET)来检测各种分子,许多荧光团供体和受体(如荧光蛋白和一些天然颜色以及无机纳米结构等)可用作FRET传感器的一部分[20]。具有荧光和猝灭特性的纳米材料经常被用作有机荧光染料(例如BODIPY类、罗丹明类、荧光素及其衍生物、菁染料类和近红外荧光染料等)在标记分析中的替代品。
1.1.1 基于量子点的荧光检测传感器
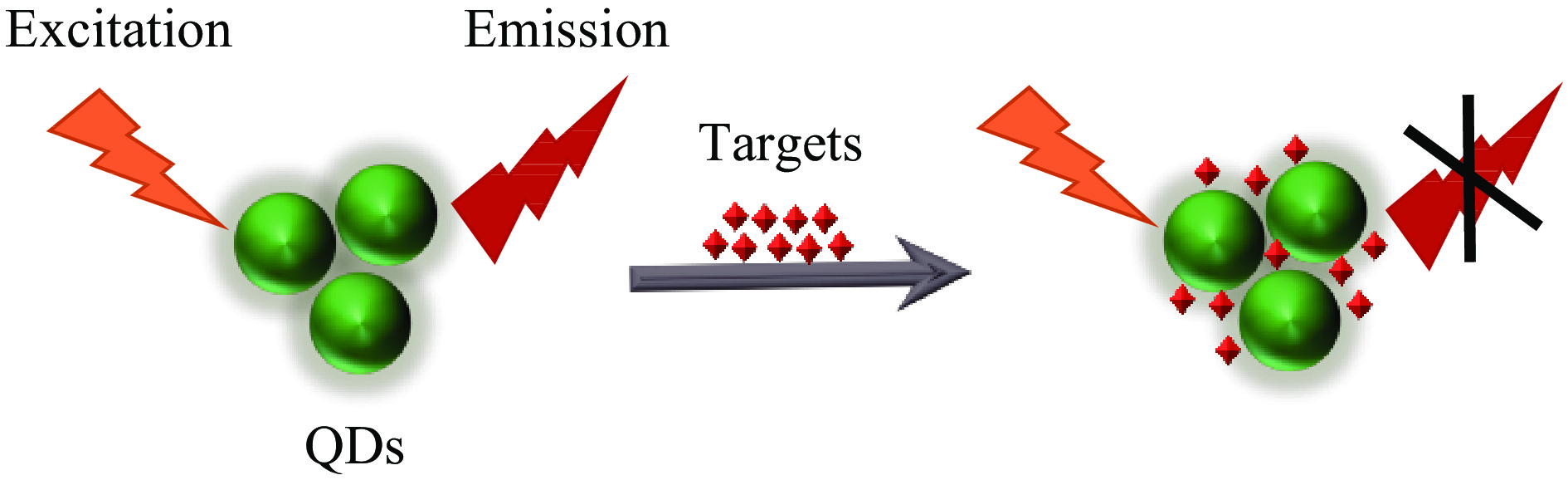
量子点(QDs)作为一种荧光纳米标记材料,因其优越的光学特性而越来越受欢迎,不仅具有可调节的窄对称发射峰和宽激发光谱的独特光学优势,而且光稳定性高、荧光寿命长,可以作为荧光供体或猝灭剂用于FRET系统[21]。基于量子点的荧光传感器检测喹诺酮类抗生素的基本原理是通过电子转移导致量子点的荧光猝灭(图1)。Xia等[22]建立了一种基于CdSe量子点敏化的FRET荧光传感器用于选择性的检测环丙沙星(Ciprofloxacin,CIP),CdSe QDs荧光强度与CIP浓度存在良好的线性关系。与HPLC相比,该方法对CIP表现出优异的选择性和灵敏度,已成功用于牛奶样品中CIP的检测,检测限为0.6 μmol/L。该研究表明量子点敏化FRET系统作为传感器具有实际应用的潜力。Tan等[23]基于GSH-CdTe量子点的电子转移机理,建立了一种左氧氟沙星(Levofloxacin,LFO)荧光检测方法,以LFO作为电子受体加入量子点中,阻止了量子点的自由电子和价带空穴的重组,导致量子点的荧光猝灭,该方法简单、快速、成本低廉,已应用于牛奶样品中LFO的检测,检测限为1.53 ng/mL。Suanchan等[24]通过将石墨烯量子点和分层多孔碳掺入分子印迹聚合物中制备了纳米复合探针来检测OFL,所开发的纳米复合探针对OFL具有超敏性和选择性,同时不受结构类似化合物的影响。已成功用于检测牛奶中的OFL,回收率在92%~99%之间,检测限为0.066 ng/mL,加标牛奶样品的分析结果与HPLC分析结果吻合良好。
1.1.2 基于上转换纳米粒子的荧光检测传感器
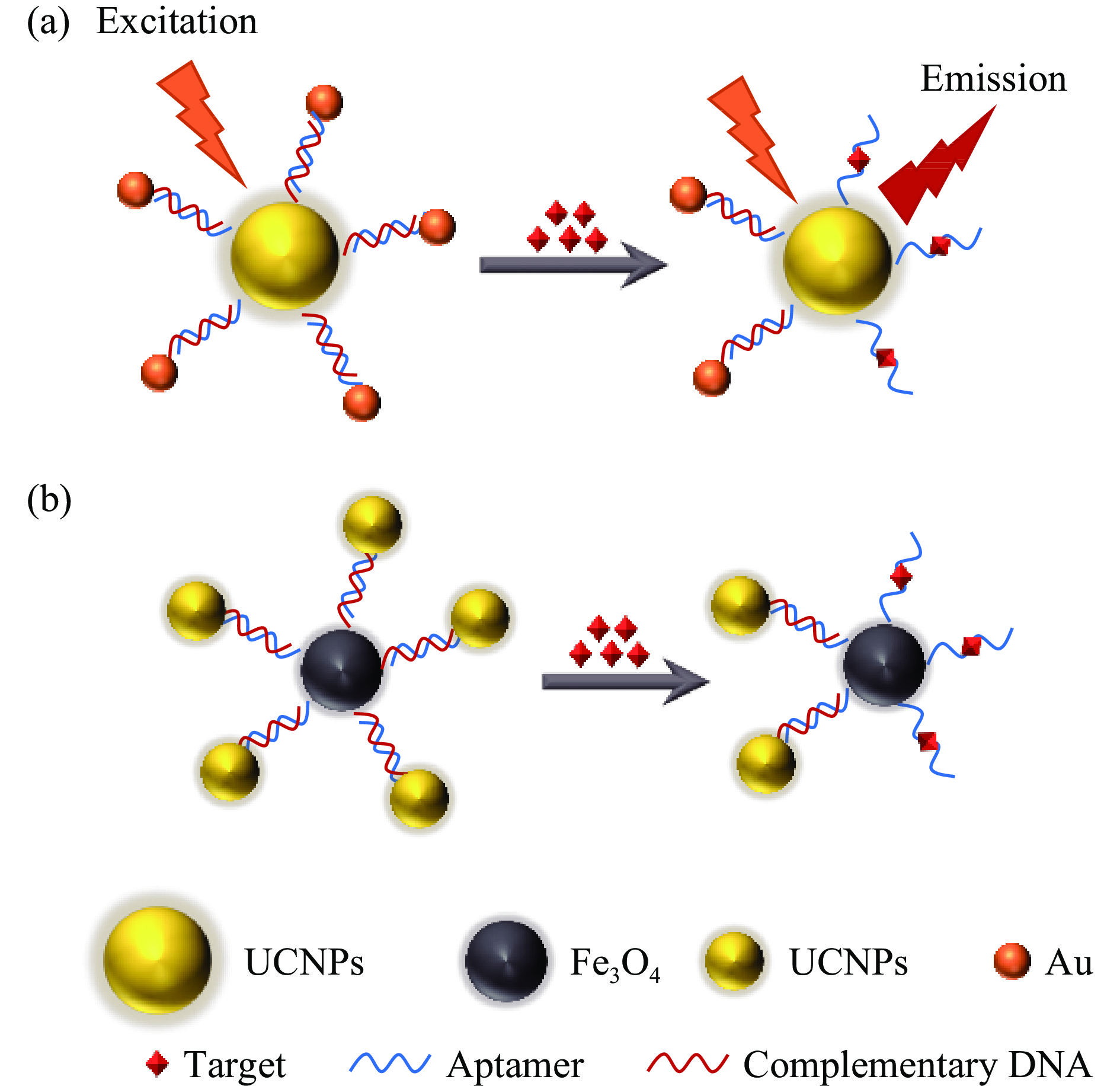
上转换纳米粒子(UCNPs)是一系列发光纳米材料,可以将低能近红外光转化为高能紫外/可见光,具有化学稳定性高、非自发荧光、透光能力好、毒性低等特点,这些特性使UCNPs成为生物检测中发光标记的热门材料[25]。基于上转换纳米粒子的荧光传感器检测喹诺酮类抗生素的基本原理是通过荧光的猝灭或恢复引起荧光强度的变化(图2)。Zhang等[26]构建了一种基于FRET的传感器用于ENR的检测,使用适配体修饰的上转换纳米粒子(CSUNP)作为能量供体,氧化石墨烯(Graphene oxide,GO)作为能量受体,CSUNP-GO复合物的形成导致CSUNP荧光猝灭,ENR存在时,适配体与ENR结合使CSUNP从GO中置换出来引起荧光恢复。与商业试剂盒相比,该方法在2 h内将检测限降低了约13倍,可用于商业奶粉中的ENR检测,检测限为1.59 ng/mL。Hu等[27]通过使用抗体功能化的UCNPs作为荧光信号探针,抗原修饰的聚苯乙烯颗粒作为免疫传感探针,建立了一种用于检测NOR的荧光传感器。生成的免疫复合物数量随NOR浓度的增加而减少,导致荧光信号降低。该方法与商业试剂盒结果一致,且更为灵敏,检测限低至0.01 ng/mL,整个提取过程快速而简单,特别是对于牛奶样品,无需任何预处理即可直接分析。Zhang等[28]利用氟喹诺酮类抗生素与标记的金纳米粒子对抗体连接的上转换荧光体UCPs的竞争反应,提出了一种荧光检测方法,同时检测三种抗生素,对恩诺沙星、环丙沙星、诺氟沙星的检测限为0.19~0.32 ng/mL。在水样中(自来水)的回收率在73.5%~114.5%。该方法操作简单,无需洗涤和分离步骤,除过滤外无需样品预处理,且对各种干扰物质具有较高的耐受性。Liu等[29]采用适配体官能化的Fe3O4与上转换纳米粒子偶联作为纳米探针(UCNPs-cDNA/apt-Fe3O4),开发了一种检测食品中ENR的传感方法。在ENR存在时,适配体与ENR结合导致UCNPs-cDNA被释放,使荧光强度降低,磁分离后,检测探针表面剩余荧光强度,可实现ENR的定量检测,该方法已应用于四种鱼类样品(鲈鱼、蛇头鱼、鲶鱼、西班牙鲭鱼)中ENR的分析,有较高的回收率(85.1%~98.5%),检测限为0.06 ng/mL。该方法具有灵敏度高、抗干扰能力强等优点,此外,磁性纳米颗粒的引入简化了分离过程,提高了检测的效率。
1.2 基于比色的喹诺酮类抗生素检测传感器
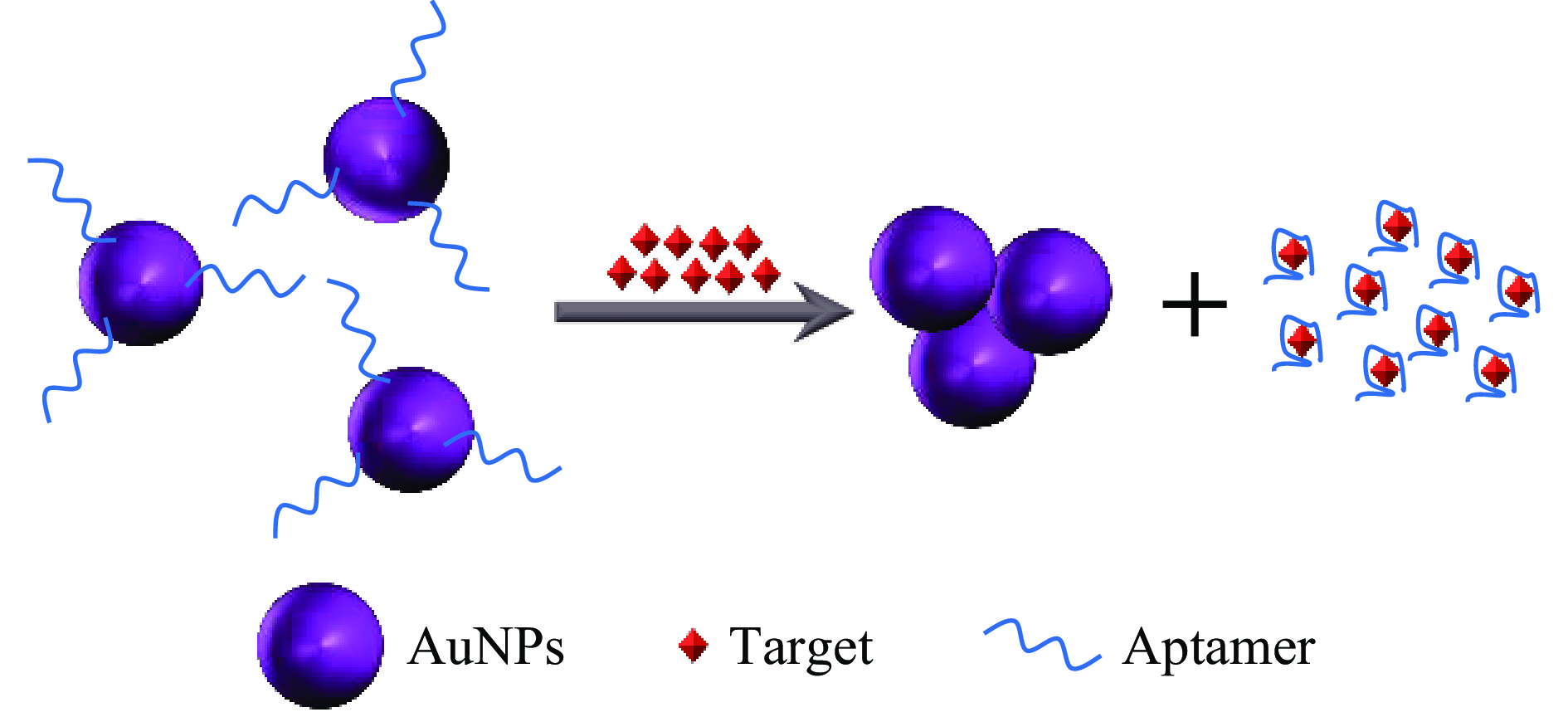
在各种光学方法中,比色法是一种更简单、更流行的传感方法。在比色分析中,可以简单的通过有色试剂对分析物进行检测,检测信号可以用肉眼观察,无需昂贵的仪器和复杂的设备。金纳米粒子(AuNPs)由于其独特的光学特性、高惰性和抗氧化稳定性而被广泛用于比色分析。基于金纳米粒子的比色传感器检测喹诺酮类抗生素的基本原理是通过靶标与适配体的结合使AuNPs聚集引起颜色变化(图3)。Zhou等[30]提出了一种测定自来水中OFL的比色法。在该检测中,OFL与适配体的结合使AuNPs聚集,导致溶液由红色变为蓝色,用肉眼便能观察,也可以用紫外-可见光谱测量。此方法简单、经济、快速、准确率高,并且不需要任何复杂的仪器。在20~400 nmol/L浓度范围内具有线性范围,检测限为3.4 nmol/L。Lavaee等[31]基于AuNPs修饰的互补DNA链和分析物对适配体的竞争结合建立了一种比色传感器,实现了对CIP的特异性检测。在CIP的作用下,AuNPs和AuNPs上的DNA/适配体可以发挥其催化活性,导致颜色由黄色变为无色。该方法简单快速,只需1 h即可完成,且能够选择性检测CIP,检测限为1.2 nmol/L,已成功用于检测牛奶样品中的CIP。
除AuNPs外,还有很多其他材料,如金属复合材料、半导体材料和共轭复合物等,也可用作比色分析中的指示剂。Sun等[32]合成了一种双金属有机凝胶材料(FO@ZMFO@FM-MOG) ,该材料具有类过氧化物酶、类过氧化氢酶和类过氧化酶三种酶的性质。基于FO@ZMFO@FM-MOG的酶活性构建了用于检测果汁中NOR的比色传感器,对NOR的检测限为52 nmol/L。FO@ZMFO@FM-MOG具有良好的重复性和稳定性,此外,还建立了对NOR的智能手机检测平台用于现场分析。Ren等[33]首次将二维材料黑磷用作比色试剂,研发一种比色/光热双读出免疫方法,用于测定自来水中的NOR。在该检测中,分析物被抗体修饰的磁性/上转换纳米复合材料捕获,与抗体形成免疫复合物,添加的黑磷可被暴露的抗原捕获,形成肉眼可观察的棕色带。经红外光照射后通过手机摄像头的热成像获得实时温度进行定量分析。该方法快速、灵敏,检测限可低至45 pg/mL。Rezende等[34]用聚二乙炔(PDA)、三嵌段共聚物和十二烷基硫酸钠(SDS)组成的纳米共聚物,研制了用于检测牛奶中ENR的比色传感器,ENR和SDS的直接相互作用释放足够的能量克服PDA的动能导致PDA颜色的转变,该传感器对ENR的检测限为19.4 ng/mL。所制备的纳米共聚物成本低廉,制备所需时间短,对ENR具有良好的特异性,具有较好的推广价值。
1.3 基于表面增强拉曼散射的喹诺酮类抗生素检测传感器
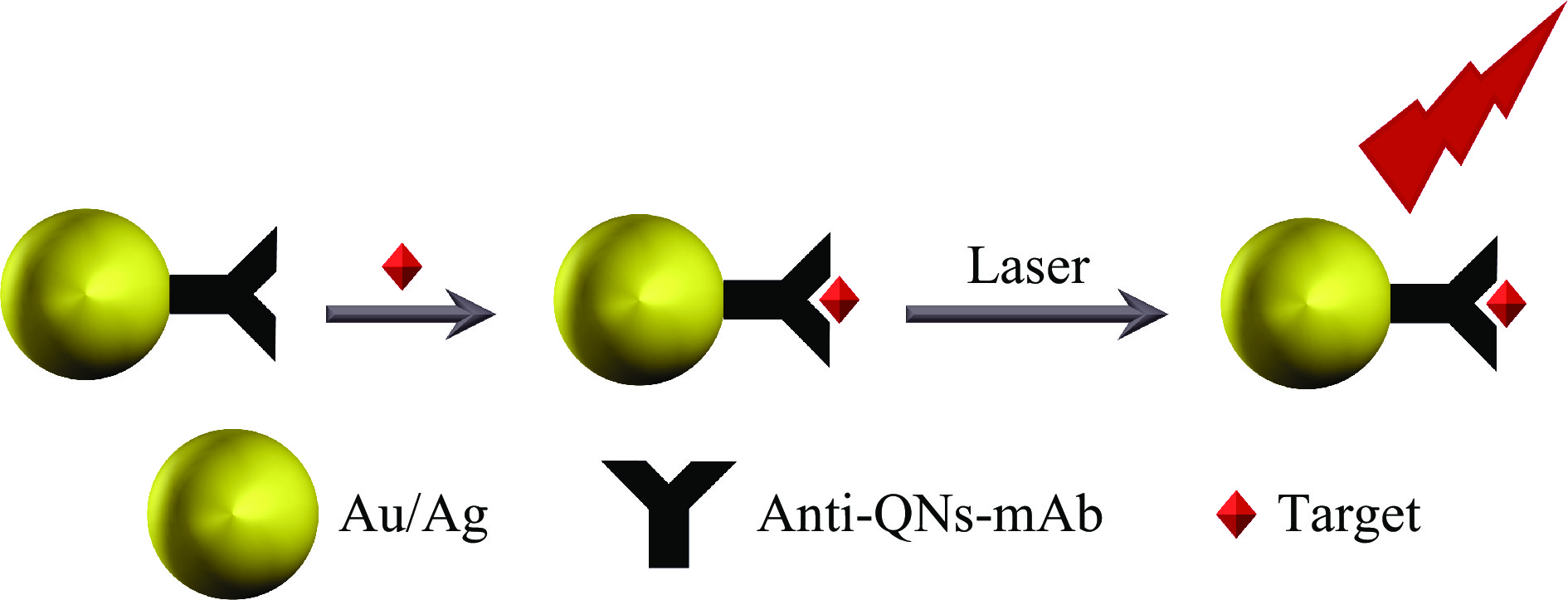
表面增强拉曼光谱(SERS)是一种强大的振动光谱技术,可以通过激发局部表面等离子体产生的电磁场高灵敏度地检测低浓度分析物的结构 [35]。SERS基底是高灵敏度SERS检测的关键组成部分,根据化学成分的不同,可分为贵金属、贵金属复合物和贵金属与半导体的杂化材料等[36]。基于SERS的传感器检测喹诺酮类抗生素的基本原理是样品表面电磁场的增强引起吸附分子拉曼信号的增强(图4)。Shi等[37]设计了一种基于SERS的多重免疫纳米探针,用于检测牛奶中的喹诺酮类(Quinolones,QNS)抗生素。该方法基于拉曼活性分子偶联的AuNPs与抗NOR单克隆抗体组成的纳米探针,使用纳米探针和包被抗原可以特异性的捕获游离分析物。该方法对NOR的检测限为0.55 pg/mL。此外,该抗NOR单克隆抗体也可识别其他几种常见的QNS,因此该方法可用于8种QNS的同时检测,包括诺氟沙星、依诺沙星、环丙沙星、氧氟沙星、氟罗沙星、马波沙星、恩诺沙星、培氟沙星。Liu等[38]建立了一种独立式液体平台(FSM)作为SERS基底用于自来水中NOR的检测。该SERS基底通过将双金属纳米颗粒悬浮液放在疏水表面上,然后使用金属膜孔板形成FSM获得,其中NOR吸附在Ag表面,与模具形成FSM, SERS强度随NOR的浓度升高而增强,从而实现对NOR的定量分析,回收率超过95%,检测限为1.3 ng/mL。这种基于FSM的SRES检测可以在几分钟内完成,并且具有高度可重复性。Li等[39]以阳极氧化铝(AOO)为模板,然后利用界面自组装技术将银纳米颗粒分布在AOO模板上,制备了SERS基板,用于检测牛奶中的LFO。该SERS基板具有信号优异的重复性,SERS信号在30天内基本一致。该方法可以在1×10−6~2×10−5 mol/L浓度范围内实现对牛奶中LFO的检测,检测限为1.88 µmol/L。
1.4 基于免疫层析的喹诺酮类抗生素检测传感器
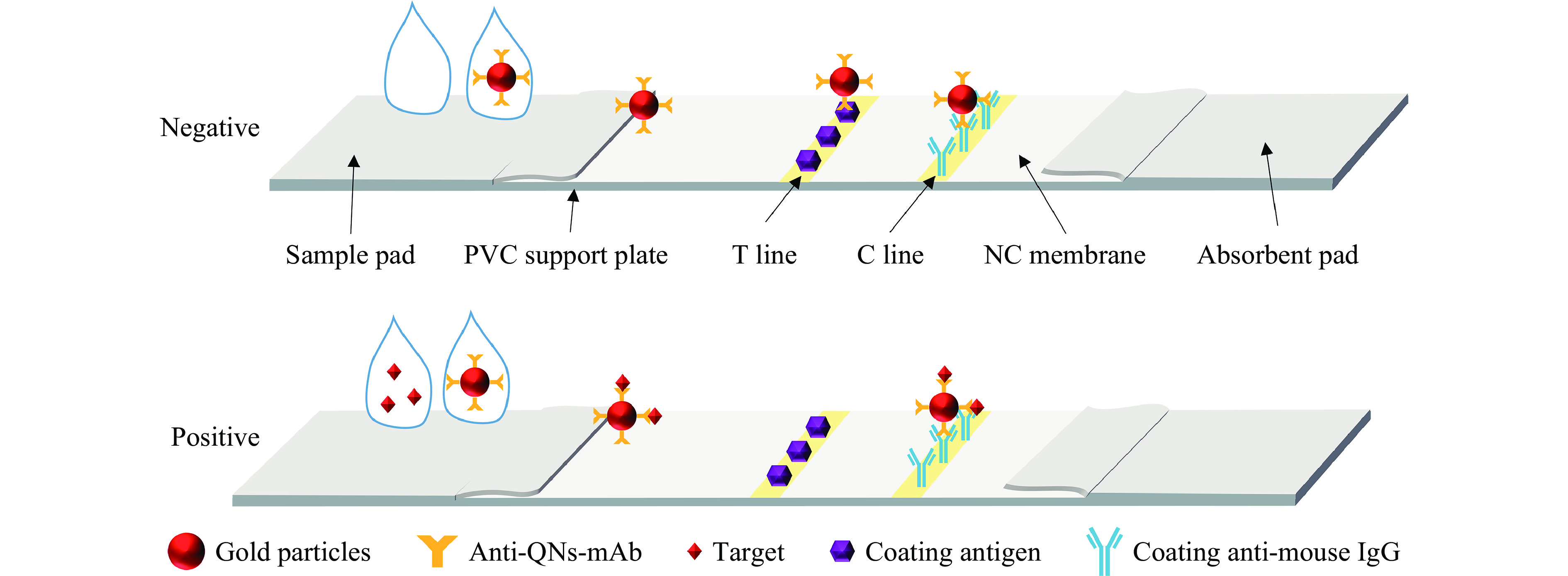
横向流动免疫分析法(ICA)因其简单、快速、方便和低成本的特性而广泛应用于传染病分析和环境污染检测等方面,在抗生素检测方面也有广泛的应用。ICA用于检测抗生素时常用AuNPs、QDs、UCNPs等纳米材料作为标签和荧光猝灭剂,以提高检测的灵敏度[40]。基于免疫层析的传感器检测喹诺酮类抗生素的基本原理如图5所示,靶标存在时,抗体标记的AuNPs与靶标结合而不与抗原结合,T线不显示。Peng等[41]将基于AuNPs的免疫层析条与抗体和抗原组装,设计了一种用于检测牛奶中喹诺酮类抗生素的试纸条,该抗原可与喹诺酮类抗生素在标记有抗体的AuNPs孵育的样品中竞争。设计的试纸条可以检测32种喹诺酮类抗生素,仅需10 min即可用肉眼观察到检测结果。试纸的检测范围在1~100 ng/mL,检测限为0.1~10 ng/mL。Oliveira等[42]制备了一种基于AuNPs和高特异性抗OFL单克隆抗体的纸质传感器,用于检测牛肉中OFL残留。建立的免疫层析试纸条对OFL的检测限为0.16 ng/mL,线性范围为3.125~100 ng/mL,反应时间仅需12 min。该试纸条具有较高的特异性,与QNS类似物的交叉反应率低。Liu等[43]设计了基于量子点微球(Quantum dot microsphere,QDMs)的免疫层析试纸条用于鱼肉中CIP的定量检测,这些试纸可提供低的检测限(0.05 ng/mL)和宽的线性检测范围(0.1~100 ng/mL),具有高灵敏度和良好的选择性、重现性和稳定性,可在15 min内完成CIP的检测,且成本低廉。Hu等[44]分别用抗体标记的AuNPs、QDs和UCNPs作为信号探针建立了三种类型的免疫层析试纸条,实现对牛奶样品中NOR的检测。这三种试纸条在标准溶液中的检测限分别为2.0、2.0、0.5 ng/mL,在牛奶样品中的检测限分别为20.0、10.0、2.5 ng/mL。与AuNPs试纸条相比,QDs试纸条在标准溶液中显示出相似的灵敏度,在牛奶样品中显示出更高的灵敏度,QDs的使用增强了该方法的抗干扰能力。UCNPs在标准溶液和牛奶样品中显示出最高的灵敏度,并且更加稳定。另外,基于QDs和UCNPs的试纸条成本更低,适用于样品中低浓度小分子的现场快速检测。
![]() 图 5 基于免疫层析的光学传感器检测喹诺酮类抗生素的原理图注:Negative:阴性;Positive:阳性;Sample pad:样品垫;PVC support plate:PVC板;T line:T线;C line:C线;NC membrane:硝酸纤维素膜;Absorbent pad:吸附垫;Gold particles:金属材料;Anti-QNs-mAb:抗喹诺酮类单克隆抗体;Target:靶标;Coating antigen:包被抗原;Coating anti-mouse IgG:二抗。Figure 5. The schematic diagram of optical sensor based on immunochromatography for detecting quinolone antibiotics
图 5 基于免疫层析的光学传感器检测喹诺酮类抗生素的原理图注:Negative:阴性;Positive:阳性;Sample pad:样品垫;PVC support plate:PVC板;T line:T线;C line:C线;NC membrane:硝酸纤维素膜;Absorbent pad:吸附垫;Gold particles:金属材料;Anti-QNs-mAb:抗喹诺酮类单克隆抗体;Target:靶标;Coating antigen:包被抗原;Coating anti-mouse IgG:二抗。Figure 5. The schematic diagram of optical sensor based on immunochromatography for detecting quinolone antibiotics1.5 不同光学传感器的比较
目前,针对食品中喹诺酮类抗生素的检测,传统的方法无法满足现场检测的要求,同时,为了适应喹诺酮类抗生素的低检出要求,需要开发高灵敏度的新型检测方法。一些新的用于检测喹诺酮类抗生素的光学方法有荧光法、比色法、SERS法和ICA法,各光学检测方法都有其独特的优势。
对比已报道的各种光学方法的检测限,SERS法对喹诺酮类抗生素的检测灵敏度最高,不同的基底材料均可以获得超低的检测限。比较而言,基于贵金属的SERS检测拥有更低的检测限,最低可以达到0.00037 ng/mL。此外,SERS法可以实现喹诺酮类抗生素的多组分残留同时检测,在抗生素残留的现场超灵敏检测方面具有很大应用潜力。然而,仅有金、银等贵金属和少数半导体材料具有较强的SERS效应,使其应用受到一定程度的限制。基于UCNPs材料的荧光检测法也具有很高的灵敏度(检测限0.01 ng/mL),这可以归结于UCNPs的低背景荧光和尖锐的发射带宽的优势,纳米材料的修饰是影响传感器灵敏度的关键因素。QDs和UCNPs材料作为荧光标记在检测中的应用,提高了检测中化学反应的稳定性,进而提高了检测方法的抗干扰能力。不仅如此,通过引入适配体/抗体或制备不同结构的纳米材料还可以实现多组分残留的同时检测。这种方法的不足之处是所需的纳米材料制备过程较为复杂,反应时间长。
比色法和ICA法有一个共同的优势:肉眼即可观察到检测结果。比色法还具有操作简单,线性范围宽、成本低的优点,然而这种方法的灵敏度较低。ICA法由于其简单、快速、方便的特点,在现场检测中的应用较为广泛,通常可在15 min以内完成检测,且可以同时检测多组分残留。相比SERS和荧光法,比色和ICA检测的灵敏度较低,已有相关研究表明抗体的引入可提高此类方法的灵敏度,另外,纳米共轭复合物和QDM材料的使用也可获得较低的检测限。因此,使用生物受体(抗体/适配体)与金属和金属复合物材料结合或合成新材料等,借此提高比色和ICA检测的灵敏度是未来的研究方向。
表1列举了一些有代表性的研究,对检测原理、靶标物、检测限、线性范围、检测时间和实际样品等几个方面进行了总结。从表中可见,各类光学传感器因检测原理的不同在检测时间上有一定差异,从10 min到5 h不等,对NOR的检测时间较短,约10~20 min,对ENR的检测时间则较长,最少用时为90 min,推测检测时间可能与靶标物有关;喹诺酮类抗生素检测的光学传感器在真实样品的应用有液体基质样品和固体食品样品,在液体基质样品中的应用较为普遍,主要为牛奶和自来水。
表 1 近年来用于喹诺酮类抗生素检测的光学传感器的实例Table 1. Examples of optical sensors used for quinolone antibiotics detection in recent years检测方法 原理 靶标 LOD(ng/mL) 线性范围(ng/mL) 时间 样品 荧光 量子点电子转移导致荧光猝灭 LFO 1.53 730~7300 - 牛奶[23] 与GO结合导致CSUNP荧光猝灭 ENR 0.47 0.976~62.5 2 h 奶粉[26] 分析物和荧光免疫探针与抗体的竞争结合 NOR 0.01 0.01~10 15 min 牛奶,蜂蜜[27] 靶向FQs与AuNPs对单抗连接的UCPs的竞争反应 ENR;CIP;NOR 0.19~0.32 0~80 - 自来水[28] 适配体和上转换纳米粒子的杂交探针与靶标结合后的荧光猝灭 ENR 0.06 1~10 90 min 鲈鱼,蛇头鱼,
鲇鱼[29]对不同靶标的荧光颜色转换 OFL;CIP 0.693;0.802 - 80 min -[45] 比色 AuNPs在盐溶液中聚集 OFL 1.221 7.23~144.55 70 min 自来水[30] 互补DNA链与CIP对适配体的竞争结合 CIP 0.397 1.325~165.67 1 h 牛奶[31] 抗体捕获,比色和光热分析 NOR 0.045 0.05~100 20 min 自来水[33] SERS 分析物和抗原与标记的AuNPs间的竞争 NOR、CIP等 0.00055 0.0001~1 15 min 牛奶[37] 微结构光流控器检测未标记的抗生素拉曼信号 CIP;NOR 0.033;0.003 - - 自来水[46] Au@Ag提供的电磁场对拉曼信号的放大 LEVO 0.00037 0.361~36100 - -[47] ICA 抗原与分析物的竞争策略 CIP,OFL等 0.1~10 1~100 10 min 牛奶[41] 抗体标记的AuNPs对抗生素的特异性识别 OFL 0.16 3.125~100 12 min 牛肉[42] 基于QDM的免疫层析 CIP 0.05 0.1~100 15 min 鱼肉[43] AuNPs,QDs,UCNPs分别标记NOR单克隆抗体 NOR 2.0;2.0;0.5 - 10 min 牛奶[44] 注:表中“-”表示所引文献未提及该内容;表2同。 2. 喹诺酮类抗生素的电化学传感器检测方法
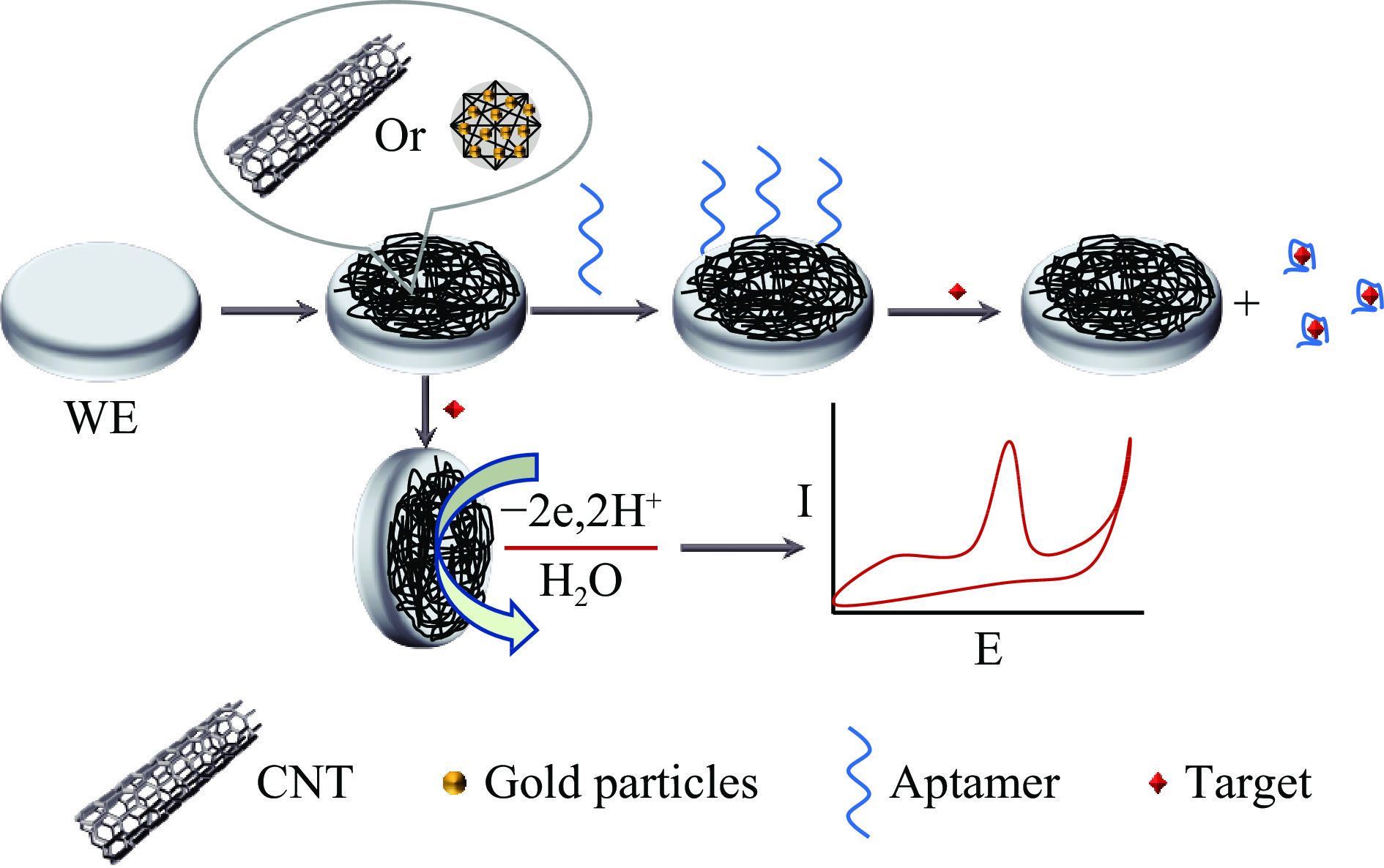
纳米材料修饰电极构建的电化学传感器因简单、快速、灵敏度高、选择性好、响应快速、实施成本低而成为当前的研究热点[48]。电化学传感器的性能很大程度上取决于电极修饰材料的性质,在喹诺酮类抗生素的检测方面,目前常用的提高电极性能的材料主要有碳纳米材料、金属纳米材料、氧化还原介质等[49]。电化学传感器检测喹诺酮类抗生素的基本原理是电极表面的电子转移引起的电信号变化,如图6所示,电子的转移可由靶标与修饰材料的反应引起,也可通过在电极表面修饰适配体与靶标结合引起。
2.1 基于碳纳米材料的电化学传感器
碳纳米材料具有较大的比表面积、极高的导电性和良好的生物相容性,应用领域广泛,尤其在电化学研究中具有独特优势,是修饰电极的常用材料之一。Hu等[50]基于碳纳米管-五氧化二钒-壳聚糖(CNT-V2O5-CS)纳米复合材料修饰丝网印刷电极,研制了一种电化学适配体传感平台。通过监测CIP与适配体结合产生的电化学信号的变化实现对CIP的定量检测,检测限为0.5 ng/mL。这种适体传感器结合了V2O5的生物相容性、CNTs的高效电子转移能力、CS的有效成膜强度和丝网印刷碳电极(SPCE)的可移植性,对CIP具有良好的选择性。在实际应用中,该电化学传感器对加标牛奶样品中CIP的回收率为94.50%~97.87%,具有制备简单、选择性好、成本低、稳定性高等优点。Singh等[51]通过在碳纳米管上快速电沉积电催化元素,建立了一种用于检测自来水中CIP电化学传感器。设计的传感器由氧功能化碳纳米管、聚多巴胺和和电沉积的银纳米颗粒组成,修饰电极的电化学响应与0.005~10 µmol/L范围内的CIP浓度成正相关,对自来水中CIP的检测限为5 nmol/L。该传感器稳定性好,重现性高,成本低廉。Sadat等[52]设计了基于四氧化三铁纳米粒子修饰的多壁碳纳米管(Fe3O4NPs/MWCNTs)的电化学传感器,并用于ENR的检测。由于Fe3O4NPs和MWCNTs的协同电催化作用,制备的传感器对ENR具有快速、灵敏的响应。该传感器对ENR的检测限为0.09 µmol/L,已成功应用于牛奶、鸡蛋、蜂蜜和鸡肉样品中微量ENR的高灵敏度测定。
2.2 基于金属纳米材料的电化学传感器
金属纳米材料因其制备过程简单,具有独特的光电效应,在荧光和电化学领域均有广泛应用,金属纳米材料还具有优异的导电性和生物相容性,是修饰电极的优良材料。Lü等[53]开发了一种基于镍金属有机骨架(Ni-MOF)和AuNPs的电化学适配体传感器,该传感器可灵敏地检测ENR。Ni-MOF和AuNPs可以增加适配体的负载并协同催化亚硫砜,从而提高检测灵敏度。该传感器对ENR的检测限为0.0056 pg/mL,同时,该传感器灵敏度高、重复性好、稳定性长,已经应用于蜂蜜和牛奶中ENR的检测。Gissawong等[54]以废咖啡粉活性炭为载体,在玻璃碳电极上沉积AuNPs并与超分子溶剂(SUPRAS)结合开发了一种电化学传感器,用于CIP的检测。该传感器对CIP的检测限为0.2 nmol/L,已成功应用于牛奶中CIP的测定。这种传感器制作简单、成本低廉,使用绿色溶剂和回收生物质废物(废咖啡渣)作为活性炭(AC)前体,是一种环保传感器。Pilehvar等[55]通过将共价连接的AuNPs修饰电极用作ssDNA的高效固定化平台,制备了一种简便、快速、灵敏的电化学适配体传感器,用于OFL的检测,检测限为1 nmol/L。该固定化平台可使目标分子更有效的与固定的适配体相互作用,从而提高传感器的灵敏度和稳定性,该传感器已成功用于自来水中OFL的测定。
2.3 基于氧化还原介质的电化学传感器及其他电化学传感器
高效的氧化还原介质可以促进靶标和电极之间的电化学通信并携带电子进行传感,许多氧化还原介质如二茂铁/二茂铁合物(Fc/Fc+)和亚甲蓝(MB)等,已被广泛应用于喹诺酮类抗生素检测电化学传感器的传感和表征。Aymard等[56]将抗喹诺酮抗体通过碳二亚胺偶联在丝网印刷电极上,以二氟沙星和氨基二茂铁为偶联剂合成了电化学探针,建立了一种检测肉类(猪肉、鸡肉、牛肉、羊肉、马肉、鸭肉和火鸡肉)中ENR的电化学免疫传感器,检测限为3 ng/mL。该传感器的稳定性在4 ℃下可保持1个月以上,并具有良好的特异性。Taghdisi等[57]建立了以双标记适配体为检测元件,亚甲蓝为氧化还原剂的电化学方法,用于CIP的检测。这种方法具有高选择性,对CIP的检测限为0.1 nmol/L,可检测出牛奶中的CIP。
除了氧化还原介质,一些其他材料也可用于电极的修饰,并应用于喹诺酮类抗生素的检测。de Souza等[58]建立了一种检测食品中CIP的纸电极传感器,使用指甲油和石墨粉组成的导电墨水制造,并由滤纸支撑。该方法显示了9.90~220 µmol/L的宽线性范围,检测限为4.96 µmol/L。用于检测蜂蜜、牛奶样品中的CIP,具有良好的精度和准确度。该传感器制造简单,成本低廉,可以作为一次性传感器使用。
2.4 不同电化学传感器的比较
碳纳米材料因其高导电性和良好的成本效益在电化学应用中得到广泛关注,通过纳米材料修饰电极,可以提高电化学响应,从而获得较低的检测限,提高检测效率。同时,碳纳米材料的使用赋予了电化学传感器更好的稳定性。金属纳米材料在光学和电化学领域均有应用,具备良好的选择性和稳定性,并且有着更高的灵敏度。碳纳米材料和金属纳米材料与适配体的结合均可提高检测的灵敏度,特别是金属纳米材料与适配体结合后显示了极高的灵敏度(检测限为5.6×10−6 ng/mL)。除了碳纳米材料和金属纳米材料,氧化还原介质与抗体或适配体的结合也可提高电化学传感器的灵敏度和稳定性。相比上述材料修饰的传感器,石墨粉等低成本材料制备的电化学传感器虽然灵敏度较低,但制造简单、成本低廉,可以作为一次性传感器使用。
表2对上述电化学传感方法的检测原理、靶标物、检测限、线性范围、检测时间和实际样品测定等方面进行了总结,电化学传感器的检测方法主要有电化学阻抗谱(Electrochemical impedance spectroscopy,EIS)、差分脉冲伏安法(Differential pulse voltammetry,DPV)和方波伏安法(Square wave voltammetry,SWV),其中最常用的是DPV。总的来说,电化学传感器有更短的检测时间,通常在20 min以内。电化学方法比光学方法表现出更好的灵敏度。优良的电极修饰材料不仅可以提高电导率和催化活性,还可以通过专门设计的信号标记放大元件,提高检测的灵敏度。通过纳米材料修饰电极,提高电化学传感器的电导率、响应速度和灵敏度,获得更低的LOD,以精确检测样品中低浓度水平的喹诺酮类抗生素,是现阶段喹诺酮类抗生素检测的重点研究方向之一。
表 2 喹诺酮类抗生素检测的电化学传感器Table 2. Electrochemical sensors for the detection of quinolone antibiotics检测方法 原理 靶标 LOD(ng/mL) 线性范围(ng/mL) 时间 样品 EIS 固定于纳米复合基质的适配体对抗生素的特异识别 CIP 0.5 0.5~64 10 min 牛奶[50] SWV OCNTs-PDA-Ag修饰玻碳电极 CIP 1.656 1.656~3313 - 自来水[51] DPV Ni-MOF&AuNPs负载适配体与靶标结合 ENR 5.6×10−6 10-5~1 - -[53] DPV AuNPs,AC修饰玻碳电极 CIP 0.066 0.166~8.284 7 min 牛奶[54] DPV 适配体与OFL结合产生信号变化 OFL 0.361 18.05~7220 - 自来水[55] DPV 特定结合物与游离ENR在固定化抗体上的竞争性结合 ENR 3 5~10 6 min 猪、鸡、牛、羊、鸭[56] DPV 双标记适配体修饰电极 CIP 0.033 99.39~149.09 60 min 牛奶[57] SWV 铋膜电极 CIP 0.003 0.008~0.2 62 s 自来水[59] 3. 总结与展望
喹诺酮类抗生素的残留对食品安全的不利影响已经引起广泛关注,其在食品中的检测是维护食品安全的重要手段。喹诺酮类抗生素的常规分析方法步骤繁琐,且需要专业操作,限制了其在抗生素检测中的应用。基于纳米材料的传感器具有实时分析、低 LOD 和分析所需的样品量小等优势,可有效提高检测效率,解决现场快速检测面对的问题。本文对荧光、比色、SERS、ICA等光学方法和基于不同纳米材料的电化学方法在喹诺酮类抗生素检测方面的研究进展进行了综述。在光学传感器中,使用AuNPs、QDs、UCNPs等纳米材料能够提高检测的灵敏度和特异性,通过引入抗体与纳米材料相结合还可以实现多组分抗生素的同时检测。在电化学传感器中,使用碳纳米材料和金属纳米材料修饰电极可以提高电化学传感器的稳定性和灵敏度;此外,纳米材料与生物受体(适配体/抗体)结合可以显著提高检测的灵敏度。电化学方法的研究对象主要是喹诺酮类抗生素中关注最多的环丙沙星和恩诺沙星,而光学方法的研究对象更为广泛,除了环丙沙星和恩诺沙星,几种不得检出的抗生素也都有涉及,可针对检测目标的特性选择合适的检测方法。ICA和比色两种方法简便、快速、结果可视化,适用于较高浓度喹诺酮类抗生素的定性和半定量检测,低浓度喹诺酮类抗生素的检测可以选择高灵敏度的荧光和SERS两种方法。电化学方法则适用于样品中低浓度抗生素的准确定量检测,而新型纳米材料的使用及其与生物受体的结合以提高检测灵敏度是光学传感器研究的热点方向。在电化学传感器对喹诺酮类抗生素检测方面的研究中,碳/金属纳米复合材料、金属氧化物材料和金属有机框架材料对电极修饰的应用少有报道,而这些材料在其他物质如重金属离子检测方面都有应用,它们在喹诺酮类抗生素检测电化学传感器中的应用也值得关注。
-
图 5 基于免疫层析的光学传感器检测喹诺酮类抗生素的原理图
注:Negative:阴性;Positive:阳性;Sample pad:样品垫;PVC support plate:PVC板;T line:T线;C line:C线;NC membrane:硝酸纤维素膜;Absorbent pad:吸附垫;Gold particles:金属材料;Anti-QNs-mAb:抗喹诺酮类单克隆抗体;Target:靶标;Coating antigen:包被抗原;Coating anti-mouse IgG:二抗。
Figure 5. The schematic diagram of optical sensor based on immunochromatography for detecting quinolone antibiotics
表 1 近年来用于喹诺酮类抗生素检测的光学传感器的实例
Table 1 Examples of optical sensors used for quinolone antibiotics detection in recent years
检测方法 原理 靶标 LOD(ng/mL) 线性范围(ng/mL) 时间 样品 荧光 量子点电子转移导致荧光猝灭 LFO 1.53 730~7300 - 牛奶[23] 与GO结合导致CSUNP荧光猝灭 ENR 0.47 0.976~62.5 2 h 奶粉[26] 分析物和荧光免疫探针与抗体的竞争结合 NOR 0.01 0.01~10 15 min 牛奶,蜂蜜[27] 靶向FQs与AuNPs对单抗连接的UCPs的竞争反应 ENR;CIP;NOR 0.19~0.32 0~80 - 自来水[28] 适配体和上转换纳米粒子的杂交探针与靶标结合后的荧光猝灭 ENR 0.06 1~10 90 min 鲈鱼,蛇头鱼,
鲇鱼[29]对不同靶标的荧光颜色转换 OFL;CIP 0.693;0.802 - 80 min -[45] 比色 AuNPs在盐溶液中聚集 OFL 1.221 7.23~144.55 70 min 自来水[30] 互补DNA链与CIP对适配体的竞争结合 CIP 0.397 1.325~165.67 1 h 牛奶[31] 抗体捕获,比色和光热分析 NOR 0.045 0.05~100 20 min 自来水[33] SERS 分析物和抗原与标记的AuNPs间的竞争 NOR、CIP等 0.00055 0.0001~1 15 min 牛奶[37] 微结构光流控器检测未标记的抗生素拉曼信号 CIP;NOR 0.033;0.003 - - 自来水[46] Au@Ag提供的电磁场对拉曼信号的放大 LEVO 0.00037 0.361~36100 - -[47] ICA 抗原与分析物的竞争策略 CIP,OFL等 0.1~10 1~100 10 min 牛奶[41] 抗体标记的AuNPs对抗生素的特异性识别 OFL 0.16 3.125~100 12 min 牛肉[42] 基于QDM的免疫层析 CIP 0.05 0.1~100 15 min 鱼肉[43] AuNPs,QDs,UCNPs分别标记NOR单克隆抗体 NOR 2.0;2.0;0.5 - 10 min 牛奶[44] 注:表中“-”表示所引文献未提及该内容;表2同。 表 2 喹诺酮类抗生素检测的电化学传感器
Table 2 Electrochemical sensors for the detection of quinolone antibiotics
检测方法 原理 靶标 LOD(ng/mL) 线性范围(ng/mL) 时间 样品 EIS 固定于纳米复合基质的适配体对抗生素的特异识别 CIP 0.5 0.5~64 10 min 牛奶[50] SWV OCNTs-PDA-Ag修饰玻碳电极 CIP 1.656 1.656~3313 - 自来水[51] DPV Ni-MOF&AuNPs负载适配体与靶标结合 ENR 5.6×10−6 10-5~1 - -[53] DPV AuNPs,AC修饰玻碳电极 CIP 0.066 0.166~8.284 7 min 牛奶[54] DPV 适配体与OFL结合产生信号变化 OFL 0.361 18.05~7220 - 自来水[55] DPV 特定结合物与游离ENR在固定化抗体上的竞争性结合 ENR 3 5~10 6 min 猪、鸡、牛、羊、鸭[56] DPV 双标记适配体修饰电极 CIP 0.033 99.39~149.09 60 min 牛奶[57] SWV 铋膜电极 CIP 0.003 0.008~0.2 62 s 自来水[59] -
[1] BISACCHI G S. Origins of the quinolone class of antibacterials: An expanded "discovery story"[J]. Journal of Medicinal Chemistry,2015,58(12):4874−4882. doi: 10.1021/jm501881c
[2] ANDERSSON M I, MACGOWAN A P. Development of the quinolones[J]. Journal of Antimicrobial Chemotherapy,2003,51(suppl_1):1−11.
[3] TANG H Z, WANG Y H, LI S, et al. Graphene oxide composites for magnetic solid-phase extraction of twelve quinolones in water samples followed by MALDI-TOF MS[J]. Analytical and Bioanalytical Chemistry,2019,411(26):7039−7049. doi: 10.1007/s00216-019-02081-w
[4] 卢金连, 杜明慧, 潘运安, 等. 有机蔬菜中喹诺酮类抗生素污染特征与风险评价[J]. 环境科学与技术,2021,44(3):209−217. [LU Jinlian, DU Minghui, PAN Yunan, et al. Pollution characteristics and risk assessment of quinolone antibiotics in organic vegetables[J]. Environmental Science and Technology,2021,44(3):209−217. doi: 10.19672/j.cnki.1003-6504.2021.03.027 [5] 林功师. 市售鱼类喹诺酮类药物残留调查[J]. 水产养殖,2022,43(5):32−35. [LING Gongshi. Survey of quinolones residues in fishes in the retailer[J]. Journal of Aquaculture,2022,43(5):32−35. doi: 10.3969/j.issn.1004-2091.2022.05.008 [6] BARBOSA TORRALBO J, BARRÓN BUENO D, HERMO OUTEIRAL M, et al. Determination and characterization of quinolones in foodstuffs of animal origin by CE-UV, LC-UV, LC-Fl, LC-MS and LC-MS/MS[J]. Ovidius University Annals of Chemistry,2009,20(2):165−179.
[7] SAMANIDOU V, DEMETRIOU C, PAPADOYANNIS I. Direct determination of four fluoroquinolones, enoxacin, norfloxacin, ofloxacin, and ciprofloxacin, in pharmaceuticals and blood serum by HPLC[J]. Analytical and Bioanalytical Chemistry,2003,375(5):623−629. doi: 10.1007/s00216-003-1749-9
[8] JIANG W, WANG Z, BEIER R C, et al. Simultaneous determination of 13 fluoroquinolone and 22 sulfonamide residues in milk by a dual-colorimetric enzyme-linked immunosorbent assay[J]. Analytical Chemistry,2013,85(4):1995−1999. doi: 10.1021/ac303606h
[9] HAN R W, ZHENG N, WANG J Q, et al. Survey of tetracyclines, sulfonamides, sulfamethazine, and quinolones in UHT milk in china market[J]. Journal of Integrative Agriculture,2013,12(7):1300−1305. doi: 10.1016/S2095-3119(13)60433-5
[10] JINQING J, HAITANG Z, JUNWEI L, et al. Development and optimization of an indirect competitive ELISA for detection of norfloxacin residue in chicken liver[J]. Procedia Environmental Sciences,2011,8:128−133. doi: 10.1016/j.proenv.2011.10.021
[11] HERRERA-HERRERA A V, HERNáNDEZ-BORGES J, BORGES-MIQUEL T M, et al. Dispersive liquid-liquid microextraction combined with nonaqueous capillary electrophoresis for the determination of fluoroquinolone antibiotics in waters[J]. Electrophoresis,2010,31(20):3457−3465. doi: 10.1002/elps.201000285
[12] WANG Y, BAEYENS W R G, HUANG C, et al. Enhanced separation of seven quinolones by capillary electrophoresis with silica nanoparticles as additive[J]. Talanta,2009,77(5):1667−1674. doi: 10.1016/j.talanta.2008.10.002
[13] MORENO-GONZÁLEZ D, LARA F J, GÁMIZ-GRACIA L, et al. Molecularly imprinted polymer as in-line concentrator in capillary electrophoresis coupled with mass spectrometry for the determination of quinolones in bovine milk samples[J]. Journal of Chromatography A,2014,1360:1−8. doi: 10.1016/j.chroma.2014.07.049
[14] DAWADI S, THAPA R, MODI B, et al. Technological advancements for the detection of antibiotics in food products[J]. Processes,2021,9(9):1500. doi: 10.3390/pr9091500
[15] MAJDINASAB M, YAQUB M, RAHIM A, et al. An overview on recent progress in electrochemical biosensors for antimicrobial drug residues in animal-derived food[J]. Sensors (Basel),2017,17(9):1947. doi: 10.3390/s17091947
[16] MADURAIVEERAN G, JIN W. Nanomaterials based electrochemical sensor and biosensor platforms for environmental applications[J]. Trends in Environmental Analytical Chemistry,2017,13:10−23. doi: 10.1016/j.teac.2017.02.001
[17] MAJDINASAB M, MITSUBAYASHI K, MARTY J L. Optical and electrochemical sensors and biosensors for the detection of quinolones[J]. Trends Biotechnol,2019,37(8):898−915. doi: 10.1016/j.tibtech.2019.01.004
[18] HOLZINGER M, LE GOFF A, COSNIER S. Synergetic effects of combined nanomaterials for biosensing applications[J]. Sensors (Basel),2017,17(5):1010. doi: 10.3390/s17051010
[19] ZHANG R, BELWAL T, LI L, et al. Nanomaterial-based biosensors for sensing key foodborne pathogens: Advances from recent decades[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1465−1487. doi: 10.1111/1541-4337.12576
[20] SADEGHI A S, ANSARI N, RAMEZANI M, et al. Optical and electrochemical aptasensors for the detection of amphenicols[J]. Biosens Bioelectron,2018,118:137−152. doi: 10.1016/j.bios.2018.07.045
[21] RENUKA R M, MAROLI N, ACHUTH J, et al. Highly adaptable and sensitive FRET-based aptamer assay for the detection of Salmonella paratyphi A[J]. Spectrochim Acta Part A:Molecular and Biomolecular Spectroscopy,2020,243:118662. doi: 10.1016/j.saa.2020.118662
[22] XIA H, PENG M, LI N, et al. CdSe quantum dots-sensitized FRET system for ciprofloxacin detection[J]. Chemical Physics Letters,2020,740:137085. doi: 10.1016/j.cplett.2019.137085
[23] TAN X, LI Q, YANG J. A simple fluorescence method detection levofloxacin in milk based on GSH-CdTe QDs[J]. Journal of Molecular Structure,2020,1201:127175. doi: 10.1016/j.molstruc.2019.127175
[24] SUANCHAN K, CHANSUD N, SA-NGUANPRANG S, et al. A nanocomposite optosensing probe based on hierarchical porous carbon and graphene quantum dots incorporated in selective polymer for the detection of trace ofloxacin[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2021,628:127376. doi: 10.1016/j.colsurfa.2021.127376
[25] RONG Y, HASSAN M M, OUYANG Q, et al. Lanthanide ion (Ln(3+))-based upconversion sensor for quantification of food contaminants: A review[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3531−3578. doi: 10.1111/1541-4337.12765
[26] ZHANG Y, DUAN B, BAO Q, et al. Aptamer-modified sensitive nanobiosensors for the specific detection of antibiotics[J]. Journal of Materials Chemistry B,2020,8(37):8607−8613. doi: 10.1039/D0TB01441A
[27] HU G, SHENG W, ZHANG Y, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J]. Analytical and Bioanalytical Chemistry,2015,407(28):8487−8496. doi: 10.1007/s00216-015-8996-4
[28] ZHANG Z, ZHANG M, WU X Y, et al. Upconversion fluorescence resonance energy transfer-A novel approach for sensitive detection of fluoroquinolones in water samples[J]. Microchemical Journal,2016,124:181−187. doi: 10.1016/j.microc.2015.08.024
[29] LIU X, SU L, ZHU L, et al. Hybrid material for enrofloxacin sensing based on aptamer-functionalized magnetic nanoparticle conjugated with upconversion nanoprobes[J]. Sensors and Actuators B:Chemical,2016,233:394−401. doi: 10.1016/j.snb.2016.04.096
[30] ZHOU X, WANG L, SHEN G, et al. Colorimetric determination of ofloxacin using unmodified aptamers and the aggregation of gold nanoparticles[J]. Mikrochim Acta,2018,185(7):355. doi: 10.1007/s00604-018-2895-2
[31] LAVAEE P, DANESH N M, RAMEZANI M, et al. Colorimetric aptamer based assay for the determination of fluoroquinolones by triggering the reduction-catalyzing activity of gold nanoparticles[J]. Microchimica Acta,2017,184(7):2039−2045. doi: 10.1007/s00604-017-2213-4
[32] SUN M, HE M, JIANG S, et al. Multi-enzyme activity of three layers FeOx@ZnMnFeOy@Fe-Mn organogel for colorimetric detection of antioxidants and norfloxacin with smartphone[J]. Chemical Engineering Journal,2021,425:131823. doi: 10.1016/j.cej.2021.131823
[33] REN S, LI Q, WANG J, et al. Development of a fast and ultrasensitive black phosphorus-based colorimetric/photothermal dual-readout immunochromatography for determination of norfloxacin in tap water and river water[J]. Journal of Hazardous Materials,2021,402:123781. doi: 10.1016/j.jhazmat.2020.123781
[34] REZENDE J D P, PACHECO A F C, MAGALHÃES O F, et al. Polydiacetylene/triblock copolymer/surfactant nanoblend: A simple and rapid method for the colorimetric screening of enrofloxacin residue[J]. Food Chemistry,2019,280:1−7. doi: 10.1016/j.foodchem.2018.12.033
[35] SHARMA B, FRONTIERA R R, HENRY A I, et al. SERS: Materials, applications, and the future[J]. Materials Today,2012,15(1−2):16−25. doi: 10.1016/S1369-7021(12)70017-2
[36] LIANG J F, PENG C, LI P, et al. A review of detection of antibiotic residues in food by surface-enhanced Raman spectroscopy[J]. Bioinorg Chemistry and Applications,2021,2021:8180154.
[37] SHI Q, HUANG J, SUN Y, et al. A SERS-based multiple immuno-nanoprobe for ultrasensitive detection of neomycin and quinolone antibiotics via a lateral flow assay[J]. Microchimica Acta,2018,185(2):84. doi: 10.1007/s00604-017-2556-x
[38] LIU J, LIU W, ZHOU S N, et al. Free-standing membrane liquid-state platform for SERS-based determination of norfloxacin in environmental samples[J]. Journal of Analysis and Testing,2021,5(3):217−224. doi: 10.1007/s41664-021-00192-x
[39] LI N, HAN S, LIN S, et al. Fabrication of an AAO-based surface-enhanced Raman scattering substrate for the identification of levofloxacin in milk[J]. New Journal of Chemistry,2021,45(17):7571−7577. doi: 10.1039/D1NJ00642H
[40] HAIPING L, JIANGYUE W, FANPING M, et al. Immunochromatographic assay for the detection of antibiotics in animal-derived foods: A review[J]. Food Control,2021,130:108356. doi: 10.1016/j.foodcont.2021.108356
[41] PENG J, LIU L, XU L, et al. Gold nanoparticle-based paper sensor for ultrasensitive and multiple detection of 32 (fluoro) quinolones by one monoclonal antibody[J]. Nano Research,2017,10(1):108−120. doi: 10.1007/s12274-016-1270-z
[42] OLIVEIRA C P D, SOARES N D F F, TEIXEIRA A V N D C, et al. Gold nanoparticle-based paper sensor for highly specific detection of ofloxacin in beef[J]. Journal of Food Chemistry & Nanotechnology,2019,05(04):72−78.
[43] LIU J, WANG B, HUANG H, et al. Quantitative ciprofloxacin on-site rapid detections using quantum dot microsphere based immunochromatographic test strips[J]. Food Chemistry,2021,335:127596. doi: 10.1016/j.foodchem.2020.127596
[44] HU G, GAO S, HAN X, et al. Comparison of immunochromatographic strips using colloidal gold, quantum dots, and upconversion nanoparticles for visual detection of norfloxacin in milk samples[J]. Food Analytical Methods,2020,13(5):1069−1077. doi: 10.1007/s12161-020-01725-3
[45] XIAO J, LIU M, TIAN F, et al. Stable europium-based metal-organic frameworks for naked-eye ultrasensitive detecting fluoroquinolones antibiotics[J]. Inorganic Chemistry,2021,60(7):5282−5289. doi: 10.1021/acs.inorgchem.1c00263
[46] TENG P, GAO D, YANG X, et al. In situ SERS detection of quinolone antibiotic residues in a water environment based on optofluidic in-fiber integrated Ag nanoparticles[J]. Applied Optics,2021,60(22):6659−6664. doi: 10.1364/AO.426611
[47] TIAN Y, LI G, ZHANG H, et al. Construction of optimized Au@Ag core-shell nanorods for ultralow SERS detection of antibiotic levofloxacin molecules[J]. Optics Express,2018,26(18):23347−23358. doi: 10.1364/OE.26.023347
[48] NGUYEN L D, HUYNH T M, NGUYEN T S V, et al. Nafion/platinum modified electrode-on-chip for the electrochemical detection of trace iron in natural water[J]. Journal of Electroanalytical Chemistry,2020,873:114396. doi: 10.1016/j.jelechem.2020.114396
[49] WANG Q, XUE Q, CHEN T, et al. Recent advances in electrochemical sensors for antibiotics and their applications[J]. Chinese Chemical Letters,2021,32(2):609−619. doi: 10.1016/j.cclet.2020.10.025
[50] HU X, GOUD K Y, KUMAR V S, et al. Disposable electrochemical aptasensor based on carbon nanotubes-V2O5-chitosan nanocomposite for detection of ciprofloxacin[J]. Sensors and Actuators B:Chemical,2018,268(1):278−286.
[51] SINGH V, KUSS S. Pico-molar electrochemical detection of ciprofloxacin at composite electrodes[J]. Analyst,2022,147(16):3773−3782. doi: 10.1039/D2AN00645F
[52] SADAT KHALOO S, MOZAFFARI S, BAREKAT A, et al. Fabrication of a modified electrode based on multi-walled carbon nanotubes decorated with iron oxide nanoparticles for the determination of enrofloxacin[J]. Micro & Nano Letters,2015,10(10):561−566.
[53] LÜ L, ZHANG B, TIAN P, et al. A “signal off” aptasensor based on AuNPs/Ni-MOF substrate-free catalyzed for detection enrofloxacin[J]. Journal of Electroanalytical Chemistry,2022,911:116251. doi: 10.1016/j.jelechem.2022.116251
[54] GISSAWONG N, SRIJARANAI S, BOONCHIANGMA S, et al. An electrochemical sensor for voltammetric detection of ciprofloxacin using a glassy carbon electrode modified with activated carbon, gold nanoparticles and supramolecular solvent[J]. Microchimica Acta,2021,188(6):208. doi: 10.1007/s00604-021-04869-z
[55] PILEHVAR S, REINEMANN C, BOTTARI F, et al. A joint action of aptamers and gold nanoparticles chemically trapped on a glassy carbon support for the electrochemical sensing of ofloxacin[J]. Sensors and Actuators B:Chemical,2017,240:1024−1035. doi: 10.1016/j.snb.2016.09.075
[56] AYMARD C, KANSO H, SERRANO M J, et al. Development of a new dual electrochemical immunosensor for a rapid and sensitive detection of enrofloxacin in meat samples[J]. Food Chemistry,2022,370:131016. doi: 10.1016/j.foodchem.2021.131016
[57] TAGHDISI HEIDARIAN S M, TAVANAEE SANI A, DANESH N M, et al. A novel electrochemical approach for the ultrasensitive detection of fluoroquinolones based on a double-labelled aptamer to surpass complementary strands of aptamer lying flat[J]. Sensors and Actuators B:Chemical,2021,334:129632. doi: 10.1016/j.snb.2021.129632
[58] DE SOUZA C C, ALVES G F, LISBOA T P, et al. Low-cost paper-based electrochemical sensor for the detection of ciprofloxacin in honey and milk samples[J]. Journal of Food Composition and Analysis,2022,112:104700. doi: 10.1016/j.jfca.2022.104700
[59] KERGARAVAT S V, ROMERO N, REGALDO L, et al. Simultaneous electrochemical detection of ciprofloxacin and Ag(I) in a silver nanoparticle dissolution: Application to ecotoxicological acute studies[J]. Microchemical Journal,2021,162:105832. doi: 10.1016/j.microc.2020.105832
-
期刊类型引用(2)
1. 王宏,王丽阳,周杰伦,曾晓房,姜浩,梁一柱,陈学桥,白卫东. 化橘红活性成分及功效研究进展. 农产品加工. 2024(23): 85-91 .  百度学术
百度学术
2. 任晨汐,卞灿锋,李宁,高雅,张玉霞,胡钦,肖丽霞,关天竺. 基于网络药理学和分子对接探究药膳“枸杞-桑椹-覆盆子汤”治疗糖尿病肾病的分子机制. 保鲜与加工. 2023(11): 51-61 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



