Identification Method of Taro (Colocasia esculenta L.) Origin Based on Gas Chromatography-Ion Mobility Spectrometry Technology
-
摘要: 分析不同产地芋头挥发性有机化合物组成差异,并构建芋头产地溯源的可视化指纹图谱。采用气相离子迁移谱法对不同产地芋头的挥发性物质进行测定,结合主成分分析(PCA)实现样品产地的快速区分,进一步筛选芋头中差异挥发性物质。结果表明,在不同产地芋头中,共检测到45个信号峰,鉴定出26种化合物,包括单体和部分化合物的二聚体。主成分分析将芋头分为3类,其中,靖江香沙芋和奉化芋头的挥发性物质较为相似,而与荔浦芋头、沙沟芋头差别很大。异丙醇、2-甲基-乙酸丁酯、辛酸甲酯是区别不同芋头的特征标记物。该方法直观、快速,为地方特色芋头的区分提供了新方法和技术支持。Abstract: To analyze the composition of volatile organic compounds in taro from different origins, and construct visual fingerprint of taro origins. The volatile components of taro from different origins were determined by gas chromatography-ion mobility spectrometry (GC-IMS), and principal component analysis (PCA) could quickly distinguish the differences of volatile components, further screened the different volatile compounds in taro samples. Results showed that, a total of 45 signal peaks were detected in taro from different origins, and 26 compounds were identified, including monomers and dimers of some compounds. Taro samples could be divided into three categories by PCA. Among them, the volatile substances of Jingjiang taro and Fenghua taro were similar, but they were significant different from Lipu taro and Shagou taro. Isopropanol, 2-methyl-butyl acetate and methyl octanoate were regarded as characteristic markers to distinguish different taro samples. This method was intuitive and rapid, and would provide a novel method and technical support for distinguishing local characteristic taro.
-
芋头(Colocasia esculenta L.),天南星科草本植物,原产于东南亚,广泛种植在热带和亚热带地区,是一种富含淀粉的块茎[1-3]。全球范围内,尼日利亚、喀麦隆、加纳、埃塞俄比亚和中国是芋头的五大主产国,总产量占比81.9%[4]。芋头以根部的块茎作为主要食用部位,而其叶片、茎也可以用于制作浓汤、酱汁、炖菜的辅料,其营养价值丰富[5]。不同产地芋头品种,受田间栽培与管理、气候条件、地域差异等因素的影响,导致芋头的品质和风味有一定的差异。芋头的特征挥发性风味物质是决定消费者采购意向的重要感官形式,也是影响芋头品质和加工特性的重要因素,其挥发性物质组成及含量对芋头的高值化利用起到重要作用。因此,找到一种便捷、高效鉴别芋头挥发性化合物和评估风味品质的分析方法显得尤为重要。
香气、味觉和外观是衡量食品质量的3个重要指标。其中,挥发性香气化合物对食品风味影响显著。顶空气相-离子迁移谱(headspace gas chromatography-ion mobility spectrometry,HS-GC-IMS)技术是一种新兴的挥发性风味物质分析检测方法,相比气相色谱-质谱法而言,它不需要复杂的预处理,检测时间短,灵敏度高,可以在常压下操作[6]。杨智鹏等[7]以国内主产区的灰枣和骏枣为研究对象,成功构建了不同产地枣果特征风味物质的GC-IMS库。李军山等[8]建立GC-IMS结合化学计量学方法快速鉴别连翘产地的方法,河南、山东、陕西产地样品的区别明显。刘振平等[9]采用GC-IMS技术对产自重庆三峡库区的油菜花、五倍子花、枇杷花和柑橘花的特色蜂蜜挥发性化合物进行测定和分析,实现了不同植物来源蜂蜜的鉴别和分类。郭家刚等[10]通过GC-IMS技术对安徽省铜陵市、舒城县、临泉县三地的生姜特征风味成分进行分析,为生姜产地区分、溯源和品质评价提供新的思路。近年来,HS-GC-IMS技术已广泛应用于食品风味分析的各个领域,包括食品分类和掺假、食品新鲜度和变质评价、异味检测、食品加工监测、食品贮藏过程中的香气变化评价[11-16]。然而,目前应用HS-GC-IMS技术来评估芋头挥发性有机物的组成如何影响其地理来源鲜有报道。
本研究以沙沟芋头、靖江香沙芋、奉化芋头和荔浦芋头四个不同产地样品为研究对象,采用HS-GC-IMS技术对其挥发性有机物进行检测。通过主成分分析(principal component analysis,PCA)对芋头产地差异进行分类,结合正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analyses,OPLS-DA)进一步验证分类标记的合理性,并筛选样品中特征标记物。利用挥发性风味化合物的特性,建立一种快速、简单、有效的市面上芋头质量控制的方法,为区分芋头的地理来源提供一个新的维度。其结果有望提高食品安全性和真实性,进而激发农产品种植业的市场潜力。
1. 材料与方法
1.1 材料与仪器
新鲜无虫害的芋头 分别购买自我国山东临沂、江苏靖江、浙江宁波、广西荔浦4个不同产地的种植农户,经塑料袋包装标记后,随即转运到实验室进行测试。4个产地的12种样品的具体信息如表1。正构酮类(C4~C9,均为分析纯)试剂 北京国药集团化学试剂有限公司。
表 1 芋头产地基本信息Table 1. Basic information of taro origins编号 取样地点 样品名称 T1-1 临沂市罗庄区白沙沟村 沙沟芋头 T1-2 临沂市罗庄区唐沙沟村 T1-3 临沂市罗庄区郑旺村 T2-1 靖江市斜桥镇 靖江香沙芋 T2-2 靖江市孤山镇 T2-3 靖江市西来镇 T3-1 宁波市奉化区溪口镇 奉化芋头 T3-2 宁波市奉化区尚田镇 T3-3 宁波市奉化区萧王庙镇 T4-1 荔浦市青山镇 荔浦芋头 T4-2 荔浦市修仁镇 T4-3 荔浦市新坪镇 Flavour Spec®风味分析仪 德国G.A.S.mbH公司;20 mL顶空进样瓶 上海安谱实验科技股份有限公司;FA 1004分析天平 上海越平科学仪器有限公司;XY-8608破壁机 广东德玛仕智能厨房设备有限公司。
1.2 实验方法
1.2.1 样品前处理
将待测新鲜芋头样品用流动水清洗2~3次,去皮取果肉,使用破壁机搅拌均匀,随后取样置于20 mL的顶空进样瓶中密封,同一产地样品测试3次。
1.2.2 HS-GC-IMS技术风味物质测定
芋头中挥发性有机化合物(volatile organic compounds,VOCs)的测定,参考Feng等[17]的方法,并做一些修改。使用一台配备有自动进样器和顶空进样装置的气相离子迁移色谱风味分析仪进行分析。首先,准确称取3.0 g样品,放入20 mL顶空进样瓶中。随后,样品在50 ℃以500 r/min的转速孵育15 min。孵育后,通过85 ℃的注射器温度将500 μL的顶空气体自动注入到分析仪器中。VOCs的分离使用MXT-5毛细管柱(15 m×0.53 mm,1 μm FT)。载气(N2,纯度>99.99%)流速变化如下,初始按照2 mL/min维持2 min,线性上升至100 mL/min,整个过程用时20 min。在柱温60 ℃下实现待分析物分离,随后在45 ℃的IMS电离室中电离。测试过程的漂移气也是N2,流速为150 mL/min。相同条件下,根据正构酮类(C4~C9)的出峰情况,计算检测到化合物的保留指数(retention index,RI)。根据仪器自带数据库,结合RI和漂移时间(drift time,DT)进行化合物的比对,实现对挥发性化合物的鉴定,同时根据仪器检测到的峰强度来表征挥发性化合物的相对含量。
1.3 数据处理
仪器分析软件包括实验室分析查看器(laboratory analytical viewer,LAV)和配套的三个插件(Reporter,Gallery plot和动态PCA),以及GC×IMS数据库搜索,可用于不同角度的样本分析。测量过程为3次,结果用平均值±标准差表示。使用SPSS 24.0软件进行单因素方差分析(analysis of variance,ANOVA),并通过邓肯多重检验来表示组间显著性差异(P<0.05)。通过SIMCA 13.0软件,对挥发性物质进行OPLS-DA,满足变量重要性投影(variable importance on projection,VIP)>1.0和P<0.05两个条件,筛选样品中差异风味化合物。
2. 结果与分析
2.1 不同产地芋头挥发性有机化合物差异比较
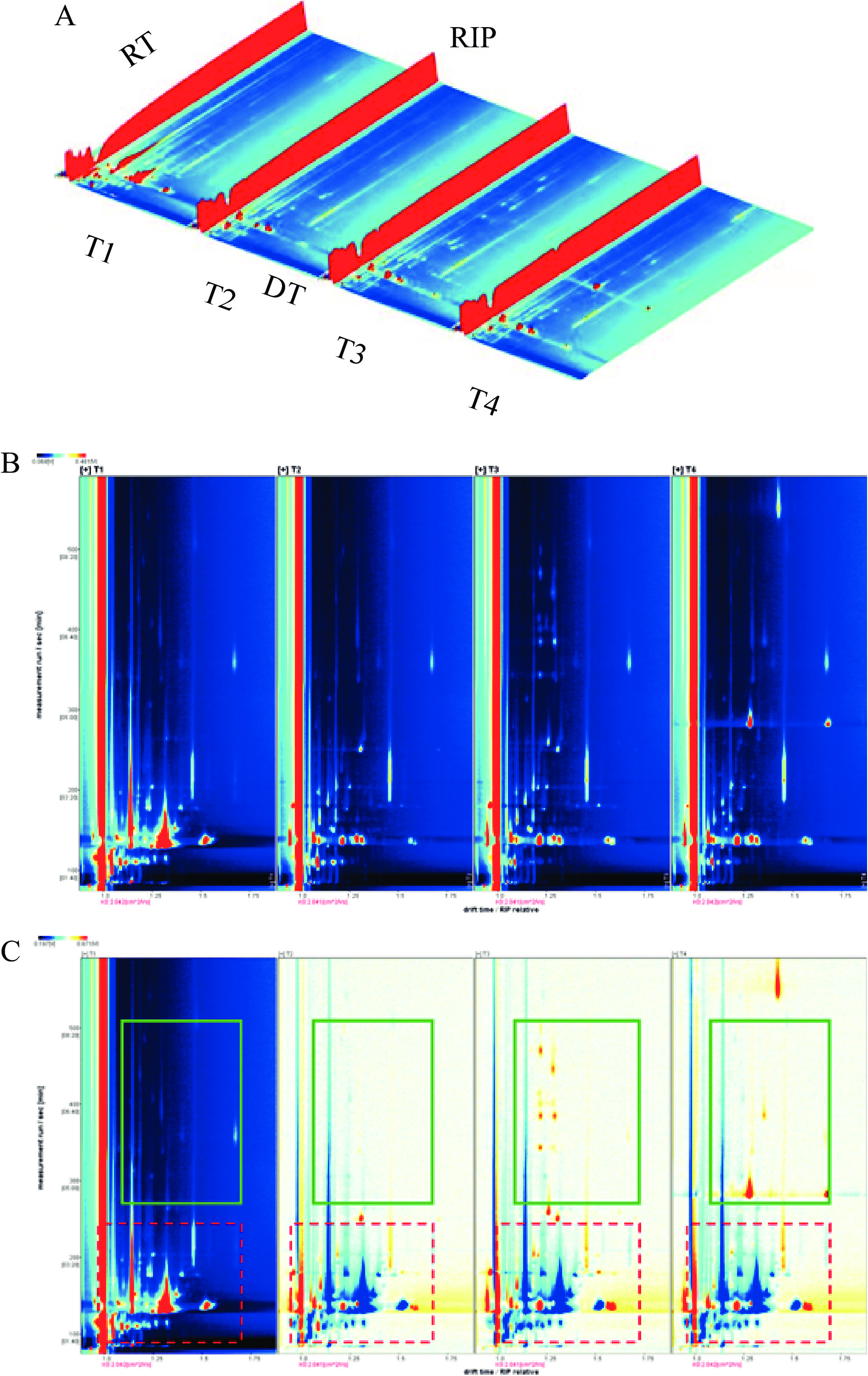
HS-GC-IMS技术被应用于不同产地芋头挥发性风味物质分析中,以便获取较为全面的挥发性代谢物的信息。不同产地芋头VOCs的三维谱图如图1A所示,可以直观地观察到样品中一些挥发性物质含量有所减少,同时也伴随着部分新的化合物形成。一些VOCs产生了不同的产物离子(如单体或二聚体),这取决于VOCs的浓度,并且单体化合物的离子迁移速率要高于其二聚体[18]。为了方便分析不同产地芋头之间中VOCs的差异,得到样品的二维谱图(图1B和图1C)。在二维谱图中,横坐标1.0处的红色垂直线代表反应离子峰(reaction ion peak,RIP),每个点代表一个VOCs的信号峰。在不同产地芋头样品中,VOCs的保留时间主要集中在100~600 s,差异最明显的信号峰集中在保留时间100~200 s的区域内。背景颜色的深浅表示化合物含量的不同,白点表示含量较低,红点表示含量较高,因此,色调越深,对应化合物的浓度亦越高[19]。为了更直观地比较不同样品之间挥发性物质的差异,选用T1样品的出峰信号强度的俯视谱图作为参考,得到不同样品之间的差异谱图(图1C)。当样品中VOCs含量与之相同时,呈现白色;当VOCs浓度低于参考值时,呈现蓝色;当VOCs浓度高于参考值时,呈现红色。通过比较化合物的漂移时间和信号峰强度,对各个检测到的挥发性风味成分进行定性分析。在图1C的方框区域内,不同产地芋头中挥发性风味物质含量差别较大,其中,绿色实线框区域内挥发性成分在奉化芋头和荔浦芋头中含量较高,沙沟芋头和靖江香沙芋中较低。而红色虚线框区域内的挥发性成分在沙沟芋头中含量较高,靖江香沙芋中含量最低。
2.2 不同产地芋头挥发性物质GC-IMS指纹图谱
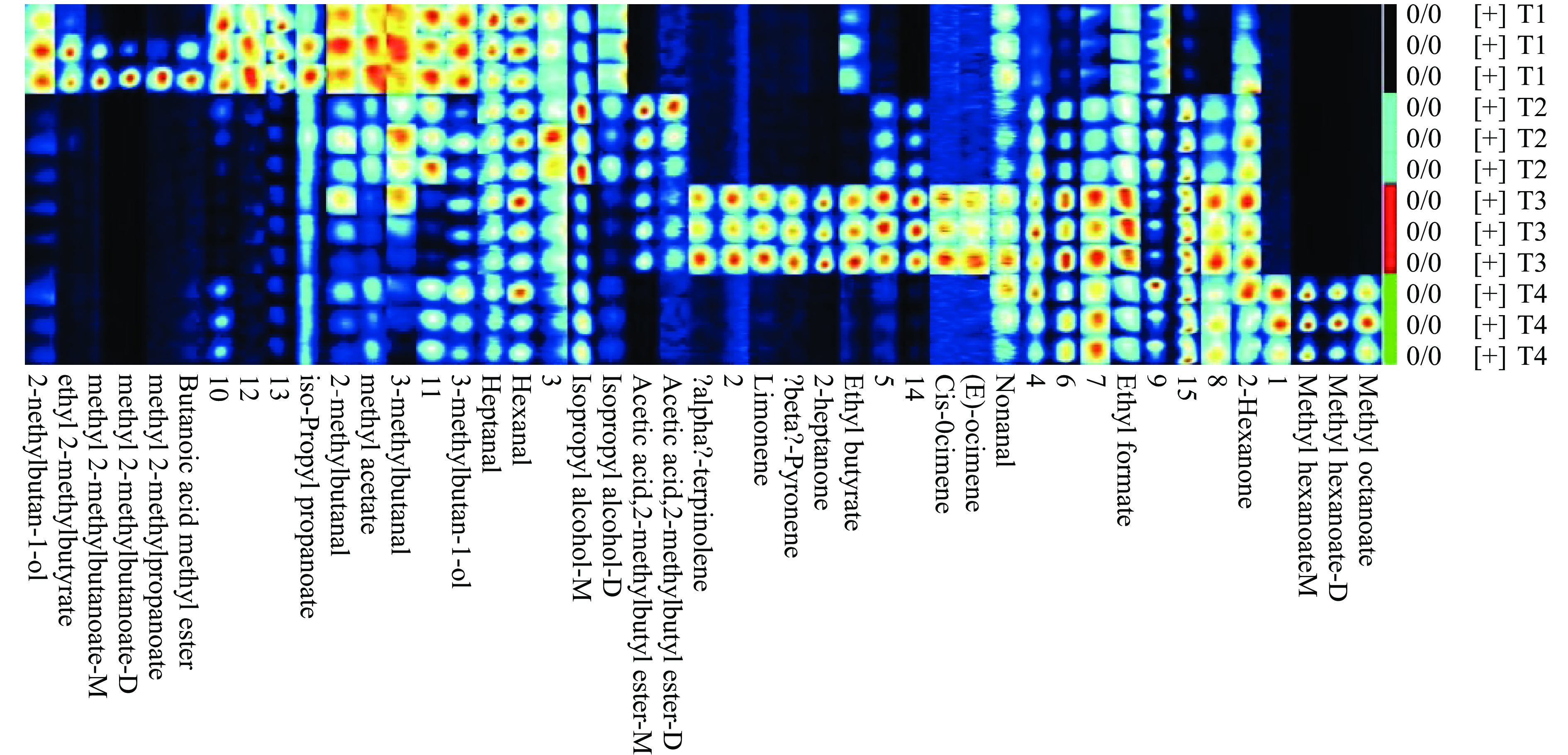
风味是农产品重要的品质特性,食品的风味物质几乎总是与食品基质共同存在,而它们被释放出来需要基质成分受到化学或物理因素的影响。研究表明,农产品品质的好坏往往伴随着挥发性化合物的变化,并与之有紧密联系[20-21]。基于分析仪器的NIST数据库,结合化合物的RI、RT、漂移时间,本研究检测到芋头中挥发性有机物的结果,如表2和图2所示。共检测到45个信号峰,鉴定出26种风味物质,包括11种酯类、5种醛类、5种烯类、3种醇类和2种酮类。另外,含有15种未知化合物。其中,酯类、醛类和烯类是芋头中种类最为丰富的挥发性风味物质。
表 2 HS-GC-IMS技术鉴定芋头样品中挥发性化合物Table 2. Volatile compounds identified in taro samples by HS-GC-IMS technology序号 中文名称 英文名称 CAS# 分子式 MW RI RT DT 备注 1 辛酸甲酯 Methyl octanoate C111-11-5 C9H18O2 158.2 1140.5 553.003 1.429 2 己酸甲酯 Methyl hexanoate C106-70-7 C7H14O2 130.2 924 284.075 1.284 M 3 己酸甲酯 Methyl hexanoate C106-70-7 C7H14O2 130.2 923.4 283.565 1.682 D 4 2-甲基-丁酸乙酯 ethyl 2-methylbutyrate C7452-79-1 C7H14O2 130.2 843.4 230.764 1.229 5 2-甲基-丁酸甲酯 methyl 2-methylbutanoate C868-57-5 C6H12O2 116.2 771.7 193.990 1.186 M 6 2-甲基-丁酸甲酯 methyl 2-methylbutanoate C868-57-5 C6H12O2 116.2 768.3 192.608 1.538 D 7 丙酸异丙酯 iso-Propyl propanoate C637-78-5 C6H12O2 116.2 749.9 185.142 1.185 8 丁酸甲酯 Butanoic acid methyl ester C623-42-7 C5H10O2 102.1 717.2 171.871 1.432 9 异丁酸甲酯 methyl 2-methylpropanoate C547-63-7 C5H10O2 102.1 681.3 158.323 1.440 10 2-甲基-乙酸丁酯 Acetic acid, 2-methylbutyl ester C624-41-9 C7H14O2 130.2 880.5 250.671 1.311 M 11 2-甲基-乙酸丁酯 Acetic acid, 2-methylbutyl ester C624-41-9 C7H14O2 130.2 879.3 250.031 1.706 D 12 丁酸乙酯 Ethyl butyrate C105-54-4 C6H12O2 116.2 791.7 203.056 1.208 13 乙酸甲酯 Methyl acetate C79-20-9 C3H6O2 74.1 522.7 115.562 1.035 14 甲酸乙酯 Ethyl formate C109-94-4 C3H6O2 74.1 503.8 110.455 1.068 15 壬醛 Nonanal C124-19-6 C9H18O 142.2 1108.9 507.586 1.475 16 庚醛 Heptanal C111-71-7 C7H14O 114.2 902.5 265.704 1.326 17 己醛 Hexanal C66-25-1 C6H12O 100.2 793.8 204.220 1.254 18 2-甲基丁醛 2-methylbutanal C96-17-3 C5H10O 86.1 661.2 152.909 1.159 19 3-甲基丁醛 3-methylbutanal C590-86-3 C5H10O 86.1 651.4 150.270 1.170 20 α-松油烯 terpinolene C586-62-9 C10H16 136.2 1083.3 470.810 1.223 21 柠檬烯 Limonene C138-86-3 C10H16 136.2 1023.5 384.704 1.223 22 β-吡喃烯 1,2,6,6-tetramethylcyclohexa-1,3-diene C514-96-5 C10H16 136.2 993.6 343.427 1.222 23 (Z)-罗勒烯 Cis-Ocimene C3338-55-4 C10H16 136.2 1034.7 400.884 1.221 24 (E)-罗勒烯 (E)-Ocimene C3779-61-1 C10H16 136.2 1044.4 414.754 1.216 25 2-甲基-1-丁醇 2-methylbutan-1-ol C137-32-6 C5H12O 88.1 734.9 179.059 1.227 26 3-甲基-1-丁醇 3-methylbutan-1-ol C123-51-3 C5H12O 88.1 730.1 177.124 1.241 27 异丙醇 Isopropyl alcohol C67-63-0 C3H8O 60.1 505 110.775 1.092 M 28 异丙醇 Isopropyl alcohol C67-63-0 C3H8O 60.1 506.2 111.094 1.217 D 29 2-庚酮 2-Heptanone C110-43-0 C7H14O 114.2 897.2 261.183 1.263 30 2-己酮 2-Hexanone C591-78-6 C6H12O 100.2 796.9 205.854 1.185 31 未知物1 unidentified − − − 1024.8 386.645 1.356 32 未知物2 unidentified − − − 1066.4 446.399 1.287 33 未知物3 unidentified − − − 779.2 197.031 1.090 34 未知物4 unidentified − − − 695.5 163.098 1.102 35 未知物5 unidentified − − − 739 180.721 1.519 36 未知物6 unidentified − − − 601.4 136.759 1.221 37 未知物7 unidentified − − − 610.6 139.247 1.567 38 未知物8 unidentified − − − 589 133.441 1.591 39 未知物9 unidentified − − − 611.6 139.524 1.290 40 未知物10 unidentified − − − 576.7 130.123 1.139 41 未知物11 unidentified − − − 500.3 109.498 1.169 42 未知物12 unidentified − − − 520.4 114.924 1.266 43 未知物13 unidentified − − − 599.7 136.309 1.321 44 未知物14 unidentified − − − 742 181.951 0.961 45 未知物15 unidentified − − − 604.8 137.705 0.948 注:MW表示化合物分子量;RI表示保留指数;RT表示保留时间(s);DT表示漂移时间(ms);M表示化合物单体;D表示化合物的二聚体。 酯类主要是游离酸类和醇类通过酯化作用而形成,通常酯类中多数能够为水果和发酵食品提供花香味、水果味,更是芋头中重要的芳香类物质。沙沟芋头中丁酸乙酯、乙酸甲酯、丁酸甲酯、丙酸异丙酯、异丁酸甲酯、2-甲基-丁酸乙酯和2-甲基-丁酸甲酯的含量更丰富,靖江香沙芋中则以2-甲基-乙酸丁酯为主,奉化芋头中主要酯类是丁酸乙酯、2-甲基-乙酸丁酯和甲酸乙酯,辛酸甲酯和己酸甲酯在荔浦芋头的酯类中含量最高。其中,丁酸乙酯具有水果味、甜味,赋予芋头独特的风味。
醛类是芋头中重要的挥发性化合物,己醛和庚醛是芋头样品中主要的醛类物质。其中,己醛在沙沟芋头中含量最高,提供脂肪味和青草味[22-23]。由于其气味阈值很低,在较低的浓度下就能被人所感知,故壬醛对芋头香气同样有着很大的贡献。但是醛类的稳定性差,在食物基质中容易被还原为醇类或氧化为酸类[24]。而且,高浓度的醛类也可能会导致异味的产生[25]。
醇类是食品中重要的挥发性化合物,具有温和的气味特征,主要来源于多不饱和脂肪酸中的脂肪氧合酶反应[26]。少量醇类化合物可产生淡淡的香气,并可作为其他香气物质的良好溶剂[27]。醇类是芋头中另一大类挥发性物质,包括异丙醇、2-甲基-1-丁醇和3-甲基-1-丁醇。其中,2-甲基-1-丁醇是与麦芽、葡萄酒和洋葱香气相关的一种重要醇类[28],其含量在沙沟芋头中最高,而其他样品中基本未检测到。沙沟芋头中2-甲基-1-丁醇和3-甲基-1-丁醇的含量明显高于其他样品,在图2中对应指纹图谱的色调也更深。
2.3 不同产地芋头化学计量学分析及差异挥发性化合物的确定
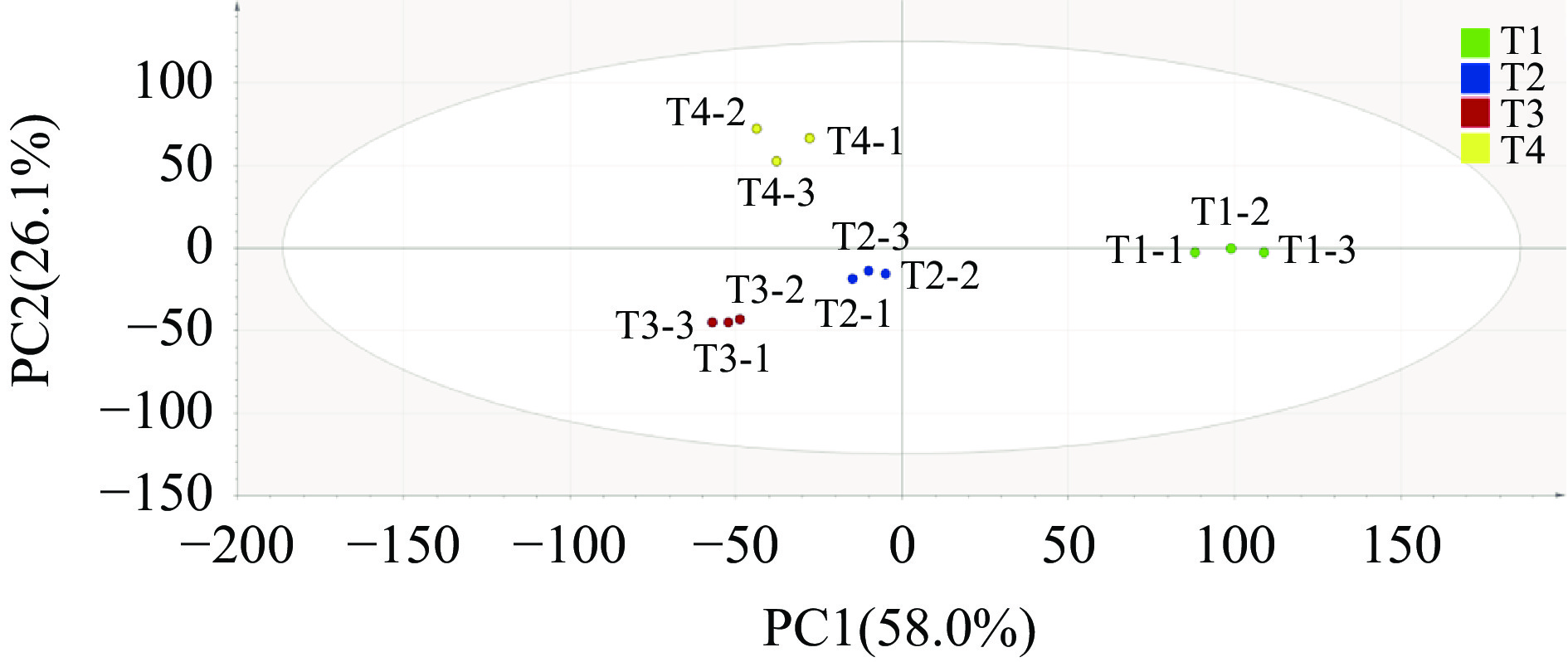
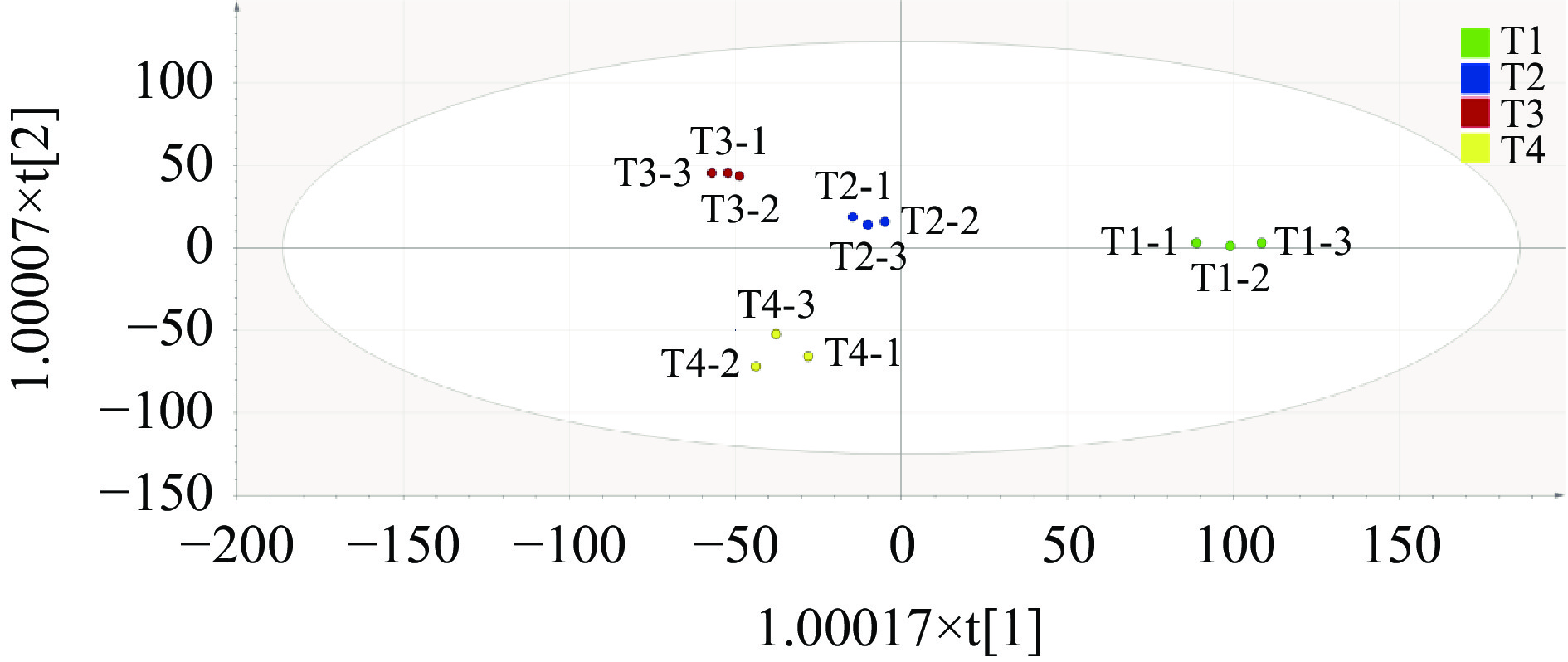
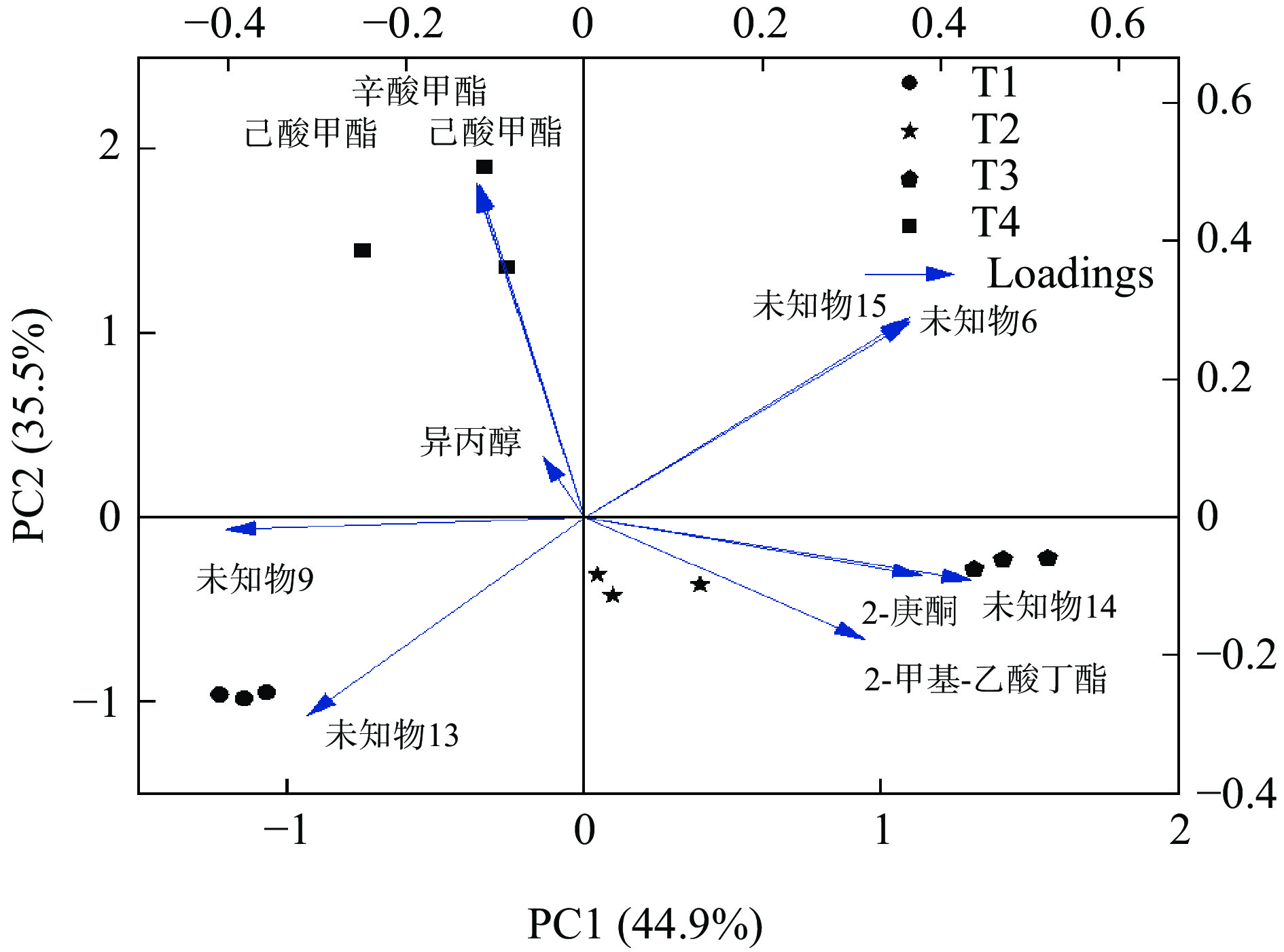
PCA分析可以简化实验数据,并通过确定几个主成分因子来代表原始样本中许多复杂且难以找到的变量,然后根据不同样本中主成分因子的贡献率来评估样本之间的规律性和差异[29-31]。通常,累计贡献率达到60%及以上时,证明该模型可被选作分离模型[32]。本研究采用PCA分析了不同产地芋头的VOCs差异。如图3所示,累积贡献率达84.1%,其中第一主成分(PC1)贡献率58.0%,第二主成分(PC2)贡献率26.1%。由图3可知,不同产地芋头样品在前2个PC有明显的分离趋势。沙沟芋头位于PC1正向,其他产地的芋头位于PC1反向,故沙沟芋头可以根据PC1与其他样品得以区分。荔浦芋头位于PC2正向,靖江香沙芋和奉化芋头位于PC2反向,因此,荔浦芋头根据PC2可与其他组样品明显区别。靖江香沙芋和奉化芋头均位于PC1和PC2的反向,说明这两个产地样品在风味物质组成上差别不大。由图4可知,OPLS-DA分析与PCA分析的结果基本一致,不同产地芋头可以分为3个组别,即组1为T1、组2为T2和T3、组3为T4。综上,HS-GC-IMS技术能够成功区别不同产地芋头的挥发性物质。
基于HS-GC-IMS的挥发性风味特征分析,结合OPLS-DA模型,在同时满足VIP>1.0和P<0.05条件下,筛选样品中差异挥发性风味化合物。如表3所示,共筛选出差异风味物质10个,其中已知化合物有5个,包括己酸甲酯、异丙醇、辛酸甲酯、2-甲基-乙酸丁酯和2-庚酮,这些化合物赋予芋头典型的果香味、奶酪味和蜡质味。根据筛选出的差异挥发性物质,绘制出不同产地芋头的PCA载荷图(图5)。前两个PC的累积贡献率为80.4%,其中,异丙醇、辛酸甲酯和己酸甲酯位于PC1反向和PC2正向,与荔浦芋头的相关性较高;2-庚酮和2-甲基-乙酸丁酯位于PC1正向和PC2反向,与靖江香沙芋和奉化芋头的相关性较高。因此,异丙醇、辛酸甲酯和己酸甲酯可作为荔浦芋头的特征标记物,2-庚酮和2-甲基-乙酸丁酯可作为靖江香沙芋和奉化芋头的特征标记物。
表 3 不同产地芋头中差异挥发性化合物Table 3. Volatile differential compounds in taro from different origins序号 化合物名称 CAS# VIP 香气描述a 1 未知物13 − 2.754 2 己酸甲酯-M C106-70-7 2.631 果香味 3 异丙醇 C67-63-0 2.147 酒味 4 未知物6 − 1.992 5 辛酸甲酯 C111-11-5 1.659 蜡质味 6 未知物14 − 1.586 7 未知物15 − 1.570 2' 己酸甲酯-D C106-70-7 1.506 果香味 8 2-甲基-乙酸丁酯 C624-41-9 1.173 果香味 9 未知物9 − 1.160 10 2-庚酮 C110-43-0 1.070 奶酪味 注:“−”表示无,a表示香气描述参考http://www.thegoodscentscompany.com/search2.html。 3. 结论
本文首次采用HS-GC-IMS技术结合化学计量学方法对沙沟芋头、靖江香沙芋、奉化芋头和荔浦芋头4个产地样品挥发性有机化合物进行分析,构建了芋头样品的风味指纹图谱。共检测到45个信号峰,鉴定出26种化合物。其中,酯类11种、醛类5种、烯类5种、醇类3种和酮类2种。根据样品风味物质的出峰情况,通过PCA分析,不同产地芋头能够明显区分。在VIP>1.0和P<0.05条件下,共筛选出10种差异挥发性化合物,而已知化合物有5种。进一步确定了异丙醇、辛酸甲酯和己酸甲酯是荔浦芋头的特征标记物,2-庚酮和2-甲基-乙酸丁酯是靖江香沙芋和奉化芋头的特征标记物。但是,GC-IMS不能得到挥发性化合物的具体含量,也有几种未知物有待确定。为此,后续将借助其他风味检测分析技术,更为全面的阐明地理来源对芋头品质的影响,为地理标志性农产品的产地溯源提供一定的指导。
-
表 1 芋头产地基本信息
Table 1 Basic information of taro origins
编号 取样地点 样品名称 T1-1 临沂市罗庄区白沙沟村 沙沟芋头 T1-2 临沂市罗庄区唐沙沟村 T1-3 临沂市罗庄区郑旺村 T2-1 靖江市斜桥镇 靖江香沙芋 T2-2 靖江市孤山镇 T2-3 靖江市西来镇 T3-1 宁波市奉化区溪口镇 奉化芋头 T3-2 宁波市奉化区尚田镇 T3-3 宁波市奉化区萧王庙镇 T4-1 荔浦市青山镇 荔浦芋头 T4-2 荔浦市修仁镇 T4-3 荔浦市新坪镇 表 2 HS-GC-IMS技术鉴定芋头样品中挥发性化合物
Table 2 Volatile compounds identified in taro samples by HS-GC-IMS technology
序号 中文名称 英文名称 CAS# 分子式 MW RI RT DT 备注 1 辛酸甲酯 Methyl octanoate C111-11-5 C9H18O2 158.2 1140.5 553.003 1.429 2 己酸甲酯 Methyl hexanoate C106-70-7 C7H14O2 130.2 924 284.075 1.284 M 3 己酸甲酯 Methyl hexanoate C106-70-7 C7H14O2 130.2 923.4 283.565 1.682 D 4 2-甲基-丁酸乙酯 ethyl 2-methylbutyrate C7452-79-1 C7H14O2 130.2 843.4 230.764 1.229 5 2-甲基-丁酸甲酯 methyl 2-methylbutanoate C868-57-5 C6H12O2 116.2 771.7 193.990 1.186 M 6 2-甲基-丁酸甲酯 methyl 2-methylbutanoate C868-57-5 C6H12O2 116.2 768.3 192.608 1.538 D 7 丙酸异丙酯 iso-Propyl propanoate C637-78-5 C6H12O2 116.2 749.9 185.142 1.185 8 丁酸甲酯 Butanoic acid methyl ester C623-42-7 C5H10O2 102.1 717.2 171.871 1.432 9 异丁酸甲酯 methyl 2-methylpropanoate C547-63-7 C5H10O2 102.1 681.3 158.323 1.440 10 2-甲基-乙酸丁酯 Acetic acid, 2-methylbutyl ester C624-41-9 C7H14O2 130.2 880.5 250.671 1.311 M 11 2-甲基-乙酸丁酯 Acetic acid, 2-methylbutyl ester C624-41-9 C7H14O2 130.2 879.3 250.031 1.706 D 12 丁酸乙酯 Ethyl butyrate C105-54-4 C6H12O2 116.2 791.7 203.056 1.208 13 乙酸甲酯 Methyl acetate C79-20-9 C3H6O2 74.1 522.7 115.562 1.035 14 甲酸乙酯 Ethyl formate C109-94-4 C3H6O2 74.1 503.8 110.455 1.068 15 壬醛 Nonanal C124-19-6 C9H18O 142.2 1108.9 507.586 1.475 16 庚醛 Heptanal C111-71-7 C7H14O 114.2 902.5 265.704 1.326 17 己醛 Hexanal C66-25-1 C6H12O 100.2 793.8 204.220 1.254 18 2-甲基丁醛 2-methylbutanal C96-17-3 C5H10O 86.1 661.2 152.909 1.159 19 3-甲基丁醛 3-methylbutanal C590-86-3 C5H10O 86.1 651.4 150.270 1.170 20 α-松油烯 terpinolene C586-62-9 C10H16 136.2 1083.3 470.810 1.223 21 柠檬烯 Limonene C138-86-3 C10H16 136.2 1023.5 384.704 1.223 22 β-吡喃烯 1,2,6,6-tetramethylcyclohexa-1,3-diene C514-96-5 C10H16 136.2 993.6 343.427 1.222 23 (Z)-罗勒烯 Cis-Ocimene C3338-55-4 C10H16 136.2 1034.7 400.884 1.221 24 (E)-罗勒烯 (E)-Ocimene C3779-61-1 C10H16 136.2 1044.4 414.754 1.216 25 2-甲基-1-丁醇 2-methylbutan-1-ol C137-32-6 C5H12O 88.1 734.9 179.059 1.227 26 3-甲基-1-丁醇 3-methylbutan-1-ol C123-51-3 C5H12O 88.1 730.1 177.124 1.241 27 异丙醇 Isopropyl alcohol C67-63-0 C3H8O 60.1 505 110.775 1.092 M 28 异丙醇 Isopropyl alcohol C67-63-0 C3H8O 60.1 506.2 111.094 1.217 D 29 2-庚酮 2-Heptanone C110-43-0 C7H14O 114.2 897.2 261.183 1.263 30 2-己酮 2-Hexanone C591-78-6 C6H12O 100.2 796.9 205.854 1.185 31 未知物1 unidentified − − − 1024.8 386.645 1.356 32 未知物2 unidentified − − − 1066.4 446.399 1.287 33 未知物3 unidentified − − − 779.2 197.031 1.090 34 未知物4 unidentified − − − 695.5 163.098 1.102 35 未知物5 unidentified − − − 739 180.721 1.519 36 未知物6 unidentified − − − 601.4 136.759 1.221 37 未知物7 unidentified − − − 610.6 139.247 1.567 38 未知物8 unidentified − − − 589 133.441 1.591 39 未知物9 unidentified − − − 611.6 139.524 1.290 40 未知物10 unidentified − − − 576.7 130.123 1.139 41 未知物11 unidentified − − − 500.3 109.498 1.169 42 未知物12 unidentified − − − 520.4 114.924 1.266 43 未知物13 unidentified − − − 599.7 136.309 1.321 44 未知物14 unidentified − − − 742 181.951 0.961 45 未知物15 unidentified − − − 604.8 137.705 0.948 注:MW表示化合物分子量;RI表示保留指数;RT表示保留时间(s);DT表示漂移时间(ms);M表示化合物单体;D表示化合物的二聚体。 表 3 不同产地芋头中差异挥发性化合物
Table 3 Volatile differential compounds in taro from different origins
序号 化合物名称 CAS# VIP 香气描述a 1 未知物13 − 2.754 2 己酸甲酯-M C106-70-7 2.631 果香味 3 异丙醇 C67-63-0 2.147 酒味 4 未知物6 − 1.992 5 辛酸甲酯 C111-11-5 1.659 蜡质味 6 未知物14 − 1.586 7 未知物15 − 1.570 2' 己酸甲酯-D C106-70-7 1.506 果香味 8 2-甲基-乙酸丁酯 C624-41-9 1.173 果香味 9 未知物9 − 1.160 10 2-庚酮 C110-43-0 1.070 奶酪味 注:“−”表示无,a表示香气描述参考http://www.thegoodscentscompany.com/search2.html。 -
[1] GONCALVES R, SILVA A, SILVA A, et al. Influence of taro (Colocasia esculenta L. Shott) growth conditions on the phenolic composition and biological properties[J]. Food Chemistry,2013,141(4):3480−3485. doi: 10.1016/j.foodchem.2013.06.009
[2] CHAND N, SUTHAR S, KUMAR K, et al. Enhanced removal of nutrients and coliforms from domestic wastewater in cattle dung biochar-packed Colocasia esculenta-based vertical subsurface flow constructed wetland[J]. Journal of Water Process Engineering,2021,41:101994. doi: 10.1016/j.jwpe.2021.101994
[3] KRISTL J, SEM V, MERGEDUS A, et al. Variation in oxalate content among corm parts, harvest time, and cultivars of taro (Colocasia esculenta (L.) Schott)[J]. Journal of Food Composition and Analysis,2021,102(1):104001.
[4] MITHARWAL S, KUMAR A, CHAUHAN K, et al. Nutritional, phytochemical composition and potential health benefits of taro (Colocasia esculenta L.) leaves: A review[J]. Food Chemistry,2022,383:132406. doi: 10.1016/j.foodchem.2022.132406
[5] GOUVEIA C, GANANCA J, LEBOT V, et al. Quantitation of oxalates in corms and shoots of Colocasia esculenta (L.) Schott under drought conditions[J]. Acta Physiologiae Plantarum,2018,40(12):214. doi: 10.1007/s11738-018-2784-7
[6] WANG X, YANG S, HE J, et al. A green triple-locked strategy based on volatile-compound imaging, chemometrics, and markers to discriminate winter honey and sapium honey using headspace gas chromatography-ion mobility spectrometry[J]. Food Research International,2019,119:960−967. doi: 10.1016/j.foodres.2019.01.004
[7] 杨智鹏, 赵文, 魏喜喜, 等. 基于气相离子迁移谱的不同产地枣果挥发性有机物指纹图谱分析[J/OL]. 食品科学: 1−14[2023-03-02]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220715.1009.014.html YANG Zhipeng, ZHAO Wen, WEI Xixi, et al. Fingerprint analysis of volatile organic compounds in Jujube from different geographical origins by gas chromatography-ion mobility spectrometry[J]. Food Science: 1−14[2023-03-02]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220715.1009.014.html.
[8] 李军山, 高晗, 张浩. 气相离子迁移谱结合化学计量法快速鉴别不同产地连翘[J]. 中国民族民间医药,2021,30(12):47−50,88. [LI Junshan, GAO Han, ZHANG Hao. Identification of Forsythiae fructus from different origins by GC-IMS with chemometrics methods[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2021,30(12):47−50,88. [9] 刘振平, 聂青玉, 庞钶靖, 等. 气相离子迁移谱技术鉴别重庆三峡库区特色中蜂蜜研究[J]. 食品与发酵工业,2021,47(22):273−278. [LIU Zhenping, NIE Qingyu, PANG Kejing, et al. Study on the identification of specialty honey of Apis cerana from the three Gorges Reservoir area of Chongqing based on gas chromatography-ion mobility spectrometry[J]. Food and Fermentation Industries,2021,47(22):273−278. doi: 10.13995/j.cnki.11-1802/ts.027151 [10] 郭家刚, 杨松, 丁思年, 等. 基于气相离子迁移谱的不同产地生姜挥发性有机物指纹图谱分析[J]. 食品科学,2021,42(24):236−241. [GUO Jiagang, YANG Song, DING Sinian, et al. Fingerprint analysis of volatile organic compounds in Ginger rhizomes from different geographical origins by gas chromatography-ion mobility spectrometry[J]. Food Science,2021,42(24):236−241. [11] YU H, GUO W, XIE T, et al. Aroma characteristics of traditional Huangjiu produced around Winter Solstice revealed by sensory evaluation, gas chromatography-mass spectrometry and gas chromatography-ion mobility spectrometry[J]. Food Research International,2021,145:110421. doi: 10.1016/j.foodres.2021.110421
[12] XIN A, TANG X, DONG G, et al. Quality assessment of fermented rose jams based on physicochemical properties, HS-GC-MS and HS-GC-IMS[J]. LWT-Food Science and Technology,2021,151:112153. doi: 10.1016/j.lwt.2021.112153
[13] WANG S, CHEN H, SUN B. Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry (GC-IMS)[J]. Food Chemistry,2020,315:126158. doi: 10.1016/j.foodchem.2019.126158
[14] SONG J, SHAO Y, YAN Y, et al. Characterization of volatile profiles of three colored quinoas based on GC-IMS and PCA[J]. LWT-Food Science and Technology,2021,146:111292. doi: 10.1016/j.lwt.2021.111292
[15] DUAN Z, DONG S, DONG Y, et al. Geographical origin identification of two salmonid species via flavor compound analysis using headspace-gas chromatography-ion mobility spectrometry combined with electronic nose and tongue[J]. Food Research International,2021,145:110385. doi: 10.1016/j.foodres.2021.110385
[16] GERHARDT N, BIRKENMEIER M, SCHWOLOW S, et al. Volatile compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS) as a benchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J]. Analytical Chemistry,2018,90(3):1777−1785. doi: 10.1021/acs.analchem.7b03748
[17] FENG X, WANG H, WANG Z, et al. Discrimination and characterization of the volatile organic compounds in eight kinds of huajiao with geographical indication of China using electronic nose, HS-GC-IMS and HS-SPME-GC-MS[J]. Food Chemistry,2022,375:131671. doi: 10.1016/j.foodchem.2021.131671
[18] GERHARDT N, SCHWOLOW S, ROHN S, et al. Quality assessment of olive oils based on temperature-ramped HS-GC-IMS and sensory evaluation: Comparison of different processing approaches by LDA, kNN, and SVM[J]. Food Chemistry,2019,278:720−728. doi: 10.1016/j.foodchem.2018.11.095
[19] TIAN X, LI Z, CHAO Y, et al. Evaluation by electronic tongue and headspace-GC-IMS analyses of the flavor compounds in dry-cured pork with different salt content[J]. Food Research International,2020,137:109456. doi: 10.1016/j.foodres.2020.109456
[20] LIU J, YANG J, JIANG C, et al. Volatile organic compound and endogenous phytohormone characteristics during callus browning in Aquilaria sinensis[J]. Industrial Crops and Products,2021,168:113605. doi: 10.1016/j.indcrop.2021.113605
[21] SUN X, GU D, FU Q, et al. Content variations in compositions and volatile component in jujube fruits during the blacking process[J]. Food Science and Nutrition,2019,7(4):1387−1395. doi: 10.1002/fsn3.973
[22] JAROS D, THAMKE I, RADDATZ H, et al. Single-cultivar cloudy juice made from table apples: An attempt to identify the driving force for sensory preference[J]. European Food Research and Technology,2009,229(1):51−61. doi: 10.1007/s00217-009-1025-0
[23] QIN Z, PETERSEN M, BREDIE W. Flavor profiling of apple ciders from the UK and Scandinavian region[J]. Food Research International,2018,105:713−723. doi: 10.1016/j.foodres.2017.12.003
[24] DI CAGNO R, FILANNINO P, GOBBETTI M. Lactic acid fermentation drives the optimal volatile flavor-aroma profile of pomegranate juice[J]. International Journal of Food Microbiology,2017,248:56−62. doi: 10.1016/j.ijfoodmicro.2017.02.014
[25] YUAN B, ZHAO C, YAN M, et al. Influence of gene regulation on rice quality: Impact of storage temperature and humidity on flavor profile[J]. Food Chemistry,2019,283:141−147. doi: 10.1016/j.foodchem.2019.01.042
[26] MARUSIC RADOVCIC N, VIDACEK S, JANCI T, et al. Characterization of volatile compounds, physico-chemical and sensory characteristics of smoked dry-cured ham[J]. Journal of Food Science and Technology,2016,53:4093−4105. doi: 10.1007/s13197-016-2418-2
[27] LAAKSONEN O, KULDJARV R, PAALME T, et al. Impact of apple cultivar, ripening stage, fermentation type and yeast strain on phenolic composition of apple ciders[J]. Food Chemistry,2017,233:29−37. doi: 10.1016/j.foodchem.2017.04.067
[28] CHEN C, LU Y, YU H, et al. Influence of 4 lactic acid bacteria on the flavor profile of fermented apple juice[J]. Food Bioscience,2018,27:30−36.
[29] LI M, YANG R, ZHANG H, et al. Development of a flavor fingerprint by HS-GC-IMS with PCA for volatile compounds of Tricholoma matsutake Singer[J]. Food Chemistry,2019,290:32−39. doi: 10.1016/j.foodchem.2019.03.124
[30] LI X, SUN Y, WANG X, et al. Relationship between key environmental factors and profiling of volatile compounds during cucumber fruit development under protected cultivation[J]. Food Chemistry,2019,290:308−315. doi: 10.1016/j.foodchem.2019.03.140
[31] YANG L, LIU J, WANG X, et al. Characterization of volatile component changes in Jujube fruits during cold storage by ising headspace-gas chromatography-ion mobility spectrometry[J]. Molecules,2019,24:3904. doi: 10.3390/molecules24213904
[32] WU Z, CHEN L, WU L, et al. Classification of Chinese honeys according to their floral origins using elemental and stable isotopic compositions[J]. Journal of Agricultural and Food Chemistry,2015,63(22):5388−5394. doi: 10.1021/acs.jafc.5b01576
-
期刊类型引用(2)
1. 庞钶靖,刘振平,张学健,甘芳瑗,姜容,龙道崎. 气相色谱-离子迁移谱技术在动植物源食品产地溯源中的应用. 食品安全质量检测学报. 2025(01): 1-7 .  百度学术
百度学术
2. 田芸,孙海燕,朱旋,郝丹青,秦公伟,党娅. 基于气相离子迁移色谱分析不同贮藏时期蓝莓的挥发性化合物变化. 食品研究与开发. 2024(24): 168-175 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



