The Effects of Lactic Acid Bacteria Fermentation on Protein Gelation and Gastrointestinal Digestive Characteristics from Four Pulses
-
摘要: 本研究对乳酸菌发酵的四种杂豆蛋白凝胶及消化特性进行研究,分别从鹰嘴豆、红芸豆、小扁豆、豌豆四种杂豆中进行蛋白提取,命名为CP、RKP、LP、PP。采用植物乳杆菌B1-6对制备的四种杂豆蛋白进行发酵,对发酵形成的杂豆蛋白凝胶最小凝胶浓度、质构特性、微观结构和色泽等进行了比较研究。将四种杂豆蛋白凝胶进行动态模拟胃肠道消化,对不同杂豆蛋白凝胶消化特性及对乳酸菌的保护作用进行了研究。结果表明:CP、RKP、LP、PP在乳酸菌作用下的最小临界凝胶浓度(LGC)分别为1.6%(w/v)、1.6%(w/v)、1.4%(w/v)和1.2%(w/v);CP与LP凝胶硬度显著高于RKP与PP凝胶(P<0.05),且形成的凝胶具有致密而均匀的三维蛋白凝胶网络,而RKP与PP形成的凝胶微观结构较为疏松。采用动态模拟胃肠道消化模型对具有不同结构特征的四种杂豆蛋白凝胶进行消化特性评估,CP和LP在消化早、中期的可溶性蛋白和肽含量显著高于另两组蛋白凝胶(RKP和PP),且CP和LP凝胶对植物乳杆菌B1-6的保护作用显著优于另两组蛋白凝胶。研究结果表明四种杂豆蛋白在乳酸菌发酵作用下表现出差异性胶凝能力及消化特性,为明确不同杂豆蛋白在乳酸菌作用下的发酵性能、凝胶特性及营养特性提供参考依据。
-
关键词:
- 杂豆 /
- 发酵 /
- 凝胶特性 /
- 体外动态模拟胃肠道消化 /
- 消化特性
Abstract: The current study investigated the effects of lactic acid bacteria fermentation on the protein gelation and digestive characteristics from four pulses, namely, chickpea, red kidney bean, lentil and pea. Protein extracted from the four pulses was named CP, RKP, LP and PP. Protein gels were prepared by using Lactobacillus plantarum B1-6, and the least gelation concentration (LGC), texture characteristics, microstructure, and color were investigated. The gels were subsequently subjected to an in vitro dynamic gastrointestinal digestion, and the protein digestive characteristics and the protective effect on vitality of lactic acid bacteria were studied. The results showed that the LGC of CP, RKP, LP and PP gels was 1.6% (w/v), 1.6% (w/v), 1.4% (w/v) and 1.2% (w/v), respectively. The hardness of CP and LP gels was significantly higher than that of RKP and PP gels (P<0.05), and the gels formed by CP and LP demonstrated a relatively dense and uniform three-dimensional protein gel network, whereas the microstructure of gels formed by RKP and PP was relatively loose. The results obtained from the gastrointestinal study showing the CP and LP gels demonstrated a significantly higher protective effect on Lactobacillus plantarum B1-6 vitality compared with RKP and PP gels. The two gels (CP and LP) also gave higher soluble protein and peptide contents at the early and medium stages of gastrointestinal digestion. The results showed that the four pulse proteins exhibited different gelling capacities and digestibility characteristics during lactic acid bacterial fermentation. This study provided valuable information on the effects of lactic acid bacterial fermentation on fermentation performance, gelation property, and nutritional characteristics of different pulse proteins. -
近年来,随着植物基酸奶市场的飞速发展以及消费者对健康消费理念的升级,植物基酸奶已成为研究者关注的热点问题。植物基酸奶是以豆类、坚果类、谷物类或其他富含蛋白质的植物为原料,经发酵作用而形成的具有低饱和脂肪酸,不含胆固醇和反式脂肪酸等特点的植物基食品[1]。由于植物基蛋白与牛乳蛋白结构与特性的差异,导致以植物蛋白为原料的发酵酸奶存在口感粗糙、粉感严重以及豆腥味重等问题[2]。目前,国内外市场上销售的植物基酸奶的基底多以大豆为主[3],而以杂豆为基底的植物基酸奶市场占比较少。
据联合国粮食及农业组织(FAO)数据显示,2020年世界杂豆生产总值达370118.7万美元,我国的杂豆生产总值达2148.3万美元,我国为世界少数几个杂豆资源非常丰富的国家之一。其中,芸豆、鹰嘴豆、豌豆和小扁豆分别为世界产量第一、第二、第三和第六[4]的杂豆类。杂豆蛋白含量较高,鹰嘴豆、红芸豆、小扁豆和豌豆蛋白含量为23%~30%,且组成较为均衡,研究表明,鹰嘴豆蛋白所含必需氨基酸齐全,易消化[5],为优质植物蛋白;此外,研究表明一些杂豆蛋白具有独特的生理功能,如红芸豆蛋白产生的肽段具有较高的抗氧化活性和免疫调节[6]等功能;小扁豆蛋白具有预防心血管疾病和降低胆固醇[7]等生理功能;豌豆蛋白产生的多肽具有抗氧化[8]、抗癌防癌、抗菌消炎和增强机体免疫力等生理功能。因此,四种杂豆蛋白是营养、功能价值较高的优质植物蛋白源,在植物基酸奶的应用中具有广阔的市场前景。
蛋白凝胶是决定酸奶品质的重要因素。乳酸菌发酵诱导蛋白凝胶是典型的酸诱导凝胶。乳酸菌在发酵过程中pH降低,促使经适当热前处理的蛋白质分子在接近等电点时分子间静电斥力减弱,从而形成有序的三维凝胶结构,这在牛乳和大豆中已有较多相关报道[9-10]。然而,不同植物基来源的蛋白由于其自身特性的差异,在乳酸菌发酵作用下形成的凝胶能力可能不同,凝胶结构与质构特性可能存在差异,继而影响植物基酸奶的感官品质。关于杂豆蛋白在乳酸菌作用下的凝胶特性的相关报道较少,Boeck等[11]研究指出小扁豆蛋白在乳酸菌发酵作用下可形成凝胶,且质构和流变学特性结果表明其结构与酸牛乳凝胶类似,该作者指出,小扁豆蛋白在其他发酵乳制品替代品中显示出很高的应用潜力。而截止目前,鹰嘴豆、红芸豆、豌豆尚未有相关研究报道。
食品基质(Food Matrix)是影响营养素分子释放与吸收的重要因素。研究表明,蛋白凝胶结构的差异性将进一步引发蛋白质分子在胃肠道消化过程中重排,导致差异性的分子释放及降解模式,最终影响其营养价值[12]。发酵牛乳凝胶结构状态与蛋白质分子的消化特性已得到较为充分的研究[13]。然而,杂豆蛋白在该领域的研究尚属空白。本研究主要探究乳酸菌对鹰嘴豆、豌豆、红芸豆、小扁豆这四种杂豆蛋白的凝胶形成、凝胶特性、微观结构、体外动态胃肠道消化中的消化行为的影响及蛋白凝胶对乳酸菌的保护作用,以期为植物基酸奶发酵底物的选择和发挥益生作用等方面提供理论依据。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌B1-6(Lactobacillus plantarum B1-6) 来源于新疆传统发酵饮品BOZA,保藏于南京农业大学食品科技学院微生物实验室。该菌株通过16S rDNA序列鉴定,基因加入号KM200717;样品 采购自江苏省南京市玄武区苏果超市,选取自带包装、成熟干燥且来自不同产地的杂豆4种,于20 ℃条件下储藏。四种杂豆为鹰嘴豆(品种:卡布里;产地:新疆)、红芸豆(品种:英国大红;产地:辽宁)、小扁豆(品种:04鉴1;产地:甘肃)和豌豆(品种:中豌6号;产地:山东);α-淀粉酶(来自人类唾液,A1031,1500 U/mg)、胃蛋白酶(来自猪胃粘膜,P7125,400 U/mg)、胰酶(来自猪胰腺,p7545,200 U/mg)、胆汁盐(来自猪,B8631) 美国Sigma-Aldrich公司;MRS培养基 青岛海博生化科技有限公司;正戊烷 色谱纯,上海沃凯试剂公司;甲醇 色谱纯,美国Tedia试剂公司;考马斯亮蓝G250、十二烷基硫酸钠、邻苯二甲醛(o-phthaldialdehyde,OPA) 分析纯,南京寿德试剂公司;牛血清白蛋白 分析纯,上海源叶生物公司;胰酪蛋白胨 分析纯,美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
LRH-150型生化培养箱 上海一恒科学仪器有限公司;SU8010型冷冻电子显微镜 日本东京日立公司;64RL型高速冷冻离心机 美国Beckman公司;TLP型质构分析仪 美国Food Technology公司;CR-400型色差仪 英国Norma Lab公司;Bionic Rat Model II+型机械小鼠模型 江苏省南通东概念新材料科技有限公司。
1.2 实验方法
1.2.1 杂豆蛋白提取
鹰嘴豆蛋白的提取参照安馨等[14]的方法,红芸豆蛋白的提取参考梁珊等[15]的方法,小扁豆蛋白的提取参考聂丽洁[16]的方法,豌豆蛋白的提取参考秦高一鑫等[17]的方法。
1.2.1.1 脱脂
杂豆粉碎过筛(100目标准筛)。称取100 g杂豆粉置于1 L三角瓶中,用500 mL正己烷混溶,放入搅拌机(180 r/min,20 ℃)搅拌60 min,取沉淀倒回三角瓶,加正己烷重复3次,最后取沉淀,用平板晾晒一晚后收集。
1.2.1.2 杂豆蛋白提取工艺
脱脂豆粉用水按1:10(50 g脱脂豆粉:500 mL纯水)的比例混合均匀,调节溶液pH,室温下搅拌提取,后离心弃沉淀,调节上清液pH至等电点后离心,收集沉淀冷冻干燥得到四种杂豆蛋白。
提取参数:鹰嘴豆调节溶液pH至10.0,搅拌提取80 min(180 r/min),离心20 min(3500 r/min,4 ℃),调至等电点pI值4.5,离心10 min(4000 r/min,4 ℃);红芸豆调节溶液pH至9.0,搅拌提取120 min(180 r/min),离心30 min(3500 r/min,4 ℃),调至等电点pI值4.5,离心20 min(4000 r/min,4 ℃);小扁豆调节溶液pH至9.0,搅拌提取90 min(180 r/min),离心20 min(3800 r/min,4 ℃),调至等电点pI值4.6,离心15 min(3800 r/min,4 ℃);豌豆调节溶液pH至9.0,搅拌提取120 min(180 r/min),离心10 min(4000 r/min,4 ℃),调至等电点pI值4.2,离心10 min(4000 r/min,4 ℃)。获取的鹰嘴豆蛋白、红芸豆蛋白、小扁豆蛋白和豌豆蛋白分别被简称为CP、RKP、LP和PP。
1.2.1.3 杂豆蛋白主要成分的测定
水分含量测定:采用GB 5009.3-2016《食品中水分的测定》的直接干燥法;灰分含量测定:采用GB 5009.4-2016《食品中灰分的测定》的灼烧法;总蛋白含量测定:采用GB 5009.5-2016《食品中蛋白质的测定》的凯氏定氮法;粗脂肪含量测定:采用GB 5009.6-2016《食品中脂肪的测定》的索氏抽提法;碳水化合物含量测定:采用GB/Z 21922-2008《食品营养成分基本术语》的减法计算。
1.2.2 乳酸菌发酵制备杂豆蛋白凝胶
1.2.2.1 菌种活化
菌种活化按照Blana等[18]的方法。将植物乳杆菌B1-6接种于MRS液体培养基中,于37 ℃培养箱中进行活化培养。两次连续培养后,将发酵液离心30 s(10000 r/min,20 ℃),在菌体沉淀中加入等体积生理盐水(0.85%,m/v)以洗去培养基。清洗两次后加入等体积生理盐水混合均匀后备用。
1.2.2.2 杂豆蛋白凝胶的制备
采用去离子水分别配制终浓度在0.1%~3.0%(w/v)的四种杂豆蛋白溶液,杂豆蛋白溶液浓度的选择参考Rui等[19]的方法。调节pH至7.0,85 ℃灭菌10 min,加入过滤除菌的葡萄糖使其终浓度为2.0%(w/v),分别接种3.0%(v/v)的植物乳杆菌B1-6发酵种子液,置于37 ℃培养箱内发酵。
1.2.2.3 发酵速率的测定
参考Rui等[19]的方法,乳酸菌发酵速率以乳酸菌在杂豆蛋白体系发酵产酸致pH降低所需的时间进行计量,具体计算公式如下:
v=ΔpHt 式中:v表示乳酸菌发酵速率,1/h;ΔpH表示发酵杂豆蛋白pH降低值;t表示pH降低所需的发酵时间,h。
1.2.3 发酵杂豆蛋白凝胶特性研究
1.2.3.1 最小临界凝胶浓度的研究
根据Guldiken等[20]的方法对四种杂豆蛋白的凝胶形成能力进行分析。在平底玻璃管内监测杂豆蛋白凝胶的直观图像。在发酵pH7.0、6.5、6.0、5.5、5.0、4.5时将各蛋白浓度样品倒置,当样品不流动时,表明凝胶形成,倒置后样品有少许流动时表明弱凝胶形成。临界凝胶浓度(LGC)为将平底玻璃管倒置后,样品能够形成倒置不流动凝胶的最小蛋白浓度,低于此浓度不能形成自支撑凝胶。样品的pH由pH计测量。
1.2.3.2 质构特性
探明四种杂豆蛋白最小凝胶浓度后,采用蛋白浓度在2.0%(w/v)发酵杂豆蛋白凝胶样品,将其切为23 mm高×25 mm直径的圆柱体,使用TLP质构仪测定样品的硬度、弹性、内聚性和胶黏性,测定模式选用T.P.A模式,具体参数设置如下:探头型号选择p/50,选择探头直径50 mm的平头探头,前速度为1 mm/s测量时速度为5 mm/s,返回速度为5 mm/s,触发力为5 g,2次压缩中停顿时间设为5 s,探头移动距离为30%。
1.2.3.3 凝胶色差
采用CR-400色差仪测定,测量结果用亮度(L*)、红度(a*)和黄度(b*)表示。色差值(ΔE)的计算公式如下:
ΔE=√(L∗)2+(a∗)2+(b∗)2 1.2.3.4 微观结构
发酵杂豆蛋白凝胶样品的微观结构测定参考 Liu 等[21]的方法。采用日立 SU8010扫描电镜,配有冷冻固定装置。低温固定是将少量样品放置在样品专用槽上,通过超快速冷却技术将温度降至液氮(−196 ℃)或以下。将冷冻固定试样在真空条件下进行低温断裂,以观察其内部微观结构,电压为15 kV。
1.2.4 发酵杂豆蛋白凝胶胃肠道消化特性研究
1.2.4.1 动态模拟胃肠道消化
参考Pongmalai等[22]的方法,配制模拟胃液和模拟肠液并对体外模拟胃肠道消化模型的参数进行设置。模拟胃液(SGF):缓冲液KCl(6.9 mmol/L)、NaHCO3(25 mmol/L)、KH2PO4(0.9 mmol/L)、NaCl(47.2 mmol/L)、(NH4)2CO3(0.5 mmol/L)和MgCl2(H2O)6(0.1 mmol/L),用缓冲液配制胃蛋白酶(0.27 g/L)和粘蛋白(1.5 g/L),pH调至1.6,置于37 ℃水浴中20 min激发酶的活力。模拟肠液(SIF):缓冲液为KH2PO4(0.8 mmol/L)、KCl(6.8 mmol/L)、NaCl(38.4 mmol/L)、NaHCO3(85 mmol/L)和MgCl2(H2O)6(0.33 mmol/L),用缓冲液配制胰酶(5.62 g/L)和胆盐(8.17 g/L),pH调至7.0,置于37 ℃水浴中20 min激发酶的活力。
消化开始前,调节温度设置为37 ℃并提前预热。预热结束后,在胃中加入0.6 mL的SGF,再注入5 mL的样品。设置设备运行参数:模拟胃液、肠液注入速度52 µL/min;排空速度104 μL/min;胃挤压频率3 cpm,胃滚动频率12 cpm,肠滚动频率36 cpm,消化时间为3 h,在肠消化0、30、90及180 min分别取模拟消化样品。取样后用于乳酸菌活菌计数样品不经灭酶过程直接测定,用于可溶性蛋白、肽含量测定的样品置于沸水浴灭酶处理5 min后进行测定。
1.2.4.2 肽含量测定
参照吴寒等[23]的方法进行肽含量的检测。取不同消化时间的样品200 µL,加入等体积10%三氯乙酸(w/w),充分混匀后在20 ℃条件下静置沉淀4~5 h,离心15 min(5000 r/min,4 ℃)后收集上清液。取5 µL上清液,加入200 µL OPA反应试剂,室温下反应2 min,在340 nm波长下测定吸光值,以胰酪蛋白胨标准溶液绘制标准曲线,标曲方程为y=0.1885x+0.1516,R2=0.9981,计算肽含量(μg/mL)。
1.2.4.3 可溶性蛋白含量测定
参照李洋[24]的方法,采用考马斯亮蓝法(Bradford)进行可溶性蛋白含量测定。准确吸取1 mL样液与5 mL考马斯亮蓝染色液混匀,室温下反应5 min,在595 nm波长下测定吸光值。根据以牛血清白蛋白为标准做出的标准曲线,标曲方程为y=0.1429x+0.3075,R²=0.9922,计算可溶性蛋白含量(μg/mL)。
1.2.4.4 乳酸菌活菌计数
乳酸菌活菌数参照Feng等[25]的方法,采用平板计数法测定。具体方法是:吸取杂豆凝胶消化产物100与900 µL无菌生理盐水(0.85%,v/v)充分混合后梯度稀释至一定倍数,采用MRS琼脂培养基平板倾注法,在37 ℃条件下倒置培养48 h计菌落总数,测定乳酸菌活菌数。
1.3 数据处理
试验数据为3次重复试验结果的平均值,采用SPSS 22.0软件对数据进行ANOVA单因素方差分析,应用Duncan检测对结果进行显著性分析(P<0.05),采用Origin 8.5软件作图。
2. 结果与分析
2.1 四种杂豆蛋白提取物的主要成分分析
四种杂豆蛋白提取物的主要成分含量如表1所示。由表1可知,四种杂豆蛋白提取物蛋白质含量均达80%以上,其中,LP蛋白质含量最高,CP蛋白质含量最低,四种杂豆蛋白含量均具有显著差异性(P<0.05)。PP和RKP脂肪含量较高于CP与LP。四种杂豆蛋白中RKP碳水化合物含量最低,CP、LP和PP碳水化合物含量相似。CP灰分含量为5.81%,显著高于其他三种杂豆(P<0.05),RKP、LP与PP灰分含量无显著差异(P>0.05)。
表 1 四种杂豆蛋白提取物的主要成分含量Table 1. The content of main components of four pulse proteins2.2 四种杂豆蛋白种类及浓度对发酵速率的影响
四种杂豆蛋白种类及浓度对发酵速率的影响如表2所示。发酵导致四种杂豆蛋白的pH均呈下降趋势。由表2可知,下降速率随pH降低逐渐减缓。四种杂豆蛋白相比,蛋白浓度为0.1%(w/v)的RKP和PP样品发酵速率更快;蛋白浓度为1.0%~3.0%(w/v)的LP和RKP样品发酵速率更快,这说明低蛋白浓度的RKP和PP和高浓度的LP和RKP发酵性能更优异。此外,高浓度蛋白(2.0%~3.0%,w/v)条件下,pH下降速率减缓,蛋白浓度在3.0%(w/v)的CP、RKP和PP在pH5.5至4.5酸化速率变慢,而3.0%(w/v)的LP酸化速率无明显变化。说明LP的胶凝过程受蛋白浓度影响较小,而高浓度的CP、RKP和PP可以显著延缓植物乳杆菌的产酸速率(P<0.05),这可能与高浓度蛋白具有更强的缓冲作用有关[26]。四种杂豆蛋白发酵速率的差异与乳酸菌差异化利用杂豆蛋白作为生长所需氮源密切相关。四种杂豆蛋白的组成、结构、小分子肽含量均可能导致乳酸菌代谢变化,从而影响产酸速率。郭增旺等[27]发现球蛋白含量影响了芸豆蛋白的成胶速率。
表 2 杂豆蛋白种类及浓度对发酵速率的影响Table 2. Effects of four pulse proteins and concentrations on the fermentation rate蛋白浓度(%) 蛋白种类 v(1/h) pH7.0~6.5 pH6.5~6.0 pH6.0~5.5 pH5.5~5.0 pH5.0~4.5 0.1 CP 1.000±0.034bc 0.500±0.045c 0.353±0.022c 0.222±0.006d 0.122±0.003d RKP 3.000±0.785a 1.500±0.251a 0.545±0.021b 0.353±0.002b 0.222±0.010b LP 1.764±0.307b 0.857±0.083b 0.500±0.012b 0.273±0.011c 0.188±0.011c PP 2.000±0.142b 1.364±0.161a 0.667±0.054a 0.429±0.015a 0.250±0.021a 1.0 CP 0.316±0.009c 0.118±0.002c 0.069±0.010c 0.049±0.001c 0.033±0.000c RKP 1.500±0.166a 0.400±0.034a 0.171±0.006a 0.122±0.003a 0.085±0.001b LP 1.000±0.111b 0.250±0.013b 0.143±0.006b 0.115±0.003b 0.093±0.003a PP 0.429±0.021c 0.139±0.052c 0.052±0.005d 0.025±0.001d 0.022±0.000d 1.5 CP 0.323±0.012d 0.157±0.041b 0.073±0.001c 0.053±0.001c 0.036±0.001c RKP 0.750±0.016a 0.309±0.013a 0.170±0.005a 0.010±0.002a 0.049±0.001b LP 0.375±0.014c 0.166±0.062b 0.115±0.002b 0.095±0.002b 0.064±0.001a PP 0.405±0.022b 0.101±0.021c 0.035±0.001d 0.025±0.000d 0.018±0.000d 2.0 CP 0.280±0.010c 0.107±0.023c 0.061±0.001c 0.037±0.000c 0.025±0.000c RKP 0.500±0.017a 0.167±0.065a 0.125±0.004a 0.077±0.001b 0.049±0.001b LP 0.375±0.009b 0.151±0.072b 0.118±0.002b 0.083±0.001a 0.060±0.001a PP 0.240±0.011d 0.065±0.002d 0.026±0.001d 0.020±0.000d 0.015±0.000d 3.0 CP 0.172±0.004d 0.091±0.003c 0.048±0.001b 0.030±0.000c 0.021±0.001c RKP 0.375±0.071a 0.214±0.015a 0.111±0.005a 0.063±0.001b 0.030±0.000b LP 0.240±0.011c 0.143±0.007b 0.115±0.004a 0.088±0.003a 0.061±0.002a PP 0.300±0.014b 0.054±0.001d 0.022±0.001c 0.017±0.002d 0.012±0.000d 注:同列不同字母表示同一浓度、不同蛋白之间具有显著差异(P<0.05)。 2.3 最小临界凝胶浓度的测定
不同发酵时间及不同pH对四种杂豆蛋白成胶特性的影响如图1所示。CP、RKP、LP和PP的最小临界凝胶浓度(LGC)分别为1.6%(w/v)、1.6%(w/v)、1.4%(w/v)和1.2%(w/v),说明PP可以在较低的蛋白浓度下形成凝胶,其次为LP,而CP和RKP需要较高的浓度才可以形成凝胶。四种杂豆蛋白的LGC值均低于文献报道的乳酸菌诱导大豆蛋白形成凝胶的LGC值,说明四种杂豆蛋白具有良好的成胶特性[26]。
四种杂豆LGC值的差异可能与各杂豆蛋白组成及蛋白结构差异密切相关。安馨等[14, 16]研究表明杂豆蛋白中球、清蛋白含量均占80%以上,但其比例各不相同,如芸豆、鹰嘴豆、小扁豆球蛋白含量较高,而清蛋白含量较低;豌豆蛋白中球蛋白含量较低(56.6%±0.60%),清蛋白含量较高(34.0%±4.34%)。这可能是造成PP的LGC值较低的原因之一。此外,提高蛋白浓度促使杂豆蛋白在较高的pH条件下形成凝胶。当蛋白溶液浓度提升至2.0%(w/v)时,CP 和 LP 初始凝胶 pH 由 4.5 上升至 5.0,RKP 和 PP初始凝胶pH分别由4.5和5.0上升至5.5,这可能与四种杂豆蛋白中游离巯基等基团含量的差异有关,Yang等[28-29]研究指出PP和RKP的游离巯基含量高于LP和CP的游离巯基含量,且游离巯基含量可能与蛋白凝胶点呈正相关。
2.4 四种杂豆蛋白凝胶的质构特性分析
根据杂豆蛋白的最小凝胶浓度和发酵过程中pH下降规律,选取蛋白浓度在2.0%(w/v),发酵终点pH为5.0的四种杂豆蛋白凝胶做进一步研究。
四种杂豆蛋白凝胶的质构特性如表3所示。由表3可知,杂豆蛋白种类对凝胶弹性和胶粘性的影响差异不显著(P>0.05)。CP与LP蛋白凝胶的硬度显著高于RKP与PP(P<0.05),且LP蛋白凝胶的硬度显著高于CP(P<0.05),说明CP与LP的蛋白凝胶机械强度更高,特别是LP蛋白凝胶,而RKP与PP硬度较低。CP、PP和RKP蛋白凝胶的内聚性显著高于LP(P<0.05),说明LP蛋白凝胶内部结合力更小,这可能与四种杂豆蛋白组成差异有关。四种杂豆蛋白凝胶硬度和弹性值与文献报道的乳酸菌发酵大豆蛋白凝胶相比较低,说明杂豆蛋白形成的凝胶比较柔软,可能与LGC值较低有关[9]。
表 3 四种杂豆蛋白凝胶的质构特性Table 3. Textural properties of four pulses protein gels蛋白种类 硬度(g) 弹性(mm) 内聚性 胶黏性(N) CP 0.277±0.001b 0.510±0.028a 0.750±0.021ab 0.171±0.014a RKP 0.232±0.010c 0.590±0.169a 0.740±0.028b 0.181±0.014a LP 0.300±0.002a 0.570±0.099a 0.420±0.014c 0.174±0.001a PP 0.240±0.003c 0.480±0.056a 0.780±0.014a 0.127±0.057a 2.5 四种杂豆蛋白发酵前后的色差分析
凝胶的色泽是影响其外观和认可度的重要指标之一,其中L*代表亮度,a*为红度值,b*为黄度值,ΔE越大表示样品的颜色变化的程度越大。
四种杂豆蛋白发酵前后的色泽的变化如表4所示。由表4可知,发酵后四种杂豆蛋白的L*值均增大,说明四种杂豆蛋白发酵后凝胶亮度增加,其中,LP的亮度提升程度较高。这可能与凝胶的网络结构增大了光反射的程度有关[30]。有研究[31]证明孔隙更小的凝胶网络会导致反射光增强,因此亮度值更大。这与样品的微观结构相符。此外,CP、LP和PP的a*值均偏向绿色且b*值均偏向黄色,而RKP的a*值偏向红色且b*值偏向黄色。发酵没有改变四种杂豆蛋白的a*、b*值偏向,但改变了其偏向程度。发酵后CP、LP和PP蛋白的a*、b*绝对值增大,而RKP的a*、b*绝对值减小,说明发酵增加了CP、LP和PP的黄绿程度且降低RKP的红黄程度。从总色差(ΔE)的测定来看,发酵后四种杂豆蛋白凝胶样品的总色差均减小且总色差仍差异显著(P<0.05),其中,CP和LP样品降幅明显小于RKP和PP,说明LP和CP颜色变化程度更浅。这与计红芳等[32]研究报道豌豆蛋白与牛肉盐溶蛋白共混形成凝胶后样品亮度增大以及红度和黄度偏向加深相符。
表 4 四种杂豆蛋白发酵前后的色差分析Table 4. Chromatic aberration between the four pulse proteins before and after fermentation蛋白种类 L* a* b* ΔE 发酵前 CP 35.75±0.32a −2.33±0.07d 1.02±0.27ab 14.48±0.29d RKP 22.70±0.11d 0.42±0.10a 0.89±0.03b 27.32±0.11a LP 27.53±0.26b −0.98±0.04b 1.28±0.02a 22.53±0.26c PP 26.03±0.13c −1.80±0.05c 1.09±0.05ab 24.07±0.13b 发酵后 CP 44.37±0.08b −3.19±0.03c 2.40±0.10a 6.78±0.13c RKP 43.33±0.58c 0.31±0.06a 0.42±0.06c 13.79±0.57a LP 49.17±0.11a −2.11±0.01b 4.36±0.05a 9.06±0.09b PP 44.37±0.11b −3.19±0.03c 2.40±0.26b 6.78±0.11c 2.6 四种杂豆蛋白凝胶的微观结构分析
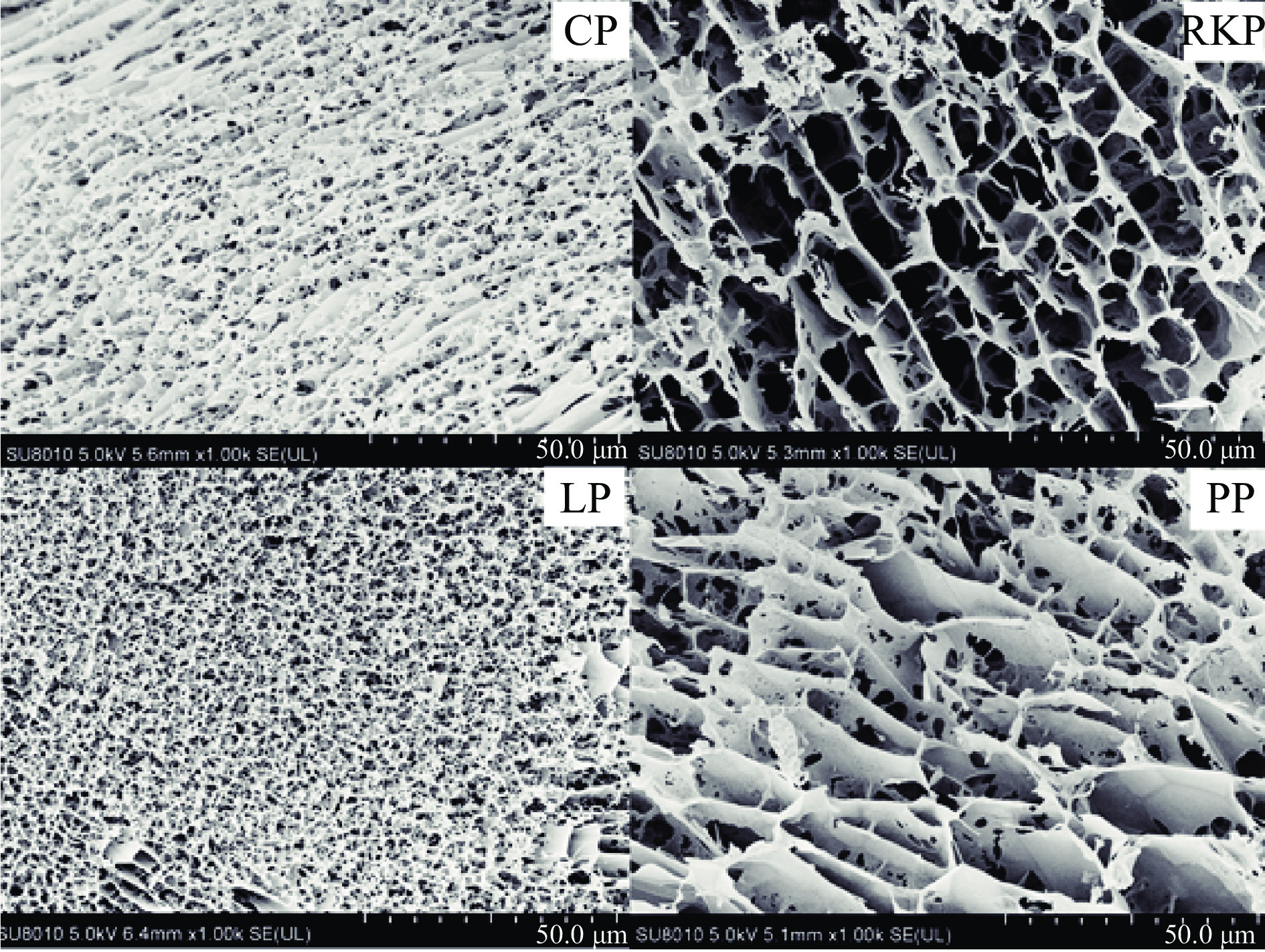
微观结构的表征是研究凝胶结构与特性的重要手段。四种杂豆蛋白凝胶的微观结构如图2所示。由图2可知,所有杂豆蛋白凝胶样品的微观结构都呈现网状多孔结构,且不同杂豆蛋白凝胶网络结构存在一定差异。RKP和PP样品均具有带非均质孔[33]和大量粗链的凝胶结构,其孔径约为20 μm。而CP和LP呈现出密集和精细的蛋白三维凝胶网络,其孔径约为2.5 μm。与LP相比,CP的三维凝胶网络含有大量粗链且网孔分布不均匀,LP形成一种无粗链结构、孔洞均匀的三维凝胶网络。聂丽洁[16]曾指出球蛋白含量更高的CP和LP蛋白凝胶结构更致密。Xing等[34]研究报道乳酸菌发酵的大豆生物豆腐中呈现类似的蜂窝状凝胶网络结构[35]。
2.7 杂豆蛋白凝胶对动态胃肠道消化的pH影响分析
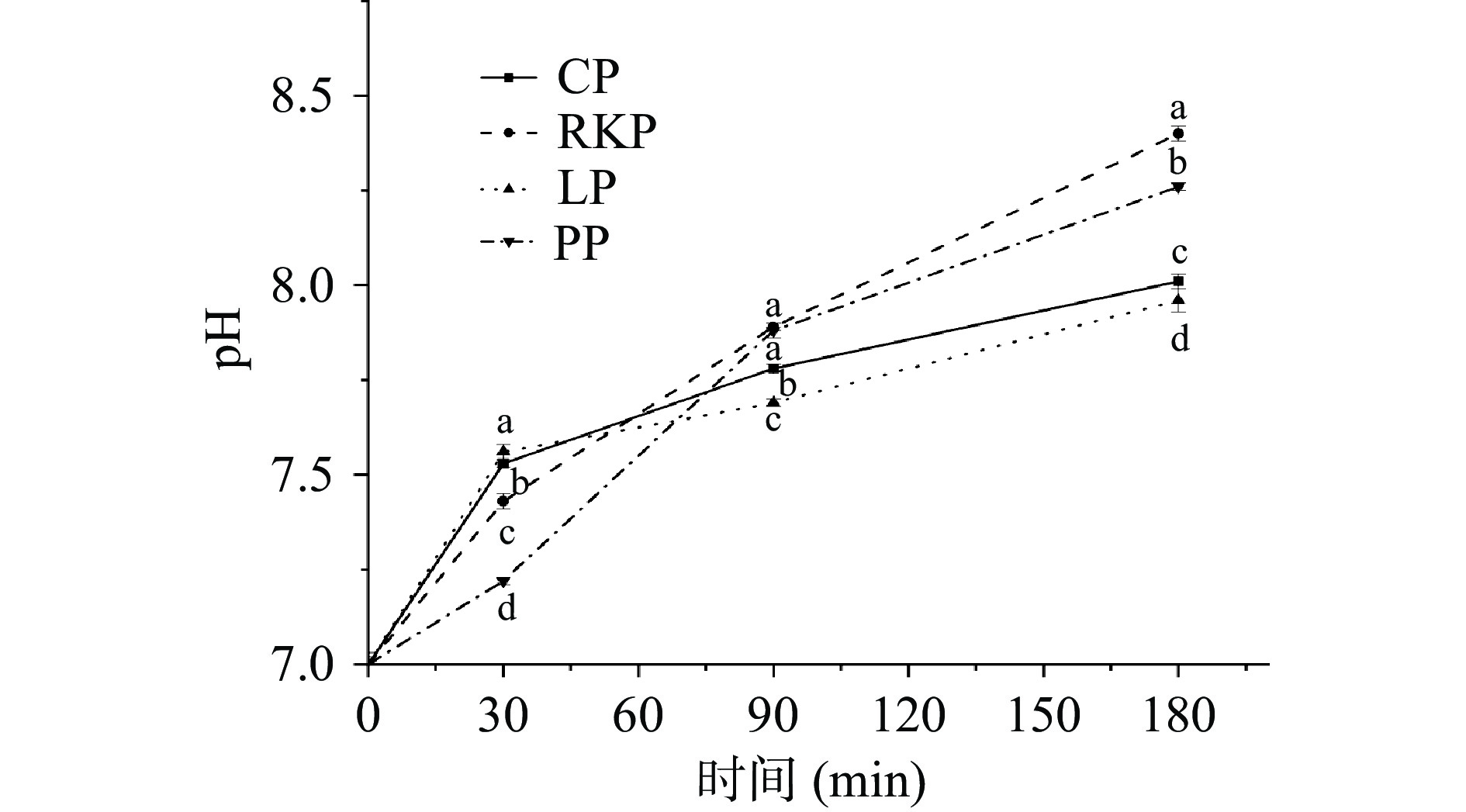
四种杂豆蛋白凝胶对胃肠道消化pH的影响如图3所示。杂豆蛋白凝胶中蛋白质等物质具有一定的缓冲作用。蛋白质结构的改变可能引起酶解特性[36]的变化。由图3可知,肠道消化的初始pH为7.0,在肠消化前期(0~30 min),LP的肠消化液的pH最高,PP的肠消化液pH最低,各样品间均存在显著差异(P<0.05),这可能与其胃肠转换速率及碱性氨基酸的释放有关[37]。在肠消化中期和后期(30~180 min),RKP与PP蛋白的肠消化液pH变化比CP与LP更剧烈,说明CP与LP蛋白对胃肠液的缓冲能力高于RKP与PP蛋白,这可能与致密的凝胶网络更耐受胃肠液的环境[38]有关。有研究表明杂豆蛋白中球蛋白在胃肠消化过程中缓冲能力高于清蛋白[16],这可能是球蛋白含量高的CP和LP蛋白凝胶样品具有更强的缓冲能力的原因。
2.8 杂豆蛋白凝胶在胃肠道消化过程中可溶性蛋白含量的变化
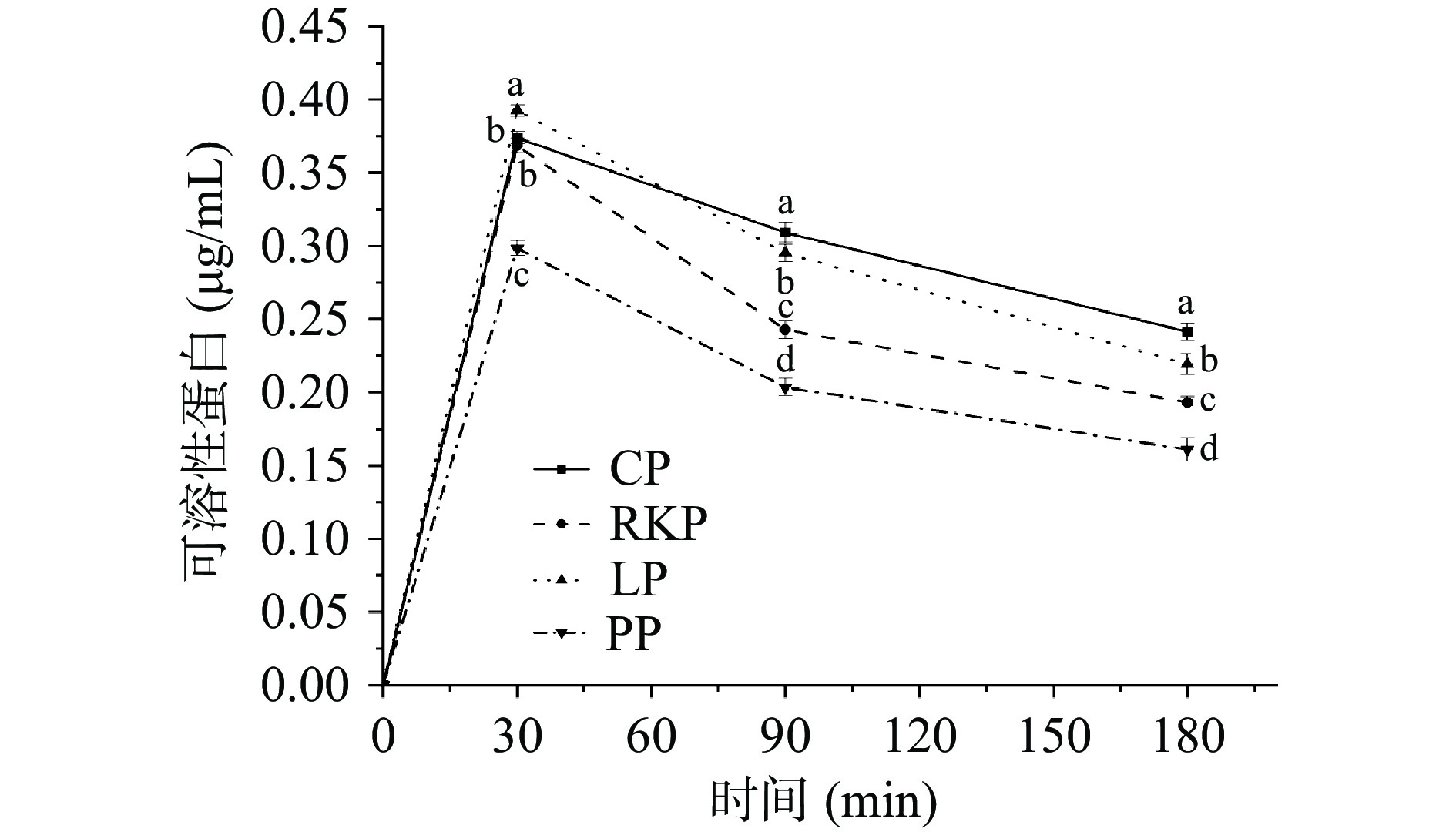
四种杂豆蛋白凝胶在肠消化中可溶性蛋白的含量如图4所示。可溶性蛋白含量表征容易发生酶水解的蛋白质数量指标[39]。由图4可知,四种蛋白凝胶经动态胃肠消化后可溶性蛋白含量均呈现先上升后下降的趋势。在消化早期(0~30 min),各组杂豆凝胶可溶性蛋白呈上升趋势且于肠消化30 min达到顶点,表明可溶性蛋白在消化早期呈现释放过程。其中,LP消化产物可溶性蛋白含量最高,其次为CP和RKP,而PP可溶性蛋白显著较低(P<0.05)。这一研究结果说明LP、CP与RKP凝胶在肠道蠕动、pH作用与消化酶解作用下更易释放可溶性蛋白。在消化中期和后期(30~180 min),各组样品可溶性蛋白含量下降,这可能是由于排空或蛋白降解[40]为小分子肽所致,CP和LP蛋白凝胶的可溶性蛋白含量减少量显著低于RKP和PP蛋白凝胶(P<0.05),可能与其较为致密的凝胶结构有关。Yang等[41]研究指出致密的凝胶网络会延缓胃消化过程的蛋白质水解速率。
2.9 杂豆蛋白凝胶在胃肠道消化过程中肽含量的变化
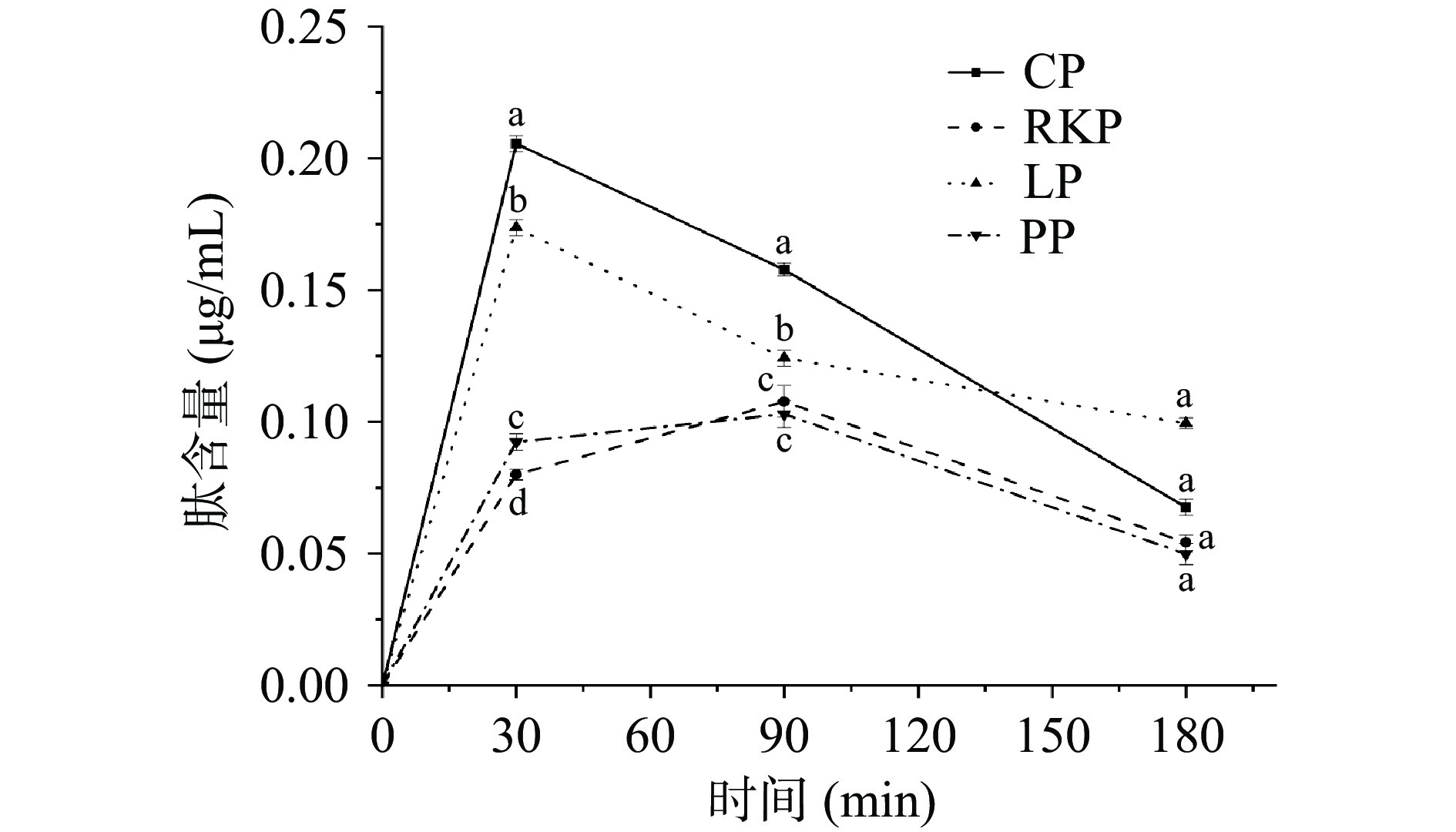
四种杂豆蛋白凝胶在肠消化时间(0、30、90、120 min)的消化产物中肽的含量变化如图5所示。由图5可知,在肠消化早期(0~30 min),CP与LP蛋白凝胶释放的肽含量明显高于RKP与PP蛋白凝胶且CP与LP蛋白凝胶的肽含量均为RKP和PP蛋白凝胶的两倍左右,说明CP和LP凝胶酶解速率较快,这可能与蛋白酶对CP和LP蛋白水解作用更强和可溶性蛋白底物量更高有关[42];在消化中期和后期(30~180 min),尽管RKP和PP消化产物的肽含量得到了一定程度的提升,但CP和LP的肽含量仍显著高于RKP和PP(P<0.05),且CP与LP之间的肽含量仍存在显著差异(P<0.05),这说明不同杂豆在乳酸菌作用下形成的凝胶及结构差异可能蛋白酶切位点暴露的差异,从而影响其消化效率。结果表明,结构较为致密的凝胶(CP和LP)释放肽的能力优于结构较为疏松的凝胶(RKP和PP)。四种杂豆蛋白凝胶肽含量变化趋势与大豆蛋白凝胶的体外消化特性相似,研究表明,乳酸菌诱导的大豆蛋白凝胶网络结构对蛋白质消化及释放肽有一定的延缓作用[43]。这与本研究结果相似。
2.10 杂豆蛋白凝胶在动态胃肠消化中对植物乳杆菌B1-6活力的保护作用研究
乳酸菌通常以口服的形式进入人体,所以只有耐受胃及十二指肠道的严苛环境,到达小肠才能发挥生理功效。因此,对植物乳酸杆菌在不同杂豆蛋白凝胶结构内的耐受胃肠消化的程度进行了比较研究。
四种杂豆蛋白凝胶在胃肠道中消化对植物乳杆菌B1-6活菌数的影响如图6所示。由图6可知,经动态胃肠消化后,四种杂豆蛋白凝胶中植物乳杆菌的存活率均呈下降趋势。在消化前期与中期(0~90 min),CP、LP与PP样品的植物乳酸杆菌存活率显著高于RKP(P<0.05)。在消化后期(90~180 min),所有杂豆蛋白的植物乳杆菌存活率均下降至最低且四组凝胶不存在显著差异(P>0.05)。结果表明,消化前期和中期致密的凝胶网络结构对植物乳杆菌的保护作用更佳,凝胶结构在消化后期的解构导致植物乳杆菌的保护作用的大幅削弱。这与伍鹏等[44]报道发酵乳中酪蛋白在胃肠道消化环境中形成结构致密的凝聚物对乳酸菌有保护作用类似。李军等[45]曾报道肠道消化阶段末期动物双歧杆菌活菌数大量下降,这与本研究结果一致。
3. 结论
本文对植物乳杆菌引导四种杂豆(鹰嘴豆、红芸豆、小扁豆、豌豆)蛋白凝胶形成及特性进行了研究,结果表明:鹰嘴豆蛋白、红芸豆蛋白、小扁豆蛋白和豌豆蛋白的最小临界凝胶浓度(LGC)分别为1.6%(w/v)、1.6%(w/v)、1.4%(w/v)和1.2%(w/v);质构特性结果表明CP和LP蛋白凝胶硬度显著高于RKP和PP蛋白凝胶(P<0.05),微观结构结果表明CP和LP形成的凝胶具有较为致密而均匀的三维蛋白凝胶网络,而RKP与PP形成的凝胶微观结构较为疏松。采用动态模拟胃肠道消化模型对具有不同结构特征的四种杂豆蛋白凝胶进行消化特性评估,结果表明,CP、LP蛋白在消化早、中期的可溶性蛋白和肽含量显著高于另两组蛋白凝胶(RKP和PP),且CP、LP蛋白凝胶对植物乳杆菌B1-6的保护作用显著优于另两组蛋白凝胶。本研究结果有助于加深对四种杂豆蛋白在乳酸菌发酵作用下表现出差异性胶凝能力及消化特性的影响认知,为明确不同杂豆蛋白在乳酸菌作用下的发酵性能、凝胶特性及营养特性提供了理论与应用基础。
-
表 1 四种杂豆蛋白提取物的主要成分含量
Table 1 The content of main components of four pulse proteins
表 2 杂豆蛋白种类及浓度对发酵速率的影响
Table 2 Effects of four pulse proteins and concentrations on the fermentation rate
蛋白浓度(%) 蛋白种类 v(1/h) pH7.0~6.5 pH6.5~6.0 pH6.0~5.5 pH5.5~5.0 pH5.0~4.5 0.1 CP 1.000±0.034bc 0.500±0.045c 0.353±0.022c 0.222±0.006d 0.122±0.003d RKP 3.000±0.785a 1.500±0.251a 0.545±0.021b 0.353±0.002b 0.222±0.010b LP 1.764±0.307b 0.857±0.083b 0.500±0.012b 0.273±0.011c 0.188±0.011c PP 2.000±0.142b 1.364±0.161a 0.667±0.054a 0.429±0.015a 0.250±0.021a 1.0 CP 0.316±0.009c 0.118±0.002c 0.069±0.010c 0.049±0.001c 0.033±0.000c RKP 1.500±0.166a 0.400±0.034a 0.171±0.006a 0.122±0.003a 0.085±0.001b LP 1.000±0.111b 0.250±0.013b 0.143±0.006b 0.115±0.003b 0.093±0.003a PP 0.429±0.021c 0.139±0.052c 0.052±0.005d 0.025±0.001d 0.022±0.000d 1.5 CP 0.323±0.012d 0.157±0.041b 0.073±0.001c 0.053±0.001c 0.036±0.001c RKP 0.750±0.016a 0.309±0.013a 0.170±0.005a 0.010±0.002a 0.049±0.001b LP 0.375±0.014c 0.166±0.062b 0.115±0.002b 0.095±0.002b 0.064±0.001a PP 0.405±0.022b 0.101±0.021c 0.035±0.001d 0.025±0.000d 0.018±0.000d 2.0 CP 0.280±0.010c 0.107±0.023c 0.061±0.001c 0.037±0.000c 0.025±0.000c RKP 0.500±0.017a 0.167±0.065a 0.125±0.004a 0.077±0.001b 0.049±0.001b LP 0.375±0.009b 0.151±0.072b 0.118±0.002b 0.083±0.001a 0.060±0.001a PP 0.240±0.011d 0.065±0.002d 0.026±0.001d 0.020±0.000d 0.015±0.000d 3.0 CP 0.172±0.004d 0.091±0.003c 0.048±0.001b 0.030±0.000c 0.021±0.001c RKP 0.375±0.071a 0.214±0.015a 0.111±0.005a 0.063±0.001b 0.030±0.000b LP 0.240±0.011c 0.143±0.007b 0.115±0.004a 0.088±0.003a 0.061±0.002a PP 0.300±0.014b 0.054±0.001d 0.022±0.001c 0.017±0.002d 0.012±0.000d 注:同列不同字母表示同一浓度、不同蛋白之间具有显著差异(P<0.05)。 表 3 四种杂豆蛋白凝胶的质构特性
Table 3 Textural properties of four pulses protein gels
蛋白种类 硬度(g) 弹性(mm) 内聚性 胶黏性(N) CP 0.277±0.001b 0.510±0.028a 0.750±0.021ab 0.171±0.014a RKP 0.232±0.010c 0.590±0.169a 0.740±0.028b 0.181±0.014a LP 0.300±0.002a 0.570±0.099a 0.420±0.014c 0.174±0.001a PP 0.240±0.003c 0.480±0.056a 0.780±0.014a 0.127±0.057a 表 4 四种杂豆蛋白发酵前后的色差分析
Table 4 Chromatic aberration between the four pulse proteins before and after fermentation
蛋白种类 L* a* b* ΔE 发酵前 CP 35.75±0.32a −2.33±0.07d 1.02±0.27ab 14.48±0.29d RKP 22.70±0.11d 0.42±0.10a 0.89±0.03b 27.32±0.11a LP 27.53±0.26b −0.98±0.04b 1.28±0.02a 22.53±0.26c PP 26.03±0.13c −1.80±0.05c 1.09±0.05ab 24.07±0.13b 发酵后 CP 44.37±0.08b −3.19±0.03c 2.40±0.10a 6.78±0.13c RKP 43.33±0.58c 0.31±0.06a 0.42±0.06c 13.79±0.57a LP 49.17±0.11a −2.11±0.01b 4.36±0.05a 9.06±0.09b PP 44.37±0.11b −3.19±0.03c 2.40±0.26b 6.78±0.11c -
[1] 郑晨曦, 徐斌, 翟鹏贵, 等. 国外植物酸奶产品营养成分现况调查[J]. 中国食物与营养,2022,28(1):51−56. [ZHENG Chenxi, XU Bin, ZHAI Penggui, et al. Investigation on nutritional components of plant-based yoghurt products[J]. Food and Nutrition in China,2022,28(1):51−56. [2] 郑梓威, 张彭湃, 苏海龙, 等. 植物酸奶发展优势及存在问题[J]. 食品工业,2021,42(12):375−380. [ZHENG Ziwei, ZHANG Pengpai, SU Hailong, et al. The development advantages and existing problem of plant-based milk[J]. The Food Industry,2021,42(12):375−380. [3] 蔡文琪, 李梦宇, 吴敬凡, 等. 植物基酸奶的制备及其营养特性的研究进展[J]. 食品与发酵科技,2022,58(2):117−123. [CAl Wenqi, Ll Mengyu, WU Jingfan, et al. Preparation and nutritional characteristics of plant-based yoghurt[J]. Food and Fermentation Science & Technology,2022,58(2):117−123. doi: 10.3969/j.issn.1674-506X.2022.02-018 [4] 梁喜龙, 梁鹏飞, 梅宏瑶, 等. 杂豆的分类、起源、种质保存、国内分布及特殊功能[J]. 北方农业学报,2017,45(3):36−39. [LIANG Xilong, LIANG Pengfei, MEI Hongyao, et al. Classification, origin, germplasm preservation, domestic distribution and special function from various Legumes[J]. Journal of Northern Agriculture,2017,45(3):36−39. [5] 张旭娜, 么杨, 崔波, 等. 鹰嘴豆功能活性及应用研究进展[J]. 食品安全质量检测学报,2018,9(9):1983−1988. [ZHANG XuNa, YAO Yang, CUI Bo, et al. Research advance on the biological activity and application of chickpea[J]. Journal of Food Safety & Quality,2018,9(9):1983−1988. [6] 叶夕苗, 李俊, 毛堂芬, 等. 贵州不同品种芸豆营养品质差异分析[J]. 食品工业科技,2021,42(18):73−80. [YE Ximiao, LI Jun, MAO Tangfen, et al. Analysis on the difference of nutritional quality of different kidney bean varieties in Guizhou[J]. Science and Technology of Food Industry,2021,42(18):73−80. doi: 10.13386/j.issn1002-0306.2021010107 [7] 李素芬, 刘建福. 挤压改性小扁豆全粉营养蛋糕的研制[J]. 食品工业,2015,36(1):121−124. [LI Sufen, LIU Jianfu. Development of nutritional cake containing whole lentil flour modified by extrusion[J]. The Food Industry,2015,36(1):121−124. [8] 孙冬阳, 呼鑫荣, 薛文通. 豌豆功效成分及其生理活性的研究进展[J]. 食品工业科技,2019,40(2):316−320. [SUN Dongyang, HU Xinrong, XUE Wentong. Research progress of efficacy components and physiological activity of pea[J]. Science and Technology of Food Industry,2019,40(2):316−320. doi: 10.13386/j.issn1002-0306.2019.02.055 [9] KAI H, YONGYONG L, YU Z, et al. Formulation of plant-based yoghurt from soybean and quinoa and evaluation of physicochemical, rheological, sensory and functional properties[J]. Food Bioscience,2022,49:101831. doi: 10.1016/j.fbio.2022.101831
[10] XINGYAO L, QIN L, ZHAO X. Free radical scavenging ability of soybean milk fermented by Lactobacillus plantarum YS4 isolated from yak yoghurt in vitro[J]. IOP Conference Series:Earth and Environmental Science,2021,792:012020. doi: 10.1088/1755-1315/792/1/012020
[11] BOECK T, ZANNINI E, SAHIN A W, et al. Nutritional and rheological features of lentil protein isolate for yoghurt-like application[J]. Foods (Basel, Switzerland),2021,11(8):1692.
[12] FARDET A, DUPONT D, RIOUX L E, et al. Influence of food structure on dairy protein, lipid and calcium bioavailability: A narrative review of evidence[J]. Critical Reviews in Food Science and Nutrition,2019,59(13):1987−2010. doi: 10.1080/10408398.2018.1435503
[13] VIANNA F S, DA CRUZ SILVA CANTO A C V, COSTA-LIMA B, et al. Milk from different species on physicochemical and microstructural yoghurt properties[J]. Ciencia Rural,2019,49(6):e20180522. doi: 10.1590/0103-8478cr20180522
[14] 安馨, 鱼晓敏, 李层层, 等. 鹰嘴豆蛋白质的营养学评价[J]. 食品科技,2018,43(6):83−87. [AN Xin, YU Xiaomin, LI Cengceng, et al. Nutritional evaluation on chickpea protein[J]. Food Science and Technology,2018,43(6):83−87. doi: 10.13684/j.cnki.spkj.2018.06.016 [15] 梁珊, 高小丽, 高金锋, 等. 脱脂脱皮对芸豆营养成分及蛋白提取率的影响[J]. 西北农林科技大学学报(自然科学版),2015,43(9):82−88. [LIANG Shan, GAO Xiaoli, GAO Jinfeng, et al. Influence of defatting and dehulling on nutritional ingredients and protein extraction rate of kidney beans[J]. Journal of Northwest A & F University (Natural Science Edition),2015,43(9):82−88. doi: 10.13207/j.cnki.jnwafu.2015.09.012 [16] 聂丽洁. 杂豆粉及杂豆蛋白的功能性质研究[D]. 杨凌: 西北农林科技大学, 2013 NIE Lijie. Physicochemical and functional properties of dehulled and defatted flours and proteins from different legumes[D]. Yangling: Northwest A & F University, 2013.
[17] 秦高一鑫, 裴斐, 袁彪, 等. 豌豆蛋白和多糖同步提取工艺优化及其抗氧化活性研究[J]. 中国粮油学报,2019,34(10):16−22. [QIN Gaoyixin, PEI Fei, YUAN Biao, et al. Process optimization of simultaneous extraction of pea protein and polysaccharide and evaluation of antioxidant activity[J]. Journal of the Chinese Cereals and Oils Association,2019,34(10):16−22. doi: 10.3969/j.issn.1003-0174.2019.10.004 [18] BLANA V A, GROUNTA A, TASSOU C C, et al. Inoculated fermentation of green olives with potential probiotic Lactobacillus pentosus and Lactobacillus plantarum starter cultures isolated from industrially fermented olives[J]. Food Microbiology,2014,38:208−218. doi: 10.1016/j.fm.2013.09.007
[19] RUI X, ZHANG Q, HUANG J, et al. Does lactic fermentation influence soy yogurt protein digestibility: A comparative study between soymilk and soy yogurt at different pH[J]. Journal of the Science of Food and Agriculture,2019,99(2):861−867. doi: 10.1002/jsfa.9256
[20] GULDIKEN B, STOBBS J, NICKERSON M. Heat induced gelation of pulse protein networks[J]. Food Chemistry,2021,350:129158. doi: 10.1016/j.foodchem.2021.129158
[21] LIU J, LUO D L, LI X, et al. Effects of inulin on the structure and emulsifying properties of protein components in dough[J]. Food Chemistry,2016,210:235−241. doi: 10.1016/j.foodchem.2016.04.001
[22] PONGMALAI P, FU N, SOPONRONNARIT S, et al. Microwave pretreatment enhances the formation of cabbage sulforaphane and its bioaccessibility as shown by a novel dynamic soft rat stomach model[J]. Journal of Functional Foods,2018,43:186−195. doi: 10.1016/j.jff.2018.02.009
[23] 吴寒, 芮昕, 李春阳, 等. 多菌种固态发酵法提高燕麦全谷物的蛋白质营养品质[J]. 食品科学,2018,39(16):168−175. [WU Han, RUI Xin, LI Chunyang, et al. Improved protein nutritional quality of whole oat grains by solid state fermentation with mixed strains[J]. Food Science,2018,39(16):168−175. doi: 10.7506/spkx1002-6630-201816025 [24] 李洋. 燕麦蛋白分离提纯工艺及功能性研究[D]. 郑州: 河南工业大学, 2012 LI Yang. The research on extraction process and functional studies of oat protein[D]. Zhengzhou: Henan University of Technology, 2012.
[25] FENG X M, ERIKSSON A R B, SCHNURER J. Growth of lactic acid bacteria and Rhizopus oligosporus during barley tempeh fermentation[J]. International Journal of Food Microbiology,2005,104(3):249−256. doi: 10.1016/j.ijfoodmicro.2005.03.005
[26] 李良, 杨晓宇, 王雁, 等. 植物乳杆菌发酵大豆分离蛋白凝胶的特性分析[J]. 华南理工大学学报(自然科学版),2019,47(3):93−100. [LI Liang, YANG Xiaoyu, WANG Yan, et al. Analysis on the characteristics of soybean protein isolate gel fermented by Lactobacillus plantarum[J]. Journal of South China University of Technology (Natural Science Edition),2019,47(3):93−100. [27] 郭增旺, 陆涛, 瞿东杨, 等. 四种芸豆蛋白的理化与功能特性分析[J]. 中国食品添加剂,2016,8(8):199−204. [GUO Zengwang, LU Tao, ZHAI Dongyang, et al. Analysis of physicochemical and functional properties of four kinds of kidney bean protein[J]. China Food Additives,2016,8(8):199−204. doi: 10.3969/j.issn.1006-2513.2016.08.025 [28] YANG M, LI N, TONG L, et al. Comparison of physicochemical properties and volatile flavor compounds of pea protein and mung bean protein-based yogurt[J]. LWT-Food Science & Technology,2021,152:112390.
[29] 郑文彬, 韩晶, 王颖, 等. 黑龙江省芸豆主栽品种蛋白质功能性质分析[J]. 中国粮油学报,2017,32(2):6−12. [ZHENG Wenbin, HAN Jing, WANG Ying, et al. Analysis of functional properties of protein of main cultivar kidney beans in Heilongjiang Province[J]. Journal of the Chinese Cereals and Oils Association,2017,32(2):6−12. doi: 10.3969/j.issn.1003-0174.2017.02.002 [30] FENG L, ZHANG M, BHANDARI B, et al. Determination of postharvest quality of cucumbers using nuclear magnetic resonance and electronic nose combined with chemometric methods[J]. Food and Bioprocess Technology,2018,11(12):2142−2152. doi: 10.1007/s11947-018-2171-9
[31] 曹连鹏, 傅玉颖, 李欣, 等. 酸诱导大豆蛋白凝胶动态变化与流变特性[J]. 中国食品学报,2017(11):36−43. [CHAO Lianpeng, FU Yuying, LI Xin, et al. Dynamic behavior of acid-induced soybean protein gels and their rheological properties[J]. Journal of Chinese Institute of Food Science and Technology,2017(11):36−43. doi: 10.16429/j.1009-7848.2017.11.005 [32] 计红芳, 李莎莎, 张令文, 等. 豌豆蛋白对牛肉盐溶蛋白共混凝胶特性的影响[J]. 食品与发酵工业,2019(9):89−95. [JI Hongfang, LI Shasha, ZHANG Lingwen, et al. Effects of pea protein on co-gel properties of salt-soluble proteins in beef[J]. Food and Fermentation Industries,2019(9):89−95. doi: 10.13995/j.cnki.11-1802/ts.018733 [33] URBONAITE V, DE JONGH H H J, VAN DER LINDEN E, et al. Water holding of soy protein gels is set by coarseness, modulated by calcium binding, rather than gel stiffness[J]. Food Hydrocolloids,2015,46:103−111. doi: 10.1016/j.foodhyd.2014.12.010
[34] XING G, GIOSAFATTO C V L, CARPENTIERI A, et al. Gelling behavior of bio-tofu coagulated by microbial transglutaminase combined with lactic acid bacteria[J]. Food Research International,2020,134:109200. doi: 10.1016/j.foodres.2020.109200
[35] ZHENG L, YU Y, TONG Z, et al. The characteristics of starch gels molded by 3D printing[J]. Journal of Food Processing and Preservation,2019,43(7):13993.
[36] 孙乐常, 林怡晨, 刘伟锋, 等. 蓝圆鲹酸/碱等电点沉淀法分离蛋白凝胶特性与消化特性[J]. 食品科学,2019,40(12):22−29. [SUN Lechang, LIN Yichen, LIU Weifeng, et al. Gelation and digestive properties of blue round scads (Decapterus maruadsi) protein recovered by acidic/alkaline isoelectric solubilization/precipitation[J]. Food Science,2019,40(12):22−29. doi: 10.7506/spkx1002-6630-20180626-484 [37] GOH K M, LAI O M, ABAS F, et al. Effects of sonication on the extraction of free-amino acids from moromi and application to the laboratory scale rapid fermentation of soy sauce (Article)[J]. Food Chemistry,2017,215:200−208. doi: 10.1016/j.foodchem.2016.07.146
[38] 李星. 热处理和贮藏期间乳蛋白的消化吸收机制研究[D]. 哈尔滨: 哈尔滨工业大学 2021 LI Xing. Research of the digestion and absorption mechanism of milk proteins during the heat treatment and storage[D]. Harbin: Harbin Institute of Technology, 2021.
[39] ALIZADEH H, LEUNG D W M, COLE A L J. Concurrent occurrence of alpha-amylase inhibitor and stimulator in red kidney bean seed: Physiological implications[J]. Biol Plant,2010,54(1):195−197. doi: 10.1007/s10535-010-0034-y
[40] BARAC M B, PESIC M B, STANOJEVIC S P, et al. Comparative study of the functional properties of three legume seed isolates: Adzuki, pea and soy bean (Article)[J]. Journal of Food Science and Technology,2015,52(5):2779−2787. doi: 10.1007/s13197-014-1298-6
[41] YANG X, REN Y, LIU H, et al. Differences in the physicochemical, digestion and microstructural characteristics of soy protein gel acidified with lactic acid bacteria, glucono-6-lactone and organic acid[J]. International Journal of Biological Macromolecules,2021,185:462−470. doi: 10.1016/j.ijbiomac.2021.06.071
[42] JORDAN W, YANA G, SRIRAMARAO P, et al. Limited hydrolysis combined with controlled Maillard-induced glycation does not reduce immunoreactivity of soy protein for all sera tested[J]. Food Chemistry,2016,213:742−752. doi: 10.1016/j.foodchem.2016.07.012
[43] YANG X, KE C, LI L. Physicochemical, rheological and digestive characteristics of soy protein isolate gel induced by lactic acid bacteria[J]. Journal of Food Engineering,2021,292:110243. doi: 10.1016/j.jfoodeng.2020.110243
[44] 伍鹏, 王娟, 王晶晶, 等. 基于仿生胃肠道模型的发酵乳中益生菌存活率评价[J]. 食品与发酵工业,2021,47(12):147−153. [WU Peng, WANG Juan, WANG Jingjing, et al. Evaluation of probiotics viability in fermented milk based on a biomimetic gastrointestinal model[J]. Food and Fermentation Industries,2021,47(12):147−153. doi: 10.13995/j.cnki.11-1802/ts.026269 [45] 李军, 张丽末, 桂萌, 等. 动物双歧杆菌RH对消化道的耐受性及其微胶囊制备的研究[J]. 食品科学,2017,38(22):14−21. [LI Jun, ZHANG Limo, GUI Meng, et a1. Resistance of Bifidobacterium RH to simulated gastrointestinal conditions and preparation of microcapsules containing this strain[J]. Food Science,2017,38(22):14−21. doi: 10.7506/spkx1002-6630-201722003







 下载:
下载:


 下载:
下载:



