Optimization of Englyst Method for Determination of Starch Digestibility of Japonica Rice Based on AOAC Method
-
摘要: 研究较快速、准确测定粳米淀粉消化特性的方法。以粳米淀粉为试验对象,AOAC法(AOAC Official Method 2002.02)测定结果为基准,对Englyst法的酶解反应时间、混合酶比例、混合酶的添加量、混合酶pH等试验条件进行优化,得到适合粳米淀粉消化特性测定的方法,并对该方法测定结果进行准确度、精密度分析。结果表明,当酶解时间为270 min、混合酶比例[α-胰腺淀粉酶(AMY):淀粉葡萄糖苷酶(AMG)]为10:1、混合酶添加量为AMY(3600 U)+AMG(360 U)、混合酶pH为6.0、样品不经糊化处理时,测得的粳米淀粉中RS含量2.13%±0.05%与AOAC法测定结果2.02%±0.06%无显著差异,并且其测定时间由AOAC法的16 h调整为270 min,大大缩短了试验时间;与原Englyst方法相比,改进后的Englyst法测得的结果2.13%±0.05%准确度和精密度高,重现性好。因此,改进后的Englyst法可以快速、准确地测定粳米淀粉的消化特性。Abstract: It is of great significance to study a rapid and accurate method for determining the digestion characteristics of japonica rice starch. Taking japonica rice starch as the research object and the determination results of AOAC method (AOAC Official Method 2002.02) as the standard, the test conditions of Englyst method were optimized to obtain a determination method, which was suitable for the digestion characteristics of japonica rice starch. The accuracy and precision of the determination results were analyzed. When the hydrolysis time was 270 min, the proportion of mixed enzymes was 10:1, the amount of mixed enzyme was AMY (3600 U)+AMG (360 U), the pH of mixed enzyme was 6.0, and the sample was not gelatinized, there was no significant difference between the RS content 2.13%±0.05% measured by the improved Englyst method and that 2.02%±0.06% measured by AOAC method. Compared with the AOAC method, the determination time was adjusted from 16 h of AOAC method to 270 min, the test time was greatly shortened. Compared with Englyst method, the improved method 2.13%±0.05% had good repeatability. Therefore, the improved Englyst method can quickly and accurately determine the digestion characteristics of japonica rice starch.
-
全世界大约有一半以上的人口以稻米为主食,我国是世界四大稻米生产国之一,稻米加工业长期以来在我国整个食品工业中发挥着重要的作用[1]。稻米是许多营养素和功能成分的重要来源,包括膳食纤维、抗性淀粉、矿物质和抗氧化剂[2]。稻米淀粉除具有其他淀粉所具备的普通功能的同时,还具有淀粉颗粒细小且粒度分布均匀[3],易被人体消化吸收、低过敏性、质构柔滑和口感好等优良特质[4],是制备功能性淀粉基食品的优质原料。粳米直链淀粉含量低,胶稠度软,口感柔软甘滑[5],深受市场欢迎,近年来,人们生活水平不断提高,国民对粳米的消费需求快速增加。研究粳米淀粉消化特性的测定方法,对扩宽淀粉的应用范围、提高稻米的整体经济效益具有重要意义[6]。
目前对于粳米消化特性的研究多集中在消化特性的改善及抗性淀粉的制备上[7-9],专门研究粳米淀粉消化特性测定方法的还很少。而无论是改善淀粉的消化特性,还是研究其生理功能,都需要首先建立一种准确又可靠的定量分析方法[10]。RS作为定量描述淀粉消化特性的一个重要指标[11],目前测定法主要有Englyst法[12]、Berry法[13]、Bjrock法[14]、Goni法[15]、Champ法[16]和美国分析化学家协会(Association of Official Analytical Chemists,AOAC)方法[17],这些方法有各自的特点,较常用的是Englyst法和AOAC法[18]。Englyst法和AOAC法均能够较为全面地测定淀粉体外消化特性[19],AOAC法为直接法,是国内外普遍采用的测定RS含量的方法,耗时较长[20]。Englyst法为间接法,准确度低于AOAC法,但所需时间较少,且能测定淀粉的RS、SDS、RDS含量[21]。本文分别采用AOAC法和Englyst法测定抗性淀粉标准品中的抗性淀粉含量,比较了两种方法测定标准品的结果。然后以粳米淀粉为试验对象,AOAC法测定结果为基准,对Englyst法的试验条件进行优化,确定适合粳米淀粉消化特性的测定方法,并对该方法测定结果进行准确度、精密度分析。研究粳米淀粉的消化特性测定方法,对今后粳米淀粉的进一步研究与应用具有重要意义。
1. 材料与方法
1.1 材料与仪器
粳米淀粉 上海源叶生物科技有限公司;抗性淀粉检测试剂盒(抗性淀粉标准品1 RS=0.56%、抗性淀粉标准品2 RS=4.9%、抗性淀粉标准品3 RS=36.5%)、葡萄糖测定试剂盒 Megazyme公司;α-胰腺淀粉酶(12 U/mg)、淀粉葡萄糖苷酶(82.5 U/mg) Sigma公司;瓜尔豆胶 北京索莱宝科技有限公司;乙酸、氢氧化钠、无水乙醇、氢氧化钾 分析纯,天津市光复科技发展有限公司。
SHA-B水浴式恒温振荡器 常州市国立试验设备研究所;722可见分光光度计 天津市泰斯特分析仪器有限公司;JA 2003电子天平 上海浦春计量仪器有限公司;TG 16高速离心机 上海卢湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 AOAC法测定淀粉体外消化特性
1.2.1.1 AOAC法测定抗性淀粉标准品体外消化特性
抗性淀粉标准品的体外消化特性按照AOAC法[17]的步骤进行测定。准确称取100(±5) mg样品,置于15 mL离心管中,加入4 mL已预热至37 ℃的混合酶溶液,混合酶溶液pH为6.0,其中含α-胰腺淀粉酶(AMY)120 U,淀粉葡萄糖苷酶(AMG)12 U,涡旋混匀,160 r/min、37 ℃水浴下连续振荡16 h。取出离心管,加入4 mL无水乙醇,涡旋混匀,5000×g进行离心10 min,弃去上清液。向沉淀中加入2 mL的85%乙醇溶液,重悬浮并涡旋混匀,加入6 mL的85%乙醇溶液,混匀后再次离心,弃去上清液。重复进行上述步骤。加入2 mL的去离子水使沉淀物充分润湿,再向其中加入4 mol/L的氢氧化钾溶液2 mL,冰水浴振荡20 min后,加入pH为3.8的乙酸钠缓冲液8 mL,涡旋混匀,加入AMG溶液(660 U/mL)0.5 mL,涡旋混匀。取出离心管,50 ℃水浴30 min。
抗性淀粉(RS)含量按照以下步骤进行测定:对于RS含量大于10%的样品,将离心管中的样液全部转移至100 mL容量瓶中,并用蒸馏水定容至刻度线,吸取10 mL溶液于离心管中,5000×g离心10 min,取上清液,用葡萄糖氧化酶(GOPOD)测定葡萄糖含量。对于RS含量小于10%的样品,直接离心,取上清液,用GOPOD测定葡萄糖含量。RS和葡萄糖的计算公式如下:
葡萄糖含量(%)=ΔA×F×V×1000.1×m×1000 (1) RS(%)=葡萄糖含量×0.9 (2) 式中:
Δ A为相对于空白试剂的吸光度值;F为从吸光度值到微克的转换(μg);V为样品的最终体积(mL);m为试样的质量(mg);0.9为葡萄糖转化系数。1.2.1.2 AOAC法测定粳米淀粉体外消化特性
同方法1.2.1.1。
1.2.2 Englyst法测定淀粉体外消化特性
1.2.2.1 Englyst法测定抗性淀粉标准品体外消化特性
采用Englyst法[12]测定抗性淀粉标准品的体外消化特性。称取1 g样品置于50 mL离心管中,加5粒玻璃珠、50 mg瓜尔豆胶粉,加入20 mL乙酸钠缓冲液(pH5.2)和已预热至37 ℃的混合酶溶液5 mL,酶添加量为AMY(3600 U)+AMG(360 U),涡旋混匀,160 r/min、37 ℃水浴下进行振荡。在振荡20、120 min后分别取出0.5 mL的反应液,立即移入19.5 mL 66%乙醇中,涡旋混匀,离心取上清液,用GOPOD测定葡萄糖含量。快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)的计算公式如下:
RDS(%)=(G20−FG)×0.9TS×100 (3) SDS(%)=(G120−G20)×0.9TS×100 (4) RS(%)=TS−(RDS+SDS)TS×100 (5) 式中:FG为酶解前淀粉悬浮液中的游离葡萄糖含量(mg);G20为淀粉酶解20 min后酶解液中的葡萄糖含量(mg);G120为淀粉酶解120 min后酶解液中的葡萄糖含量(mg);0.9为葡萄糖转化系数;TS为样品中总淀粉含量(mg)。
1.2.2.2 Englyst法测定粳米淀粉体外消化特性
同方法1.2.2.1。
1.2.3 Englyst法中酶解时间对粳米淀粉体外消化特性测定结果的影响
准确称取100(±5) mg样品置于50 mL离心管中,加入已预热至37 ℃的混合酶溶液25 mL,混合酶溶液pH为6.0,酶添加量为AMY(3600 U)+AMG(360 U),涡旋混匀,160 r/min、37 ℃水浴下进行振荡。20 min后取出1 mL反应液,立即在沸水浴中进行灭酶,离心取上清液,用GOPOD测定葡萄糖含量。分别在120、180、240、270、300、360 min后取出1 mL反应液,立即移入3 mL 66%乙醇中,涡旋混匀,并在沸水浴中进行灭酶,离心取上清液,用GOPOD测定葡萄糖含量。
1.2.4 Englyst法中混合酶比例对粳米淀粉体外消化特性测定结果的影响
准确称取100(±5) mg样品置于50 mL离心管中,加入已预热至37 ℃的混合酶溶液25 mL,混合酶溶液pH为6.0,AMY添加量为3600 U,分别设置混合酶的比例为5:1、10:1和20:1,涡旋混匀,160 r/min、37 ℃水浴下进行振荡。20 min后取出1 mL反应液,立即在沸水浴中进行灭酶,离心取上清液,用GOPOD测定葡萄糖含量。270 min后取出1 mL反应液,立即移入3 mL 66%乙醇中,涡旋混匀,并在沸水浴中进行灭酶,离心取上清液,用GOPOD测定葡萄糖含量。计算公式同方法1.2.2.1。
1.2.5 Englyst法中混合酶添加量对粳米淀粉体外消化特性测定结果的影响
准确称取100(±5)mg样品置于50 mL离心管中,加入已预热至37 ℃的混合酶溶液25 mL,其pH为6.0,分别设置混合酶添加量为AMY(600 U)+AMG(60 U)、AMY(1800 U)+AMG(180 U)、AMY(3600 U)+AMG(360 U)和AMY(4800 U)+AMG(480 U),涡旋混匀,160 r/min、37 ℃水浴下进行振荡。以下步骤同1.2.4。
1.2.6 Englyst法中混合酶pH对粳米淀粉体外消化特性测定结果的影响
准确称取100(±5) mg样品置于50 mL离心管中,加入已预热至37 ℃的混合酶溶液25 mL,酶添加量为AMY(3600 U)+AMG(360 U),分别调节pH至5.2、6.0和6.9,涡旋混匀,160 r/min、37 ℃水浴下进行振荡。以下步骤同1.2.4。
1.2.7 Englyst法中原料预处理对粳米淀粉体外消化特性测定结果的影响
分别称取两份100(±5) mg样品置于50 mL离心管中,加入5 mL乙酸钠缓冲液(pH 6.0),涡旋混匀。一份100 ℃水浴30 min,冷却至室温,另外一份不作处理,分别加入已预热至37 ℃的混合酶溶液20 mL,酶添加量为AMY(3600 U)+AMG(360 U),调节酶液pH至6.0,涡旋混匀,160 r/min、37 ℃水浴下进行振荡。以下步骤同1.2.4。
1.3 数据处理
所有的实验均重复6次,分析所得出的数据均以平均值±标准偏差表示。其中曲线图使用Origin 2021和Microsoft Office Excel进行绘制,使用SPSS 25进行单因素方差分析。
2. 结果与分析
2.1 粳米淀粉体外消化特性测定方法的比较
采用AOAC法和Englyst法对抗性淀粉质量分数为0.56%(抗性淀粉标准品1)、4.9%(抗性淀粉标准品2)、36.5%(抗性淀粉标准品3)的标准品以及粳米淀粉进行测定,测定结果如表1所示。由表1可知,AOAC法测得的RS含量的标准差和变异系数较小,重现性较好,但AOAC法测定时间(16 h)比Englyst法(120 min)长,且步骤繁琐,不利于快速测定样品中抗性淀粉的含量。Englyst法采用混合酶水解可消化淀粉,通过总淀粉含量减去可消化淀粉含量来进行间接计算,测定时简单快速,但其测定结果受到酶解时间、混合酶比例、混合酶添加量等多方面因素的影响。因此为了快速准确地检测粳米淀粉体外消化特性,首先采用AOAC法得到粳米淀粉中RS含量,然后以该含量为基准来对Englyst法的试验条件进行优化,从而得到Englyst改进法。
表 1 两种方法测定抗性淀粉含量的比较Table 1. Comparison of two methods for determining the content of resistant starch样品 AOAC法RS含量(%) 标准差 变异系数(%) Englyst法RS含量(%) 标准差 变异系数(%) 标准品1 0.78 0.02 3.85 1.26 0.12 9.52 标准品2 4.98 0.05 1.00 7.10 0.56 7.89 标准品3 36.71 0.77 2.10 40.33 1.95 4.84 粳米淀粉 2.02 0.06 2.97 4.19 0.30 7.16 2.2 酶解时间对Englyst法测定结果的影响
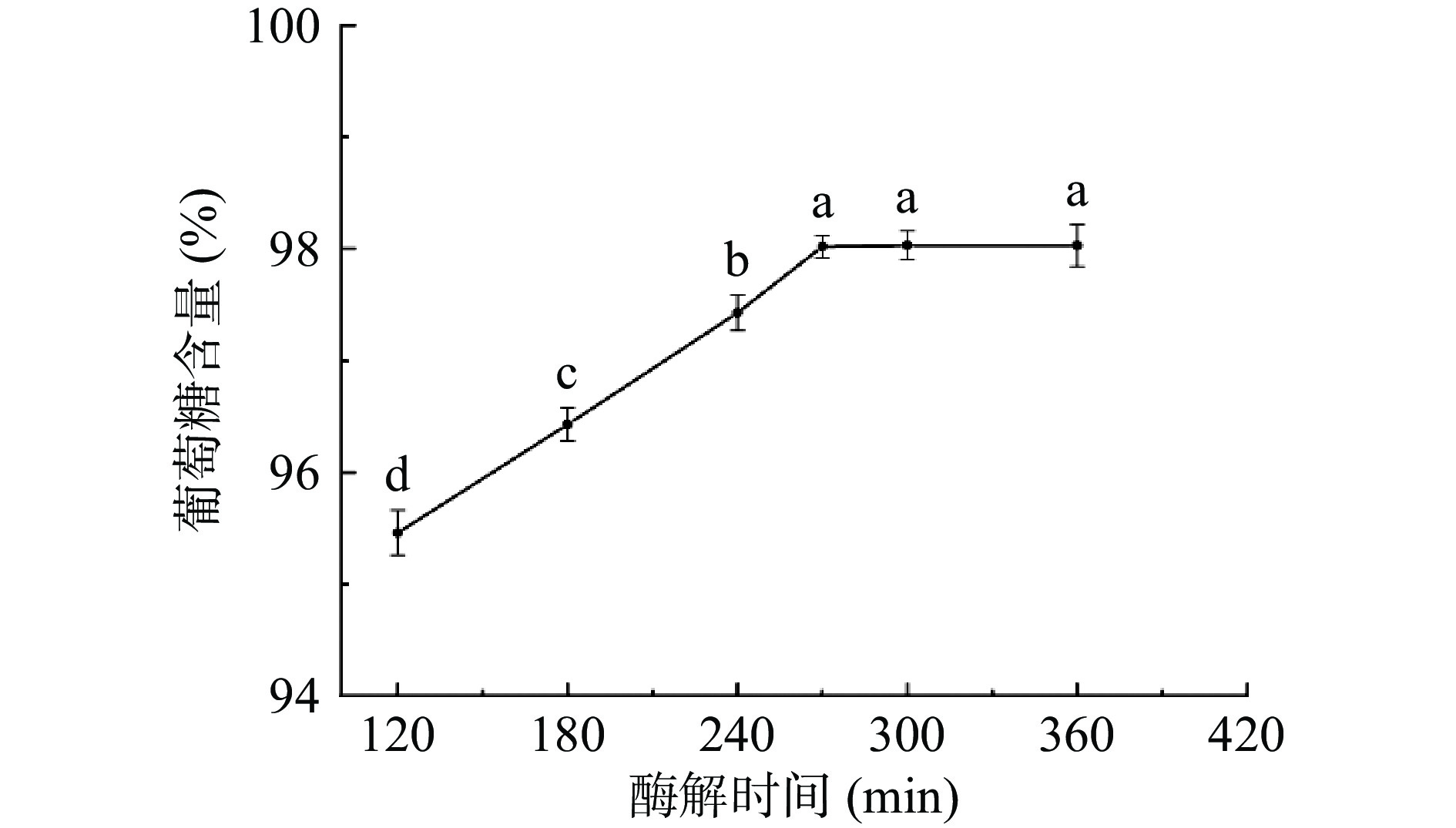
在120、180、240、270、300和360 min分别测定样液中葡萄糖含量,测定结果如图1所示。根据图1可知,随着酶解时间的增加,样液中的葡萄糖含量呈现递增的趋势,270 min后趋于平缓。淀粉酶解120 min后约95%被分解成葡萄糖,270 min后约98%被分解成葡萄糖,此后葡萄糖含量基本不变。在该实验的作用条件下,120 min时慢消化淀粉未被完全分解,而270 min时已基本上被完全分解,因此本实验选取270 min作为最佳的酶解时间。
2.3 混合酶比例对Englyst法测定结果的影响
研究发现,在测定淀粉体外消化特性时,AMG的添加量对最终测定结果有显著影响[22]。通过固定AMY添加量、改变AMG用量即调节两种酶的比例来对试验条件进行优化,测定结果如表2所示。淀粉在AMY的作用下能水解生成麦芽糖、麦芽三糖等,麦芽糖对AMY具有抑制作用,AMG则可以将麦芽糖水解生成葡萄糖,进而消除这种抑制作用[23]。当混合酶比例为20:1和15:1时,AMG的添加量较少,麦芽糖对AMY的抑制作用不能被完全消除,使得测定结果中可消化淀粉(RDS+SDS)含量偏低、RS含量偏高。当混合酶比例为10:1时,RS含量的测定结果2.13%±0.05%与AOAC法测定结果2.02%±0.06%无显著差异,继续增加AMG添加量,RDS、SDS、RS含量无显著变化。因此,在后续试验中选择10:1作为最佳的混合酶比例。
表 2 混合酶比例对Englyst法测定结果的影响Table 2. Effect of mixed enzyme ratio on the determination results of Englyst method混合酶比例(AMY:AMG) RDS(%) SDS(%) RS(%) 20:1 20.68±0.19c 73.03±0.58a 6.29±0.17a 15:1 24.97±0.21b 70.87±0.51b 4.16±0.12b 10:1 29.49±0.25a 68.38±0.51c 2.13±0.05c 7.5:1 29.80±0.27a 68.06±0.51c 2.14±0.08c 5:1 30.06±0.32a 67.75±0.43c 2.19±0.08c 注:不同小写字母表示各组存在显著差异,P<0.05,下同。 2.4 混合酶添加量对Englyst法测定结果的影响
对混合酶的添加量进行优化,测定结果如表3所示。随着混合酶添加量的增加,可消化淀粉含量先上升后下降,RS含量相反。当AMY总添加量为3600 U、AMG总添加量为360 U时,测定结果2.13%±0.05%与AOAC法测定结果2.02%±0.06%无显著差异,此时RDS、SDS和RS的含量分别为29.49%、68.38%、2.13%。由此可见,并不是混合酶添加的量越高,其测定结果就越好[24]。这可能是因为当底物水平不变时,底物的水解程度在一定范围内会随着酶量的增加而增大,当酶溶液与底物的相互作用达到饱和时,继续增加酶的用量不仅不会增加底物的水解程度,反而会抑制底物的水解[25]。因此选择AMY(3600 U)+AMG(360 U)作为测定粳米淀粉体外消化特性的最佳混合酶添加量。
表 3 混合酶添加量对Englyst法测定结果的影响Table 3. Effect of mixed enzyme addition on the determination results of Englyst method混合酶添加量 RDS(%) SDS(%) RS(%) AMY(600 U)+AMG(60 U) 17.52±0.08d 48.85±0.29d 33.63±0.49a AMY(1800 U)+AMG(180 U) 21.87±0.20c 56.71±0.37c 21.42±0.25b AMY(3600 U)+AMG(360 U) 29.49±0.25a 68.38±0.47a 2.13±0.05d AMY(4800 U)+AMG(480 U) 29.26±0.28b 68.24±0.43b 2.50±0.09c 2.5 混合酶pH对Englyst法测定结果的影响
溶液的pH是影响测定结果准确度的一个重要因素[26]。AMY的最佳pH范围一般为6.7~7.0,AMG的pH范围一般是4.5~5.0[27]。由于这两种酶的pH范围不同,因此需要综合考虑其活性释放的最佳pH。分别设置混合酶的pH为5.2、6.0和6.9来对试验条件进行优化,测定结果如表4所示。由表4可知,随着混合酶pH的增大,RDS含量先增加后减少,SDS含量呈上升趋势,RS含量先减少后增加,当pH为6.0时测定结果2.13%±0.05%与AOAC法测定结果2.02%±0.06%无显著差异。当混合酶pH为5.2时,AMY的活力受到抑制,可消化淀粉未被完全分解,使得测定结果中RS含量偏高。当混合酶的pH为6.0时,两种酶的活性都能得到有效释放[28]。当混合酶pH为6.9时,接近AMY作用的最适pH7.0,具有较强的淀粉水解能力,但由于AMG的最适pH为4.5~5.0,此时糖化酶并未发生作用[29]。由此可知,当混合酶pH为6.0时,更适合测定粳米淀粉体外消化特性。
表 4 混合酶pH对Englyst法测定结果的影响Table 4. Effect of mixed enzyme pH on the determination results of Englyst method混合酶pH RDS(%) SDS(%) RS(%) 5.2 19.35±0.17c 60.32±0.30c 20.33±0.11a 6.0 29.49±0.25a 68.38±0.47b 2.13±0.05c 6.9 26.08±0.31b 69.35±0.39a 4.57±0.05b 2.6 原料预处理对Englyst法测定结果的影响
对粳米淀粉采取糊化和不糊化两种预处理方式进行测定,测定结果如表5所示。由表5可知,粳米淀粉经糊化处理后,一部分SDS转变为RDS,导致测得的RDS含量较高,SDS含量偏低。未经糊化处理测得的结果2.13%±0.05%与AOAC法测得的结果2.02%±0.06%无显著差异,而糊化后RS2失去其酶抗性[30],导致测得的RS含量偏低。因此,在测定粳米淀粉体外消化特性时采用不糊化的预处理方式,避免了在测定蒸煮/凝胶化粳米淀粉时重复糊化的问题。
表 5 原料预处理对Englyst法测定结果的影响Table 5. Effect of raw material pretreatment on the determination results of Englyst method原料预处理方式 RDS(%) SDS(%) RS(%) 糊化 41.56±0.30a 57.39±0.38b 1.05±0.02b 不糊化 29.49±0.25b 68.38±0.47a 2.13±0.05a 2.7 方法准确性和重复性比较
根据上述试验,得到Englyst改进法的最佳试验条件:酶解时间为270 min、混合酶比例(AMY:AMG)为10:1、混合酶添加量为AMY(3600 U)+AMG(360 U)、混合酶pH为6.0、样品不经糊化处理。
分别对AOAC法、Englyst法及Englyst改进法测定粳米淀粉体外消化特性的结果进行比较,如表6所示。由表6可知,Englyst改进法测定结果与AOAC法无显著差异(P<0.05),且大大缩短了试验时间;与Englyst法相比,Englyst改进法测得的数据变异系数较小,表明该方法测得的数值变异程度小,重复性好[31]。因此,Englyst改进法可以用于测定粳米淀粉体外消化特性。
表 6 AOAC法、Englyst法及改进后的Englyst法测定结果比较Table 6. Comparison of determination results of AOAC method, Englyst method and Englyst improved method测定方法 RS含量(%) 变异系数(%) AOAC法 2.02±0.06b 2.97 Englyst法 4.19±0.30a 7.16 改进后的Englyst法 2.13±0.05b 2.35 3. 结论
本文通过对AOAC法和Englyst法测定抗性淀粉标准品中RS含量的比较分析,发现Englyst法测定结果的准确度偏低,但Englyst法测定时间短,其测定结果在该抗性淀粉标准品允许的误差范围内。Englyst法测定结果受到酶解时间、混合酶比例、混合酶添加量等多方面因素的影响。采用AOAC法得到粳米淀粉中RS含量,然后以该含量为基准对Englyst法的试验条件进行优化,得到了测定粳米淀粉体外消化特性的最佳试验条件:酶解时间为270 min、混合酶比例(AMY:AMG)为10:1、混合酶添加量为AMY(3600 U)+AMG(360 U)、混合酶pH为6.0、样品不经糊化处理。优化后的方法变异系数小,重现性较好。这一结论对扩宽粳米淀粉应用范围、提高粳米整体的经济效益具有重要意义。
-
表 1 两种方法测定抗性淀粉含量的比较
Table 1 Comparison of two methods for determining the content of resistant starch
样品 AOAC法RS含量(%) 标准差 变异系数(%) Englyst法RS含量(%) 标准差 变异系数(%) 标准品1 0.78 0.02 3.85 1.26 0.12 9.52 标准品2 4.98 0.05 1.00 7.10 0.56 7.89 标准品3 36.71 0.77 2.10 40.33 1.95 4.84 粳米淀粉 2.02 0.06 2.97 4.19 0.30 7.16 表 2 混合酶比例对Englyst法测定结果的影响
Table 2 Effect of mixed enzyme ratio on the determination results of Englyst method
混合酶比例(AMY:AMG) RDS(%) SDS(%) RS(%) 20:1 20.68±0.19c 73.03±0.58a 6.29±0.17a 15:1 24.97±0.21b 70.87±0.51b 4.16±0.12b 10:1 29.49±0.25a 68.38±0.51c 2.13±0.05c 7.5:1 29.80±0.27a 68.06±0.51c 2.14±0.08c 5:1 30.06±0.32a 67.75±0.43c 2.19±0.08c 注:不同小写字母表示各组存在显著差异,P<0.05,下同。 表 3 混合酶添加量对Englyst法测定结果的影响
Table 3 Effect of mixed enzyme addition on the determination results of Englyst method
混合酶添加量 RDS(%) SDS(%) RS(%) AMY(600 U)+AMG(60 U) 17.52±0.08d 48.85±0.29d 33.63±0.49a AMY(1800 U)+AMG(180 U) 21.87±0.20c 56.71±0.37c 21.42±0.25b AMY(3600 U)+AMG(360 U) 29.49±0.25a 68.38±0.47a 2.13±0.05d AMY(4800 U)+AMG(480 U) 29.26±0.28b 68.24±0.43b 2.50±0.09c 表 4 混合酶pH对Englyst法测定结果的影响
Table 4 Effect of mixed enzyme pH on the determination results of Englyst method
混合酶pH RDS(%) SDS(%) RS(%) 5.2 19.35±0.17c 60.32±0.30c 20.33±0.11a 6.0 29.49±0.25a 68.38±0.47b 2.13±0.05c 6.9 26.08±0.31b 69.35±0.39a 4.57±0.05b 表 5 原料预处理对Englyst法测定结果的影响
Table 5 Effect of raw material pretreatment on the determination results of Englyst method
原料预处理方式 RDS(%) SDS(%) RS(%) 糊化 41.56±0.30a 57.39±0.38b 1.05±0.02b 不糊化 29.49±0.25b 68.38±0.47a 2.13±0.05a 表 6 AOAC法、Englyst法及改进后的Englyst法测定结果比较
Table 6 Comparison of determination results of AOAC method, Englyst method and Englyst improved method
测定方法 RS含量(%) 变异系数(%) AOAC法 2.02±0.06b 2.97 Englyst法 4.19±0.30a 7.16 改进后的Englyst法 2.13±0.05b 2.35 -
[1] 芦鑫, 张晖, 姚惠源. 不同提取方法对粳米淀粉结构的影响[J]. 食品科学,2008,29(1):102−106. [LU Xin, ZHANG Hui, YAO Huiyuan. Effects of different extraction methods on the structure of japonica rice starch[J]. Food Science,2008,29(1):102−106. [2] REBEIRA S P, PRASANTHA B D R, JAYATILAKE D V, et al. A comparative study of dietary fiber content, in vitro starch digestibility and cooking quality characteristics of pigmented and non-pigmented traditional and improved rice[J]. Food Research International,2022,157:111389. doi: 10.1016/j.foodres.2022.111389
[3] CHENG Z H, LI J N, QIAO D L, et al. Microwave reheating enriches resistant starch in cold-chain cooked rice: A view of structural alterations during digestion[J]. International Journal of Biological Macromolecules,2022,208:80−87. doi: 10.1016/j.ijbiomac.2022.03.034
[4] ZHENG J, HUANG S, ZHAO R Y, et al. Effect of four viscous soluble dietary fibers on the physicochemical, structural properties, and in vitro digestibility of rice starch: A comparison study[J]. Food Chemistry,2021,362:130181. doi: 10.1016/j.foodchem.2021.130181
[5] BIAN J L, REN G L, FANG-FU X U, et al. Comparison of grain yield and quality of different types of japonica rice cultivars in the northern Jiangsu plain, China[J]. Journal of Integrative Agriculture,2021,20(8):2065−2076. doi: 10.1016/S2095-3119(20)63348-2
[6] 丁国华, 白良明, 孙世臣, 等. 黑龙江省国审水稻品种龙稻115的选育[J]. 中国种业,2020,05:61−62. [DING Guohua, BAI Liangming, SUN Shichen, et al. Breeding of Longdao 115, a national approved rice variety in Heilongjiang Province[J]. China seed industry,2020,05:61−62. [7] 米红波, 邓婷月, 李毅, 等. 抗性淀粉的消化特性及其在食品中的应用[J]. 食品与生物技术学报,2021,40(9):9−15. [MI Hongbo, DENG Tingyue, LI Yi, et al. Digestive characteristics of resistant starch and its application in food[J]. Journal of Food and Biotechnology,2021,40(9):9−15. [8] 张婧婷. 抗性淀粉的类型及其制备技术研究进展[J]. 现代面粉工业,2021,35(6):26−33. [ZHANG Jingting. Research progress on types and preparation technology of resistant starch[J]. Modern Flour Industry,2021,35(6):26−33. doi: 10.3969/j.issn.1674-5280.2021.06.007 [9] YI X, LI C. Main controllers for improving the resistant starch content in cooked white rice[J]. Food Hydrocolloids,2022,122:107083. doi: 10.1016/j.foodhyd.2021.107083
[10] GUO Y X, ZHANG W H, SUN Y S, et al. Asymmetrical flow field-flow fractionation combined with liquid chromatography enables rapid, quantitative, and structurally informative detection of resistant starch[J]. Microchemical Journal,2022,181:107787. doi: 10.1016/j.microc.2022.107787
[11] HE H, CHI C D, XIE F W, et al. Improving the in vitro digestibility of rice starch by thermomechanically assisted complexation with guar gum[J]. Food Hydrocolloids,2020,102:105637. doi: 10.1016/j.foodhyd.2019.105637
[12] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition,1992,46:S33−S50.
[13] BERRY C S. Resistant starch: formation and measurement of starch that survives exhaustive digestion with amylolytic enzymes during the determination of dietary fibre[J]. Journal of Cereal Science,1986,4(4):301−314. doi: 10.1016/S0733-5210(86)80034-0
[14] BJORCK I, NYMAN M, PEDERSEN B, et al. On the digestibility of starch in wheat bread-studies in vitro and in vivo[J]. Journal of Cereal Science,1986,4:1−11. doi: 10.1016/S0733-5210(86)80002-9
[15] GONI I, GARCIA-DIZ L, MANAS E, et al. Analysis of resistant starch: a method for foods and food products[J]. Food Chemistry,1996,56(4):445−449. doi: 10.1016/0308-8146(95)00222-7
[16] CHAMP M. Determination of resistant starch in foods and food products: interlaboratory study[J]. European Journal of Clinical Nutrition,1992,46(2):51−62.
[17] AOAC. Resistant starch in starch and plant materials[S]. AOAC Official Method, 2002.
[18] ZHANG Z N, ZHANG M Q, ZHANG B, et al. Radio frequency energy regulates the multi-scale structure, digestive and physicochemical properties of rice starch[J]. Food Bioscience,2022,47:101616. doi: 10.1016/j.fbio.2022.101616
[19] YOU H, LIANG C, ZHANG O L, et al. Variation of resistant starch content in different processing types and their starch granules properties in rice[J]. Carbohydrate Polymers,2022,276:118742. doi: 10.1016/j.carbpol.2021.118742
[20] 芦俊峰, 吴建美, 尹幸念, 等. 马铃薯抗性淀粉对T2DM调节作用的研究进展[J]. 华南国防医学杂志,2022,36(4):316−319. [LU Junfeng, WU Jianmei, YIN Xingnian, et al. Research progress of potato resistant starch in regulating T2DM[J]. South China Journal of Defense Medicine,2022,36(4):316−319. [21] 郑宝东, 王琦, 郑亚凤, 等. 抗性淀粉的生物学功效及在食品加工中的应用[J]. 食品科学技术学报,2015,33(5):1−7. [ZHENG Baodong, WANG Qi, ZHENG Yafeng, et al. Biological efficacy of resistant starch and its application in food processing[J]. Journal of Food Science and Technology,2015,33(5):1−7. [22] 严梅荣. 抗性淀粉测定方法的研究进展[J]. 食品科学,2006(4):251−254. [YAN Meirong. Research progress on determination methods of resistant starch[J]. Food Science,2006(4):251−254. doi: 10.3321/j.issn:1002-6630.2006.04.063 [23] 任娜梅, 马蓁, 胡新中. 抗性淀粉体外分析方法的优劣势比较及研究进展[J]. 中国粮油学报,2020,35(11):169−178. [REN Namei, MA Zhen, HU Xinzhong. Comparison of advantages and disadvantages of in vitro analysis methods of resistant starch and research progress[J]. Chinese Journal of Grain and Oil,2020,35(11):169−178. [24] 周毅. 浅谈酶促反应方法与影响酶促反应速度的因素[J]. 中国卫生标准管理,2014,5(23):71−72. [ZHOU Yi. Brief discussion on enzymatic reaction methods and factors affecting enzymatic reaction speed[J]. China Health Standard Management,2014,5(23):71−72. [25] 苑晓云, 曹庆芹, 秦岭, 等. 板栗抗性淀粉测定方法的优化[J]. 北京农学院学报,2017,32(3):38−41. [YUAN Xiaoyun, CAO Qingqin, QIN Ling, et al. Optimization of determination method of chestnut resistant starch[J]. Journal of Beijing Agricultural University,2017,32(3):38−41. [26] 李爱萍, 唐书泽, 张志森, 等. 大米抗性淀粉定量测定方法比较研究[J]. 食品工业科技,2006(1):195−197. [LI Aiping, TANG Shuze, ZHANG Zhisen, et al. Comparative study on quantitative determination methods of rice resistant starch[J]. Food Industry Science and Technology,2006(1):195−197. doi: 10.3969/j.issn.1002-0306.2006.01.064 [27] 师德强, 吴光, 李检秀, 等. α-淀粉酶Amy7C及其突变体最适pH值的定量预测[J]. 广西科学,2014,21(6):664−670. [SHI Deqiang, WU Guang, LI Jianxiu, et al. α-Quantitative prediction of optimum pH value of amylase Amy 7C and its mutants[J]. Guangxi Science,2014,21(6):664−670. doi: 10.3969/j.issn.1005-9164.2014.06.017 [28] MCCLEARY B V. Measurement of resistant starch and incorporation of resistant starch into dietary fibre measurements[M]. Resistant Starch, 2013: 131-144.
[29] 范媛媛, 马青, 谭梅青, 等. 天然抗性淀粉测定方法的优化[J]. 现代食品科技,2013,29(5):1036−1039,960. [FAN Y Y, MA Q, TAN M Q, et al. Optimization of determination method of natural resistant starch[J]. Modern Food Technology,2013,29(5):1036−1039,960. [30] 熊春红, 谢明勇, 陈钢. 抗性淀粉研究综述[J]. 天然产物研究与开发,2007,19:708−717, 661. [XIONG Chunhong, XIE Mingyong, CHEN Gang. Review on research of resistant starch[J]. Research and Development of Natural Products,2007,19:708−717, 661. doi: 10.3969/j.issn.1001-6880.2007.04.040 [31] 周颖, 邹彦平, 姜元荣, 等. 抗性淀粉测定方法探讨及预处理对宜糖米抗性淀粉质量分数的影响[J]. 食品与生物技术学报,2017,36(4):416−419. [ZHOU Ying, ZOU Yanping, JIANG Yuanrong, et al. Discussion on the determination method of resistant starch and the effect of pretreatment on the mass fraction of resistant starch in sugar suitable rice[J]. Journal of Food and Biotechnology,2017,36(4):416−419. -
期刊类型引用(3)
1. 贾健辉,窦博鑫,高嫚,张楚佳,刘颖,张娜. 染料木素对α-葡萄糖苷酶的抑制及分子机制. 食品工业科技. 2025(05): 63-71 .  本站查看
本站查看
2. 张楚佳,贾健辉,高嫚,王泽冉,刘颖,窦博鑫,张娜. 3种物理方法制备抗性粳米淀粉的结构与物化特性. 中国食品学报. 2025(01): 193-207 .  百度学术
百度学术
3. 高嫚,贾健辉,张楚佳,张智,刘颖,窦博鑫,张娜. 粳米重组米的制备工艺优化及性能研究. 食品工业科技. 2024(05): 169-176 .  本站查看
本站查看
其他类型引用(2)











 下载:
下载:
 下载:
下载:



