Research Progress on Extraction, Separation, Purification and Detection Technology of Limonins in Citrus
-
摘要: 柑橘是世界第一大类水果,每年有大量的柑橘加工副产品产生,这些副产品中含有丰富的类柠檬苦素化合物,具有抗肿瘤、抗炎、抗病毒等多种生理作用,已被应用于食品、医药和农业等领域。开发高效的类柠檬苦素提取、分离纯化技术,研发快速的类柠檬苦素分析检测方法,有着重要的理论和实践价值。本文介绍了柑橘中类柠檬苦素结构特征及含量,重点综述了类柠檬苦素的提取、分离纯化及检测技术。总结发现新兴技术如超声辅助、超临界流体提取类柠檬苦素的提取效率较好,联合应用大孔树脂吸附、高速逆流色谱、制备型高效液相色谱法分离效果好。在检测技术方面,液相色谱是柑橘中类柠檬苦素使用最广泛的分析方法,可以准确检测出柑橘中所含类柠檬苦素的种类和含量,但高效、绿色、快速的前处理技术和便捷、高通量的检测技术还有待开发。本文为柑橘中类柠檬苦素的深入研究和综合开发利用提供参考,为促进柑橘副产物资源的利用提供依据。Abstract: Citrus is the largest fruit in the world, and a large number of citrus processing by-products are produced every year. These by-products are rich in limonoids, which have many physiological functions such as anti-tumor, anti-inflammatory and anti-virus, and have been used in food, medicine and agriculture. It is of great theoretical and practical value to develop efficient extraction, separation and purification technology of limonoids, and to develop rapid analysis and detection methods of limonoids. In this article, the structural characteristics and content of limonoids in citrus are introduced, and the extraction, separation, purification and detection techniques of limonoids are emphatically summarized. It is found that emerging technologies such as ultrasonic-assisted and supercritical fluid extraction has better extraction efficiency, and the combination of macroporous resin adsorption, high-speed countercurrent chromatography and preparative high-performance liquid chromatography has better separation effect. In terms of detection technology, liquid chromatography is the most widely used analytical method for limonoids in citrus, which can accurately detect the types and contents of limonoids in citrus. However, efficient, green and rapid pretreatment technology and convenient and high-throughput detection technology need to be developed. This paper would provide a reference for the in-depth research and comprehensive development and utilization of limonoids in citrus, and provide a basis for promoting the utilization of citrus by-product resources.
-
Keywords:
- citrus /
- limonoids /
- extraction /
- separation and purification /
- detection
-
柑橘类水果是全球广泛种植、加工和消费的最大类水果之一,每年全世界柑橘类水果废弃物的数量超过约1.1~1.2亿吨,几乎占新鲜水果的一半[1]。柑橘类水果废物(果皮、种子为主)中富含类柠檬苦素化合物,是柑橘重要的生理功能活性成分之一[2]。类柠檬苦素化合物是由一组高含氧的四环三萜衍生物组成的次生代谢产物,因具有明显苦味影响水果和果汁口感,早期的研究集中在通过减少这些次生代谢产物,以降低苦味来提高果汁的商业价值[3]。近十几年对类柠檬苦素的研究表明,该类化合物具有多种生理活性,如抗癌、抗神经源性疾病、抗菌、消炎止痛等[4-5],这些研究为类柠檬苦素的药物和营养食品的合理开发利用提供数据支撑。目前寻求新的类柠檬苦素提取、分离纯化技术将工艺过程中的溶剂消耗、时间消耗和样品损失降低到最小,以使传统的提取技术小型化和自动化是诸多学者的主要研究目标。本文综述了国内外有关柑橘柠檬苦素类化合物的提取、分离纯化及检测技术方面的研究进展,并对未来的研究开发提出展望。
1. 柑橘中类柠檬苦素的结构特征与含量
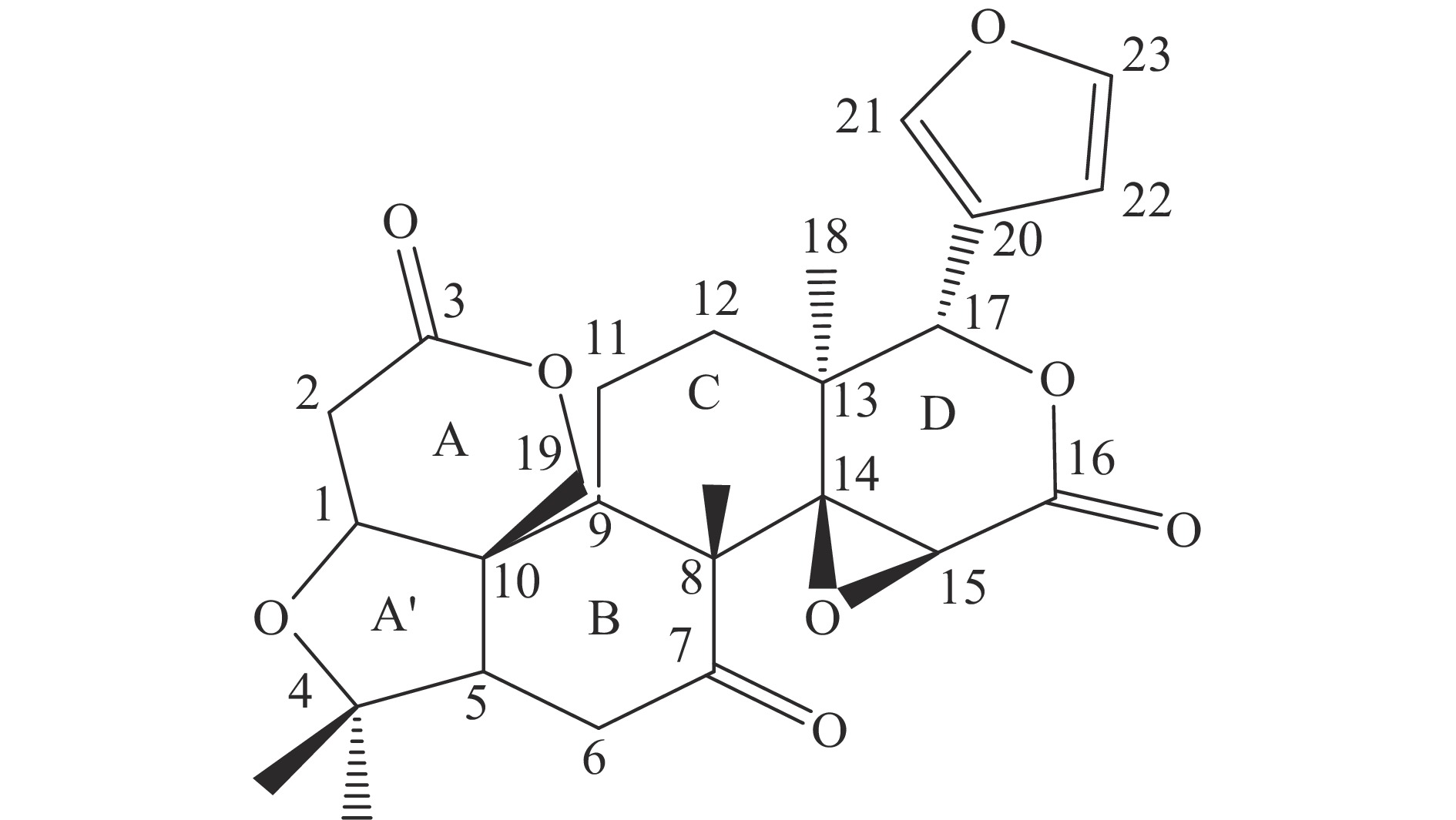
柠檬苦素类化合物是一类含有4,4,8-三甲基-17-呋喃基甾体基本骨架结构的化合物[6]。
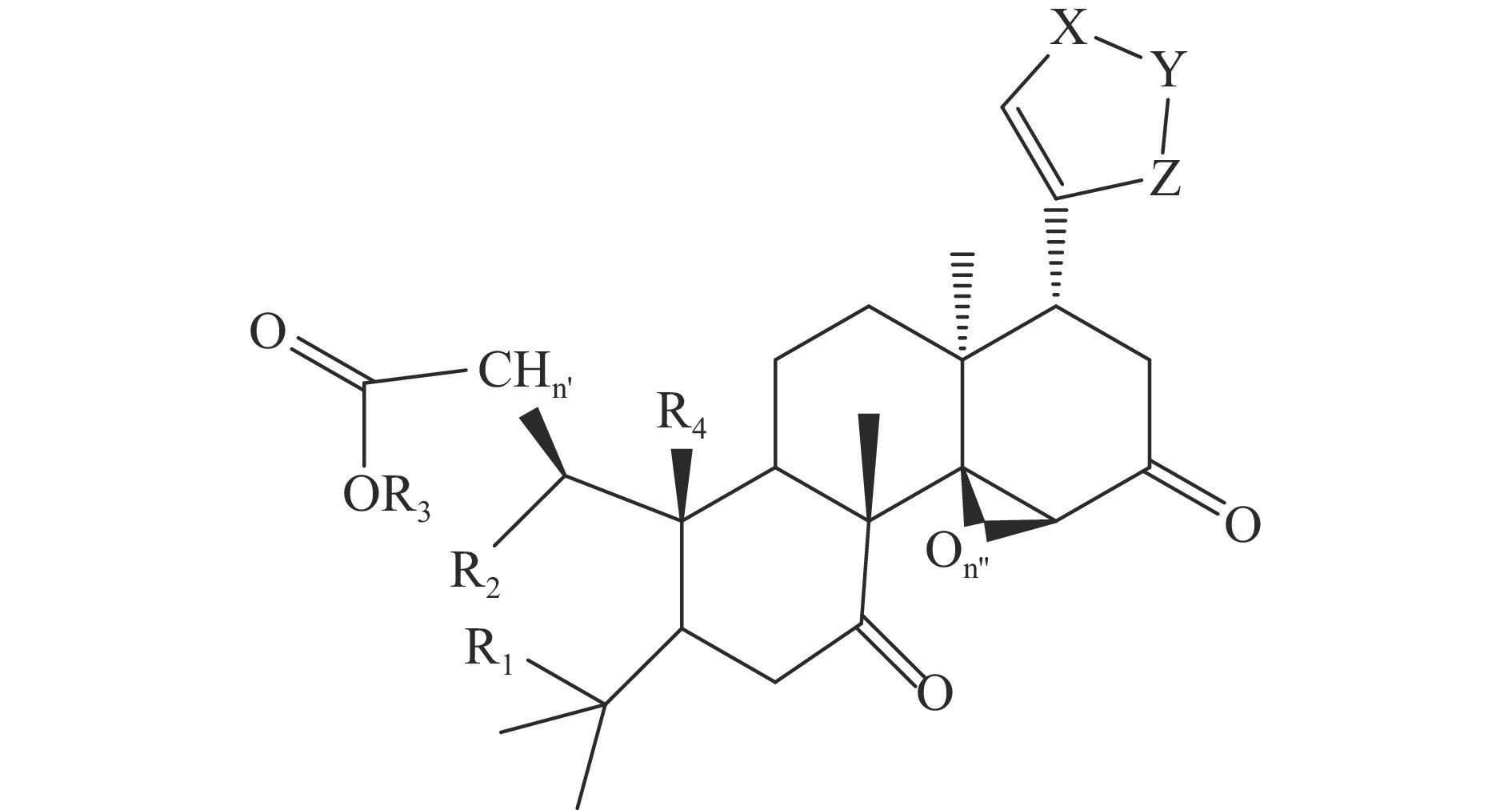
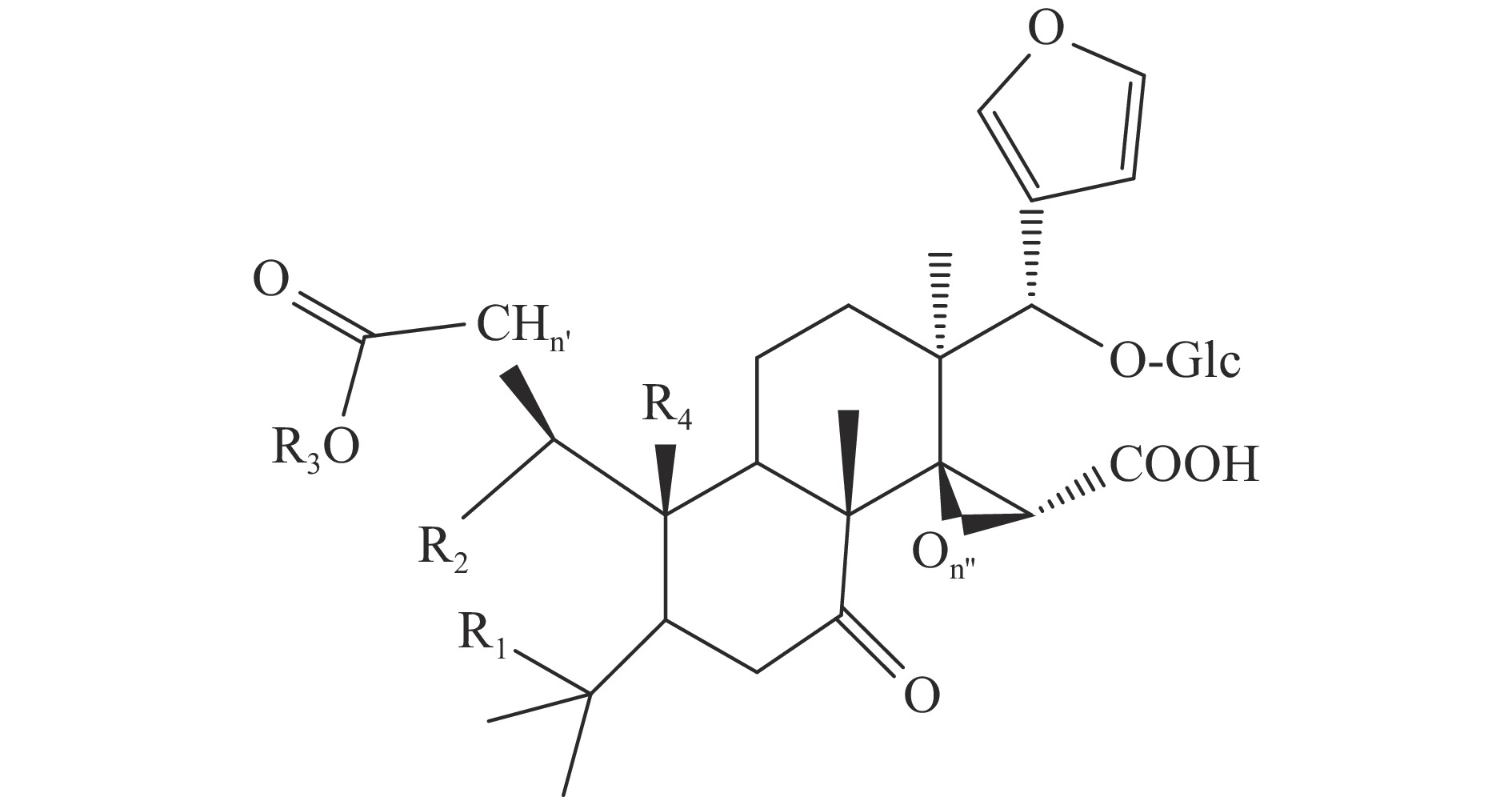
柑橘中类柠檬苦素的特征在于在C-17位有连接到D环的呋喃环,C-3、C-4、C-7、C-16和C-17位具有含氧官能团[4],如图1。目前从柑橘属植物中发现超过55种柠檬苦素类苷元和18种柠檬苦素配糖体,前者主要在种子中形成,后者在果实成熟过程中形成。对于大多数柑橘属植物,柠檬苦素是含量最多的苷元,其次是诺米林,其主要的柠檬苦素类苷元化合物(1~10),结构和来源详见表1和图2。葡萄糖苷类化合物(11~15)是由柠檬苦素苷元在17位和1分子葡萄糖以糖苷键的形式结合而形成的[7],其结构和来源详见图3和表2,其中柠檬苦素葡糖糖苷是最具代表性的葡萄糖苷[8]。
表 1 柠檬苦素苷元类化合物(1~10)主要结构和来源Table 1. Main structure and sources of limonin aglycones (1~10)编号 名称 n’ n’’ 分子式 R1 R2 R3 R4 X Y Z 来源 参考文献 1 柠檬苦素 2 1 C26H30O8 O 成环 O-CH=CH 葡萄柚 [13] 2 诺米林 2 1 C28H34O9 与R3成环 OAc 与 R1成环 H O-CH=CH 宫内伊予柑 [14] 3 黄柏酮 1 1 C26H30O7 与R3成环 − 与 R1成环 H O-CH=CH 柠檬 [15] 4 宜昌橙苦素 2 1 C26H32O9 OH OH 成环 O-CH=CH 柠檬、葡萄柚 [16] 5 异黄柏酮酸 2 1 C26H32O8 O H H O-CH=CH 葡萄柚 [17] 6 脱乙酰诺米林 2 1 C26H32O8 与R3成环 OH 与 R1成环 H O-CH=CH 香橼 [18] 7 柠檬酸 2 1 C26H30O10 O 成环 CO-O-CHOH 日本夏橙 [19] 8 异柠檬酸 2 1 C26H30O10 O 成环 CHOH-O-CO 宽皮柑桔 [4] 9 枸橼苦素 2 1 C28H34O11 与R3成环 OAc 与 R1成环 H CHOH-O-CO 佛手 [20] 10 脱氧柠檬苦素 2 0 C26H30O7 O 成环 O O-CH=CH 葡萄柚 [21] 表 2 葡萄糖苷类柠檬苦素化合物(11~15)主要结构和来源Table 2. Main structure and sources of limonoids β-D-glucosides (11~15)柑橘中类柠檬苦素化合物含量受品种、组织部位、成熟度等因素的影响。LU等[9]测定五种常见柑橘水果(甜橙、柑橘、西柚、柚子、柠檬)种子中类柠檬苦素含量,结果表明甜橙、柑橘、西柚、柚子、柠檬中类柠檬苦素占种子干重含量分别为0.10%~2.36%、0.01%~1.76%、1.50%~3.09%、1.22%、0.53%~1.90%,柚类种子可作为类柠檬苦素的重要来源。RUSSO等[10]报道了香柠檬不同部位中类柠檬苦素含量,结果表明种子中含量最高,为6828.1 mg/kg,其次是果皮和果肉,果汁中最少,该结论符合通常在柑橘果实中不同部位,类柠檬苦素含量呈种子>果皮>汁胞的这一规律。柑橘类柠檬苦素在幼果中主要以苷元存在,随着果实成熟发育,苷元含量逐渐减少。HUANG等[11]报道了Orah品种诺米林含量在整个果实成熟阶段发生明显变化,在落果期和幼果期含量最低,分别为0.42和0.45 mg/10 g,果实膨大期达18.88 mg/100 g,而成熟期时未检测出诺米林。HUANG等[12]研究龙安柚、脆香甜柚、白市柚和琯溪柚四种柚子在果实不同生长发育阶段类柠檬苦素的积累,结果表明,琯溪柚、龙安柚和脆香甜柚果实汁囊中柠檬苦素含量在花后90~170 d之间增加,在花后170 d时达到最大,分别为65.5、85.4和116 μg/g,花后170~230 d之间下降,白市柚汁囊中柠檬苦素含量的变化则时在果实发育早期(花后90 d)最高,为66.7 μg/g,显著高于其他品种,诺米林含量的变化与柠檬苦素含量的变化趋势几乎相同。
2. 柠檬苦素类化合物的提取
柑橘及其废弃物是柠檬苦素类化合物的重要来源。从天然样品中提取柠檬苦素类化合物的现代技术主要包括超声辅助提取、超临界流体提取、双水相提取等,与传统的溶剂浸提、热回流提取、索氏提取等相比,溶剂的消耗减少,操作时间缩短。此外,由于柑橘成分复杂,为确保柠样品中柠檬苦素类化合物的含量,在进行分析前需要经过目标分析物的预富集处理,以提高检测灵敏度。目前类柠檬苦素检测前处理技术有固相萃取、分子印迹技术、QuEChERS等技术。表3概述了现代提取技术在提取类柠檬苦素方面的优缺点比较。
表 3 柠檬苦素类化合物的现代提取技术的优缺点Table 3. Advantages and disadvantages of modern extraction techniques of limonoids提取纯化技术 优点 缺点 参考文献 UAE 与传统方式相比溶剂、时间减少,提取率提高,易于使用 仍需较大的溶剂量和较长的时间,当操作温度较高时,类柠檬苦素
可能分解,从而降低了类柠檬苦素的提取率和生物活性[24−25,35] SFE 操作简单、分离容易、提取速度快、提取物纯度高、
活性成分不易被破坏生产设备复杂昂贵,需定期维护,成本相对较高 [26−27] ATPE 溶剂、样品和时间消耗少,对环境友好 试剂成本较高,需开发简便易行的试剂回收方法,选择性低 [29−30] SPE 与其他技术相比提取时间较少,溶剂和样品消耗较少,
可用吸附剂具多样性,自动化程度高,重现性好,
富集系数高当固相材料的堵塞时会导致操作步骤复杂,
进而增加时间和溶剂消耗[31−32] MIT 在应用于复杂食品基质中时,能准确、快速、稳定、
重复地富集目标成分聚合时易受溶剂影响,不适用于如水等强极性溶剂的功能单体 [33,36] QuEChERS 操作简单、快速、有效、价格便宜 基质效应明显、净化效果还需提升 [34,37] 2.1 类柠檬苦素提取工艺技术
2.1.1 超声辅助提取
超声辅助萃取(Ultrasound assisted extraction,UAE)是广泛应用于从食物和植物样品中提取化学成分的技术。超声波能够破坏植物材料组织,导致细胞释放出生物活性化合物,使活性成分更容易扩散和溶解在溶剂中[23]。尤文挺等[24]通过正交实验确定了从高橙皮中提取柠檬苦素的最佳超声条件:声强0.2556 W/cm2,乙醇体积分数70%,料液比30:1,提取时间30 min,柠檬苦素提取率为60.90 mg/100 g。HONG等[25]从柠檬籽中提取类柠檬苦素,基于三因素三水平的响应面试验优化超声辅助提取,获得最佳提取工艺为提取时间56 min,温度56 ℃,超声波功率300 W,类柠檬苦素得率为6.02%±0.07%(n=3),且具有显著的抗氧化活性。超声辅助提取方法简单、快速,但仍需较大的溶剂量和较长的时间,与其他技术联用,控制提取的功率和时间效果会更好。
2.1.2 超临界流体提取
超临界流体提取(Supercritical fluid extraction,SFE)作为一种简单的绿色提取方法已被应用于类柠檬苦素的提取,常用的溶剂为安全、无毒、价格便宜的CO2。JUN等[26]采用超临界二氧化碳-乙醇体系从葡萄柚糖浆中提取柠檬苦素类糖苷的最佳超临界条件为:压力48.3 MPa、温度50 ℃、10%乙醇、时间40 min、流速为5.0 L/min的条件下,产量为0.61 mg/g。孟鹏[27]通过响应面法优化了超临界CO2(乙醇为夹带剂)萃取金柑果实中的柠檬苦素的工艺条件及参数,柠檬苦素得率(1.19 g/kg)略低于二氯甲烷超声波法,但优于乙醇水浴和超声波法。压力和温度是影响超临界CO2提取的决定性因素,HERRERA等[28]比较了SFE和有机溶剂提取枳实种子中柠檬苦素效果,甲醇和丙酮提取8 h产率分别为1.650 mg/g和0.779 mg/g,而在压力44.2 MPa,温度333 K的条件下,柠檬苦素产率为0.388 mg/g,其产率低于有机溶剂提取,但只需2 h。SFE可以在短时间内实现快速提取,但在提取过程中需施加高温高压,易导致类柠檬苦素氧化。因此,尽管超临界萃取技术有其他技术无法比拟的优点,但该技术的推广还需解决如何提高稳定性差成分的提取率和降低成本、适应工业化生产的问题。
2.1.3 双水相提取
双水相提取(Aqueous two-phase extraction,ATPE)是根据待萃取物进入两水相间,在各种力的共同作用下,其有效成分在两相中进行选择性分配达到分离效果。目前已被应用于从天然样品中提取柠檬苦素的双水相体系有乙醇-硫酸铵双水相体系、离子液体双水相体系。汪建红等[29]采用乙醇-硫酸铵双水相体系从柠檬籽中提取柠檬苦素,60%乙醇,12 g硫酸铵,料液比1:15 g/mL,60 ℃下提取3 h,平均得率为1.2535%。汪开拓等[30]比较了四种弱酸性离子液体双水相体系从柠檬籽中提取柠檬苦素的效果,发现采用1.50 mol/L[TMG][Cl]/1.35 mol/L NaH2PO4,响应面优化试验后,柠檬苦素提取率为12.126 mg/g,萃取率达97.59%。双水相体系仍然需要使用大量有机溶剂,造成一定的环境污染,随着人们对绿色化学的需求,研究微型化绿色环保的提取体系将是一个发展趋势。
2.2 类柠檬苦素检测前处理技术
2.2.1 固相萃取
固相萃取(Solid-phase extraction,SPE)是一种可替代的液液萃取(Liquid-liquid extraction,LLE)方法,能最大限度地减少溶剂和样品的消耗。NI等[31]采用Sep-Pak C18短柱萃取果汁中柠檬苦素、柚皮素-7-O-葡萄糖苷、柚皮苷和柚皮素,比较纯乙腈和60%乙腈的洗脱效果,结果表明浓度范围为60%~100%的2 mL的乙腈溶液足以洗脱1 mL果汁中的所有分析物,结合HPLC成功测定四种化合物,其中柠檬苦素检出限和定量限分别为95.1和317 ng/mL,回收率为102.4%~103.9%。LIU等[32]使用Oasis HLB 30 mg小柱对人体尿样进行固相萃取,可除去盐和其他杂质干扰,结合LC-MS/MS成功处理和测定了尿样中的柠檬苦素,获得了非常低的定量限,为0.0783 ng/mL,该方法灵敏、快速、选择性高,可应用于生物化学和临床研究。目前,越来越多的新型固相吸附材料被开发出来,提高固相萃取的效率,使固相萃取的应用更加广泛,但更高效、更适用于类柠檬苦素的高选择性固相吸附剂材料有待进一步研究。
2.2.2 分子印迹技术
分子印迹技术(Molecular imprinting technology,MIT)是以特定的目标分子为模板,在合适的条件下合成对该分子具有特异性的聚合物。ZHANG等[33]以甲基丙烯酸和乙二醇二甲基丙烯酸酯分别用作功能单体和交联剂,制备了基于二氧化硅粒子的分子印迹聚合物,首次将其应用于吸附柠檬汁中的类柠檬苦素,结果表明,该聚合物对类柠檬苦素有良好的选择性识别作用,柠檬苦素、诺米林和黄柏酮的吸附量分别是20.88、1.87、4.31 mg/g,是表面分子非印迹聚合物吸附容量的3.3倍,经HPLC分析能有效地将柠檬汁中的柠檬苦素提取出来,该分子印迹聚合物也可用于其他柑橘类果汁的脱苦吸附。
2.2.3 QuEChERS法
近年新发展起来的QuEChERS法是一种快速、简单、有效、价格低廉的前处理方法,广泛应用于农兽药残留、毒素等物质的检测,应用于植物活性成分的富集和提取较少。钟世欢等[34]用900 mg MgSO4、450 mg PSA和50 mg GCB作净化剂,有效去除了柚类果实中糖、有机酸、色素等干扰杂质,结合HPLC同时测定柚类果实中柠檬苦素、诺米林、黄柏酮3种柠檬苦素类化合物,该方法在0.10~200 μg/mL线性良好,相对标准偏差为1.0%~2.1%。QuEChERS法操作简单,溶剂使用量少,检测成本较低,但是易受基质效应干扰,还需提升净化效果。
3. 柠檬苦素类化合物的分离纯化
3.1 重结晶
重结晶是纯化固体有机化合物的传统方法,影响结晶法分离纯化的主要因素是样品的溶解度和溶剂的种类。HONG等[25]采用超声辅助提取柠檬中的类柠檬苦素,得到柠檬苦素(715.40 mg/g)、诺米林(277.20 mg/g)和黄柏酮(47.40 mg/g),通过重结晶得到纯度为93.21%和82.53%的柠檬苦素和诺米林。重结晶纯化物质的得率较低,有时为了提高纯化得率,会采用分布结晶法。邹连生[38]采用分步结晶法纯化类柠檬苦素粗品,三次纯化后柠檬苦素的回收率比普通结晶提高了15.6%。重结晶的方法是分离纯化的重要方法,具有方便快捷、易操作、溶剂少的优点,但对被提纯物纯度有要求。
3.2 大孔树脂吸附
大孔吸附树脂是具有多孔性和较大比表面积的一类新型非离子高分子化合物,可以从溶液中选择地吸附有机物。庞立等[39]研究D-101大孔树脂对柠檬苦素的纯化富集效果,采用80%乙醇溶液作洗脱剂,柠檬苦素的吸附率达88.53%,得率82.75%,HPLC测得其含量达到92.79%,并且在重复过程中树脂的吸附性能未明显降低。DANDEKAR等[40]建立了一种用异丙苯磺酸钠水溶助长剂结合聚苯乙烯吸附树脂(SP700)来提取和纯化柠檬苦素类化合物的新方法,先用水洗涤柱以除去水溶助长剂,然后用甲醇-水梯度洗脱,分离得到脱乙酰诺米林酸葡萄糖苷、脱乙酰诺米林和柠檬苦素。除此之外,XIANG等[41]还分别考察了HZ-816、D4020和Amberlite XAD-16 HP三种树脂对类柠檬苦素粗提物的吸附效果,75%乙醇洗脱的HZ-816和80%乙醇洗脱的D4020对柠檬苦素和诺米林的解吸能力优于Amberlite XAD-16 HP,通过HZ-816和D4020树脂的纯化步骤之后,柠檬苦素的纯度分别为19.80%和7.75%,诺米林的纯度分别为61.70%和18.23%,但D4020会同时富集较多的黄酮类化合物,增加杂质的含量,从而增加纯化难度。大孔树脂吸附量大、选择性好、易再生、成本低,通常与其他方法配合使用才能获得理想的纯化效果。
3.3 高速逆流色谱
高速逆流色谱法(High-speed counter-current chromatography,HSCCC)是一种连续高效的液-液的色谱技术,可以消除传统色谱柱中使用的固体载体基质对样品的不可逆吸附损失[42]。XIANG等[41]采用正己烷:正丁醇:水(2:1.3:1.3)体系分离纯化类柠檬苦素,该体系具有良好的K值(Klimonin=0.8,Knomilin=1.8)。除了溶剂体系是影响HSCCC效果的关键因素,色谱柱的转速、流动相的流速等也会影响分离效果。在此基础上考察了上相流速、仪器转速和下相流速,得到柠檬苦素的含量大于95%,并且分离时间较短。HSCCC具有连续、快速、回收率高等优点,能够同时实现样品多种成分的有效分离与纯化,且获得的单体纯度较高,但溶剂体系的筛选比较耗时耗力,因此还需对溶剂体系的选择建立完善的理论指导体系。
3.4 制备型高效液相色谱
制备型高效液相色谱(Preparative high performance liquid chromatography,PHPLC)是通过高负载、高分离度的制备柱对目标成分进行分离,与常规方法相比,它是一种高效快速的分离技术[43]。XIANG等[41]通过半制备型高效液相色谱(Semi-pre-HPLC)对经HSCCC未能成功分离的类柠檬苦素流出液进行分离,选择乙腈-甲醇-水(30:25:45,v/v/v)作流动相,以8 mL/min流速进样,在45 min内成功分离出含量达95%的异黄柏酮酸和诺米林。PHPLC具有制备量大、产率和纯度高、分离速度快、仪器自动化程度高等优点,可在工业化的大规模生产中发挥重要作用。这些用于柑橘中类柠檬苦素分离纯化的方法优缺点的比较见表4。
4. 柠檬苦素类化合物的检测技术
4.1 光谱技术
柠檬苦素结构中含呋喃环,可以在4-二甲氨基苯甲醛(DMAB)或艾利希Ehrlich试剂作用下生成的络合物显色,通常在490~530 nm下进行检测,此方法可简单快速地测定类柠檬苦素化合物的总量[44]。ABBASI等[45]用此方法测定浓缩橙汁中的柠檬苦素含量,线性范围为9.9~21.8 mg/mL,回收率范围为95.62%~101.79%。其他光谱技术,如荧光检测、红外吸收光谱和核磁共振光谱,也已应用到柑橘中类柠檬苦素化合物的分析检测。荧光技术是在一定条件下将样品与硫酸反应,460 nm处测定,但该方法对实验条件要求严格,不适于推广使用[46]。Lan等[47]用手持式和台式近红外光谱仪测定柑橘种子中柠檬苦素、诺米林和黄柏酮,UHPLC-MS/MS进行验证,手持式不能准确地定量柠檬苦素,但与台式相似,均可定量诺米林和黄柏酮,这为检测柠檬苦素类化合物提供了高通量、低成本的现场分析技术。核磁共振光谱技术(Nuclear magnetic resonance spectroscopy,NMR)由于受到成本、复杂性、通量以及对相对纯分析物的要求限制,通常会与其他技术联用[48]。表5为柑橘中柠檬苦素类化合物检测方法的汇总。
表 5 柑橘中柠檬苦素类化合物检测方法的汇总Table 5. Summary of determination methods of limonoids in citrus检测方法 基质 目标物 线性范围 检出限 定量限 回收率(%) 流动相 分析柱 参考文献 分光光度
计法浓缩橙汁 柠檬苦素 9.9~21.8 mg/mL − − 95.62~101.79 − − [45] 荧光
技术葡萄柚汁 柠檬苦素 − 0.5 mg/L − − − − [46] HPLC 柑橘
种子7种类柠檬苦素 0.5~8 μg 0.25~50 μg − − 3 mmol/L磷酸-乙腈,梯度洗脱 HPLC,C18
(250 mm×4.6 mm,5 μm)[49] 柑橘
果汁诺米林、脱乙酰诺米林
诺米林酸、脱乙酰诺米林酸、黄柏酮25~5000 mg/L 50 ng 250 ng 50 mg/L:
95.0~106.5
100 mg/L:96.7~103.7乙腈-4 mmol/L甲酸水溶液,等度洗脱 HPLC,Phenomenex Phenosphere-
Next-5µ-Phenyl column
(150 mm×2.0 mm)[50] 柚子
果实柠檬苦素、诺米林 0.015~0.5 mg/mL − 0.003 mg/mL 97.2~101.2 乙腈-水,
等度洗脱HPLC,ZORBAX Eclipse
plus C18 column
(4.6 mm×100 mm);
UPLC-MS/MS,
HSS T3
(2.1 mm×50 mm,
1.8 μm)[51] 柑橘果实 柠檬苦素、诺米林 1~400 μg/mL 柠檬苦素:0.25 μg/mL
诺米林:0.30 μg/mL柠檬苦素:0.80 μg/mL
诺米林:1.00 μg/mL98.2~106.9 乙腈-磷酸缓冲液(pH3.5),
等度洗脱HPLC,C18
(4.6 mm×150 mm,
5 μm)[11] 金柑
果实柠檬苦素
诺米林柠檬苦素:1~1780 μg/mL
诺米林:1~1720 μg/mL柠檬苦素1.65 μg/g
诺米林
1.28 μg/g− 杆檬苦素:97.19~100.06
诺米林:95.35~99.83乙腈-水,
等度洗脱UPLC,Acquity UPLC BEH C18
(100 mm×2.1 mm,
1.7 μm)[52] LC-MS 柑桔
果汁柠檬苦素、诺米林 APCI-LC-MS:
120 pg~6 ng
ESI-LC-MS:
240 pg~6 ngAPCI LC-MS:60 pg
ESI LC-MS: 180 pg− − 甲酸-甲醇,梯度洗脱 APCI- LC-MS(正相和反相)和ESI LC-MS(反相),Luna 3 µm column
(150 mm×2 mm)[53] 柠檬籽 柠檬苦素、诺米林、黄柏酮 柠檬苦素:200~400 μg/mL 诺米林:200~400 μg/mL
黄柏酮:
100~200 μg/mL− − − 水-乙腈,
等度洗脱UPLC-TOF/MS,C18
(2.1 mm×50 mm,1.7 μm);
HPLC-UV,Inertsil ODS-3 column
(4.6 mm×250 mm,
5 μm)[25] 四种柑橘籽 柠檬苦素、诺米林 柠檬苦素:10~500 µg/mL
诺米林:10~200 µg/mL柠檬苦素:4.3 µg/mL
诺米林:4.59 µg/mL柠檬苦素:12.98 µg/mL
诺米林:13.94 µg/mL98.2~106.9 0.1% 甲酸乙腈-0.1% 甲酸水,梯度洗脱 HPLC-HR-MS,C18
(RP-18e 50–4.6 mm)[2] 传感
器法柑橘汁 柠檬苦素 15~50 mg/L − − − − − [54] SFC 11种柑橘精油 12种类柠檬素苷元 0.5~21.2 mg/L 0.006 mg/L 0.021 mg/L 98 − SFC-APCI-QqQ-MS,
Ascentis™ C18
(250 mm×4.6 mm,5 μm )[55] 4.2 液相色谱
在液相色谱(HPLC)分析中,色谱柱的类型、填料和长度是影响分离的重要因素。类柠檬苦素的检测多采用C18作为分离填料,连接紫外、二极管矩阵检测器等。随着分析技术的发展,超高效液相色谱(UHPLC)已经广泛应用于类柠檬苦素的快速分离,如孟鹏等[52]使用ACQUITY UPLCTMBEH C18柱(2.1 mm×100 mm,1.7 μm)在3 min内分离出金柑中柠檬苦素和诺米林,检出限分别为1.65、1.28 μg/g。如表3所示,最常用的流动相为乙腈-水、乙腈-磷酸水。绍金良等[56]用乙腈-磷酸水作流动相, 类柠檬苦素分离良好, 基线平稳、峰型合适。此外,为了进一步提高目标物的分离度,还会采用三相流动相梯度。CHEN等[57]采用乙腈-四氢呋喃-水(17.5:17.5:65)在207 nm测定柠檬苦素,分离效果好,1.0~50.0 mg/L线性关系良好,LOD为0.07 μg,回收率为98.69%,该方法能简便快速测定柑橘类果汁中柠檬苦素。
4.3 液质联用
液质联用(Liquid chromatography-massspectrometry,LC-MS)结合了液相色谱的强大分辨能力和质谱的检测特异性,满足复杂化学或生物基质中低水平的类柠檬苦素进行量化的要求[32,58],已成为目前的主流分析方法。液相色谱质谱联用仪测定类柠檬苦素主要采用大气压化学电离离子源(Atmospheric pressure chemical ionization,APCI)和电喷雾离子源(Electrospray ionization,ESI)[59-60],通常APCI用于鉴定柠檬苦素糖苷配基,而ESI用于鉴定柠檬苦素配糖体[61]。MANNERS等[53]采用APCI-LC-MS(正相和反相)和ESI-LC-MS(反相)快速检测柑橘汁中柠檬苦素类化合物,结果表明:APCI检测限接近60 pg,其灵敏度是传统紫外方法检测方法的30倍以上,ESI的灵敏度是HPLC-UV的10倍以上,正相和反相两种模式下,准确度差别不大。类柠檬苦素的LC-MS分析鉴定,易基质干扰,通常使用相似基质或内标物来校正定量。
4.4 传感器法
近年来,传感器因其高灵敏度、简单性和低廉的价格而越来越受欢迎,尤其是在生物样品中。微生物生物传感器因其操作简单、便携性、灵敏、特异和使用快速而受关注,如PURI等[54]采用恶臭假单胞菌G7菌株营养缺陷型突变体(lim+)突变体开发一种电流型微生物生物传感器测定金橘汁中柠檬苦素,将柠檬苦素作为呼吸作用的碳源,在温度30 ℃、pH6.5和浓度106 CFU/mL的对数中期细胞条件下,柠檬苦素在15~50 mg/L范围内呈线性,并且可以重复使用。有机电化学晶体管(Organic electrochemical transistor,OECT)在低电压和低功耗下展现出了优越的信号放大能力被广泛用于生物和化学传感[62]。SARAF等[63]开发了一种以二氧化铈纳米颗粒功能化的OECT作为传感器来检测超低浓度的柠檬苦素,具有较高灵敏度,LOD为10 nmol/L,响应时间以s为单位。DAS等[64]开发了一种简单、快速、现场量化检测柠檬苦素的方法,该方法中采用复合材料硅酸镁-聚乙烯(MgSiO3·xH2OPVA)的电容式传感器从柑橘柠檬汁中选择性吸附柠檬苦素来量化柠檬苦素,将灵敏度提高到2.392±0.3 µF/mg·L−1,响应时间约6 s,可循环2次使用,采用HPLC验证仅存在0~12%的偏差。
4.5 其他检测方法
除了上述方法外,类柠檬苦素化合物的检测技术还有超临界流体色谱法(Supercritical fluid chromatography, SFC),毛细管电泳(Capillary electrophoresis, CE)。SFC是以超临界流体流动相结合特定的检测器对样品中类柠檬苦素进行检测的一种色谱方法,与HPLC相似,需要对色谱柱、流动相等进行优化以获得更好的分离效果,与质谱联用可以显著提高灵敏度,弥补SFC的不足。ZOCCALI等[55]对不同柑橘精油中的柠檬苦素苷元和柠檬苦素进行定量定性分析,建立SFC-APCI-QqQ方法,使用极少量的有机溶剂甲醇(170 μL),约7 min进行快速表征,经验证LOD和LOQ分别为0.006和0.021 mg/L,检测范围为0.5~21.2 mg/L,获得较高灵敏度,鉴定出了12种柠檬苦素类化合物。CE具有分析速度快、溶剂消耗少,对样品前处理要求较低的特点。BRADDOCK等[65]采用CE测定柑橘组织中柠檬苦素,以极少量的葡萄柚籽为原料,只经过滤处理,在75 mmol硼砂,pH=9.4,15 kV,25 °C,50 µm×57 cm石英柱,214 nm条件下,5 s压力进样,检出限为2.00±0.08 mg/L。这些用于类柠檬苦素测定的技术的优缺点的比较总结于表6。
表 6 柠檬苦素类化合物的检测技术的优缺点Table 6. The advantages and disadvantages of determination techniques of limonoids检测技术 优点 缺点 参考文献 分光光度计 快速、操作简单 准确性和可靠性受到限制,需要额外的样品处理来形成有色络合物 [45] 荧光技术 灵敏度高于紫外分光光度法和薄层色谱法 缺乏选择性,要求基质简单,需要经过反应,处理繁琐 [46,66] NMR 无需标准物质,能快速获得结果,易于使用,可用于固体和液体样品,只需简单的预处理 缺乏灵敏度、存在一定的准确度问题、仪器成本高、样品应稳定、
不易挥发且无水[48,67] IR 高且恒定的分辨率,简单、快速、无损测量,无需标准品 样品应稳定、不挥发且不含水,在检测前需进行建模,数据的获取耗时耗力 [68] HPLC 分离柱和测器具多样性、高灵敏度和准确度,能同时进行类柠檬苦素的分离和定量 与分光光度计法相比,使用较复杂、昂贵、需要大量有机溶剂、不环保、对类柠檬苦素的吸附取决于所用的柱、流动相取决于所用的柱和所研究类柠檬苦素的极性 [11,69] SFC 能实现快速分离,减少溶剂用量,高效环保 对流动相要求高,需要特殊材料维持高压操作条件,仪器成本较高 [55] LC-MS 具有进样量小、分析范围广、灵敏度高、分析速度快,自动化程度高 样品前处理复杂、分析时间长、要求苛刻,仪器结构复杂,维护费用高 [32,70] 传感器法 高灵敏度、简单易操作和成本低 检测种类和数量单一,寿命较短,检测数据稳定性、重现性有待提高 [63-64] 5. 结论与展望
本文综述了柑橘中柠檬苦素类化合物的分析方法,包括提取、分离纯化和检测方法。传统的提取纯化方法虽成本低廉,不需要复杂的设备,但是处理时间长、有机溶剂使用量大、回收率低、稳定性差,无法满足检测需求。尽管新型的萃取技术已被开发并应用于类柠檬苦素的提取,但更高效、快速、绿色、节能的前处理技术仍有待开发。随着新型吸附剂,如分子印迹聚合物、纳米材料等新材料的发展,研究高效的固相萃取方法对柠檬苦素类化合物的提取具有广阔的前景。同时,近年来用于测定类柠檬苦素的主要分析方法是HPLC,这是因为其具有高灵敏度、高选择性和高通量的优点,但前处理繁琐、分析时间长、仪器维护费用高,仅限于实验室,难以应用于现场分析。生物传感器和电化学传感器为类柠檬苦素的检测开辟了低成本、快速和更高灵敏度的道路,因此在现有分析方法的基础上,建立方便、快捷、灵敏的检测方法是类柠檬苦素化合物分析未来的发展方向。
-
表 1 柠檬苦素苷元类化合物(1~10)主要结构和来源
Table 1 Main structure and sources of limonin aglycones (1~10)
编号 名称 n’ n’’ 分子式 R1 R2 R3 R4 X Y Z 来源 参考文献 1 柠檬苦素 2 1 C26H30O8 O 成环 O-CH=CH 葡萄柚 [13] 2 诺米林 2 1 C28H34O9 与R3成环 OAc 与 R1成环 H O-CH=CH 宫内伊予柑 [14] 3 黄柏酮 1 1 C26H30O7 与R3成环 − 与 R1成环 H O-CH=CH 柠檬 [15] 4 宜昌橙苦素 2 1 C26H32O9 OH OH 成环 O-CH=CH 柠檬、葡萄柚 [16] 5 异黄柏酮酸 2 1 C26H32O8 O H H O-CH=CH 葡萄柚 [17] 6 脱乙酰诺米林 2 1 C26H32O8 与R3成环 OH 与 R1成环 H O-CH=CH 香橼 [18] 7 柠檬酸 2 1 C26H30O10 O 成环 CO-O-CHOH 日本夏橙 [19] 8 异柠檬酸 2 1 C26H30O10 O 成环 CHOH-O-CO 宽皮柑桔 [4] 9 枸橼苦素 2 1 C28H34O11 与R3成环 OAc 与 R1成环 H CHOH-O-CO 佛手 [20] 10 脱氧柠檬苦素 2 0 C26H30O7 O 成环 O O-CH=CH 葡萄柚 [21] 表 2 葡萄糖苷类柠檬苦素化合物(11~15)主要结构和来源
Table 2 Main structure and sources of limonoids β-D-glucosides (11~15)
表 3 柠檬苦素类化合物的现代提取技术的优缺点
Table 3 Advantages and disadvantages of modern extraction techniques of limonoids
提取纯化技术 优点 缺点 参考文献 UAE 与传统方式相比溶剂、时间减少,提取率提高,易于使用 仍需较大的溶剂量和较长的时间,当操作温度较高时,类柠檬苦素
可能分解,从而降低了类柠檬苦素的提取率和生物活性[24−25,35] SFE 操作简单、分离容易、提取速度快、提取物纯度高、
活性成分不易被破坏生产设备复杂昂贵,需定期维护,成本相对较高 [26−27] ATPE 溶剂、样品和时间消耗少,对环境友好 试剂成本较高,需开发简便易行的试剂回收方法,选择性低 [29−30] SPE 与其他技术相比提取时间较少,溶剂和样品消耗较少,
可用吸附剂具多样性,自动化程度高,重现性好,
富集系数高当固相材料的堵塞时会导致操作步骤复杂,
进而增加时间和溶剂消耗[31−32] MIT 在应用于复杂食品基质中时,能准确、快速、稳定、
重复地富集目标成分聚合时易受溶剂影响,不适用于如水等强极性溶剂的功能单体 [33,36] QuEChERS 操作简单、快速、有效、价格便宜 基质效应明显、净化效果还需提升 [34,37] 表 4 柠檬苦素类化合物的分离纯化方法的优缺点
Table 4 The advantages and disadvantages of separation and purification methods of limonoids
表 5 柑橘中柠檬苦素类化合物检测方法的汇总
Table 5 Summary of determination methods of limonoids in citrus
检测方法 基质 目标物 线性范围 检出限 定量限 回收率(%) 流动相 分析柱 参考文献 分光光度
计法浓缩橙汁 柠檬苦素 9.9~21.8 mg/mL − − 95.62~101.79 − − [45] 荧光
技术葡萄柚汁 柠檬苦素 − 0.5 mg/L − − − − [46] HPLC 柑橘
种子7种类柠檬苦素 0.5~8 μg 0.25~50 μg − − 3 mmol/L磷酸-乙腈,梯度洗脱 HPLC,C18
(250 mm×4.6 mm,5 μm)[49] 柑橘
果汁诺米林、脱乙酰诺米林
诺米林酸、脱乙酰诺米林酸、黄柏酮25~5000 mg/L 50 ng 250 ng 50 mg/L:
95.0~106.5
100 mg/L:96.7~103.7乙腈-4 mmol/L甲酸水溶液,等度洗脱 HPLC,Phenomenex Phenosphere-
Next-5µ-Phenyl column
(150 mm×2.0 mm)[50] 柚子
果实柠檬苦素、诺米林 0.015~0.5 mg/mL − 0.003 mg/mL 97.2~101.2 乙腈-水,
等度洗脱HPLC,ZORBAX Eclipse
plus C18 column
(4.6 mm×100 mm);
UPLC-MS/MS,
HSS T3
(2.1 mm×50 mm,
1.8 μm)[51] 柑橘果实 柠檬苦素、诺米林 1~400 μg/mL 柠檬苦素:0.25 μg/mL
诺米林:0.30 μg/mL柠檬苦素:0.80 μg/mL
诺米林:1.00 μg/mL98.2~106.9 乙腈-磷酸缓冲液(pH3.5),
等度洗脱HPLC,C18
(4.6 mm×150 mm,
5 μm)[11] 金柑
果实柠檬苦素
诺米林柠檬苦素:1~1780 μg/mL
诺米林:1~1720 μg/mL柠檬苦素1.65 μg/g
诺米林
1.28 μg/g− 杆檬苦素:97.19~100.06
诺米林:95.35~99.83乙腈-水,
等度洗脱UPLC,Acquity UPLC BEH C18
(100 mm×2.1 mm,
1.7 μm)[52] LC-MS 柑桔
果汁柠檬苦素、诺米林 APCI-LC-MS:
120 pg~6 ng
ESI-LC-MS:
240 pg~6 ngAPCI LC-MS:60 pg
ESI LC-MS: 180 pg− − 甲酸-甲醇,梯度洗脱 APCI- LC-MS(正相和反相)和ESI LC-MS(反相),Luna 3 µm column
(150 mm×2 mm)[53] 柠檬籽 柠檬苦素、诺米林、黄柏酮 柠檬苦素:200~400 μg/mL 诺米林:200~400 μg/mL
黄柏酮:
100~200 μg/mL− − − 水-乙腈,
等度洗脱UPLC-TOF/MS,C18
(2.1 mm×50 mm,1.7 μm);
HPLC-UV,Inertsil ODS-3 column
(4.6 mm×250 mm,
5 μm)[25] 四种柑橘籽 柠檬苦素、诺米林 柠檬苦素:10~500 µg/mL
诺米林:10~200 µg/mL柠檬苦素:4.3 µg/mL
诺米林:4.59 µg/mL柠檬苦素:12.98 µg/mL
诺米林:13.94 µg/mL98.2~106.9 0.1% 甲酸乙腈-0.1% 甲酸水,梯度洗脱 HPLC-HR-MS,C18
(RP-18e 50–4.6 mm)[2] 传感
器法柑橘汁 柠檬苦素 15~50 mg/L − − − − − [54] SFC 11种柑橘精油 12种类柠檬素苷元 0.5~21.2 mg/L 0.006 mg/L 0.021 mg/L 98 − SFC-APCI-QqQ-MS,
Ascentis™ C18
(250 mm×4.6 mm,5 μm )[55] 表 6 柠檬苦素类化合物的检测技术的优缺点
Table 6 The advantages and disadvantages of determination techniques of limonoids
检测技术 优点 缺点 参考文献 分光光度计 快速、操作简单 准确性和可靠性受到限制,需要额外的样品处理来形成有色络合物 [45] 荧光技术 灵敏度高于紫外分光光度法和薄层色谱法 缺乏选择性,要求基质简单,需要经过反应,处理繁琐 [46,66] NMR 无需标准物质,能快速获得结果,易于使用,可用于固体和液体样品,只需简单的预处理 缺乏灵敏度、存在一定的准确度问题、仪器成本高、样品应稳定、
不易挥发且无水[48,67] IR 高且恒定的分辨率,简单、快速、无损测量,无需标准品 样品应稳定、不挥发且不含水,在检测前需进行建模,数据的获取耗时耗力 [68] HPLC 分离柱和测器具多样性、高灵敏度和准确度,能同时进行类柠檬苦素的分离和定量 与分光光度计法相比,使用较复杂、昂贵、需要大量有机溶剂、不环保、对类柠檬苦素的吸附取决于所用的柱、流动相取决于所用的柱和所研究类柠檬苦素的极性 [11,69] SFC 能实现快速分离,减少溶剂用量,高效环保 对流动相要求高,需要特殊材料维持高压操作条件,仪器成本较高 [55] LC-MS 具有进样量小、分析范围广、灵敏度高、分析速度快,自动化程度高 样品前处理复杂、分析时间长、要求苛刻,仪器结构复杂,维护费用高 [32,70] 传感器法 高灵敏度、简单易操作和成本低 检测种类和数量单一,寿命较短,检测数据稳定性、重现性有待提高 [63-64] -
[1] NEELIMA M, KAVITA S, MUKTY S, et al. Bio-sorbents, industrially important chemicals and novel materials from citrus processing waste as a sustainable and renewable bioresource: A review[J]. Journal of Advanced Research,2020,23:61−82. doi: 10.1016/j.jare.2020.01.007
[2] MONTOYA C, GONZÁLEZ L, PULIDO S, et al. Identification and quantification of limonoid aglycones content of citrus seeds[J]. Revista Brasileira de Farmacognosia,2019,29(6):710−714. doi: 10.1016/j.bjp.2019.07.006
[3] MANNERS G D. Citrus limonoids: Analysis, bioactivity, and biomedical prospects[J]. Journal of Agricultural and Food Chemistry,2007,55(21):8285−8294. doi: 10.1021/jf071797h
[4] SHI Y, ZHANG Y, LI H, et al. Limonoids from citrus: Chemistry, anti-tumor potential, and other bioactivities[J]. Journal of Functional Foods,2020,75:104213. doi: 10.1016/j.jff.2020.104213
[5] GUALDANI R, CAVALLUZZI M, LENTINI G, et al. The chemistry and pharmacology of citrus limonoids[J]. Molecules,2016,21(11):1530. doi: 10.3390/molecules21111530
[6] DONALD E C, OPENDER K, MURRAY B I, et al. Biological activity of limonoids from the rutales[J]. Phytochemistry,1992,31(2):377−394. doi: 10.1016/0031-9422(92)90003-9
[7] 张群琳, 何雅静, 李甜, 等. 柠檬苦素类化合物抗病原体作用及机制研究进展[J]. 天然产物研究与开发,2020,32(6):1078−1085. [ZHANG Qunlin, HE Yajing, LI Tian, et al. Research progress of anti-pathogen effect and mechanism of limonin compounds[J]. Research and Development of Natural Products,2020,32(6):1078−1085. ZHANG Qunlin, HE Yajing, LI Tian, et al. Research progress of anti-pathogen effect and mechanism of limonin compounds[J]. Research and Development of Natural Products, 2020, 32(6): 1078-1085.
[8] ROSA T, MONICA ROSA L, FRANCESCO M. An overview on chemical aspects and potential health benefits of limonoids and their derivatives[J]. Critical Reviews in Food Science and Nutrition,2013,54(2):225−250.
[9] LU X, ZHAO C, SHI H, et al. Nutrients and bioactives in citrus fruits: Different citrus varieties, fruit parts, and growth stages[J]. Critical Reviews in Food Science and Nutrition,2021,63(14):2018−2041.
[10] RUSSO M, ARIGÒ A, CALABRÒ M L, et al. Bergamot (Citrus bergamia Risso) as a source of nutraceuticals: Limonoids and flavonoids[J]. Journal of Functional Foods,2016,20:10−19. doi: 10.1016/j.jff.2015.10.005
[11] HUANG S, LIU X, XIONG B, et al. Variation in limonin and nomilin content in citrus fruits of eight varieties determined by modified HPLC[J]. Food Science and Biotechnology,2019,28(3):641−647. doi: 10.1007/s10068-018-0509-8
[12] HUANG S, DONG T, XIONG B, et al. Variation in the content and composition of limonoids in fruits of four pomelo varieties during fruit development: The natural debittering process in pomelo fruits[J]. Journal of Food Composition and Analysis,2021,100:103928. doi: 10.1016/j.jfca.2021.103928
[13] DREYER D L. Citrus bitter principles-II: Application of NMR to structural and stereochemical problems[J]. Tetrahedron,1965,21(1):75. doi: 10.1016/S0040-4020(01)82204-3
[14] ISHII T, OHTA H, NOGATA Y, et al. Limonoids in seeds of Iyo tangor (Citrus iyo Hort. ex Tanaka)[J]. Food Science and Technology Research,2003,9(2):162−164. doi: 10.3136/fstr.9.162
[15] KIM J, JAYAPRAKASHA G K, PATIL B S. Obacunone exhibits anti-proliferative and anti-aromatase activity in vitro by inhibiting the p38 MAPK signaling pathway in MCF-7 human breast adenocarcinoma cells.[J]. Biochimie,2014,105:36−44. doi: 10.1016/j.biochi.2014.06.002
[16] OZAKI Y, FONG C H, HERMAN Z, et al. Limonoid glucosides in citrus seeds[J]. Agricultural and Biological Chemistry,1991,55(1):137−141.
[17] BENNETT R D, HASEGAWA S, HERMAN Z. Glucosides of acidic limonoids in citrus[J]. Phytochemistry,1989,28(10):2777−2781. doi: 10.1016/S0031-9422(00)98087-7
[18] HAMDAN D, EL-READI M Z, TAHRANI A, et al. Secondary metabolites of ponderosa lemon (Citrus pyriformis) and their antioxidant, anti-Inflammatory, and cytotoxic activities[J]. Zeitschrift Fur Naturforschung Section C-A Journal of Biosciences,2011,66(7−8):385−393. doi: 10.1515/znc-2011-7-810
[19] MAKITA T, OHTA K, NAKABAYASHI T. New limonoid from the seeds of citrus-natsudaidai[J]. Agricultural and Biological Chemistry,1980,44(3):693−694.
[20] CHAN Y Y, LI C H, SHEN Y C, et al. Anti-inflammatory principles from the stem and root barks of citrus medica[J]. Chemical& Pharmaceutical Bulletin,2010,58(1):61−65.
[21] BENNETT R D, HASEGAWA S. 7α-Oxygenated limonoids from the rutaceae[J]. Phytochemistry, 1982: 2235-2349.
[22] HASEGAWA S, BENNETT R D, HERMAN Z, et al. Limonoid glucosides in citrus[J]. Phytochemistry, 1989: 1717-1720.
[23] CHAVES J O, de SOUZA M C, DA SILVA L C, et al. Extraction of flavonoids from natural sources using modern techniques[J]. Frontiers in Chemistry, 2020, 8:507887.
[24] 尤文挺, 江天, 王洒, 等. 高橙皮中柠檬苦素超声提取工艺的优化[J]. 中成药,2020,42(5):1301−1303. [YOU W T, JIANG T, WANG S, et al. Optimization of ultrasonic extraction technology of limonin from high orange peel[J]. Chinese Patent Medicine,2020,42(5):1301−1303. YOU W T, JIANG T, WANG S, et al. Optimization of ultrasonic extraction technology of limonin from high orange peel [J]. Chinese Patent Medicine, 2020, 42(5): 1301-1303.
[25] HONG Y, CHAO W, SHITING D, et al. Optimization of ultrasonic-assisted extraction and UPLC-TOF/MS analysis of limonoids from lemon seed[J]. LWT-Food Science and Technology,2017,84:135−142. doi: 10.1016/j.lwt.2017.05.059
[26] YU J, DEEPAK V D, ROMEO T T, et al. Supercritical fluid extraction of limonoid glucosides from grapefruit molasses[J]. Journal of Agricultural and Food Chemistry,2006,54(16):6041−6045. doi: 10.1021/jf060382d
[27] 孟鹏. 金柑柠檬苦素类化合物的提取纯化、结构鉴定及生物活性研究[D]. 福州: 福建农林大学, 2013. MENG Peng. Extraction, purification, structure identification and biological activity of limonoids from kumquat[D]. Fuzhou: Fujian Agriculture and Forestry University, 2013.
[28] CASTILLO-HERRERA G A, FARÍAS-ÁLVAREZ L J, GARCÍA-FAJARDO J A, et al. Bioactive extracts of Citrus aurantifolia swingle seeds obtained by supercritical CO2 and organic solvents comparing its cytotoxic activity against L5178Y leukemia lymphoblasts[J]. The Journal of Supercritical Fluids,2015,101:81−86. doi: 10.1016/j.supflu.2015.02.026
[29] 汪建红, 廖立敏, 匡玉兰. 柠檬籽中柠檬苦素的双水相提取方法研究及工艺改进[J]. 食品工业,2016,37(11):111−113. [WANG Jianhong, LIAO Limin, KUANG Yulan. Study on aqueous two-phase extraction method of limonin from lemon seeds and process improvement[J]. Food Industry,2016,37(11):111−113. WANG Jianhong, LIAO Limin, KUANG Yulan. Study on aqueous two-phase extraction method of limonin from lemon seeds and process improvement [J]. Food Industry, 2016, 37(11): 111-113.
[30] 汪开拓, 蒋永波, 王富敏, 等. 柠檬籽粒中柠檬苦素离子液体双水相提取体系的优化与抗氧化活性分析[J]. 核农学报,2020,34(11):2507−2518. [WANG Kaituo, JIANG Yongbo, WANG Fumin, et al. Optimization of aqueous two-phase extraction system of limonin in lemon seeds and analysis of antioxidant activity[J]. Journal of Nuclear Agriculture,2020,34(11):2507−2518. WANG Kaituo, JIANG Yongbo, WANG Fumin, et al. Optimization of aqueous two-phase extraction system of limonin in lemon seeds and analysis of antioxidant activity[J]. Journal of Nuclear Agriculture, 2020, 34(11): 2507-2518.
[31] NI H, ZHANG S F, GAO Q F, et al. Development and evaluation of simultaneous quantification of naringin, prunin, naringenin, and limonin in citrus juice[J]. Food Science and Biotechnology,2015,24(4):1239−1247. doi: 10.1007/s10068-015-0159-z
[32] LIU S, ZHANG J, ZHOU L, et al. Quantification of limonin in human urine using solid-phase extraction by LC-MS/MS[J]. Journal of Chromatography B,2012,907:163−167. doi: 10.1016/j.jchromb.2012.08.038
[33] ZHANG J W, TAN L, ZHANG Y Z, et al. Debittering of lemon juice using surface molecularly imprinted polymers and the utilization of limonin[J]. Journal of Chromatography B,2018,1104:205−211.
[34] 钟世欢, 陈青俊, 王京, 等. QuEChERS-HPLC测定柚类果实中柠檬苦素类化合物[J]. 食品与发酵工业,2022,48(4):261−265. [ZHONG Shihuan, CHEN Qingjun, JING Wang, et al. Determination of limonoids in pomelo fruits by QuEChERS-HPLC[J]. Food and Fermentation Industry,2022,48(4):261−265. ZHONG Shihuan, CHEN Qingjun, JING Wang, et al. Determination of limonoids in pomelo fruits by QuEChERS-HPLC [J]. Food and Fermentation Industry, 2022, 48(4): 261-265.
[35] 郁林娜, 程盛勇, 付洋, 等. 响应面法优化橘核中3种柠檬苦素类成分的超声辅助提取工艺[J]. 食品研究与开发,2019,40(5):133−137. [YU Linna, CHENG Shengyong, FU Yang, et al. Response surface methodology (RSM) was used to optimize the ultrasonic-assisted extraction process of three limonoids from orange kernels[J]. Food Research and Development,2019,40(5):133−137. YU Linna, CHENG Shengyong, FU Yang, et al. Response surface methodology (RSM) was used to optimize the ultrasonic-assisted extraction process of three limonoids from orange kernels[J]. Food Research and Development, 2019, 40(5): 133-137.
[36] 李珍柱, 苏学素, 焦必宁, 等. 柑橘中类黄酮的前处理及检测技术研究进展[J]. 食品工业科技,2018,39(4):329−336. [LI Zhenzhu, SU Xuesu, JIAO Bining, et al. Research progress of pretreatment and detection technology of flavonoids in citrus[J]. Food Industry Science and Technology,2018,39(4):329−336. LI Zhenzhu, SU Xuesu, JIAO Bining, et al. Research progress of pretreatment and detection technology of flavonoids in citrus[J]. Food Industry Science and Technology, 2018, 39(4): 329-336.
[37] 李俊超, 秦学磊, 吴圣江, 等. QuEChERS前处理方法在食品检测中的应用进展[J]. 食品研究与开发,2021,42(24):206−212. [LI Junchao, QIN Xuelei, WU Shengjiang, et al. Application progress of QuEChERS pretreatment method in food detection[J]. Food Research and Development,2021,42(24):206−212. LI Junchao, QIN Xuelei, WU Shengjiang, et al. Application progress of QuEChERS pretreatment method in food detection[J]. Food Research and Development, 2021, 42(24): 206-212.
[38] 邹连生. 柑桔类柠檬苦素的提取、纯化和体外抗肿瘤的研究[D]. 重庆: 西南农业大学, 2001. ZOU Liansheng. Study on extraction, purification and anti-tumor in vitro of citrus limonin[D]. Chongqing: Southwest Agricultural University, 2001.
[39] 庞立, 邓子牛, 刘吉凯, 等. 柑橘柠檬苦素大孔树脂分离纯化方法[J]. 食品科学,2015,36(14):24−28. [PANG Li, DENG Ziniu, LIU Jikai, et al. Separation and purification method of citrus limonin by macroporous resin[J]. Food Science,2015,36(14):24−28. PANG Li, DENG Ziniu, LIU Jikai, et al. Separation and purification method of citrus limonin by macroporous resin [J]. Food Science, 2015, 36(14): 24-28.
[40] DANDEKAR D V, JAYAPRAKASHA G K, PATIL B S. Simultaneous extraction of bioactive limonoid aglycones and glucoside from Citrus aurantium L. using hydrotropy[J]. Z Naturforsch C J Biosci,2008,63(3−4):176−180. doi: 10.1515/znc-2008-3-403
[41] XIANG Y, CAO J, LUO F, et al. Simultaneous purification of limonin, nomilin and isoobacunoic acid from pomelo fruit (Citrus grandis) segment membrane[J]. Journal of Food Science,2014,79(10):C1956−C1963. doi: 10.1111/1750-3841.12581
[42] ZHANG P, ZHU K, ZHANG J, et al. Purification of flavonoids from mulberry leaves via high-speed counter-current chromatography[J]. Processes,2019,7(2):91. doi: 10.3390/pr7020091
[43] GAO D, QUAN C, ZHANG W, et al. Purification of folic acid candidate reference material by preparative high-performance liquid chromatography[J]. Journal of Liquid Chromatography & Related Technologies,2017,40(8):419−427.
[44] NANA O, MOMENI J, BOYOM F F, et al. Microwave-assisted extraction as an advanced technique for optimisation of limonoid yields and antioxidant potential from Trichilia roka (Meliaceae)[J]. Current Research in Green and Sustainable Chemistry,2021,4:100147. doi: 10.1016/j.crgsc.2021.100147
[45] ABBASI S, ZANDI P, MIRBAGHERI E. Quantitation of limonin in Iranian orange juice concentrates using high-performance liquid chromatography and spectrophotometric methods[J]. European Food Research and Technology,2005,221(1−2):202−207. doi: 10.1007/s00217-005-1136-1
[46] FISHER J F. Fluorometric determination of limonin in grapefruit and orange juice[J]. Journal of Agricultural and Food Chemistry,1973,21(6):1109−1110. doi: 10.1021/jf60190a020
[47] LAN Z, ZHANG Y, CHEN X, et al. Efficient detection of limonoid from citrus seeds by handheld NIR: Compared with benchtop NIR[J]. Food Analytical Methods,2022,15(7):1909−1921. doi: 10.1007/s12161-022-02245-y
[48] TONTSA A T, MKOUNGA P, NJAYOU F N, et al. Rubescins A, B and C: New havanensin type limonoids from root bark of Trichilia rubescens (Meliaceae)[J]. Chemical & Pharmaceutical Bulletin,2013,61(11):1178−1183.
[49] VIKRAM A, JAYAPRAKASHA G K, PATIL B S. Simultaneous determination of citrus limonoid aglycones and glucosides by high performance liquid chromatography[J]. Analytica Chimica Acta,2007,590(2):180−186. doi: 10.1016/j.aca.2007.03.029
[50] BREKSA A, KING D, VILCHES A. Determination of citrus limonoid glucosides by high performance liquid chromatography coupled to post-column reaction with ehrlich’s reagent[J]. Beverages,2015,1(2):70−81. doi: 10.3390/beverages1020070
[51] WANG F, YU X, LIU X, et al. Temporal and spatial variations on accumulation of nomilin and limonin in the pummelos[J]. Plant Physiology and Biochemistry,2016,106:23−29. doi: 10.1016/j.plaphy.2016.04.039
[52] 孟鹏, 郑宝东. 超高效液相色谱法快速并同时检测金柑中柠檬苦素和诺米林[J]. 中国食品学报,2013,13(2):177−181. [MENG Peng, ZHENG Baodong. Rapid and simultaneous determination of limonin and nomilin in kumquat by ultra-high performance liquid chromatography[J]. China Journal of Food Science,2013,13(2):177−181. MENG Peng, ZHENG Baodong. Rapid and simultaneous determination of limonin and nomilin in kumquat by ultra-high performance liquid chromatography [J]. China Journal of Food Science, 2013, 13(2): 177-181.
[53] MANNERS G D, BREKSA A P, SCHOCH T K, et al. Analysis of bitter limonoids in citrus juices by atmospheric pressure chemical ionization and electrospray ionization liquid chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2003,51(13):3709−3714. doi: 10.1021/jf021124t
[54] PURI R, MALIK M, GHOSH M. An amperometric biosensor developed for detection of limonin levels in kinnow mandarin juices[J]. Annals of Microbiology,2012,62(3):1301−1309. doi: 10.1007/s13213-011-0376-5
[55] ZOCCALI M, ARIGÒ A, RUSSO M, et al. Characterization of limonoids in citrus essential oils by means of supercritical fluid chromatography tandem mass spectrometry[J]. Food Analytical Methods,2018,11(11):3257−3266. doi: 10.1007/s12161-018-1303-1
[56] 邵金良, 刘兴勇, 王丽, 等. 高效液相色谱法同时测定柠檬中柠檬苦素和诺米林含量[J]. 食品安全质量检测学报,2018,9(13):3309−3314. [SHAO Jinliang, LIU Xingyong, WANG Li, et al. Simultaneous determination of limonin and nomilin in lemon by high performance liquid chromatography[J]. Journal of Food Safety and Quality Inspection,2018,9(13):3309−3314. SHAO Jinliang, LIU Xingyong, WANG Li, et al. Simultaneous determination of limonin and nomilin in lemon by high performance liquid chromatography [J]. Journal of Food Safety and Quality Inspection, 2018, 9(13): 3309-3314.
[57] CHEN J, GAO Y, WU W, et al. Determination of bitter components in citrus juice by high performance liquid chromatography[J]. Se Pu Chinese Journal of Chromatography,2006,24(2):157−160.
[58] LIU S, CHEN P, ZHANG N, et al. Comprehensive characterization of the in vitro and in vivo metabolites of limonin in human samples using LC-Q-TOF/MS[J]. Journal of Chromatography B,2017,1068:226−232.
[59] BRECHT D, UTESCHIL F, SCHMITZ O J. Development of a fast-switching dual (ESI/APCI) ionization source for liquid chromatography/mass spectrometry[J]. Rapid Communications in Mass Spectrometry,2020,34(17).
[60] TIAN Q, SCHWARTZ S J. Mass spectrometry and tandem mass spectrometry of citrus limonoids[J]. Analytical Chemistry (Washington),2003,75(20):5451−5460. doi: 10.1021/ac030115w
[61] ANDREW P B, MARLENE B H, MICHELLE L Y. Liquid chromatography-electrospray ionisation mass spectrometry method for the rapid identification of citrus limonoid glucosides in citrus juices and extracts[J]. Food Chemistry,2009,117(4):739−744. doi: 10.1016/j.foodchem.2009.04.050
[62] ERICA Z, OLLE I. Active materials for organic electrochemical transistors[J]. Advanced Materials,2018,30(44):1800941. doi: 10.1002/adma.201800941
[63] SARAF N, BARKAM S, PEPPLER M, et al. Microsensor for limonin detection: An indicator of citrus greening disease[J]. Sensors and Actuators B:Chemical,2019,283:724−730. doi: 10.1016/j.snb.2018.12.067
[64] DAS S, SAHU P P. A novel electrochemical interdigitated electrodes sensor for limonin quantification and reduction in Citrus limetta juice[J]. Food Chemistry,2022,381:132248. doi: 10.1016/j.foodchem.2022.132248
[65] BRADDOCK R J, BRYAN C R. Extraction parameters and capillary electrophoresis analysis of limonin glucoside and phlorin in citrus byproducts[J]. Journal of Agricultural and Food Chemistry,2001,49(12):5982−5988. doi: 10.1021/jf010737n
[66] BREKSA A P, MANNERS G D. Determination of limonin D-Ring lactone hydrolase activity by solid phase extraction with indirect fluorescence detection[J]. Journal of Agricultural and Food Chemistry,2004,52(12):3772−3775. doi: 10.1021/jf049928r
[67] PARK S, NHIEM N X, SUBEDI L, et al. Isolation of bioactive limonoids from the fruits of Melia azedarach[J]. Journal of Asian Natural Products Research,2020,22(9):830−838. doi: 10.1080/10286020.2019.1666826
[68] QIN S, LÜ C H, WANG Q S, et al. Extraction, identification, and antioxidant property evaluation of limonin from pummelo seeds[J]. Animal Nutrition (Zhongguo xu mu shou yi xue hui),2018,4(3):281−287.
[69] PANAWAN S, VACHIRA C. Microwave-assisted improved extraction and purification of anticancer nimbolide from Azadirachta indica (Neem) leaves[J]. Molecules,2020,25(12):2913. doi: 10.3390/molecules25122913
[70] SHI X, WU Y, LÜ T, et al. A chemometric-assisted LC-MS/MS method for the simultaneous determination of 17 limonoids from different parts of Xylocarpus granatum fruit[J]. Analytical and Bioanalytical Chemistry,2017,409(19):4669−4679. doi: 10.1007/s00216-017-0413-8
-
期刊类型引用(1)
1. 于心雨,胡云霄,魏琳,王舒悦,李珊珊,胡福良. 2023年国内外蜂王浆研究概况. 中国蜂业. 2024(03): 38-49 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



