Determination of Hyaluronic Acid in Dairy Products by Ultra-high Performance Liquid Chromatography-Tandem Mass Spectrometry
-
摘要: 本文建立一种超高效液相色谱-串联质谱(UPLC-MS/MS)测定乳制品中透明质酸含量的分析方法。样品经透明质酸酶降解,乙腈稀释,PRIME HLB固相萃取柱净化,Waters BEH Amide(2.1 mm×100 mm,1.7 μm)酰胺柱分离,以0.2%氨水-乙腈(含0.2%氨水)为流动相梯度洗脱。采用电喷雾离子源负离子模式扫描,多反应监测模式进行检测,外标法定量。结果表明:乳制品中透明质酸在0.5~200 mg/kg添加水平下回收率为91.4%~106.2%,RSD为2.3%~6.7%。方法的定量限为0.5 mg/kg。该方法简单,适用于乳制品中透明质酸的定量检测。应用本方法对市售乳制品中透明质酸进行检测,所测样品符合标准要求。
-
关键词:
- 超高效液相串联质谱法 /
- 乳制品 /
- 透明质酸
Abstract: The approach combining ultra-high performance liquid chromatography with tandem mass spectrometry (UPLC-MS/MS) for determining hyaluronic acid in dairy products was proposed in this study. The samples were degraded by hyaluronidase, diluted with acetonitrile, and then purified by PRIME HLB cartridge. The analysis was conducted on a BEH Amide column (2.1 mm×100 mm, 1.7 μm) by gradient elution using 0.2% concentration of aqueous ammonia solution and acetonitrile (containing 0.2% ammonia) as mobile phases. Qualification was achieved by negative electrospray ionization with multiple reaction monitoring (MRM). Meanwhile, the external standard method for quantitation was applied. In accordance with the results, the recoveries of hyaluronic acid in dairy products were 91.4%~106.2%, and RSDs were 2.3%~6.7% at the addition levels of 0.5~200 mg/kg. Presumably, with a limit of quantification of 0.5 mg/kg, the demonstrated method was easy and feasible for quantifying the hyaluronic acid in dairy products. This method was used to detect commercially dairy products, and the tested samples meet the standard requirements. -
透明质酸(Hyaluronic Acid,HA)是以葡萄糖醛酸和N-乙酰氨基葡萄糖组成的直链高分子酸性多糖,其分子量最高可达107 Da,也是机体内存在量最多,唯一不含硫酸盐基团且不与蛋白质共价结合的糖胺聚糖[1]。为提高水溶性,商品化的HA一般为其钠盐,即透明质酸钠。HA以其独特的分子结构和理化性质,在医药、化妆品、保健品中已有广泛应用[2–6],近年来HA在普通食品中的应用也越来越受到重视[7–9]。2021年1月国家卫生健康委员会批准透明质酸钠用于普通食品中,其中在乳及乳制品中最大使用量为0.2 g/kg[10]。
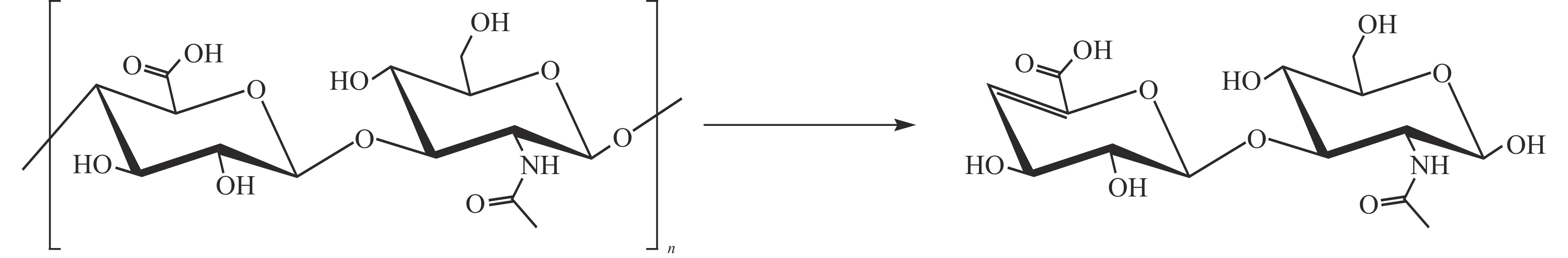
目前HA的主要定量分析方法有分光光度法[11]、薄层色谱法[12]、酶联免疫法[13]、毛细管电泳法[14]、高效液相色谱法[15-16]、质谱法[17-18]等。其中,分光光度法主要用于测定原料中HA的含量,其专属性较差。高效液相色谱法是测定食品及药品中HA的主要方法。由于HA具有不同的分子量分布,分子排阻过滤色谱(size exclusion liquid chromatography,SEC)虽然可直接测定HA,但其对HA的分子量有一定要求。通常HA能够被细菌来源透明质酸酶(Hyaluronidase,HAase)特异性降解为透明质酸不饱和二糖(unsaturated disaccharides of HA,ΔDi-HA)(见图1),以此可以来测定HA的含量[19],但ΔDi-HA的强极性以及较弱的紫外吸收,往往需要使用2-氨基苯甲酰胺(2-aminobenzamide,2-AB)[20]、2-氨基吖啶酮(2-Aminoacridone,AMAC)[21]、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl- 5-pyrazolone,PMP)[22-23]等试剂对ΔDi-HA进行衍生,以提高色谱保留时间和灵敏度。
乳制品基质复杂,含有的大量蛋白质、糖、脂类等物质,易对液相色谱法测定造成干扰;流动相使用的无机酸或高浓度缓冲盐与质谱不兼容,且衍生过程较为繁琐。目前还没有液相色谱串联质谱法测定乳制品中HA的相关报道。本研究着重对分析方法进行改进与优化,建立一种PRIME HLB固相萃取柱净化,超高效液相色谱串联质谱法检测乳制品中HA含量的方法。本文旨在建立一种无需衍生、质谱兼容性良好、灵敏度高的方法,可以应用于乳制品中HA含量的分析检测及质量控制。
1. 材料与方法
1.1 材料与仪器
乳粉、酸奶、鲜牛奶 均购于本地超市;乙腈、乙酸铵 色谱纯,Merck公司;磷酸二氢钠、磷酸氢二钠、甲酸、氨水 分析纯,国药集团化学试剂有限公司;HA对照品 含量98.5%(以透明质酸钠计),华熙生物科技股份有限公司;透明质酸酶 酶活5000 IU/mL,华熙生物科技股份有限公司;GHP微孔滤膜(0.2 μm) 美国Waters公司。
I-class超高效液相色谱、TQS三重四级杆串联质谱仪(配有电喷雾离子源(ESI)及Masslynx数据处理系统)、BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm)、BEH HILIC色谱柱(2.1 mm×100 mm,1.6 μm)、20位固相萃取仪、MAX固相萃取柱(60 mg/3 mL)、PRIME HLB固相萃取柱(150 mg/3 mL) 美国Waters公司;Hypercarb PGC色谱柱(2.1 mm×100 mm,3 μm) Thermo公司;FE28型pH计 梅特勒-托利多公司;涡旋振荡器 德国IKA公司;D-16C高速离心机 赛多利斯公司。
1.2 实验方法
1.2.1 样品前处理
1.2.1.1 提取
称取1 g试样于离心管中,加入pH6.0的磷酸盐缓冲液5 mL,加入透明质酸酶1 mL,混匀,42 ℃酶解2 h,水定容至10 mL,待净化。
1.2.1.2 净化
PRIME HLB固相萃取法:取1mL酶解液加入4 mL乙腈,涡旋混匀,8000 r/min离心10 min,取上清液过PRIME HLB固相萃取柱,收集洗脱液。经0.2 μm滤膜过滤后,待测定。
MAX固相萃取法:使用前依次用3 mL甲醇,3 mL水活化,3 mL 2%甲酸水活化。取1 mL酶解液过固相萃取柱,用3 mL水淋洗,弃去全部流出液。用3 mL 5%氨水甲醇洗脱,收集洗脱液。将洗脱液50 ℃氮吹浓缩至近干,准确加入1.0 mL乙腈-水(80:20)溶液溶解,涡旋混匀,用0.2 μm滤膜过滤后,待测。
1.2.2 仪器条件
1.2.2.1 液相色谱条件
BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm)。柱温:40 ℃。进样量:1 μL。流速:0.30 mL/min 。流动相:A:0.2%氨水B:乙腈(含0.2%氨水)。梯度洗脱:0.0~1.0 min,95% B;1.0~3.5 min,70% B;3.5~5.0 min,70% B;5.0~5.1 min,95% B;5.1~8.0 min,95% B。
1.2.2.2 质谱条件
离子源:电喷雾离子源(Electronic spray ionization,ESI),负离子模式(ESI−);毛细管电压:2 kV;离子源温度:120 ℃;脱溶剂温度:350 ℃;脱溶剂气流速:1000 L/h;检测方式:多反应监测(Multiple rection monitoring,MRM)模式进行检测;母离子、子离子、锥孔电压及碰撞能量见表1。
表 1 ΔDi-HA 质谱参数Table 1. Mass spectrometry parameters of ΔDi-HA名称 母离子 子离子(m/z) 锥孔电压(V) 碰撞能量(eV) ΔDi-HA 378 175* −10 15 378 87 −10 25 注:*表示该物质的定量离子。 1.2.3 方法学验证
取HA对照品10 mg于10 mL容量瓶中按1.2.1.1方法酶解,制得HA对照品酶解液。取空白乳粉、酸奶样品按PRIME HLB固相萃取前处理方法制备空白基质。乳粉、酸奶样品标准曲线:分别使用空白基质稀释HA对照品酶解液,使其含有HA 0.01、0.05、0.1、0.5、1.0、5.0 μg/mL的基质线性系列溶液,绘制标准曲线。鲜牛奶样品:乙腈水(80:20)溶液稀释HA对照品酶解液,使其含HA 0.01、0.05、0.1、0.5、1.0、5.0 μg/mL线性系列溶液,绘制标准曲线。
分别将低浓度HA对照品溶液加入空白乳粉、酸奶、鲜牛奶样品中,按信噪比(signal-noise ratio,S/N)≥3的浓度计算方法检出限(limit of detection,LOD),按信噪比S/N≥10的浓度计算方法定量限(Limit of quantitation,LOQ)。在空白样品中分别添加0.5、10、200 mg/kg 3 个浓度水平的HA对照品,各浓度水平6个平行样本分析,计算平均回收率及相对标准偏差。
1.3 数据处理
使用Masslynx(SCN 950)软件采集质谱图,TargetLynx处理谱图,外标法定量。Excel 2019、Origin 2022对数据进行处理。
2. 结果与分析
2.1 色谱柱的选择
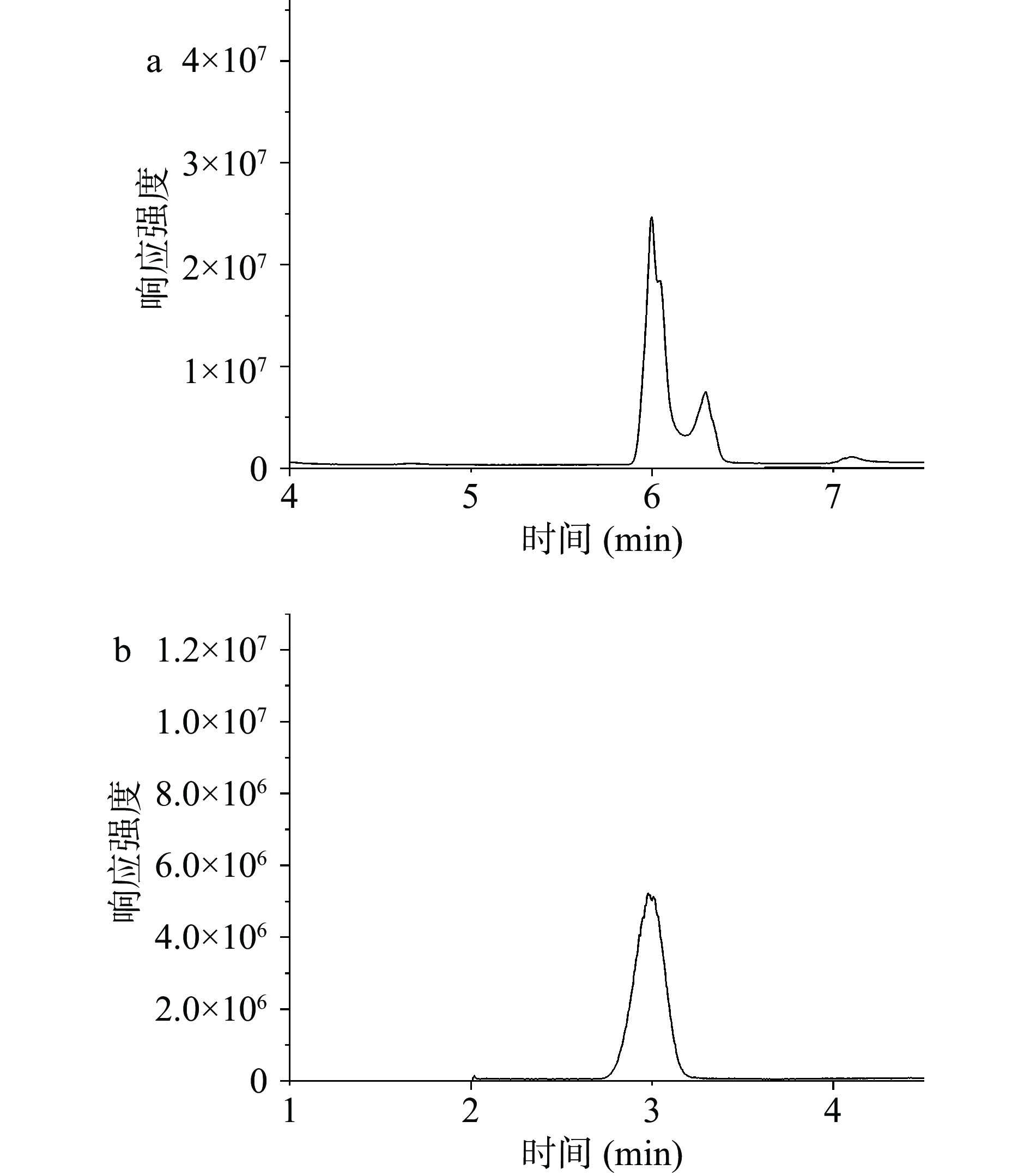
ΔDi-HA具有亲水性和强极性,在常规C18色谱柱上几乎不保留。多孔石墨碳色谱柱(porous graphitized carbon,PGC)和亲水性相互作用色谱柱(hydrophilic interaction liquid chromatography,HILIC)是分离糖胺聚糖的有利工具[24–27]。Hypercarb PGC色谱柱与硅胶基质固定相不同,其通过极性化的石墨化碳表面与极性组分发生相互作用,而起到分离作用。BEH Amide和BEH HILIC色谱柱均属于HILIC模式。Amide柱以三键键合的酰胺基(Amide)为键合相,其耐受pH范围更广(pH范围为2~11),与BEH HILIC柱相比更适合使用碱性流动相。实验分别比较了ΔDi-HA在Hypercarb PGC、BEH Amide及BEH HILIC色谱柱的分离效果。不同色谱柱对ΔDi-HA的分离见图2。BEH HILIC色谱柱由于流动相pH使用范围限制,ΔDi-HA出现的双峰不能被有效抑制。Hypercarb PGC柱虽耐受pH较广,且对ΔDi-HA有较好的保留,但BEH Amide在较高有机相比例下对ΔDi-HA进行洗脱,目标化合物更容易离子化,质谱响应值更高,并且可以区分不同聚合度的HA寡糖。实验最终选择BEH Amide色谱柱用于ΔDi-HA的分离。
2.2 流动相选择
实验考察了水-乙腈、0.1%氨水-乙腈(含0.1%氨水)、0.2%氨水-乙腈(含0.2%氨水)、5 mmol/L乙酸铵-乙腈、10 mmol/L乙酸铵-乙腈、20 mmol/L乙酸铵-乙腈对分离效果的影响。ΔDi-HA由于变旋现象,在溶液中以α或β差向异构体的形式存在,从而导致水-乙腈体系中色谱峰出现双峰。乙酸铵并不能抑制峰的分裂,并且随着乙酸铵浓度的增加,保留时间逐渐延长,信号响应显著降低。α、β差向异构体之间变旋现象可通过高pH或高柱温抑制[28]。实验中氨水的加入可明显抑制色谱峰的分裂,同时在高pH下可以提高离子化效率,具有良好的质谱兼容性,无需进行额外的衍生或柱后修饰即可进行质谱检测。乙腈中氨水的加入可更好地维持体系pH。兼顾色谱柱的使用寿命、色谱峰峰型以及质谱的兼容性,最终选择色谱柱温度40 ℃,0.2%氨水-乙腈(含0.2%氨水)作为流动相。不同流动相ΔDi-HA的总离子流图见图3。
2.3 质谱条件的选择
ΔDi-HA由于羧基的存在,在离子化时中容易失去氢离子而形成负离子。分别对ΔDi-HA采用正离子模式和负离子模式扫描,结果表明负离子模式下ΔDi-HA母离子丰度更高,且背景干扰峰较少。在负离子模式下,通过改变碰撞电压,确定特征碎片离子峰。最终选择子离子 m/z 175、m/z 87为定性离子,其中含量较高的子离子m/z 175为定量离子。
2.4 样品前处理条件优化
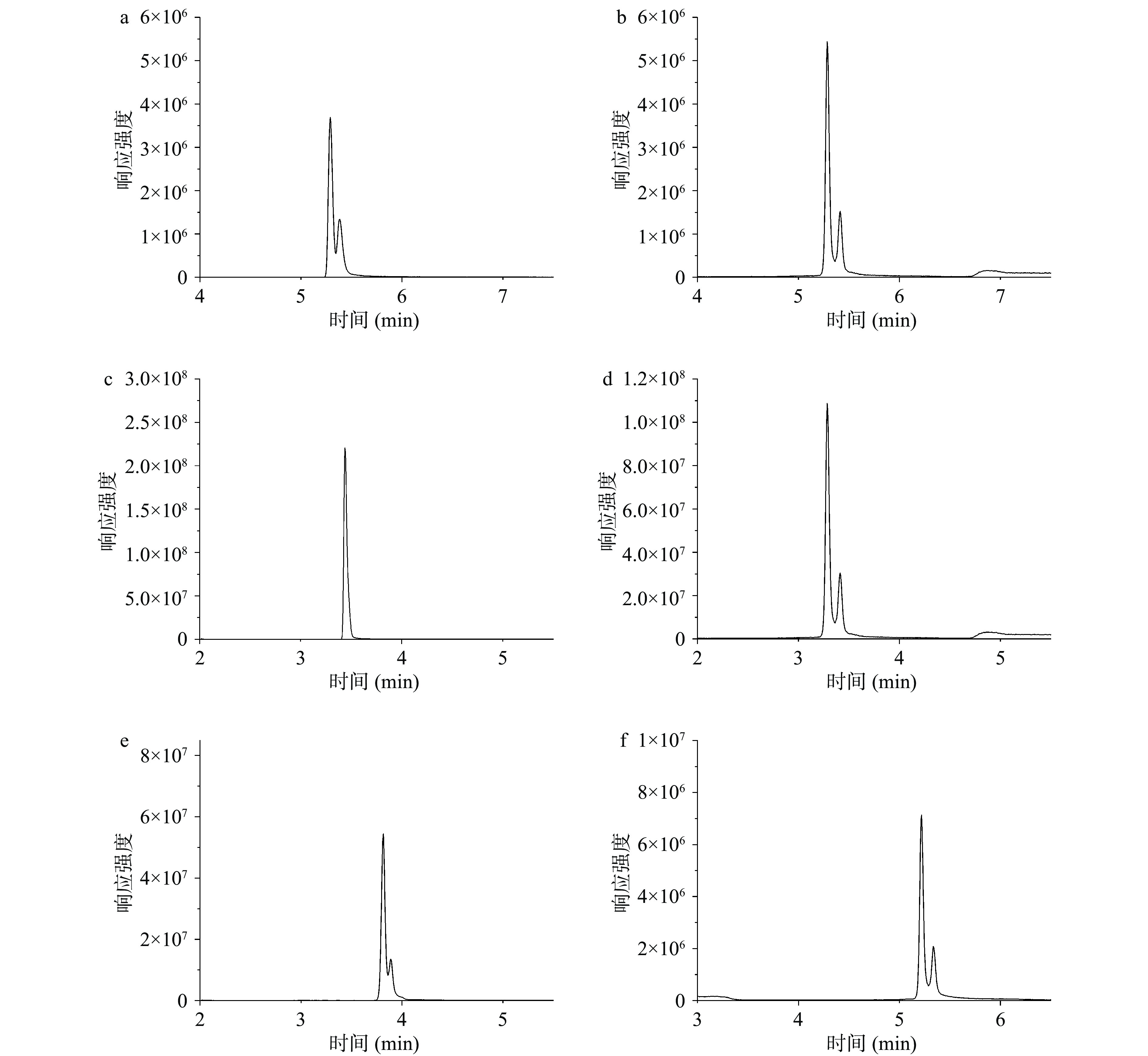
样品加入磷酸盐缓冲液使溶解,目的是使透明质酸酶在pH6.0介质中保持一个高活性状态[29]。根据称样量、酶活性,确定加入过量的透明质酸酶酶解液1.0 mL,42 ℃酶解反应2 h[16]。乳制品中含有的大量的脂类及蛋白质等成分,不仅会影响色谱柱的寿命,还会引起基质效应干扰目标化合物的测定,因此需对样品进行适当前处理。实验分别对PRIME HLB和MAX两种固相萃取法进行净化效果的比较。不同前处理方法的回收率见图4。从图4可以看出,PRIME HLB固相萃取柱的回收率要高于MAX。MAX以聚苯乙烯/二乙烯苯为基质的阴离子交换固相萃取柱,具有反相保留和离子交换双重保留模式。ΔDi-HA具有强极性及弱酸性,在MAX柱上的保留较弱。而PRIME HLB是一种新型固相萃取吸附剂,其组成主要为聚苯乙烯吡咯烷酮,可以很好地吸附脂质,而对ΔDi-HA不保留。样品经高比例乙腈稀释后直接通过PRIME HLB固相萃取柱净化,省去传统的活化、平衡步骤[30]。同时乳制品中含有的蛋白质可经乙腈稀释,高速离心后去除。洗脱液含有的高比例乙腈,不需溶剂转换,即可避免色谱溶剂效应的产生,产生较对称的峰型。
2.5 基质效应(matrix effect,ME)
在电喷雾离子源进行离子化过程中,基质成分和ΔDi-HA可以相互竞争,从而导致ME。ME会导致ΔDi-HA的信号强度有不同程度的减弱或增强。实验分别对乳粉、酸奶、鲜牛奶样品ME进行了研究,ME以ΔDi-HA在基质中峰面积(A)和相对应浓度的纯溶剂峰面积(B)之比计算(ME(%)=A/B×100)[31]。小于100%表示存在基质抑制效应,大于100%表示存在基质增强效应。ΔDi-HA在乳粉、酸奶、鲜牛奶中ME见图5。从图5中可以看出,在鲜牛奶样品中,基质效应不明显,而在乳粉、酸奶中的表现出一定的基质增强效应。表明ΔDi-HA经过PRIME HLB固相萃取柱的净化,可有效去除杂质。为进一步减轻基质效应的影响,乳粉、酸奶应采用基质匹配法进行定量分析。
2.6 方法学验证
2.6.1 标准曲线、检出限与定量限
HA对照品的系列浓度为0.01、0.05、0.1、0.5、1.0、5.0 μg/mL。以ΔDi-HA的定量离子峰面积(y)为纵坐标,相应的质量浓度(x,μg/mL)为横坐标进行线性回归,得到HA在不同基质中的线性方程及相关系数(表2)。在0.01~5 μg/mL范围内ΔDi-HA呈良好的线性关系,线性方程及相关系数见表3。将低浓度HA对照品溶液加入空白样品中,以S/N≥3确定方法检出限为0.1 mg/kg,S/N≥10确定方法定量限为0.5 mg/kg。
表 2 不同样品基质线性方程及相关系数Table 2. Linear equations and correlation coefficients of different sample matrixes稀释溶剂 线性方程 相关系数(r) 乳粉基质 y=741584x+4054.03 0.999 酸奶基质 y=704105x+7090.77 0.999 乙腈水(80:20) y=464851x−1180.28 0. 999 2.6.2 加标回收与相对标准偏差
取乳粉、酸奶、鲜牛奶空白样品基质,分别添加低(0.5 mg/kg)、中(10 mg/kg)、高(200 mg/kg)3个浓度水平的HA溶液,按样品前处理,每个水平测定6次,计算回收率和相对标准偏差(RSD)。由表3可知,乳制品中HA在0.5~200 mg/kg添加水平下回收率为91.4%~106.2%,RSD为2.3%~6.7%,回收率及精密度满足检测要求。
表 3 乳制品中HA的加标回收率和相对标准偏差RSD (n=6)Table 3. Spiked recoveries and RSDs of HA in dairy products (n=6)化合物 0.5 mg/kg 10 mg/kg 200 mg/kg 回收率
(%)RSD
(%)回收率
(%)RSD
(%)回收率
(%)RSD
(%)乳粉 100.1 6.7 92.1 2.3 94.3 2.4 鲜牛奶 104.5 2.3 100.8 3.1 106.2 7.5 酸奶 102.3 5.3 94.7 6.8 91.4 4.8 2.7 实际样品测定
以本方法的前处理条件及仪器条件对3件含HA的乳制品进行分析测定,所测样品均符合国家标准要求,检测结果见表4。
表 4 实际样品中HA含量检测结果Table 4. Analysis results of HA in actual samples样品 样品类型 含量(mg/kg)
(以透明质酸钠计)相对标准偏差(%) 样品1 乳粉 170.5 5.6 样品2 鲜牛奶 190.4 5.3 样品3 酸奶 50.2 6.4 3. 结论
本文建立了PRIME HLB固相萃取超高效液相色谱串联质谱检测乳制品中HA含量的方法。HA通过细菌来源透明质酸酶特异性降解为ΔDi-HA,乙腈稀释后,PRIME HLB固相萃取柱净化去除杂质,亲水性相互作用色谱柱BEH Amide酰胺柱分离,超高效液相色谱串联质谱法测定,外标法定量。本方的检出限为0.1 mg/kg,定量限0.5 mg/kg;在0.5~200 mg/kg浓度范围内,回收率为91.4%~106.2%,RSD为2.3%~6.7%。该方法无需衍生,流动相避免使用高浓度盐及无机酸,具有更好的质谱兼容性,可准确测定乳制品中HA的含量,为HA的质量把控和质量鉴定提供有效的手段。
-
表 1 ΔDi-HA 质谱参数
Table 1 Mass spectrometry parameters of ΔDi-HA
名称 母离子 子离子(m/z) 锥孔电压(V) 碰撞能量(eV) ΔDi-HA 378 175* −10 15 378 87 −10 25 注:*表示该物质的定量离子。 表 2 不同样品基质线性方程及相关系数
Table 2 Linear equations and correlation coefficients of different sample matrixes
稀释溶剂 线性方程 相关系数(r) 乳粉基质 y=741584x+4054.03 0.999 酸奶基质 y=704105x+7090.77 0.999 乙腈水(80:20) y=464851x−1180.28 0. 999 表 3 乳制品中HA的加标回收率和相对标准偏差RSD (n=6)
Table 3 Spiked recoveries and RSDs of HA in dairy products (n=6)
化合物 0.5 mg/kg 10 mg/kg 200 mg/kg 回收率
(%)RSD
(%)回收率
(%)RSD
(%)回收率
(%)RSD
(%)乳粉 100.1 6.7 92.1 2.3 94.3 2.4 鲜牛奶 104.5 2.3 100.8 3.1 106.2 7.5 酸奶 102.3 5.3 94.7 6.8 91.4 4.8 表 4 实际样品中HA含量检测结果
Table 4 Analysis results of HA in actual samples
样品 样品类型 含量(mg/kg)
(以透明质酸钠计)相对标准偏差(%) 样品1 乳粉 170.5 5.6 样品2 鲜牛奶 190.4 5.3 样品3 酸奶 50.2 6.4 -
[1] 张伟, 陈俊霖, 胡康. 动物源细胞外基质中糖胺聚糖物质的检测方法[J]. 中国组织工程研究,2019,23(30):4861−4867. [ZHANG W, CHEN J L, HU K. Methods for detecting glycosaminoglycan in the extracellular matrix of animal cells[J]. Chinese Journal of Tissue Engineering Research,2019,23(30):4861−4867. doi: 10.3969/j.issn.2095-4344.1428 [2] BERGSTRAND S, INGSTAD H K, Møystad A, et al. Long-term effectiveness of arthrocentesis with and without hyaluronic acid injection for treatment of temporomandibular joint osteoarthritis[J]. Journal of Oral Science,2019,61(1):82−88. doi: 10.2334/josnusd.17-0423
[3] DU H, LIU P, ZHU J, et al. Hyaluronic acid-based dissolving microneedle patch loaded with methotrexate for improved treatment of psoriasis[J]. ACS Applied Materials & Interfaces,2019,11(46):43588−43598.
[4] VASVANI S, KULKARNI P, RAWTANI D. Hyaluronic acid: A review on its biology, aspects of drug delivery, route of administrations and a special emphasis on its approved marketed products and recent clinical studies[J]. International Journal of Biological Macromolecules,2020,151:1012−1029. doi: 10.1016/j.ijbiomac.2019.11.066
[5] GRAçA M F P, MIGUEL S P, CABRAL C S D. et al. Hyaluronic acid-based wound dressings: A review[J]. Carbohydrate Polymers,2020,241:116364. doi: 10.1016/j.carbpol.2020.116364
[6] YAFTALI N A, WEBER K. Corticosteroids and Hyaluronic Acid Injections[J]. Clinics in Sports Medicine,2019,38(1):1−15. doi: 10.1016/j.csm.2018.08.006
[7] WANG S J, WANG Y H, HUANG L C. The effect of oral low molecular weight liquid hyaluronic acid combination with glucosamine and chondroitin on knee osteoarthritis patients with mild knee pain[J]. Medicine,2021,100(5):e24252. doi: 10.1097/MD.0000000000024252
[8] 刘硕, 王景召. 透明质酸的特性及其在食品中的应用[J]. 化工设计通讯,2018,44(8):62. [LIU S, WANG J Z. Characteristics of hyaluronic acid and its application in food[J]. Chemical Engineering Design Communications,2018,44(8):62. doi: 10.3969/j.issn.1003-6490.2018.08.058 [9] 宋东宇, 王若贤, 李硕, 等. 透明质酸钠功能机理及在食品中的应用进展[J]. 食品安全导刊,2022(1):162−165. [SONG D Y, WANG R X, LI S, et al. Functional mechanism of sodium hyaluronate and its utilization in food[J]. China Food Safety Magazine,2022(1):162−165. doi: 10.3969/j.issn.1674-0270.2022.1.spaqdk202201054 [10] 国家卫生健康委. 关于蝉花子实体(人工培植)等15种“三新食品”的公告[EB/OL]. (2020-12-28) [2021-01-07]. http://www.nhc.gov.cn/sps/s7892/202101/59f6380209494ea6b67a49648e59fd84.shtml [11] 李敏, 侯增淼, 李晓颖, 等. 改良咔唑法测定重组人溶菌酶滴眼液中透明质酸钠的含量[J]. 化学分析计量,2019,28(1):95−98. [LI M, HOU Z M, LI X Y, et al. Determination of sodium hyaluronate in recombinant human lysozyme eye drops by modified carbazole method[J]. Chemical Analysis and Meterage,2019,28(1):95−98. doi: 10.3969/j.issn.1008-6145.2019.01.023 [12] NIMPTSCH K, SÜß R, RIEMER T, et al. Differently complex oligosaccharides can be easily identified by matrix-assisted laser desorption and ionization time-of-flight mass spectrometry directly from a standard thin-layer chromatography plate[J]. Journal of Chromatography A,2010,1217(23):3711−3715. doi: 10.1016/j.chroma.2010.04.005
[13] HUANG X, SCHMIDT T A, SHORTT C, et al. A competitive alphascreen assay for detection of hyaluronan[J]. Glycobiology,2017,28(3):137−147.
[14] XU X, WEN C, AI C, et al. Quantitative analysis of acidic polysaccharides using hydrophilic interaction chromatography and mass spectrometry after acid hydrolysis[J]. Current Pharmaceutical Analysis,2018,14(5):443−449. doi: 10.2174/1573412913666170525163234
[15] RUCKMANI K, SHAIKH S Z, KHALIL P, et al. Determination of sodium hyaluronate in pharmaceutical formulations by HPLC-UV[J]. Journal of Pharmaceutical Analysis,2013,3(5):324−329. doi: 10.1016/j.jpha.2013.02.001
[16] 陈玉娟, 陈雯雯, 乔莉苹, 等. 高效液相色谱法测定透明质酸钠含量的研究[J]. 药学研究,2020,39(3):146−148, 180. [CHEN Y J, CHEN W W, QIAO L P, et al. Determination of sodium hyaluronate by HPLC[J]. Journal of Pharmaceutical Research,2020,39(3):146−148, 180. [17] WENDE F J, GOHIL S, MOJARRADI H, et al. Determination of substitution positions in hyaluronic acid hydrogels using NMR and MS based methods[J]. Carbohydrate Polymers,2016,136:1348−1357. doi: 10.1016/j.carbpol.2015.09.112
[18] YEUNG B, MARECAK D. Molecular weight determination of hyaluronic acid by gel filtration chromatography coupled to matrix-assisted laser desorption ionization mass spectrometry[J]. Journal of Chromatography A,1999,852(2):573−581. doi: 10.1016/S0021-9673(99)00647-0
[19] ŠIMEK M, LEMR K, HERMANNOVÁ M, et al. Analysis of hyaluronan and its derivatives using chromatographic and mass spectrometric techniques[J]. Carbohydrate Polymers,2020,250:117014. doi: 10.1016/j.carbpol.2020.117014
[20] KIRAN G, SRIKANTH C B, SALIMATH P V, et al. Diet-induced hypercholesterolemia imparts structure-function changes to erythrocyte chondroitin sulphate/dermatan sulphate[J]. Journal of Biochemistry,2015,158(3):217−224. doi: 10.1093/jb/mvv037
[21] AALTONEN K, NIEMELÄ T, SANKARI S, et al. Determination of the unsaturated disaccharides of hyaluronic acid in equine synovial fluid by high-performance liquid chromatography and fluorescence detection[J]. Acta Veterinaria Scandinavica,2015,57(1):12. doi: 10.1186/s13028-015-0098-y
[22] SEDLÁčEK J, HERMANNOVÁ M, MRÁZEK J, et al. Insight into the distribution of amino groups along the chain of chemically deacetylated hyaluronan[J]. Carbohydrate Polymers,2019,225:115156. doi: 10.1016/j.carbpol.2019.115156
[23] 黄芳, 邓欣, 王玉芹, 等. 酸水解-柱前衍生化-高效液相色谱法测定面膜化妆品中透明质酸[J]. 理化检验(化学分册),2019,55(8):898−903. [HUANG F, DENG X, WANG Y Q, et al. HPLC determination of hyaluronic acid in mask cosmetics with acid hydrolysis and precolumn derivatization[J]. Physical Testing and Chemical Analysis Part B:Chemical Analysis,2019,55(8):898−903. [24] 吴成玲, 刘建芬, 张真庆. 亲水相互作用色谱-高分辨质谱分析不同糖胺聚糖寡糖[J]. 分析化学,2015,43(8):1198−1202. [WU C L, LIU J F, ZHANG Z Q. Hydrophilic interaction liquid chromatography-quadrupole-time-of-flight mass spectrometry for analysis of glycosaminoglycan oligosaccharides[J]. Chinese Journal of Analytical Chemistry,2015,43(8):1198−1202. doi: 10.11895/j.issn.0253-3820.150228 [25] HETRICK E M, KRAMER T T, RISLEY D S. Evaluation of a hydrophilic interaction liquid chromatography design space for sugars and sugar alcohols[J]. Journal of Chromatography A,2017,1489:65−74. doi: 10.1016/j.chroma.2017.01.072
[26] OSAGO H, SHIBATA T, HARA N, et al. Quantitative analysis of glycosaminoglycans, chondroitin/dermatan sulfate, hyaluronic acid, heparan sulfate, and keratan sulfate by liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. Analytical Biochemistry,2014,467:62−74. doi: 10.1016/j.ab.2014.08.005
[27] 周鹏, 王征, 高希, 等. 亲水作用色谱-质谱联用法测定茶叶中5种游离糖[J]. 分析试验室,2020,39(11):1322−1327. [ZHOU P, WANG Z, GAO X, et al. Determination of 5 free saccharides in teas by hydrophilic interaction liquid chromatography-mass spectrometry[J]. Chinese Journal of Analysis Laboratory,2020,39(11):1322−1327. [28] GHOSH R, KLINE P. HPLC with charged aerosol detector (CAD) as a quality control platform for analysis of carbohydrate polymers[J]. BMC Research Notes,2019,12(1):268. doi: 10.1186/s13104-019-4296-y
[29] GUO X, SHI Y, SHENG J, et al. A novel hyaluronidase produced by Bacillus sp. A50[J]. PLOS ONE,2014,9(4):e94156. doi: 10.1371/journal.pone.0094156
[30] 彭大红, 梅艳珍, 郝爱月, 等. 基于响应面分析的PRiME HLB-HPLC法高灵敏检测牛乳中5种限用氟喹诺酮类药物[J]. 食品科技,2021,46(8):276−283. [PENG D H, MEI Y Z, HAO A Y, et al. Highly sensitive detection of five restricted fluoroquinolones in milk by PRiME HLB-HPLC based on response surface analysis[J]. Food Science and Technology,2021,46(8):276−283. [31] 廖惠云, 吴洋, 马梦婕, 等. 基质匹配曲线校正-HPLC-MS/MS法同时测定干性食品包装纸中8种甜味剂[J]. 食品科学,2021,42(12):328−333. [LIAO H Y, WU Y, MA M J, Et al. Simultaneous determination of eight sweeteners in dry food wrappings by using matrix matched solvent calibration-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2021,42(12):328−333. doi: 10.7506/spkx1002-6630-20191128-278 -
期刊类型引用(10)
1. 舒丽枝,时苗苗,张牧焓,卞欢,徐为民,王道营. 卟啉类化合物和游离铁对鸡胸肉肌原纤维蛋白理化特性的影响. 江苏农业学报. 2024(10): 1952-1961 .  百度学术
百度学术
2. 王晓芸,高霞,尤娟,尹涛,刘茹. 超声预处理对鲜湿鱼粉品质的影响及其作用机制. 食品科学. 2024(23): 213-220 .  百度学术
百度学术
3. 韩馨蕊,李颖,刘苗苗,范鑫,冯莉,曹云刚. 安石榴苷与焦磷酸钠对肌原纤维蛋白氧化稳定性及凝胶性能的影响. 食品科学. 2022(08): 15-21 .  百度学术
百度学术
4. 莫玲,香庆文,李晶晶,叶玉萍,赵超超. 孕哺期摄入氧化乳蛋白对子代小鼠机体氧化还原状态的影响. 食品科学技术学报. 2021(03): 122-128 .  百度学术
百度学术
5. 梁恽红,卢涵,张香美. 蛋白二、三级结构对鱼糜凝胶质构和持水力的影响及其测定方法研究进展. 东北农业大学学报. 2021(10): 87-96 .  百度学术
百度学术
6. 谢晨,熊泽语,李慧,金素莱曼,陈百科,包海蓉. 金针菇多糖对三文鱼片冻藏期间品质的影响. 食品与发酵工业. 2021(22): 178-183 .  百度学术
百度学术
7. 刘芳芳,林婉玲,李来好,吴燕燕,杨少玲,黄卉,杨贤庆,林织. 海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理. 食品科学. 2020(14): 15-22 .  百度学术
百度学术
8. 冯程,Manonose Tariro Upenyu,李志豪,王萍,余雄伟,付琴利,李述刚. 丙烯醛对籽瓜种仁蛋白质结构及凝胶特性影响研究. 食品科技. 2019(09): 66-71 .  百度学术
百度学术
9. 刁小琴,关海宁,李杨,刘丽美. 高压均质对肌原纤维蛋白乳化特性及结构的影响. 食品与发酵工业. 2019(18): 107-112 .  百度学术
百度学术
10. 郭兆斌,马纪兵,张丽,陈骋,陈立业,刘勇,韩玲,余群力. 传统风干牦牛肉加工过程中肌原纤维蛋白氧化对氨基酸的影响. 食品与发酵工业. 2019(22): 202-207+212 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:
