Optimization of Extraction Technology, Structure Characterization and Antioxidant Activity of Polysaccharide from Hibiseus manihot L.
-
摘要: 优化金花葵干花苞中多糖的提取工艺,并对其结构和抗氧化活性进行研究。本研究在单因素实验的基础上,通过正交试验优化水提醇沉法提取多糖的工艺,利用高效液相色谱(HPLC)法分析多糖的单糖组成,应用傅里叶红外光谱(FTIR)法和扫描电镜(SEM)观察对多糖官能团和外貌进行分析,并检测了多糖清除自由基的能力和还原力。结果表明,金花葵的干花苞多糖最佳提取工艺为:提取温度100 ℃、提取时间3 h和料液比1:50 g/mL。在此工艺条件下,多糖得率为17.23%±0.19%,多糖含量为27.87%±0.60%。其单糖组成及摩尔比为阿拉伯糖:半乳糖:鼠李糖:甘露糖:葡萄糖=0.97:1:0.23:0.05:0.43。表面呈不规则片状,并且证明具有糖醛酸、吡喃糖环官能团。此外,提取的多糖具有一定的清除DPPH自由基、ABTS+自由基能力,对自由基半数抑制对应浓度(IC50)分别为1.22、4.43 mg/mL,表明具有良好的抗氧化活性。研究结果为金花葵花苞中多糖的化学结构解析和功能研究提供了研究基础与理论依据。Abstract: To optimize the extraction technology of polysaccharides from Hibiseus manihot L. the dried flower buds, and study its structure and antioxidant activity. In this study, on the basis of single factor experiments, the orthogonal experimental design methodology the optimization of extraction process of polysaccharide of the dried flower buds was carried out by water extraction and alcoholic precipitation method. The crude polysaccharides composition was analyzed by high performance liquid chromatography (HPLC), the functional groups and external structure of the polysaccharide were analyzed by Fourier infrared spectroscopy (FTIR) and scanning electron microscopy (SEM), and the free radical scavenging ability and reducing power of the polysaccharides were also tested. The results showed that the optimal extraction conditions were as follows: Extraction temperature of 100 ℃, extraction duration of 3 h, solid-liquid ratio of 1:50 g/mL. Under this condition, the yield of polysaccharide was 17.23%±0.19% and the polysaccharide content was 27.87%±0.60%. The polysaccharide from the dried flower buds was composed of arabinose, galactose, rhamnose, mannose and glucose in molar ratios of 0.97:1:0.23:0.05:0.43. The obtained polysaccharide extract was found to be mainly composed of irregular lamellar structures with the functional groups of uronic acid and pyranose ring. The polysaccharides have certain ability of scavenging DPPH free radical, ABTS+ free radical, the corresponding half-inhibitory concentrations (IC50) of polysaccharides against DPPH radicals and ABTS+ radicals were 1.22 and 4.43 mg/mL, respectively, it would prove that the polysaccharide had good antioxidant activity. The results would provide a theoretical basis for structural determination research of polysaccharides of Hibiseus manihot L..
-
金花葵(Hibiseus manihot L)属于锦葵科秋葵属,它被人们称为野芙蓉,菜芙蓉,有的地区又称其为黏干或山榆皮[1]。金花葵具有防三高、补肾、清热利湿、消炎止痛、解毒健胃、提高免疫力、防止氧化、抑制肿瘤细胞生长[2]等作用。金花葵体内具有含量较高的黄酮类化合物、多糖等多种生物活性成分[3]。其花苞中也富含多糖活性成分,魏青等[4]研究表明金花葵花苞中多糖的抗氧化能力优于其茎、叶多糖。因此,提高金花葵花苞中多糖提取率,明确其理化性质和生物活性,对金花葵的深入挖掘利用具有重要意义。
植物多糖的提取成本不高[5],但在医学药用上的价值却很高[6-9],关于金花葵多糖提取方法有很多,如水提醇沉法、微波法、超声法等。水提醇沉法,过程安全、成本低廉,而且操作十分简单,适合产业化[10]。黄杰涛等[11]利用响应面法优化金花葵多糖水提醇沉法的提取工艺,到目前为止,关于金花葵水提醇沉法提取工艺优化方法很多,但有关优化后提取多糖类组分结构进一步探究却很少[12-13],因此本研究采用水提醇沉法对金花葵干花苞多糖进行提取,通过单因素结合正交试验优化最佳提取工艺,在此基础上对提取多糖的结构特性进行初探,旨在为金花葵花苞多糖类物质的化学结构解析和生物活性评价研究提供理论基础。
1. 材料与方法
1.1 材料与仪器
金花葵干花苞 购自河南;单糖标准品 上海源叶生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮基双(3-乙基苯并噻晔啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS) 美国Sigma公司;所有试剂 均为分析纯。
RE-2000B旋转蒸发器 上海一科仪器有限公司;DF-101S集热式恒温加热磁力搅拌器、SZCL-2型数显智能控温磁力搅拌器、SHZ-DⅢ予华牌循环水真空泵 巩义市予华仪器有限公司;UV-1600紫外可见分光光计 上海美谱达仪器有限公司;Agilent 1260型高效液相色谱仪 美国安捷伦公司;MIKRO 220R高速低温离心机 德国Hettich公司;JSM-7500F冷场发射扫描电镜 日本电子株式会社。
1.2 实验方法
1.2.1 金花葵多糖提取
参考姜天宇等[14]的方法修改,取金花葵干花苞粉碎、80目过筛之后得到实验所需金花葵花粉,称取20 g粉末加无水乙醇(料液比1:10 g/mL),90 ℃水浴浸提4 h,去油、抽滤、收集固体残留物,晾干称重备用。取去油后固体按比例加水,加热套回流提取,提取后6000 r/min离心12 min收集上清液,再旋转蒸发浓缩溶液至100 mL左右,加入浓缩液1/5体积的Sevag试剂(V三氯甲烷:V正丁醇=4:1)混合振摇,5000 r/min离心10 min分液除去蛋白,然后加上清液3倍无水乙醇静置过夜,后续5000 r/min离心10 min收集沉淀并冷冻干燥所得即为金花葵多糖,最后计算粗多糖得率,公式如下:
粗多䅯得率 (%)=mM×100 式中:m为多糖粉末质量(g);M为金花葵花粉末质量(g)。
1.2.2 葡萄糖标准曲线的制作
精密称取10 mg葡萄糖加蒸馏水定容至10 mL容量瓶中,配为1 mg/mL葡萄糖标准溶液,备用。准确吸取0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准对照溶液分别定容至10 mL容量瓶中。取各稀释液1 mL于试管中,依次添加1 mL 6%的苯酚标准溶液、5 mL浓硫酸,充分混合后静置30 min冷却至室温后,用蒸馏水做空白对照,在490 nm波长处测吸光度,以葡萄糖质量浓度C为横坐标,吸光度A为纵坐标绘制标准曲线。
1.2.3 多糖的含量测定
采用苯酚-硫酸法[15]进行多糖的含量测定。精密称取10 mg多糖加蒸馏水定容至10 mL容量瓶中,配为1 mg/mL多糖样品溶液,备用。将该样品溶液稀释10倍后准确吸取1 mL于试管中,分别添加1 mL 6%的苯酚标准溶液、5 mL浓硫酸,充分混合后,静置30 min,于490 nm波长处测吸光度,并将测得吸光度代入葡萄糖标准曲线,依照公式计算多糖的含量,多糖的含量计算公式如下:
多糖含量 (%)=C×V×NM×100 式中:C为葡萄糖标准溶液浓度(mg/mL);N为稀释倍数;V为样品溶液体积(mL);M为金花葵花粉末质量(mg)。
1.2.4 多糖提取工艺优化
1.2.4.1 单因素实验
采用水提醇沉法提取金花葵多糖,测得多糖得率。选取料液比(1:20、1:30、1:40、1:50、1:60 g/mL)、提取时间(2.5、3.0、3.5、4.0、4.5 h)、提取温度(70、80、90、100、110 ℃)做单因素实验,对金花葵多糖提取工艺进行优化,其中固定因素水平为提取时间4.0 h、液料比1:40 g/mL、提取温度100 ℃。
1.2.4.2 正交试验
根据单因素实验的结果,对提取料液比、提取时间和提取温度三个重要因素分别取3个水平进行正交试验,优化金花葵多糖提取工艺。正交试验的三因素三水平选取见表1。
表 1 正交试验因素与水平Table 1. Factors and levels of orthogonal experiment水平 因素 1 A料液比(g/mL) B提取时间(h) C提取温度(℃) 1 1:40 2.5 80 2 1:50 3 90 3 1:60 3.5 100 1.2.5 单糖组成分析
多糖的单糖组成测定参考文献[16-18]的方法,称取5 mg的多糖冻干粉于安瓿瓶中,加5 mL 2 mol/L三氟乙酸充氮气封口后在110 ℃条件下水解240 min,冷却后吸取2 mL水解液加入1 mL甲醇,在50 ℃下氮气吹干,重复两次。向吹干残渣加2 mL 0.2 mol/L NaOH溶液充分溶解,备用。单糖衍生化:分别取0.5 mL的混合单糖标准液和金花葵多糖水解液加0.5 mL 0.5 mol/L PMP(1-pheny-3-methyl-5-pyrazolone)甲醇溶液混合均匀在70 ℃水浴加热2.5 h,冷却至室温后,加0.5 mL 0.2 mol/L HCl混合均匀,再加入等体积氯仿萃取,弃去氯仿层,收集水解层,重复萃取三次除去多余PMP。水相过0.45 μm微孔膜过滤后,采用高效液相色谱检测。
检测条件:Agilent 1260型液相色谱仪(配DAD检测器)、Curosil-PFP色谱柱(4.6 mm×250 mm,5 μm)。流动相A为磷酸钠缓冲液(100 mmol/L,pH6.4),流动相B乙腈,通过0 min→30 min→35 min→40 min时间点对乙腈比例从15%→28%→40%→15%的比例变化进行梯度洗脱。流速1.0 mL/min,柱温30 ℃,进样量5 μL,检测波长250 nm。
1.2.6 多糖结构分析
1.2.6.1 红外光谱分析
采用傅里叶变换红外光谱对多糖的基础官能团进行分析[19]。取干燥的约10 mg多糖与约100 mg溴化钾(KBr)粉末混合,置于玛瑙研钵中,研磨均匀后压片,用傅立叶红外光谱仪器在500~4000 cm−1区内进行扫描,初步分析多糖官能团。
1.2.6.2 扫描电镜
取少量干燥多糖,用铜胶带粘在样品架上,放置在离子溅射装置中,并涂上一层导电金粉,采用冷场发射扫描电镜在50、200和2000倍下进行观察。
1.2.7 体外抗氧化活性测定
1.2.7.1 DPPH自由基清除能力的测定
参考Liu等[20]测定方式并稍作修改。配制50 mL 0.1 mmol/mL DPPH溶液备用。分别吸取1.5 mL不同浓度梯度(0.3、0.4、0.5、1、1.5、1.5、2、2.5、3、3.5 mg/mL)的多糖溶液与抗坏血酸(阳性对照)于不同试管中,加入2.0 mL DPPH溶液,再加0.5 mL蒸馏水摇匀室温避光静置30 min,在517 nm下分别测定吸光值记为A1。以等体积无水乙醇重复以上操作(做空白)记A0,不加反应液等体积样品溶液记A2。实验均平行测定3次。计算DPPH自由基清除率公式如下:
X(%)=[1−(A1−A2)A0]×100 式中:A0为空白溶液吸光值;A1为多糖或抗坏血酸溶液吸光值;A2为样品溶液本底吸光值。
1.2.7.2 ABTS+自由基清除能力的测定
参考Deseo等[21]测定方法并进行修改,将5.0 mL 7 mmol/L ABTS溶液与5.0 mL 140 mmol/L K2S2O7溶液均匀混合后室温避光反应24 h,用无水乙醇稀释,使其734 nm处吸光度为0.7±0.02,得ABTS工作液。随后分别吸取0.1 mL不同浓度梯度的多糖溶液(1、1.5、2、2.5、3、3.5、5 mg/mL)和抗坏血酸(阳性对照)于试管中,加入3.9 mL ABTS工作液,均匀混合室温避光反应10 min,在734 nm下测定吸光值记为A1。以等体积无水乙醇重复以上操作(做空白)记A0,不加反应液等体积样品溶液(0.1 mL多糖或抗坏血酸+3.9 mL无水乙醇)记A2。实验均平行测定3次。ABTS+自由基清除率公式如下:
X(%)=[1−(A1−A2)A0]×100 式中:A0为空白溶液吸光值;A1为多糖或抗坏血酸溶液吸光值;A2为样品溶液本底吸光值。
1.3 数据处理
以上每个试验重复3次,结果以平均值±标准差表示。采用Excel 2010、SPSS25.0统计分析软件和Origin 2019软件对实验数据进行处理、方差分析及实验数据作图。
2. 结果与分析
2.1 多糖含量的测定
通过苯酚-硫酸法测定金花葵干花苞中多糖含量,以标准品浓度x为横坐标、吸光度A为纵坐标,建立标准曲线回归方程:y=10.032x−0.1404(R2=0.9998)。经过标准曲线计算出在料液比1:50 g/mL,提取时间3 h,提取温度100 ℃提取条件下样品多糖含量为27.87%±0.60%。
2.2 粗多糖提取条件的优化
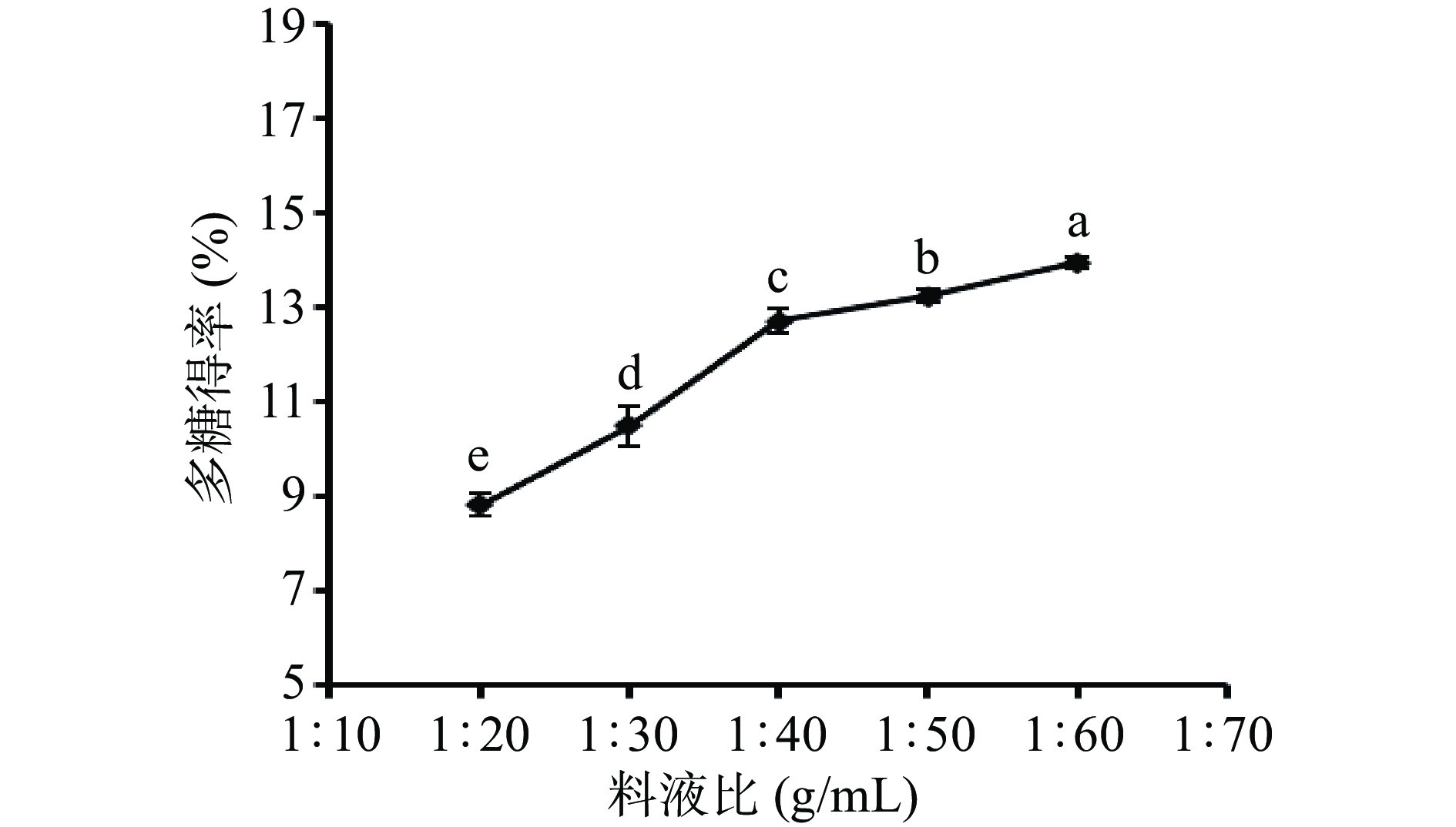
2.2.1 料液比对金花葵多糖得率的影响
从图1可知,随着料液比加大,金花葵多糖得率总体有所上升,在料液比为1:40 g/mL之后,其多糖得率上升趋势减缓,趋于平缓。这是因为金花葵花中多糖含量有限,当料液比太大,多糖得率受溶解度的约束作用变小,所以在料液比大于1:40 g/mL时,多糖得率趋于稳定,后续再增大料液比,可能会使其他水溶性物质的溶解量增加,抑制多糖的溶出,最后多糖得率反而可能下降[22-23]。因此考虑经济效率最大化,选择料液比1:40、1:50和1:60 g/mL进行下一步的正交试验。
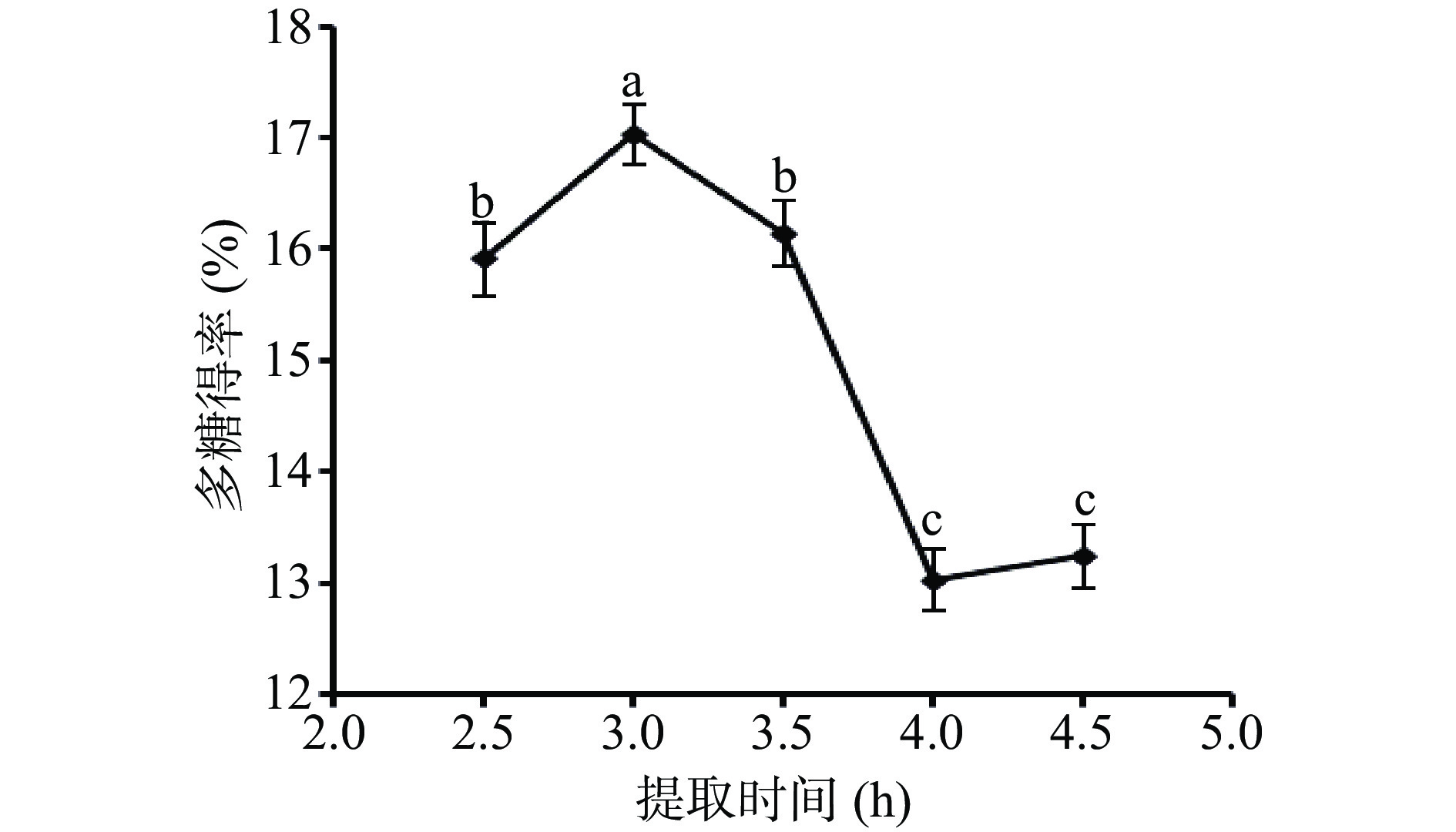
2.2.2 提取时间对金花葵多糖得率的影响
从图2可知,随着提取时间的增大,金花葵多糖得率有所上升,在提取时间3 h时达到峰值(得率为17.12%),随后有所下降至平缓,这是因为在一定提取时间范围内,增长提取时间有助于多糖的充分提取,但是提取时间过长,可能会导致多糖水解和溶剂的挥发,进而使多糖的得率下降[24]。总体来说,提取时间在2.5~3.5 h之间,得率较高且相对稳定,因而选择提取时间2.5、3和3.5 h进行下一步的正交试验。
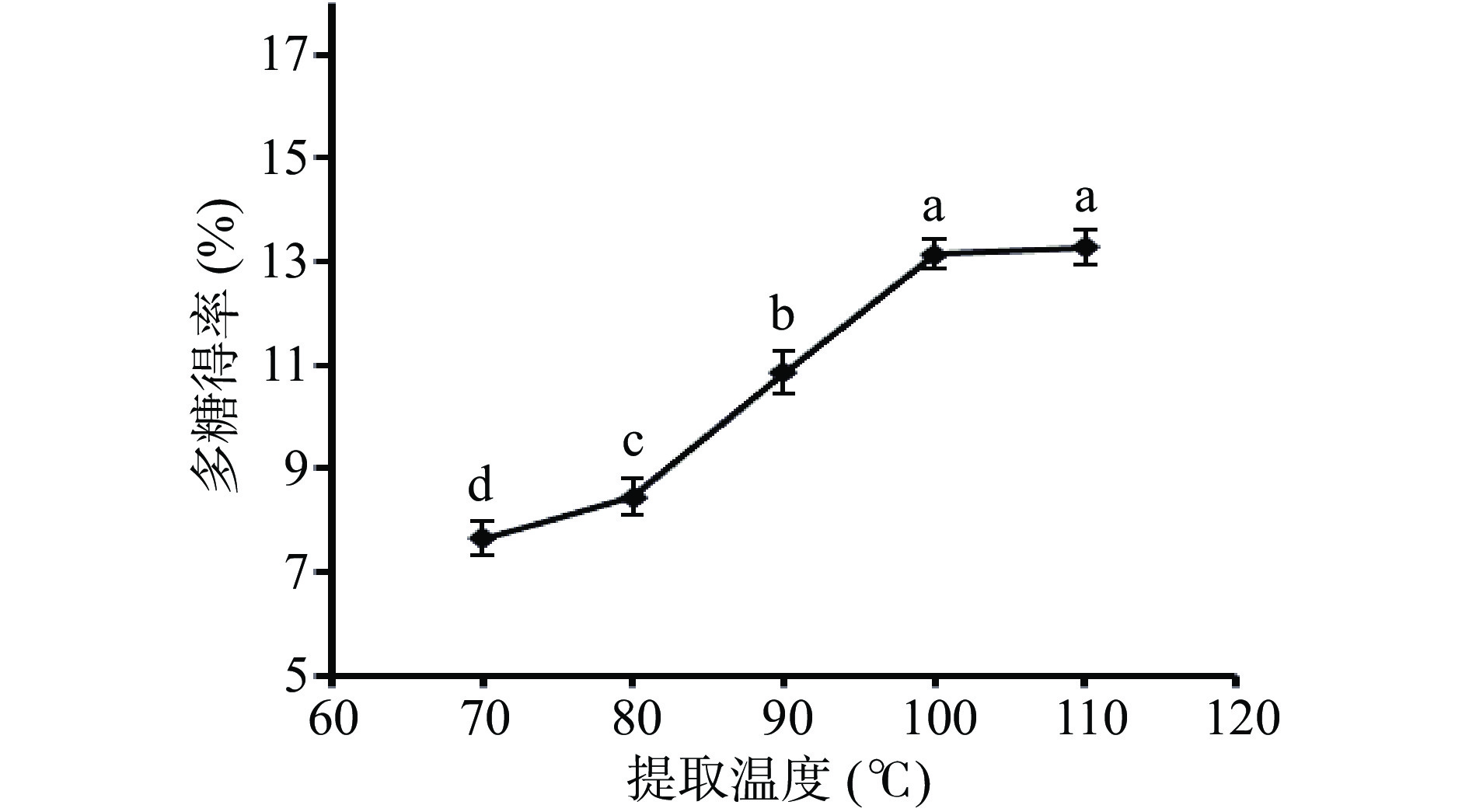
2.2.3 提取温度对金花葵多糖得率的影响
从图3可知,随着提取温度上升分子间运动加快有助水溶性多糖溶出[25],多糖得率有所上升;当提取温度超过100 ℃之后,多糖得率变化不大,且从得到的多糖溶液发现,色泽加深。推测高温可能对多糖的结构与活性有一定的影响,超过100 ℃时多糖易产生降解[26],因此选择80、90和100 ℃这三个温度进行下一步的正交试验。
2.2.4 正交试验结果
表2和表3结果分析,料液比、提取时间和提取温度这三个因素对金花葵多糖得率的影响大小顺序为:提取温度>提取时间>料液比,其中提取温度是多糖得率的关键影响因素。方差分析结果表明提取温度对多糖得率有显著影响(P<0.05),提取时间和料液比对多糖得率无显著影响(P>0.05),根据因素的主次顺序,分析得出最佳提取条件为A2B2C3:料液比1:50 g/mL,提取时间3 h,提取温度100 ℃。后续在这个条件下重复三次实验,得到金花葵多糖得率分别是17.21%、17.38%和17.11%,取平均值为17.23%,相对标准偏差(RSD)为0.19%。与正交试验中最高得率17.54%相近,验证了正交试验的最佳提取条件为A2B2C3。
表 2 正交试验结果Table 2. Results of orthogonal test实验号 因素 多糖得率(%) A B C 1 1 1 1 8.37 2 1 2 2 10.84 3 1 3 3 16.14 4 2 1 2 9.94 5 2 2 3 17.54 6 2 3 1 8.66 7 3 1 3 14.20 8 3 2 1 8.93 9 3 3 2 9.78 K1 35.35 32.51 25.96 K2 36.14 37.31 30.56 K3 32.91 34.58 47.88 R 3.23 4.80 21.92 表 3 方差分析结果Table 3. Results of variance analysis方差来源 离差平方和 自由度 均方 F值 P值 A 1.89 2 0.95 2.77 0.2652 B 3.86 2 1.93 5.67 0.1500 C 89.07 2 44.53 130.59 0.0076 误差 0.68 2 0.34 总和 95.51 2.3 单糖组成分析
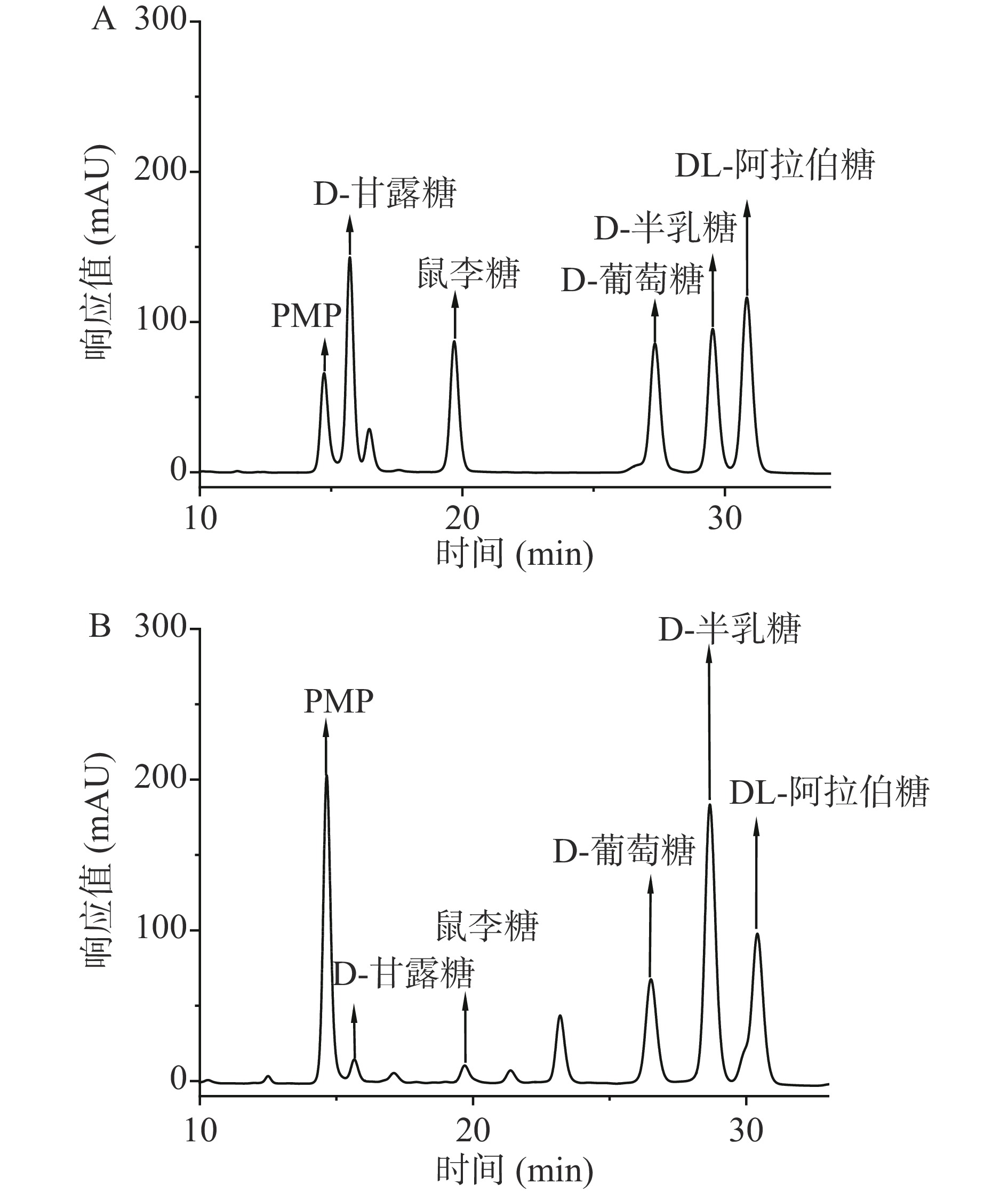
为了初步分析多糖中单糖组成,查阅文献[27]综合考虑选择5种标准单糖(D-甘露糖、鼠李糖、D-葡萄糖、D-半乳糖、DL-阿拉伯糖)为对照,分别将5种标准单糖配成0.4 mg/mL的混标溶液(经PMP衍生化处理),通过高效液相色谱分析。以单糖组成的浓度为横坐标(x)、峰面积为纵坐标(y)建立各标准单糖的标准曲线(图4A):鼠李糖(y=70.586x+125.58,R2=0.9783)、D-葡萄糖(y=78.675x+44.112,R2=0.9901)、D-半乳糖(y=92.615x−93.513,R2=0.9691)、DL-阿拉伯糖(y=72.288x+9.5592,R2=0.9846)、D-甘露糖(y=134.65x−88.737,R2=0.9908)。HLPC分析表明(如图4B),金花葵多糖是一种杂多糖,是由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖等组成。其中阿拉伯糖、半乳糖、鼠李糖、甘露糖、葡萄糖的物质的量之比为0.97:1:0.23:0.05:0.43。阿拉伯糖、半乳糖成分略高。
2.4 多糖结构分析
2.4.1 红外光谱
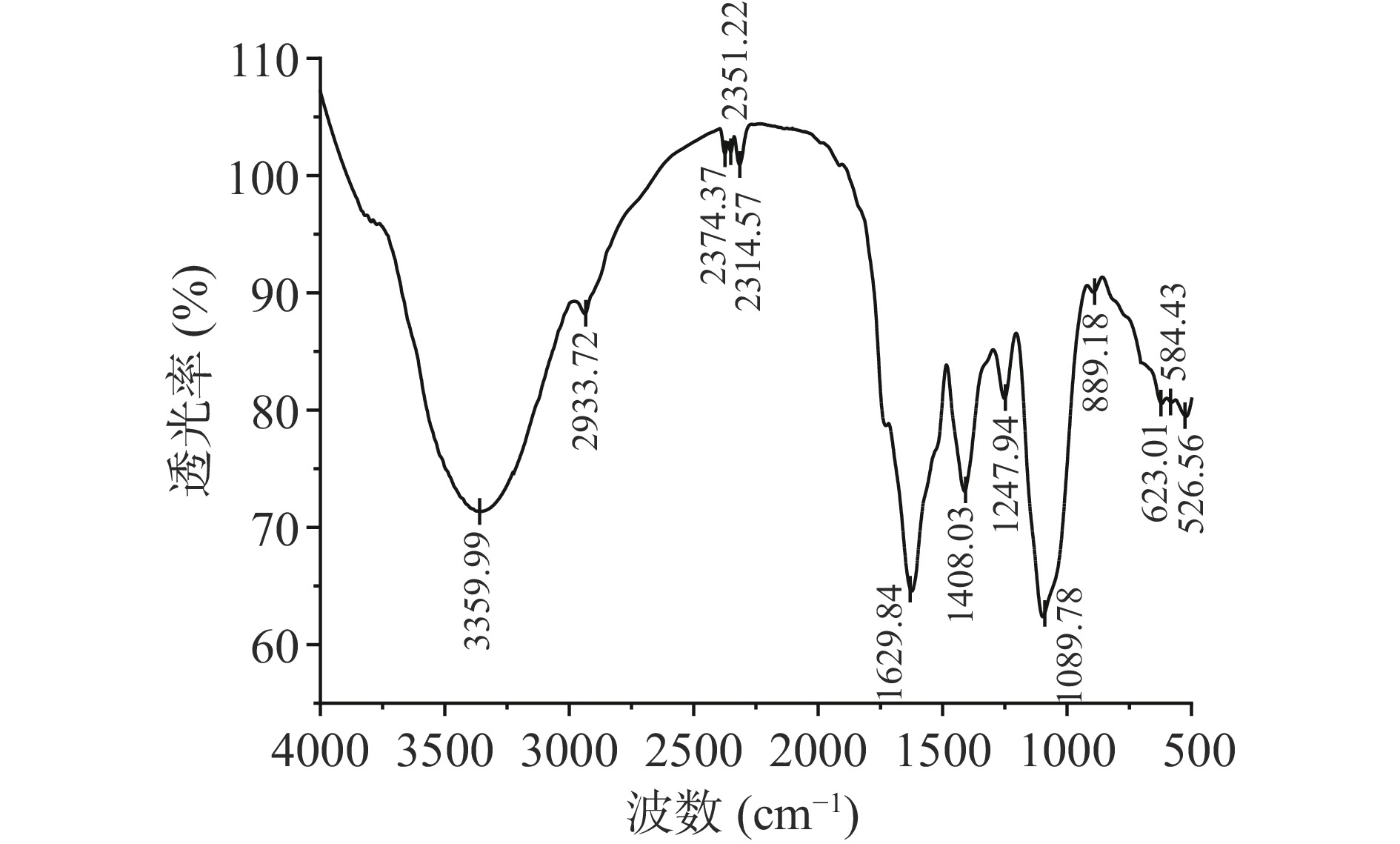
根据红外光谱法测定分析多糖中的基础官能团。如图5所示,在大约3359.99 cm−1处出现强而宽的吸收峰,可判断是其分子中的氢键引起的O-H的伸缩振动,而约2933.72 cm−1附近的吸收峰,表明存在C-H的伸缩振动,且这两处吸收峰都是多糖的主要特征吸收峰[28]。1629.84 cm−1位置强吸收峰出现,认为存在-COOH的C=O不对称伸缩振动[29],且1408.03 cm−1位置的弱吸收峰则反映了-COOH的C-O伸缩振动,表明其含有糖醛酸[30]。1000~1200 cm−1处的吸收峰,表明存在吡喃糖环的C-O-C和C-O-H的伸缩振动[31]。
2.4.2 扫描电镜
通过扫描电镜在50、200及2000倍下观察了金花葵多糖的表面形貌。如图6所示,放大50倍时,多糖形状无规律,层层片状结构,且碎片形状大小不一。放大200倍时,多糖表面边缘褶皱且不规则,推测是冻干时引起的[32]。文献[33]也发现,高倍镜放大2000倍时,多糖呈光滑、层状、片状形貌,表面有边缘褶皱。
2.5 金花葵多糖的体外抗氧化活性
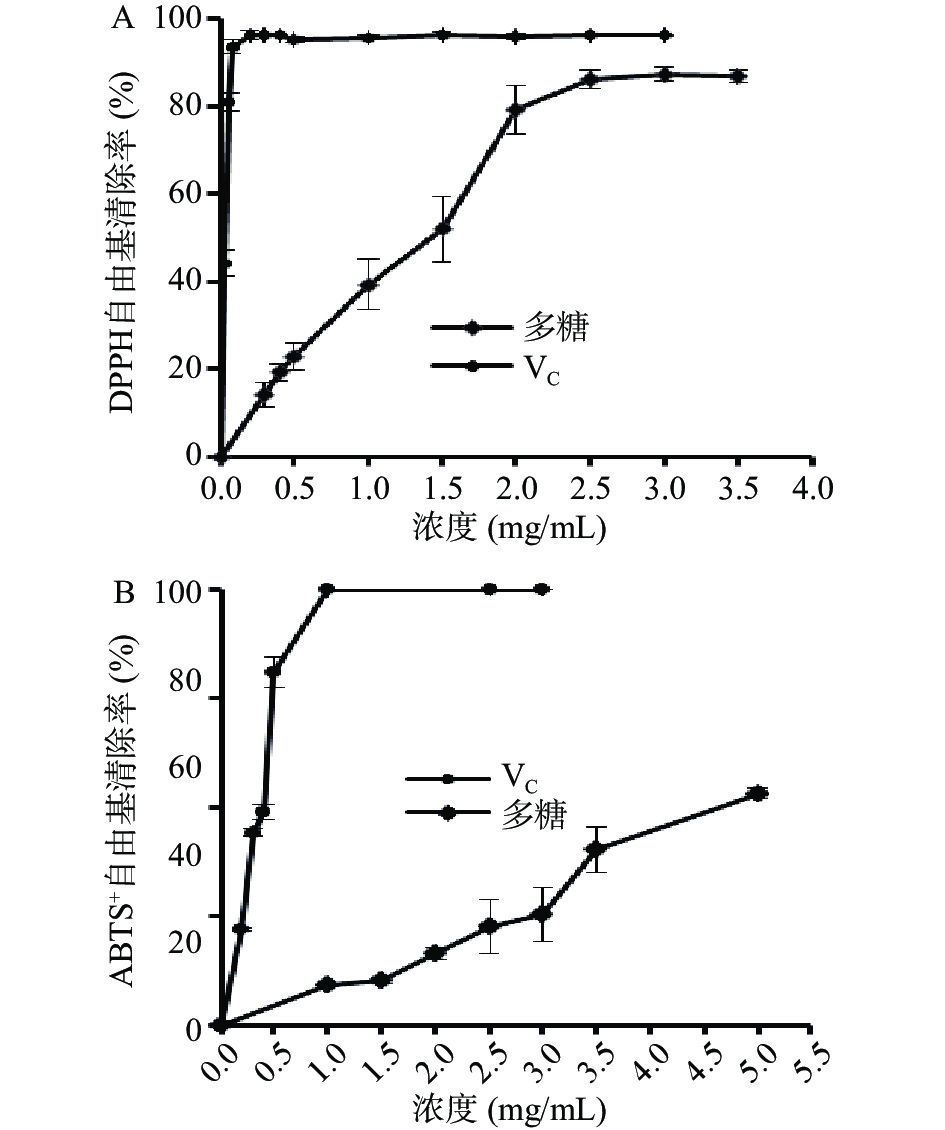
自由基清除能力的测定如图7所示,DPPH自由基清除率在0~2.5 mg/mL范围内(图7A),ABTS+自由基清除率在0~5.5 mg/mL范围内(图7B),伴随着多糖浓度的提高,其自由基清除率逐渐提高,在多糖浓度为2.5 mg/mL时,DPPH自由基清除率达到86.16%±2.07%,与该浓度的抗坏血酸对DPPH自由基清除能力接近,当多糖浓度在5.0 mg/mL时,ABTS+自由基清除率达到了53.16%±1.26%,优于仙人掌皮多糖[34](在10 mg/mL时,对ABTS+自由基清除率为39.85%)的ABTS+自由基清除能力。金花葵多糖对DPPH自由基和ABTS+自由基半数抑制对应的浓度(IC50)分别为1.22、4.43 mg/mL。相对于马齿苋多糖[35](DPPH自由基半数抑制对应的浓度(IC50)为6.79 mg/mL)、仙人掌皮多糖[34](ABTS+自由基半数抑制对应的浓度(IC50)高于10 mg/mL),总体显示金花葵多糖具有良好的抗氧化活性。
3. 结论
本研究采用水提醇沉法提取金花葵干花苞中多糖,以单因素条件筛选结合正交试验对其提取工艺进行优化,确定最佳的提取工艺参数:提取温度100 ℃、提取时间3 h和料液比1:50 g/mL,在其优化条件下,其多糖得率达17.23%±0.19%;通过高效液相色谱结果分析,金花葵多糖是由葡萄糖、甘露糖、鼠李糖、半乳糖、阿拉伯糖等所组成,其中阿拉伯糖、半乳糖、鼠李糖、甘露糖、葡萄糖的物质的量之比为0.97:1:0.23:0.05:0.43。经扫描电镜和红外分析表明,金花葵多糖是一种无规则、层层片状、具有吡喃环的杂多糖,多糖分子又含糖醛酸,其可能是酸性多糖。DPPH自由基与ABTS+自由基清除实验结果表明金花葵花苞中多糖具有较好的抗氧化能力,其对DPPH自由基、ABTS+自由基的半数抑制对应浓度(IC50)分别为1.22、4.43 mg/mL,以上结果为金花葵花中多糖的进一步应用开发研究提供了技术支持和理论依据。
-
表 1 正交试验因素与水平
Table 1 Factors and levels of orthogonal experiment
水平 因素 1 A料液比(g/mL) B提取时间(h) C提取温度(℃) 1 1:40 2.5 80 2 1:50 3 90 3 1:60 3.5 100 表 2 正交试验结果
Table 2 Results of orthogonal test
实验号 因素 多糖得率(%) A B C 1 1 1 1 8.37 2 1 2 2 10.84 3 1 3 3 16.14 4 2 1 2 9.94 5 2 2 3 17.54 6 2 3 1 8.66 7 3 1 3 14.20 8 3 2 1 8.93 9 3 3 2 9.78 K1 35.35 32.51 25.96 K2 36.14 37.31 30.56 K3 32.91 34.58 47.88 R 3.23 4.80 21.92 表 3 方差分析结果
Table 3 Results of variance analysis
方差来源 离差平方和 自由度 均方 F值 P值 A 1.89 2 0.95 2.77 0.2652 B 3.86 2 1.93 5.67 0.1500 C 89.07 2 44.53 130.59 0.0076 误差 0.68 2 0.34 总和 95.51 -
[1] 王霞, 叶强, 郑英杰, 等. 金花葵的化学成分研究简述[J]. 中国林副特产,2020(4):3. [WANG X, YE Q, ZHENG Y J, et al. Brief research on the chemicial constiuents of Hibiseus manihot[J]. Chinese Forest Sub-specialty,2020(4):3. [2] 何杨. 金花葵有效成分的提取分离及生物活性的初步研究[D]. 郑州: 郑州大学, 2019. HE Y. Extraction, preliminary study on extraction, separation and biological activity of active components from Hibiseus manihot[D]. Zhengzhou: Zhengzhou University, 2019.
[3] 杨美娟, 黄坤艳, 李玲, 等. 金花葵化学成分及其生物活性研究进展[J]. 安徽农业科学,2019,47(17):5−7,19. [YANG M J, HUAN K Y, LI L, et al. Research progress on chemical constituents and biological activity of Hibiscus manihot L[J]. Anhui Agricultural Sciences,2019,47(17):5−7,19. doi: 10.3969/j.issn.0517-6611.2019.17.002 [4] 魏青, 赵佳, 殷秀萍, 等. 金花葵多糖的分离纯化及抗氧化活性的研究[J]. 农业与技术,2020,40(10):4. [WEI Q, ZHAO J, YIN X P, et al. Isolation, purification and antioxidant activity of Hibiseus manihot polysaccharides[J]. Agriculture and Technology,2020,40(10):4. doi: 10.19754/j.nyyjs.20200530005 [5] 吴林娜, 刘梅, 李兴红. 多糖的生物活性及其在蔬菜中的应用[J]. 蔬菜,2021(5):32−38. [WU L N, LIU M, LI X H. Biological activity of polysaccharides and their application in vegetables[J]. Vegetables,2021(5):32−38. [6] QU J, HUANG P, ZHANG L, et al. Hepatoprotective effect of plant polysaccharides from natural resources: A review of the mechanisms and structure-activity relationship[J]. International Journal of Biological Macromolecules,2020,161(5):24−34.
[7] JIN M L, HUANG Q S, ZHAO K, et al. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L[J]. International Journal of Biological Macromolecules,2013,54(1):16−23.
[8] ZHANG Z S, WANG X M, HAN Z P, et al. Purification, antioxidant and moisture-preserving activities of polysaccharides from papaya[J]. Carbohydrate Polymers,2012,87(3):2332−2337. doi: 10.1016/j.carbpol.2011.10.067
[9] NIU J, PI Z F, YUE H, et al. Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chromatography-mass spectrometry[J]. Journal of Chromatograpy B,2012,907:7−12. doi: 10.1016/j.jchromb.2012.08.012
[10] 张盟雨, 王静, 张应中, 等. 水提醇沉法提取油茶饼粕多糖的响应面优化[J]. 林业与环境科学,2019,35(5):1−6. [ZHANG M Y, WANG J, ZHANG Y Z, et al. Optimization of water extraction and alcohol precipitation method for preparation of Camellia oleifera cake polysaccharides by response surface analysis[J]. Forestry and Environmental Sciences,2019,35(5):1−6. doi: 10.3969/j.issn.1006-4427.2019.05.001 [11] 黄杰涛, 张莲姬. 响应面法优化金花葵多糖提取工艺[J]. 食品工业科技,2016(19):5. [HUANG J T, ZHANG L J. Response surface methodology for optimizing extraction of polysaccharides from Aurea helianthus[J]. Science and Technology of Food Industry,2016(19):5. [12] 张晓娇, 孙立权, 罗爱芹, 等. 响应面法优化金花葵花水溶性黄酮和总多糖提取工艺[J]. 食品工业科技,2019,40(15):8. [ZHANG X J, SUN L Q, LUO A J, et al. Optimization of extraction technology of water-soluble flavonoid and total polysaccharides from Aurea helianthus flower by response surface methodology[J]. Science and Technology of Food Industry,2019,40(15):8. [13] 巫玲丽, 穆祯强, 张利. 金花葵多糖提取的工艺优化及抗氧化活性研究[J]. 南方农业学报,2017,48(1):109−113. [WU L L, MU Z Q, ZHANG L. Optimizing extraction technique of Hibiseu Smanihot L polysaccharides and antioxidant activity[J]. Journal of Southern Agriculture,2017,48(1):109−113. doi: 10.3969/j:issn.2095-1191.2017.01.109 [14] 姜天宇, 张筠, 付红岩, 等. 酸浆果实多糖的提取优化及其生物活性研究[J]. 食品安全质量检测学报,2021,12(14):5779−5785. [JIANG T Y, ZHANG Y, FU H Y, et al. Study on extraction optimization and biological activity of polysaccharide from Physalis alkekengi fruit[J]. Journal of Food Safety and Quality,2021,12(14):5779−5785. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.14.039 [15] X LIN, X JI, WANG M, et al. An alkali-extracted polysaccharide from Zizyphus jujuba cv. Muzao: Structural characterizations and antioxidant activities[J]. International Journal of Biological Macromolecules,2019,136(6):607−615.
[16] 周凌云, 鲁斌, 孙玉. 东方栓孔菌多糖对小鼠的降血糖和降血脂作用[J]. 南方医科大学学报,2020,40(8):1127−1133. [ZHOU L Y, LU B, SUN Y. Glucose-lowering effect of Trametes orientalis polysaccharides in hyperglycemic and hyperlipidemic mice[J]. J South Med Univ,2020,40(8):1127−1133. [17] 张倩男, 徐方敏, 连之娜, 等. 柱前衍生反相高效液相色谱法测定田菁种子水解液中的单糖[J]. 林产化学与工业,2020,40(3):31−38. [ZHANG Q N, XU F M, LIAN Z N, et al. Analysis of monosaccharide in Sesbania cannabina seed enzymatic hydrolysate by pre-column derivatization reversed-phase high performance liquid chromatography[J]. Chemistry and Industry of Forest Products,2020,40(3):31−38. doi: 10.3969/j.issn.0253-2417.2020.03.004 [18] 周彦强, 吴光斌, 陈发河. PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成[J]. 食品科学,2019,40(4):266−271. [ZHOU Y Q, WU G B, CHEN F H. Analysis of monosaccharide composition of polysaccharides from okra by pre-column derivatization high performance liquid chromatography[J]. Food Science,2019,40(4):266−271. doi: 10.7506/spkx1002-6630-20180130-426 [19] PR A, SP B, RA A, et al. Isolation and structural characterization of sulfated polysaccharide from Spirulina platensis and its bioactive potential: In vitro antioxidant, antibacterial activity and zebrafish growth and reproductive performance[J]. International Journal of Biological Macromolecules,2019,141:809−821. doi: 10.1016/j.ijbiomac.2019.09.024
[20] LIU Xiaoyan, CHEN Yixuan, WU Linxiu, et al. Optimization of polysaccharides extraction from Dictyophora indusiata and determination of its antioxidant activity[J]. International Journal of Biological Macromolecules,2017,103(4):175−181.
[21] DESEO M A, ELKINS A, ROCHFORT S, et al. Antioxidant activity and polyphenol composition of Sugarcane molasses extract[J]. Food Chemistry,2020,314:126180. doi: 10.1016/j.foodchem.2020.126180
[22] 唐健波, 肖雄, 杨娟, 等. 响应面优化超声辅助提取刺梨多糖工艺研究[J]. 天然产物研究与开发,2015,27(2):314−320. [TANG J B, XIAO X, YANG J, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Rosa roxburghii Tratt using response surface methodology[J]. Natural Product Research and Development,2015,27(2):314−320. doi: 10.16333/j.1001-6880.2015.02.024 [23] 汪梦雯, 刘文婷, 任雪宁, 等. 茯茶多糖提取工艺优化及其体外抗氧化和对益生菌生长的影响[J]. 陕西科技大学学报,2020,38(1):50−57. [WANG M W, LIU W T, REN X N, et al. Optimization of extraction process of polysaccharides from Fu brick tea and its antioxidation in vitro and effect on growth of probiotics[J]. Journal of Shaanxi University of Science & Technology,2020,38(1):50−57. doi: 10.3969/j.issn.1000-5811.2020.01.009 [24] 孙思燕, 江宁, 戴竹青, 等. 荷叶离褶伞多糖提取工艺优化及抗氧化活性研究[J]. 食品工业科技,2020,41(9):155−167. [SUN S Y, JIANG N, DAI Z Q, et al. Study on the optimization of extraction technology and antioxidant activity of polysaccharides from Lyophyllum decastes (Fr.) Singer[J]. Science and Technology of Food Industry,2020,41(9):155−167. [25] 宋姗姗, 杨艾华, 王微微, 等. 湄潭白茶多糖提取工艺优化及其抑菌活性研究[J]. 食品工业科技,2021,42(13):230−234. [SONG S S, YANG A H, WANG W W, et al. Optimization of extraction technology of polysaccharides from Meitan white tea and its antibacterial activity[J]. Science and Technology of Food Industry,2021,42(13):230−234. [26] 江和栋, 牛仙, 万仁口, 等. 灵芝孢子多糖的提取工艺优化及单糖组成、抗氧化活性分析[J]. 中国食品学报,2021,21(4):159−167. [JIANG H D, NIU X, WAN R K, et al. Optimization of extraction and analysis of monosaccharide composition and antioxidant activity of Ganoderma lucidum spore polysaccharide[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(4):159−167. doi: 10.16429/j.1009-7848.2021.04.019 [27] 刘剑. 金花葵富硒及硒多糖的研究[D]. 西安: 陕西科技大学, 2018 LIU J. Study on selenium rich and selenium polysaccharide of Jinhuakui[D]. Xi'an: Shanxi University of Science and Technology, 2018.
[28] ZZ A, JIAO C A, YI C A, et al. Extraction, structural characterization and antioxidant activity of turmeric polysaccharides[J]. LWT,2022,154:112805. doi: 10.1016/j.lwt.2021.112805
[29] SU Y, LI L. Structural characterization and antioxidant activity of polysaccharide from four auriculariales[J]. Carbohydrate Polymers,2019,229:115407.
[30] LAN Z, YMA B, YZ A, et al. Increased antioxidant activity and improved structural characterization of sulfuric acid-treated stepwise degraded polysaccharides from Pholiota nameko PN-01[J]. International Journal of Biological Macromolecules,2020,166(1):1220−1229.
[31] YLA B, JP B, PJ B, et al. Enzyme and microwave co-assisted extraction, structural characterization and antioxidant activity of polysaccharides from purple-heart radish[J]. Food Chemistry,2022,372:131274. doi: 10.1016/j.foodchem.2021.131274
[32] 韦志, 阮心眉, 戴涛涛, 等. 碱提砂仁多糖的结构表征及其抗氧化活性研究[J]. 食品工业科技,2021,42(24):7. [WEI Z, RUAN X M, DAI T T, et al. Structure characterization and antioxidant activity of polysaccharides from Amomum villosum extracted with alkaline solution[J]. Science and Technology of Food Industry,2021,42(24):7. doi: 10.13386/j.issn1002-0306.2021040255 [33] XLSABC D, CYLBC D, HYDBC D, et al. Extraction, purification, structural characterization, and antioxidant activity of polysaccharides from wheat bran[J]. Journal of Molecular Structure,2021,1233:130096. doi: 10.1016/j.molstruc.2021.130096
[34] AMAMOU S, LAZREG H, HAFSA J, et al. Effect of extraction condition on the antioxidant, antiglycation and α-amylase inhibitory activities of Opuntia macrorhiza fruit peels polysaccharides[J]. LWT-Food Science and Technology,2020,127:109411. doi: 10.1016/j.lwt.2020.109411
[35] 王博, 陈美琼, 郭翔宇, 等. 马齿苋多糖提取优化及抗氧化活性研究[J]. 北华大学学报(自然科学版),2022,23(4):471−477. [WANG B, CHENG M Q, GUO X Y, et al. Optimization of extraction process and antioxidant activities of polysaccharide from Portulaca oleracea[J]. Journal of Beihua University (Natural Science),2022,23(4):471−477. doi: 10.11713/j.issn.1009-4822.2022.04.009 -
期刊类型引用(10)
1. 王红,彭励,宋乐,冯璐,李振凯,李彦青,高跳. 银柴胡多糖超声辅助提取工艺优化及抗氧化活性分析. 食品工业科技. 2024(01): 185-191 .  本站查看
本站查看
2. 张浩,叶嘉,郭海燕,张含钰,郭伟. 金花葵花多糖对LPS诱导致炎小鼠的抗炎作用. 饲料研究. 2024(03): 95-99 .  百度学术
百度学术
3. 楚洪涛,刘仲旭,麻明杰,张婷,曹丽. 金花葵的主要研究简述. 现代农业研究. 2024(07): 6-12 .  百度学术
百度学术
4. 王天怡,张庆芬,黄磊磊,刘佳怡,杨逢建. 白丁香花多糖的提取、纯化及抗氧化活性研究. 食品工业科技. 2024(15): 233-243 .  本站查看
本站查看
5. 李慧,岳柯昕,王其凤,冯小燕,严天文,张涛. 秋葵属植物多糖的研究进展. 食品工业. 2024(07): 181-185 .  百度学术
百度学术
6. 龚欢,覃宝怡,施松善,张婷婷,王辉俊,王顺春. 制黄精多糖的结构表征及其抗氧化活性研究. 中草药. 2024(16): 5418-5427 .  百度学术
百度学术
7. 马鹰,路娟,夏念桐,王志刚,陈曦. 金花葵的化学成分和药理作用研究进展. 化学与生物工程. 2024(09): 7-14 .  百度学术
百度学术
8. 刘贵涛,权煜,饶欢,赵丹丹,赵霞,郝建雄,刘学强. 亚麻籽粕蛋白多肽的制备及其抗氧化性. 食品研究与开发. 2024(24): 84-91 .  百度学术
百度学术
9. 冉俊枫,张文明,张静雯,任艳,吕露阳,曾锐. 苦竹笋多糖提取工艺优化及其抗氧化活性研究. 食品科技. 2023(10): 165-172 .  百度学术
百度学术
10. 蒋大珍,马佰诚,杨皎,罗进城,孙雪薇,李佳琳. 槲寄生多糖提取工艺优化及抗氧化活性研究. 北方农业学报. 2023(05): 84-92 .  百度学术
百度学术
其他类型引用(3)







 下载:
下载:



 下载:
下载:



