Effect of Camellia Oil on Lipid Metabolism of HepG2 Cells Induced by Free Fatty Acids
-
摘要: 目的:探究山茶油对游离脂肪酸诱导的HepG2细胞脂质代谢的影响。方法:首先,利用CCK8法测定不同浓度山茶油对HepG2细胞活性的影响以选定适宜浓度进行后续实验。其次,采用不同浓度山茶油对HepG2细胞进行24 h干预,再使用0.5 mmol/L游离脂肪酸处理24 h诱导建立脂肪肝细胞模型。然后,通过油红O染色法判断各组间的脂滴生成情况,并参照相关试剂盒测定各干预下细胞内脂质水平的变化情况。最后,通过qRT-PCR法测定细胞内脂质代谢相关基因的表达,以探讨山茶油调节脂质代谢的作用及其可能的机制。结果:与正常对照组相比,造模干预组细胞内的甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)含量显著升高(P<0.05),高密度脂蛋白胆固醇(HDL-C)含量显著降低(P<0.05);与造模干预组相比,茶油预处理显著逆转了游离脂肪酸诱导细胞内TG、HDL-C和LDL-C含量的变化(P<0.05)。qRT-PCR结果表明,与造模干预组相比,山茶油预处理显著降低了游离脂肪酸诱导的HepG2细胞内脂肪酸转运酶(CD36)、固醇调节元件结合蛋白-1c(SREBP-1c)、脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)和过氧化物酶体增殖物激活受体-γ(PPARγ) mRNA表达量(P<0.05);同时显著升高了脂肪甘油三酯脂肪酶(ATGL)、过氧化物酶体增殖物激活受体-α(PPARα)和肉毒碱棕榈酰转移酶-1A(CPT1A)mRNA表达量(P<0.05)。结论:山茶油可通过调节脂质生成和氧化相关基因的表达水平,部分缓解由游离脂肪酸诱导的HepG2细胞脂质代谢紊乱。Abstract: Objective: To evaluate the effects of camellia oil on lipid metabolism in free fatty acid-induced HepG2 hepatocytes. Methods: To screen the optimal concentration of action, the effect of camellia oil on HepG2 activity was assessed by CCK-8 assay. HepG2 cells were exposed to different concentrations of camellia oil for 24 h, after which the cells were treated with 0.5 mmol/L free fatty acids for 24 h to induce in vitro model of liver steatosis. Then, intracellular lipid content was detected using Oil Red O staining. Lipid profiles were measured by commercial kits. The mRNA expression of genes related to lipid metabolism was measured by qRT-PCR to investigate the effects and possible mechanisms of camellia oil in regulating lipid metabolism. Results: Compared with the normal control group, fatty acids induction significantly increased the contents of triglyceride (TG) and low-density lipoprotein cholesterol (LDL-C) (P<0.05), and decreased the content of high-density lipoprotein cholesterol (HDL-C) (P<0.05). Interestingly, camellia oil pretreatment significantly reversed the changes in intracellular contents of TG, HDL-C and LDL-C induced by fatty acids incubation (P<0.05). In addition, compared with the model group, camellia oil pretreatment significantly decreased the mRNA expression of fatty acid transporter (CD36), fatty acid synthase (FAS), acetyl-CoA carboxylase (ACC), sterol regulatory element-binding protein-1c (SREBP-1c), and peroxisome proliferator-activated receptor γ (PPARγ) (P<0.05), and increased the mRNA expression of adipose triglyceride lipase (ATGL), peroxisome proliferator-activated receptor alpha (PPARɑ), and carnitine palmitoyltransferase-1A (CPT1A) (P<0.05). Conclusions: Camellia oil may alleviate the lipid metabolism disorder induced by free fatty acids in HepG2 cells partly by modulating the expression levels of genes involved in lipid lipogenesis and oxidation.
-
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是指一类包括非酒精性脂肪肝、非酒精性脂肪肝炎、肝硬化和肝癌在内的疾病连续体[1],在全球成年人口中的患病率约为25%[2]。相关调查发现,NAFLD已成为青少年和成年人慢性肝病发病率增加的主要驱动因素[3],同时也是我国慢性肝病发生的首要原因[2]。其主要特征和早期病理变化是由甘油三酯代谢异常引起的肝细胞内脂肪过度沉积[4-5]。肝脏被认为是最为重要的脂肪代谢场所,也是脂质平衡的中心调节者。当肝脏内脂质的摄取、生成和清除三者之间的平衡被打破时,脂质将在肝脏中逐渐蓄积,最终引起肝脏脂肪变性[6]。因此,维持肝脏脂质稳态对于预防和治疗NAFLD具有重要意义。
山茶油(Camellia oil)又称茶油、茶籽油、油茶籽油,是我国特有的纯天然木本优质食用植物油。茶油中含有不饱和脂肪酸、多酚、角鲨烯、生育酚等生物活性成分[7],具有调节血脂、减轻肝损伤、抗高血压、抗阿尔茨海默病等作用[8]。多项动物研究发现,相比于猪油、棕榈油、大豆油、红花油等食用油,茶油能更有效地升高高密度脂蛋白胆固醇(HDL-C)水平和降低低密度脂蛋白-胆固醇(LDL-C)/HDL-C比率,同时可显著减少高脂饮食诱导的肥胖小鼠的脂肪沉积、降低动脉粥样硬化指数、减轻肝脂肪变性和炎症[9-12]。这表明山茶油可有效调节体内脂质代谢,从而降低血脂水平,但是目前其调控脂质代谢的具体机制尚不明确。近年来,有研究报道山茶油可通过调节过氧化物酶体增殖物受体激活剂(PPARs)的表达介导脂质代谢来改善小鼠的记忆障碍[13]。另有文献报道,油茶中的多酚提取物[14]和油茶皂苷A2[15]可通过下调固醇调节元件结合蛋白-1c(SREBP-1c)、脂肪酸合成酶(FAS)的表达来抑制脂肪酸合成,同时上调酰基辅酶A氧化酶(ACOX-1)、肉毒碱棕榈酰转移酶-1A(CPT1A)的表达以促进脂肪酸β氧化,进而发挥对脂肪酸代谢的调控作用。此外,Gao等[16]研究认为山茶油可以显著下调高脂饮食喂养小鼠肝脏中SREBP1和SREBP断裂激活蛋白的表达,从而降低其血清和肝脏中的甘油三酯水平。因此,推测山茶油可通过调节脂质代谢相关基因的表达,进而抑制脂质在肝脏中过度积聚。但是目前尚未有关山茶油对肝细胞内脂质蓄积的预防作用以及其调节机制的研究报道。
本研究利用游离脂肪酸诱导建立HepG2细胞脂质积累模型,采用预防性给予山茶油进行干预,观察其对HepG2细胞内脂质水平及脂质代谢相关基因表达的影响,探究山茶油对体外脂质积累的抑制作用,从而为山茶油防治NAFLD提供理论依据。
1. 材料与方法
1.1 材料与仪器
人肝癌细胞HepG2 湖南丰晖生物科技有限公司;有机山茶油 福建省沈郎油茶股份有限公司;0.25% 胰酶-EDTA、DMED高糖培养基 上海赛默飞世尔科技有限公司;胎牛血清 Newzerum;二甲基亚砜 MP;1%青霉素-链霉素-两性霉素B混合液、牛血清白蛋白(不含脂肪酸)、改良Lillie-Mayer苏木素染色液 北京索莱宝科技有限公司;磷酸缓冲盐溶液(1×PBS)(0.01 mol/L,pH7.2~7.4) 南京生航生物技术有限公司;油酸(oleic acid,OA)、棕榈酸(palmitic acid,PA) 美国Sigma公司;油红O干粉 上海生工生物工程有限公司;4%多聚甲醛固定液、CCK-8试剂盒 Biosharp;总胆固醇(T-CHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测试盒 南京建成生物科技有限公司;BCA蛋白定量试剂盒 上海雅酶生物医药科技有限公司;曲拉通Triton X-100(98%) 北京索莱宝科技有限公司;无水乙醇、甲醇、异丙醇 国药集团化学试剂有限公司;AG RNAex Pro RNA提取试剂、Evo M-MLV反转录预混型试剂盒、SYBR Green Pro Taq HS 预混型qPCR试剂盒 湖南艾科瑞生物工程有限公司。
HF-safe1200型生物安全柜 香港力康科学仪器有限公司;Forma系列CO2培养箱、酶标仪、Quant Studio 5荧光定量PCR仪 美国Thermo公司;DM500型倒置生物显微镜 德国Leica公司;5430R型高速冷冻台式离心机 德国Eppendorf公司;DS-11型超微量紫外分光光度计 美国Denovix公司;Veriti 96型梯度PCR仪 美国应用生物系统(ABI)公司。
1.2 实验方法
1.2.1 细胞培养
参照邓金兰[17]的方法进行HepG2细胞培养。取5 mL 胎牛血清和0.5 mL青霉素-链霉素-两性霉素B混合液加至44.5 mL DMED高糖培养基中,混合配制成50 mL的完全培养基。将生长状态良好的HepG2细胞以15×104个/孔的密度种板至六孔板中,按2 mL/孔加入完全培养基,于37 ℃,5% CO2培养箱进行培养。待细胞达到生长抑制时,用PBS清洗后加入适量0.25%胰酶-EDTA,待镜下观察见细胞回缩变圆,用枪头将细胞吹打下来并转移至离心管中,以300 r/min离心5 min,留取细胞沉淀进行传代处理。
1.2.2 山茶油及造模条件对HepG2细胞活性的影响
参照Shan等[18]的研究方法并结合CCK-8试剂盒测定细胞活性。将HepG2细胞按0.8×104个/孔接种于96孔板,第2 d按100 µL/孔分别加入含0.5 mmol/L游离脂肪酸(OA:PA=2:1)的培养基和含不同浓度的山茶油(0、5、10、25、50、75和100 µL/mL)的培养基于CO2培养箱培养24 h,各设6个复孔。随后,弃原培养基,每孔加入100 µL含CCK-8试剂的培养基(其中CCK-8试剂:完全培养基为1:10),置于37 ℃恒温培养箱孵育30~40 min,于450 nm处测定各孔的吸光度值(OD值)。细胞存活率计算公式如下:
细胞存活率(%)=OD干预−OD空白OD0干预−OD空白×100 式中:OD干预表示具有细胞、培养基、CCK-8溶液和药物溶液孔的吸光度值;OD空白表示具有培养基、CCK-8溶液,没有细胞的孔的吸光度值;OD0干预表示具有细胞、培养基、CCK-8溶液,没有药物溶液的孔的吸光度值。
1.2.3 细胞的分组干预
根据预实验结果并结合相关文献[19],采用0.5 mmol/L游离脂肪酸(OA:PA=2:1)于37 ℃,5% CO2培养箱培养24 h作为诱导脂肪肝细胞模型建立的条件。将实验分为正常对照组、造模干预组和山茶油干预组(分别用含5、10、20和30 µL/mL山茶油的培养基进行处理),每组3个重复。将HepG2细胞按15×104个/孔接种于六孔板中,待细胞生长达60%左右,正常对照组和造模干预组使用完全培养基培养24 h,山茶油干预组按实验分组进行干预培养24 h,各设3个平行实验组。弃原培养基,PBS洗2遍,造模干预组和山茶油干预组均换用含0.5 mmol/L游离脂肪酸(OA-PA混合液,其中OA:PA为2:1)的培养基进行24 h造模干预培养。正常对照组则换用新鲜的完全培养基继续培养24 h。
1.2.4 油红O染色观察细胞内脂滴形成情况
参照曾璐[20]的染色方法并进行改进。按1.2.3对细胞进行分组干预处理。随后,弃原培养基,PBS洗2遍。倒置晾干5 min,加4%多聚甲醛固定液固定30 min;弃固定液,蒸馏水洗2遍;加60%异丙醇处理5~10 min;弃异丙醇,加入配制好的油红O工作液避光染色30 min;用60%异丙醇洗去多余的油红O染液;苏木素复染核1~2 min,用蒸馏水洗去多余染液。最后,于倒置显微镜下对染色结果进行观察。
1.2.5 细胞内脂质相关指标的测定
按1.2.3进行相关的干预处理后,收集细胞沉淀。先将98% Triton X-100稀释至2%,然后按80 µL/孔将2% Triton X-100加至六孔板中,裂解30 min,刮下细胞,按试剂盒说明对细胞内的TC、TG、HDL-C、LDL-C及其相应的蛋白浓度进行测定。
1.2.6 qRT-PCR测定脂质代谢相关基因的表达情况
按1.2.3对细胞进行干预处理后,弃原培养基,用PBS清洗。使用Trizol裂解提取细胞总RNA并测定浓度。使用Evo M-MLV反转录预混型试剂盒将RNA逆转录为cDNA,再取2 µL cDNA样本按照SYBR Green Pro Taq HS 预混型qPCR试剂盒进行PCR扩增。
PCR扩增条件:第一步,95 ℃预变性30 s;第二步,95 ℃预变性5 s,60 ℃退火并延伸30 s,共40个循环。溶解曲线条件:循环数:1,95 ℃,15 s,60 ℃,1 min,95 ℃,1 s。以人GAPDH基因为内标参照,使用比较法2−ΔΔCt来计算目的基因mRNA相对表达量。引物序列见表1。
表 1 实时荧光定量PCR引物序列Table 1. Real-time PCR primer sequences基因 上游(5'→3') 下游(5'→3') CD36 AGCCACAAACCAAGAATCTACCTG CTTCCCAGTTAAAAGGAAAGGCACT PPARγ ATTCAAGACAACCTGCTACAAGCC CTGTCTCCGTCTTCTTGATCACC SREBP-1c CAGCTCTGTCCCCATCAGGT ACTTCTTGCAGGGAGACCCAA FAS CACAACTCCAAGGACACAGTCA CCCGGATCACCTTCTTGAGC ACC GAGACTAGCCAAACAATCTCGTCA AATCTTCTGATGCCTGCGTTG ATGL CCCACTTCAACTCCAAGGACGA TCTGAAATGCCACCATCCACGTA PPARα GAGTTTATGAGGCCATATTCGCCAT TCACAGAACGGTTTCCTTAGGCTT CPT1A TGCAAAGGCGACATCAATCCG AAATCCACGTCGTTTGCCAGA PGC-1α CCATGGATGAAGGGTACTTTTCTG TCTTCTTCCAGCCTTGGGGA GAPDH GCACCGTCAAGGCTGAGAAC TGGTGAAGACGCCAGTGGA 1.3 数据处理
采用IBM SPSS 20.0和Graph Pad Prism 9.0软件进行统计学分析。各指标数据经过正态性检验和方差齐性检验,进行单因素方差分析(One-Way ANOVA)。若方差齐性则采用LSD法进行两两比较,若方差不齐则采用Dunnet’ T3 进行两两比较。检验水准α=0.05。结果以平均值±标准误(
¯X ±SEM)。P<0.05为差异有统计学意义。2. 结果与分析
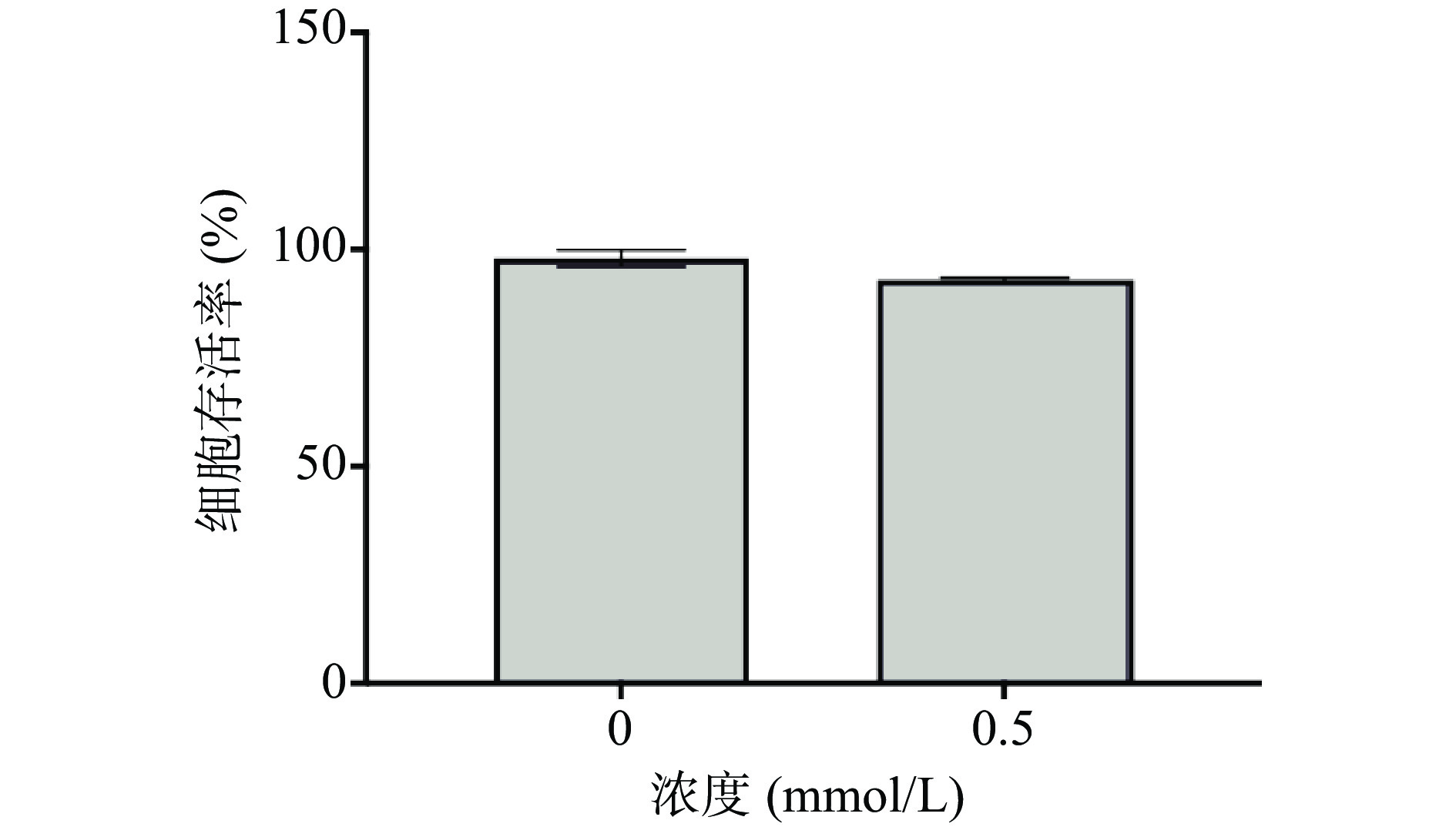
2.1 0.5 mmol/L游离脂肪酸干预24 h对HepG2细胞活性的影响
由于棕榈酸的脂毒性显著高于同等浓度下油酸的毒性[21],因此本实验在造模干预时选了用对肝细胞毒性最小的PA与OA浓度比,即PA:OA为1:2[22]。在0.5 mmol/L游离脂肪酸(PA:OA=1:2)干预培养24 h的造模条件下对HepG2细胞活性进行了测定,如图1所示。在24 h干预下,游离脂肪酸浓度为0.5 mmol/L时细胞活性(93.08%)与正常对照组(0 mmol/L)的细胞活性(98.00%)之间差异无统计学意义(P>0.05)。说明此干预条件对细胞的正常生长不会产生明显的影响。同时,由于HepG2细胞并不具备长时间储存脂质的能力,摄入的脂肪酸浓度过高不仅会诱发细胞内脂质积累过量,还会导致细胞功能受损,甚至凋亡,影响后续研究的进行[23]。因此,后续实验应在对细胞不产生明显毒性作用的基础上,综合考虑在0.5 mmol/L游离脂肪酸干预24 h的条件下HepG2细胞内的成脂量,以判断建立的体外脂质积累模型是否成功。
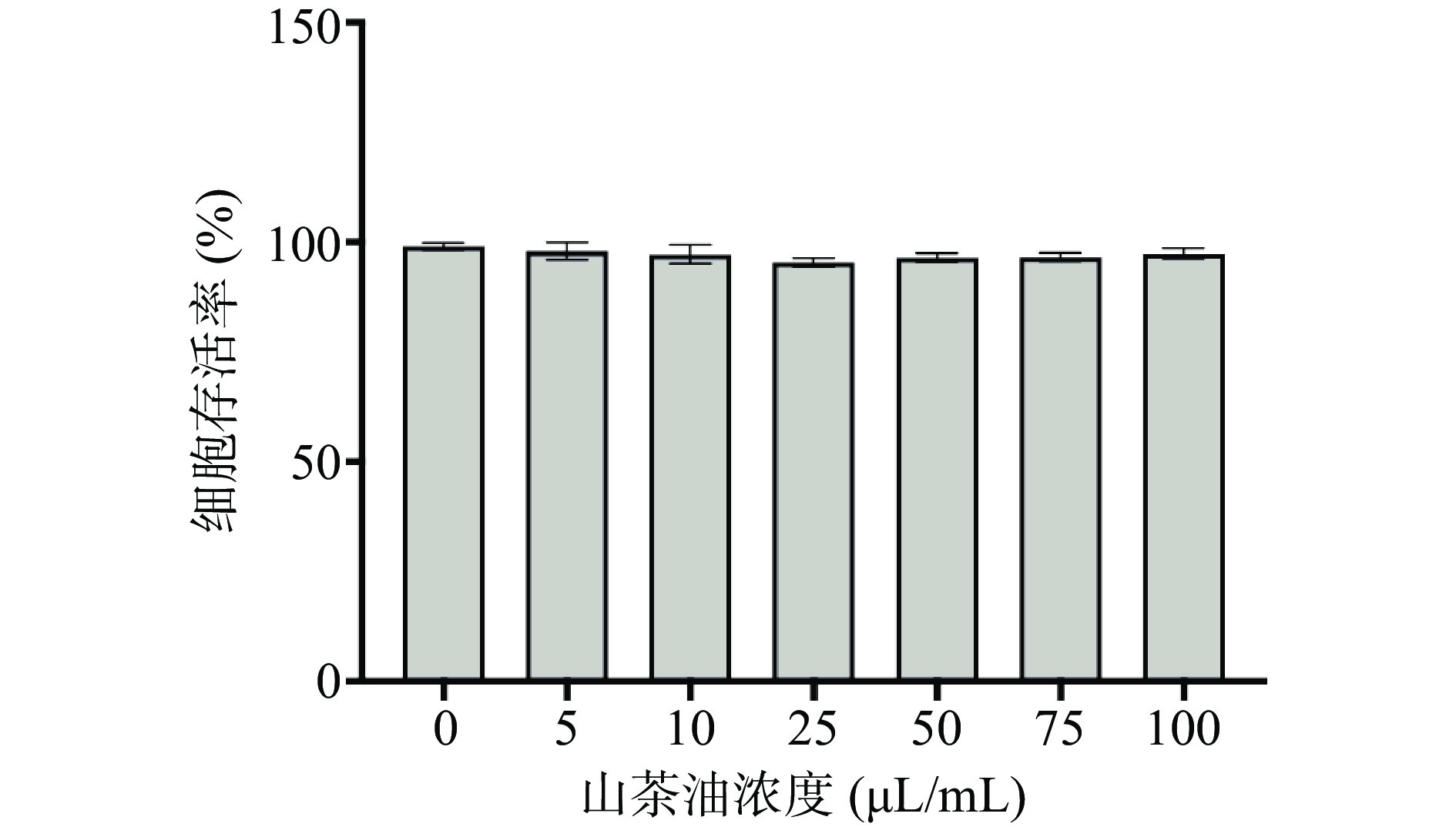
2.2 山茶油对HepG2细胞活性的影响
如图2所示,HepG2细胞的存活率随山茶油的浓度增加,呈现不同程度地降低。但与正常对照组(0 µL/mL)相比,在5、10、25、50、75和100 µL/mL山茶油浓度干预下,HepG2细胞的存活率均未出现统计学意义的显著降低(P>0.05),细胞的存活率均在95%以上。该结果表明在0~100 µL/mL浓度范围内的山茶油对HepG2细胞的存活状况没有出现明显的毒性影响。李晓静[24]通过对比大豆油、椰子油等八种食用油对HepG2细胞存活率的影响,发现当脂肪酸浓度低于200 μmol/L时,细胞的存活率均在90%以上。说明膳食油脂在一定浓度范围内,对细胞的毒性较弱。同时,由于预实验观察到的山茶油具有体外降脂效果的浓度大致在25 µL/mL,因此本研究最终选用了5、10、20和30 µL/mL的山茶油浓度进行后续实验。
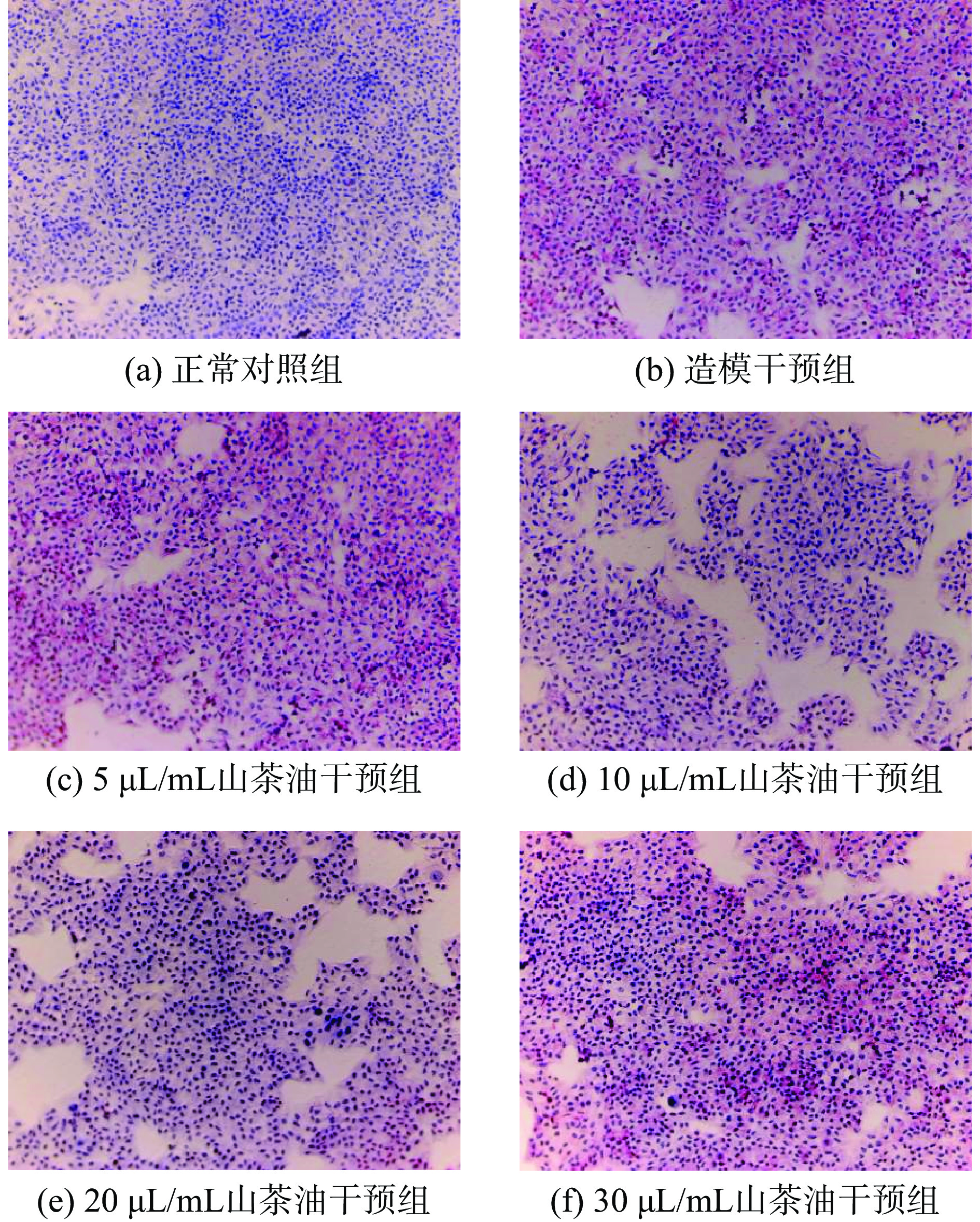
2.3 油红O染色观察不同浓度山茶油对游离脂肪酸诱导的HepG2细胞内脂滴形成的情况
利用油红O染色性质,显微镜下观察不同山茶油干预后HepG2细胞内脂质含量的变化结果如图3所示。正常对照组细胞整体呈现蓝色,几乎没有脂质积累。相比于正常对照组,造模干预组细胞内可见明显红色脂滴生成。而与造模干预组相比,山茶油干预组细胞内红色脂滴出现不同程度地减少,其中10和20 µL/mL山茶油干预组的减少较为明显。说明山茶油干预可以在一定程度上抑制游离脂肪酸诱导的细胞内脂滴的形成;但当山茶油浓度升高达30 µL/mL时,可见这种抑制效果被减弱。
2.4 山茶油对HepG2细胞内脂质水平的影响
肝脏细胞从血液中吸收的游离脂肪酸和内源性从头合成的脂肪酸,最终会以TG的形式存储下来;当TG在肝细胞内过度积累将会导致NAFLD的发生[6, 25]。通过对HepG2细胞内TG含量进行检测发现,各组间细胞内TG水平与染色结果基本一致(表2)。与正常对照组相比,造模干预组细胞内TG含量升高,约为正常对照组的4.8倍,说明建立的脂肪肝细胞模型较为成功。与造模干预组相比,山茶油干预组细胞内TG含量显著降低(P<0.05)。其中10和20 µL/mL山茶油干预组TG含量降低更为明显。而当山茶油浓度为30 µL/mL时,细胞内TG含量出现升高的趋势。这可能是由于山茶油的浓度过高,使得进入细胞内的游离脂肪酸增加,导致其降脂效果被减弱。
表 2 不同浓度山茶油干预对HepG2细胞内TC、TG、HDL-C、LDL-C的影响Table 2. Effects of different concentrations of camellia oil on TC, TG, HDL-C and LDL-C组别 TG
(mmol/L)TC
(mmol/g prot)HDL-C
(mmol/L)LDL-C
(mmol/L)正常对照组 0.24±0.06a 0.04±0.01a 0.012±0.000c 0.010±0.001a 造模干预组 1.15±0.04e 0.05±0.01ab 0.005±0.000a 0.023±0.002c 5 µL/mL山茶油
干预组0.93±0.02d 0.06±0.01b 0.008±0.001b 0.020±0.001c 10 µL/mL山茶油
干预组0.61±0.02b 0.05±0.00ab 0.008±0.001b 0.015±0.001b 20 µL/mL山茶油
干预组0.66±0.01b 0.06±0.00b 0.009±0.001b 0.012±0.001a 30 µL/mL山茶油
干预组0.81±0.04c 0.06±0.00b 0.007±0.000b 0.013±0.001ab 注:同列不同小写字母表示差异有统计学意义,P<0.05。 高密度脂蛋白(HDL)在肝脏中合成,主要用于逆向转运磷脂和胆固醇(TC),对肝脏具有保护作用[26]。HDL还可以抑制低密度脂蛋白(LDL)的氧化过程,降低氧化LDL引起的损伤,从而降低氧化应激反应,减少脂肪肝的发生风险[27]。由表2可知,与正常对照组相比,造模干预组细胞内HDL-C含量显著降低(P<0.05),LDL-C含量显著升高(P<0.05),TC含量略有升高,但差异无统计学意义(P>0.05)。说明在游离脂肪酸的干预下,细胞内脂蛋白的表达出现异常。与造模干预组相比,山茶油干预组细胞内的TC含量虽然无显著变化(P>0.05),但是细胞内HDL-C含量显著升高(P<0.05),LDL-C含量显著降低(P<0.05)。说明山茶油可以有效抑制由游离脂肪酸引起的HepG2细胞内HDL-C和LDL-C的异常,从而维持细胞内胆固醇的相对恒定。这与Gao等[16]和吴雪辉等[28]的研究结果相似。
2.5 山茶油对HepG2细胞肝脂代谢相关基因表达的影响
肝脏脂质蓄积主要由游离脂肪酸(FFA)在肝脏中的摄取升高,线粒体脂肪酸β氧化(FAO)受损或脂肪酸从头合成(DNL)的异常活化等多种因素引起[29-30]。当肝脏甘油三酯合成速率超过肝脏甘油三酯分解代谢速率时,甘油三酯就会在细胞内蓄积[31]。因此,控制甘油三酯的合成和分解代谢有利于从根本上预防和改善由甘油三酯积累引起的肝细胞内脂质积累。
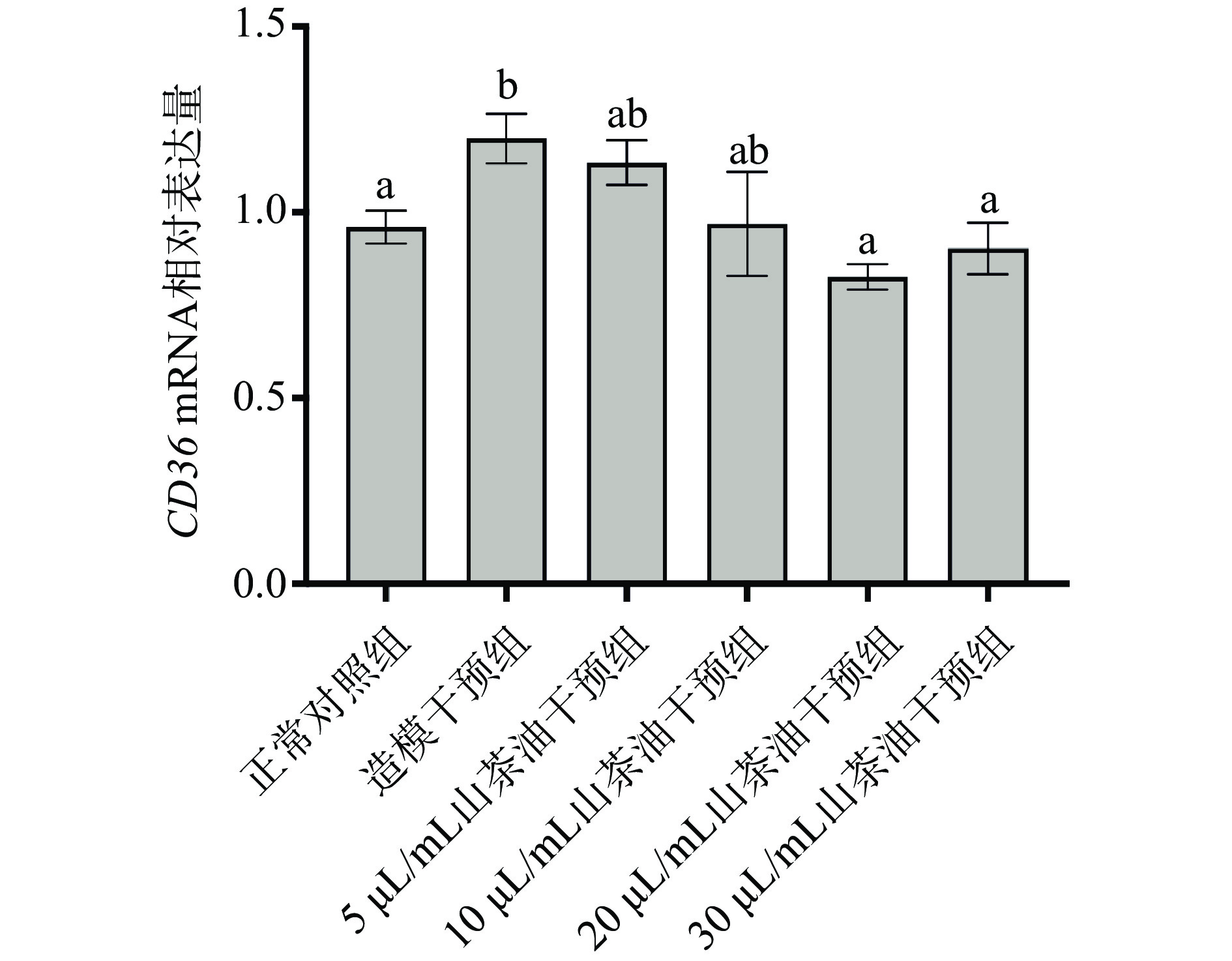
2.5.1 山茶油对HepG2细胞内脂质摄取相关基因表达的影响
CD36是一种脂肪酸转运酶,参与脂肪酸的摄取、储存和TG的分泌等脂质代谢的多个过程。可将长链脂肪酸从循环中转运到脂肪细胞、肝脏细胞和肌细胞中[32],在肝脏脂代谢中起着至关重要的作用。其过度表达会导致FFA过度摄取、TG积累增加,进而加速肝脂肪变性的进程[33]。由图4可知,与正常对照组相比,造模干预组CD36 mRNA的表达水平显著升高(P<0.05);与造模干预组相比,山茶油干预可以不同程度地降低CD36 mRNA的表达,当山茶油浓度为20和30 µL/mL时表现为差异具有显著性(P<0.05)。说明山茶油可能通过降低CD36的表达以减少HepG2细胞对脂肪酸的摄取,进而抑制细胞内的脂质积聚。
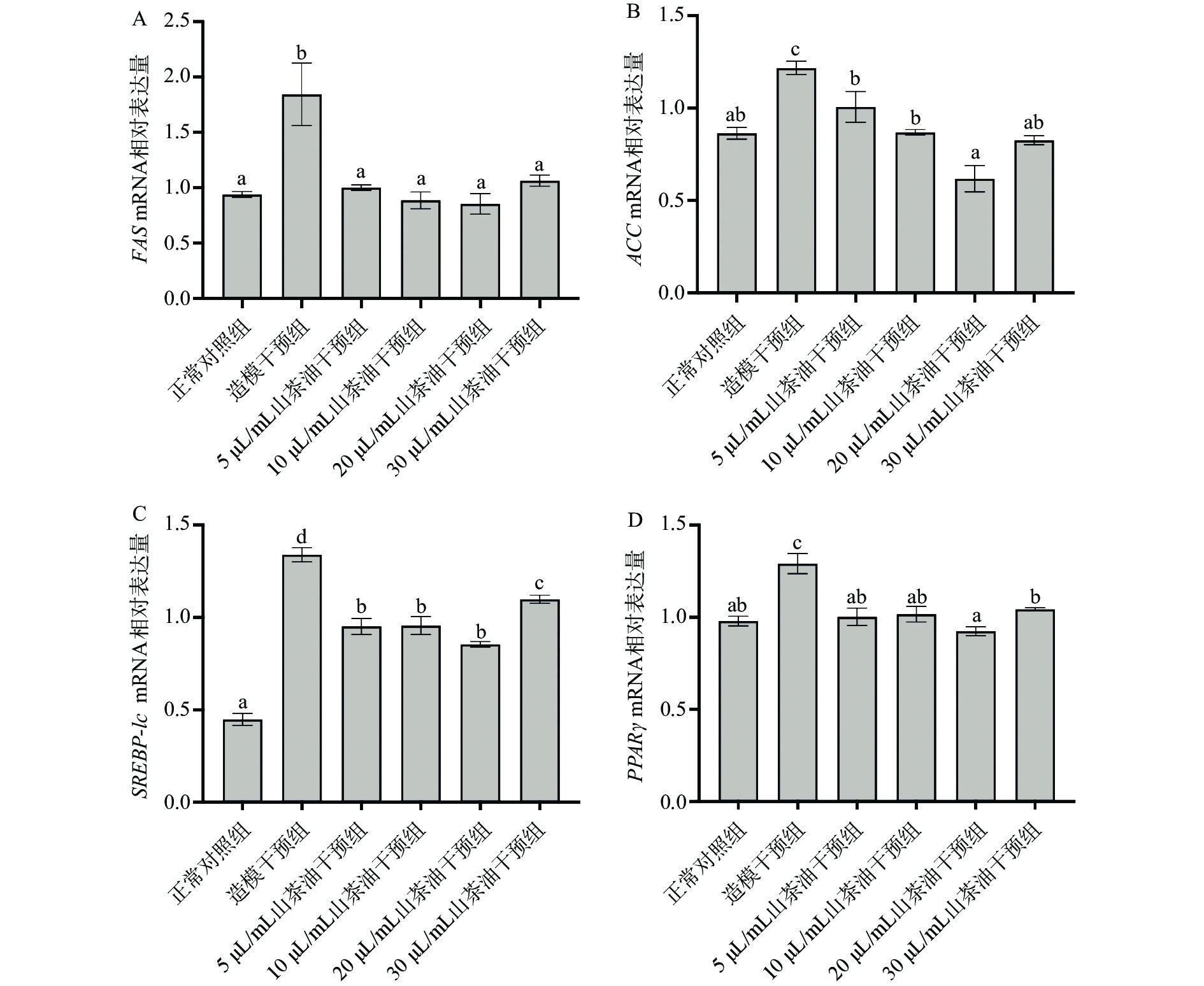
2.5.2 山茶油对HepG2细胞内脂肪生成相关基因的影响
DNL是一种通过乙酰辅酶A羧化酶(ACC)和FAS将乙酰辅酶A和丙二酰辅酶A转化为脂肪酸的细胞过程[34]。在肝脏中,乙酰辅酶A可以通过ACC和FAS转化为棕榈酸酯,最终储存为甘油三酯。由图5A和5B可知,与正常对照组相比,造模干预组细胞内的FAS和ACC mRNA表达量均显著升高(P<0.05)。说明过多游离脂肪酸的确会激活肝细胞内与脂质生成相关的酶,加速TG的合成[35]。临床研究发现,在肥胖的NAFLD患者中,DNL的比率增加会导致肝脏中约20%~30%的脂肪积聚[36]。与造模干预组相比,不同浓度山茶油预处理可显著下调FAS和ACC基因的表达(P<0.05),并在0~20 µL/mL浓度范围内随山茶油剂量的增加而下调更为明显。有研究指出,FAS和ACC的表达量下调不仅可以有效降低脂肪的合成[37],同时ACC抑制还可以通过促进CPT-1的活性而增加线粒体β-氧化[38]。因此,推测山茶油可通过降低脂肪合成相关酶的表达从而降低脂质的从头合成,同时还可能影响肝细胞内线粒体的脂质分解,且该作用效果在0~20 µL/mL山茶油浓度范围内具有一定的剂量效应关系。
SREBP-1c作为NAFLD最直观最敏感的指标,其在肝脏中过表达与肝脏脂肪变性呈正相关[39]。SREBP-1c可上调ACC1和FAS的编码基因,启动TG的合成[40-41]。由图5C可知,与正常对照组相比,造模干预组细胞内的SREBP-1c mRNA表达量显著升高(P<0.05)。与造模干预组相比,山茶油干预可以不同程度地显著降低细胞内SREBP-1c mRNA表达量(P<0.05),变化趋势与FAS和ACC基因大致相同。有文献报道,在NAFLD小鼠中,SREBP1/FAS信号通路被激活,抑制SREBP1的活性可以有效降低肝脏脂质沉积,改善NAFLD小鼠的肝脂肪变性[42-43]。说明山茶油也可能通过下调SREBP1/FAS/ACC信号通路,从而减少肝细胞脂质的从头合成,以抵抗游离脂肪酸引起的肝细胞脂质沉积。
过氧化物酶体增殖物激活受体-γ(PPARγ)是脂肪生成的重要转录因子,可以通过调节SREBP-1c进而刺激其下游ACC和FAS的表达促使NAFLD的形成[44];还可以通过上调CD36的表达增加肝脏脂肪酸摄取[45]。由图5D可知,与正常对照组相比,造模干预组细胞内的PPARγ mRNA表达量显著升高(P<0.05)。PPARγ过表达会加速脂肪细胞的分化,增加脂肪细胞和肝脏细胞中的脂质积累[46]。与造模干预组相比,山茶油干预组细胞内PPARγ mRNA表达量显著下调(P<0.05),且在20 µL/mL时下降最为明显。Zhang等[47]发现肝细胞PPARγ特异性敲除的小鼠,其肝细胞脂质合成和摄取相关基因的表达均会下调,肝细胞脂质积累程度也会减轻。这表明山茶油可通过下调PPARγ基因的表达,进而降低HepG2细胞内脂质的合成和摄取,发挥体外降脂作用。
以上说明山茶油预处理可以有效降低SREBP-1c、FAS、ACC和PPARγ的表达,进而在一定程度上抑制由游离脂肪酸引起的肝细胞内过量脂质的生成。其中,在0~20 µL/mL范围内会随山茶油浓度的升高,脂质合成基因的表达下调更为显著;而当山茶油干预浓度达30 µL/mL时,虽然仍能有效抑制细胞内脂肪的从头合成,但相比其他浓度山茶油干预组,这些基因的表达会相对上调。这与TG含量的变化是基本一致的。
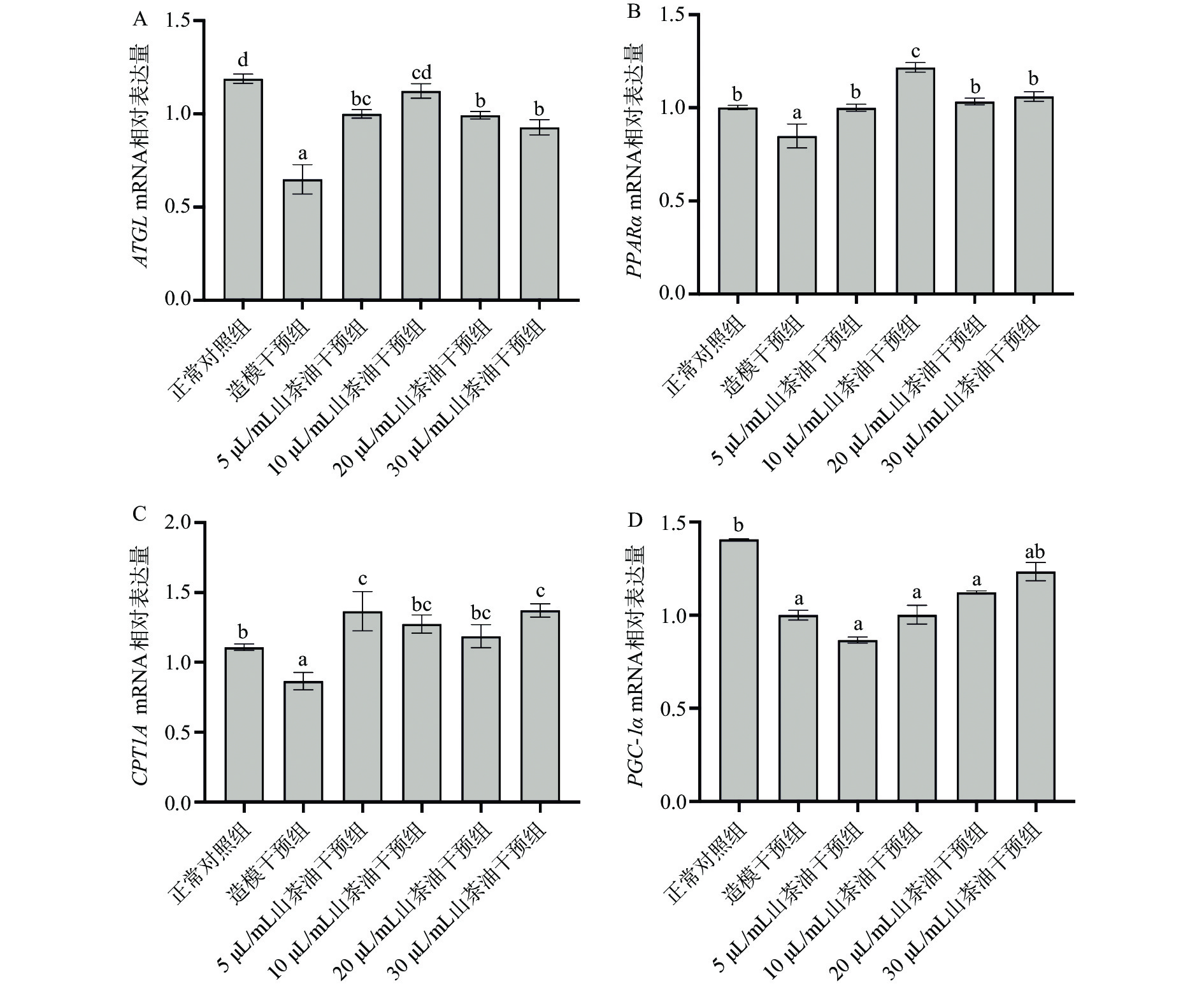
2.5.3 山茶油对HepG2细胞内脂质分解相关基因表达的影响
脂肪分解需要先将甘油三酯分解为甘油和脂肪酸,而后通过FAO分解产生能量。脂肪甘油三酯脂肪酶(ATGL)是TG水解第一步过程中的限速酶,可将TG分解为FFA和二酰基甘油[48]。ATGL水平升高可使减少肝脏脂肪生成和甘油三酯积累,促进肝脏甘油三酯的分泌[49]。如图6A所示,与正常对照组相比,造模干预组细胞内ATGL mRNA表达量显著降低(P<0.05);与造模干预组相比,山茶油干预显著上调了细胞内ATGL mRNA的表达(P<0.05)。Reid等[50]通过体内外实验研究发现,ATGL过表达可以促进脂肪酸β氧化,刺激游离脂肪酸的直接释放,并改善肝脂肪变性。因此,推测山茶油可通过上调ATGL的表达,增加细胞内甘油三酯的分解,并促进细胞内的线粒体FAO。
FAO是分解消耗脂质的主要途径。过量的脂肪酸可被FAO分解用来产生能量,以减少细胞中脂肪酸的沉积[32]。PPARα是FAO中重要的转录调节因子。PPARα的激活可以诱导脂肪酸氧化相关基因(CPT1A、PGC-1α)的表达,从而降低肝脏脂质沉积[51]。如图6B所示,造模干预组细胞内PPARα mRNA表达量相比正常对照组显著降低(P<0.05),而山茶油干预抑制了由游离脂肪酸引起的PPARα mRNA表达量的下调。CPT1被认为是肝组织和细胞中长链脂肪酸FAO的关键调节酶和限速酶,与脂肪酸的分解和代谢途径密切相关[52]。CPT1是脂肪酸氧化的限速酶,包括CPT1A、CPT1B、CPT1C三种亚型。其中,CPT1A亚型在肝脏中特异性表达,其表达量上调能改善NAFLD[53]。如图6C所示,与正常对照组相比,造模干预组细胞内CPT1A mRNA表达量显著降低(P<0.05);与造模干预组相比,山茶油干预组显著上调了细胞内CPT1A mRNA的表达(P<0.05)。Bruce等[54]指出CPT1表达上调可以增强脂肪酸氧化,同时其过度表达不会影响线粒体容量或功能的标志物。过氧化物酶体增殖物受体γ辅助激活因子1α(PGC-1α),作为过氧化物酶体增殖物激活受体(PPAR)家族的首要成员,其表达量上调可增加线粒体内的能量代谢,加快脂肪的β氧化[55]。如图6D所示,与正常对照组相比,造模干预组细胞内PGC-1α的mRNA表达量显著下调(P<0.05);与造模干预组相比,山茶油对细胞内PGC-1α mRNA表达量的影响虽无统计学差异(P>0.05),但是其表达量会随着山茶油浓度的增加呈剂量依赖式上升。在山茶油浓度为30 µL/mL时,与正常对照组中细胞内PGC-1α mRNA表达量无显著差异(P>0.05)。Morris等[56]研究发现在原代肝细胞和大鼠肝脏中,腺病毒过表达PGC-1α会使得线粒体含量和/或功能增加,FAO升高,甘油三酯积累减少及甘油三酯分泌减少。说明山茶油可不同程度地上调细胞内FAO相关基因的表达,加速脂肪酸的氧化分解,以减少细胞内甘油三酯的过度积累,进而预防过量游离脂肪酸引起的肝细胞脂质沉积。
3. 讨论与结论
本研究通过对不同浓度山茶油预处理后HepG2细胞内脂质水平相关指标的测定发现,山茶油可有效抑制游离脂肪酸引起的细胞内TG和LDL-C水平的升高及HDL-C的降低,抵抗游离脂肪酸引起的细胞内脂质水平的异常。Shen等[57]认为茶籽油改善高脂血症大鼠血脂质异常的作用主要归因于茶籽油中含有较多的不饱和脂肪酸。不饱和脂肪酸已被广泛认为具有降低血脂的功能[58]。此外,本研究还发现当山茶油浓度为0~20 µL/mL时,其体外降脂作用具有一定的剂量依赖性。这与黄翠莉等[59]与唐琦等[60]的研究结果是一致的。但是,以往研究没有考虑当茶油的干预浓度超过实验所设干预浓度时,这种剂量效应关系是否仍存在。本研究中,当山茶油浓度为30 µL/mL时,虽然其细胞内 TG 的含量 0.81±0.04 mmol/L仍低于造模干预组的 1.15±0.04 mmol/L,但相比于10和20 µL/mL山茶油干预组可以发现山茶油抑制细胞内甘油三酯积累的效果被减弱了。Tomé-Carneiro 等[61]和Assy等[62]研究指出在过量食用橄榄油或其他油脂的情况下,高水平的游离脂肪酸不仅可能会损害脂质代谢,增加血脂代谢紊乱的风险,还会刺激肝细胞脂质生成,加速NAFLD的进程。因此,在一定浓度范围内(0~30 µL/mL)的山茶油可以有效抑制游离脂肪酸诱导的肝细胞内脂滴的形成,延缓NAFLD的发展。但是,山茶油浓度过高是否会加重肝细胞内的脂质积累还需进一步的研究。
本研究通过对细胞内脂质摄取和合成相关基因的表达量进行测定发现,CD36、SREBP-1c、FAS、ACC和PPARγ基因表达量的变化趋势与TG含量的变化基本一致,表明0~20 µL/mL的山茶油能够剂量依赖性地降低脂肪合成相关基因的表达,以减少细胞内TG的含量;在30 µL/mL时,降脂效果相对减弱。此外,研究发现山茶油可能通过降低ACC的表达,同时升高ATGL的表达,进而加速肝细胞内线粒体的β氧化。线粒体β氧化可将过量的脂肪酸分解,用以产生能量,同时保护细胞免受其损害[63-64]。本研究对细胞内FAO相关基因(PPARα、CPT1A和PGC-1α)的表达进行了检测,发现山茶油可以上调线粒体FAO相关基因的表达。Orellana-Gavaldà等[65]研究指出脂肪酸β氧化可能通过减少肝脏三酰甘油的积累发挥保护作用。因此,山茶油可通过增加线粒体FAO,减少细胞内甘油三酯的积累,发挥保护肝细胞的作用。
综上所述,山茶油可通过调节脂质的转运和合成相关基因的表达,减少细胞内脂质的合成;同时,通过上调肝细胞内脂质的分解代谢和线粒体脂肪酸β-氧化相关基因的表达,促进细胞内的甘油三酯分解,进而抑制脂质在肝细胞中积聚,发挥体外降脂作用。本研究有助于更全面地了解山茶油的降脂作用效果,对于指导日常合理食用山茶油发挥其降脂作用具有重要意义,同时也为进一步深入研究山茶油对肝脏脂质代谢的作用机制提供了理论依据。
-
表 1 实时荧光定量PCR引物序列
Table 1 Real-time PCR primer sequences
基因 上游(5'→3') 下游(5'→3') CD36 AGCCACAAACCAAGAATCTACCTG CTTCCCAGTTAAAAGGAAAGGCACT PPARγ ATTCAAGACAACCTGCTACAAGCC CTGTCTCCGTCTTCTTGATCACC SREBP-1c CAGCTCTGTCCCCATCAGGT ACTTCTTGCAGGGAGACCCAA FAS CACAACTCCAAGGACACAGTCA CCCGGATCACCTTCTTGAGC ACC GAGACTAGCCAAACAATCTCGTCA AATCTTCTGATGCCTGCGTTG ATGL CCCACTTCAACTCCAAGGACGA TCTGAAATGCCACCATCCACGTA PPARα GAGTTTATGAGGCCATATTCGCCAT TCACAGAACGGTTTCCTTAGGCTT CPT1A TGCAAAGGCGACATCAATCCG AAATCCACGTCGTTTGCCAGA PGC-1α CCATGGATGAAGGGTACTTTTCTG TCTTCTTCCAGCCTTGGGGA GAPDH GCACCGTCAAGGCTGAGAAC TGGTGAAGACGCCAGTGGA 表 2 不同浓度山茶油干预对HepG2细胞内TC、TG、HDL-C、LDL-C的影响
Table 2 Effects of different concentrations of camellia oil on TC, TG, HDL-C and LDL-C
组别 TG
(mmol/L)TC
(mmol/g prot)HDL-C
(mmol/L)LDL-C
(mmol/L)正常对照组 0.24±0.06a 0.04±0.01a 0.012±0.000c 0.010±0.001a 造模干预组 1.15±0.04e 0.05±0.01ab 0.005±0.000a 0.023±0.002c 5 µL/mL山茶油
干预组0.93±0.02d 0.06±0.01b 0.008±0.001b 0.020±0.001c 10 µL/mL山茶油
干预组0.61±0.02b 0.05±0.00ab 0.008±0.001b 0.015±0.001b 20 µL/mL山茶油
干预组0.66±0.01b 0.06±0.00b 0.009±0.001b 0.012±0.001a 30 µL/mL山茶油
干预组0.81±0.04c 0.06±0.00b 0.007±0.000b 0.013±0.001ab 注:同列不同小写字母表示差异有统计学意义,P<0.05。 -
[1] POWELL E E, WONG V W, RINELLA M. Non-alcoholic fatty liver disease[J]. Lancet (London, England),2021,397(10290):2212−2224. doi: 10.1016/S0140-6736(20)32511-3
[2] 李磊, 王征, 吕新月, 等. 非酒精性脂肪性肝硬化的临床特征及预后相关危险因素分析[J]. 中华消化杂志,2018,38(2):115−120. [LI L, WANG Z, LYU X Y, et al. Clinical characteristics and prognosisi related risk factors in nonalcoholic steatosis liver criihosis[J]. Chinese Journal of Digestion,2018,38(2):115−120. doi: 10.3760/cma.j.issn.0254-1432.2018.02.011 [3] PAIK J M, KABBARA K, EBERLY K E, et al. Global burden of NAFLD and chronic liver disease among adolescents and young adults[J]. Hepatology,2022,75(5):1204−1217. doi: 10.1002/hep.32228
[4] PETRONI M L, BRODOSI L, BUGIANESI E, et al. Management of non-alcoholic fatty liver disease[J]. BMJ,2021,372:1−20.
[5] BLOND E, DISSE E, CUERQ C, et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease[J]. Obesity Facts,2016,9(2):65−90. doi: 10.1159/000443344
[6] SINTONI M C, HAY D C, DRAKE A J. Metabolic control of gene transcription in non-alcoholic fatty liver disease: The role of the epigenome[J]. Clinical Epigenetics,2019,11(1):1−12. doi: 10.1186/s13148-018-0606-9
[7] 谭传波, 田华, 赖琼玮, 等. 鲜榨山茶油中生物活性物质研究[J]. 粮食与油脂,2019,32(11):19−21. [TAN C B, TIAN H, LAI Q W, et al. Research on bioactive substances from fresh pressed camellia oil[J]. Cereals & Oils,2019,32(11):19−21. doi: 10.3969/j.issn.1008-9578.2019.11.006 [8] LI Z, LIU A, DU Q, et al. Bioactive substances and therapeutic potential of camellia oil: An overview[J]. Food Bioscience,2022,49:1−12.
[9] 陈梅芳, 顾景范, 孙明堂, 等. 茶油延缓动脉粥样硬化形成及其机理的探讨[J]. 营养学报,1996,18(1):13−19. [CHEN M F, GU J F, SUN M T, et al. Effect of tea-seed oil on the atheromatic formation and its mechanism[J]. Acta Nutrimenta Sinica,1996,18(1):13−19. doi: 10.3321/j.issn:0512-7955.1996.01.001 [10] 卜文婕, 朱建梁, 李艳, 等. 不同食用油脂对大鼠血脂代谢及脂肪肝的影响[J]. 食品工业科技,2014,35(11):337−340. [BU W J, ZHU J L, LI Y, et al. Effect of different oil on lipid metabolism and hepatic steatosis in rats[J]. Science and Technology of Food Industry,2014,35(11):337−340. doi: 10.13386/j.issn1002-0306.2014.11.066 [11] CHOU T Y, LU Y F, INBARAJ B S, et al. Camelia oil and soybean-camelia oil blend enhance antioxidant activity and cardiovascular protection in hamsters[J]. Nutrition (Burbank, Los Angeles County, Calif),2018,51−52:86−94. doi: 10.1016/j.nut.2017.12.011
[12] HUANG T Y, ZHOU W K, MA X G, et al. Oral administration of camellia oil ameliorates obesity and modifies the gut microbiota composition in mice fed a high-fat diet[J]. FEMS Microbiology Letters,2021,368(10):1−10.
[13] GUO P L, ZENG M N, CAO B, et al. Camellia oil improves Aβ25-35-induced memory impairment by regulating the composition of the gut microbiota and lipid metabolism in mice[J]. Journal of Functional Foods,2022,96:1−12.
[14] CHEN Q P, WU X Q, LIU L L, et al. Polyphenol-rich extracts from Oiltea camellia prevent weight gain in obese mice fed a high-fat diet and slowed the accumulation of triacylglycerols in 3T3-L1 adipocytes[J]. Journal of Functional Foods,2014,9:148−155. doi: 10.1016/j.jff.2014.03.034
[15] DI T M, YANG S L, DU F Y, et al. Oleiferasaponin A₂, a novel saponin from Camellia oleifera Abel. seeds, inhibits lipid accumulation of HepG2 cells through regulating fatty acid metabolism[J]. Molecules (Basel, Switzerland),2018,23(12):3296. doi: 10.3390/molecules23123296
[16] GAO J, MA L, YIN J, et al. Camellia (Camellia oleifera bel.) seed oil reprograms gut microbiota and alleviates lipid accumulation in high fat-fed mice through the mTOR pathway[J]. Food & Function,2022,13(9):4977−4992.
[17] 邓金兰. 浒苔多糖的硫酸根修饰对体外降血糖作用的影响研究[D]. 福建: 福建医科大学, 2016 DENG J L. The study of hypoglycemic effect through sulfating modification of enteromorpha polysaccharides in vitro[D]. Fujian: Fujian University of Medicine, 2016.
[18] SHAN D D, WANG J M, DI Q N, et al. Steatosis induced by nonylphenol in HepG2 cells and the intervention effect of curcumin[J]. Food Funct,2022,13(1):327−343. doi: 10.1039/D1FO02481G
[19] LEE M R, PARK K I, MA J Y. Leonurus japonicus Houtt attenuates nonalcoholic fatty liver disease in free fatty acid-induced HepG2 cells and mice fed a high-fat diet[J]. Nutrients,2017,10(1):20−32. doi: 10.3390/nu10010020
[20] 曾璐. 基于肝脂肪变性HepG2细胞模型探讨护肝清脂片主要成分对脂质代谢的影响及可能机制[D]. 广州: 南方医科大学, 2015 ZENG L. Lipid metabolic effects and mechanisme of main components of Hugan Qingzhi Tablet on hepatic steatosis HepG2 cell model[D]. Guangzhou: Southern Medical University, 2015.
[21] INNIS S M. Palmitic acid in early human development[J]. Critical Reviews in Food Science and Nutrition,2016,56(12):1952−1959. doi: 10.1080/10408398.2015.1018045
[22] GÓMEZ-LECHÓN M J, DONATO M T, MARTÍNEZ-ROMERO A, et al. O Conner J-E: A human hepatocellular in vitro model to investigate steotosis[J]. Chemico-Biological Interactions,2007,165(2):106−116. doi: 10.1016/j.cbi.2006.11.004
[23] ZHANG D, XIE L Y, WEI Y, et al. Development of a cell-based antioxidant activity assay using dietary fatty acid as oxidative stressor[J]. Food Chemistry,2013,141(1):347−356. doi: 10.1016/j.foodchem.2013.02.082
[24] 李晓静. 食用油脂中改善HepG2细胞脂质积累和氧化应激的关键组分研究[D]. 无锡: 江南大学, 2020 LI X J. Key components in fats and oils improving lipid accumulation and oxidative stress in HepG2 cells[D]. Wuxi: Jiangnan University, 2020.
[25] 田思聪. 莱菔硫烷对肝脏脂肪滴形成的影响及MAM区的调控机制[D]. 哈尔滨: 哈尔滨工业大学, 2019 TIAN S C. Effect of sulforaphane on lipid droplets formation and regulatory metabolism of mitochondria-associated membrane in liver[D]. Harbin: Harbin Institute of Technology, 2019.
[26] 林洁, 陈玉霞, 章卫平. 肝脏调节胆固醇代谢稳态的研究进展[J]. 中国动脉硬化杂志,2022,30(9):1−12. [LIN J, CHEN Y X, ZHANG W P. Progress in liver regulation of cholesterol homeostasis[J]. Chinese Journal of Arteriosclerosis,2022,30(9):1−12. doi: 10.3969/j.issn.1007-3949.2022.09.002 [27] 程武. 甘油三酯与高密度脂蛋白胆固醇比值(TG/HDL-C)和谷氨酰转移酶(GGT)预测非酒精性脂肪肝(NAFLD)的价值[J]. 中外医疗,2018,37(21):5−8. [CHENG W. The value of triglyceride versus high-density lipoprotein cholesterol (TG/HDL-C) and glutamyl transferase (GGT) in predicting non-alcoholic fatty liver (NAFLD)[J]. China & Foreign Medical Treatment,2018,37(21):5−8. doi: 10.16662/j.cnki.1674-0742.2018.21.005 [28] 吴雪辉, 黄永芳, 谢治芳. 茶油的保健功能作用及开发前景[J]. 食品科技,2005(8):94−96. [WU X H, HAUNG Y F, XIE Z F. Health functions and prospective of camellia oil[J]. Food Science and Technology,2005(8):94−96. doi: 10.3969/j.issn.1005-9989.2005.08.029 [29] NASSIR F, ARNDT J J, JOHNSON S A, et al. Regulation of mitochondrial trifunctional protein modulates nonalcoholic fatty liver disease in mice[J]. Journal of Lipid Research,2018,59(6):967−973. doi: 10.1194/jlr.M080952
[30] WANG L F, WANG X N, HUANG C C, et al. Inhibition of NAMPT aggravates high fat diet-induced hepatic steatosis in mice through regulating Sirt1/AMPKα/SREBP1 signaling pathway[J]. Lipids in Health & Disease,2017,16(1):1−13.
[31] FRANCESCO P, MAURIZIA P, MICHELA L, et al. The role of lipid and lipoprotein metabolism in non-alcoholic fatty liver disease[J]. Children,2017,4(6):1−14.
[32] HUANG W C, CHEN Y L, LIU H C, et al. Ginkgolide C reduced oleic acid-induced lipid accumulation in HepG2 cells[J]. Saudi Pharmaceutical Journal,2018,26(8):1178−1184. doi: 10.1016/j.jsps.2018.07.006
[33] PEI K, GUI T, KAN D, et al. An overview of lipid metabolism and nonalcoholic fatty liver disease[J]. BioMed Research International,2020(4):1−12.
[34] GENG Y, FABER K N, MEIJER V, et al. How does hepatic lipid accumulation lead to lipotoxicity in non-alcoholic fatty liver disease?[J]. Hepatology International,2021,15(1):21−35. doi: 10.1007/s12072-020-10121-2
[35] CAO P Q, HUANG G D, YANG Q Y, et al. The effect of chitooligosaccharides on oleic acid-induced lipid accumulation in HepG2 cells[J]. Saudi Pharmaceutical Journal Spj the Official Publication of the Saudi Pharmaceutical Society,2016,24(3):292−298.
[36] FABBRINI E, TIEMANN C T, LOVE-GREGORY L, et al. Physiological mechanisms of weight gain-induced steatosis in people with obesity[J]. Gastroenterology,2016,150(1):79−81. doi: 10.1053/j.gastro.2015.09.003
[37] 陶嘉, 唐超, 孟凡强, 等. 黑木耳多肽对棕榈酸诱导的脂肪肝细胞的降脂作用[J]. 食品科学,2022,43(3):106−113. [TAO J, TANG C, MENG F Q, et al. Lipid-lowering effect of auricularia auricula peptides on palmitic acid-induced liver cells[J]. Food Science,2022,43(3):106−113. doi: 10.7506/spkx1002-6630-20210311-144 [38] PARK M, YOO J H, LEE Y S, et al. Lonicera caerulea extract attenuates non-alcoholic fatty liver disease in free fatty acid-induced HepG2 hepatocytes and in high fat diet-fed mice[J]. Nutrients,2019,11(3):496. doi: 10.3390/nu11030496
[39] 索宇鸿, 刘近春. 非酒精性脂肪性肝病的治疗进展[J]. 临床肝胆病杂志,2018,34(10):2232−2236. [SUO Y H, LIU J C. Research advances in the treatment of nonalcoholic fatty liver disease[J]. Journal of Clinical Hepatology,2018,34(10):2232−2236. doi: 10.3969/j.issn.1001-5256.2018.10.038 [40] WANG Y, VISCARRA J, KIM S J, et al. Transcriptional regulation of hepatic lipogenesis[J]. Nature Reviews Molecular Cell Biology,2015,16(11):678−689. doi: 10.1038/nrm4074
[41] HIGUCHI N, KATO M, SHUNDO Y, et al. Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease[J]. Hepatology Research,2010,38(11):1122−1129.
[42] LI Y, XU S Q, MIHAYLOVA M M, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metabolism,2011,13(4):376−388. doi: 10.1016/j.cmet.2011.03.009
[43] ZHANG L, LI H X, PAN W S, et al. Novel hepatoprotective role of leonurine hydrochloride against experimental non-alcoholic steatohepatitis mediated via AMPK/SREBP1 signaling pathway[J]. Biomedicine & Pharmacotherapy=Biomedecine & Pharmacotherapie,2019,110:571−581.
[44] PETTINELLI P, VIDELA L A. Up-regulation of PPAR-gamma mRNA expression in the liver of obese patients: An additional reinforcing lipogenic mechanism to SREBP-1c induction[J]. The Journal of Clinical Endocrinology and Metabolism,2011,96(5):1424−1430. doi: 10.1210/jc.2010-2129
[45] BLANCHARD P G, TURCOTTE V, CÔTÉ M, et al. Peroxisome proliferator-activated receptor γ-activation favours selective subcutaneous lipid deposition by coordinately regulating lipoprotein lipase modulators, fatty acid transporters and lipogenic enzymes[J]. Acta Physiologica (Oxford, England),2016,217(3):227−239. doi: 10.1111/apha.12665
[46] JANANI C, RANJITHA-KUMARI B D. PPAR gamma gene-A review[J]. Diabetes & Metabolic Syndrome,2015,9(1):46−50.
[47] ZHANG W L, SUN Q, ZHONG W, et al. Hepatic peroxisome proliferator-activated receptor gamma signaling contributes to alcohol-induced hepatic steatosis and inflammation in mice[J]. Alcoholism, Clinical and Experimental Research,2016,40(5):988−999. doi: 10.1111/acer.13049
[48] FRÜHBECK G, MÉNDEZ-GIMÉNEZ L, FERNÁNDEZ-FORMOSO J A, et al. Regulation of adipocyte lipolysis[J]. Nutrition Research Reviews,2014,27(1):63−93. doi: 10.1017/S095442241400002X
[49] LIU H K, HUNG T M, HUANG H C, et al. Bai-Hu-Jia-Ren-Shen-Tang decoction reduces fatty liver by activating AMP-activated protein kinase in vitro and in vivo[J]. Evidence-based Complementary and Alternative Medicine:eCAM,2015,2015:1−11.
[50] REID B N, ABLES G P, OTLIVANCHIK O A, et al. Hepatic overexpression of hormone-sensitive lipase and adipose triglyceride lipase promotes fatty acid oxidation, stimulates direct release of free fatty acids, and ameliorates steatosis[J]. The Journal of Biological Chemistry,2008,283(19):13087−13099. doi: 10.1074/jbc.M800533200
[51] ZHANG J, ZHANG H, DENG X, et al. Baicalin attenuates non-alcoholic steatohepatitis by suppressing key regulators of lipid metabolism, inflammation and fibrosis in mice[J]. Life Sciences,2018,192:46−54. doi: 10.1016/j.lfs.2017.11.027
[52] LI N, SUN Y R, HE L B, et al. Amelioration by Idesia polycarpa Maxim. var. vestita Diels. of oleic acid-induced nonalcoholic fatty liver in HepG2 cells through antioxidant and modulation of lipid metabolism[J]. Oxidative Medicine and Cellular Longevity,2020,2020(5):1−13.
[53] 罗婷婷, 杨仁国, 贺微微. 甲基莲心碱通过活化HepG-2细胞中的AMPK并介导ACC/CPT1A和SREBP1/FAS通路改善棕榈酸诱导的脂质积累[J]. 中药材,2021,44(7):1751−1755. [LUO T T, YANG R G, HE W W. Niensinine ameliorates palmitate-induced lipid accumulation by activating AMPK in HepG-2 cells and mediating ACC/CPT1A and SREBP1/FAS pathways[J]. Journal of Chinese Medicinal Materials,2021,44(7):1751−1755. [54] BRUCE C R, HOY A J, TURNER N, et al. Overexpression of carnitine palmitoyltransferase-1 in skeletal muscle is sufficient to enhance fatty acid oxidation and improve high-fat diet-induced insulin resistance[J]. Diabetes,2009,58(3):550−558. doi: 10.2337/db08-1078
[55] WU Q, WANG Q, FU J, et al. Polysaccharides derived from natural sources regulate triglyceride and cholesterol metabolism: a review of the mechanisms[J]. Food & Function,2019,10(5):2330−2339.
[56] MORRIS E M, MEERS G M, BOOTH F W, et al. PGC-1α overexpression results in increased hepatic fatty acid oxidation with reduced triacylglycerol accumulation and secretion[J]. American journal of Physiology Gastrointestinal and Liver Physiology,2012,303(8):979−992. doi: 10.1152/ajpgi.00169.2012
[57] SHEN T T, WU S X. Effects of tea seed oil on hyperlipidemic rats induced by high-fat diet[J]. Food Science and Technology Research,2017,23(1):101−109. doi: 10.3136/fstr.23.101
[58] SHIREEN K F, PACE R D, MAHBOOB M, et al. Effects of dietary vitamin E, C and soybean oil supplementation on antioxidant enzyme activities in liver and muscles of rats[J]. Food Chem Toxicol,2008,46(10):3290−3294. doi: 10.1016/j.fct.2008.07.015
[59] 黄翠莉, 吴苏喜, 刘瑞兴, 等. 油茶籽油对大鼠降血脂和预防脂肪肝的影响[J]. 食品科学,2011,32(13):332−335. [HUANG C L, WU S X, LIU R X, et al. Blood lipid-lowering and fatty liver-preventing effects of tea seed (Camellia oleifera Abel.) oil in rats[J]. Food Science,2011,32(13):332−335. [60] 唐琦, 严家俊. 油茶籽油对大鼠降血脂和预防脂肪肝的影响[J]. 广东化工,2016,43(1):36−37, 28. [TANG Q, YAN J J. The effects of the oils from tea seed on reducing blood lipid and prevent the fatty liver on rats[J]. Guangdong Chemical Industry,2016,43(1):36−37, 28. doi: 10.3969/j.issn.1007-1865.2016.01.016 [61] TOMÉ-CARNEIRO J, CRESPO M C, HAZAS M C L D L, et al. Olive oil consumption and its repercussions on lipid metabolism[J]. Nutrition Reviews,2020,78(11):952−968. doi: 10.1093/nutrit/nuaa014
[62] ASSY N, NASSAR F, NASSER G, et al. Olive oil consumption and non-alcoholic fatty liver disease[J]. World Journal of Gastroenterology,2009,15(15):1809−1815. doi: 10.3748/wjg.15.1809
[63] NGUYEN M T, FAVELYUKIS S, NGUYEN A K, et al. A subpopulation of macrophages infiltrates hypertrophic adipose tissue and is activated by free fatty acids via Toll-like receptors 2 and 4 and JNK-dependent pathways[J]. The Journal of Biological Chemistry,2007,282(48):35279−35292. doi: 10.1074/jbc.M706762200
[64] SMITH M M, MINSON C T. Obesity and adipokines: Effects on sympathetic overactivity[J]. The Journal of Physiology,2012,590(8):1787−1801. doi: 10.1113/jphysiol.2011.221036
[65] ORELLANA-GAVALDÀ J M, HERRERO L, MALANDRINO M I, et al. Molecular therapy for obesity and diabetes based on a long-term increase in hepatic fatty-acid oxidation[J]. Hepatology,2011,53(3):821−832. doi: 10.1002/hep.24140
-
期刊类型引用(2)
1. 王佳,丁方莉,安宇,曾雪莹,张智慧,李思楠,徐开媛,周芳,王颖,张璐,徐炳政,孙泽堃. 芸豆-蓝靛果复合发酵液制备工艺优化及其抗氧化活性. 食品工业科技. 2025(03): 222-231 .  本站查看
本站查看
2. 王胜宇,杨梅,胡鹤宇,朱才庆,董欢欢,管咏梅,朱卫丰. 结合态酚类物质在植物生长、食品加工及人体消化过程中的释放规律研究进展. 食品工业科技. 2024(14): 408-417 .  本站查看
本站查看
其他类型引用(1)






 下载:
下载:

 下载:
下载:
