Influence of Different Processing Methods on Phenols in Hulless Barley
-
摘要: 为探明不同加工方式对青稞全谷物中酚类物质的影响,最大程度地保留抗氧化和降血糖活性物质。以海南昆仑17号青稞籽粒为实验材料,分别采用蒸制、煮制、炒制、微波、烤制、空气炸锅等六种加工方式对青稞籽粒进行热加工处理,分析加工前后青稞中游离多酚、结合多酚、游离黄酮和结合黄酮的含量,以及抗氧化和降血糖活性的变化。结果表明,不同加工方式制备的青稞多酚和黄酮含量存在一定程度上的差异。与未加工相比,其他加工方式所得青稞游离多酚和游离黄酮的含量均显著降低(P<0.05)(除炒制外),结合多酚和结合黄酮的含量均升高。与未加工相比,蒸制和煮制的方式对青稞游离多酚含量的损失高达43.77%和67.85%,炒制使青稞结合黄酮含量增加38.10%。此外,不同加工方式的青稞多酚提取物具有较好的DPPH自由基清除能力和α-葡萄糖苷酶抑制活性,且清除和抑制能力在一定浓度范围内具有浓度依赖性。在六种加工方式中,炒制处理青稞游离和结合多酚提取物(5 mg/mL)的DPPH自由基清除率最高,分别为70.01%、54.52%,且其α-葡萄糖苷酶抑制率也最高,分别为84.84%、75.70%。因此,炒制处理可较好地保留热加工前全谷物青稞中酚类物质的含量,从而发挥抗氧化和降血糖作用。Abstract: This research was performed to investigate the impacts of different processing methods on phenols in hulless barley for the purpose of achieving furthest retention of the antioxidant and hypoglycemic bioactives. Using Hainan Kunlun 17 hulless barley as experimental material, the hulless barley grains were thermally processed by six different processing methods, including steaming, boiling, frying, microwave, baking and air fryer, and the contents of free polyphenols, bound polyphenols, free flavonoids and bound flavonoids, as well as the changes of antioxidant and hypoglycaemic activities in hulless barley before and after processing were analysed. The results showed that the contents of polyphenols and flavonoids in hulless barley were varied after preparing by different processing methods. Compared with unprocessed hulless barley, the contents of free polyphenols and free flavonoids from other processing methods were significantly decreased (P<0.05) (except frying), while the contents of bound polyphenols and bound flavonoids increased. Compared with unprocessed one, the free polyphenols content of hulless barley after steaming and boiling preparation were deeply decreased by 43.77% and 67.85%, respectively, whereas the content of bound flavonoids in the fried one was increased by 38.10%. In addition, the polyphenol extracts of the heat processed hulless barley had better scavenging ability of DPPH free radical and inhibitory activity of α-glucosidase, and the scavenging and inhibitory activities were concentration-dependent in a certain concentration range. Among the six processing methods, DPPH radical scavenging rates in free and bound polyphenol extracts (5 mg/mL) of fried hulless barley showed the highest levels of 70.01% and 54.52%, respectively, and their α-glucosidase inhibition rates were also the highest at 84.84% and 75.70%, respectively. Therefore, phenolics could be retained maximally after frying, and then exerting their antioxidant and hypoglycemic effects.
-
Keywords:
- hulless barley /
- processing method /
- phenols /
- antioxidant /
- α-glucosidase
-
青稞(Hordeum vulgare L. var. nudum Hook. f.)是青藏高原地区人们的主要粮食,也是开发功能性食品为该地区创造收入的绝佳原料。青稞富含多酚、膳食纤维等多种活性物质[1],这些活性成分具有抗氧化、降血糖、降血脂等功能[2-3]。有研究表明,天然抗氧化剂具有高效清除自由基的能力,对人体的心脑血管疾病以及衰老有一定帮助[4],且抗氧化剂中的酚酸类、黄酮类等物质对人体健康有益,但在人体内不能自动合成,因此合理膳食并从食物中摄取多酚类物质从而预防相关疾病尤为重要[4-6]。而全谷物类中含有丰富的多酚类物质,可起到抗氧化、降血糖、减缓衰老等预防慢性疾病的作用[7-8]。
有研究报道,在加工过程中多酚类物质容易受高温、高压等影响而发生含量的变化,且多酚类物质与抗氧化活性、α-葡萄糖苷酶抑制活性具有一定的相关性[9-10]。王耀红等[11]在实验中发现,蒸、煮和微波处理均导致紫色马铃薯中的花青素含量降低,而蒸制和微波后紫色马铃薯游离多酚、结合多酚和绿原酸的含量及抗氧化活性均提高,但水煮后,除结合多酚的含量增加外,其余成分的含量均显著降低。高岳[12]在探究蒸煮和挤压对糙米全谷物多酚类物质的影响时发现,挤压全谷物糙米制品多酚提取物的抗氧化活性和抑制α-葡萄糖苷酶的能力均得到提高。张欢[13]采用不同蒸煮方式处理糙米发现,电饭煲、微波、高压蒸煮、蒸制4种蒸煮方式糙米的多酚含量、组成及其抗氧化性存在差异性,高压蒸煮糙米所得多酚含量提高15.58%,其他蒸煮方式所得多酚含量均呈下降趋势,且蒸煮后所得多酚具有抗氧化、抑制α-淀粉酶、α-葡萄糖苷酶的作用,同时延缓淀粉的水解,降低葡萄糖的生成速率,达到延缓血糖升高的目的[14-15]。以青稞为代表的全谷物类食物,通常需要经过热处理加工后才能食用,如蒸制、煮制、炒制等,但这些加工方式对青稞多酚类物质及其功能的影响仍鲜为研究。
当前我国处于乡村振兴发展的关键阶段,青稞作为西藏、青海、甘肃等地的主要粮食作物,青稞产业发展事关脱贫地区能否巩固脱贫攻坚成果,实现同乡村振兴的有效衔接。但目前为止,加工对青稞功能成分、活性的影响及机理不清,成为制约该加工产业发展的重大瓶颈。因此本研究通过蒸制、煮制、炒制、微波、烤制和空气炸锅六种热加工方式处理青稞样品,探究不同加工方式对青稞全谷物中游离多酚、结合多酚、游离黄酮、结合黄酮含量的影响,以及清除DPPH自由基和抑制α-葡萄糖苷酶的能力,以期为突破青稞精深加工产品开发、营养保持和调控技术瓶颈提供技术储备,为青稞产业的发展提供技术支撑。
1. 材料与方法
1.1 材料与仪器
海南昆仑17号 青海省农林科学院作物育种栽培研究所青稞研究室提供;福林酚(优级纯) 北京索莱宝科技有限公司;没食子酸和芦丁标准品(纯度≥98.0%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、α-葡萄糖苷酶(250 U/7.6 mg)、对硝基苯酚吡喃葡萄糖苷(p-Nitrophenol Glucopyranoside,PNPG) 上海源叶生物科技有限公司;甲醇、丙酮、盐酸、乙酸乙酯、无水碳酸钠、亚硝酸钠(均为分析级) 国药集团化学试剂有限公司。
SZ22S1蒸锅 苏泊尔公司;C22-WT2202多功能电磁炉 广东美的生活电器制造有限公司;M1-L201B微波炉、T7-L328E电烤箱 广东美的厨房电器制造有限公司;HD9232空气炸锅 飞利浦(中国)投资有限公司;DHG-9203A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;BJ-150多功能粉碎机 德清拜杰电器有限公司;KQ5200DV数控超声波清洗器 昆山市超声仪器有限公司;TDL-5-A低速大容量离心机 上海安亭科学仪器厂;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;SPECTRA MAX190酶标仪 Molecular Devices。
1.2 实验方法
1.2.1 不同加工方式青稞全粉的制备
除去青稞籽粒中的杂质并去除破损和不饱满的籽粒后再进行清洗、晾干备用。蒸制:蒸锅中加入适量的水,将200 g青稞置于锅中蒸制70 min后熟化,取出冷却至室温[16]。煮制:500 mL水用电磁炉以1800 W功率加热,待水沸腾后加入40 g青稞籽粒,煮制40 min,得到大多数熟化的青稞籽粒,取出冷却至室温[17]。炒制:用电磁炉以1800 W功率使炒锅预热1 min,加入40 g青稞籽粒不断翻炒1 min,得到大多数膨胀爆裂的青稞籽粒[18-19]。微波:将40 g整粒青稞润麦24 h后,放于800 W微波炉处理5 min,得到大多数籽粒开花的青稞[16]。烤制:称取40 g青稞润麦24 h后平铺于烤箱中,烤箱上下层温度设置为220 ℃,烤制5 min,得到大多数熟化膨胀的青稞籽粒[16]。空气炸锅:40 g青稞籽粒润麦24 h取出,再放入180 ℃的空气炸锅中5 min,得到大多数籽粒开花的青稞。所有样品包括未加工的样品均在40 ℃电热恒温鼓风干燥箱中干燥至恒重。
所有样品统一用粉碎机30 s处理并过60目筛,筛上物再经反复粉碎处理得青稞全粉,放置于自封袋−20 ℃冰箱避光保存备用。
1.2.2 青稞酚类物质提取
参照Zhao等[20]、杨希娟等[21]和周红等[22]的方法分别提取游离多酚和结合多酚。称取1.00 g不同加工方式的青稞全粉,加入预冷的80%丙酮25 mL,室温超声(200 W)提取30 min,离心(5000 r/min,15 min)收集上清液,沉淀重复上述操作,合并3次所得上清液。上清液旋蒸干后用甲醇定容至10 mL,过0.22 μm有机滤膜,得到游离多酚提取液,−20 ℃避光保存。提取过游离多酚的残渣加入20 mL正己烷,200 r/min振荡提取1 h,3000 r/min离心5 min,收集沉淀物并加入17 mL盐酸/甲醇溶液(v/v=11/89),70 ℃水浴60 min,加乙酸乙酯20 mL混匀后3000 r/min离心5 min,收集上清液并重复3次。上清液旋蒸干后用甲醇定容至10 mL并过0.22 μm有机滤膜,得到结合多酚提取液,−20 ℃避光保存。
1.2.3 青稞酚类物质含量测定
1.2.3.1 总多酚含量的测定
采用Folin-Ciocalteau法并参考姚轶俊等[23]和Li等[24]的方法稍作修改。配制没食子酸储备液,用甲醇稀释得到梯度0、10、20、40、60、80、100 μg/mL的标准使用液。吸取上述标准液或样液,并加入400 μL蒸馏水和100 μL福林-酚试剂,摇匀,反应6 min后加入7%的Na2CO3溶液1 mL与800 μL蒸馏水,摇匀后避光静置90 min并以甲醇代替样品提取液为空白对照。取200 μL最终反应溶液添加到96孔板中,760 nm处测定吸光值,重复3次。标准曲线方程为:Y=0.0023X−0.0003,R2=0.999,线性范围0~100 μg/mL。
根据线性回归方程计算样品中游离多酚和结合多酚含量,两项之和为总多酚含量。多酚含量以每100 g提取物(干基)中所含相当于没食子酸的质量mg表示,计算公式为:
多酚含量(mg/100g)=Y×V1000×m×100 (1) 式中:Y为多酚质量浓度(μg/mL),V为提取液总体积(mL),m为样品干质量(g)。
1.2.3.2 总黄酮含量的测定
采用NaNO2-Al(NO3)3-NaOH显色法并参考范铭等[25]的方法稍作修改。配制芦丁标准溶液0.2 mg/mL,依次吸取0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL芦丁标准溶液或0.4 mL样液,加水至1.2 mL,再加入5%的NaNO2溶液0.2 mL,摇匀后放置6 min,加10%的Al(NO3)3溶液0.2 mL,摇匀后放置6 min,再加入4%的NaOH溶液2 mL,摇匀后静置15 min,制成芦丁浓度分别为0.0、8.0、16、24、32、40、48 μg/mL的标准系列工作液,并以甲醇代替样品提取液为空白对照。在510 nm处测定吸光值,重复3次。标准曲线方程为:Y=0.0071X−0.0162,R2=0.9988,线性范围0~48 μg/mL。
根据线性回归方程计算样品中游离黄酮和结合黄酮含量,两项之和为总黄酮含量。黄酮含量以每100 g提取物(干基)中所含相当于芦丁的质量mg表示,计算公式:
黄酮含量(mg/100g)=Y×V1000×m×100 (2) 式中:Y为黄酮质量浓度(μg/mL),V为提取液总体积(mL),m为样品干质量(g)。
1.2.4 青稞酚类物质活性测定
1.2.4.1 抗氧化活性
参考龙晓珊等[26]的方法,并加以改进,采用DPPH法评价其抗氧化活性。使用甲醇配制0.1 mmol/L的DPPH溶液并避光保存。5 mg/mL游离多酚提取液和结合多酚提取液分别用甲醇稀释为2、1、0.5、0.2、0.1 mg/mL。分别取10 μL不同浓度待测样品和190 μL的DPPH溶液在96孔板中混匀,室温避光反应30 min后在波长517 nm处测定OD值。DPPH自由基清除率按公式(3)计算:
DPPH自由基清除率(%)=(1−A3−A2A1)×100 (3) 式中:A3为待测样品和DPPH溶液的OD值,A2为待测样品和甲醇的OD值,A1为甲醇和DPPH溶液的OD值。
1.2.4.2 α-葡萄糖苷酶抑制能力测定
参考潘玥等[27]和Tian等[28]的方法并做适当修改。将青稞游离多酚与结合多酚配制为质量浓度为5、2、1、0.5、0.2、0.1 mg/mL溶液。在96孔板中先后加入15 μL不同质量浓度待测样品和α-葡萄糖苷酶溶液15 μL,37 ℃下反应15 min。再依次加入5 mmol/L PNPG底物30 μL,37 ℃下静置30 min后在波长405 nm处测定OD值。
反应体系如下:空白管A1中α-葡萄糖苷酶溶液15 μL和PBS缓冲液15 μL,空白对照管A2中PBS缓冲液30 μL,待测样品管A3中15 μL待测样品和α-葡萄糖苷酶溶液15 μL,待测样品对照管A4中加入15 μL待测样品和PBS缓冲液15 μL,37 ℃反应15 min。再分别加入5 mmol/L PNPG底物30 μL,静置30 min后在波长405 nm处测定OD值。抑制率依照公式(4)计算:
α萄糖苷酶抑制率(%)=(1−A3−A4A1−A2)×100 (4) 1.3 数据处理
采用Excel 2010和IBM SPSS Statistics 25版软件对数据进行整理,通过单因素方差分析(ANOVA)和Duncan多重比较方法进行显著性分析,P<0.05表示具有显著性差异,结果以均值±标准差的形式表示(n=3),由Origin 2021版软件作图。
2. 结果与分析
2.1 青稞的不同加工处理
图1为未加工与不同加工方式青稞的表观图,可以发现青稞经热处理后都出现了不同程度的体积膨胀,湿热处理(蒸制、煮制)使青稞吸水膨胀,而干热处理表现出明显的膨化现象。
2.2 不同加工方式对青稞多酚含量的影响
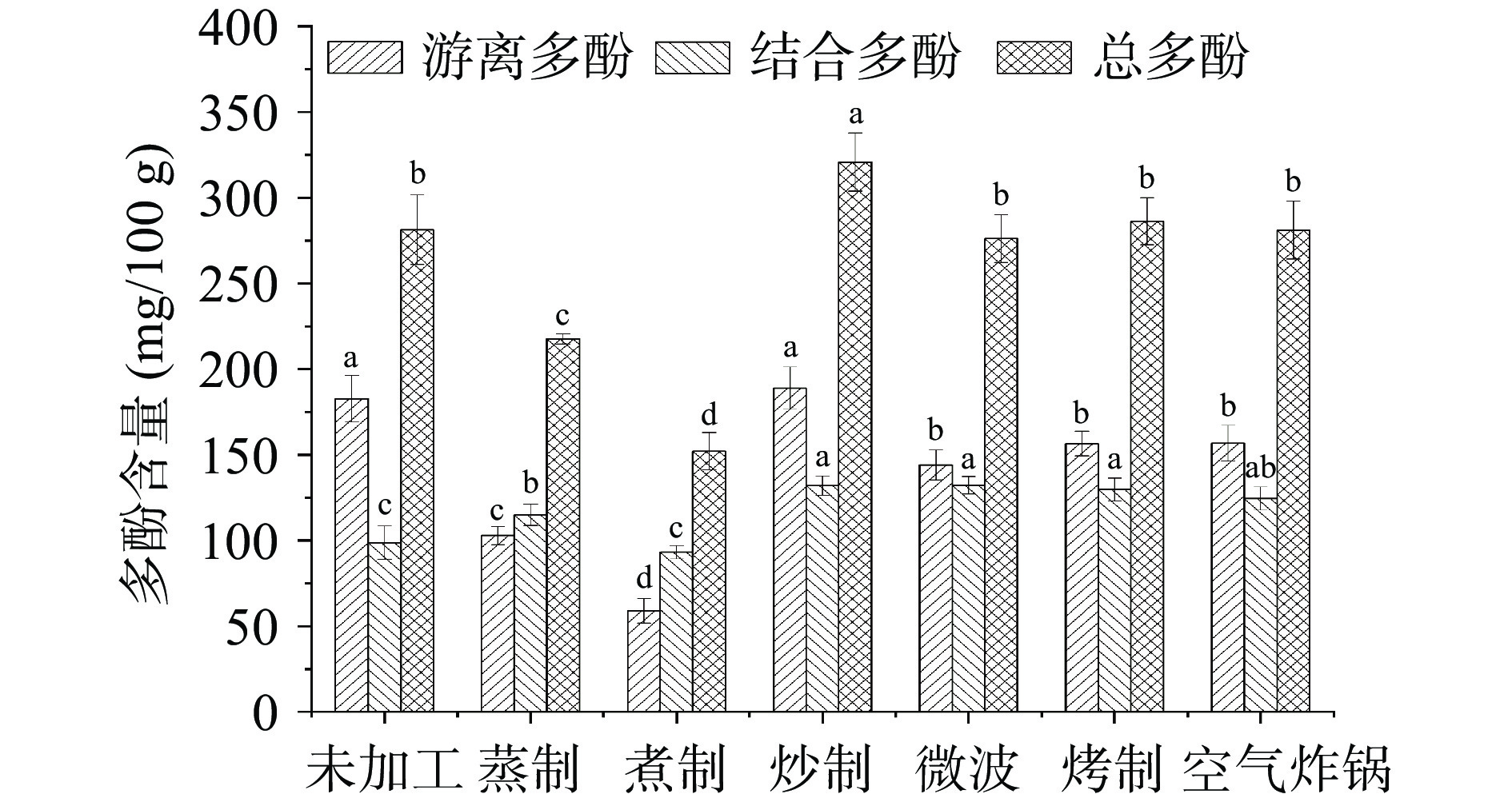
由图2可知,不同加工方式所得青稞多酚含量之间存在不同程度上的差异。未处理青稞的游离多酚、结合多酚和总多酚含量分别为182.72±13.64、98.65±9.72和281.37±20.23 mg/100 g。经热处理加工后,游离多酚、结合多酚、总多酚的含量分别在58.94~188.85、93.10~132.08、152.04~320.77 mg/100 g之间。除蒸制与煮制外,所得游离多酚含量均高于结合多酚。与未加工相比,炒制、微波和烤制处理后所得结合多酚含量分别提高33.89%、33.73%、31.45%,这可能由于加工过程中,青稞中蛋白质、纤维素的结构变化导致结合多酚的释放,且热处理时间短、温度高的加工条件更有利于多酚的保留和释放[29]。
青稞中的酚类物质在不同热加工过程中受到不同程度的综合作用力,与结合态酚类化合物相比,游离态酚类化合物结构不稳定,更易被破坏和分解[30],因而在不同加工方式中,与未加工相比,青稞游离多酚的含量均显著降低(P<0.05)(除炒制外)。蒸制和煮制的方式对青稞游离多酚的含量影响较大,损失率高达43.77%和67.85%,这可能是由于部分可溶性游离多酚在加工时溶解于水中,也可能是由于长时间的热处理导致部分多酚被氧化,因而游离多酚含量有所降低[13, 31]。分别经过微波、烤制和空气炸锅处理的青稞测得的游离多酚含量之间无显著性差异(P>0.05)。综上所述,炒制加工较好地保留和释放了热加工前全谷物青稞本应含有的多酚含量,但蒸制与煮制对青稞多酚的损失较大。
2.3 不同加工方式对青稞黄酮含量的影响
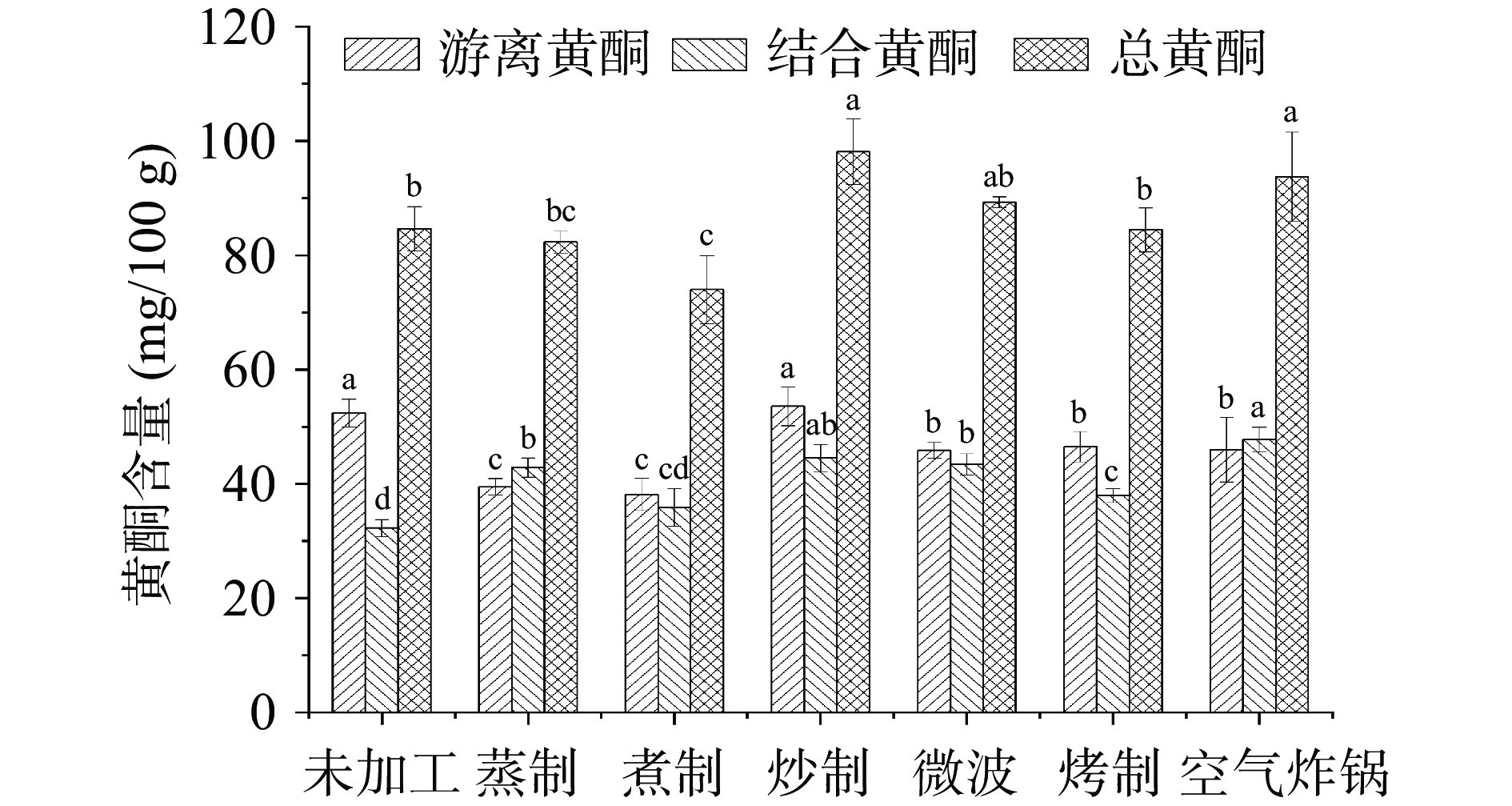
黄酮类化合物通常存在于粮食、果品、蔬菜中,是评价食物健康功效的主要指标之一[32]。由图3可知,不同加工方式所得青稞总黄酮含量之间存在差异。未经处理青稞的游离黄酮、结合黄酮和总黄酮含量依次为 52.39±2.43、32.23±1.48 和 84.61±3.87 mg/100 g。六种加工方式青稞的游离黄酮含量在38.12~53.57 mg/100 g之间,结合黄酮含量在35.87~47.77 mg/100 g之间,总黄酮含量在73.99~98.99 mg/100 g之间。除蒸制和空气炸锅外,青稞游离黄酮的含量均高于结合黄酮含量。与未加工相比,青稞加工处理后,结合黄酮的含量均有所提高,其中炒制青稞的结合黄酮和总黄酮含量显著增加了38.10%和15.93%(P<0.05),游离黄酮含量无显著变化(P>0.05),这可能是由于黄酮在热处理中的变化主要取决于原料以及加工过程中相对温度高、时间短的热处理方式对青稞细胞的破坏越剧烈,更有利游离黄酮的保留与结合黄酮的释放[33]。
青稞经过加工后,游离黄酮的含量与游离多酚的含量变化一致,且青稞分别经过微波、烤制和空气炸锅测得的游离黄酮含量之间也无显著性差异(P>0.05)。除炒制外,其他方式的青稞与未加工青稞相比,游离黄酮含量均显著降低(P<0.05),蒸、煮加工对游离黄酮的损失程度高于微波、烤制和空气炸锅加工。原因可能是在蒸煮过程中,青稞籽粒膨胀破裂导致水分流失,也带走了部分的游离黄酮类物质,或者是微波、烤箱和空气炸锅的穿透作用,导致了游离黄酮被破坏分解,使得黄酮类物质含量减少[12, 34-35]。因此,炒制的加工方式对黄酮含量更有一定的保护作用。
2.4 不同加工方式青稞多酚提取物的抗氧化活性
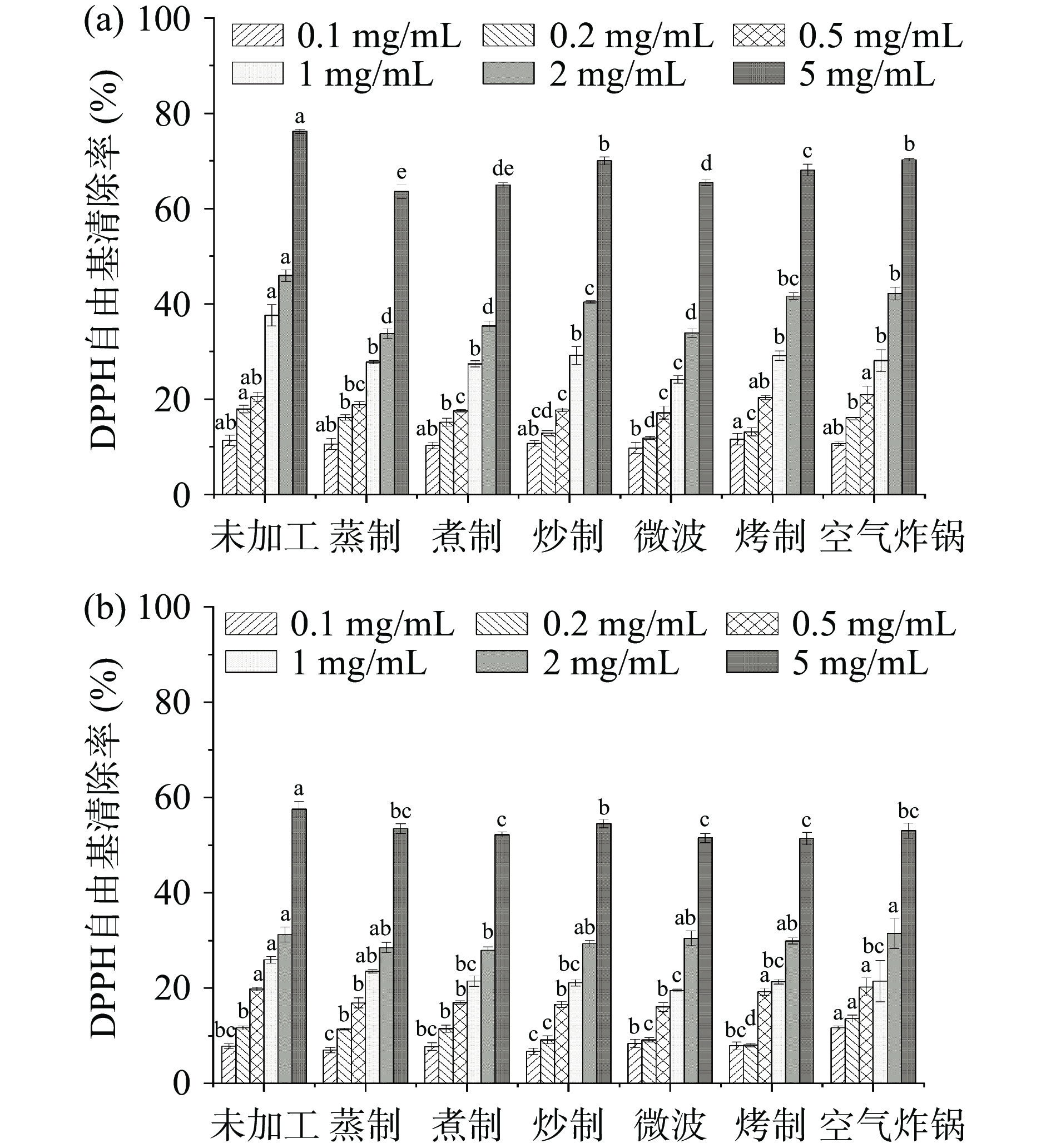
不同加工方式青稞多酚抗氧化活性如图4所示。不同加工方式所得青稞多酚提取物对DPPH自由基均有清除能力,随着浓度的提高,清除率不断上升,且游离多酚的自由基清除能力高于结合多酚。由图4a可知,在经过加工处理后,青稞游离多酚的DPPH自由基清除率与游离多酚和游离黄酮的含量变化情况相似。与未加工相比,不同加工方式所得青稞游离多酚的DPPH自由基的清除能力均有所降低,但青稞游离多酚提取物浓度为5 mg/mL时,清除率均已达到60%以上,且炒制与空气炸锅加工处理使游离多酚的清除能力降低最少,仅分别降低6.18%与5.96%,而蒸、煮后清除率显著降低(P<0.05),分别降低了12.61%、11.23%,这表明游离多酚提取物的含量与DPPH自由基清除率间呈正相关性。然而,青稞结合多酚提取物的DPPH自由基清能力(图4b),在经过加工处理后,与结合多酚和结合黄酮的含量变化相反。与未加工相比,不同加工的结合多酚提取物(浓度≥0.5 mg/mL)的DPPH清除率均下降,但在青稞游离多酚提取物为5 mg/mL时,清除率均在50%以上,而六种加工方式中,炒制加工的结合多酚的自由基清除能力最好,仅降低了3%。这可能是由于青稞中游离与结合多酚类物质中单体多酚的组成以及含量不同,且不同单体酚对自由基的清除具有不同差异的选择性[36]。根据以上分析结果可以发现,清除DPPH自由基的多酚类物质主要在游离多酚提取物中,炒制处理更适合青稞的加工,能够更好地保留其中的抗氧化活性物质。
2.5 不同加工方式青稞多酚提取物对α-葡萄糖苷酶活性的影响
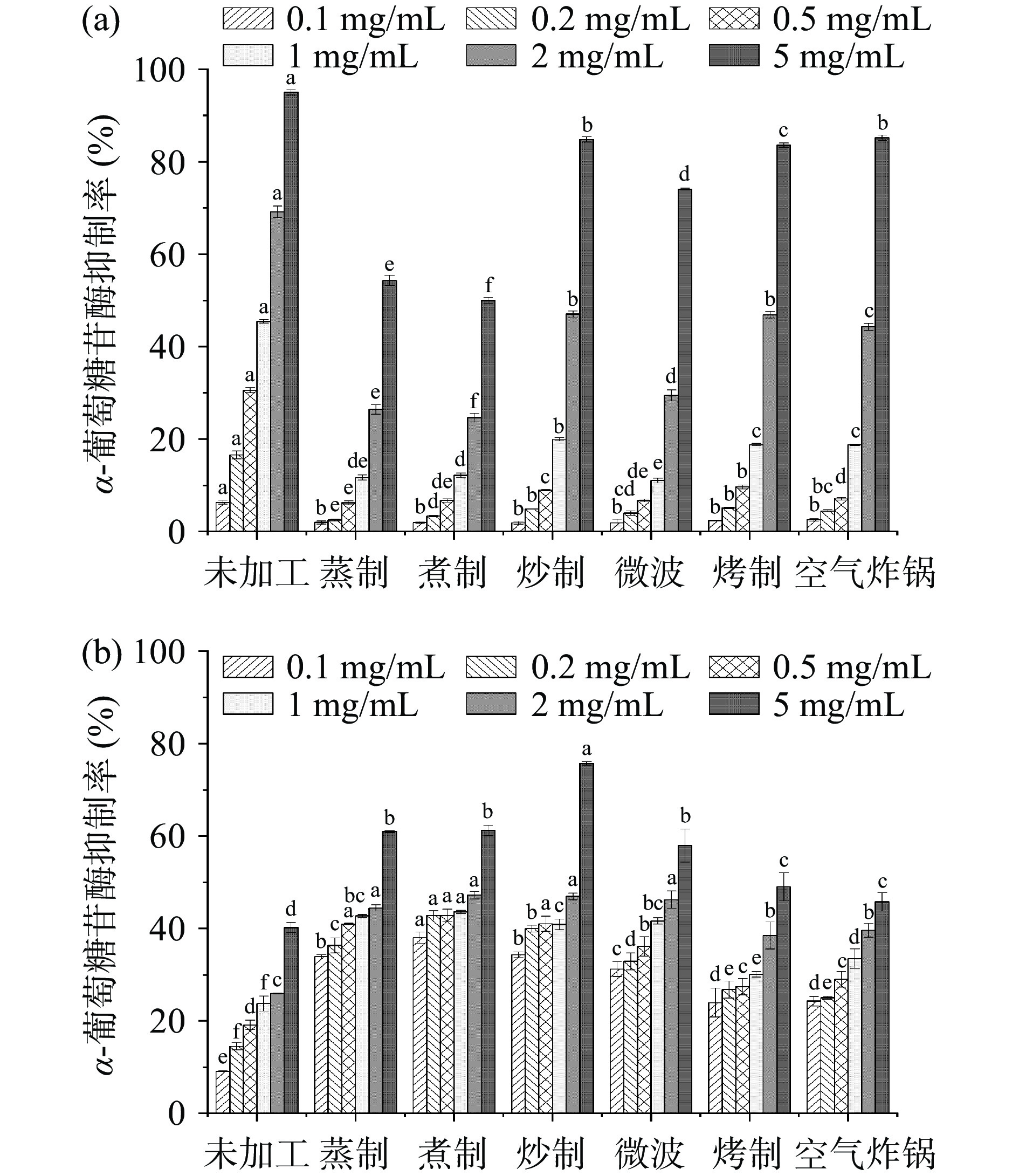
α-葡萄糖苷酶活性的抑制作用如图5所示。青稞多酚提取物对α-葡萄糖苷酶均具有抑制作用,游离多酚的抑制作用在0.1~5 mg/mL的范围内呈现出较强的浓度依赖性。此外,不同加工方式所得多酚提取物对α-葡萄糖苷酶活性的抑制作用存在差异。由图5a可知,在经过加工处理后,青稞游离多酚提取物抑制α-葡萄糖苷酶活性与游离多酚和游离黄酮的含量变化情况相似。当质量浓度为5 mg/mL时,游离多酚对α-葡萄糖苷酶的抑制能力大小依次为:炒制>空气炸锅>烤制>微波>蒸制>煮制,其中炒制、烤制和空气炸锅干热处理的抑制率均达到了80%以上,湿热处理的蒸、煮方式的青稞游离多酚的抑制率相对较低,抑制率分别为54.32%和49.99%,这表明干热处理方式对更能有效地保留青稞的生物活性。Zheng等[37]的研究发现,不同处理方式对青稞降血糖均有作用,且干热处理在提高血糖代谢和氧化性应激能力方面效果更佳。而在本实验中,经热处理后所得青稞的结合多酚提取物对α-葡萄糖苷酶的抑制能力增强,随着浓度的增加,抑制能力呈上升趋势(图5b)。此外,当提取物质量浓度5 mg/mL时,炒制所得结合多酚对α-葡萄糖苷酶活性的抑制率达到70%以上,这很可能是因为炒制过程使结合多酚含量增加,因而使结合多酚的抑制效果更好。由此可以说明,青稞多酚提取物对α-葡萄糖苷酶活性均具有一定的抑制效果,不同加工方式的游离多酚与结合多酚最高抑制率可达84.84%,且炒制加工的效果最佳。
3. 结论
本文对比研究了不同加工方式对青稞全谷物中酚类物质的影响。结果表明,不同加工处理所得多酚、黄酮的含量以及清除DPPH自由基和抑制α-葡萄糖苷酶的能力存在差异。与未加工相比,其他加工方式青稞游离多酚与游离黄酮含量均显著降低(P<0.05)(除炒制外),这可能由于在不同热加工过程中青稞中的酚类物质受到的作用力不同,与结合态酚类物质相比,游离态酚类物质结构不稳定,更易被破坏和分解。而不同加工方式所得青稞结合多酚与结合黄酮含量与未加工相比均有所提高,但蒸和煮的方式对青稞游离多酚和游离黄酮含量的损失较大,这与洪晴悦[16]的研究结果一致。在六种加工方式中,炒制处理的青稞游离和结合多酚提取物(5 mg/mL)在清除DPPH自由基和抑制α-葡萄糖苷酶的能力上较为突出,并均存在剂量依赖性,这可能由于炒制处理后结合多酚含量的增加,因而使其活性相对较好。
综上所述,青稞多酚提取物具有较强的抗氧化活性与α-葡萄糖苷酶抑制能力,炒制青稞能够最大限度地保留和释放酚类物质的含量与生物活性。本研究揭示了青稞多酚和黄酮总含量及其活性在不同加工方式中的变化规律,为青稞抗氧化、降血糖的深入研究以及功能性产品开发提供理论依据。但具体是多酚中的哪些成分的变化有待进一步研究,后续可通过液质联用建立青稞多酚含量的测定方法,探究单一成分的变化。
-
-
[1] 夏雪娟. 青稞全谷粉对高脂膳食大鼠胆固醇肝肠代谢的影响机制研究[D]. 重庆: 西南大学, 2018 XIA X J. Effects of whole-grain Qingke (Tibetan Hordeum vulgare L. Zangqing 320) on cholesterol metabolism in the liver and intestine of rats under high-fat diet and the involved mechanisms[D]. Chongqing: Southwest University, 2018.
[2] XIA X J, XING Y X, LI G N, et al. Antioxidant activity of whole grain Qingke (Tibetan Hordeum vulgare L.) toward oxidative stress in β-galactose induced mouse model[J]. Journal of Functional Foods,2018,45:355−362. doi: 10.1016/j.jff.2018.04.036
[3] YANG X J, DANG B, FAN M T. Free and bound phenolic compound content and antioxidant activity of different cultivated blue highland barley varieties from the Qinghai-Tibet plateau[J]. Molecules,2018,23(4):879. doi: 10.3390/molecules23040879
[4] 王海俊, 沈诗茜, 陈泽斌, 等. 不同加工方式对黑小麦面粉抗氧化活性的影响[J]. 江苏农业学报,2017,33(1):204−209. [WANG H J, SHEN S Q. CHEN Z B, et al. The effects on antioxidant activity of black wheat flour under different processing methods[J]. Jiangsu Journal of Agricultural Sciences,2017,33(1):204−209. doi: 10.3969/j.issn.1000-4440.2017.01.033 [5] 师琪, 管福琴, 孙浩. 小麦麸皮总黄酮苷抗肿瘤作用及初步的机制研究[J]. 食品科技,2013,38(6):220−226. [SHI Q, GUAN F L, SUN H. Antitumor effects and preliminary mechanism of total flavone from wheat bran[J]. Food Science and Technology,2013,38(6):220−226. doi: 10.13684/j.cnki.spkj.2013.06.058 [6] LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science,2007,46(3):207−219. doi: 10.1016/j.jcs.2007.06.010
[7] GE X Z, JING L Z, ZHAO K, et al. The phenolic compounds profile, quantitative analysis and antioxidant activity of four naked barley grains with different color[J]. Food Chemistry,2021,335:127655. doi: 10.1016/j.foodchem.2020.127655
[8] 王静, 刘丁丽, 罗丹, 等. 体外模拟消化对藜麦抗氧化活性、α-葡萄糖苷酶和α-淀粉酶抑制活性影响研究[J]. 中国粮油学报,2021,36(4):51−58. [WANG J, LIU D L, LUO D, et al. Effects of simulated gastrointestinal digestion in vitro on the antioxidant, α-glucosidase and α-amylase inhibitory activities of quinoa[J]. Journal of the Chinese Cereals and Oils Association,2021,36(4):51−58. doi: 10.3969/j.issn.1003-0174.2021.04.010 [9] JIN H M, DANG B, ZHANG W G, et al. Polyphenol and anthocyanin composition and activity of highland barley with different colors[J]. Molecules,2022,27(11):3411. doi: 10.3390/molecules27113411
[10] ADISAKWATTANA S, CHANTARASINLAPIN P, THAMMARAT H, et al. A series of cinnamic acid derivatives and their inhibitory activity on intestinal alpha-glucosidase[J]. Journal of Enzyme inhibition & Medicinal Chemistry,2009,24(5):1194−1200.
[11] 王耀红, 王蕾, 赵朋, 等. 不同加工方式对紫色马铃薯中酚类物质的影响[J]. 食品科学,2017,38(7):115−121. [WANG Y L, WANG L, ZHAO P, et al. Effects of domestic cooking methods on phenol contents and antioxidant activity in purple-fleshed potatoes[J]. Food Science,2017,38(7):115−121. doi: 10.7506/spkx1002-6630-201707019 [12] 高岳. 糙米全谷物酚类物质降血糖活性及作用机制研究[D]. 广州: 华南理工大学, 2019 GAO Y. Research on hypoglycemic activity and mechanism of phenolic compound in whole grain brown rice[D]. Guangzhou: South China University of Technology, 2019.
[13] 张欢. 蒸煮方式对糙米多酚抗氧化性、淀粉酶和葡萄糖苷酶活性的影响研究[D]. 沈阳: 沈阳师范大学, 2021 ZHANG H. Effect of different cooking methods on antioxidant activities and amylase and glucoside activities of phenolic compounds in brown rice[D]. Shenyang: Shenyang Normal University, 2021.
[14] 董华强, 李梅, 吴剑峰, 等. 多穗柯根皮苷水杨酸酯抗氧化和降血糖活性研究[J]. 食品科学,2009,30(19):279−282. [DONG H Q, LI M, WU J F, et al. Antioxidant and hypoglycemic activities of phloridzin-6"-O-salicylate[J]. Food Science,2009,30(19):279−282. doi: 10.3321/j.issn:1002-6630.2009.19.065 [15] DENG N, ZHANG B S, LI T, et al. Assessment of the phenolic profiles, hypoglycemic activity, and molecular mechanism of different highland barley (Hordeum vulgare L.) varieties[J]. International Journal of Molecular Sciences,2020,21(4):1175. doi: 10.3390/ijms21041175
[16] 洪晴悦. 不同热加工对青稞主要生物活性成分和体外消化与肠菌发酵特性的影响[D]. 重庆: 西南大学, 2017 HONG Q Y. Effects of different thermal processing on main bioactive components, in vitro digestion and fermentation characteristics of Qingke[D]. Chongqing: Southwest University, 2017.
[17] 王倩倩, 李明泽, 陆红佳, 等. 不同加工方式对青稞降脂益肠功效的影响[J]. 食品科学,2014,35(13):276−280. [WANG Q Q, LI M Z, LU H J, et al. Influence of different processing methods on the effect of hulless barley on improving intestinal health and lowering serum lipid levels[J]. Food Science,2014,35(13):276−280. doi: 10.7506/spkx1002-6630-201413055 [18] 杨希娟. 青稞糌粑加工工艺研究[J]. 食品工业,2016,37(8):78−81. [YANG X J. Research on processing technology of hulless barely Tsampa[J]. Food Industry,2016,37(8):78−81. [19] XIANG Z Y, DENGJ L, YANG K L, et al. Effect of processing on the release of phenolic compounds and antioxidant activity during in vitro digestion of hulless barley[J]. Arabian Journal of Chemistry,2021,14(12):103447. doi: 10.1016/j.arabjc.2021.103447
[20] ZHAO H F, DONG J J, LU J, et al. Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley (Hordeum vulgare L.)[J]. Journal of Agricultural & Food Chemistry,2006,54(19):7277−7286.
[21] 杨希娟, 党斌, 樊明涛. 溶剂提取对青稞中不同形态多酚组成及抗氧化活性的影响[J]. 食品科学,2018,39(24):239−248. [YANG X J, DANG B, FAN M T. Effect of different extraction solvents on phenolic profiles and antioxidant activities of hulless barley[J]. Food Science,2018,39(24):239−248. doi: 10.7506/spkx1002-6630-201824036 [22] 周红, 张杰, 张文刚, 等. 青海黑青稞营养及活性成分分析与评价[J]. 核农学报,2002,35(7):1609−1618. [ZHOU H, ZHANG J, ZHANG W G, et al. Analysis and evaluation of the nutritional quality and active components of Qinghai black highland barley[J]. Journal of Nuclear Agricultural Sciences,2002,35(7):1609−1618. [23] 姚轶俊, 李枝芳, 王立峰, 等. 体外模拟消化对四种杂粮中酚类物质及其降脂活性的影响[J]. 中国粮油学报,2020,35(5):30−36. [YAO Y B, LI Z F, WANG L F, et al. Effect of in vitro digestion on phenolic compounds and lipid-lowering effect of four coarse cereals[J]. Journal of the Chinese Cereals and Oils Association,2020,35(5):30−36. [24] LI Y P, SKOUROUMOUNIS G K, ELSEY G M, et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J]. Food Chemistry,2011,129(2):570−576. doi: 10.1016/j.foodchem.2011.04.068
[25] 范铭, 刘哲, 曹艳, 等. 不同干燥方式对桑葚渣提取物主要活性成分及α-淀粉酶抑制活性的影响[J]. 浙江农业科学,2018,59(10):1911−1916. [FAN M, LIU Z, CAO Y, et al. Effects of different drying methods on main active components and α-amylase inhibitory activity of mulberry residue extract[J]. Zhejiang Agricultural Science,2018,59(10):1911−1916. [26] 龙晓珊, 廖森泰, 刘书成, 等. 肉桂多酚清除自由基及抑制α-葡萄糖苷酶活性的能力[J]. 现代食品科技,2021,37(8):119−126. [LONG X S, LIAO S T, LIU S C, et al. The abilities of cinnamon polyphenols to scavenge free radicals and inhibit α-glucosidase[J]. Modern Food Science and Technology,2021,37(8):119−126. [27] 潘玥, 刘小莉, 王英, 等. 蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的体外抑制活性研究[J]. 天然产物研究与开发,2022,34(4):579−587. [PAN Y, LIU X L, WANG Y, et al. Inhibitory effect of polyphenols from blueberry leaves on the activity of α-amylase and α-glucosidase in vitro[J]. Natural Product Research and Development,2022,34(4):579−587. [28] TIAN J L, SI X, WANG Y H, et al. Bioactive flavonoids from Rubus corchorifolius inhibit α-glucosidase and α-amylase to improve postprandial hyperglycemia[J]. Food Chemistry,2021,341(1):128149.
[29] YU Y F, ZHANG B, XIA Y H, et al. Bioaccessibility and transformation pathways of phenolic compounds in processed mulberry (Morus alba L.) leaves after in vitro gastrointestinal digestion and faecal fermentation[J]. Journal of Functional Foods,2019,60:103406. doi: 10.1016/j.jff.2019.06.008
[30] LIN S, GUO H, BUGONG J D, et al. Phenolic profiles, β-glucan contents, and antioxidant capacities of colored Qingke (Tibetan hulless barley) cultivars[J]. Journal of Cereal Science,2018,81:69−75. doi: 10.1016/j.jcs.2018.04.001
[31] ALIN, POPOVICĆ V, KOUTCHMA T, et al. Effect of thermal, high hydrostatic pressure, and ultraviolet-C processing on the microbial inactivation, vitamins, chlorophyll, antioxidants, enzyme activity, and color of wheatgrass juice[J]. Journal of Food Process Engineering,2020.
[32] 井璐珍. 不同色泽青稞及发芽青稞中酚类物质的定性定量分析及抗氧化活性研究[D]. 杨凌: 西北农林科技大学, 2019 JING L Z. Qualitative and quantitative analysis of phenolic compounds in different colors of highland barley and germinated highland barley and their antioxidant activity[D]. Yangling: Northwest A & F University, 2019.
[33] WANG Q, SHAO H J, ZHANG Z, et al. Phenolic profile and antioxidant properties of sand rice (Agriophyllum squarrosum) as affected by cooking and in vitro digestion[J]. Journal of the Science of Food & Agriculture,2019,99(8):3871−3878.
[34] LI Q, SHI X H, ZHAO Q J, et al. Effect of cooking methods on nutritional quality and volatile compounds of Chinese chestnut (Castanea mollissima Blume)[J]. Food Chemistry,2016,201:80−86. doi: 10.1016/j.foodchem.2016.01.068
[35] LI B, YANG W, NIE Y Y, et al. Effect of steam explosion on dietary fiber, polysaccharide, protein and physicochemical properties of okara[J]. Food Hydrocolloids,2019,94:48−56. doi: 10.1016/j.foodhyd.2019.02.042
[36] ABDEL A, EI M, CHOO T M, et al. Free and bound phenolic acids and total phenolics in black, blue, and yellow barley and their contribution to free radical scavenging capacity[J]. Cereal Chemistry,2012,89(4):198−204. doi: 10.1094/CCHEM-10-11-0116
[37] ZHENG B, ZHONG S W, TANG Y K, et al. Understanding the nutritional functions of thermally-processed whole grain highland barley in vitro and in vivo[J]. Food Chemistry,2020,310:125979. doi: 10.1016/j.foodchem.2019.125979










 下载:
下载:
 下载:
下载:



