Optimization on Extraction Technology and Component Analysis of Wax from Munage Grapes Pericarp
-
摘要: 表皮蜡质是影响果蔬耐贮性的重要因素之一,故本研究以木纳格葡萄为材料,采用响应面法对有机溶剂浸泡提取葡萄表皮蜡质的工艺进行优化分析,同时利用气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)对葡萄表皮蜡质成分及其含量进行鉴定分析。结果表明:在单因素基础上,响应面法优化蜡质提取最佳条件为二氯甲烷与正己烷混合比3:1 mL/mL,液料比2:1 mL/g,提取时间7.5 min,在该提取条件下,蜡质提取量为43.60±1.04 mg/100 g,这与响应面预测值相差0.98%。表皮蜡质经GC-MS检测,共鉴定出61种蜡质化合物,包括脂肪酸、烃类各13种,醇类10种,酯类9种,醛类5种,萜类4种,未分类化合物7种,其中脂肪酸的相对含量最高,占总蜡质含量的58.06%。这为深入研究葡萄表皮蜡质化学成分与果实采后品质之间的关系提供理论参考。Abstract: Cuticular wax is one of the important factors affecting the storability of fruits and vegetables. Thus, Munage grape was used as material in this study, and response surface methodology was used to optimize the process parameters of extracting cuticular wax from grapes by soaking in organic solvent. At the same time, the components and content of the cuticular wax were identified and analyzed by gas chromatography-mass spectrometry (GC-MS). The results showed that on the basis of single factor, the optimum conditions of wax extraction optimized by response surface methodology were as follows: The mixing ratio of dichloromethane and hexane was 3:1 mL/mL, the liquid-solid ratio was 2:1 mL/g, and the extraction time was 7.5 min. Under the optimal extraction conditions, the wax extraction amount was 43.60±1.04 mg/100 g, which was 0.98% difference from the predicted value of response surface. A total of 61 compounds were identified in epidermal wax, including 13 kinds of fatty acids, 13 kinds of hydrocarbon compounds, 10 kinds of alcohols, 9 kinds of esters, 5 kinds of aldehydes, 4 kinds of terpenoids, and 7 kinds of unclassified compounds. The relative content of fatty acids was the highest, accounting for 58.06% of the total wax content. This provided a theoretical reference for the further study of the relationship between the composition of cuticular wax in grapes and postharvest qualities of fruits.
-
Keywords:
- Munage grape /
- cuticular wax /
- extraction process /
- response surface methodology /
- wax composition
-
木纳格葡萄(Vitis vinifera L. cv. Munage),属欧亚种,原产于新疆阿图什市,每年9~10月成熟,是优良的晚熟品种[1]。该葡萄果肉厚而脆、皮薄多汁,且具有较耐贮运等特点,因而成为国内大众喜爱的浆果类水果之一[2]。木纳格葡萄表皮覆盖有肉眼可见的白色天然蜡质涂层,此天然蜡质同其他水果表面含有的植物表皮蜡质有着类似作用,在该葡萄采后运输、贮藏及销售等过程中具有维持果实新鲜品质的潜在效果,是木纳格较耐贮运的原因之一。植物表皮蜡质是覆盖于植物器官或组织表面的疏水性物质[3],可保护植物免受生物和非生物胁迫,如抵抗病虫害、减少紫外线辐射、防止植物水分散失、抑制病原菌感染等[4-5],因此近年来植物表皮蜡质得到越来越多研究者的关注。
目前用于植物表皮蜡质研究最常用的蜡质提取方法为有机溶剂浸泡法[6]。库尔勒香梨表皮蜡质在三氯甲烷与二氯甲烷混合比2:1(v/v)条件下进行60 s提取,提取量为56.4 mg/100 g[7];苹果表皮和水稻成熟叶片分别浸泡于氯仿溶剂1 h、30 s提取出986.46 μg/cm2、49.99 μg/cm2的表皮蜡质[8-9];以乙酸乙酯为提取剂提取玫瑰花蜡质,提取2 h,提取率为2.65%[10];枸杞果实按料液比1:1 g/mL浸泡于正己烷1 h后,该果实的表皮蜡质几乎被提取完全[11]。以上现有的提取表皮蜡质的方法都可最大程度地提取对应植物的表皮蜡质,因此对于不同植物的表皮蜡质,其提取条件也会有所不同,应采取适于植物自身的提蜡方法。
植物表皮蜡质的成分主要由脂肪族化合物(脂肪酸、烃类、酯类、醇类、醛类等)及部分萜类物质组成,而不同植物种类、品种、器官及组织的蜡质成分和含量有所不同[12]。有研究证实,烷烃是苹果表皮蜡质的主要成分,并可维持果实重量[13],同时烷烃也是3个亚洲梨品种(库尔勒、雪花、玉露香)的主要蜡质化合物[14]。在有关9个蓝莓品种果实蜡质成分的研究中发现[15]:萜类是蓝莓果实表皮蜡质的主要成分,其含量占总蜡质的64.2%。此外,萜类和脂肪酸都是越桔果实表皮蜡质中主要化合物,可起到抑制病原菌感染的作用[16]。由此可推测,不同品种水果果实的表皮蜡质成分不同,或许是造成果实采后贮藏品质差异的重要因素。故了解表皮蜡质与果实采后品质的联系,应明确该果实的表皮蜡质成分,而关于葡萄表皮蜡质成分的研究还有限,所以对木纳格葡萄表皮蜡质进行提取,并深入研究其成分及含量对葡萄采后贮藏特性具有十分重要的意义。
为此,本研究利用有机溶剂浸泡法提取木纳格葡萄表皮蜡质,选取不同提取溶剂、溶剂混合比、液料比及提取时间为实验因素,考察各因素对木纳格葡萄表皮蜡质提取量的影响,并结合响应面试验优化该果实表皮蜡质提取条件。同时采用气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)对蜡质进行鉴定分析,以此确定木纳格葡萄表皮蜡质的成分及含量,为今后葡萄表皮蜡质的相关研究提供理论依据。
1. 材料与方法
1.1 材料与仪器
木纳格葡萄 2021年9月23日采摘于新疆维吾尔自治区阿图什市,运至石河子大学食品学院,挑选无果皮损烂、无蜡质磨损、果梗完整的葡萄果实用于表皮蜡质提取;二氯甲烷、正己烷、乙酸乙酯、甲醇 分析纯,天津市北联精细化学品开发有限公司;三氟化硼-甲醇溶液(14%)、正庚烷、正二十四烷 色谱纯,上海易恩化学技术有限公司;氯化钠、无水硫酸钠 天津市盛奥化学试剂有限公司。
RV-10旋转蒸发仪 德国艾卡仪器设备有限公司;8890-7000D气相色谱-质谱联用仪 美国安捷伦公司;ME204/02电子分析天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 表皮蜡质提取流程及操作要点
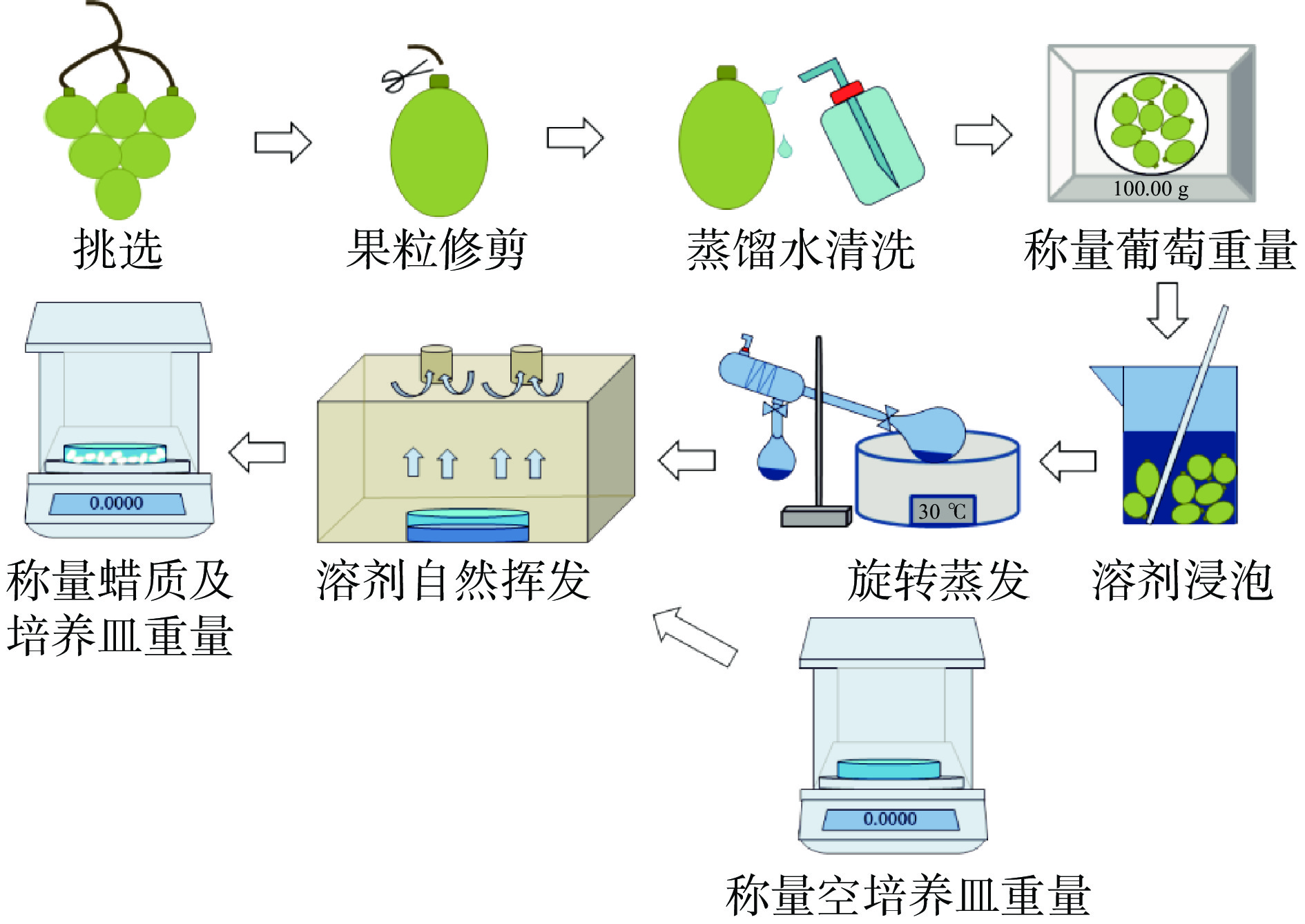
葡萄表皮蜡质提取采用有机溶剂浸泡法,提取工艺见图1,操作要点如下:
挑选修剪:挑选无任何损伤果粒的葡萄果穗,从果穗上将果粒剪下,保留较短的果梗(果梗缺失会导致葡萄果粒尾部的损伤),以此来避免溶剂浸泡时提取出果肉中的脂溶性物质。
清洗称量:修剪完的果粒用蒸馏水轻轻冲洗,待葡萄表皮蒸馏水自然晾干后,称量试验所需的葡萄果粒(约M=100.00 g)。
溶剂浸泡:在常温下,将称量的葡萄果粒放入烧杯中(500 mL),缓慢倒入有机溶剂提取剂,并开始计时。葡萄浸泡期间,需用玻璃棒轻轻搅拌,以此使果粒的各部位都接触到提取剂。
溶剂挥发:浸泡提取结束后,镊子小心夹出葡萄果粒。含有蜡质的提取剂使用旋转蒸发仪进行浓缩,随后将浓缩后的溶剂转移至合适的玻璃培养皿(已知重量m1)中。最后将培养皿(含提取剂+蜡质)放入通风橱中进行自然挥发,直至恒重。
称量:将含有干燥蜡质粉末的培养皿放入分析天平中称其重量得m2。
采用差量法计算该果实的表皮蜡质提取量,其计算公式为:
蜡质提取量(mg/100g)=m2−m1M×100 式中:m1表示空培养皿的重量,mg;m2表示培养皿及所提蜡质的重量,mg;M表示葡萄果粒重量,g。
1.2.2 表皮蜡质提取工艺优化
1.2.2.1 单因素实验
采用1.2.1中葡萄表皮蜡质提取操作流程,以蜡质提取量为评价指标进行单因素实验。固定液料比2:1 mL/g、提取时间6 min,考察提取溶剂(二氯甲烷、正己烷、乙酸乙酯、甲醇)对蜡质提取量的影响;固定提取溶剂二氯甲烷和正己烷、液料比2:1 mL/g、提取时间6 min,考察溶剂混合比(1:1、2:1、3:1、4:1、5:1 mL/mL)对蜡质提取量的影响;固定溶剂混合比3:1 mL/mL、提取时间6 min,考察液料比(1:1、1.5:1、2:1、2.5:1、3:1 mL/g)对蜡质提取量的影响;固定溶剂混合比3:1 mL/mL、液料比2:1 mL/g,考察提取时间(2、4、6、8、10 min)对蜡质提取量的影响。
1.2.2.2 响应面试验
依据单因素实验结果,将提取剂(二氯甲烷:正己烷)设为固定因素,利用Design-Expert 8.0.6中Box-Behnken设计方法,以溶剂混合比(A)、液料比(B)、提取时间(C)为试验因素,以蜡质提取量(Y)为响应值进行优化试验,因素及水平设计见表1。
表 1 响应面试验因素与水平Table 1. Factors and levels of response surface experiments水平 因素 A溶剂混合比(mL/mL) B液料比(mL/g) C提取时间(min) −1 2:1 1.5:1 4 0 3:1 2:1 6 1 4:1 2.5:1 8 1.2.3 表皮蜡质化学成分检测
1.2.3.1 GC-MS测定蜡质前的甲酯化处理
参照李珍慈[7]和王月[17]等的方法并稍作修改,详细为:称取蜡质粉末100 mg,倒入磨口圆底瓶(50 mL)中并加10 mL三氟化硼-甲醇溶液(14%),同时混入100 μL正二十四烷(1 μg/μL)作为内标物。将磨口圆底瓶放入水浴锅(75 ℃)中,并用铁架台固定,冷凝回流5 min后从冷凝器上端加入正庚烷(10 mL),继续冷凝回流2 min。取出磨口圆底瓶,待冷却至室温,加入饱和氯化钠溶液(10 mL)静置分层,用注射器吸取上清液移至闭塞管中(含0.8 g无水硫酸钠)。最后将闭塞管的上清液通过有机微孔膜(直径0.22 μm)注入样品瓶中待GC-MS检测。表皮蜡质成分定性参照NIST17.L(谱库/数据库),以正二十四烷(C24H50)为内标物,采用内标法进行定量分析,且利用峰面积归一化法计算蜡质成分的相对质量分数。
1.2.3.2 气相色谱条件
采用HP-5石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气(He)流速:1.1 mL/min,线速度40 cm/s;进样量:1.0 μL,不分流;进样口温度:250 ℃;传输线温度:290 ℃;程序升温:初始温度80 ℃,以4 ℃/min升温至290 ℃,恒温30 min。
1.2.3.3 质谱条件
电离方式为电子电离源,离子源温度:230 ℃;四级杆温度150 ℃;电子轰击能量:70 eV;质量扫描范围35~600 m/z。
1.3 数据处理
各试验均进行三次重复,结果以平均值±标准差表示。Origin 2018软件进行数据处理及绘图。DPS 7.0.5软件进行方差分析,并对平均值进行多重比较分析(Duncan新复极差法)。Design-Expert 8.0.6软件进行响应面试验优化设计。
2. 结果与分析
2.1 葡萄表皮蜡质提取条件的单因素实验
2.1.1 不同提取溶剂对葡萄表皮蜡质提取量的影响
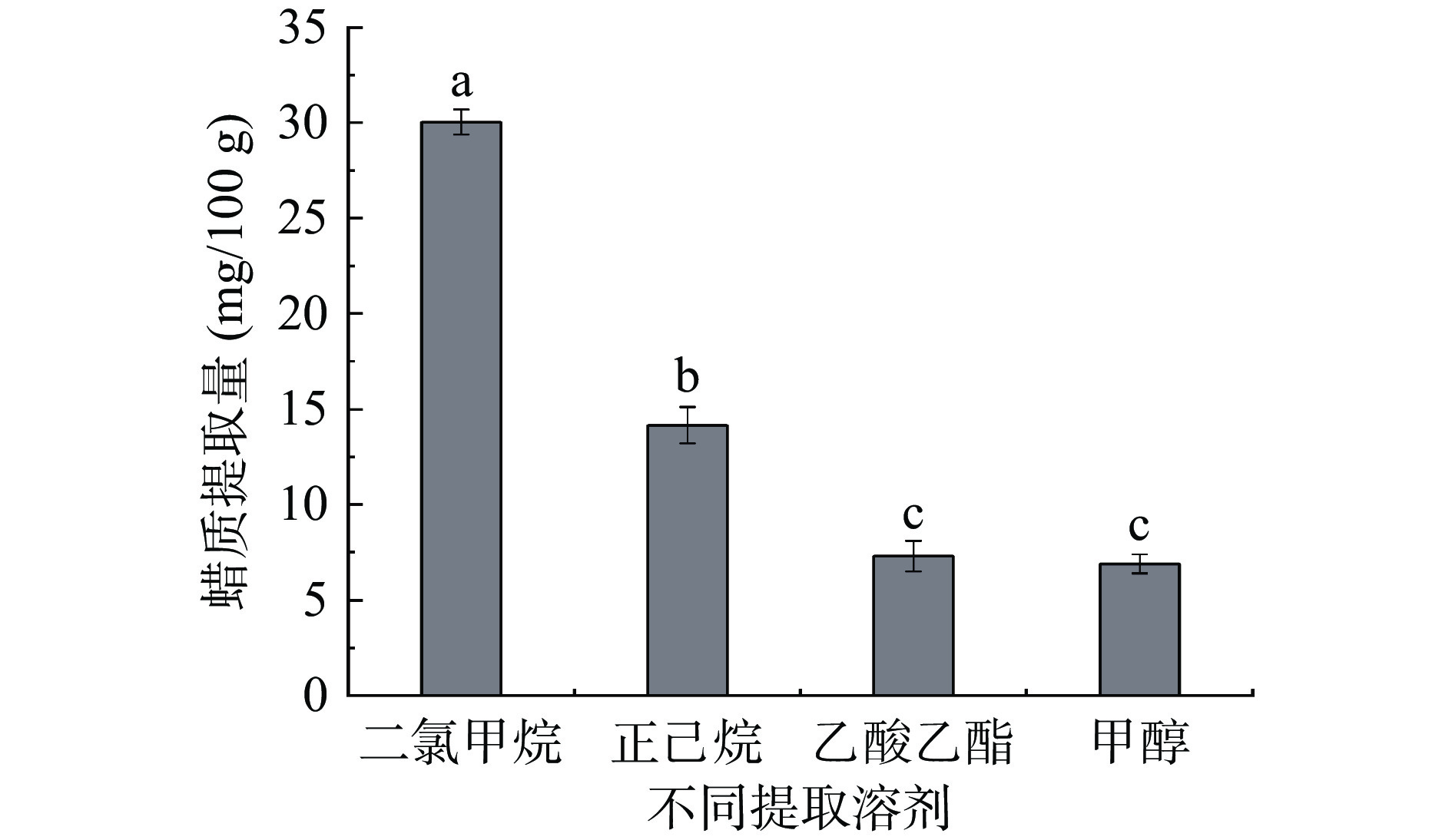
本试验选取4种常见的有机溶剂,因它们能够溶解植物蜡质,且极性低,不致葡萄果皮有损伤还可充分提取蜡质。由图2可知,二氯甲烷的蜡质提取量(30.03±0.66 mg/100 g)显著高于其他3种提取溶剂(P<0.05),正己烷的蜡质提取量(14.15±0.95 mg/100 g)仅次于二氯甲烷。而乙酸乙酯(7.3±0.80 mg/100 g)、甲醇(6.9±0.50 mg/100 g)的蜡质提取量较少,且两者之间没有显著差异(P>0.05)。有机溶剂混合可增大溶剂浸提率,进而增加植物表皮蜡质提取量[18]。故选取蜡质提取量较高的二氯甲烷与正己烷,将两者混合液作为蜡质提取剂进行后续试验。
2.1.2 溶剂混合比对葡萄表皮蜡质提取量的影响
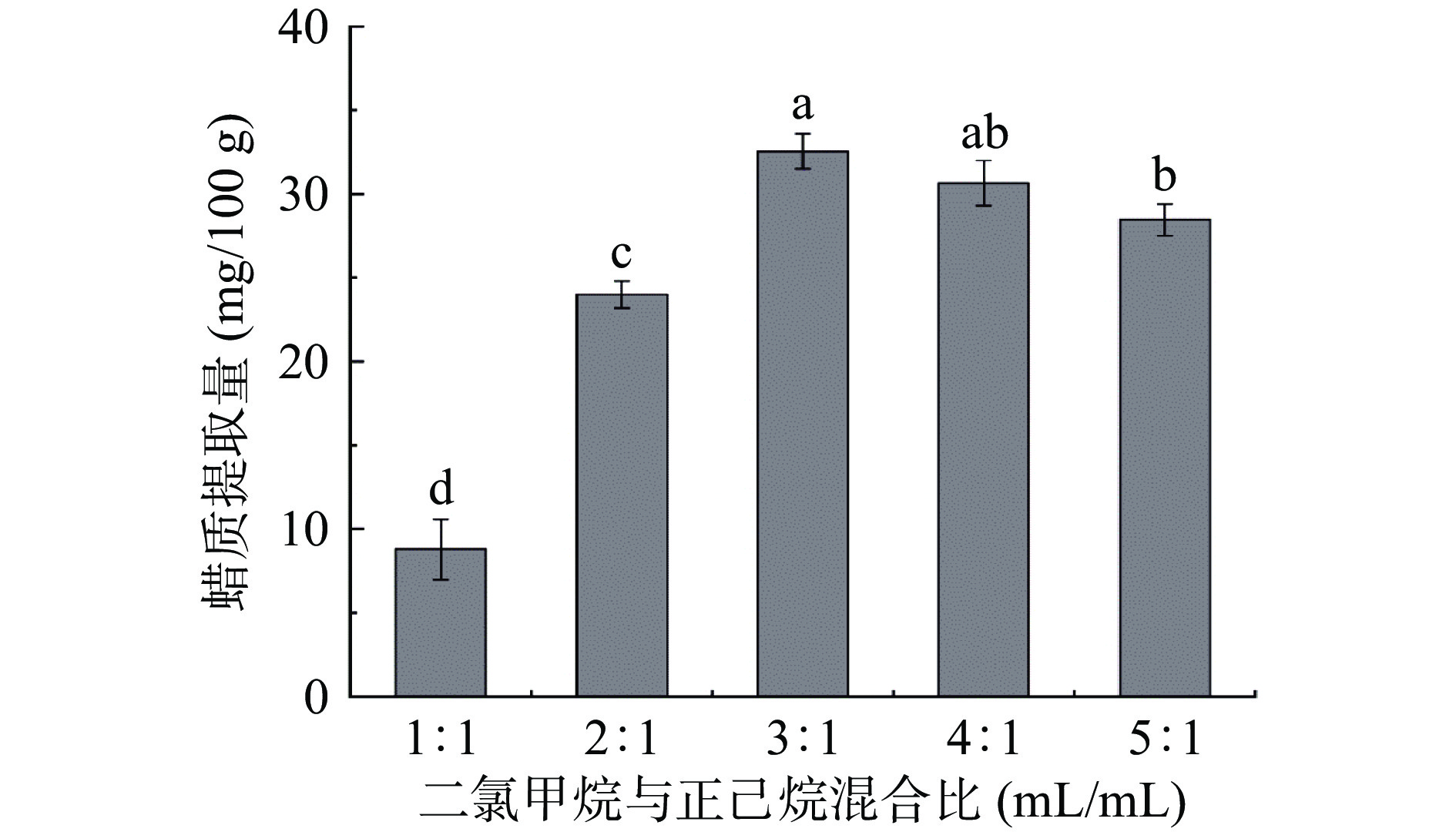
由图3可知,随着溶剂混合比增大,蜡质提取量先呈上升趋势,说明大部分表皮蜡质会被二氯甲烷所溶解。当混合比为3:1时,蜡质提取量(32.55±1.05 mg/100 g)达到峰值,但与混合比4:1的蜡质提取量无显著差异(P>0.05),且蜡质提取量高于单一溶剂的蜡质提取量,但与二氯甲烷的蜡质提取量(30.03±0.66 mg/100 g)无显著差异(P>0.05),这或许是蜡质中某些成分能更好地溶于二氯甲烷,而另一些成分能更多地溶于正己烷,此结果与李述刚[18]、李珍慈[19]等的研究结果一致。此后混合比增加,蜡质提取量有缓慢降低趋势,这或许因混合比的增加,混合剂中正己烷体积含量甚微,易溶于正己烷的蜡质不能被充分提取,而混合剂中二氯甲烷为主要溶剂且发挥着单一提取剂的作用,导致蜡质提取量降低。综上,选取二氯甲烷与正己烷混合比为3:1进行后续试验。
2.1.3 液料比对葡萄表皮蜡质提取量的影响
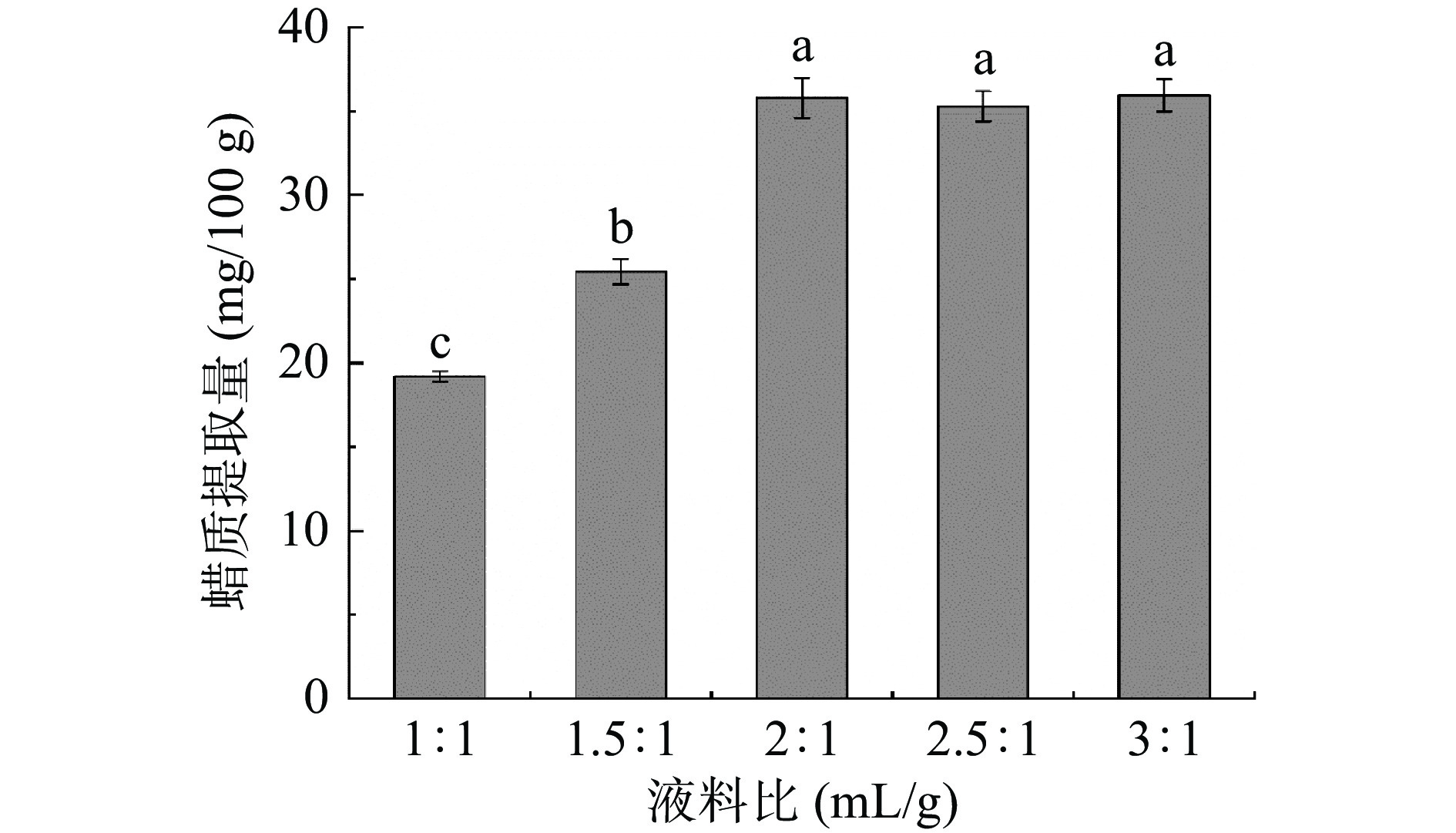
提取剂的体积含量也是直接影响植物表皮蜡质提取量的重要因素。如图4所示,蜡质提取量随着液料比的增大而显著增加(P<0.05),直至液料比为2:1时,蜡质提取量为35.80±1.20 mg/100 g,随后液料比2.5:1、3:1的蜡质提取量趋于平稳且无显著差异(P>0.05)。由此可得:液料比较小时,会因溶剂量较少而不足以将试验中果实的蜡质完全溶解;混合提取剂200 mL时,葡萄果实(100 g)的蜡质几乎被完全溶解,此时蜡质提取量处于饱和状态。故从节约试剂、高效提取的角度考虑,选取2:1为最佳液料比。
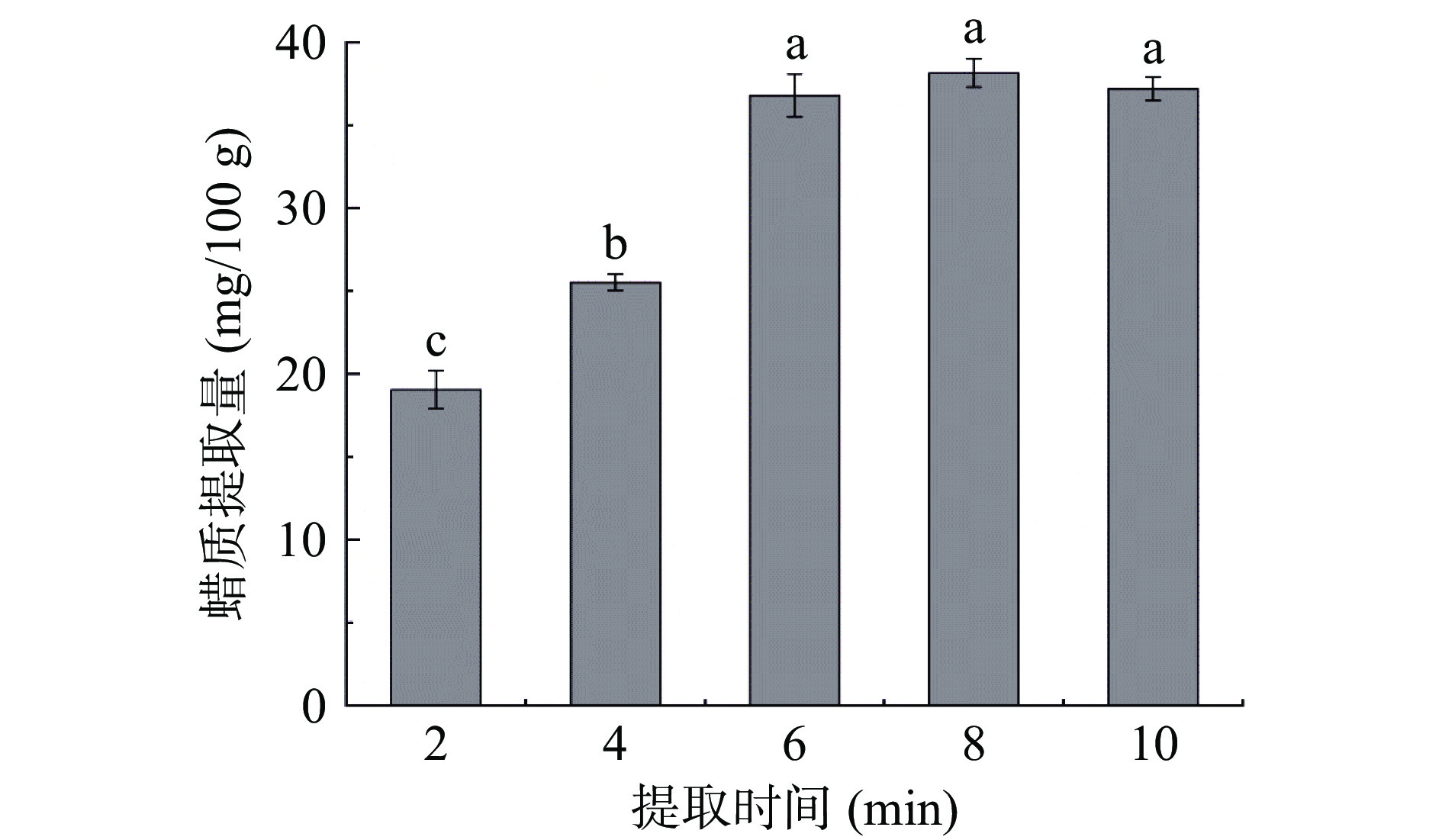
2.1.4 提取时间对葡萄表皮蜡质提取量的影响
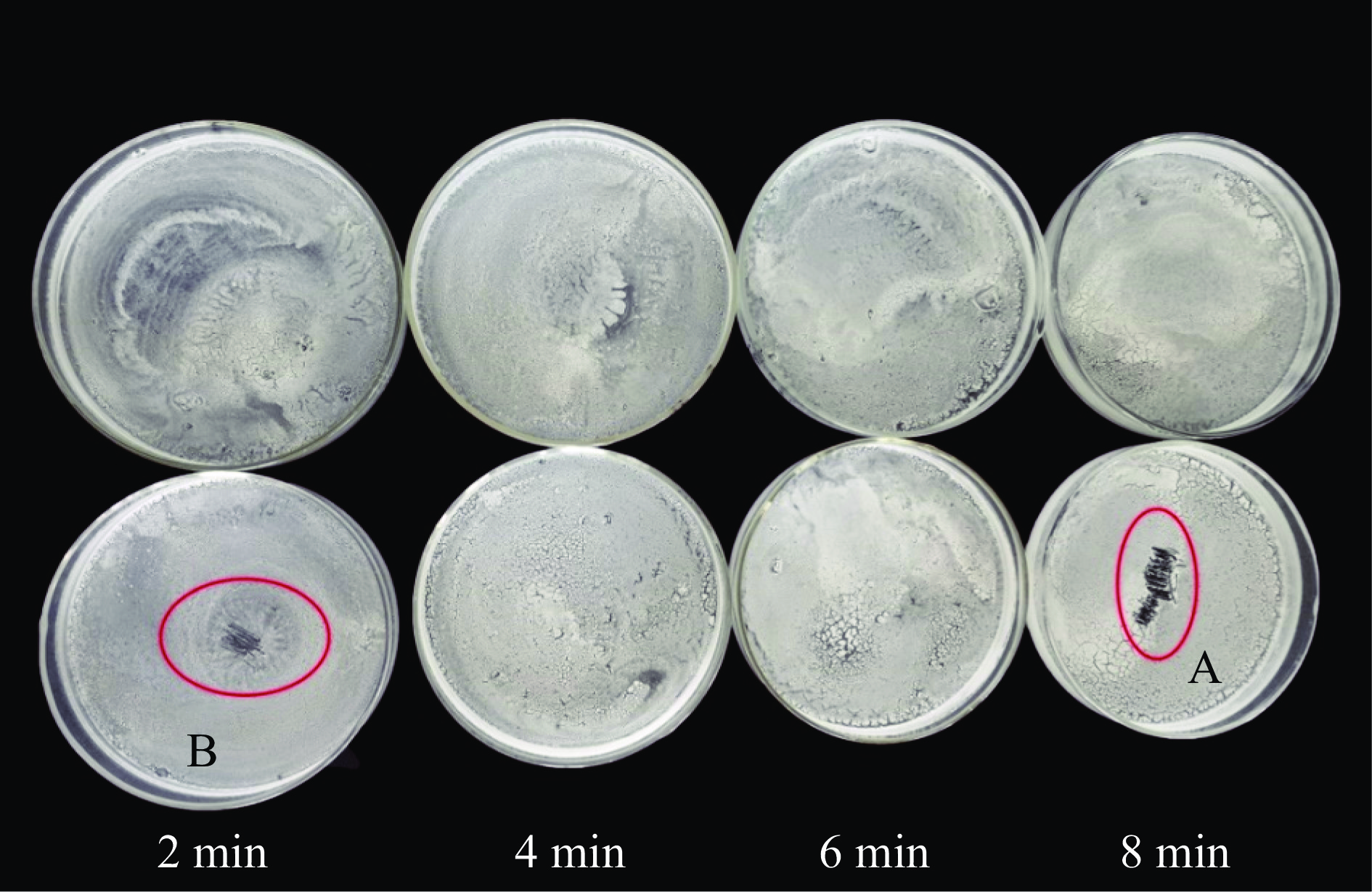
有机溶剂进行植物表皮蜡质提取时,为避免破坏植物表皮组织而提取出细胞内脂溶性物质,提取时间应适于植物自身而控制在一定的时间范围内[19]。故本试验根据预实验设置提取时间为2~10 min,考察其对蜡质提取量的影响。由图5可知,蜡质提取量随着提取时间的增加出现上升趋势,直至6 min后蜡质提取量趋于平稳状态,说明此时葡萄表皮蜡质基本被提取完全。尽管8 min时有最高蜡质提取量(38.15±0.85 mg/100 g),但与6、10 min时蜡质提取量之间无显著差异(P>0.05)。此外,也可通过图6发现,提取8 min时,器皿中有一层较厚的蜡质粉末(见图6 A处),而2 min时,器皿上含有的蜡质粉末较薄(见图6 B处),说明随着提取时间增大,器皿上的蜡质粉末量越多,即蜡质提取量越多。然而提取6和8 min得到的蜡质粉末量相差不明显,但明显多于2和4 min。因此,综合以上试验结果,可选6 min为最佳蜡质提取时间。
2.2 葡萄表皮蜡质提取条件的响应面试验结果及分析
2.2.1 响应面试验设计与结果
依据单因素实验,以表皮蜡质提取量Y(mg/100 g)为响应值,运用Design-Expert 8.0.6软件对溶剂混合比A(2:1、3:1、4:1 mL/mL)、液料比B(1.5:1、2:1、2.5:1,mL/g)、提取时间C(4、6、8 min)进行优化设计,设计及结果见表2。
表 2 响应面试验设计与结果Table 2. Designs and results of response surface experiments试验号 A B C Y蜡质提取量(mg/100 g) 1 0 −1 −1 27.2 2 0 0 0 38.8 3 0 0 0 40.5 4 0 0 0 37.3 5 1 −1 0 27.5 6 1 0 1 37.2 7 1 0 −1 32.0 8 0 −1 1 28.1 9 −1 0 1 30.2 10 0 1 1 43.3 11 1 1 0 36.0 12 0 1 −1 31.9 13 −1 0 −1 24.0 14 0 0 0 41.6 15 −1 1 0 31.4 16 0 0 0 39.9 17 −1 −1 0 23.7 2.2.2 响应面试验方差分析
由Design-Expert 8.0.6软件可得方差分析结果(见表3),并得蜡质提取量回归方程如下:
表 3 响应面回归模型方差分析Table 3. Response surface regression model variance analysis方差来源 平方和 自由度 平均方差 F值 P值 显著性 模型 607.17 9 67.46 26.11 0.0001 ** A 68.45 1 68.45 26.49 0.0013 ** B 162.90 1 162.90 63.05 <0.0001 ** C 70.21 1 70.21 27.18 0.0012 ** AB 0.16 1 0.16 0.062 0.8106 AC 0.25 1 0.25 0.097 0.7648 BC 27.56 1 27.56 10.67 0.0137 * A2 145.21 1 145.21 56.20 0.0001 ** B2 70.69 1 70.69 27.36 0.0012 ** C2 35.35 1 35.35 13.68 0.0077 ** 残差 18.09 7 2.58 失拟项 7.26 3 2.42 0.89 0.5175 误差 10.83 4 2.71 总和 625.26 16 R2=0.9711 R2Adj=0.9339 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 Y=39.62+2.93A+4.51B+2.96C+0.20AB−0.25AC+2.62BC−5.87A2−4.10B2−2.90C2
由表3可知,回归模型极显著(P<0.01),且失拟项不显著(P>0.05),说明该响应面模型构建合理,能够反映响应值(蜡质提取量)的变化。同时可知相关系数R2=0.9711,校正相关系数R2Adj=0.9339,说明构建的响应面模型能够准确预测蜡质提取条件与蜡质提取量之间的关系,且所选因素能够引起93.39%的蜡质提取量变化。综上可得本试验中响应面模型可信度较高,能够分析预测葡萄表皮蜡质提取工艺参数。
通过各因素的P值、F值,得出试验中溶剂混合比、液料比及提取时间分别对蜡质提取量有极显著影响(P<0.01),且影响程度为:B>C>A,即液料比>提取时间>溶剂混合比。此外,从模型方程的交互项(AB、AC、BC)可得出:料液比与提取时间的交互作用对蜡质提取量有显著影响(P<0.05);而料液比与溶剂混合比、提取时间与溶剂混合比的交互作用对蜡质提取量均无显著影响(P>0.05)。模型方程中二次项(A2、B2、C2)都对蜡质提取量有极显著影响(P<0.01)。
2.2.3 响应面图形分析
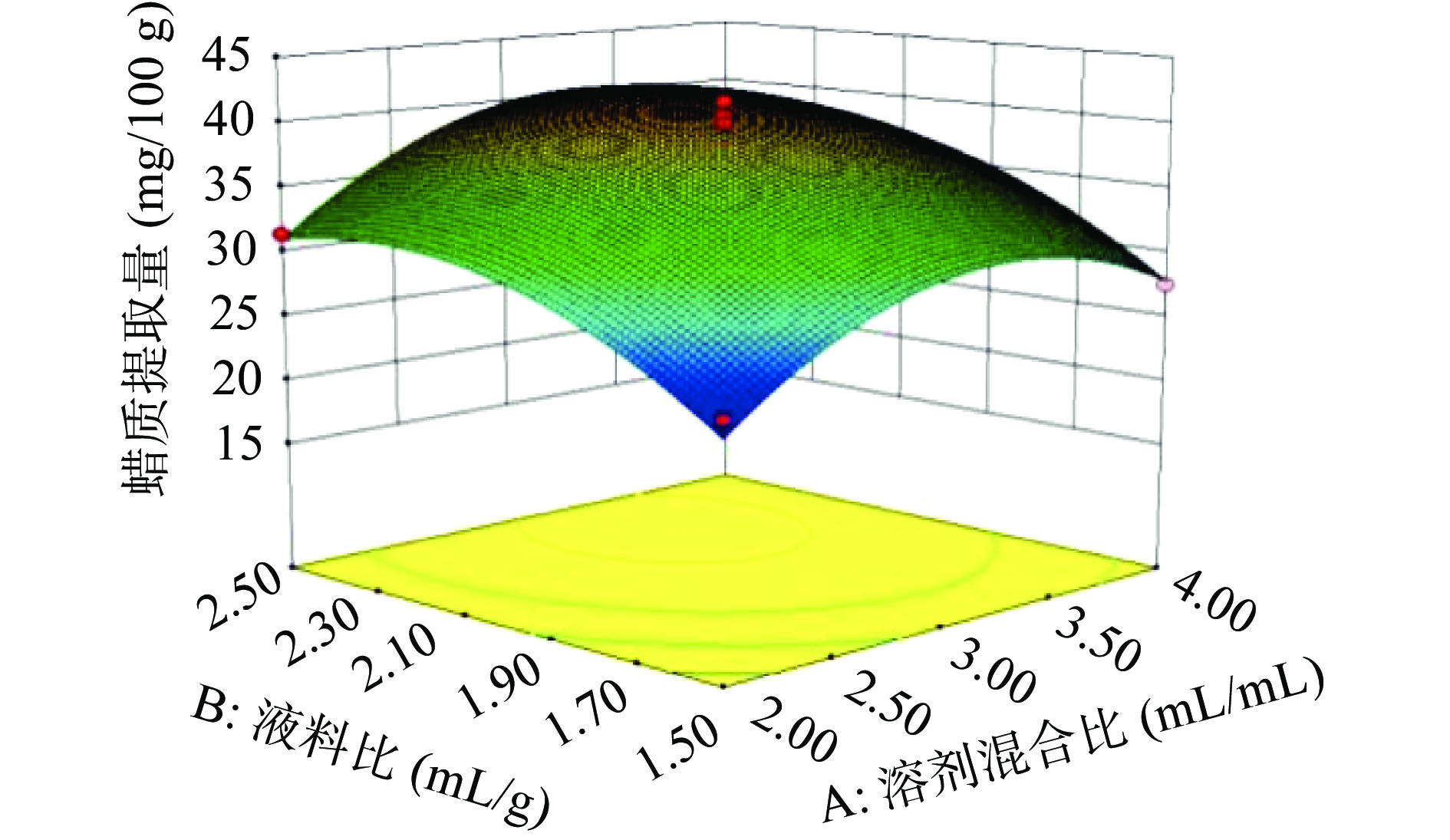
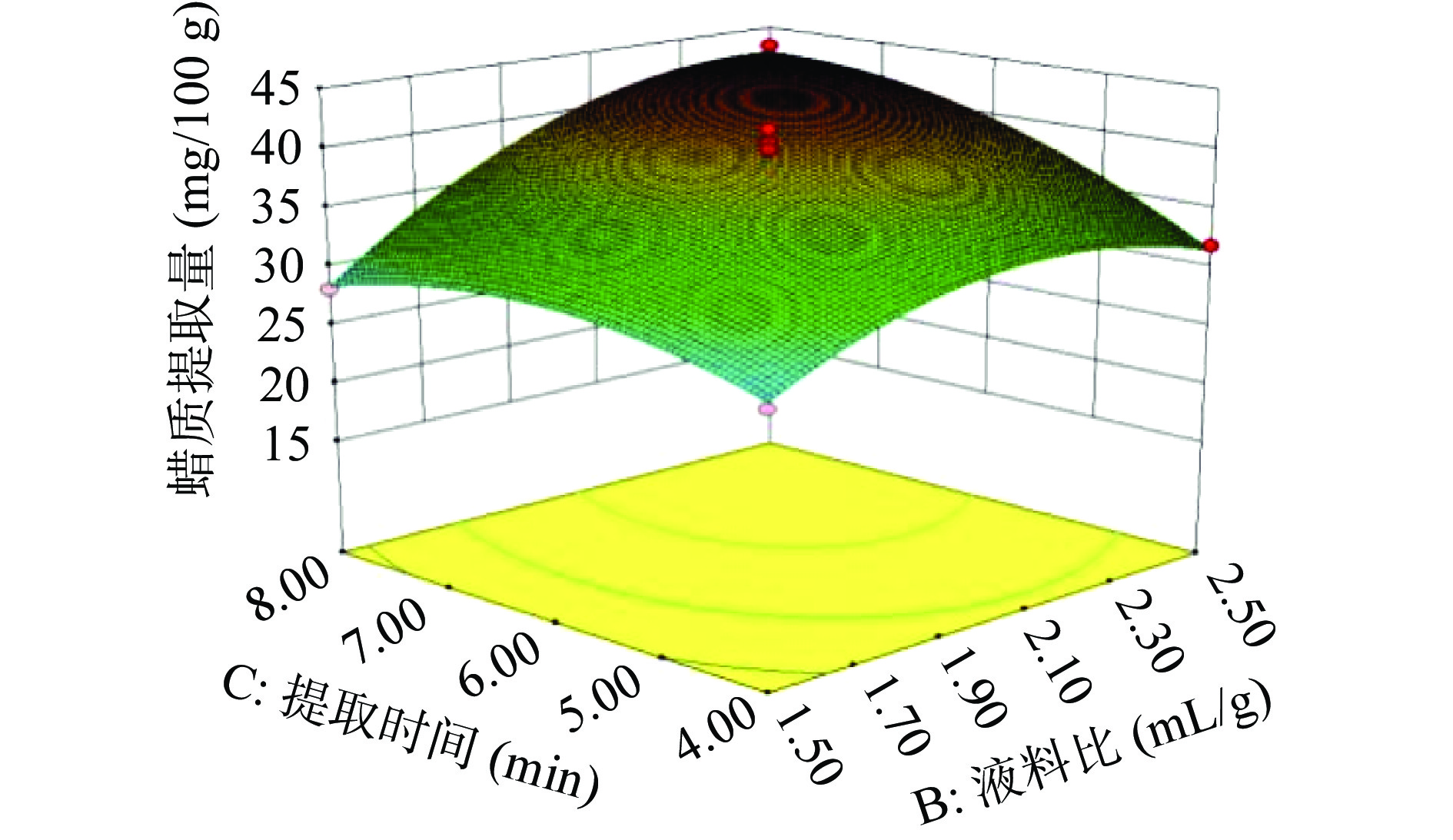
通过Design-Expert 8.0.6软件,可得各因素对蜡质提取量影响的响应面图(见图7~图9)。
响应面图可反映各因素对蜡质提取量的影响及各因素之间的交互效果[20]。响应面中3D曲面的陡峭程度可用于判定所选因素对蜡质提取量的影响,剖面越陡峭,说明该因素对蜡质提取量影响越大,反之剖面越平缓,该因素对蜡质提取量影响越小[21-22]。由试验中响应面3D曲面图可知,液料比的剖面最陡峭,其次是提取时间,溶剂混合比的坡面最平缓,说明三个因素对蜡质提取量的影响程度依次为:液料比>提取时间>溶剂混合。
两个因素的交互效果可通过等高线来评定:当等高线呈圆形时,两个因素的交互作用不显著;而呈鞍形时,两个因素的交互效果显著[23-24]。由响应面图中等高线可知,溶剂混合比与液料比、提取时间的等高线分别呈近似圆形和圆形,故溶剂混合比与液料比、提取时间的交互作用不显著,因而对蜡质提取量影响较小。液料比与提取时间的交互作用等高线呈明显的鞍形(见图9),故液料比和提取时间的交互作用显著,对蜡质提取量影响较大。以上结果与表3中方差分析的显著性差异一致。
2.2.4 响应面最佳提取条件及其验证
Design-Expert 8.0.6软件对响应面试验数据进行分析,可得最佳蜡质提取条件,其参数为:溶剂混合比3.24:1 mL/mL,液料比2.42:1 mL/g,提取时间7.76 min,预测蜡质提取量为43.1743 mg/100 g。根据实际试验的可操作性,简化提取条件参数为:溶剂混合比3:1 mL/mL,液料比2:1 mL/g,提取时间7.5 min。在此最佳蜡质提取条件下进行重复试验,得蜡质提取量为43.60±1.04 mg/100 g,与预测值的相对误差为0.98%,说明本研究构建的响应面模型合理。因此本研究中响应面优化所得蜡质提取条件可靠性高,可用于提取葡萄表皮蜡质。
2.3 木纳格葡萄表皮蜡质成分分析及讨论
2.3.1 木纳格葡萄表皮蜡质化学成分及其相对含量
GC-MS测得木纳格葡萄表皮蜡质化学成分如图10所示。该果实蜡质成分主要由脂肪酸、酯类、烃类、醛类、醇类、萜类及未分类物质组成,这与大部分关于水果(如苹果、亚洲梨、蓝莓、甜樱桃)表皮蜡质成分研究的结果相似[13-15,25]。木纳格葡萄蜡质成分中脂肪酸的含量最高,占总蜡质的58.06%,该成分也是高山越桔果实中主要的蜡质组分,占该果实总蜡质含量的54.8%[26]。木纳格葡萄蜡质中也检测到酯类(10.22%)、烃类(7.03%)、醛类(6.04%)和醇类(4.93%),这些脂肪族化合物的相对含量之间相差不大。除脂肪族化合物外,在木纳格葡萄蜡质中也检测到少量萜类,占总蜡质含量的3.24%,该成分也是植物表皮蜡质中常见的化合物。其他物质占总蜡质含量的10.48%,其大多由含氧环烷烃、酮类、2,6-二叔丁基对甲酚及1,4-二叔丁基苯组成。
2.3.2 木纳格葡萄表皮蜡质化学成分中主要物质相对含量
利用GC-MS,从木纳格葡萄表皮蜡质中共鉴定出61种化合物,其中脂肪酸、烃类各13种,醇类10种,酯类9种,醛类5种,萜类4种,其他化合物7种,各蜡质成分中主要物质及其占总蜡质含量如表4所示。
表 4 表皮蜡质化学成分中主要物质及含量Table 4. Main substance and content of chemical components of cuticular wax蜡质化合物 分子式 相对含量(%) 脂肪酸
(13种)饱和脂肪酸 Saturated fatty acids 十一酸 Undecanoic acid C11H22O2 0.79 十二酸(月桂酸) Lauric acid C12H24O2 0.38 十六酸(棕榈酸;软脂酸) Palmitic acid C16H32O2 8.82 十七酸 Margaric acid C17H34O2 0.09 十八酸(脂蜡酸;硬酯酸) Stearic acid C18H36O2 8.57 二十酸(花生酸) Arachidic acid C20H40O2 7.87 二十二酸(山嵛酸) Docosanoic acid C22H44O2 5.39 二十四酸(木蜡酸) Lignoceric acid C24H48O2 6.37 二十六酸(蜡酸) Cerotic acid C26H52O2 7.51 二十八酸(煤褐酸) Montanic acid C28H56O2 5.88 不饱和脂肪酸 Unsaturated fatty acids 顺式-9-十八碳烯酸(油酸) Oleic acid C18H34O2 4.12 9,12,15-十八碳三烯酸(亚油酸) Linoleic acid C18H32O2 2.12 顺-9-十六烯酸(棕榈油酸) Palmitoleic acid C16H30O2 0.21 烃类
(13种)烷烃 Alkanes 正十三烷 Tridecane C13H28 0.95 正十四烷 Tetradecane C14H30 0.22 正十五烷 Pentadecane C15H32 0.29 正十七烷 Heptadecane C17H36 1.19 正十九烷 Nonadecane C19H40 1.21 2,3,4-三甲基戊烷 Pentane, 2,3,4-trimethyl- C8H18 0.24 2-甲基二十四烷 Tetracosane, 2-methyl C25H52 0.27 6-甲基十三烷 Tridecane, 6-methyl- C14H30 0.59 3-乙基-3-甲基己烷 Hexane, 3-ethyl-3-methyl- C9H20 0.78 1,1-二甲基-2-戊基环丙烷 Cyclopropane,1,1-dimethyl-2-pentyl- C10H20 0.18 环十二烷 Cyclododecane C12H24 0.13 (1-辛基十二烷基)-环己烷 (1-octyldodecyl)-Cyclohexane C26H52 0.78 烯烃 Olefin 顺-5-十四烯 5-Tetradecene, (Z)- C14H28 0.20 醇类
(10种)十一醇 1-Undecanol C11H24O 0.30 二十一醇 1-Henicosanol C21H44O 0.29 2,2-二甲基辛醇 1-Octanol, 2,2-dimethyl- C10H22O 1.44 反式-2-癸烯-1-醇 2-Decen-1-ol, (E)- C10H20O 0.19 2-甲基-1-癸醇 1-Decanol, 2-methyl- C11H24O 0.21 2-己基-1-癸醇 1-Decanol, 2-hexyl- C16H34O 0.95 2-己基-1-辛醇 1-octanol, 2-Hexyl- C14H30O 0.38 2-辛基十二醇 2-Octyldodecan-1-ol C20H42O 0.79 2-(十八氧基)乙醇 2-(Octadecyloxy)ethanol C20H42O2 0.24 3,7,11,15-四甲基,1-十六烷基
-3-醇1-Hexadecyn-3-ol, 3,7,11,15-tetramethyl- C20H38O 0.13 酯类
(9种)邻苯二甲酸二甲酯 Dimethyl phthalate C10H10O4 1.89 邻苯二甲酸二丁酯 Dibutyl phthalate C16H22O4 3.07 邻苯二甲酸二辛酯 Dioctyl phthalate C24H38O4 1.14 甲基丙烯酸月桂酯 Lauryl methacrylate C16H30O2 0.13 9,10-亚甲基十六酸甲酯 Methyl 9,10-methylenehexadecanoate C18H34O2 0.49 12-甲基十四烷酸甲酯 Methyl 12-methyltetradecanoate C16H32O2 0.35 十七烷基乙酸酯 Heptadecyl acetate C19H38O2 0.66 3-(3,5-二叔丁基-4-羟基苯基)丙酸甲酯 Hydrocinnamic acid, 3,5-di-tert-butyl-4-hydroxy-, methylester C18H28O3 1.52 (Z)-油酸己酯 hexyl (Z)-oleate C24H46O2 0.95 醛类
(5种)十五醛 Pentadecanal C15H30O 3.93 棕榈醛二异戊基缩醛 Palmitaldehyde, diisopentyl acetal C26H54O2 1.47 壬醛二甲缩醛 Nonanal dimethyl acetal C11H24O2 0.35 13-甲基十四醛 13-Methyltetradecanal C15H30O 0.13 反式-2-壬醛 2-Nonenal, (E)- C9H16O 0.15 萜类
(4种)异长叶烯 Isolongifolene C15H24 1.10 2,5-二甲基-3-丙二醇-1-烯-2-基六-3,4-二烯-2-醇 3,4-Hexadien-2-ol,
3-isopropenyl-2,5-dimethyl-C11H18O 0.24 (1S,2S,3S,5R)-(+)-异松蒎醇 (+)-isopinocampheol C10H18O 0.12 α-2,5-三甲基苯丙烯酮 Acrylophenone, 2,2',5'-trimethyl- C12H14O 1.78 其他
(7种)1,2-环氧十八烷 Oxirane, hexadecyl- C18H36O 3.45 1-(乙烯基氧基)-癸烷 Decane, 1-(ethenyloxy)- C12H24O 0.19 1,1-二甲氧基癸烷 Decanal dimethyl acetal C12H26O2 0.26 2,6-二叔丁基对甲酚 Butylated Hydroxytoluene C15H24O 0.14 1,4-二叔丁基苯 1,4-Di-tert-butylbenzene C14H22 5.38 5-丙-1,2-二氧基庚烷-2-酮 2-Pentanone, 5-(1,2-propadienyloxy)- C8H12O2 0.29 3,4-环氧辛烷-2-酮 3,4-epoxyoctan-2-one C8H14O2 0.78 在木纳格葡萄表皮蜡质中,棕榈酸(C16:0)含量最高,其次是脂蜡酸(C18:0),相对含量分别为8.82%、8.57%,并且脂肪酸碳原子数表现出明显的偶数优势。在库尔勒香梨蜡质组分中也发现类似的现象:C16:0和C18:0是库尔勒香梨贮藏前含量最高的脂肪酸,且脂肪酸碳原子数以偶数为主[27]。高等植物原生质中脂肪酸碳原子数呈偶数特性,如遇菌类酶解,将会改变原有的奇偶特性[28]。由此可利用葡萄蜡质成分中脂肪酸碳原子数的奇偶特性来判定果实采后受病原菌的影响。木纳格葡萄中检测出3种不饱和脂肪酸,其中油酸(4.12%)和亚油酸(2.12%)含量较高,亚油酸在维持枇杷果实采后抗病性方面有着积极作用[29]。研究不饱和脂肪酸与果实抗病性的内在联系,可为进一步分析蜡质成分与葡萄采后品质关系提供借鉴。
在13种烃类化合物中,正十九烷(1.21%)、正十七烷(1.19%)及正十三烷(0.95%)含量较高,且烷烃碳原子数以奇数为主,这与高等植物原生质中烷烃碳原子数呈奇数特性的结论一致[30],在库尔勒香梨[7]和苹果[28]表皮蜡质中,烷烃的碳原子数也以奇数为主。高等植物原生质中烷烃碳原子数的奇数特性易受热作用、病原菌的影响[28,30],故可利用葡萄蜡质成分中烷烃碳原子数的奇数特性来了解蜡质与果实贮藏温度、抗病性的内在联系。除烷烃外,本试验检测到1种烯烃化合物,占总蜡质含量的0.20%。烃类化合物可有效保持果实水分,在苹果果实中C13烷烃和C14烷烃与果实失重率有相关关系[13],而木纳格葡萄蜡质中也检测到此类化合物。
本研究中醇类和酯类分别包含10种、9种蜡质化合物,但醇类相对含量(4.93%)要低于酯类(10.22%),醇类在蓝莓果实蜡质中含量也较小(3.2%)[15]。在醇类化合物中,2,2-二甲基辛醇含量最高,占总蜡质的1.44%。木纳格葡萄中酯类主要是C10~C24化合物,其中邻苯二甲酸二丁酯含量最高(3.07%),其次为邻苯二甲酸二甲酯(1.89%)。有研究证实醇类和酯类浓度增加有助于提高果实表面的光泽度与油腻感[31-32],本研究中这两类化合物含量相对较少,这或许是木纳格葡萄采后表面无油腻感的原因。
木纳格葡萄蜡质中检测到5种醛类,其中含量最高的是十五醛,其次是棕榈醛二异戊基缩醛,分别占总蜡质含量的3.93%和1.47%。醛类是植物蜡质中常见的组分,在蜜柑[33]果实表皮蜡质中,醛类为主要蜡质成分,且对该果实有保水作用。除脂肪族物质外,在检测到的4种萜类物质中,含量较高的是α-2,5-三甲基苯丙烯酮(1.78%)和异长叶烯(1.10%),另外两种萜烯醇分别占总蜡质含量的0.24%和0.12%。在木纳格葡萄蜡质中,醛类和萜类含量较低且检测到的种类较少,这可能是果实还未处于贮藏期,类似的现象也在有关10个苹果品种贮藏前后蜡质成分变化的研究中有所发现,醛类和萜类在9个苹果品种贮藏前的蜡质中并未检测到,但贮藏49 d后检测到部分醛类和萜类物质[13]。由此推测醛类和萜类或许在果实采后贮藏后期合成。
3. 结论
本研究通过选取4个因素(不同溶剂、溶剂混合比、液料比、提取时间)进行单因素实验及响应面优化实验,以此确定木纳格葡萄表皮蜡质的最佳提取工艺,同时利用GC-MS检测木纳格葡萄表皮蜡质成分及其含量。试验结果显示,表皮蜡质提取最佳条件为:溶剂混合比3:1 mL/mL,液料比2:1 mL/g,提取时间7.5 min。在此最优提取工艺下,得蜡质提取量为43.60±1.04 mg/100 g。表皮蜡质经GC-MS检测分析,共鉴定出61种蜡质化合物,包括脂肪酸、烃类各13种,醇类10种,酯类9种,醛类5种,萜类4种,未分类化合物7种,相对含量依次为58.06%、7.03%、4.93%、10.22%、6.04%、3.24%、10.48%,其中以脂肪酸为木纳格葡萄蜡质中主要组成成分,且该化合物碳原子数以偶数为主。因此,本研究确定的葡萄表皮蜡质的提取方法及其主要成分,为探索蜡质与果实耐贮性的关系奠定基础,也为今后开发合成蜡而延长果蔬贮藏期提供理论依据。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels of response surface experiments
水平 因素 A溶剂混合比(mL/mL) B液料比(mL/g) C提取时间(min) −1 2:1 1.5:1 4 0 3:1 2:1 6 1 4:1 2.5:1 8 表 2 响应面试验设计与结果
Table 2 Designs and results of response surface experiments
试验号 A B C Y蜡质提取量(mg/100 g) 1 0 −1 −1 27.2 2 0 0 0 38.8 3 0 0 0 40.5 4 0 0 0 37.3 5 1 −1 0 27.5 6 1 0 1 37.2 7 1 0 −1 32.0 8 0 −1 1 28.1 9 −1 0 1 30.2 10 0 1 1 43.3 11 1 1 0 36.0 12 0 1 −1 31.9 13 −1 0 −1 24.0 14 0 0 0 41.6 15 −1 1 0 31.4 16 0 0 0 39.9 17 −1 −1 0 23.7 表 3 响应面回归模型方差分析
Table 3 Response surface regression model variance analysis
方差来源 平方和 自由度 平均方差 F值 P值 显著性 模型 607.17 9 67.46 26.11 0.0001 ** A 68.45 1 68.45 26.49 0.0013 ** B 162.90 1 162.90 63.05 <0.0001 ** C 70.21 1 70.21 27.18 0.0012 ** AB 0.16 1 0.16 0.062 0.8106 AC 0.25 1 0.25 0.097 0.7648 BC 27.56 1 27.56 10.67 0.0137 * A2 145.21 1 145.21 56.20 0.0001 ** B2 70.69 1 70.69 27.36 0.0012 ** C2 35.35 1 35.35 13.68 0.0077 ** 残差 18.09 7 2.58 失拟项 7.26 3 2.42 0.89 0.5175 误差 10.83 4 2.71 总和 625.26 16 R2=0.9711 R2Adj=0.9339 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 表 4 表皮蜡质化学成分中主要物质及含量
Table 4 Main substance and content of chemical components of cuticular wax
蜡质化合物 分子式 相对含量(%) 脂肪酸
(13种)饱和脂肪酸 Saturated fatty acids 十一酸 Undecanoic acid C11H22O2 0.79 十二酸(月桂酸) Lauric acid C12H24O2 0.38 十六酸(棕榈酸;软脂酸) Palmitic acid C16H32O2 8.82 十七酸 Margaric acid C17H34O2 0.09 十八酸(脂蜡酸;硬酯酸) Stearic acid C18H36O2 8.57 二十酸(花生酸) Arachidic acid C20H40O2 7.87 二十二酸(山嵛酸) Docosanoic acid C22H44O2 5.39 二十四酸(木蜡酸) Lignoceric acid C24H48O2 6.37 二十六酸(蜡酸) Cerotic acid C26H52O2 7.51 二十八酸(煤褐酸) Montanic acid C28H56O2 5.88 不饱和脂肪酸 Unsaturated fatty acids 顺式-9-十八碳烯酸(油酸) Oleic acid C18H34O2 4.12 9,12,15-十八碳三烯酸(亚油酸) Linoleic acid C18H32O2 2.12 顺-9-十六烯酸(棕榈油酸) Palmitoleic acid C16H30O2 0.21 烃类
(13种)烷烃 Alkanes 正十三烷 Tridecane C13H28 0.95 正十四烷 Tetradecane C14H30 0.22 正十五烷 Pentadecane C15H32 0.29 正十七烷 Heptadecane C17H36 1.19 正十九烷 Nonadecane C19H40 1.21 2,3,4-三甲基戊烷 Pentane, 2,3,4-trimethyl- C8H18 0.24 2-甲基二十四烷 Tetracosane, 2-methyl C25H52 0.27 6-甲基十三烷 Tridecane, 6-methyl- C14H30 0.59 3-乙基-3-甲基己烷 Hexane, 3-ethyl-3-methyl- C9H20 0.78 1,1-二甲基-2-戊基环丙烷 Cyclopropane,1,1-dimethyl-2-pentyl- C10H20 0.18 环十二烷 Cyclododecane C12H24 0.13 (1-辛基十二烷基)-环己烷 (1-octyldodecyl)-Cyclohexane C26H52 0.78 烯烃 Olefin 顺-5-十四烯 5-Tetradecene, (Z)- C14H28 0.20 醇类
(10种)十一醇 1-Undecanol C11H24O 0.30 二十一醇 1-Henicosanol C21H44O 0.29 2,2-二甲基辛醇 1-Octanol, 2,2-dimethyl- C10H22O 1.44 反式-2-癸烯-1-醇 2-Decen-1-ol, (E)- C10H20O 0.19 2-甲基-1-癸醇 1-Decanol, 2-methyl- C11H24O 0.21 2-己基-1-癸醇 1-Decanol, 2-hexyl- C16H34O 0.95 2-己基-1-辛醇 1-octanol, 2-Hexyl- C14H30O 0.38 2-辛基十二醇 2-Octyldodecan-1-ol C20H42O 0.79 2-(十八氧基)乙醇 2-(Octadecyloxy)ethanol C20H42O2 0.24 3,7,11,15-四甲基,1-十六烷基
-3-醇1-Hexadecyn-3-ol, 3,7,11,15-tetramethyl- C20H38O 0.13 酯类
(9种)邻苯二甲酸二甲酯 Dimethyl phthalate C10H10O4 1.89 邻苯二甲酸二丁酯 Dibutyl phthalate C16H22O4 3.07 邻苯二甲酸二辛酯 Dioctyl phthalate C24H38O4 1.14 甲基丙烯酸月桂酯 Lauryl methacrylate C16H30O2 0.13 9,10-亚甲基十六酸甲酯 Methyl 9,10-methylenehexadecanoate C18H34O2 0.49 12-甲基十四烷酸甲酯 Methyl 12-methyltetradecanoate C16H32O2 0.35 十七烷基乙酸酯 Heptadecyl acetate C19H38O2 0.66 3-(3,5-二叔丁基-4-羟基苯基)丙酸甲酯 Hydrocinnamic acid, 3,5-di-tert-butyl-4-hydroxy-, methylester C18H28O3 1.52 (Z)-油酸己酯 hexyl (Z)-oleate C24H46O2 0.95 醛类
(5种)十五醛 Pentadecanal C15H30O 3.93 棕榈醛二异戊基缩醛 Palmitaldehyde, diisopentyl acetal C26H54O2 1.47 壬醛二甲缩醛 Nonanal dimethyl acetal C11H24O2 0.35 13-甲基十四醛 13-Methyltetradecanal C15H30O 0.13 反式-2-壬醛 2-Nonenal, (E)- C9H16O 0.15 萜类
(4种)异长叶烯 Isolongifolene C15H24 1.10 2,5-二甲基-3-丙二醇-1-烯-2-基六-3,4-二烯-2-醇 3,4-Hexadien-2-ol,
3-isopropenyl-2,5-dimethyl-C11H18O 0.24 (1S,2S,3S,5R)-(+)-异松蒎醇 (+)-isopinocampheol C10H18O 0.12 α-2,5-三甲基苯丙烯酮 Acrylophenone, 2,2',5'-trimethyl- C12H14O 1.78 其他
(7种)1,2-环氧十八烷 Oxirane, hexadecyl- C18H36O 3.45 1-(乙烯基氧基)-癸烷 Decane, 1-(ethenyloxy)- C12H24O 0.19 1,1-二甲氧基癸烷 Decanal dimethyl acetal C12H26O2 0.26 2,6-二叔丁基对甲酚 Butylated Hydroxytoluene C15H24O 0.14 1,4-二叔丁基苯 1,4-Di-tert-butylbenzene C14H22 5.38 5-丙-1,2-二氧基庚烷-2-酮 2-Pentanone, 5-(1,2-propadienyloxy)- C8H12O2 0.29 3,4-环氧辛烷-2-酮 3,4-epoxyoctan-2-one C8H14O2 0.78 -
[1] 马骏, 杨小玲, 李春媛, 等. 不同保鲜方法对新疆木纳格葡萄贮藏效果的影响[J]. 保鲜与加工,2013,13(3):24−27. [MA J, YANG X L, LI C Y, et al. Study of different preservation methods on the preservation effects of Munage grapes[J]. Storage and Process,2013,13(3):24−27. doi: 10.3969/j.issn.1009-6221.2013.03.006 [2] 唐怡, 杨红, 李文婷, 等. 1-MCP对木纳格葡萄的保鲜效果[J]. 食品工业科技,2018,39(5):301−306. [TANG Y, YANG H, LI W T, et al. The preservation effect of 1-MCP on Munage grape fruit[J]. Science and Technology of Food Industry,2018,39(5):301−306. doi: 10.13386/j.issn1002-0306.2018.05.056 [3] ISABEI L, BURCU B, LUIS F G. A focus on the biosynthesis and composition of cuticle in fruits[J]. Journal of Agricultural and Food Chemistry,2015,63(16):4005−4019. doi: 10.1021/acs.jafc.5b00013
[4] YIN Y, BI Y, CHEN S J, et al. Chemical composition and antifungal activity of cuticular wax isolated from Asian pear fruit (cv. Pingguoli)[J]. Scientia Horticulturae,2011,129(4):577−582. doi: 10.1016/j.scienta.2011.04.028
[5] JIANG B, LIU R L, FANG X J, et al. Effects of salicylic acid treatment on fruit quality and wax composition of blueberry (Vaccinium virgatum Ait)[J]. Food Chemistry,2022,368:130757. doi: 10.1016/j.foodchem.2021.130757
[6] 方子义, 赵世萍, 宋晓惜, 等. 氯仿法提取蜡梅花被片表层蜡质的研究[J]. 北方园艺,2013(23):96−99. [FANG Z Y, ZHAO S P, SONG X X, et al. Study on the extraction of waxy from the tepals surface of chimonanthus by chloroforme[J]. Northern Horticulture,2013(23):96−99. [7] 李珍慈, 江英, 秦婕, 等. 库尔勒香梨表皮蜡质提取条件研究及成分分析[J]. 中国酿造,2016,35(4):158−162. [LI Z C, JIANG Y, QIN J, et al. Extraction conditions and component analysis of epicuticular wax of Korla fragrant pears[J]. China Brewing,2016,35(4):158−162. doi: 10.11882/j.issn.0254-5071.2016.04.035 [8] 陈剑婷, 吴坤胜, 周磊磊, 等. 苹果果实角质层提取及分析方法的优化[J]. 中国农学通报,2017,33(16):53−58. [CHEN J, WU K S, ZHOU L L, et al. Optimization of extraction and analysis method of apple fruit cuticle[J]. Chinese Agricultural Science Bulletin,2017,33(16):53−58. doi: 10.11924/j.issn.1000-6850.casb16060019 [9] 周小云, 陈信波, 徐向丽, 等. 稻叶表皮蜡质提取方法及含量的比较[J]. 湖南农业大学学报(自然科学版),2007(3):273−276. [ZHOU X Y, CHEN X B, XU X L, et al. On comparison of extraction methods of epicuticular wax and content of rice leaves[J]. Journal of Hunan Agricultural University (Natural Sciences),2007(3):273−276. doi: 10.13331/j.cnki.jhau.2007.03.005 [10] 郭焰, 董成虎, 白羽嘉, 等. 玫瑰花蜡质提取工艺的研究[J]. 保鲜与加工,2012,12(3):34−37. [GUO Y, DONG C H, BAI Y J, et al. Study on the extraction technology of rose wax[J]. Storage and Process,2012,12(3):34−37. doi: 10.3969/j.issn.1009-6221.2012.03.008 [11] 杨爱梅, 吴古飞, 杜静, 等. 枸杞表皮蜡质层成分及显微结构的研究[J]. 食品工业科技,2011,32(12):112−114. [YANG A M, WU G F, DU J, et al. Study on component and microscopic structure of wax of Lycium barbarum L[J]. Science and Technology of Food Industry,2011,32(12):112−114. doi: 10.13386/j.issn1002-0306.2011.12.035 [12] ISABEI L, BURCU B, LUIS F G. The fruit cuticle as a modulator of postharvest quality[J]. Postharvest Biology & Technology,2014,87:103−112.
[13] CHAI Y, LI A, SU C W, et al. Cuticular wax composition changes of 10 apple cultivars during postharvest storage[J]. Food Chemistry,2020,324:126903. doi: 10.1016/j.foodchem.2020.126903
[14] WU X, YIN H, CHEN Y Y, et al. Chemical composition, crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J]. Postharvest Biology and Technology,2017,32:71−80.
[15] CHU W J, GAO H Y, CAO S F, et al. Composition and morphology of cuticular wax in blueberry (Vaccinium spp. ) fruits[J]. Food Chemistry,2017,219:436−442. doi: 10.1016/j.foodchem.2016.09.186
[16] PT A, NN A, LK B, et al. Analysis of composition, morphology, and biosynthesis of cuticular wax in wild type bilberry ( Vaccinium myrtillus L. ) and its glossy mutant[J]. Food Chemistry,2021,354:129517. doi: 10.1016/j.foodchem.2021.129517
[17] 王月. 不同温湿度条件下香梨蜡质的变化及与耐贮性关系的研究[D]. 石河子: 石河子大学, 2021. WANG Y. Changes in cuticular wax of Korla pear under different temperature and humidity storage and its relationship with storability[D]. Shihezi: Shihezi University, 2021.
[18] 李述刚, 白露, 陆健康, 等. 南疆灰枣果皮蜡质成分初探[J]. 食品研究与开发,2014,35(2):113−116. [LI S G, BAI L, LU J K, et al. Jujube skin wax ingredients of extraction and analysis[J]. Food Research and Development,2014,35(2):113−116. doi: 10.3969/j.issn.1005-6521.2014.02.029 [19] 李珍慈. 库尔勒香梨表皮蜡质成分分析及其在贮藏中的影响研究[D]. 石河子: 石河子大学, 2016. LI Z C. Study on the component analysis of Korla fragrant pear epicuticular wax and its influence on storage quality of pear fruit[D]. Shihezi: Shihezi University, 2016.
[20] 冯颖, 张萍萍, 赵存朝, 等. 响应面优化百香果果皮果脯制备工艺[J]. 食品工业科技,2022,43(17):275−282. [FENG Y, ZHANG P P, ZHAO C C, et al. Optimization of preparation technology of passion fruit peel and preserved fruit by response surface methodology[J]. Science and Technology of Food Industry,2022,43(17):275−282. [21] 李瑞丽, 张玎婕, 赵琪, 等. 响应面法优化超声辅助浸提葡萄籽原花青素[J]. 食品研究与开发,2021,42(15):53−60. [LI R L, ZHANG D J, ZHAO Q, et al. Optimization of ultrasonic assisted extraction of procyanidins from grape seeds based on response surface method[J]. Food Research and Development,2021,42(15):53−60. doi: 10.12161/j.issn.1005-6521.2021.15.009 [22] 牛生洋, 王凤轩, 张晓利, 等. 响应面法优化刺葡萄果实花旗松素提取工艺[J]. 食品工业科技,2022,43(18):170−176. [NIU S Y, WANG F X, ZHANG X L, et al. Optimization of extraction technology of taxifolin from fruit of Vitis davidii by response surface methodology[J]. Science and Technology of Food Industry,2022,43(18):170−176. doi: 10.13386/j.issn1002-0306.2021110149 [23] 贾金辉, 柴虹宇, 程贵兰, 等. 响应面法优化刺五加果酒的酿造工艺[J]. 食品研究与开发,2022,43(4):136−142. [JIA J H, CHAI H Y, CHENG G L, et al. Optimization of fermentation technology of Acanthopanax senticosus wine by response surface methodology[J]. Food Research and Development,2022,43(4):136−142. doi: 10.12161/j.issn.1005-6521.2022.04.020 [24] 许木果, 徐通, 杨朴丽, 等. 响应面法优化超声辅助提取诺丽果生物碱的工艺研究[J]. 食品研究与开发,2021,42(13):84−90. [XU M G, XU T, YANG P L, et al. Optimization of ultrasonic-assist extraction of alkaloids from the fruits of Morinda citrifolia (noni) by response surface methodology[J]. Food Research and Development,2021,42(13):84−90. doi: 10.12161/j.issn.1005-6521.2021.13.013 [25] PESCHEL S, FRANKE R, SCHREIBER L, et al. Composition of the cuticle of developing sweet cherry fruit[J]. Phytochemistry,2007,68(7):1017−1025. doi: 10.1016/j.phytochem.2007.01.008
[26] TRIVEDI P, KARPPINEN K, KLAVINS L, et al. Compositional and morphological analyses of wax in northern wild berry species[J]. Food Chemistry,2019,295(OCT.15):441−448.
[27] WANG Y, MAO H J, LÜ Y H, et al. Comparative analysis of total wax content, chemical composition and crystal morphology of cuticular wax in Korla pear under different relative humidity of storage[J]. Food Chemistry,2021,338:128025. doi: 10.1016/j.foodchem.2020.128025
[28] 杨艳青, 陈柏, 王晓飞, 等. 苹果果皮蜡质组分的GC-MS分析[J]. 西北农业学报,2014,23(5):104−112. [YANG Y Q, CHEN B, WANG X F, et al. GC-MS detection of epicuticular wax in apple fruits[J]. Acta Agriculture Boreali-occidentalis Sinica,2014,23(5):104−112. doi: 10.7606/j.issn.1004-1389.2014.05.017 [29] CAO S, YANG Z, CAI Y, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry,2011,127(4):1777−1783. doi: 10.1016/j.foodchem.2011.02.059
[30] 孙敏卓, 孟仟祥, 房嬛, 等. 不同溶剂抽提冷杉脂溶性物质的GC/MS分析[J]. 质谱学报,2011,32(4):222−228. [SUN M Z, MENG Q X, FANG X, et al. Component analysis of lipid soluble substances extracted by different solvents from fir by GC/MS[J]. Journal of Chinese Mass Spectrometry Society,2011,32(4):222−228. [31] DONG X Q, RAO J P, HUBER D J, et al. Wax composition of 'Red Fuji' apple fruit during development and during storage after 1-methylcyclopropene treatment[J]. Horticulture, Environment, and Biotechnology,2012,53(4):288−297. doi: 10.1007/s13580-012-0036-0
[32] ZHANG Q, QI Y, LI R, et al. Postharvest applications of N-butanol increase greasiness in apple skins by altering wax composition via effects on gene expression[J]. Postharvest Biology and Technology,2019,155:111−119. doi: 10.1016/j.postharvbio.2019.05.017
[33] WANG J Q, HAO H H, LIU R S, et al. Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and ‘Newhall’ navel orange (Citrus sinensis) from the perspective of crystal morphology, chemical composition and key gene expression[J]. Food Chemistry,2014,153:177−185. doi: 10.1016/j.foodchem.2013.12.021
-
期刊类型引用(1)
1. 李越,池慧兵,牛家峰,马斌,周慧敏,朱萍,吕凤霞. 基于定向进化技术提高呕吐毒素解毒酶DepA的催化活性. 南京农业大学学报. 2024(04): 750-759 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:



 下载:
下载:



