Secretion Expression of Xylanase B (CsXyn11B) from Chaetomium sp. and Its Application in Bread
-
摘要: 目的:对毛壳霉(Chaetomium sp.)CQ31木聚糖酶B(CsXyn11B)进行分泌表达,以提高产酶水平并探究在面包烘焙中的应用价值。方法:将木聚糖酶基因在毕赤酵母中表达,高密度发酵提高其产酶水平,对酶学性质进行表征并将其应用在面包烘焙中。结果:重组菌经高密度发酵156 h,木聚糖酶酶活力为2788 U/mL。CsXyn11B最适pH为8.0,最适温度为65 ℃。CsXyn11B能够水解多种木聚糖底物,对燕麦木聚糖、小麦阿拉伯木聚糖、榉木木聚糖和桦木木聚糖的比酶活分别为1145.8、1041.7、692.3和653.3 U/mg。该酶水解阿拉伯木聚糖,水解产物以聚合度4~6的低聚木糖为主。在面包制作过程中加入3 mg/kg CsXyn11B使面包比容增加15.9%,面包硬度降低25.3%,4 ℃贮藏2 d后硬度比对照组降低17%。结论:毛壳霉木聚糖酶B的优良酶学特性使其在烘焙食品中具有良好的应用前景。Abstract: Objective: A xylanase B (CsXyn11B) gene from Chaetomium sp. CQ31 was extracellularly expressed to improve the enzyme production and explore its application in bread baking. Methods: The xylanase (CsXyn11B) gene was expressed in Pichia pastoris, and the enzyme production was improved by high-density fermentation. The enzymae was characterized and applied in bread baking. Results: The recombinant strain was fermented at high density for 156 h, and the enzyme activity of xylanase was 2788 U/mL. The optimal pH of CsXyn11B was pH8.0, and the optimal temperature was 65 ℃. CsXyn11B hydrolyzed a variety of xylans, and the specific enzymatic activities of oat xylan, wheat arabinoxylan, beech xylan and birch xylan were 1145.8, 1041.7, 692.3 and 653.3 U/mg, respectively. The enzyme hydrolyzed arabinoxylan, and the hydrolyzed product were mainly xylo-oligosaccharides with a degree of polymerization of 4~6. Addition of CsXyn11B (3 mg/kg) into the bread making remarkably improved the specific volume by 15.9% and decreased the hardness by 25.3%. Compared with the control group, the hardness decreased by 17% after storage at 4 ℃ for 2 d. Conclusion: The excellent properties of xylanase B from Chaetomium sp. made it have a promising application prospect in baked food.
-
Keywords:
- Chaetomium sp. /
- xylanase /
- Pichia pastoris /
- high cell-density fermentation /
- bread
-
木聚糖酶(β-1,4-xylanase,EC 3.2.1.8)是木聚糖降解酶系中最重要的一种,以内切的方式随机水解木聚糖主链上的β-1,4-糖苷键,广泛的应用于低聚木糖生产、面制品、麦芽糖化和果汁澄清等食品领域[1]。微生物天然发酵产木聚糖酶活力较低,纯化步骤复杂,不能满足工业生产。利用基因工程手段将木聚糖酶进行基因克隆和异源表达能够提高木聚糖酶活力[2]。毕赤酵母是一种甲醇营养型酵母,内无天然质粒,外源木聚糖酶基因通过载体与毕赤酵母染色体同源重组形成稳定的转化子,实现外源基因表达。该表达系统具有菌体繁殖快,分泌表达水平高且适用于高密度发酵等特点[3]。目前已有多种木聚糖酶基因在毕赤酵母中成功分泌表达,如嗜热单胞菌(Thermobifida fusca)YX木聚糖酶rXyn11A的产酶表达水平为1157.6 U/mL[4],双孢霉(Bispora sp. MEY-1)木聚糖酶产酶表达水平为73400 U/mL,这也是迄今文献中报道木聚糖酶的最高表达水平[5]。
木聚糖酶的最适pH、最适温度、底物特异性和水解特性等性质的不同决定了它们适用于不同食品领域。小麦面粉作为面制品的主要原料之一,其中含有2%~4%的阿拉伯木聚糖[6]。阿拉伯木聚糖分为水溶性阿拉伯木聚糖(Water extractable arabinoxylan,WEAX)和水不溶性阿拉伯木聚糖(Water unextractable arabinoxylan,WUAX),其中WUAX的含量约为70%~75%,在面包制作过程中会干扰面筋网络的形成,导致面包体积变小,质地、口感变差[7]。在面包制作中添加木聚糖酶能够改善面包品质,对小麦阿拉伯木聚糖(Wheat arabinoxylan,WAX)特异性降解能力强的木聚糖酶可以将部分WUAX水解成WEAX,能够增加面团的延展性和弹性。当二者比例适当时能够与其他组分发生氧化凝胶作用,增强面团持水性。最终面包的比容增大,硬度降低,相同时间下面包老化缓慢[8]。已有研究中,木聚糖酶对WAX的底物特异性普遍较低,如黑曲霉(Aspergillus niger)BCC14405木聚糖酶(169 U/mg)[9]、丙酸帕卢迪杆菌(Paludibacter propionicigenes)木聚糖酶(181 U/mg)[10]和虫草属(Talaromyces leycettanus)木聚糖酶(3.5 U/mg)[11]。发掘对WAX具有高底物特异性的木聚糖酶对烘焙行业具有重要意义。
本实验室前期在土壤中分离鉴定得到一株具有高木质纤维素分解能力的嗜热丝状真菌毛壳霉CQ31,从中发掘出一个对阿拉伯木聚糖具有较高比酶活的GH11家族木聚糖酶CsXyn11B[12]。本研究对该基因进行密码子优化,在毕赤酵母中分泌表达,提高其木聚糖酶表达量。该基因对阿拉伯木聚糖的比酶活大幅提高,能够高效水解食品原料中的阿拉伯木聚糖,提高食品品质,进一步评价其在面包烘焙中的潜在应用。
1. 材料与方法
1.1 材料与仪器
毛壳霉 由本实验室筛选并保藏;毕赤酵母GS115 购自北京全式金生物科技有限公司,载体pPIC9K购自美国Invitrogen;榉木木聚糖、桦木木聚糖、燕麦木聚糖、小麦阿拉伯木聚糖 美国Sigma公司;除特殊说明外,本实验所用化学试剂均为分析级试剂。
AKTA蛋白纯化系统 美国Mettler Toledo公司;Sun-Mate醒发箱、电烤箱和模具烤盘 江苏三麦食品机械有限公司;质构仪 英国Stable Micro Systems有限公司。
1.2 实验方法
1.2.1 木聚糖酶基因的克隆与表达
利用在线软件SignalP4.1( http://www. cbs.dtu. dk/services/signalP)分析毛壳霉CQ31木聚糖酶B(CsXyn11B)信号肽编码序列。采用ExPASy ProtParam tool(http://web.expasy.org/protparam/)预测蛋白质分子量和等电点,使用DNAWorks对该基因密码子优化。根据密码子优化后的重组CsXyn11B基因序列,设计上游引物CsXyn11BUP(5' CCGGAATTCCGTCCATTCGATTTTTTGGACG 3')和下游引物CsXyn11BDN(5' ATAAGAATGCGGCCGCTCAGTGGGTCTGCACGTAGATGTC 3')。PCR扩增产物经EcoRI和NotI双酶切后与载体pPIC9K连接,得到重组质粒pPIC9K-CsXyn11B,经限制性内切酶SalI线性化,电转化得到毕赤酵母感受态细胞。
电转化液体涂布于MD平板培养基上,30 ℃下培养3 d后洗脱、重悬。涂于含有不同质量浓度G418(0.5~4.0 mg/mL)的YPD-G418平板培养基上。30 ℃下培养2~5 d。挑取单菌落于BMGY培养基30 ℃、200 r/min下培养1 d。吸取菌液于BMMY培养基中,30 ℃、200 r/min诱导3 d,每24 h加入0.5%甲醇(v/v)。诱导3 d后测定木聚糖酶活力,筛选产木聚糖酶活力最高的转化子。
1.2.2 高密度发酵产毛壳霉木聚糖酶B(CsXyn11B)
参照毕赤酵母发酵手册(VersionB,053002,Invitrogen)将菌液接种于150 mL YPD培养基中,30 ℃、200 r/min培养至OD600为10.0左右。发酵罐中加入1.5 L BSM发酵培养基灭菌,种子液中加入6.6 mL痕盐溶液,利用浓氨水调节pH至4.0后加入种子液。于转速600 r/min、通气量1.0 vvm下发酵24 h至甘油耗尽。向发酵罐中流加甘油,直至菌体湿重达到180~220 g/L之间。饥饿30 min后,调节pH至6.0、转速800 r/min。流加甲醇诱导产酶,保持DO>20%。发酵过程中每隔12 h取样测定菌体湿重、蛋白质含量和木聚糖酶活力。
1.2.3 木聚糖酶CsXyn11B的纯化
粗酶液离心后收集上清液,在20 mmol/L pH8.0 Tris-HCl缓冲液中透析,然后以0.5 mL/min流速上样至Q-Sepharose FF层析柱。采用快速蛋白液相色谱系统进行纯化,以含有0~500 mmol/L NaCl的缓冲液(20 mmol/L pH8.0 Tris-HCl)线性洗脱10个柱体积,流速为1 mL/min,收集具有木聚糖酶活力的洗脱液。收集液在20 mmol/L pH8.0 Tris-HCl缓冲液中4 ℃透析过夜,SDS-PAGE验证木聚糖酶的纯度,SDS-PAGE电泳方法参照Laemmli进行[13]。
1.2.4 木聚糖酶的活力和蛋白质含量测定
木聚糖酶的活力测定采用DNS法[14]。在900 μL(1%,w/v)榉木木聚糖底物中加入100 μL 50 mmol/L Tris-HCl缓冲液(pH8.0)稀释后的酶液,65 ℃反应10 min,加1 mL DNS终止反应。沸水加热15 min,加1 mL 40%酒石酸钾钠,冷却后在540 nm下测吸光值。木聚糖酶的活力定义:在以上反应条件下每分钟生成1 μmol木糖所需要的酶量为1个酶活力单位。
蛋白含量测定:参照Lowry等[15]方法测定,以牛血清蛋白为标准蛋白,福林酚甲A液和福林酚甲B液按50:1混合,100 μL酶液适当稀释后添加于1 mL福林酚甲混合液中。轻微振荡后室温静置10 min,加入100 μL福林酚乙液,振荡后于37 ℃保温30 min后在OD650处测定吸光度值计算蛋白含量。
1.2.5 CsXyn11B的最适pH和最适温度
最适pH的测定:采用50 mmol/L pH3.0~10.0范围内的不同缓冲液,按标准的方法于65 ℃下测定木聚糖酶活力,以最大值为100%,计算各pH下的相对酶活力。
最适温度的测定:在45~80 ℃范围内,在50 mmol/L Tris-HCl缓冲液(pH8.0)中按标准的方法测定木聚糖酶活力,以最大值为100%,计算各温度下的相对酶活力。
1.2.6 CsXyn11B的底物特异性与水解特性分析
配制不同木聚糖底物(1%,w/v),按1.2.4中描述的方法测定酶活力。以CsXyn11B对榉木木聚糖的比酶活力为100%,计算不同聚糖底物下CsXyn11B的比酶活力和相对酶活力。木聚糖底物包括:桦木木聚糖、榉木木聚糖、燕麦木聚糖和阿拉伯木聚糖。
用50 mmol/L Tris-HCl缓冲液(pH8.0)配制榉木木聚糖溶液和阿拉伯木聚糖溶液(1%,w/v)。60 ℃下,加入CsXyn11B(5 U/mL)水解,定时取样后沸水中灭活3 min。冷却离心取上清液,以木糖和低聚木糖作为对照进行薄层层析(TLC)分析,展层剂为正丁醇、冰醋酸和水的混合溶液(体积比为2:1:1),显色剂为甲醇与浓硫酸的混合液(体积比为95:5)。
1.2.7 CsXyn11B在面包中的应用
面包制作方法:500 g面粉,6 g酵母,5 g盐,50 g白糖,290 g水与纯化后的木聚糖酶CsXyn11B(1~5 ppm)混匀,以不加木聚糖酶的面包为对照组。低速和面2 min,高速3 min,加入4%黄油后低速和面2 min,高速3 min,静置5 min。分割(150 g/个)滚圆再静置15 min后整形、装盘。于38 ℃,80%相对湿度,醒发90 min。醒发好的面坯于面火180 ℃,底火200 ℃,烘烤20 min。烘烤结束后,将面包放在室温冷却2 h后装入保鲜袋密封。
通过油菜籽置换法测定其体积,计算面包的比容。将面包切成厚度为20 mm的薄片,采用质构仪测定面包芯的硬度。测试速度1 mm/s,压缩程度40%,感应力0.5 N。通过测定烘焙当天面包硬度和4 ℃冰箱贮藏2 d后面包硬度观察木聚糖酶CsXyn11B对面包老化的作用。
1.3 数据处理
数据统计和图片处理均采用Origin 8.0进行,数据均为3次平行。
2. 结果与分析
2.1 毛壳霉木聚糖酶B(CsXyn11B)的基因克隆和分泌表达
毛壳霉重组木聚糖酶B(CsXyn11B)的基因序列长684 bp,编码227个氨基酸,在N端含有19个氨基酸组成的信号肽序列。预测该酶的等电点为6.5,分子量为25.2 kDa。优化后的密码子适应数值从0.52提高到0.96,G+C的含量由65.05%下降到49.77%。PCR扩增得到的CsXyn11B基因序列,经双酶切后连接到载体中,得到重组质粒pPIC9K-CsXyn11B。重组质粒经SacⅠ线性化,电转化得到毕赤酵母感受态细胞,根据转化子对G418抗性不同进行高拷贝筛选,得到一株产胞外木聚糖酶活力最高为32 U/mL的菌株。
2.2 高密度发酵产毛壳霉木聚糖酶B(CsXyn11B)及纯化
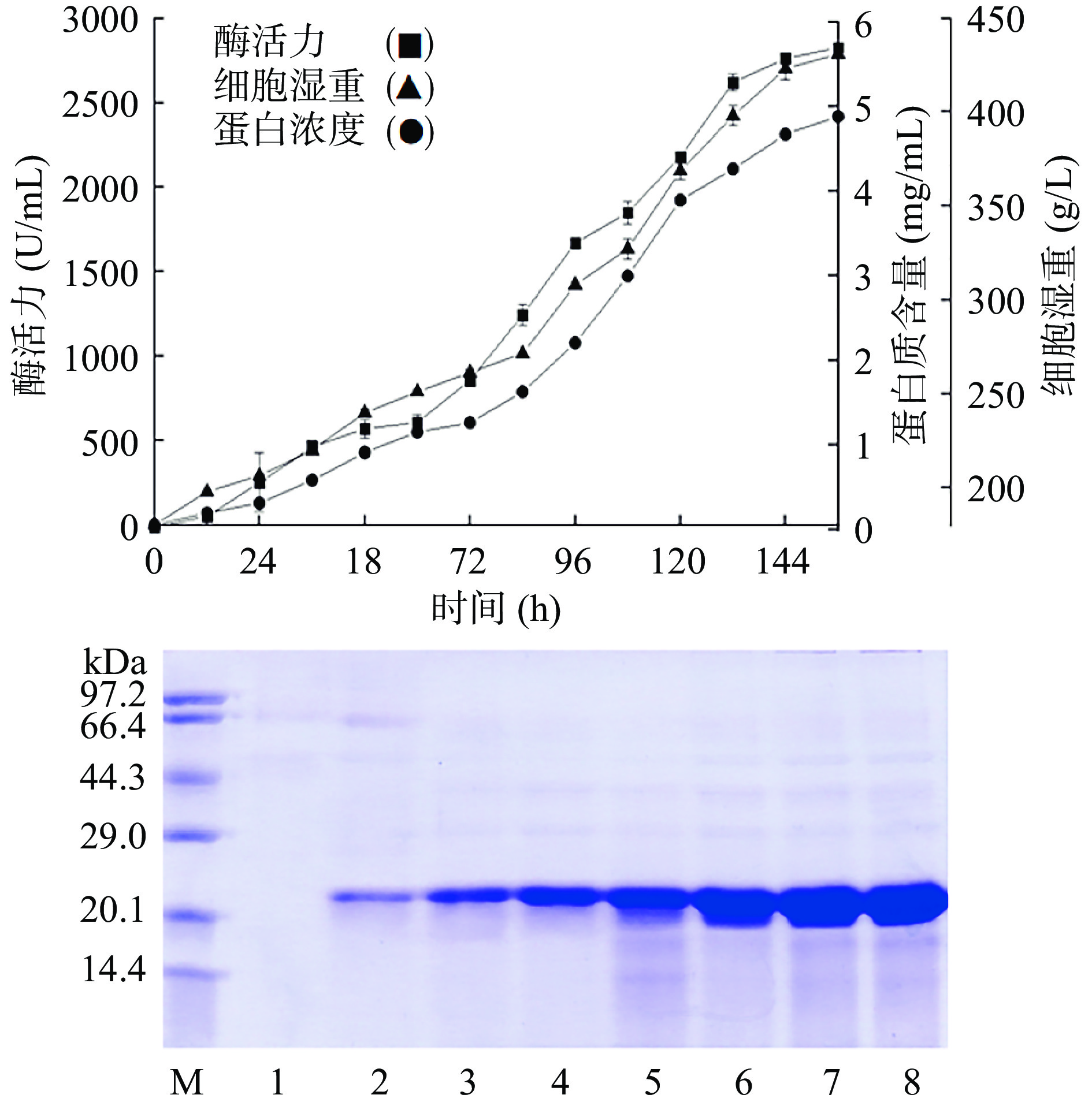
筛选得到的菌株在5 L发酵罐中进行高密度发酵156 h后,发酵上清液木聚糖酶酶活力达2788 U/mL,蛋白含量达4.8 mg/mL,菌体湿重达434.4 g/L(图1)。
目前已有许多种木聚糖酶在毕赤酵母中高效表达。重组木聚糖酶B(CsXyn11B)通过密码子优化的方法进一步提高在毕赤酵母中的分泌表达水平(2788 U/mL),比毛壳霉天然发酵产木聚糖酶活力(131 U/mL)提高21.3倍[12]。该水平高于嗜热棒状杆菌(Corynascus thermophilus)(2000 U/mL)[16]、链霉菌(Streptomyces sp.)FA1(1374 U/mL)[17]和樟绒枝霉(Malbranchea cinnamomea)(573 U/mL)[18]木聚糖酶分泌表达水平,低于同属毛壳霉CQ31的嗜热木聚糖酶CsXyn10Aop(10017 U/mL)[19]。
CsXyn11B经QSFF强阴离子交换层析柱纯化得到电泳级纯酶(图2),该酶分子量约为25.1 kDa,在电泳图上显示为一条清晰条带。纯酶液相较于粗酶液的比酶活从320 U/mg提高到1464 U/mg,纯化倍数为4.6,回收率96%。
2.3 CsXyn11B的基本酶学性质
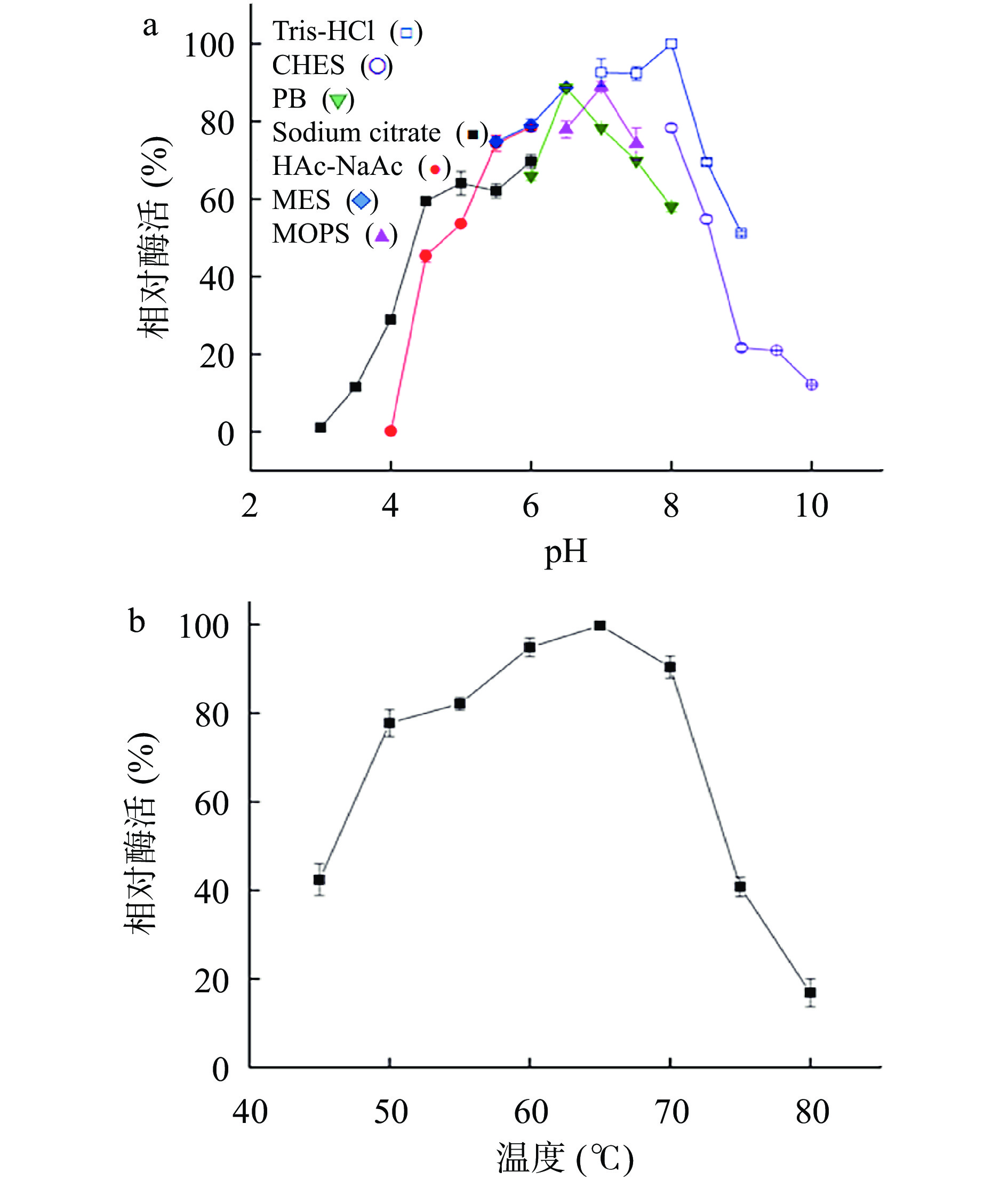
不同pH下CsXyn11B的相对酶活如图3a所示,该重组木聚糖酶最适pH为8.0。不同温度下CsXyn11B的相对酶活如图3b所示,该重组木聚糖酶最适温度为65 ℃。
不同来源的木聚糖酶最适pH有明显差异,真菌木聚糖酶多为酸性木聚糖酶。毕赤酵母表达后的CsXyn11B比毛壳霉天然发酵的木聚糖酶更耐碱,最适pH由7.5升至8.0,同时在偏碱性环境下的相对酶活力更高[12]。CsXyn11B的最适pH8.0(图3a)属于碱性木聚糖酶,高于大多数真菌木聚糖酶,如来源于铜绿拟青霉(Paecilomyces aerugineus)(pH5.5)[20]、厌氧瘤胃真菌(Anaeromyces robustus)(pH5.5)[21]和棘孢木霉(Trichoderma asperellum)(pH5.0)[22]的木聚糖酶。低于少数真菌木聚糖酶如来源于冰河藻(Planomicrobium glaciei)(pH9.0)[23]和鱼曲霉(A. fischeri)(pH9.0)[24]的木聚糖酶。大多数真菌木聚糖酶的最适温度在50~60 ℃。CsXyn11B的最适温度65 ℃(图3b)高于多数真菌木聚糖酶,如来源于裂褶菌(Schizophyllum commune)(55 ℃)[25]、棘孢木霉(T. asperellum)(50 ℃)[22]和毕赤酵母表面展示木聚糖酶(sdLeXyn)(50 ℃)[26],更适合在烘焙食品中应用。但仍不及一些嗜热真菌木聚糖酶,如同属于毛壳霉木聚糖酶CsXyn11A(70 ℃)[27]和毛壳霉木聚糖酶CsXyn10Aop(85 ℃)[19]的木聚糖酶。
2.4 CsXyn11B的底物特异性和水解特性
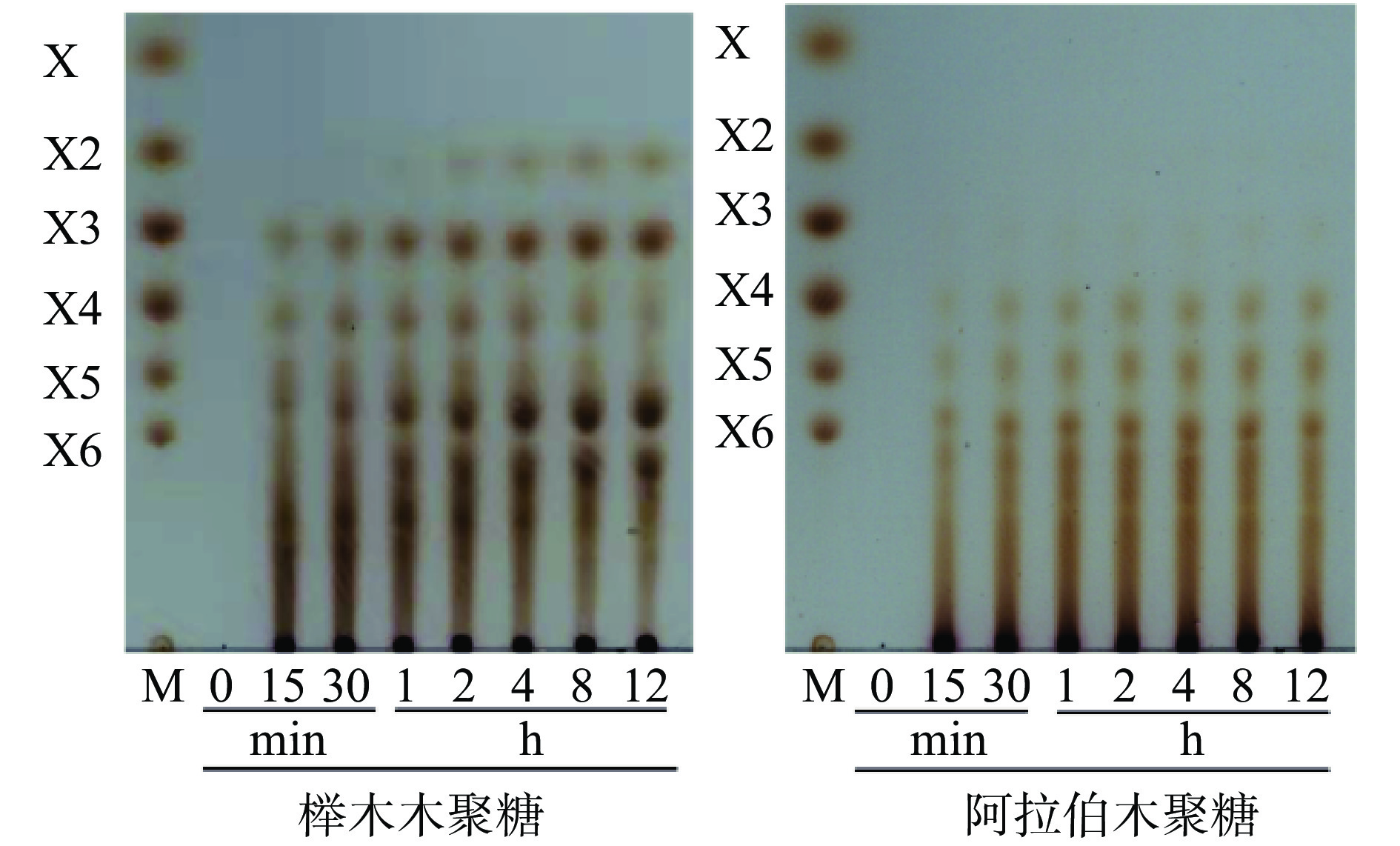
CsXyn11B的底物特异性结果见表1,CsXyn11B对燕麦木聚糖的比酶活力最高,达1145.8 U/mg;其次分别为阿拉伯木聚糖(1041.7 U/mg)、榉木木聚糖(692.3 U/mg)和桦木木聚糖(653.3 U/mg)。CsXyn11B能够水解榉木木聚糖,随时间延长,木三糖和聚合度较高的低聚木糖生成量不断增加,木四糖的含量逐渐降低。最终产物以木二糖、木三糖和聚合度较高的寡糖为主(图4)。水解阿拉伯木聚糖12 h后产物以木四糖、木五糖和木六糖为主,无木糖、木二糖和木三糖的生成(图4)。
表 1 CsXyn11B的底物特异性Table 1. Substrate specificity of CsXyn11B底物 比酶活力(U/mg) 相对酶活力(%) 燕麦木聚糖 1145.8 165.5 阿拉伯木聚糖 1041.7 150.4 榉木木聚糖 692.3 100 桦木木聚糖 653.3 94.4 CsXyn11B对各种木聚糖底物的比酶活力与天然菌发酵木聚糖酶相比均有大幅提高(天然菌发酵木聚糖酶对燕麦木聚糖,榉木木聚糖和桦木木聚糖的比酶活分别为510、449和397 U/mg)[12]。对阿拉伯木聚糖的比酶活达到1041.7 U/mg(天然菌307 U/mg),远高来源于绿色木霉(502 U/mg)[28]、温泉宏基因组(61 U/mg)[29]以及罗氏根霉(20 U/mg)[30]的木聚糖酶。CsXyn11B能够水解不同木聚糖生成低聚木糖,与其他木聚糖酶具有相似水解特性。铜绿拟青霉(P. aerugineus)木聚糖酶(PaXyn10A)水解榉木木聚糖产物只有木二糖和木三糖[20]。丙酸帕卢迪杆菌木聚糖酶(PpXyn10A)水解木聚糖终产物以木二糖和木三糖为主[10]。
2.5 CsXyn11B在面包中的应用
不同加酶量对面包性质的影响见表2。与对照组相比CsXyn11B添加量为3 mg/kg时,面包比容增加15.9%,面包硬度降低25.3%,黏着性降低26.03%,咀嚼性降低24.64%,4 ℃贮藏2 d后面包硬度较对照组降低17%。
表 2 CsXyn11B对面包品质的影响Table 2. Effect of CsXyn11B on bread quality加酶量(ppm) 比容(mL/g) 硬度(N) 4 ℃下贮存2 d后硬度(N) 黏着性 咀嚼性 0 4.66±0.15 5.35±0.01 13.97±2.06 434.35±10.49 433.40±9.91 1 5.14±0.03 4.87±0.05 13.10±1.32 400.75±15.90 409.13±14.52 2 5.26±0.20 4.46±0.18 11.93±0.85 333.86±10.43 331.06±15.42 3 5.40±0.20 4.03±0.14 11.59±0.98 321.26±12.67 326.63±9.07 4 5.39±0.15 4.18±0.15 10.36±0.43 336.16±2.89 346.62±12.70 5 5.37±0.19 4.19±0.08 10.59±0.66 374.51±11.14 375.29±12.31 木聚糖酶能够水解面粉中的阿拉伯木聚糖生成阿拉伯木寡糖,降低面团黏度,增强面团的稳定性,改善面包品质;同时,产生的阿拉伯木寡糖可以在发酵过程中作为碳源,促进酵母发酵产气,从而增大面包体积,提高面包比容[31]。黏着性和与咀嚼性的变化趋势与硬度一致,有研究表明面包的品质与硬度,黏着性和咀嚼性呈负相关,较低的硬度,黏着性和咀嚼性可以提高面包口感[32]。迄今,已有一些木聚糖酶在面包中应用的研究报道。子座木霉(T. stromaticum)[31]和Glaciecola mesophila[33]木聚糖酶可分别提高面包比容23.8%和26%。桔青霉木聚糖酶可以使面包硬度降低15%[34]。CsXyn11B对面包品质的改善效果明显,因此CsXyn11B在焙烤食品中具有良好的应用潜力。
3. 结论
本研究将毛壳霉CQ31 GH11家族木聚糖酶基因(CsXyn11B)在毕赤酵母中分泌表达,产酶水平是天然菌发酵的21.3倍(2788 U/mL)。该酶最适pH8.0,最适温度65 ℃,对阿拉伯木聚糖具有高比酶活力(1041.7 U/mg)。进一步研究其在面包烘焙中的应用价值,添加3 mg/kg重组木聚糖酶CsXyn11B能够明显增大面包体积、减小面包硬度,降低黏着性和咀嚼性。同时降低了面包在4 ℃冰箱中贮藏的老化速度。本文提供了一种在烘焙食品加工中具有良好的应用潜力的木聚糖酶。今后仍需发掘产酶水平高,对阿拉伯木聚糖比酶活力高的木聚糖酶,为木聚糖酶在烘焙食品和富含阿拉伯木聚糖的食品中的应用提供理论基础。
-
表 1 CsXyn11B的底物特异性
Table 1 Substrate specificity of CsXyn11B
底物 比酶活力(U/mg) 相对酶活力(%) 燕麦木聚糖 1145.8 165.5 阿拉伯木聚糖 1041.7 150.4 榉木木聚糖 692.3 100 桦木木聚糖 653.3 94.4 表 2 CsXyn11B对面包品质的影响
Table 2 Effect of CsXyn11B on bread quality
加酶量(ppm) 比容(mL/g) 硬度(N) 4 ℃下贮存2 d后硬度(N) 黏着性 咀嚼性 0 4.66±0.15 5.35±0.01 13.97±2.06 434.35±10.49 433.40±9.91 1 5.14±0.03 4.87±0.05 13.10±1.32 400.75±15.90 409.13±14.52 2 5.26±0.20 4.46±0.18 11.93±0.85 333.86±10.43 331.06±15.42 3 5.40±0.20 4.03±0.14 11.59±0.98 321.26±12.67 326.63±9.07 4 5.39±0.15 4.18±0.15 10.36±0.43 336.16±2.89 346.62±12.70 5 5.37±0.19 4.19±0.08 10.59±0.66 374.51±11.14 375.29±12.31 -
[1] BEG Q K, KAPOOR M, MAHAJAN L, et al. Microbial xylanases and their industrial applications: A review[J]. Applied Microbiology and Biotechnology,2001,56(3-4):326−338. doi: 10.1007/s002530100704
[2] GULERIA S, WALLA A, CHAUHAN A, et al. Molecular characterization of alkaline protease of Bacillus amyloliquefaciens SP1 involved in biocontrol of Fusarium oxysporum[J]. International Journal of Food Microbiology,2016,232:134−143. doi: 10.1016/j.ijfoodmicro.2016.05.030
[3] 李吉萍, 包昌杰, 陈光, 等. 木聚糖酶异源表达的研究进展[J]. 中国生物工程杂志,2019,39(7):91−99. [LI J P, BAO C J, CHEN G, et al. Research advances in heterologous expression of xylanase[J]. Chinese Biotechnology,2019,39(7):91−99. doi: 10.13523/j.cb.20190713 [4] ZHAO L M, GENG J, GUO Y Q, et al. Expression of the Thermobifida fusca xylanase Xyn11A in Pichia pastoris and its characterization[J]. BMC Biotechnology,2015,15(1):18. doi: 10.1186/s12896-015-0135-y
[5] LUO H, LI J, YANG J, et al. A thermophilic and acid stable family-10 xylanase from the acidophilic fungus Bispora sp. MEY-1[J]. Extremophiles,2009,13(5):849−857. doi: 10.1007/s00792-009-0272-0
[6] AUTIO K. Effects of cell wall components on the functionality of wheat gluten[J]. Biotechnology Advance,2006,24(6):633−635. doi: 10.1016/j.biotechadv.2006.07.002
[7] 陆云军, 陆利霞, 姚丽丽, 等. 酶制剂对全麦面包品质作用分析[J]. 食品工业科技,2021,42(1):363−367,372. [LU Y J, LU L X, YAO L L, et al. Analysis on the effect of enzymes on the quality of whole wheat bread[J]. Science and Technology of Food Industry,2021,42(1):363−367,372. doi: 10.13386/j.issn1002-0306.2019120153 [8] PANLAGO P, AMANDA T, VENTORIM R Z. Engineered GH11 xylanases from Orpinomyces sp. PC-2 improve techno-functional properties of bread dough[J]. Journal of the Science of Food & Agriculture,2018,2(99):741−747.
[9] AIEWVIRIYASAKUL K, BUNTEMGSOOK B, LEKAKAM H, et al. Biochemical characterization of xylanase GH11 isolated from Aspergillus niger BCC14405 (XylB) and its application in xylooligosaccharide production[J]. Biotechnology Letters,2021,43(12):2299−2310. doi: 10.1007/s10529-021-03202-1
[10] VACILOTTO M M, AMOLDI P V O, ARANTES V, et al. Paludibacter propionicigenes GH10 xylanase as a tool for enzymatic xylooligosaccharides production from heteroxylans[J]. Carbohydrate Polymers,2021,275:118684.
[11] SUCHOVA K, SPODSBERG N, KROGH K B, et al. Non-specific GH30_7 endo-beta-1,4-xylanase from Talaromyces leycettanus[J]. Molecules,2021,26(14):4614.
[12] JIANG Z Q, CONG Q Q, YAN Q J. Characterisation of a thermostable xylanase from Chaetomium sp. and its application in Chinese steamed bread[J]. Food Chemistry,2010,120:457−462. doi: 10.1016/j.foodchem.2009.10.038
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[14] MILLER G. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426−428. doi: 10.1021/ac60147a030
[15] LOWRY O, ROSEBROUGH N, FARR A, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265−275. doi: 10.1016/S0021-9258(19)52451-6
[16] YANG Z L, ZHANG Z S. Codon-optimized expression and characterization of a pH stable fungal xylanase in Pichia pastoris[J]. Process Biochemistry,2017,53:80−87. doi: 10.1016/j.procbio.2016.11.022
[17] XU Y, WU J, ZHENG K, et al. A xylanase from Streptomyces sp. FA1: Heterologous expression, characterization, and its application in Chinese steamed bread[J]. Journal of Industrial Microbiology & Biotechnology,2016,43(5):663−670.
[18] BASOTRA N, JOSHI S, SAYYANARAYAN T, et al. Expression of catalytically efficient xylanases from thermophilic fungus Malbranchea cinnamomea for synergistically enhancing hydrolysis of lignocellulosics[J]. International Journal of Biological Macromolecules,2018,108:185−192. doi: 10.1016/j.ijbiomac.2017.11.131
[19] YU J, LIU X Q, JIANG Z Q, et al. High-level expression and enzymatic properties of a novel thermostable xylanase with high arabinoxylan degradation ability from Chaetomium sp. suitable for beer mashing[J]. International Journal of Blological,2020,186:223−232.
[20] LIU X Q, YANG S Q, MA J W, et al. Efficient production of acetylated xylooligosaccharides from Hawthorn kernels by a xylanase from Paecilomyces aerugineus[J]. Industrial Crops and Products,2020,158:112962. doi: 10.1016/j.indcrop.2020.112962
[21] WEN S T, WU G G, WU H W. Biochemical characterization of a GH10 xylanase from the anaerobic rumen fungus Anaeromyces robustus and application in bread making[J]. 3 Biotech,2021,11(9):406. doi: 10.1007/s13205-021-02956-9
[22] 余静, 刘学强, 马俊文, 等. 棘孢木霉GH11家族木聚糖酶的异源表达及酶学性质[J]. 食品科学技术学报,2020,38(6):29−38. [YU J, LIU X Q, MA J W, et al. Heterologous expression and enzymatic properties of xylanase of GH11 family from Trichoderma asperellum[J]. Journal of Food Science and Technology,2020,38(6):29−38. [23] LIU Z X, SHAO T T, LI Y, et al. Expression, characterization and its deinking potential of a thermostable xylanase from Planomicrobium glaciei CHR43[J]. Forntiers in Bioengineering and Biotechnology,2021,9:618979. doi: 10.3389/fbioe.2021.618979
[24] RAJ K, CHANDRA T. Purification and characterization of xylanase from alkali-tolerant Aspergillus fischeri Fxn1[J]. FEMS Microbiology Letters,1996,145(3):457−461. doi: 10.1111/j.1574-6968.1996.tb08616.x
[25] 刘玉春, 张维清, 任菲, 等. 裂褶菌极端嗜盐木聚糖酶ScXyn22的性质及对全麦面包品质影响[J]. 食品科学,2022,43(18):127−133. [LIU Y C, ZHANG W Q, REN F, et al. The properties of extreme halotolerant xylanase ScXyn22 from Schizophyllum commune and its effect on the quality of whole wheat bread[J]. Food Science,2022,43(18):127−133. doi: 10.7506/spkx1002-6630-20211019-199 [26] LIU C J, ZHANG W J, ZHAO X H, et al. Characterization of yeast cell surface displayed Lentinula edodes xylanase and its effects on the hydrolysis of wheat[J]. International Journal of Biological Macromolecules,2022,199:341−347. doi: 10.1016/j.ijbiomac.2021.12.178
[27] LIU X Q, YANG H, JIANG Z Q, et al. Biochemical characterization of a novel glycoside hydrolase family 11 xylanase from Chaetomium sp. suitable for bread making[J]. Process Biochemistry,2022,117:1−9. doi: 10.1016/j.procbio.2022.03.017
[28] MALGAS S, PLETSCHKE B I. The effect of an oligosaccharide reducing-end xylanase, BhRex8A, on the synergistic degradation of xylan backbones by an optimised xylanolytic enzyme cocktail[J]. Enzyme and Microbial Technology,2019,122:74−81. doi: 10.1016/j.enzmictec.2018.12.010
[29] JOSHI N, SHAIMA M, SINGH S P. Characterization of a novel xylanase from an extreme temperature hot spring metagenome for xylooligosaccharide production[J]. Applied Microbiology and Biotechnology,2020,104(11):4889−4901. doi: 10.1007/s00253-020-10562-7
[30] HUANG Y H, ZHENG X L, PILGAARD B, et al. Identification and characterization of GH11 xylanase and GH43 xylosidase from the chytridiomycetous fungus, Rhizophlyctis rosea[J]. Applied Microbiology and Biotechnology,2019,103(2):777−791. doi: 10.1007/s00253-018-9431-5
[31] CARVLHO E, GOES L, UETANABARO A, et al. Thermoresistant xylanases from Trichoderma stromaticum: Application in bread making and manufacturing xylo-oligosaccharides[J]. Food Chemistry,2017,221:1499−1506. doi: 10.1016/j.foodchem.2016.10.144
[32] JIANG G H, FENG X Y, WU Z G, et al. Development of wheat bread added with insoluble dietary fiber from ginseng residue and effects on physiochemical properties, in vitro adsorption capacities and starch digestibility[J]. LWT,2021,149:111855. doi: 10.1016/j.lwt.2021.111855
[33] ZHENG H, GUO B, CHEN X, et al. Improvement of the quality of wheat bread by addition of glycoside hydrolase family 10 xylanases[J]. Applied Microbiology and Biotechnology,2011,90(2):509−515. doi: 10.1007/s00253-011-3088-7
[34] GHOSHAL G, SHIVHARE U, BANERJEE U. Effect of xylanase on quality attributes of whole-wheat bread[J]. Journal of Food Quality,2012,36(3):172−180.
-
期刊类型引用(2)
1. 张玉玺,刘星宇,齐肖亚,饶欢,赵丹丹,郝建雄,刘学强. 耐热小麦阿拉伯木聚糖酶Xyn11A在全麦面包品质改良中的应用. 食品工业科技. 2024(24): 82-89 .  本站查看
本站查看
2. 伏雪,涂敏,蔡海滨,张红骥,于德才,曾霞. 橡胶树红根病病原菌木聚糖酶编码基因GpTR1774的克隆与表达分析. 热带作物学报. 2023(12): 2461-2468 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:

 下载:
下载:



