Protective Effect of Ganoderma lucidum Polysaccharide on Myocardial Tissue in Mice under Exercise Fatigue
-
摘要: 目的:研究川赤芝多糖(Ganoderma lucidum polysaccharide,GLP)对运动疲劳小鼠心肌组织的保护作用。方法:利用沸水煎煮提取GLP,分别建立小鼠力竭游泳模型和递增负荷游泳疲劳模型,测定小鼠的力竭游泳时间、抗疲劳和抗氧化相关指标,并通过Western blot检测小鼠心肌组织中核因子E2相关因子2(NF-E2-related factor 2,Nrf2)、血红素加氧酶1(Heme oxygenase-1,HO-1)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2-Associated X蛋白(Bcl-2-Associated X,Bax)、激活型半胱氨酸天冬氨酸蛋白酶3(Cysteinyl aspartate-specific proteinase-3,Cleaved Caspase-3)表达。结果:与空白对照组(Con-A1)相比,GLP组小鼠游泳时间均极显著增加(P<0.01),且随着多糖剂量提高游泳时间随之提高;与空白对照组(Con-A2)相比,GLP低(GLP-L2)、中(GLP-M2)、高(GLP-H2)剂量组小鼠肝糖原分别增加了33.55%、50.73%和66.16%(P<0.01),肌糖原分别增加了64.18%、106.80%、117.21%(P<0.01),血乳酸和血尿素氮水平分别显著降低了32.21%、42.09%、42.45%和18.40%、34.18%、34.53%;与M-Con3相比,GLP-L3、GLP-M3、GLP-H3组小鼠心肌组织中MDA含量均显著降低(P<0.05),SOD、CAT和GSH-Px均显著升高(P<0.05),通过相关性分析发现小鼠的抗疲劳指标与抗氧化酶活性指标具有较高的相关性;另外,与运动模型组(M-Con3)相比,GLP-L3、GLP-M3、GLP-H3组小鼠心肌组织中Nrf2、HO-1和Bcl-2蛋白表达量均极显著上升(P<0.01),而Bax和Cleaved Caspase-3的蛋白表达量则极显著降低(P<0.01)。结论:川赤芝多糖具有显著的抗运动疲劳作用,其对小鼠心肌组织的保护作用可能与提高心肌细胞抗氧化能力、激活Nrf2/ARE信号通路和抑制心肌细胞凋亡有关。
-
关键词:
- 川赤芝 /
- 多糖 /
- 抗疲劳 /
- Nrf2/HO-1信号通路 /
- 细胞凋亡
Abstract: Objective: To study the protective effect of Ganoderma lucidum polysaccharide (GLP) on myocardial tissue of exercise-induced fatigue mice. Method: GLP was extracted by boiling water. The exhaustive swimming model and incremental load swimming fatigue model of mice were established respectively. The exhaustive swimming time, anti-fatigue and antioxidant related indexes of mice were measured. Moreover, Western blot was used to analyze the expression of NF-E2-related factor 2 (Nrf2), Heme oxygenase-1 (HO-1), B-cell lymphoma-2 (Bcl-2), Bcl-2-Associated X (Bax) and Cysteinyl aspartate-specific proteinase-3 (Cleaved Caspase-3). Results: Compared with blank control group (Con-A1), swimming time of GLP group increased significantly (P<0.01), and swimming time increased with increase of GLP dose. Compared with blank control group (Con-A2), the liver glycogen of GLP low (GLP-L2), medium (GLP-M2) and high (GLP-H2) dose groups increased by 33.55%, 50.73% and 66.16% respectively (P<0.01), muscle glycogen increased by 64.18%, 106.80% and 117.21% respectively (P<0.01), meanwhile the levels of blood lactic acid and blood urea nitrogen decreased by 32.21%, 42.09%, 42.45% and 18.40%, 34.18%, 34.53% respectively. Compared with model group (M-Con3), MDA content in GLP-L3, GLP-M3 and GLP-H3 groups was significantly decreased (P<0.05), while SOD, CAT and GSH-Px were significantly increased (P<0.05). Correlation analysis showed that anti-fatigue indexes of mice had a high correlation with antioxidant enzyme activity indexes. In addition, compared with M-Con3, protein expression levels of Nrf2, HO-1, and Bcl-2 in GLP-L3, GLP-M3, and GLP-H3 groups were significantly increased (P<0.01), while protein expression levels of Bax and Cleaved caspase-3 were significantly decreased (P<0.01). Conclusion: GLP had significant anti-exercise fatigue effect, and its protective effect on the myocardial tissue of mice might be related to improving the antioxidant capacity of myocardial cells, activating Nrf2/ARE signaling pathway and inhibiting the apoptosis of myocardial cells.-
Keywords:
- Ganoderma lucidum /
- polysaccharide /
- fatigue resistance /
- Nrf2/HO-1 signal path /
- cell apoptosis
-
运动性疲劳是机体在运动过程中产生的一种正常生理现象,但当机体在较长时间一直处于运动疲劳状态下时,易产生过度疲劳。过度疲劳不仅会使机体免疫能力下降,还会导致机体内脏器官受损,而且这种损伤通常是不可逆的[1]。因此,如何延缓运动性疲劳的产生和促进疲劳后机体的恢复是目前健康领域研究的重点。
机体处于运动性疲劳状态时,体内的肝糖原和肌糖原被大量消耗,血乳酸、血尿素氮等代谢产物大量堆积,同时生成较多的氧自由基,进而破坏机体稳定的内环境,导致机体脏器受损[2]。心脏作为机体最重要的循环器官,运动对心脏的刺激是双向的,研究表明适宜、规律性的运动一定程度上可以改善心脏的机能结构,提高心脏泵血能力,而长期的力竭运动则会损伤心肌引起心肌劳损[3]。此外,力竭运动引起的过度疲劳会诱导心肌细胞凋亡,进而影响心脏正常功能[4]。
多糖是川赤芝(Ganoderma lucidum)具有药理作用最主要的活性物质之一[5],被证实具有抗氧化[6]、增强免疫力[7]、抗炎[8]、抑制心肌细胞凋亡和促进心肌增殖[9]等作用。研究发现,灵芝多糖能提高心肌细胞活力,增强心肌细胞在氧化损伤条件下的存活率及增强机体心脏组织血流灌注[10],还可提高心肌细胞的抗氧化酶活性和能量代谢从而预防心力衰竭的发生[11]。另有研究表明,心肌细胞受到外界异常刺激后易导致氧自由基的大量积累,进而引起细胞毒性加重细胞损伤[12]。目前,灵芝多糖对心肌细胞损伤的保护作用虽有一定的研究,然而川赤芝多糖是否能够改善运动疲劳诱导的心肌组织损伤还鲜有报道,对其具体的作用机制还不清晰。鉴于此,本研究首先对川赤芝多糖进行纯化处理;然后通过连续灌胃小鼠多糖水溶液,测定小鼠力竭游泳运动时间和抗疲劳相关生化指标,研究其对小鼠的抗疲劳效果;最后建立小鼠递增负荷游泳运动疲劳模型,观察多糖对疲劳小鼠心脏的保护作用,通过检测心肌组织中抗氧化酶活性和相关蛋白表达情况,探讨川赤芝多糖对运动疲劳诱导下心肌细胞损伤的保护作用机制。
1. 材料与方法
1.1 材料与仪器
川赤芝(川圆芝1号) 来源于四川省农业科学院,经陈秀炳鉴定为川赤芝[13];SPF级小鼠 购自广西医科大学,许可证号:SCXK桂2020-0002;KH2PO4、乙醇、Tris-HCl、磷酸盐缓冲液、NaOH、水杨酸、HCl、MgSO4·7H2O等 均为分析纯试剂;一抗(Bax、Bcl-2、Cleaved Caspase-3、GAPDH) 北京百奥莱博科技有限公司;一抗(Nrf2、HO-1) 美国Abcam公司;肝糖原(hepatic glycogen,HG)、肌糖原(muscle glycogen,MG)检测试剂盒 南京建成生物工程研究所;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒 上海碧云天生物技术有限公司。
Eyelaosb 2000旋转蒸发仪 日本东京理化;Beta 2-8 LSCplus冷冻干燥机 德国CHRIST;ELx800酶标仪 美国Bio-Tek宝特;LT841Y-2恒温干燥箱 苏州格瑞达电子设备有限公司;CKX41-A32FL/PH荧光倒置显微镜 四川中浪科技有限公司;Mini-PROTEAN蛋白电泳仪、Gel Doc XR+化学发光成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 川赤芝粗多糖的提取
参考金鑫等[14]的方法,将川赤芝子实体在60 ℃烘箱中放置0.5 h,然后在45 ℃下烘干至恒重,备用。切片后粉碎,颗粒直径小于0.5 cm。称取2000.0 g粉末,加入30 L蒸馏水,100 ℃条件下煎煮,每次煎煮1 h,重复操作2次,合并滤液,50 ℃烘箱中放置24 h,然后45 ℃旋转蒸发浓缩至约30 mL,经过3000 Da膜过滤,向溶液中加入同体积1/3的Sevag试剂(V氯仿:V正丁醇=4:1)混合振荡后静置30 min,重复多次至无蛋白质产生,收集上层液体。除蛋白后的多糖,再经过95%酒精醇沉,经5000 r/min离心10 min去上清,冷冻干燥保存。
1.2.2 川赤芝多糖分离纯化
称取干燥后的川赤芝多糖10 g,溶于200 mL无菌蒸馏水中,将其上样到DEAE纤维素柱分离,采用0.5 mol/L的NaCl溶液洗脱,洗脱速度控制1.0 mL/min,分管收集,合并洗脱液后上样Sephadex G-100凝胶柱进行分离,用0.1 mol/L Tris-HCl缓冲液进行洗脱,控制5 min/管,收集10管,收集液冷冻干燥后即得到川赤芝多糖纯品。多糖纯度采用苯酚-硫酸法测定[15]。
1.2.3 实验分组
1.2.3.1 小鼠力竭游泳试验I组
小鼠游泳试验操作规程严格遵守广西财经学院和广西医科大学动物伦理委员会提供的指导方案执行。24只SPF级雄性昆明小鼠适应性喂养1周,第2周开始随机将小鼠分为4组,每组6只,分别为空白对照组(Con-A1)、川赤芝多糖低剂量组(10 mg/mL,GLP-L1)、川赤芝多糖中剂量组(25 mg/mL,GLP-M1)和川赤芝多糖高剂量组(50 mg/mL,GLP-H1),Con-A1组灌胃无菌生理盐水。每天按照设计方案给小鼠灌胃一次,灌胃体积均为0.1 mL/10 g,连续灌胃4周,最后一次灌胃结束2 h后,对每只小鼠进行称重,在小鼠尾根处系上体质量5%的铅丝,进行负重游泳试验,试验期间确保小鼠一直处于肌肉紧张状态直到小鼠头部沉入水下7 s,记录小鼠开始游泳至力竭时间。
1.2.3.2 小鼠游泳试验II组
小鼠的分组及灌胃剂量、体积均参照1.2.3.1,分组编号为:Con-A2、GLP-L2、GLP-M2、GLP-H2。连续灌胃5周,最后一次灌胃结束2 h后,进行60 min无负重游泳试验,游泳结束后立即麻醉小鼠并通过尾巴静脉采血,4000 r/min冷冻离心,5 min,上清液血清-20 ℃保存。采血后的小鼠颈椎脱臼处死,取小鼠肝脏和后腿骨骼肌肌肉,按照试剂盒操作处理肝脏和骨骼肌肌肉并保存于−80 ℃超低温冰箱中。采用试剂盒检测肝脏中HG、骨骼肌肌肉中MG和血清中BLA、BUN含量。
1.2.3.3 小鼠游泳疲劳试验III组
将30只SPF级雄性小鼠适应性喂养1周后,随机分为:空白对照组(Con-A3)、运动模型组(M-Con3)、川赤芝多糖低剂量组(10 mg/mL,GLP-L3)、川赤芝多糖中剂量组(25 mg/mL,GLP-M3)、川赤芝多糖高剂量组(50 mg/mL,GLP-H3),试验期间按照设计方案给小鼠灌胃1次/d,各组灌胃体积均按照小鼠体质量0.1 mL/10 g,连续灌胃6周,具体的疲劳运动方案见表1。
表 1 小鼠递增负荷疲劳模型游泳试验训练方案Table 1. Training program of swimming test in mice model of increasing load fatigue周数 游泳时间(min) 负重比例(%) 训练安排 备注 1 30 0 适应性训练,周一至周五 小鼠递增负荷游泳
训练时间未达要求
时,则训练到力竭为止2 30 2 正式训练,周一至周六 3 35 3 正式训练,周一至周六 4 40 4 正式训练,周一至周六 5 45 5 正式训练,周一至周六 6 50 6 正式训练,周一至周六 1.2.4 游泳疲劳试验III组小鼠心脏切片形态观察
最后一次游泳结束2 h后,小鼠颈椎脱臼处死,立即解剖取出心脏,用冰上预冷的PBS溶液清洗2次,再流水冲洗1次,分割成2份,一份用4%的多聚甲醛溶液固定过夜(16 h),石蜡包埋,切片、HE染色,倒置显微镜下观察心脏组织病变情况。另一份心脏组织−80 ℃保存用于后续试验。
1.2.5 心肌组织抗氧化酶活性和MDA含量测定
分别称取Con-A3、M-Con3、GLP-L3、GLP-M3和GLP-H3组小鼠心肌组织,按照1:4的比例加入预冷的PBS,研磨后离心取上清液,BCA法检测各组蛋白浓度,参照试剂盒说明书分别测定游泳疲劳试验中各组小鼠心肌组织中SOD、CAT、GSH-Px活性和MDA含量。
1.2.6 疲劳模型试验小鼠心肌组织蛋白表达测定
取方法1.2.5制备的心肌组织蛋白样品液,取20 μg进行SDS-PAGE凝胶电泳,电泳结束后转移至PVDF膜上,4%脱脂奶粉4 ℃封闭2 h,加入一抗,4 ℃封闭过夜(12 h),加入二抗孵育1 h,PBS清洗,ECL试剂显色,用化学发光成像系统拍照,采用Quantity One软件分析各条带灰度值并与GAPDH比较计算目标蛋白的表达丰度。
1.3 数据处理
所有数据采用Excel 2010整理,SPSS 22.0进行组间单因素方差分析,数据使用(
$ \overline{\mathrm{x}} $ ±s)表示;Graphpad prism 8.0进行作图分析,One-way ANOVA差异显著分析;R语言3.6.3,Psych程序包计算相关性系数和显著性差异,用Corrplot程序包画图。以P<0.05表示数据差异显著。2. 结果与分析
2.1 川赤芝多糖对小鼠体质量和力竭游泳时间的影响
从表2看知,小鼠经过1周适应性喂养后,Con-A1、GLP-L1、GLP-M1、GLP-H1组间小鼠体质量均无显著差异(P>0.05);在持续灌胃的4周中,小鼠的体质量组间均无显著差异(P>0.05)。可见,川赤芝多糖对小鼠的生长发育不存在促进或抑制作用。
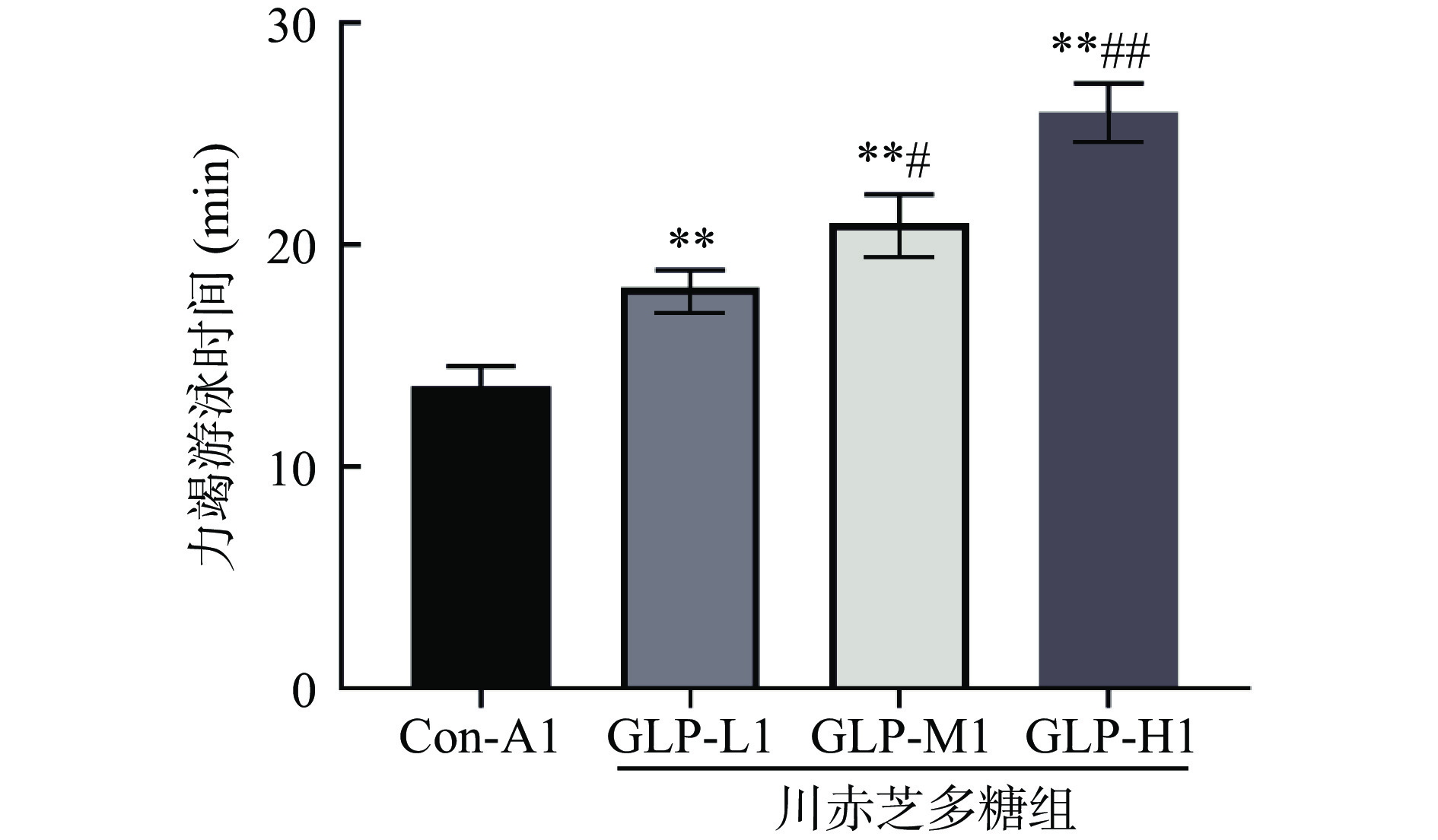
表 2 川赤芝多糖对小鼠体质量的影响Table 2. Effect of Ganoderma lucidum polysaccharide on body weight of mice组别 体质量(g) 第1周 第2周 第3周 第4周 Con-A1 21.54±1.12a 27.85±1.32a 32.76±1.57a 37.58±1.76a GLP-L1 21.72±1.05a 26.98±1.27a 31.57±1.48a 37.21±1.75a GLP-M1 21.65±0.97a 26.84±1.31a 31.85±1.53a 37.62±1.79a GLP-H1 21.59±1.08a 27.25±1.16a 32.14±1.39a 36.87±1.91a 注:同列数字后字母相同表示差异不显著(P>0.05)。 力竭游泳时间的长短可以直接反映小鼠的运动耐力,是机体抗运动性疲劳最直接指标[16]。从图1中可知,Con-A1组小鼠力竭游泳时间最短,仅为13.64±1.91 min,GLP-H1组小鼠力竭游泳时间最长为25.98±1.53 min;与Con-A1相比,GLP-L1、GLP-M1、GLP-H1小鼠的力竭游泳时间极显著增加(P<0.01)。综上可以看出,灌胃川赤芝多糖可以显著提高小鼠的力竭游泳时间,且随着多糖剂量的提高力竭游泳时间随之明显提高,表明川赤芝多糖具有显著的抗运动疲劳作用。
2.2 川赤芝多糖对小鼠体内糖原储备的影响
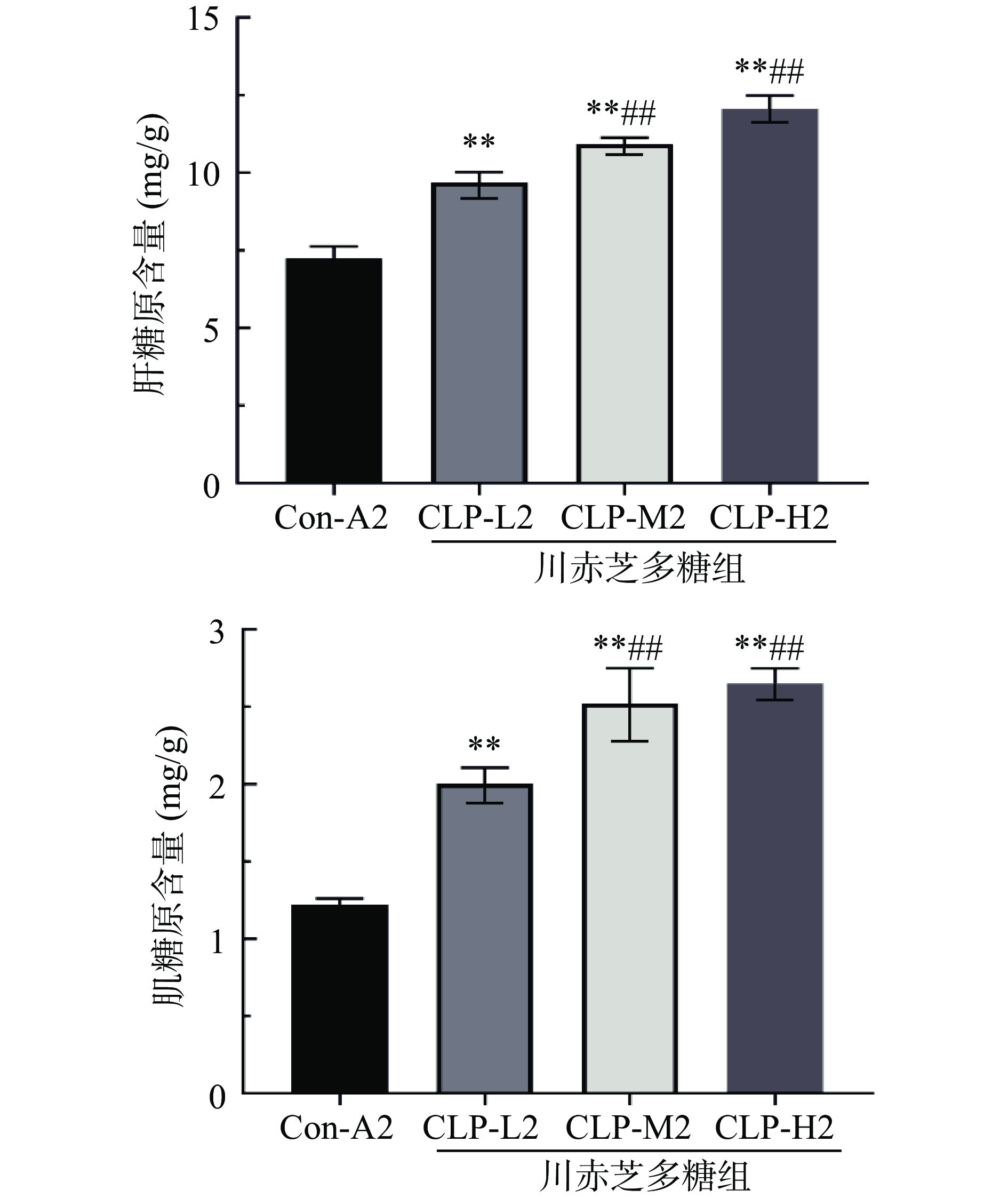
肝糖原(HG)和肌糖原(MG)是机体储存能量的两种形式。较多的研究表明,机体内HG和MG储备量越高,其为机体耐力运动提供更持久的能量[17-18]。由图2可知,Con-A2组小鼠HG和MG含量均最低,分别为7.26和1.22 mg/g;与Con-A2相比,GLP-L2、GLP-M2、GLP-H2组小鼠HG和MG均显著升高(P<0.01),HG分别增加了33.55%、50.73%和66.16%,MG分别增加了64.18%、106.80%和117.21%。可见,川赤芝多糖可以显著提高小鼠体内HG和MG的含量,进而表现出显著的抗疲劳能力。
2.3 川赤芝多糖对小鼠血乳酸(BLA)和血尿素氮(BUN)含量的影响
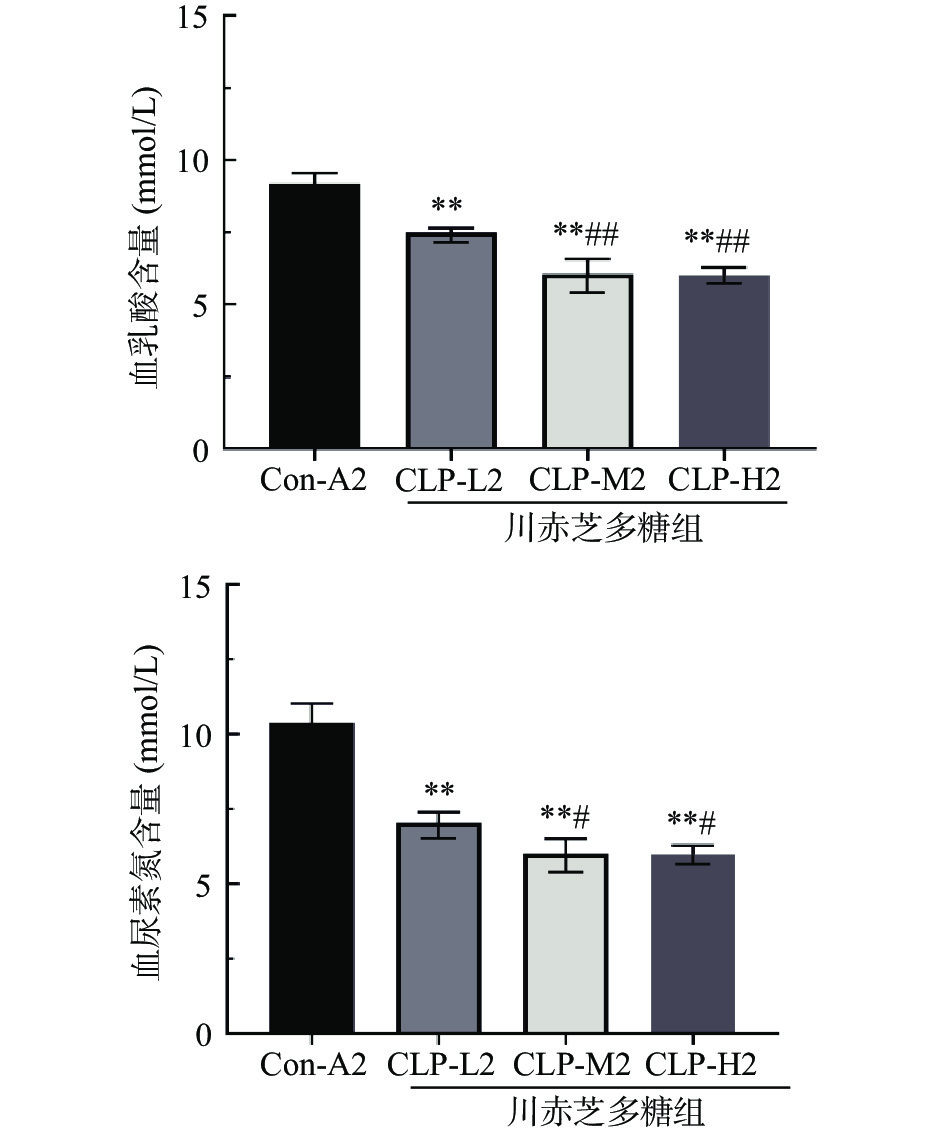
机体在高强度运动时体内细胞无氧呼吸作用增强,会将葡萄糖分解成大量乳酸,从而引发肌肉酸痛无力;当体内脂肪和碳水化合物消耗殆尽时,会通过蛋白质代谢来获得足够的能量,从而导致血清中尿素氮(BUN)的含量升高,使机体出现疲劳现象[19]。从图3可知,Con-A2小鼠BLA和BUN含量均最高,分别为9.19和10.40 mmol/L;与Con-A2相比,GLP-L2、GLP-M2、GLP-H2组中BLA、BUN含量均极显著降低(P<0.01),BLA分别降低了18.40%、34.18%、34.53%,BUN分别降低了32.21%、42.09%、42.45%;与GLP-L2相比,GLP-M2、GLP-H2组中BLA均极显著降低(P<0.01),GLP-M2、GLP-H2组中BUN均显著降低(P<0.05),此外,GLP-M2与GLP-H2组中BLA、BUN水平不存在显著差异(P>0.05)。结果表明,川赤芝多糖可通过降低小鼠血液中BLA和BUN含量,来增强小鼠的抗疲劳作用。
2.4 川赤芝多糖对小鼠心肌组织氧化应激指标的影响
从表3看知,与空白对照组(Con-A3)相比,游泳运动组小鼠心肌组织中MDA含量均显著升高(P<0.05),抗氧化酶活性均显著降低(P<0.05),说明运动性疲劳导致心肌细胞发生了脂质过氧化,破坏了体内氧化和抗氧化平衡;与M-Con3相比,GLP-L3、GLP-M3、GLP-H3组小鼠心肌组织中MDA含量均显著降低(P<0.05),SOD、CAT和GSH-Px活力均显著升高(P<0.05),可见,川赤芝多糖对运动性疲劳造成的心肌组织损伤具有较明显的保护作用,一定程度上能缓解心肌组织内脂质过氧化和氧化应激损伤。
表 3 川赤芝多糖对小鼠心肌组织MDA含量和抗氧化酶活性的影响Table 3. Effects of Ganoderma lucidum polysaccharide on MDA content and antioxidant enzyme activity in myocardial tissue of mice处理 MDA
(nmol/mg)SOD
(U/mg)CAT
(U/mg)GSH-Px
(U/mg)Con-A3 0.75±0.17##△△ 154.36±10.23##△△ 21.33±6.43##△△ 603.22±27.84##△△ M-Con3 3.51±0.78**△ 90.62±9.68**△ 9.92±1.25**△ 424.50±18.12**△ GLP-L3 3.22±0.72**# 99.77±9.55**# 11.32±2.87**# 442.26±22.64**# GLP-M3 1.79±0.29**##△△ 115.50±6.47**##△△ 12.90±3.28**##△△ 468.65±23.59**##△△ GLP-H3 1.42±0.25**##△△ 130.32±8.42**##△△ 15.32±4.68**##△△ 550.78±24.26**##△△ 注:与Con-A3对照组比较,*P<0.05,**P<0.01;与M-Con3组比较,#P<0.05,##P<0.01;与GLP-L3组比较,△P<0.05,△△P<0.01。 2.5 小鼠体内抗疲劳指标与抗氧化指标间的相关性分析
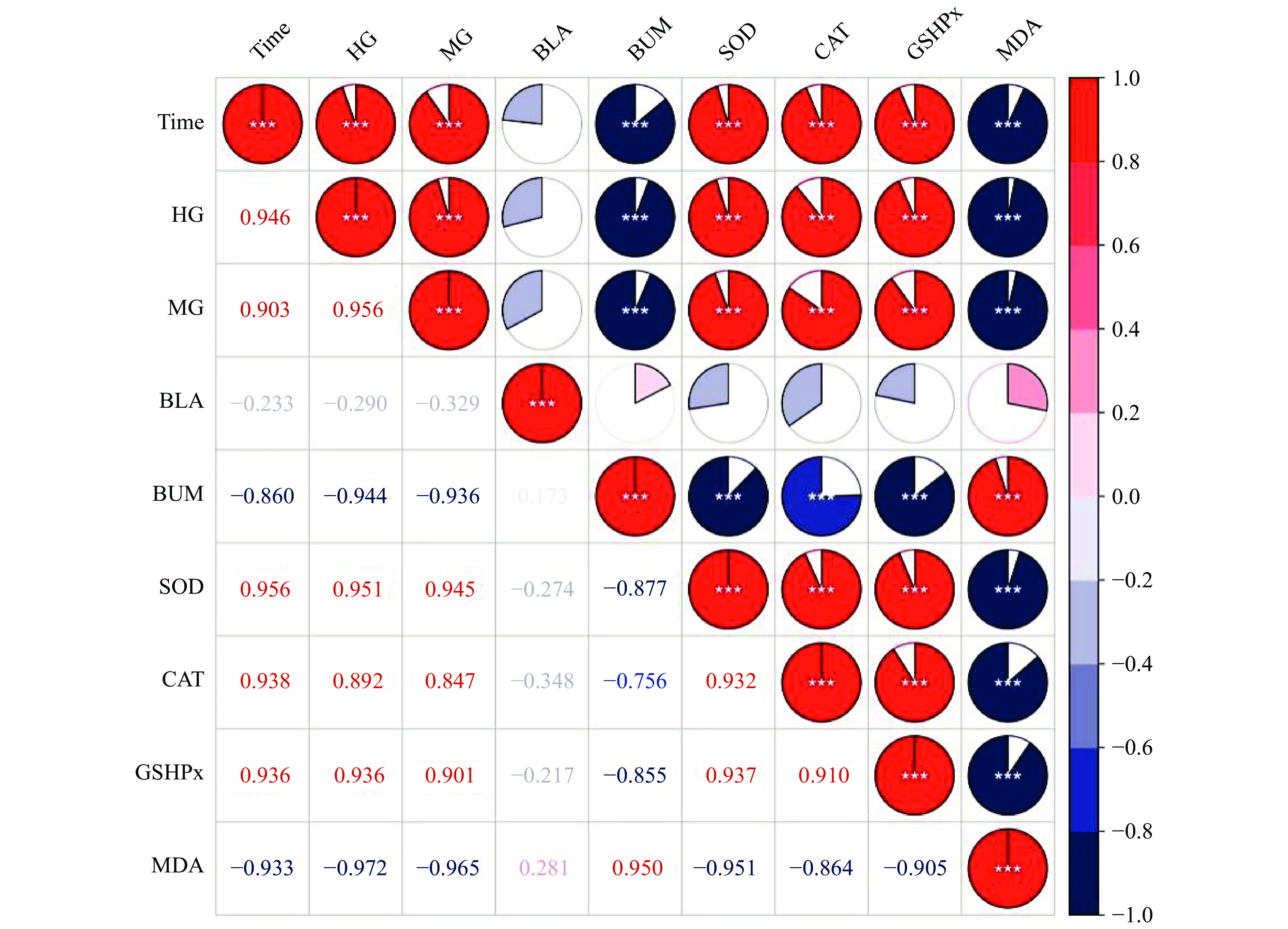
小鼠的力竭游泳时间与抗疲劳和抗氧化指标间的相关系数可视热图见图4,热图显示力竭游泳时间(Time)与HG、MG、SOD、CAT、CSH-Px呈现显著正相关性(P<0.01),相关系数均大于0.8;力竭游泳时间与BLA、BUN、MDA呈现负相关性,其中与BUN、MDA呈现显著负相关性(P<0.01),相关系数大于0.8,而与BLA的负相关性较小。此外,抗疲劳指标(HG、MG)与抗氧化酶活性(SOD、CAT、CSH-Px)显著正相关(P<0.01),而与BUN、MDA呈现显著负相关(P<0.01)。结果显示,提高机体HG、MG含量和SOD、CAT、CSH-Px活性能提高小鼠的抗运动疲劳作用,另外降低机体内BUN、MDA含量对小鼠的抗运动疲劳同样起着重要作用。
2.6 川赤芝多糖对递增负荷游泳疲劳小鼠心脏组织结构形态变化的影响
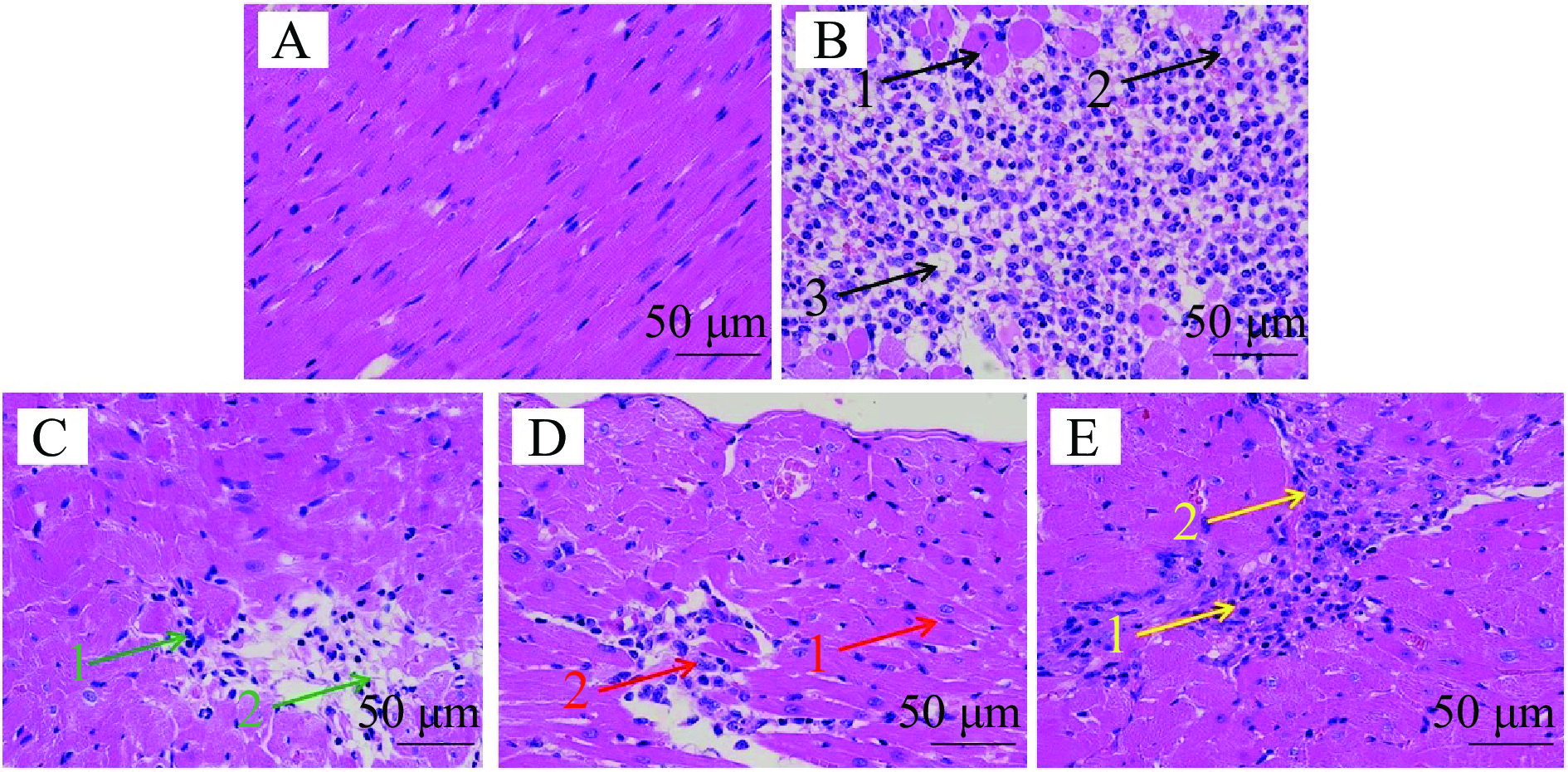
如图5所示,Con-A3组小鼠心脏细胞形态正常,细胞核清晰分明,细胞排列规律,未见细胞间出现明显扩张或挤压现象,说明细胞未出现肿胀和炎症;M-Con3组小鼠细胞间间隙明显增大,细胞充血严重(图5B箭头1),细胞排列不规则,包间间隙处出现严重炎症浸润(图5B箭头2),部分细胞出现空泡现象(图5B箭头3),核仁排列杂乱;GLP-L3组小鼠心脏细胞组织形态变化较M-Con3组有一定改善,细胞空泡现象减少,细胞皱缩程度减轻(图5C箭头1),但仍见有水肿现象(图5C箭头2);GLP-M3组则出现明显改善,细胞排列有一定规律、平整(图5D箭头1),细胞皱缩程度进一步减轻,细胞间缝隙也进一步减小(图5D箭头2),细胞水肿、炎症现象得到明显好转;GLP-H3组小鼠心脏细胞组织损伤进一步改善,细胞整体排列较规则,细胞核均匀分布,核仁明显(图5E箭头1),细胞间隙改善显著(图5E箭头2),细胞活性增强。可见,川赤芝多糖对小鼠递增负荷疲劳运动所致心脏损伤具有显著的改善作用,且随着剂量增加改善效果更好。
2.7 川赤芝多糖对小鼠心肌组织中Nfr-2、HO-1蛋白表达的影响
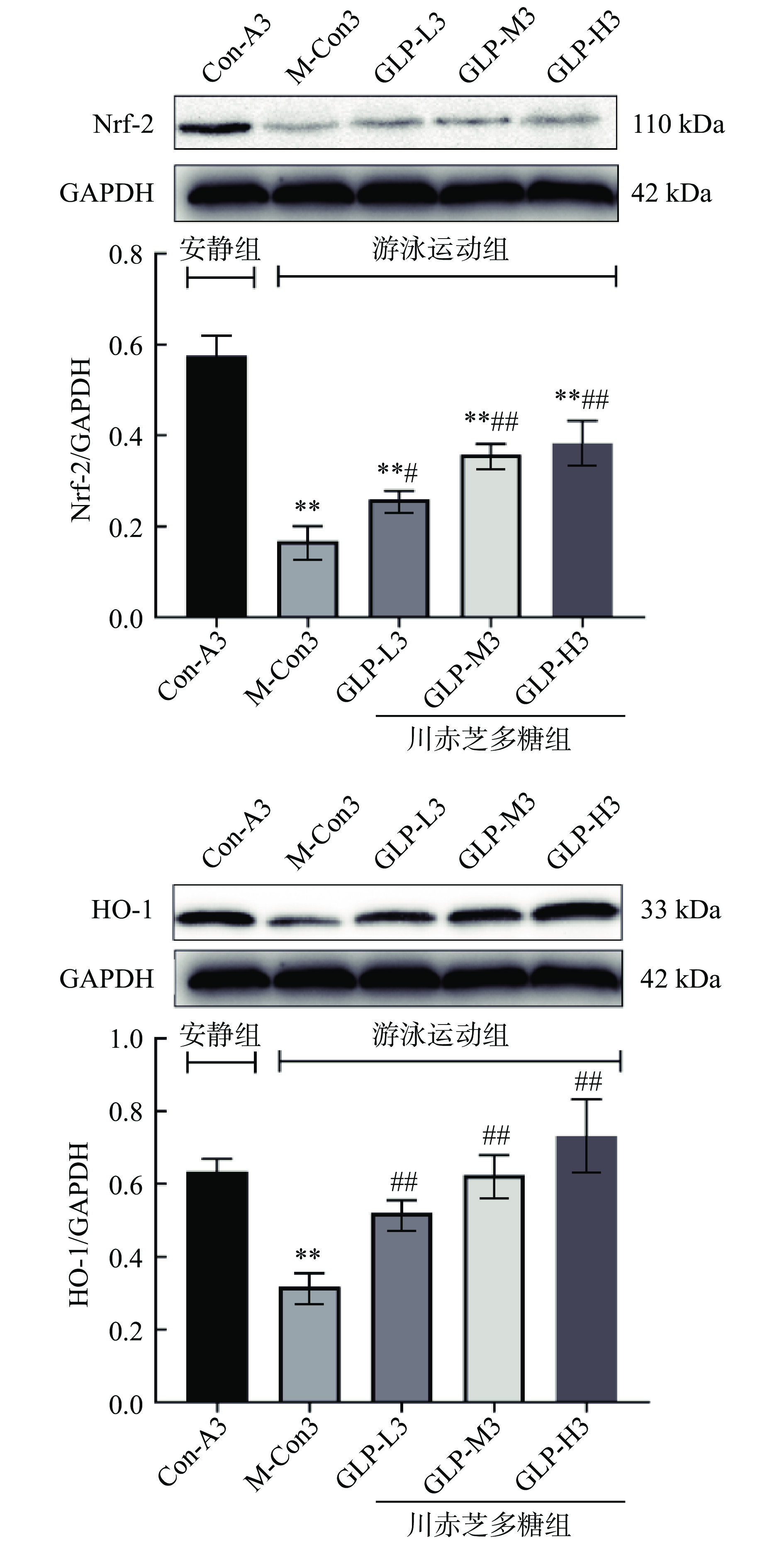
Keap1-Nrf2/ARE信号通路是细胞缓解外界胁迫产生氧化应激的主要通路,Nrf2是调节细胞氧化应激最重要的因子,其可以提高下游相关抗氧化酶的高表达来减轻细胞的氧化应激损伤,HO-1正是Nrf2/ARE信号通路下游的一种内源性抗氧化蛋白酶,HO-1的高表达可以提高细胞抗氧化的能力,进而缓解细胞发生炎症反应[20]。如图6所示,与Con-A3组相比,M-Con3组心肌细胞中Nrf2和HO-1蛋白表达极显著下调(P<0.01);与M-Con3组相比,GLP-L3、GLP-M3、GLP-H3组心肌组织中Nrf2和HO-1表达水平均极显著提高(P<0.01),GLP-H3组Nrf2、HO-1蛋白表达量均最高。结果表明,递增负荷游泳降低了小鼠心肌细胞中Nrf2、HO-1蛋白表达,川赤芝多糖干预后,Keap1-Nrf2/ARE信号通路被激活,促进了下游抗氧化酶HO-1的表达,从而提高了细胞的抗氧化水平。
![]() 图 6 心肌组织中Nrf-2和HO-1的蛋白表达注:与Con-A3比较,*P<0.05,**P<0.01;与M-Con3比较,#P<0.05,##P<0.01;图7同。Figure 6. Protein expression of Nrf-2 and HO-1 in myocardial tissue
图 6 心肌组织中Nrf-2和HO-1的蛋白表达注:与Con-A3比较,*P<0.05,**P<0.01;与M-Con3比较,#P<0.05,##P<0.01;图7同。Figure 6. Protein expression of Nrf-2 and HO-1 in myocardial tissue2.8 川赤芝多糖对小鼠心肌组织中Bax、Cleaved Caspase-3和Bcl-2蛋白表达的影响
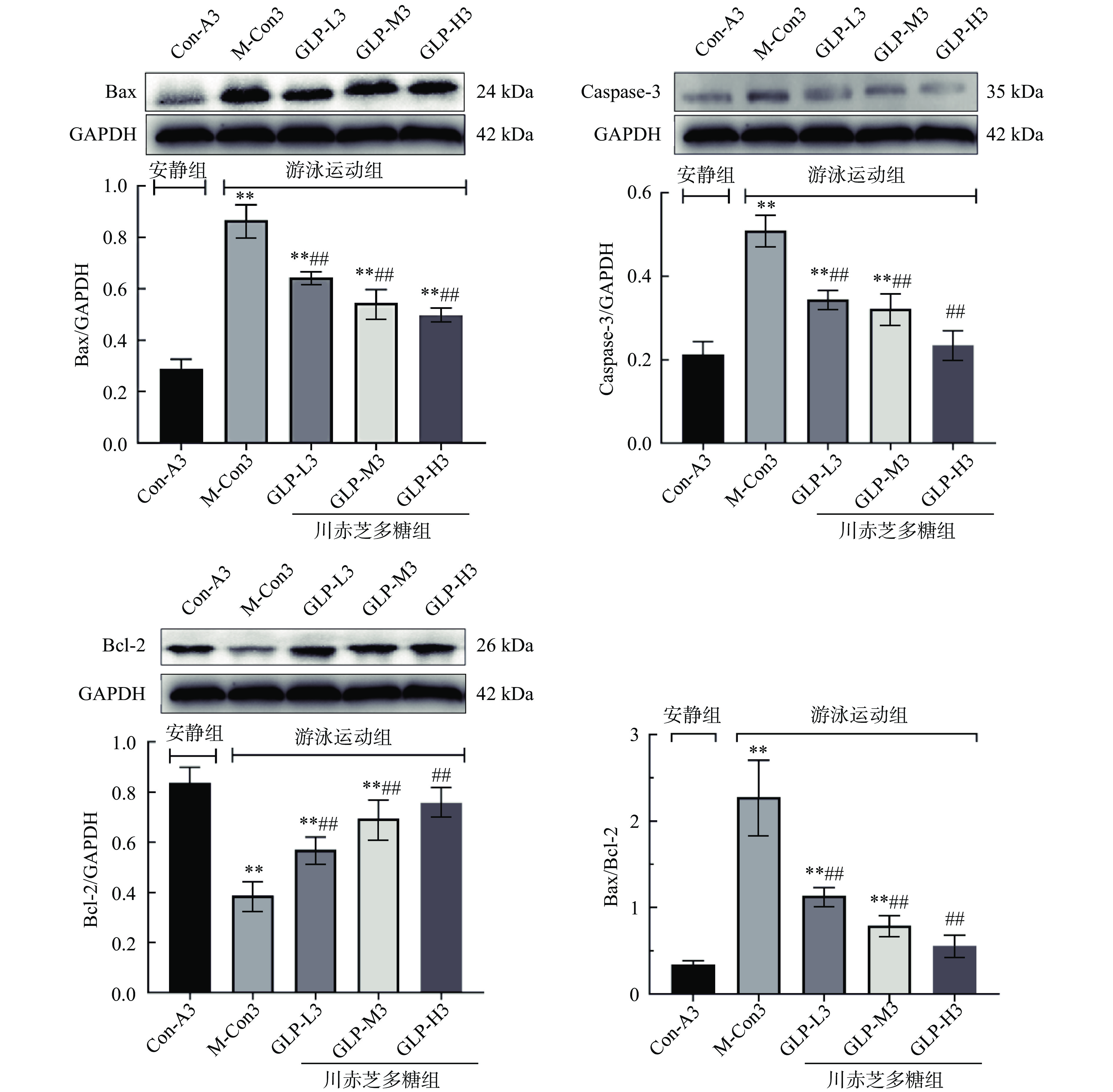
图7可知,与Con-A3相比,运动组(M-Con3、GLP-L3、GLP-M3、GLP-H3)心肌细胞内3种蛋白表达量均发生了较明显的变化,其中促凋亡蛋白(Bax)水平均显著升高(P<0.01),另外,M-Con3和GLP-L3、GLP-M3组中加速细胞凋亡蛋白(Cleaved Caspase-3)水平均极显著升高(P<0.01),抗凋亡蛋白(Bcl-2)水平则极显著降低(P<0.01),而GLP-H3组Cleaved Caspase-3、Bcl-2蛋白水平与Con-A3不存在显著差异(P>0.05);与M-Con3相比,GLP-L3、GLP-M3、GLP-H3细胞中Bax、Cleaved Caspase-3蛋白水平均极显著降低(P<0.01),Bcl-2蛋白水平则极显著升高(P<0.01);从各组心肌细胞中Bax/Bcl-2的比值上看,Con-A3的比值最低,其细胞生长正常,其次是GLP-H3、GLP-M3、GLP-L3,而M-Con3组中其比值高于2.0,表明M-Con3组心肌细胞趋于凋亡状态。可见,川赤芝多糖能提高心肌细胞Bcl-2的表达,同时抑制Bax和Cleaved Caspase-3的表达,且随着多糖剂量的升高表现出一定的依赖性,结果表明,川赤芝多糖能够抑制心肌细胞凋亡提高细胞免疫力,从而达到抗疲劳的目的。
3. 讨论
力竭游泳模型被认为是衡量机体抗疲劳能力最有效的试验模型,力竭游泳时间长短可以直接反映出机体的运动能力和抗疲劳能力,本研究结果表明,灌胃川赤芝多糖后显著延长了小鼠的力竭游泳时间(P<0.05),且力竭游泳时间与多糖剂量呈现较好的依赖关系,提示川赤芝多糖能够增强小鼠的抗疲劳能力。另外,大量的研究表明,机体在高强度或持续性运动会分解体内大量的葡萄糖,使血糖水平下降,为补充血糖平衡,储存的HG、MG会被分解,当HG、MG消耗殆尽时,机体会产生严重的疲劳感[21-22],本研究结果显示,与Con-A2相比,GLP-L2、GLP-M2、GLP-H2组小鼠HG、MG的含量显著提高(P<0.05),从而增强了小鼠的抗疲劳作用。此外,机体在高强度运动过程中,骨骼肌会产生大量的乳酸,同时,机体内蛋白质也会代谢供能产生大量的尿素氮,过多的乳酸和尿素氮会渗入血液中,使机体内环境酸碱平衡被打破,从而加重机体的疲劳感[23],BLA、BUN的清除水平与机体抗疲劳能力呈正相关,本研究结果表明,空白对照组中BLA、BUN水平显著高于川赤芝多糖组(P<0.05),可见,川赤芝多糖提高了小鼠清除BLA、BUN的能力,从而提高抗疲劳作用。
细胞内氧化应激水平对机体的抗疲劳能力具有重要影响。研究表明机体处于运动疲劳状态中时,细胞内抗氧化酶(SOD、CAT、GSH-Px)的活性会降低,在补充外源抗氧化剂后,细胞内抗氧化酶活性会明显升高,机体的抗疲劳能力得到增强[24]。MDA是细胞膜脂过氧化的重要产物,MDA含量大量积累会严重影响抗氧化酶活性水平,SOD、CAT、GSH-Px属于心肌细胞内源性抗氧化酶,能较全面反映细胞的氧化应激水平,研究证明,长期运动性疲劳与心脑血管疾病发病率呈正相关[25]。另有研究表明,灵芝多糖的抗疲劳和对心脑血管的保护作用均与多糖的强抗氧化和清除自由基的能力有密切关系,李欣[26]、莫双瑗[27]均研究发现灵芝多糖通过提高小鼠体内抗氧化酶的活性来发挥抗疲劳作用。本研究结果显示,川赤芝多糖组小鼠心肌细胞内MDA含量较模型组均出现了显著降低(P<0.05),且随着多糖剂量的增加MDA含量随之显著降低(P<0.05),另外,模型组心肌细胞中SOD、CAT、GSH-Px的酶活性均最低,说明模型组小鼠处于氧化应激状态。灌胃川赤芝多糖后,心肌细胞中SOD、CAT、GSH-Px的酶活性均得到明显提高,进一步说明川赤芝多糖可有效清除心肌细胞内过多的氧自由基,降低脂质过氧化产生的MDA,提高抗氧化酶生物活性。与此同时,通过心脏组织的微结构病理损伤研究,发现川赤芝多糖可有效改善心脏组织损伤,使细胞水肿、炎症现象得到明显好转,说明川赤芝多糖对运动性疲劳造成的心肌组织损伤具有较好的保护作用,川赤芝多糖一定程度上能够降低心肌组织内氧化应激水平。本研究结果与上文提到的相关学者的研究报道结果相似,这可能是川赤芝多糖保护心肌细胞免受氧化应激损伤的作用机制之一[28]。
Nrf2信号通路是机体对氧化应激反应的关键调节通路,机体在正常的生理状态下,大部分Nrf2分子与Keap1结合成二聚体,此时Nrf2活性被抑制,当细胞受到外源刺激时,Nrf2-Keap1结合的二聚体解离,Nrf2被激活转移到细胞核与ARE应答元件结合,启动Nrf2信号通路,位于该信号通路的下游抗氧化酶基因(HO-1)被激活,且HO-1受到受其上游启动因子Nrf2蛋白的调控[29],可见,Nrf2/HO-1信号通路在机体细胞抵御氧化应激起着重要调节作用。本研究结果表明,递增负荷运动疲劳使小鼠心肌细胞中Nrf2、HO-1蛋白表达量下降,在通过川赤芝多糖干预后,Nrf2、HO-1蛋白表达量显著上升(P<0.05),可见川赤芝多糖能激活心肌细胞中Nrf2/ARE信号通路,促进下游抗氧化酶HO-1的表达,从而提高了细胞抵御氧化应激的能力。
徐文等[30]研究认为,力竭运动诱导了小鼠心肌细胞非正常凋亡,细胞核形态结构异常,细胞凋亡率增加;张龙飞等[31]研究认为,过度疲劳使小鼠心肌细胞内线粒体功能发生紊乱,心肌细胞因为缺血而凋亡。因此,研究认为长期的力竭运动导致心肌细胞出现凋亡,是运动导致心肌结构损伤的直接因素。有研究表明,Bax、Bcl-2、Cleaved Caspase-3基因的蛋白表达水平在细胞凋亡的功能调控中起着至关重要的作用[32-33],Bcl-2是一种典型的能够抑制机体细胞凋亡的抗凋亡蛋白,而Bax的功能与Bcl-2恰恰相反,在细胞发生凋亡时Cleaved Caspase-3蛋白会迅速被激活,并加速细胞凋亡,且这种凋亡不能被恢复[34]。因此,为进一步研究川赤芝多糖对递增负荷运动疲劳诱导的心肌细胞损伤的保护作用机理,检测了心肌细胞中Bax、Bcl-2和Cleaved Caspase-3的蛋白表达情况,研究结果显示,与疲劳模型组相比,川赤芝多糖处理组小鼠心肌细胞内3种蛋白的表达水平发生了显著改变,川赤芝多糖能提高心肌细胞抗凋亡蛋白Bcl-2的表达,同时抑制Bax和Cleaved Caspase-3的表达,且随着多糖剂量的升高表现出一定的依赖性,结果进一步表明川赤芝多糖具备改善递增负荷运动小鼠的疲劳作用。
4. 结论
综上,川赤芝多糖能显著提高小鼠HG、MG含量,并降低BLA、BUN水平,同时还提高了心肌细胞中SOD、CAT、GSH-Px的酶活性。川赤芝多糖对心肌细胞的保护作用可能与其激活Nrf2/ARE信号通路有关,通过提高下游抗氧化酶的高表达来减轻细胞的氧化应激作用,此外,还可能与提高心肌组织中Bcl-2蛋白表达量并下调Bax和Cleaved Caspase-3的蛋白表达来抑制心肌细胞凋亡有关。本研究为川赤芝多糖的抗疲劳作用机制提供了一定理论基础,同时也为川赤芝多糖对提高机体运动能力的临床应用提供参考。
-
图 6 心肌组织中Nrf-2和HO-1的蛋白表达
注:与Con-A3比较,*P<0.05,**P<0.01;与M-Con3比较,#P<0.05,##P<0.01;图7同。
Figure 6. Protein expression of Nrf-2 and HO-1 in myocardial tissue
表 1 小鼠递增负荷疲劳模型游泳试验训练方案
Table 1 Training program of swimming test in mice model of increasing load fatigue
周数 游泳时间(min) 负重比例(%) 训练安排 备注 1 30 0 适应性训练,周一至周五 小鼠递增负荷游泳
训练时间未达要求
时,则训练到力竭为止2 30 2 正式训练,周一至周六 3 35 3 正式训练,周一至周六 4 40 4 正式训练,周一至周六 5 45 5 正式训练,周一至周六 6 50 6 正式训练,周一至周六 表 2 川赤芝多糖对小鼠体质量的影响
Table 2 Effect of Ganoderma lucidum polysaccharide on body weight of mice
组别 体质量(g) 第1周 第2周 第3周 第4周 Con-A1 21.54±1.12a 27.85±1.32a 32.76±1.57a 37.58±1.76a GLP-L1 21.72±1.05a 26.98±1.27a 31.57±1.48a 37.21±1.75a GLP-M1 21.65±0.97a 26.84±1.31a 31.85±1.53a 37.62±1.79a GLP-H1 21.59±1.08a 27.25±1.16a 32.14±1.39a 36.87±1.91a 注:同列数字后字母相同表示差异不显著(P>0.05)。 表 3 川赤芝多糖对小鼠心肌组织MDA含量和抗氧化酶活性的影响
Table 3 Effects of Ganoderma lucidum polysaccharide on MDA content and antioxidant enzyme activity in myocardial tissue of mice
处理 MDA
(nmol/mg)SOD
(U/mg)CAT
(U/mg)GSH-Px
(U/mg)Con-A3 0.75±0.17##△△ 154.36±10.23##△△ 21.33±6.43##△△ 603.22±27.84##△△ M-Con3 3.51±0.78**△ 90.62±9.68**△ 9.92±1.25**△ 424.50±18.12**△ GLP-L3 3.22±0.72**# 99.77±9.55**# 11.32±2.87**# 442.26±22.64**# GLP-M3 1.79±0.29**##△△ 115.50±6.47**##△△ 12.90±3.28**##△△ 468.65±23.59**##△△ GLP-H3 1.42±0.25**##△△ 130.32±8.42**##△△ 15.32±4.68**##△△ 550.78±24.26**##△△ 注:与Con-A3对照组比较,*P<0.05,**P<0.01;与M-Con3组比较,#P<0.05,##P<0.01;与GLP-L3组比较,△P<0.05,△△P<0.01。 -
[1] WATERHOUSE D F, ISMAIL T F, PRASAD S K, et al. Imaging focal and interstitial fibrosis with cardiovascular magnetic resonance in athletes with left ventricular hypertrophy: Implications for sporting participation[J]. British Journal of Sports Medicine,2012,46(1):69−77.
[2] 王倩倩, 杜鹃, 陈鸣, 等. 小麦肽的抗氧化与抗疲劳作用的研究[J]. 食品工业科技,2021,42(17):357−365. [WANG Q Q, DU J, CHEN M, et al. Study on the antioxidant and anti-fatigue effects of wheat peptides[J]. Science and Technology of Food Industry,2021,42(17):357−365. [3] 张静, 张丽娜, 阳仁均, 等. 不同强度有氧运动周期训练疲劳模型大鼠心肌形态变化及超量恢复规律[J]. 中国组织工程研究,2016,20(49):7364−7370. [ZHANG J, ZHANG L N, YANG R J, et al. Morphological changes and excess recovery of myocardial morphological changes in fatigue model rats with different intensities of aerobic exercise cycle training[J]. Chinese Tissue Engineering Research,2016,20(49):7364−7370. doi: 10.3969/j.issn.2095-4344.2016.49.010 [4] ATTILA O, BALAZS T N, CSABA M, et al. Cardiac effects of acute exhaustive exercise in a rat model[J]. International Journal of Cardiology,2015,182:258−266. doi: 10.1016/j.ijcard.2014.12.045
[5] 姜涛, 施枝江, 姚艺新, 等. 不同品种灵芝多指标的质量评价研究[J]. 中药材,2018,41(12):2847−2855. [JIANG T, SHI Z J, YAO Y X, et al. Quality evaluation of different varieties of Ganoderma lucidum with multiple indicators[J]. Chinese Materia Medica,2018,41(12):2847−2855. [6] 刘宇琪, 郝利民, 鲁吉珂, 等. 灵芝子实体和孢子粉纯化多糖体外抗氧化活性研究[J]. 食品工业科技,2019,40(16):27−31. [LIU Y Q, HAO L M, LU J K, et al. Antioxidant activity of purified polysaccharides from Ganoderma lucidum fruiting bodies and spore powder in vitro[J]. Science and Technology of Food Industry,2019,40(16):27−31. [7] LI L F, LIU H B, ZHANG Q W, et al. Comprehensive comparison of polysaccharides from Ganoderma lucidum and G. sinense: Chemical, antitumor, immunomodulating and gut-microbiota modulatory properties[J]. Scientific Reports,2018,8(1):1−10.
[8] CAI Q, LI Y Y, PEI G. Polysaccharides from Ganoderma lucidum attenuate microglia-mediated neuroinflammation and modulate microglial phagocytosis and behavioural response[J]. Journal of Neuroinflammation,2017,14(1):63. doi: 10.1186/s12974-017-0839-0
[9] XU Z H, SU X, YANG G, et al. Ganoderma lucidum polysaccharides protect against sepsis-induced cardiac dysfunction by activating SIRT1[J]. Journal of Pharmacy and Pharmacology,2021,74(1):124−130.
[10] 徐繁, 李潇, 李青山, 等. 灵芝多糖减轻蒽环类药物所致心肌细胞凋亡的研究[J]. 河北医学,2020,26(11):1826−1828. [XU F, LI X, LI Q S, et al. Study on Ganoderma lucidum polysaccharide alleviating cardiomyocyte apoptosis induced by anthracyclines[J]. Hebei Medicine,2020,26(11):1826−1828. [11] XIE Y Z, YANG F H, TAN W J, et al. The anti-cancer components of Ganoderma lucidum possesses cardiovascular protective effect by regulating circular RNA expression[J]. Oncoscience,2016,3(7/8):203−207.
[12] 陈桂林, 徐姗, 吴紫娟, 等. 五子衍宗丸多糖对过氧化氢所致心肌细胞损伤的影响[J]. 医药导报,2021,40(3):306−310. [CEN G L, XU S, WU Z J, et al. Effects of Wuzi Yanzong Pills polysaccharide on myocardial cell injury induced by hydrogen peroxide[J]. Medical Herald,2021,40(3):306−310. [13] 陈秀炳, 周洁, 张波, 等. 灵芝新品种‘川圆芝1号’[J]. 园艺学报,2017,44(11):2239−2240. [CHEN X B, ZHOU J, ZHANG B, et al. A new variety of Ganoderma lucidum No. 1[J]. Journal of Horticulture,2017,44(11):2239−2240. [14] 金鑫, 熊川, 李萍, 等. 三株海南岛野生灵芝的鉴定、多糖组成及其抗氧化活性研究[J]. 天然产物研究与开发,2020,32(2):190−199. [JIN X, XIONG C, LI P, et al. Identification, polysaccharide composition and antioxidant activity of three wild Ganoderma strains in Hainan island[J]. Natural Products Research Development,2020,32(2):190−199. [15] 梁琰, 赵志国, 张敏敏, 等. 超声辅助提取苯酚-硫酸法测定野生平盖灵芝多糖含量[J]. 食品研究与开发,2018,39(16):125−129. [LIANG Y, ZHAO Z G, ZHANG M M, et al. Determination of polysaccharide content in wild Ganoderma lucidum by ultrasonic-assisted extraction of phenol-sulfuric acid method[J]. Food Research and Development,2018,39(16):125−129. doi: 10.3969/j.issn.1005-6521.2018.16.023 [16] HU L S, FANG X Z, DU M H, et al. Anti-fatigue effect of blended Camellia oleifera Abel tea oil and Ge-132 in mice[J]. Food and Nutrition Sciences,2015,6(15):1479−1487. doi: 10.4236/fns.2015.615152
[17] 杨果, 李臣. 西番莲果皮黄酮纯化及其抗氧化与抗运动疲劳活性研究[J]. 中国食品添加剂,2022,33(4):72−80. [YANG G, LI C. Purification of flavonoids from passion fruit peel and its anti-oxidative and anti-exercise fatigue activities[J]. China Food Additives,2022,33(4):72−80. [18] 胡云峰, 李岢祎, 胡开蕾, 等. 熟制枸杞提取物抗疲劳效果研究[J]. 食品研究与开发,2022,43(4):29−33. [HU Y F, LI K Y, HU K L, et al. Study on the anti-fatigue effect of cooked Lyciumbar barum extract[J]. Food Research and Development,2022,43(4):29−33. doi: 10.12161/j.issn.1005-6521.2022.04.005 [19] 孔凡秀, 杨琪, 董佳萍, 等. 人参皂苷Rg1对疲劳小鼠骨骼肌中TFAM和NRF-1基因表达的影响[J]. 食品与生物技术学报,2022,41(2):67−72. [KONG F X, YANG Q, DONG J P, et al. Effects of ginsenoside Rg1 on TFAM and NRF-1 gene expression in skeletal muscle of fatigue mice[J]. Journal of Food and Biotechnology,2022,41(2):67−72. doi: 10.3969/j.issn.1673-1689.2022.02.009 [20] ILARIA B, ILEANA G B, ALBA M L, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. BBA-Molecular Cell Research,2018,1865(5):721−733.
[21] 蒋彤, 王亚雯, 李裕倩, 等. 苦荞低聚肽体外抗氧化活性及其对运动小鼠自由基代谢与疲劳恢复的影响[J]. 营养学报,2022,44(1):79−85. [JIANG T, WANG Y W, LI Y Q, et al. In vitro antioxidant activity of buckwheat oligopeptides and its effects on free radical metabolism and fatigue recovery in exercise mice[J]. Journal of Nutrition,2022,44(1):79−85. doi: 10.3969/j.issn.0512-7955.2022.01.015 [22] 康鹏, 李国薇, 马宏祥, 等. 运动营养食品及其抗疲劳活性成分研究进展[J]. 食品安全质量检测学报,2021,12(23):9157−9164. [KANG P, LI G W, MA H X, et al. Research progress on sports nutrition food and its anti-fatigue active ingredients[J]. Journal of Food Safety and Quality Inspection,2021,12(23):9157−9164. doi: 10.3969/j.issn.2095-0381.2021.23.spaqzljcjs202123025 [23] 林致辉, 周庆莹, 王梦妮, 等. 小建中汤对运动性疲劳小鼠骨骼肌AMPK/PGC1-α信号通路的影响[J]. 中国实验方剂学杂志,2020,26(13):73−78. [LIN Z H, ZHOU Q Y, WANG M N, et al. Effect of Xiaojianzhong decoction on AMPK/PGC1-α in skeletal muscle of exercise fatigue mice effects of signal pathways[J]. Chinese Journal of Experimental Formulas,2020,26(13):73−78. [24] 李国锋. 抗运动疲劳食源性活性成分的研究进展[J]. 食品工业科技,2020,41(24):344−353. [LI G F. Research progress of food-derived active ingredients for anti-exercise fatigue[J]. Science and Technology of Food Industry,2020,41(24):344−353. doi: 10.13386/j.issn1002-0306.2020030244 [25] 于亚琳, 郭瑞莹, 张雪琰, 等. 抗阻运动对中老年人群心血管危险因素影响的Meta分析[J]. 中国全科医学,2022,25(13):1651−1658. [YU Y L, GUO R Y, ZHANG X Y, et al. Meta-analysis of the effects of resistance exercise on cardiovascular risk factors in middle-aged and elderly people[J]. Chinese General Medicine,2022,25(13):1651−1658. [26] 李欣. 黑灵芝多糖缓解运动性疲劳的效果[J]. 食品研究与开发,2021,42(4):59−65. [LI X. Effect of black Ganoderma lucidum polysaccharide in relieving exercise-induced fatigue[J]. Food Research and Development,2021,42(4):59−65. doi: 10.12161/j.issn.1005-6521.2021.04.010 [27] 莫双瑗, 梁健. 黑灵芝多糖对运动大鼠抗疲劳和抗氧化作用[J]. 食品与生物技术学报,2018,37(5):555−559. [MO S Y, LIANG J. Anti-fatigue and antioxidant effects of black Ganoderma lucidum polysaccharides on exercise rats[J]. Journal of Food and Biotechnology,2018,37(5):555−559. doi: 10.3969/j.issn.1673-1689.2018.05.015 [28] 马艺华, 石月萍. 温阳通脉方通过NRF2/HO-1通路对缺氧/复氧损伤H9c2心肌细胞氧化应激的保护作用[J]. 中药药理与临床,2022,38(5):73−77. [MA Y H, SHI Y P. The protective effect of Wenyang Tongmai Recipe on oxidative stress of H9c2 myocardial cells injured by hypoxia/reoxygenation through NRF2/HO-1 pathway[J]. Pharmacology and Clinical of Traditional Chinese Medicine,2022,38(5):73−77. [29] MASAYUKI Y, KENSLER T W, HOZUMI M. The KEAP1-NRF2 system: A thiol-based sensor-effector apparatus for maintaining redox homeostasis[J]. Physiological Reviews,2018,98(3):1169−1203. doi: 10.1152/physrev.00023.2017
[30] 徐文, 钱钰, 殷劲. 过度疲劳状态模型大鼠心脏功能及心肌细胞凋亡调控因子的变化[J]. 中国组织工程研究,2019,23(19):3074−3079. [XU W, QIAN Y, YIN J. Changes of cardiac function and cardiomyocyte apoptosis regulating factors in rat model of excessive fatigue[J]. Chinese Tissue Engineering Research,2019,23(19):3074−3079. doi: 10.3969/j.issn.2095-4344.1253 [31] 张龙飞, 崔玉娟, 平政, 等. 红景天苷对力竭大鼠心肌线粒体呼吸功能的影响[J]. 解放军医药杂志,2014,26(11):1−5. [ZHANG L F, CUI Y J, PING Z, et al. Effects of salidroside on myocardial mitochondrial respiratory function in exhausted rats[J]. PLA Medical Journal,2014,26(11):1−5. doi: 10.3969/j.issn.2095-140X.2014.11.001 [32] 卢玉润, 李英, 胡涛, 等. 大黄酚对缺氧诱导的心肌细胞损伤保护作用及机制[J]. 西部医学,2021,33(3):317−320. [LU Y R, LI Y, HU T, et al. Protective effect and mechanism of chrysophanol on hypoxia-induced myocardial cell injury[J]. Western Medicine,2021,33(3):317−320. doi: 10.3969/j.issn.1672-3511.2021.03.002 [33] 刘广, 郑敏麟, 伞勤. 大黄素对硫酸吲哚酚诱导的心肌细胞损伤的保护作用[J]. 中国中西医结合杂志,2021,41(5):583−588. [LIU G, ZHENG M L, SAN Q. Protective effect of emodin on myocardial cell injury induced by indoxyl sulfate[J]. China Journal of Integrated Traditional Chinese and Western Medicine,2021,41(5):583−588. [34] 李利娟, 刘文涛, 罗欢欢, 等. 菟丝子总黄酮对小鼠睾丸间质细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3的影响[J]. 解放军医学院学报,2022,43(2):199−204. [LI L J, LIU W T, LUO H H, et al. Effects of total flavonoids of dodder on the apoptosis-related proteins Bax, Bcl-2 and Caspase-3 of leydig cells in mice[J]. Journal of the PLA Medical College,2022,43(2):199−204. doi: 10.3969/j.issn.2095-5227.2022.02.013 -
期刊类型引用(3)
1. 赵伟科,杨逍然,王美华. 羊肚菌硒化多糖结构表征及抗运动疲劳作用. 食品工业科技. 2024(06): 110-120 .  本站查看
本站查看
2. 李昆展,王颖,郑佳,刘浩. 基于Nrf2信号通路探析桑黄多糖对运动疲劳小鼠肝损伤的保护作用. 现代食品科技. 2024(06): 20-28 .  百度学术
百度学术
3. 杨亚萍,吕亚辉,刘飞祥,彭新. 灵芝菌丝体硒多糖结构表征、抗氧化活性及对小鼠运动疲劳的影响. 中国食品添加剂. 2023(06): 109-118 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:

 下载:
下载:



