Separation and Purification and Antioxidant Activity of Polyphenols from Sargassum horneri
-
摘要: 为研究铜藻多酚的分离纯化工艺及抗氧化活性。在超声辅助提取铜藻多酚的基础上采用大孔吸附树脂柱层析法分离纯化铜藻多酚提取物,以VC为对照采用体外实验分析其抗氧化活性。结果显示:大孔吸附树脂LX-158具有最佳的吸附和解析条件,静态吸附和解析平衡时间为5 h,动态吸附和解析的最佳条件为:粗提液和洗脱剂流速为3 mL/min,上样体积为10 mL,洗脱剂为40%乙醇溶液,洗脱剂体积为120 mL。此条件下铜藻多酚纯度从7.52%提高到40.31%。体外抗氧化活性结果显示:不同浓度的铜藻多酚对DPPH自由基、ABTS自由基、超氧阴离子自由基、羟自由基有明显的清除作用和Fe3+还原力,随着多酚浓度增大其抗氧化能力增强,IC50值分别为6.60 μg/mL、75.70 μg/mL、2.22 mg/mL、5.62 mg/mL。实验证明该纯化工艺可行且稳定,可以作为铜藻多酚纯化的工艺条件。Abstract: In order to study the separation and purification process and antioxidant activity of Sargassum horneri polyph-enols, on the basis of ultrasonic assisted extraction of Sargassum horneri polyphenols, macroporous adsorption resin column chromatography was used to separate and purify Sargassum horneri polyphenol extract, and VC was used as the control to analyze its antioxidant activity in vitro. The results showed that the macroporous adsorption resin LX-158 exhibited the best adsorption and analysis conditions. The equilibrium time for static adsorption and analysis was 5 h. The following circumstances were ideal for dynamic adsorption and analysis: The flow rate of crude extract and eluent was 3 mL/min, the loading volume was 10 mL, the eluent was a 40% ethanol solution, and the eluent volume was 120 mL. The purity of Sargassum horneri polyphenols increased from 7.52% to 40.31% under these conditions. Antioxidant activity studies revealed that varied doses of Sargassum horneri polyphenols had noticeable scavenging effects on DPPH radical, ABTS radical, superoxide anion radical, hydroxyl radical and Fe3+ reducing power. With the increase of polyphenol concen-tration, its antioxidant capacity improved, and the IC50 was 6.60 μg/mL, 75.70 μg/mL, 2.22 mg/mL, 5.62 mg/mL, respec-tively. The purification process is feasible and stable, and it can be used as a process condition for the purification of polyphenols from Sargassum horneri.
-
铜藻别名柱囊马尾藻、海柳麦、玉海藻,新鲜铜藻藻体为黄褐色,质脆、气腥、味咸,属于暖温带性海藻,主要分布在浙江、广东等地[1]。铜藻资源丰富,每年4~5月铜藻大量繁殖,其生物量约35.81~1568.44 g/m2,不充分利用会造成资源浪费,也会导致金潮等环境问题[2]。铜藻晒干后粉碎可以作为鲍鱼饲料。研究发现,铜藻中含有褐藻多酚[3]、褐藻胶[4]、褐藻多糖[5]、岩藻黄质[6]等活性成分,具有较高的营养和药用价值,可以作为化工、食品、医药等行业的优质原料。多酚是铜藻中一类重要的活性成分,鲜藻中多酚提取率为2 mg/g显著高于干铜藻的提取率800 μg/g,它具有抗氧化[7-8]、清除自由基[9]、抗肿瘤[10]、降血糖[11-12]、降血脂[13]等生物活性。
天然产物纯化方法有膜分离技术[14]、两相萃取[15]、凝胶电泳[16]、制备型HPLC[17-18]等,但是这些方法耗时、成本高,不适合工业化大量生产。大孔吸附树脂柱层析法[19-20]是一种纯化海藻粗提物中生物活性物质的方法,具有操作简单、环保绿色、可回收利用等优点。目前关于铜藻多酚大孔吸附树脂分离纯化的研究尚未发现,为了研究铜藻多酚的抗氧化活性,提高铜藻多酚纯度,本实验采用大孔吸附树脂纯化铜藻多酚,采用动态吸附和解析优化铜藻多酚分离纯化的最佳工艺条件,并在最佳的条件下试制铜藻多酚样品,评价纯化前后铜藻多酚抗氧化活性,为铜藻多酚的开发利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜铜藻 2021年5月采自福建泉州海域,经自然资源部第三海洋研究所王初生研究员鉴定为铜藻;95%乙醇 安徽安特食品股份有限公司;大孔吸附树脂X-15、LX-158、LX-8 西安蓝晓科技新材料股份有限公司;大孔吸附树脂DM130 厦门科普仪器有限公司;大孔吸附树脂HP20、HI-816 华东理工大学上海华震科技有限公司;大孔吸附树脂NKA、NKA-9、AB-8、D101、D1400 安徽三星树脂科技有限公司;抗坏血酸、亚硝酸钠、氯化铝、氢氧化钠、邻苯三酚、水杨酸、硫酸亚铁、过氧化氢、铁氰化钾、三氯化铁、三氯乙酸、福林酚、Na2CO3 国药集团化学试剂有限公司;磷酸缓冲液(pH6.8)、焦性没食子酸 西陇科学股份有限公司;DPPH自由基、ABTS、过硫酸钾 上海麦克林生化科技有限公司;芦丁、Tris-HCl溶液 上海源叶生物科技有限公司。
HZ-9212SB水浴恒温振荡器 太仓市华利达设备有限公司;BT-500EA 153YX蠕动泵 上海沪西分析仪器厂有限公司;KQ-500E超声清洗机 昆山市超声仪器有限公司;UH5300紫外-可见分光光度计 日本岛津公司;ABI5500-Q-TRAP质谱仪 美国AB公司;Hei-VAP Value G3旋转蒸发仪 德国Heidolph公司;HH-ZK水浴锅 巩义市予华仪器有限责任公司;H1650离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 铜藻多酚粗提液制备
铜藻洗净除盐,沥干水分后切碎备用。称取适量铜藻(鲜重),在乙醇体积分数为40%,超声时间53 min,液料比为60:1的条件下制备铜藻多酚粗提液[21],收集粗提液浓缩冷藏备用。
1.2.2 大孔吸附树脂纯化铜藻多酚
1.2.2.1 大孔吸附树脂预处理
称取适量X-15、LX-8、DM130、HP20、HI-816、NKA、NKA-9、AB-8、D101、D1400、LX-158共11种型号的大孔吸附树脂,分别于95%乙醇溶液中浸泡24 h,临用时洗至无醇味[22]。
1.2.2.2 大孔吸附树脂筛选
称取经预处理的大孔吸附树脂X-15等11种各1 g,加入30 mL 235 μg/mL的铜藻多酚粗提液,在25 ℃条件下水浴振荡吸附24 h(100 r/min),测定上清液中铜藻多酚浓度。过滤后,大孔吸附树脂用去离子水洗涤后,加入40 mL 40%乙醇振荡24 h(100 r/min),测定上清液中铜藻多酚的含量。计算吸附量、吸附率和解析量、解析率。计算公式如下:
QA=(C0−C1)×V1m RA=(C0−C1)C0×100 QD=C2×V2m RD=C2(C0−C1)×100 式中:QA表示吸附量,mg/g;RA表示吸附率,%;QD表示解析量,mg/g;RD表示解析率,%;C0表示铜藻多酚初始含量,μg/mL;C1表示吸附后溶液中多酚的含量,μg/mL;C2表示解析后洗脱液中多酚含量,μg/mL;V1表示样品液体积,mL;V2表示洗脱溶剂体积,mL;m表示大孔吸附树脂质量,g。
1.2.2.3 静态吸附和解析动力学研究
称取NKA-9、LX-158两种大孔吸附树脂各1 g,加入30 mL 235 μg/mL的铜藻多酚粗提液,在25 ℃条件下纯水浴振荡24 h(100 r/min)。0、0.5、1、2、4、6、8、10、12和24 h分别取样,测定上清液中铜藻多酚浓度。计算吸附量,以吸附时间为横坐标,综合吸附量为纵坐标绘制各大孔吸附树脂的吸附动力学曲线。过滤后大孔吸附树脂用纯水冲洗,加入40 mL 40%乙醇解析,25 ℃水浴振荡24 h(100 r/min)。0、0.5、1、2、4、6、8、10、12和24 h分别取样,测定上清液中铜藻多酚含量[22]。计算解析量,以解析时间为横坐标,综合解析量为纵坐标绘制各大孔吸附树脂的解析动力学曲线。
1.2.2.4 吸附等温线
准确称取18份质量为1 g的LX-158大孔吸附树脂,分为三组,每组加入30 mL不同浓度的铜藻多酚粗提液。三组分别在25、35、45 ℃振荡至吸附平衡。根据福林酚法,分别测定铜藻多酚含量。以粗提物多酚浓度为横坐标,综合吸附量为纵坐标绘制吸附等温线。
1.2.3 动态吸附和解析实验
1.2.3.1 动态吸附实验
称取2份经预处理的LX-158大孔吸附树脂10 g,湿法装柱后,用2~3倍柱体积的纯水冲洗。样品浓度为350 μg/mL,上样体积为100 mL,考察上样流速(2.25、3、3.75、4.5、5.25 mL/min)对吸附量的影响;样品浓度为350 μg/mL,上样体积为400 mL,以3 mL/min的流速上样,流出液10 mL收集成一管,测定多酚含量,考察上样体积对大孔吸附树脂吸附量的影响[23]。
1.2.3.2 动态解析实验
称取3份经预处理的LX-158大孔吸附树脂10 g,湿法装柱,用纯水冲洗至流出液清澈透明。铜藻多酚粗提液以3 mL/min的速度上样,收集流出液,计算树脂吸附量。用2~3倍柱体积的纯水清洗。100 mL洗脱剂以3 mL/min的流速洗脱,研究乙醇浓度(30%、40%、50%、60%、80%)对解析率的影响;100 mL 40%乙醇溶液作为洗脱剂,研究洗脱剂流速(2.25、3、3.75、4.5、5.25 mL/min)对解析率的影响;100 mL 40%乙醇溶液以3 mL/min的流速洗脱,流出液10 mL收集成一管,考察洗脱剂体积对解析能力的影响[23]。
1.2.4 铜藻多酚总含量测定
采用福林酚法[24]测定样品中的总酚含量。取200 μL适宜浓度的铜藻多酚溶液与1.5 mL福林酚试剂反应3 min,再加入4 mL 0.1 g/mL Na2CO3溶液,蒸馏水补足体积至10 mL,30 ℃避光反应25 min后,于760 nm测定吸光度,实验重复三次。以没食子酸为标准品绘制标准曲线,得到回归方程为y=0.1799x+0.0336,R²=0.9985。
1.2.5 LC-MS条件
参考文献[25]的方法并修改,干燥气氮气流速8.0 L/min;干燥气温度350 ℃;雾化气压力40 psig;裂解电压175 V;毛细管电压4000 V;质谱扫描范围:m/z 100~1800。
1.2.6 铜藻多酚抗氧化活性研究
1.2.6.1 铜藻多酚DPPH自由基清除能力研究
DPPH自由基清除能力测定参考文献[26]方法并加以修改。铜藻多酚溶液与DPPH甲醇溶液混合(1:1,v/v),25 ℃避光反应30 min,在517 nm处测定吸光值A1。用超纯水代替样品,测得空白对照的吸光值为A0。以VC为对照,计算铜藻多酚的DPPH自由基清除率。
清除率(%)=(A0−A1)A0×100 1.2.6.2 铜藻多酚ABTS自由基清除能力研究
ABTS自由基清除能力测定参考文献[26]方法并加以修改。ABTS溶液配制:38.4 mg ABTS和13.5 mg过硫酸钾溶解分别定容至10 mL,混合后避光放置12 h。ABTS溶液用PBS(pH6.8)缓冲液稀释45倍。0.5 mL铜藻多酚溶液与3.5 mL稀释后的ABTS溶液,常温下避光反应30 min,734 nm测定吸光值A1。用超纯水代替样品,测得空白对照组的吸光值为A0,以VC为对照,计算铜藻多酚的ABTS自由基清除率。
清除率(%)=(A0−A1)A0×100 1.2.6.3 铜藻多酚超氧阴离子自由基清除能力研究
超氧阴离子自由基清除能力测定参考文献[27]方法并加以修改。取一定质量浓度的铜藻多酚溶液2 mL于比色皿中,加入0.9 mL pH8.2的Tris-HCl溶液于石英比色皿中,加入50 μL 30 mmol/L的邻苯三酚溶液,迅速混合摇匀于325 nm测定吸光度,每隔30 s测一次,300 s后停止,吸光度随时间变化即为斜率△A样,将样品替换为Tris-HCl溶液即为△A0。空白组用超纯水代替样品,以VC为对照,计算铜藻多酚超氧阴离子自由基清除率。
清除率(%)=(ΔA0−ΔA样)ΔA0×100 1.2.6.4 铜藻多酚羟自由基清除能力研究
羟自由基清除能力测定参考文献[28]方法并加以修改。1 mL铜藻多酚溶液中加入1 mL 6 mmol/L的水杨酸溶液,再加入1 mL 6 mmol/L的FeSO4溶液和1 mL 6 mmol/L H2O2,加水定容至10 mL,37 ℃反应30 min,510 nm测定吸光值A1。用超纯水代替样品,测得空白对照的吸光值A0,以VC为对照,计算铜藻多酚羟自由基清除率。
清除率(%)=(A0−A1)A0×100 1.2.6.5 铜藻多酚Fe3+还原力研究
Fe3+还原力测定参考李爽等[29]的方法并加以修改。取1 mL的待测溶液、1 mL磷酸缓冲液(pH6.8)和1 mL铁氰化钾(1%)混匀,50 ℃水浴20 min,冷却至室温,加入1 mL三氯乙酸(10%),3000 r/min离心10 min,取0.5 mL上清液、2 mL蒸馏水和1 mL三氯化铁(0.1%)混匀,反应10 min,在700 nm处测定吸光度,以VC为对照(吸光度值越大,Fe3+还原力越强)。
1.3 数据处理
每组实验重复进行3次,结果以“平均值±标准差”表示,采用Excel分析处理数据,并采用Origin 2019b软件绘制图表。
2. 结果与分析
2.1 大孔吸附树脂筛选
由表1可知,HI-816、NKA-9、LX-8、LX-158四种树脂的吸附率分别是52.00%、53.16%、59.57%和58.87%,均有较高的吸附率。其中,LX-8的解析率为22.92%,NKA-9、LX-158两种大孔吸附树脂的吸附量和解析量分别为3.73、4.13 mg/g和2.88、3.36 mg/g,因此,选用NKA-9和LX-158进行吸附和解析动力学研究。
表 1 11种大孔吸附树脂吸附和解析效果Table 1. Effect of adsorption and desorption of 11 macroporous adsorption resins树脂种类 吸附率
(%)吸附量
(mg/g)解析率
(%)解析量
(mg/g)X-15 35.33 2.48 62.10 1.54 LX-8 59.57 4.18 22.92 0.96 DM130 32.99 2.32 49.32 1.14 HP20 39.87 2.80 48.83 1.37 HI-816 52.00 3.65 67.62 2.47 NKA 26.82 1.88 47.13 0.89 NKA-9 53.16 3.73 77.07 2.88 AB-8 27.40 1.92 53.02 1.02 D101 39.41 2.77 51.25 1.42 D1400 30.78 2.16 50.98 1.10 LX-158 58.87 4.13 81.19 3.36 2.2 铜藻多酚大孔吸附树脂的吸附和解析动力学结果
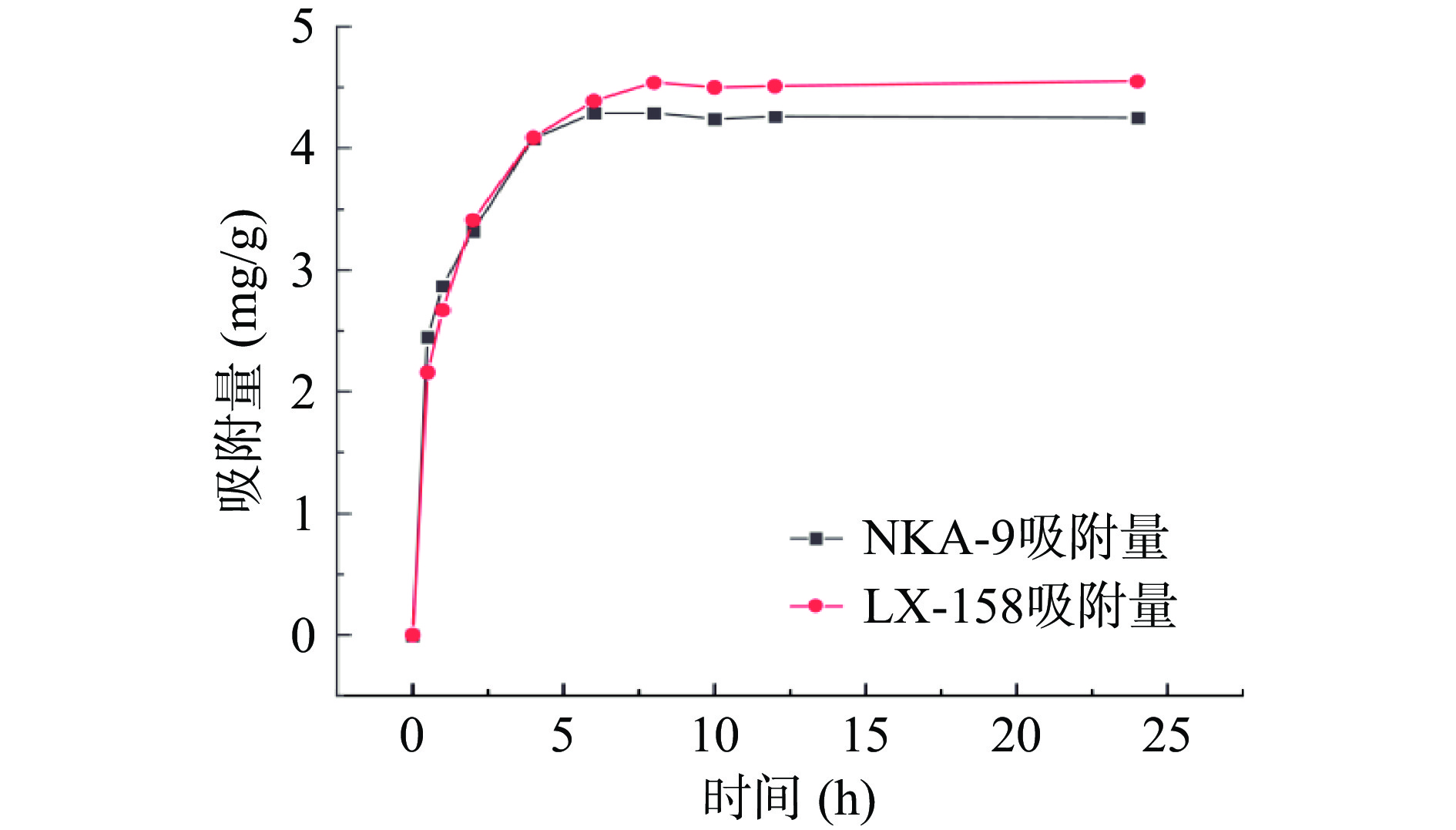
LX-158和NKA-9两种大孔吸附树脂的静态吸附动力曲线如图1所示。LX-158和NKA-9两种树脂几乎同时达到吸附平衡,LX-158的吸附量高于NKA-9。
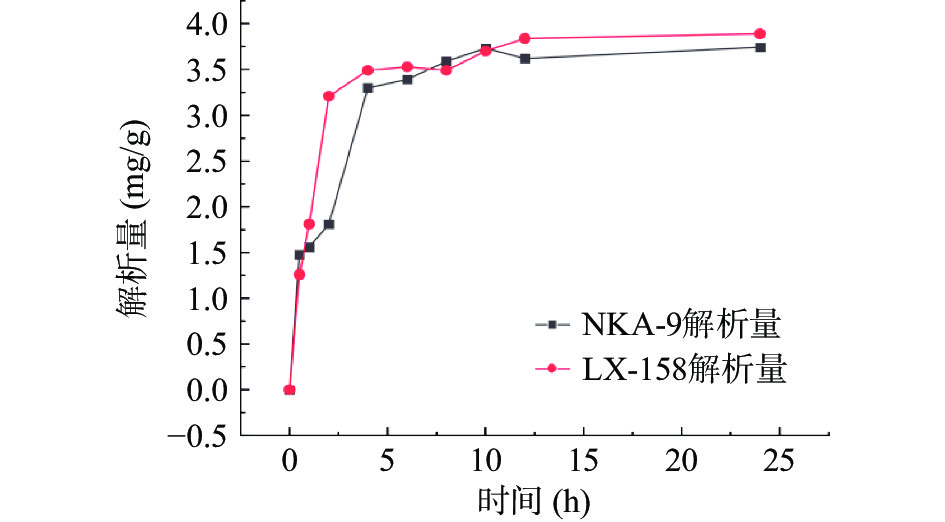
LX-158和NKA-9两种大孔吸附树脂的静态解析动力曲线如图2所示。可知LX-158和NKA-9几乎同时达到平衡,平衡时LX-158的解析量明显高于NKA-9,LX-158对铜藻多酚具有快速高效的吸附能力和解析附能力。综上所述,LX-158树脂是铜藻多酚纯化的最佳选择。
2.3 吸附等温线
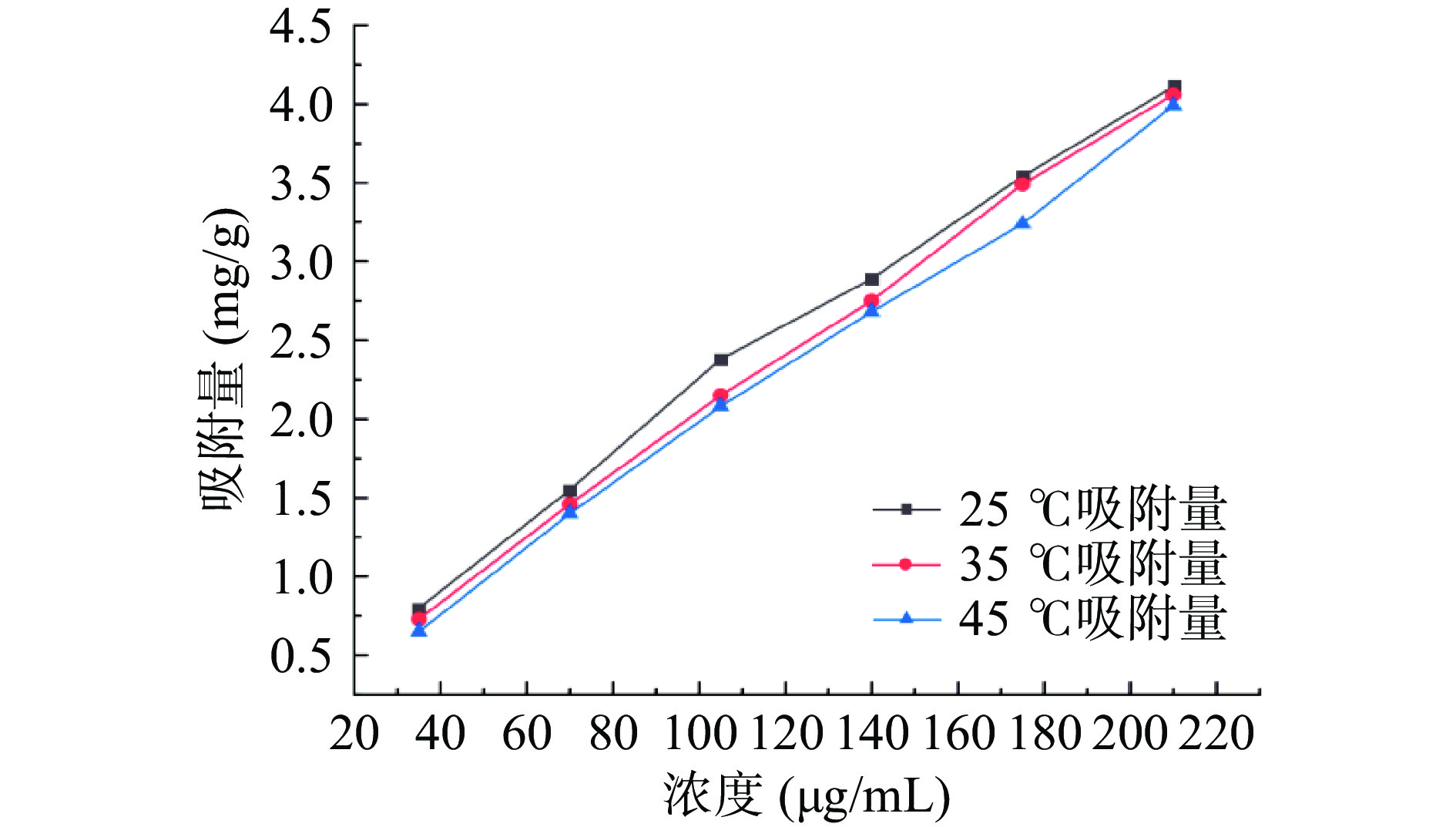
吸附等温线描述了在恒温条件下吸附在吸附剂上的吸附质平衡吸附量与吸附质在液体中的平衡浓度之间的关系,有助于了解吸附剂与吸附质之间的相互作用,优化性能参数和节约能源。图3为25、35和45 ℃时LX-158对铜藻多酚的吸附等温线,可以看出随着粗提液中多酚浓度的增加,LX-158大孔吸附树脂的铜藻多酚吸附量逐渐增加。随着温度的上升,多酚的吸附量逐渐降低,降低吸附温度有助于提高LX-158的吸附量,25 ℃是LX-158的最佳吸附温度。结果表明,LX-158对多酚的吸附是放热过程,多酚浓度增加,树脂对多酚的吸附量也增大。
2.4 动态吸附和解析实验结果
2.4.1 铜藻多酚粗提液的上样流速对吸附能力的影响
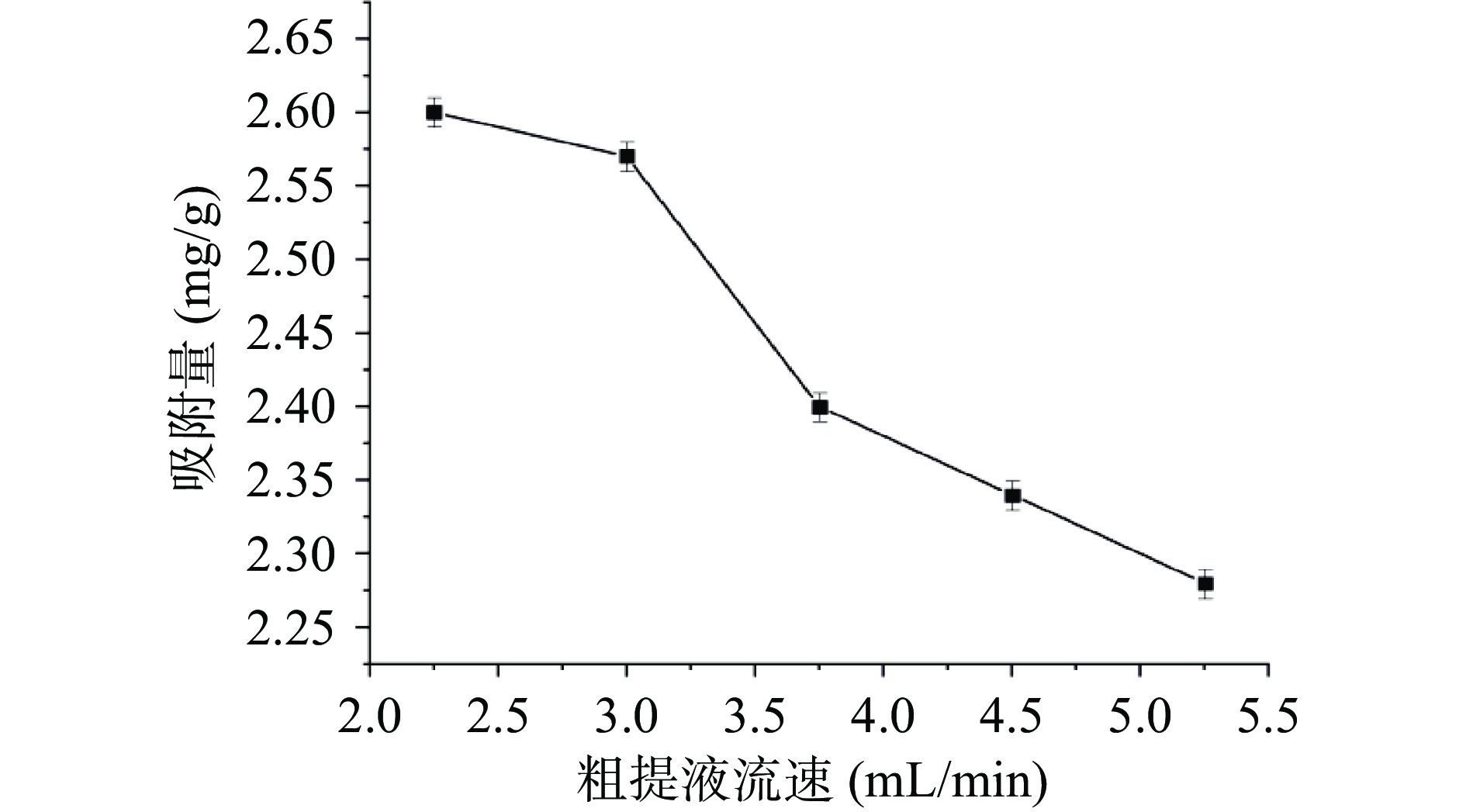
上样流速对LX-158树脂吸附铜藻多酚效果的影响如图4所示。随着粗提液流速增加,树脂对铜藻多酚吸附量不断降低,当流速为2.25~3.0 mL/min时,流速对多酚吸附量的影响不明显,流速大于3.0 mL/min时多酚的吸附量明显降低。可能是样品的流速增大,加快了样品从树脂缝隙中流出的速度,导致多酚的吸附量降低[30]。因此粗提液的上样流速为3.0 mL/min。
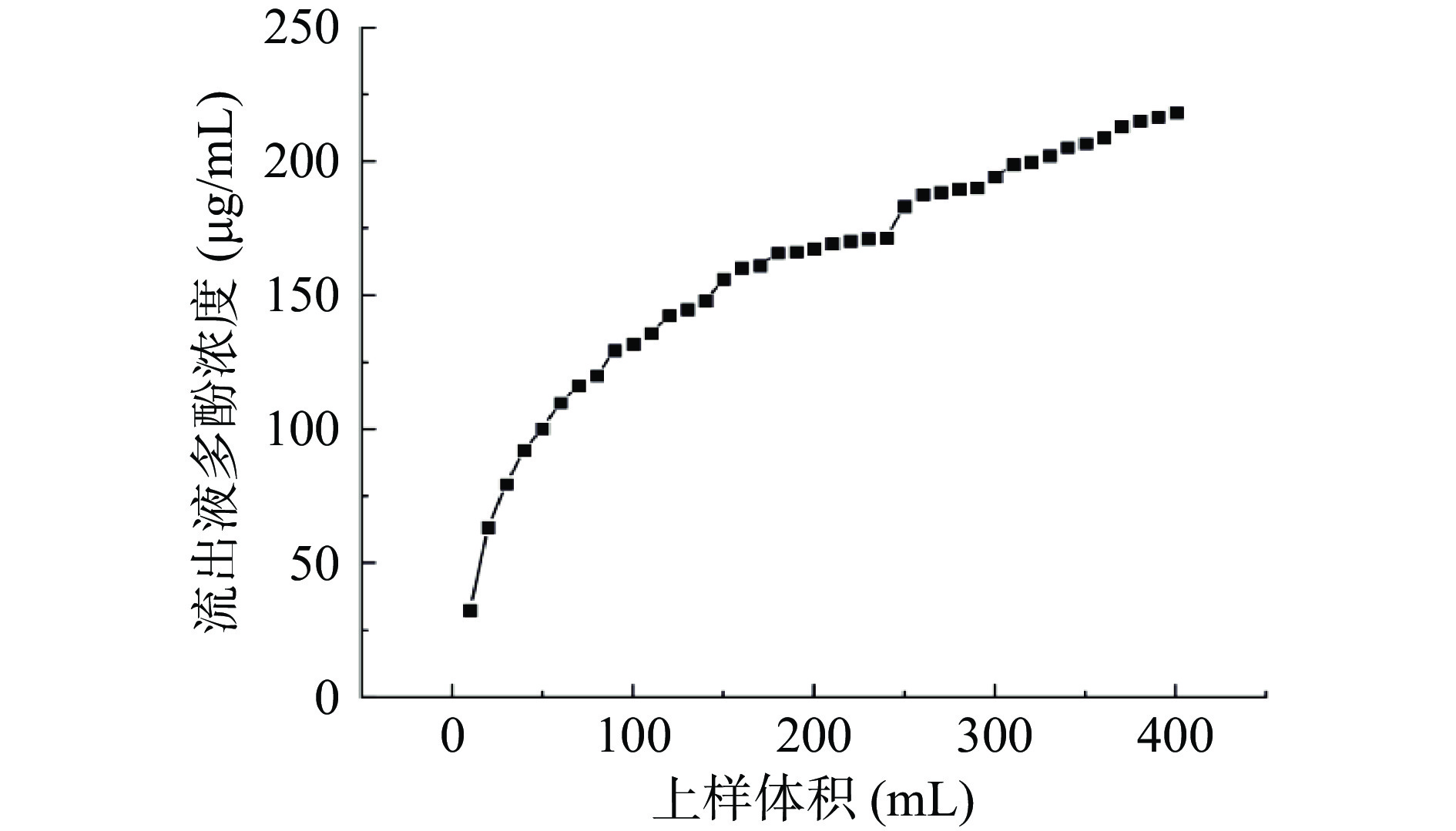
2.4.2 铜藻多酚粗提液的泄露曲线
LX-158树脂吸附铜藻多酚的泄露曲线如图5所示。当流出液在第1~37流份范围内时,各流份中铜藻多酚的浓度逐渐增加,第37流份开始流出液多酚的浓度几乎保持不变。当多酚浓度达到初始样品浓度的10%,此时为最佳上样体积[31]。第1流份时溶液中多酚浓度达到上样溶液浓度的10%,因此选择上样体积为10 mL为LX-158大孔树脂的最大上样量。
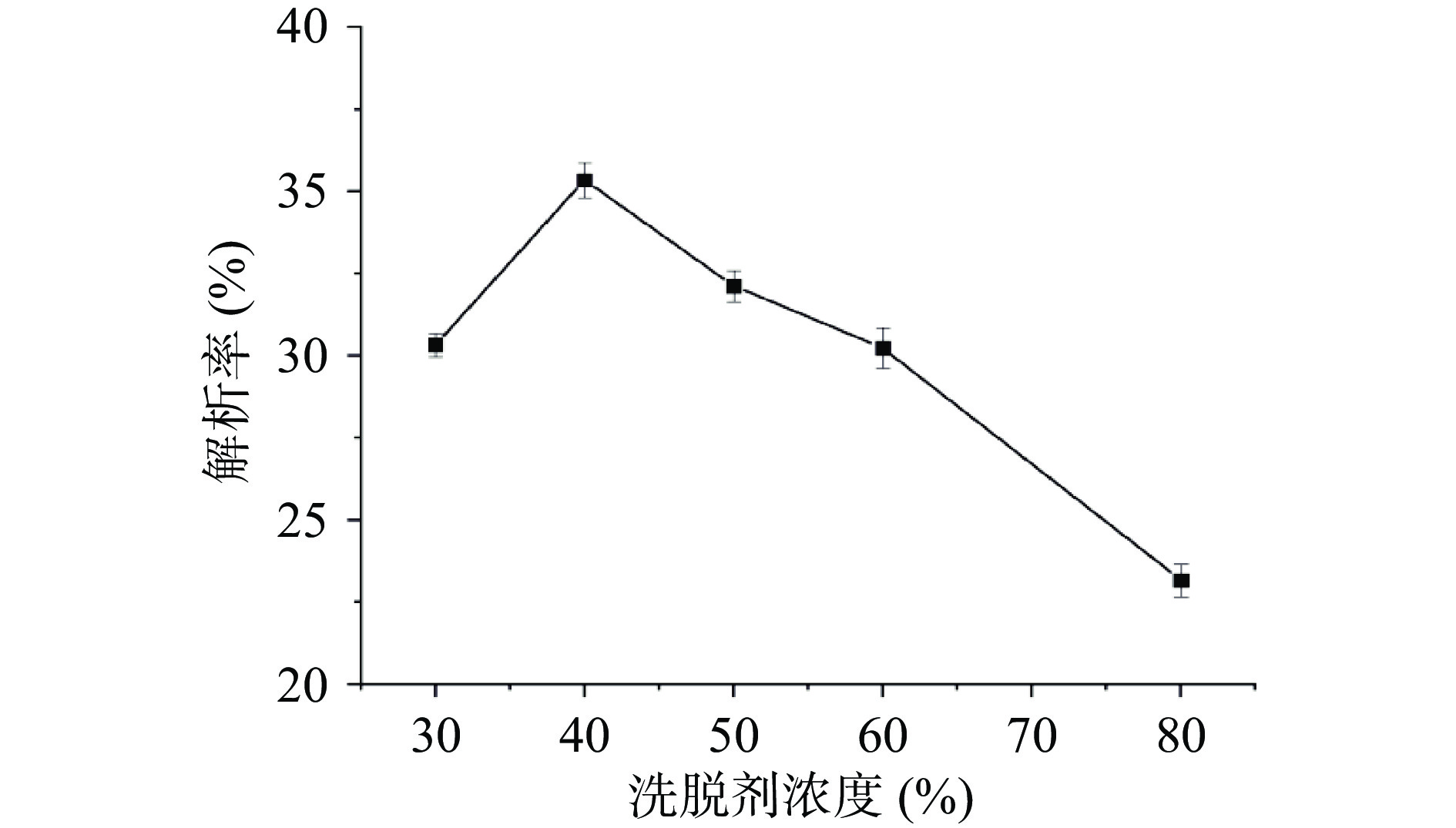
2.4.3 洗脱剂浓度对铜藻多酚解析能力的影响
以乙醇为解析溶剂,考察乙醇浓度对铜藻多酚解析能力的影响,如图6所示。随着乙醇浓度增大,乙醇浓度为40%时解析率达到最大,因为铜藻多酚的极性与40%乙醇溶液的极性相似,当乙醇浓度大于40%时,铜藻多酚的解析率明显下降,这可能是随着洗脱溶剂极性变化,杂质被洗脱下来,而多酚解析率明显下降[32]。因此,40%乙醇溶液是最佳的洗脱剂。
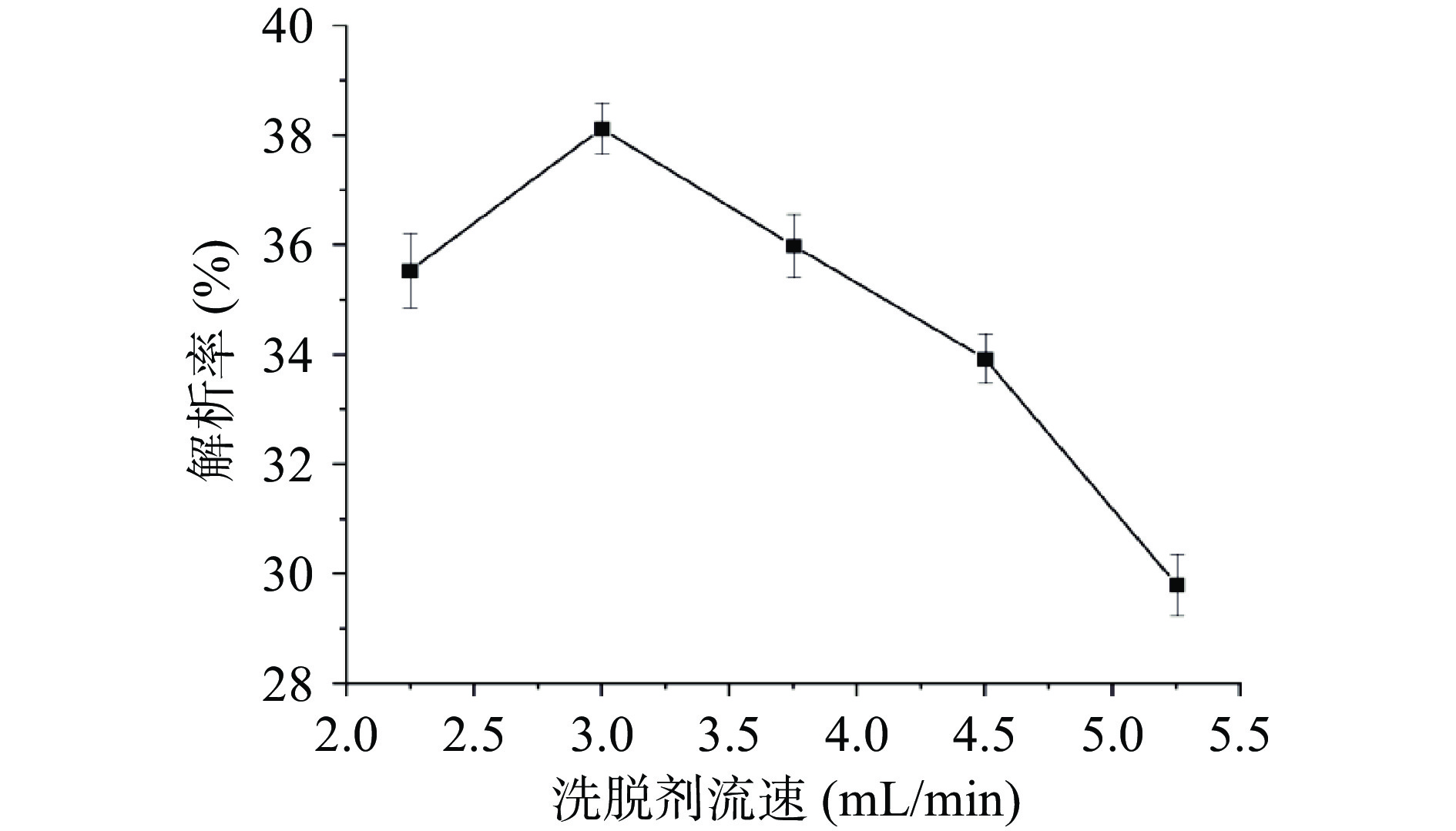
2.4.4 洗脱剂流速对铜藻多酚解析能力的影响
以40%乙醇溶液作为洗脱剂,洗脱剂流速对铜藻多酚解析能力的影响如图7所示。洗脱剂流速在2.25~3 mL/min范围内,流速对铜藻多酚解析率的影响不明显。当流速大于3 mL/min时,铜藻多酚解析率明显下降,这可能是因为解析剂与吸附的铜藻多酚接触时间短,铜藻多酚解析率随之下降[30]。因此洗脱剂流速为3 mL/min。
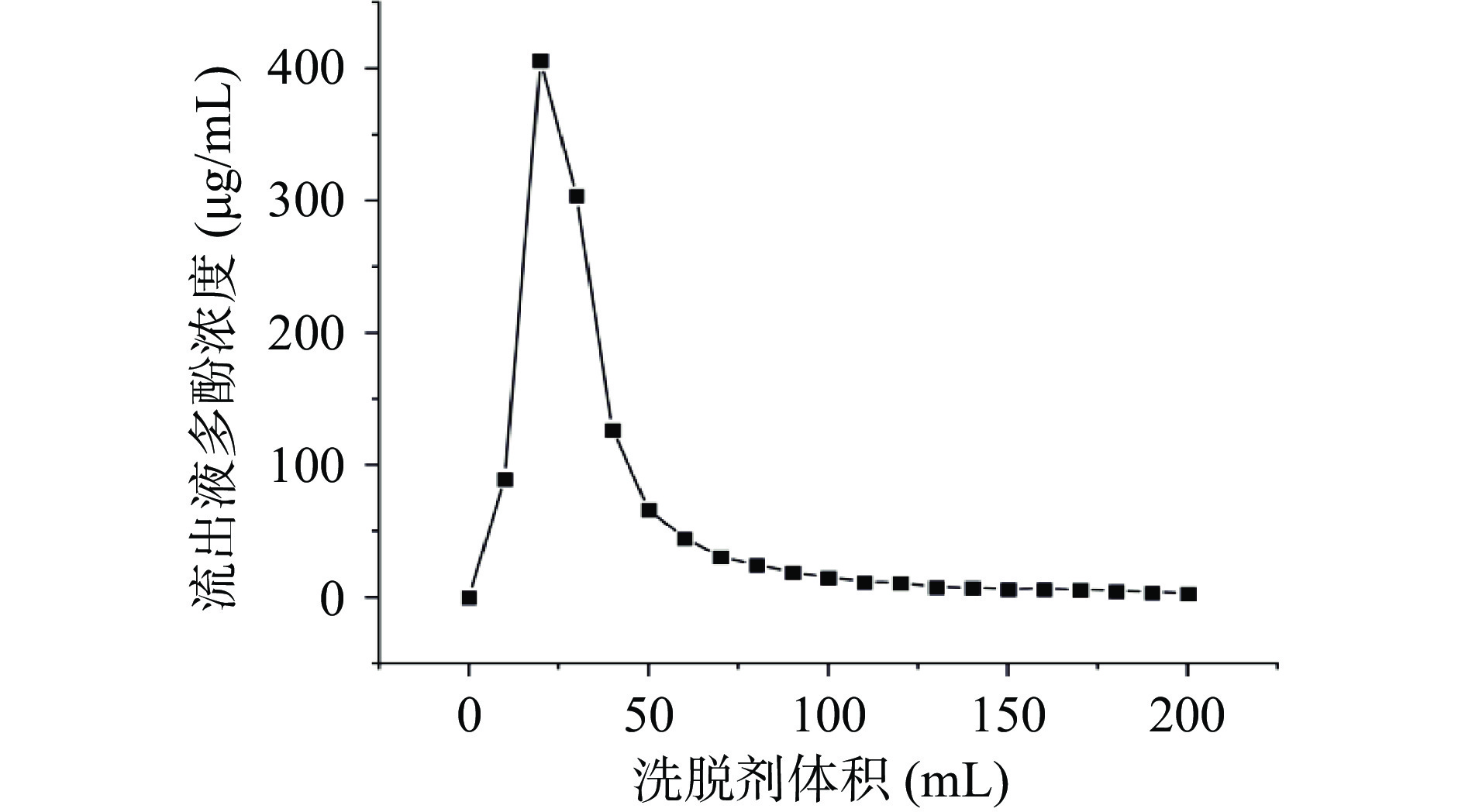
2.4.5 铜藻多酚洗脱曲线
LX-158树脂纯化铜藻多酚的洗脱曲线如图8所示。第2流份解析液中铜藻多酚的浓度达到最大,随后每个流份的多酚浓度逐渐降低,第12流份开始铜藻多酚的浓度几乎保持不变,之后流份的流出液中铜藻多酚的含量趋近于零,为了考虑成本和实验效率,选择舍弃剩余的铜藻多酚,确定洗脱剂的使用体积为120 mL。
2.5 铜藻多酚纯度测定
经LX-158大孔吸附树脂纯化后,铜藻多酚纯度从7.52%提高到40.31%,提高了4.36倍,说明LX-158型号的大孔吸附树脂可以有效提高铜藻多酚纯度。
2.6 LC-MS鉴定提取物中褐藻多酚的结构
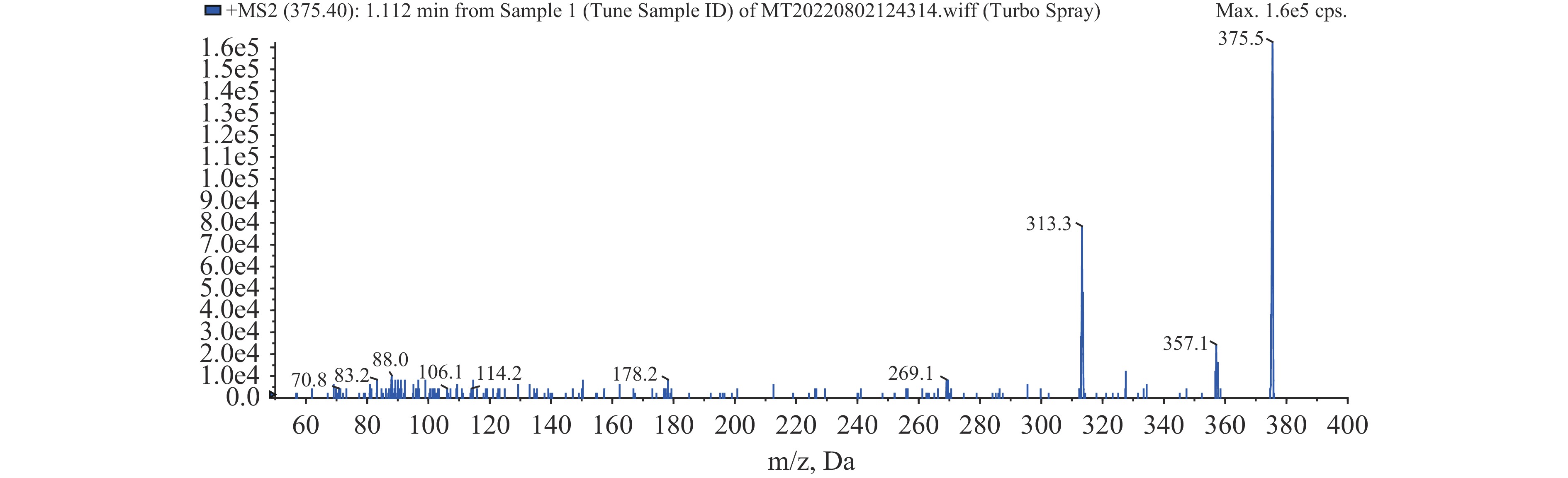
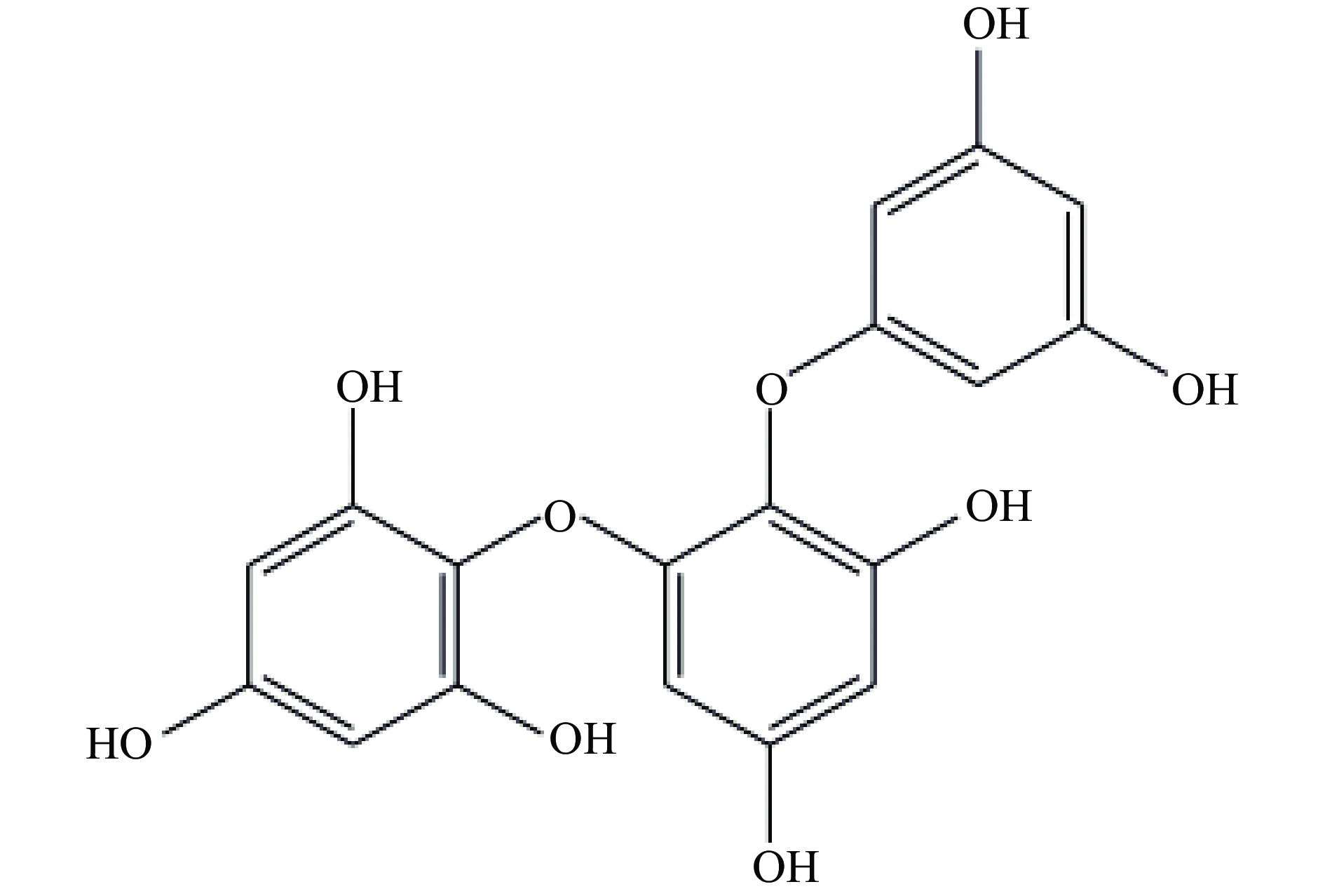
纯化后的铜藻多酚利用LC-MS进行分子量测定(如图9),正离子模式下分子离子峰为m/z375.5[M+H]+,查阅文献发现迄今已报道的分子量为374.3036的褐藻多酚有6个,分别是:Fucophlorethol-A、Fucophlorethol-B、Fucophlorethol-C、Triphlorethol A、Triphlorethol C、Trifucol[32-37]。Triphlorethol A是一种常见的三聚体,主要存在于马尾藻(Sargassum spinuligerum)[38-41]中,本研究铜藻是马尾藻属,初步推测该化合物是Triphlorethol A(如图10)。
2.7 铜藻总多酚含量测定及抗氧化活性研究
2.7.1 铜藻多酚DPPH自由基的清除率
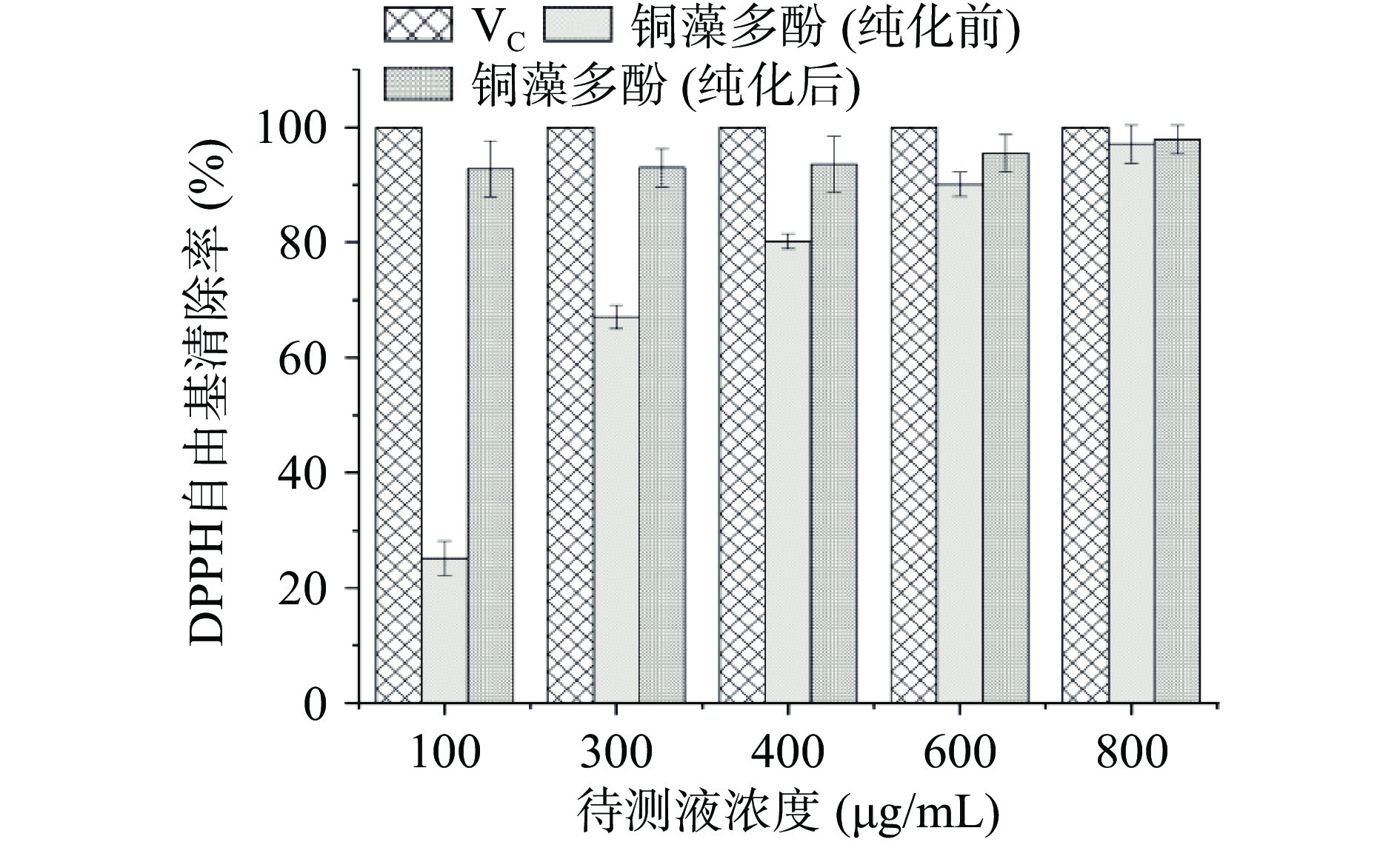
作为一种稳定的自由基,DPPH广泛应用于体外抗氧化活性的评价。以DPPH自由基清除率来表示不同浓度铜藻多酚样品对DPPH自由基的清除能力,实验结果见图11。由图可知,不同浓度的铜藻多酚对自由基的清除能力不同,对DPPH自由基清除率呈明显的剂量关系,随着铜藻多酚提取物浓度的增大,其对DPPH自由基的清除作用增强,并且纯化后的铜藻多酚的DPPH自由基的清除力明显高于纯化前,纯化后铜藻多酚浓度为100 μg/mL时,DPPH自由基清除率达到92%左右,IC50为6.60 μg/mL,说明随着铜藻多酚纯度提高,其抗氧化活性增高。
2.7.2 铜藻多酚ABTS自由基的清除率
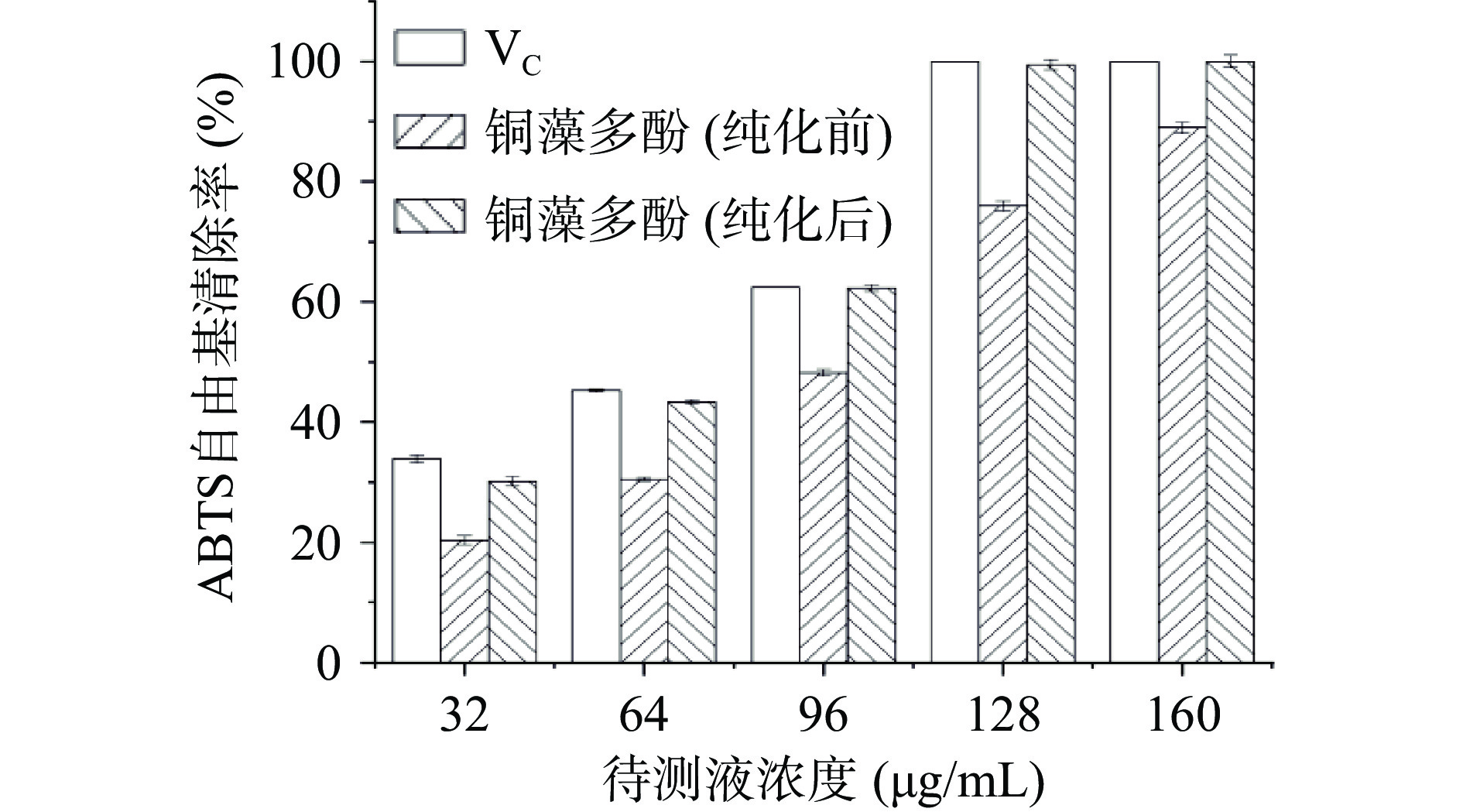
铜藻多酚可以抑制ABTS的氧化过程,在734 nm测定吸光值,计算出不同浓度铜藻多酚样品的ABTS自由基的清除率,实验结果见图12。由图可知,铜藻多酚提取物对ABTS自由基清除率呈明显的剂量关系,随着铜藻多酚提取物浓度的增大,对ABTS自由基的清除作用增强。纯化后铜藻多酚的ABTS自由基的清除能力与VC的清除能力接近,160 μg/mL纯化后铜藻多酚对自由基的清除率接近100%,表明铜藻多酚对ABTS自由基的清除能力较强,IC50为75.70 μg/mL。纯化后的铜藻多酚的ABTS自由基的清除力明显高于纯化前,说明随着铜藻多酚纯度提高,其抗氧化活性增高。
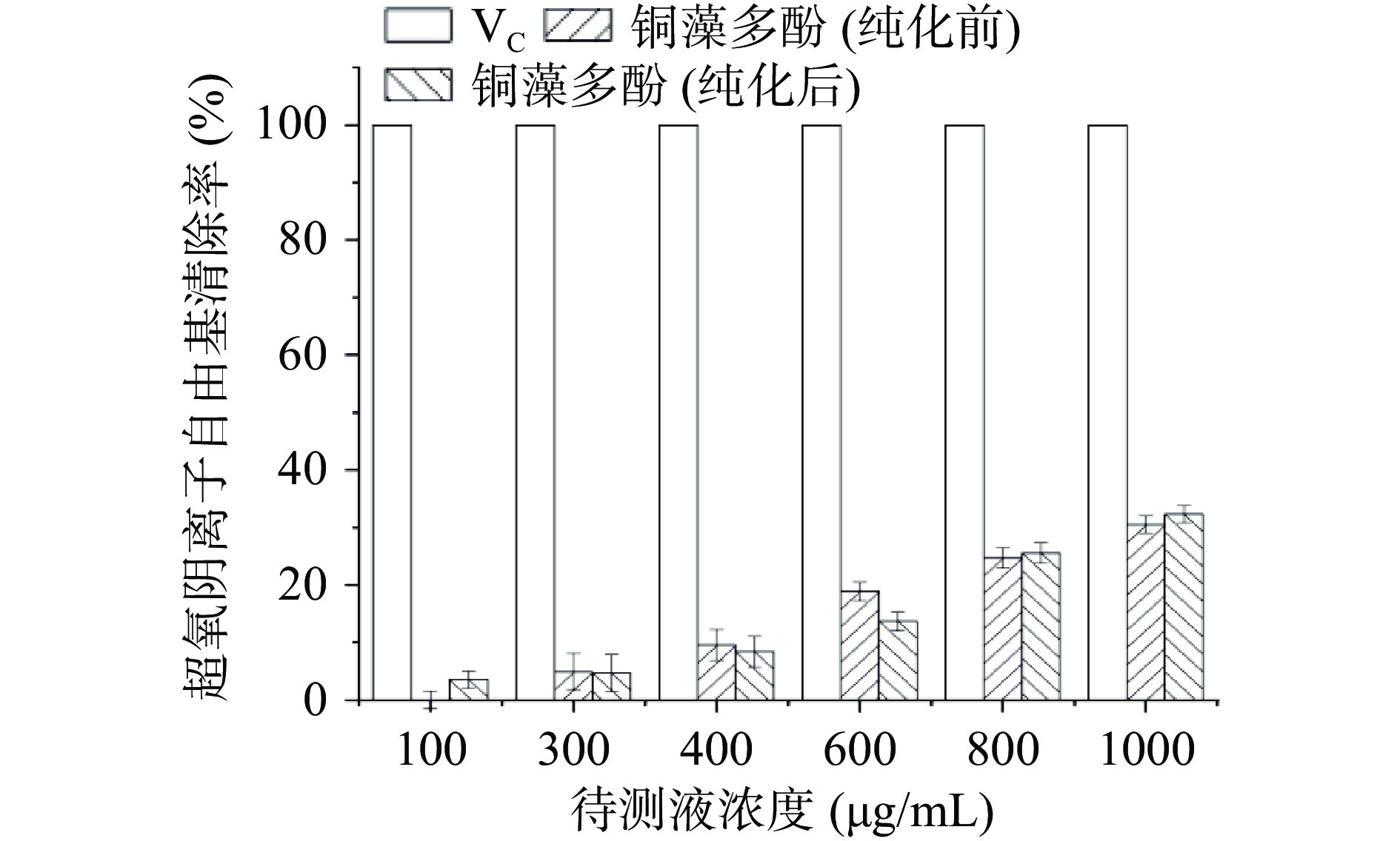
2.7.3 铜藻多酚超氧阴离子自由基的清除率
铜藻多酚能迅速与超氧阴离子反应,325 nm处的吸收峰减弱,测量300 s内吸光度变化的斜率,计算出铜藻多酚提取物对超氧阴离子自由基的清除率,实验结果见图13。由图可知,铜藻多酚对超氧阴离子有一定的清除能力,具有抗氧化活性,对超氧阴离子的清除率呈明显的剂量关系,IC50值为2.22 mg/mL。
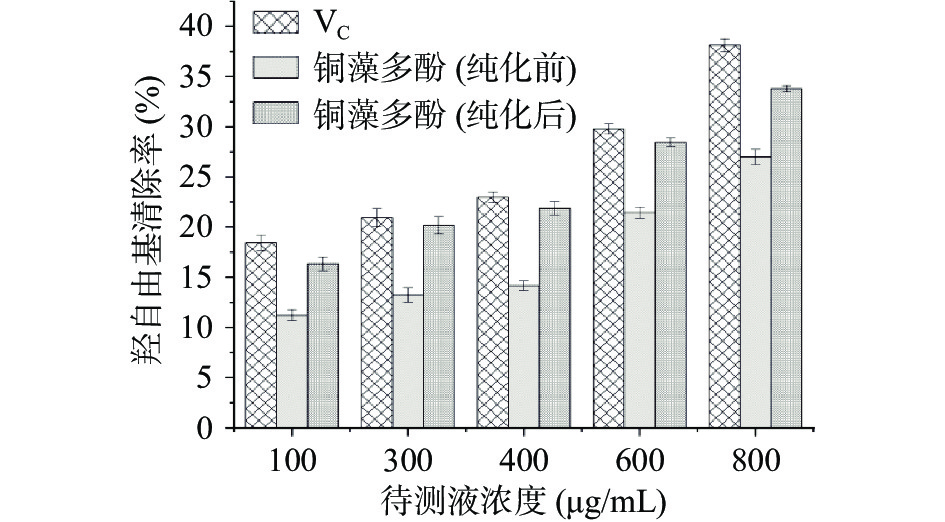
2.7.4 铜藻多酚羟自由基的清除率
Fenton反应在510 nm处有特殊吸收峰,向反应体系中加入铜藻多酚,能减少有色化合物的生成,在510 nm处测量吸光度值,计算被测物的羟自由基清除率,实验结果如图14,对羟自由基清除率依次为VC>纯化后铜藻多酚>纯化前铜藻多酚,铜藻多酚对羟自由基的清除率呈剂量依赖关系,随着铜藻多酚浓度增加,其清除能力逐渐增强。结果表明,铜藻多酚具有较高的羟自由基清除能力,略低于VC,IC50值为5.62 mg/mL。
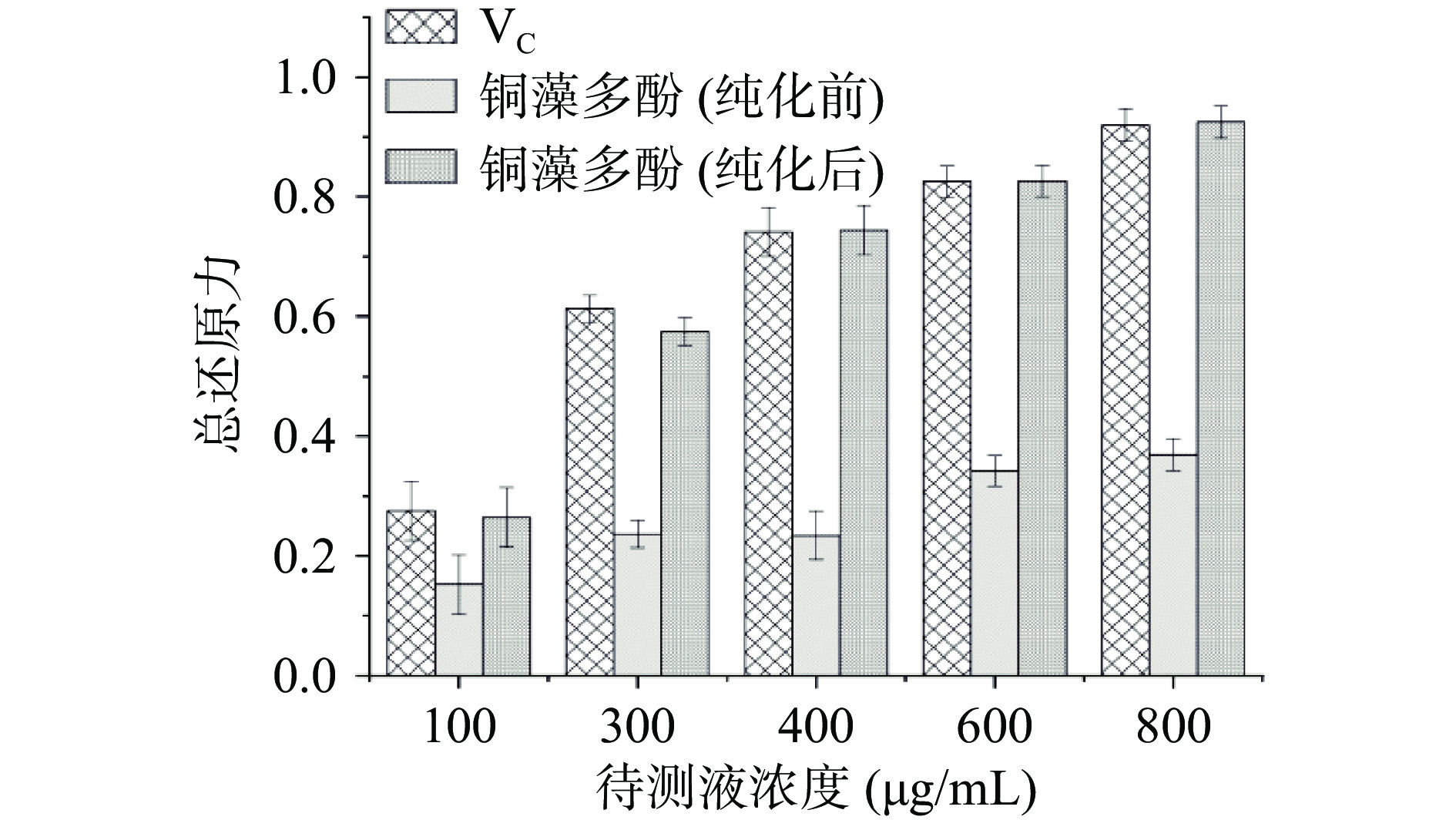
2.7.5 铜藻多酚Fe3+还原力
铜藻多酚具有一定的抗氧化活性,作为一种还原剂可以将铁氰化钾中的三价铁离子还原成二价铁离子(亚铁氰化钾),700 nm处测定的吸光度值反应了铜藻多酚的抗氧化能力,吸光度值越大,抗氧化能力越强,实验结果如图15。抗氧化能力依次是VC>纯化后铜藻多酚>纯化前铜藻多酚,经过大孔吸附树脂纯化,铜藻多酚的抗氧化活性增强,并且随着多酚浓度增加,抗氧化能力逐渐增强,纯化后铜藻多酚的抗氧化活性与VC接近。
3. 结论
大孔吸附树脂纯化铜藻多酚,在最优条件下,铜藻多酚的纯度从原来的7.52%提高到40.31%,提高了4.36倍,说明LX-158树脂可以有效提高铜藻多酚纯度。以VC为阳性对照,对铜藻多酚提取物的DPPH自由基、ABTS自由基、超氧阴离子自由基、羟基自由基的清除能力和Fe3+还原力进行测定,发现铜藻多酚具有很高的DPPH自由基、ABTS自由基、超氧阴离子自由基、羟基自由基的清除能力和Fe3+还原力,与VC接近,其IC50值分别为6.60 μg/mL、75.70 μg/mL、2.22 mg/mL、5.62 mg/mL,说明铜藻多酚具有显著的抗氧化功效。初步推测该化合物是Triphlorethol A。铜藻多酚是一种潜在的天然的抗氧化活性功能食品辅料,具有较高的开发利用价值,后续将对多酚的结构进一步研究。
-
表 1 11种大孔吸附树脂吸附和解析效果
Table 1 Effect of adsorption and desorption of 11 macroporous adsorption resins
树脂种类 吸附率
(%)吸附量
(mg/g)解析率
(%)解析量
(mg/g)X-15 35.33 2.48 62.10 1.54 LX-8 59.57 4.18 22.92 0.96 DM130 32.99 2.32 49.32 1.14 HP20 39.87 2.80 48.83 1.37 HI-816 52.00 3.65 67.62 2.47 NKA 26.82 1.88 47.13 0.89 NKA-9 53.16 3.73 77.07 2.88 AB-8 27.40 1.92 53.02 1.02 D101 39.41 2.77 51.25 1.42 D1400 30.78 2.16 50.98 1.10 LX-158 58.87 4.13 81.19 3.36 -
[1] 管华诗, 王曙光. 中华海洋本草[M]. 上海: 上海科学技术出版社, 2009 GUAN Huashi, WANG Shuguang. Chinese ocean materia medica[M]. Shanghai: Shanghai Science and Technology Press, 2009.
[2] 蔡佳宸, 耿慧霞, 孔凡洲, 等. 铜藻金潮对浒苔绿潮和几种赤潮原因种生长影响的模拟研究[J]. 海洋与湖沼,2019,50(5):1050−1058. [CAI Jiachen, GENG Huixia, KONG Fanzhou, et al. Simulation study on the effect of copper algae gold tide on the growth of Prolifera algae green tide and several species that cause red tide[J]. Ocean and Limnology,2019,50(5):1050−1058. [3] 王育信, 田晓清, 李骄洋, 等. 响应面优化铜藻(Sargassum horneri)中褐藻多酚的提取及其结构鉴定[J]. 食品工业科技,2018,39(16):143−149. [WANG Yuxin, TIAN Xiaoqing, LI Jiaoyang, et al. Response surface methodology to optimize the extraction and structure identification of brown algae polyphenols from Sargassum horneri[J]. Food Industry Science and Technology,2018,39(16):143−149. [4] 王庆玉. 产褐藻胶裂解酶菌株的筛选鉴定、产酶优化与铜藻发酵的初步研究[D]. 烟台: 烟台大学, 2021 WANG Qingyu. Screening and identification of alginate lyase-producing strains, enzyme production optimization and preliminary research on Sargassum horneri fermentation[D]. Yantai: Yantai University, 2021.
[5] 刘丽佳, 何淑婷, 姜露, 等. 铜藻粗多糖酶法提取工艺的优化及其抗氧化活性研究[J]. 浙江海洋学院学报(自然科学版),2013,32(6):503−507. [LIU Lijia, HE Shuting, JIANG Lu, et al. Optimization of the enzymatic extraction of Sargassum horneri crude polysaccharide and its antioxidant activity[J]. Journal of Zhejiang Ocean University (Natural Science Edition),2013,32(6):503−507. [6] 陈雅鑫, 何袅袅, 蔡树芸, 等. 铜藻中岩藻黄质提取及分离纯化工艺研究[J]. 食品工业科技,2022:1−14. [CHEN Yaxin, HE Niaoniao, CAi Shuyun, et al. Research on the extraction, separation and purification of fucoxanthin from Sargassum horneri[J]. Food Industry Science and Technology,2022:1−14. [7] ESSA H, FLEITA D, RIFAAT D, et al. Towards optimizing the conventional and ultrasonic-assisted extraction of sulfated polysaccharides from marine algae[J]. IOP Conference Series. Materials Science and Engineering,2018,464(1):12007.
[8] LEE J H, KIM H J, JEE Y, et al. Antioxidant potential of Sargassum horneri extract against urban particulate matter-induced oxidation[J]. Food Sci Biotechnol,2020,29(6):855−865. doi: 10.1007/s10068-019-00729-y
[9] KIM H J, HERATH K H I N, DINH D T T, et al. Sargassum horneri ethanol extract containing polyphenols attenuates PM-induced oxidative stress via ROS scavenging and transition metal chelation[J]. Journal of Functional Foods,2021,79:104401. doi: 10.1016/j.jff.2021.104401
[10] 赵树琪. 褐藻多酚Eckol抗肿瘤作用及机制研究[D]. 武汉: 武汉科技大学, 2018 ZHAO Shuqi. Antitumor effect and mechanism of brown algae polyphenol Eckol[D]. Wuhan: Wuhan University of Science and Technology, 2018.
[11] LEE J S, LEE H A, HAN J S. Sargassum sagamianum extract protects INS-1 pancreatic beta cells against high glucose-induced apoptosis[J]. Cytotechnology,2019,71(1):389−399. doi: 10.1007/s10616-019-00295-5
[12] LEE H A, LEE J H, HAN J S. A phlorotannin constituent of Ecklonia cava alleviates postprandial hyperglycemia in diabetic mice[J]. Pharm Biol,2017,55(1):1149−1154. doi: 10.1080/13880209.2017.1291693
[13] SUZUKI A, SAEKI T, IKUJI H, et al. Brown algae polyphenol, a prolyl isomerase Pin1 inhibitor, prevents obesity by inhibiting the differentiation of stem cells into adipocytes[J]. PLoS One,2016,11(12):168830.
[14] 刘春平. 铜藻中植物甾醇类成分的提取与分离方法研究[D]. 杭州: 浙江工商大学, 2017 LIU Chunping. Study on the extraction and separation methods of phytosterols from Sargassum horneri[D]. Hangzhou: Zhejiang Technology and Business University, 2017.
[15] 彭荣. 疏水色谱膜分离纯化植物源药物的研究[D]. 北京: 北京化工大学, 2016 PENG Rong. Hydrophobic chromatography membrane separation and purification of plant-derived drugs[D]. Beijing: Beijing University of Chemical Technology, 2016.
[16] 李斌. 海带岩藻黄素与褐藻多酚提取制备工艺的研究[D]. 厦门: 集美大学, 2015 LI Bin. Study on the extraction and preparation process of fucoxanthin and brown algae polyphenols from kelp[D]. Xiamen: Jimei University, 2015.
[17] OVCHINNIKOV D V, BOGOLITSYN K G, DRUZHININA A S, et al. Study of polyphenol components in extracts of arctic brown algae of fucus vesiculosus type by liquid chromatography and mass-spectrometry[J]. Journal of Analytical Chemistry,2020,75(5):633−639. doi: 10.1134/S1061934820050147
[18] 彭毓敏, 朱峰, 周炎, 等. 利用制备液相色谱系统分离中药槐花米中的芦丁[J]. 佛山科学技术学院学报(自然科学版),2020,38(3):60−64. [PENG Yumin, ZHU Feng, ZHOU Yan, et al. Separation of rutin from traditional Chinese medicine Sophora japonica by preparative liquid chromatography system[J]. Journal of Foshan University of Science and Technology (Natural Science Edition),2020,38(3):60−64. [19] 李月, 纪乃茹, 李健, 等. 红毛藻多酚提取工艺优化及抗氧化活性[J]. 食品工业科技,2021,42(7):156−161. [LI Yue, JI Nairu, LI Jian, et al. Extraction process optimization and antioxidant activity of polyphenols from red algae[J]. Food Industry Science and Technology,2021,42(7):156−161. [20] 杨玉莹, 王倩, 郝豪奇, 等. 海带多酚的提取分离纯化及其体外活性[J]. 生物加工过程,2018,16(6):52−56. [YANG Yuying, WANG Qian, HAO Haoqi, et al. Extraction, purification and in vitro activity of kelp polyphenols[J]. Bioprocessing,2018,16(6):52−56. [21] BSY A, YP B, ZA C, et al. Optimization of ultrasound-assisted extraction of bioactive compounds from Achillea kellalensis using response surface methodology[J]. Journal of Applied Research on Medicinal and Aromatic Plants,2021:100355.
[22] ZHANG X, WANG R, ZHAO Y, et al. Separation and purification of flavonoids from polygonum cuspidatum using macroporous adsorption resin[J]. Pigment & Resin Technology,2021,50(6):574−584.
[23] 栾浩, 周剑丽, 屈午, 等. 蓝莓果渣花色苷大孔树脂纯化工艺研究[J]. 中国酿造,2021,40(12):138−143. [LUAN Hao, ZHOU Jianli, QU Wu, et al. Purification of anthocyanins from blueberry pomace by macroporous resin[J]. China Brewing,2021,40(12):138−143. [24] 段海霞, 林云霞, 张金荣, 等. Folin-Ciocalteu比色法测定铜藻中褐藻多酚含量的研究[J]. 天然产物研究与开发,2015,27(8):1374−1378. [DUAN Haixia, LIN Yunxia, ZHANG Jinrong, et al. Determination of brown algae polyphenols in Sargassum horneri by Folin-Ciocalteu colorimetric method[J]. Natural Products Research and Development,2015,27(8):1374−1378. [25] PATRÍCIA V. Phlorotannin extracts from fucales characterized by HPLC-DAD-ESI-MSn: Approaches to hyaluronidase inhibitory capacity and antioxidant properties[J]. Marine Drugs,2012,10(12):2766−2781. doi: 10.3390/md10122766
[26] 张怡评, 杨婷, 洪专, 等. 青钱柳多酚提取工艺及抗氧化活性[J]. 食品工业,2021,42(6):212−216. [ZHANG Yiping, YANG Ting, HONG Zhuan, et al. Extraction process and antioxidant activity of polyphenols from P. chinensis[J]. Food Industry,2021,42(6):212−216. [27] TANG Q, HUANG G. Preparation and antioxidant activities of cuaurbit polysaccharide[J]. International Journal of Biological Macromolecules,2018,117:362−365. doi: 10.1016/j.ijbiomac.2018.05.213
[28] LI Y Z, WANG P, ZHOU H, et al. Extraction, characterization and in vitro antioxidant activity of polysaccharides from Carex meyeriana Kunth using different methods[J]. International Journal of Biological Macromolecules,2018,120(Pt B):2155−2164.
[29] 李爽, 赵宏, 王宇亮, 等. 蒲公英多糖乙酰化修饰、体外抗氧化及抑菌作用研究[J]. 食品工业科技,2022,43(3):18−25. [LI Shuang, ZHAO Hong, WANG Yuliang, et al. Study on acetylation modification in vitro antioxidant and antibacterial effects of dandelion polysaccharide[J]. Food Industry Science and Technology,2022,43(3):18−25. [30] 马景蕃, 谢晓倩, 杨昊坤, 等. 大孔树脂纯化白背天葵多酚及其体外抗氧化研究[J]. 热带作物学报,2021,42(2):575−582. [MA Jingfan, XIE Xiaoqian, YANG Haokun, et al. Purification of polyphenols from Begonia alba by macroporous resin and its antioxidant activity in vitro[J]. Journal of Tropical Crops,2021,42(2):575−582. [31] 吕成林, 汪秋宽, 宋悦凡, 等. 羊栖菜多酚的提取及纯化工艺研究[J]. 食品工业科技,2014,35(22):231−235, 240. [LÜ Chenglin, WANG Qiukuan, SONG Yuefan, et al. Study on the extraction and purification process of hijiki polyphenols[J]. Food Industry Science and Technology,2014,35(22):231−235, 240. [32] 袁欢, 彭莉莎, 孙梦瑶, 等. 大孔树脂对二角菱壳多酚的吸附及解吸性能研究[J]. 食品与机械,2021,37(4):47−52. [YUAN Huan, PENG Lisha, SUN Mengyao, et al. Study on the adsorption and desorption properties of macroporous resin for dihedral shell polyphenols[J]. Food and Machinery,2021,37(4):47−52. [33] MONTERO L, HERRERO M, ELENA I, et al. Separation and characterization of phlorotannins from brown algae Cystoseira abies-marina by comprehensive two-dimensional liquid chromatography[J]. Electrophoresis,2014,35(11):1644−1651. doi: 10.1002/elps.201400133
[34] 胡湘蜀, 寇兴然, 苏建辉, 等. 液质联用法同时测定茶多酚中17种多酚物质[J]. 分析试验室,2015,34(7):822−826. [HU Xiangshu, KOU Xingran, SU Jianhui, et al. Simultaneous determination of 17 polyphenols in tea polyphenols by liquid chromatography-mass spectrometry[J]. Analytical Laboratory,2015,34(7):822−826. [35] KURIHARAA H, KONNOA R, TAKAHASHIA K. Fucophlorethol C, aphlorotannin as a lipoxygenase inhibitor[J]. Biosci Biotechnol Biochem,2015,79(12):1954−1956. doi: 10.1080/09168451.2015.1062716
[36] KOCH M, GLOMBITZAA K W, ECKHARDB G. Phlorotannins of phaeophycea Laminaria ochroleuca[J]. Phytochemistry,1980,19(8):1821−1823. doi: 10.1016/S0031-9422(00)83820-0
[37] KIM S, KANG K, JEON J S, et al. Isolation of phlorotannins from eisenia bicyclis and their hepatoprotective effect against oxidative stress induced by tert-butyl hyperoxide[J]. Applied Biochemistry and Biotechnology,2011,165(5-6):1296−1307. doi: 10.1007/s12010-011-9347-3
[38] SAILLER B, GLOMBITZA K W. Halogenated phlorethols and fucophlorethols from the brown alga Cystophora retroflexa[J]. Natural Toxins,1999,7(2):57−62. doi: 10.1002/(SICI)1522-7189(199903/04)7:2<57::AID-NT42>3.0.CO;2-F
[39] JUNG H A, HYUN S K, KIM H R, et al. Angiotensin-converting enzyme I inhibitory activity of phlorotannins from Ecklonia stolonifera[J]. Fisheries Science,2006,72(6):1292−1299. doi: 10.1111/j.1444-2906.2006.01288.x
[40] KW G, M K. Fuhalols and deshydroxyfuhalols from the brown alga Sagassum spinuligerum[J]. Phytochemistry,1995,38(4):987−995. doi: 10.1016/0031-9422(94)00735-C
[41] KANG K A, LEE K H, CHEA S, et al. Triphlorethol A from Ecklonia cava protects V79-4 lung fibroblast against hydrogen peroxide induced cell damage[J]. Free Radical Research,2005,39(8):883−892. doi: 10.1080/10715760500161165
-
期刊类型引用(3)
1. 吴彤,盛亚男,田禹,王长远. 绿豆多酚的提取纯化、成分鉴定及抗氧化活性研究. 中国粮油学报. 2024(11): 96-104 .  百度学术
百度学术
2. 孟沛艺,房景辉,王强,汪文俊. 水深对铜藻光合作用、营养组成和氮磷吸收的影响. 海洋学报. 2024(11): 65-74 .  百度学术
百度学术
3. 刘雯,车心怡,马志超,刘舒,任丹丹,汪秋宽,何云海,王俊峰. 铜藻岩藻聚糖硫酸酯的结构组成及降血脂作用. 大连海洋大学学报. 2023(02): 323-330 .  百度学术
百度学术
其他类型引用(3)













 下载:
下载:
 下载:
下载:



