Extraction and Purification of Intracellular Polysaccharide from Schizophyllum commune and Its Biological Activity
-
摘要: 为提高裂褶菌胞内多糖得率,并研究裂褶菌多糖纯化组分的生物活性,本研究采取超声波破碎和热水浸提相结合的方法提取裂褶菌胞内粗多糖,利用响应面法对提取条件进行优化,通过DEAE-52离子交换柱层析和Sephadex G-100凝胶柱层析对提取的粗多糖进行分离纯化,并进行结构表征、抗氧化性和抑菌性试验。结果表明,裂褶菌胞内粗多糖的最优提取条件为:提取温度90 ℃,水料比30:1,超声时间30 min,超声功率230 W,裂褶菌胞内粗多糖得率达到了18.14%±0.33%。纯化多糖组分NSPG-1为β型吡喃糖,分子量为1.05×106 Da,NSPG-1多糖具有较好的抗氧化性和抑菌性,其对DPPH自由基、羟基自由基和超氧阴离子自由基的IC50值分别为6.97、1.07和11.41 mg/mL,对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的IC50值分别为7.56、12.54和10.42 mg/mL。本研究结果为裂褶菌多糖的工业化生产和开发利用提供了基础。Abstract: In order to improve the extraction rate of crude polysaccharide from Schizophyllum mycelium and explore the biological activity of purified intracellular polysaccharide, this study adopted the method of ultrasonic-assisted hot water extraction to extract intracellular crude polysaccharide from Schizophyllum mycelium and the extraction process was optimized by response surface method. On this basis, DEAE-52 ion-exchange column and Sephadex G-100 dextran gel column chromatography were used to separate and purify the crude polysaccharide, and then the structural characterization, antioxidant capacity and antibacterial activity of the purified polysaccharide were carried out. Results showed that the optimal extraction conditions of intracellular crude polysaccharides were as follows: Under the extraction temperature of 90 ℃, the water-material ratio 30:1, the ultrasonic time 30 min, the ultrasonic power 230 W. Under these conditions, the extraction rate of intracellular crude polysaccharide was 18.14%±0.33%. The purified polysaccharide fraction NSPG-1 was a β-pyranose sugar with the molecular weight of 1.05×106 Da. NSPG-1 had good antioxidant capacity and the IC50 values for DPPH radical, hydroxyl radical and superoxide anion radical were 6.97 1.07 and 11.41 mg/mL, respectively. NSPG-1 had good antibacterial activity and the IC50 values against Escherichia coli, Bacillus subtilis and Staphylococcus aureus were 7.56, 12.54 and 10.42 mg/mL, respectively. The results would provide a basis for the industrial production and utilization of Schizophyllan.
-
裂褶菌(Schizophyllum commune Fr.)又名鸡毛菌、白花、白参,属于裂褶菌科、裂褶菌属[1],其质地柔嫩,味道鲜美,是一种非常珍贵的可食用真菌,具有滋补强身的作用[2]。
裂褶菌多糖(SPG)也称裂褶菌素,是裂褶菌生物活性物质中最重要的成分之一,具有抗肿瘤性[3]、抗疲劳[4]、调节免疫功能[5-6]等功能,在食品、生物与医药等领域的应用前景十分广泛。SPG来源于子实体、菌丝体或发酵液,分胞内多糖与胞外多糖[7-8],具有独特的β-(1,6)分支的β-(1,3)-D葡聚糖结构[9],分子量从4万到10万不等。研究表明分子量和多糖的三维结构对其生物学活性具有重要影响。分子量大于100000的裂褶菌多糖活性较高,在水溶液中具备三股螺旋结构;而分子量小于50000的不具备三股螺旋结构的,没有抗肿瘤活性[10]。国内对裂褶菌的研究起步较晚,且主要集中在裂褶菌营养生理和人工栽培上,裂褶菌多糖的研究与国外存在一起差距[11]。
食用菌多糖提取主要有热水浸提法、碱浸提法、酶法、超声波法、微波法等[12],热水浸提法使用最为广泛,但存在耗时久、得率不高等问题[13]。超声波法是利用超声波的机械破碎和空化作用使细胞壁破裂,从而加速内容物向溶剂扩散的一种技术[14]。与传统方法相比较,超声提取法具有操作简单、提取率高,对设备要求较低,提取耗时短等特点,在真菌多糖的工业生产中有较大应用潜力[15]。
本文通过超声辅助热水提取法从裂褶菌菌丝体中提取胞内多糖,并优化其提取工艺,对胞内多糖进行分离纯化,并探究纯化后多糖组分的体外抗氧化性和抑菌性,以期为裂褶菌多糖相关的保健品和食品的研发提供参考。
1. 材料与方法
1.1 材料与仪器
裂褶菌 由中国农业大学烟台研究院食用菌实验室选育、分离,于4 ℃保藏;AB-8大孔树脂、DEAE-52离子交换基质 莱特新材料科技公司;Sephadex G-100葡聚糖凝胶、Tris-HCl、葡聚糖T-series标品、抗坏血酸 西格玛上海贸易公司;水杨酸、邻苯三酚 博奥拓达科技公司;DPPH 源叶生物科技有限公司;马铃薯葡萄糖琼脂(PDA)、马铃薯葡萄糖肉汤(PDB) 杭州微生物试剂有限公司。
KQ-500DE超声波清洗器 昆山市超声仪器有限公司;CR21GⅢ高速离心机 Hitachi Koki公司;BS200S精密电子天平 德国Sartorius公司;Agilent 1206高效液相色谱仪 Agilent 科技设备公司;TU-1810PU紫外分光光度计 北京普析通用仪器厂;Paragon 1000PC红外光谱仪 Perkin-Elmer股份有限公司。
1.2 实验方法
1.2.1 裂褶菌胞内多糖提取工艺优化
1.2.1.1 裂褶菌胞内多糖提取工艺
将裂褶菌接种到PDA平板上,25 ℃培养3~5 d。打取4个菌丝块,接种到PDB培养基中,25 ℃、160 r/min培养5 d。发酵液6000 r/min离心10 min,收集沉淀。用蒸馏水洗涤三次,放置50 ℃烘箱中烘干至恒重,得裂褶菌菌丝体。将裂褶菌菌丝体粉碎,过40目筛。取适量裂褶菌粉末加入一定比例的水溶解,超声处理,处理完毕后将其放置于90 ℃恒温水浴锅中浸提2 h。6000 r/min离心10 min,取上清液,利用AB-8大孔树脂[16-17]除蛋白质和色素,减压浓缩至原体积的1/3,4 ℃醇沉过夜[18],冷冻干燥,得裂褶菌胞内多糖。计算裂褶菌胞内粗多糖得率。
多糖得率计算公式如下:
Z(%,w/w)=YY0×100 式中:Z—裂褶菌多糖的得率,%;Y—烘干所得裂褶菌多糖的质量,g;Y0—裂褶菌菌丝体粉末的质量,g。
1.2.1.2 单因素实验
裂褶菌粉末10 g,超声时间20 min,超声功率180 W,设置水料比为15:1、20:1、25:1、30:1、35:1,考察料水比对胞内粗多糖得率的影响。
裂褶菌粉末10 g,水料比25:1,超声功率180 W,设置超声时间为15、20、25、30、35 min,考察超声时间对胞内粗多糖得率的影响。
裂褶菌粉末10 g,水料比25:1,超声时间30 min,设置超声功率为60、120、180、240、300 W,考察超声功率对胞内粗多糖得率的影响。
1.2.1.3 响应面法优化裂褶菌胞内多糖提取工艺
根据Box-Behnken的中心组合实验设计原理[19]和单因素实验所产生的结果,采用Design Expert设计响应面优化因素水平表(见表1),实验三因素分别用A、B、C表示,每个因素的三水平由低到高分别用
−1 、0、1表示。表 1 响应面试验因素与水平设计Table 1. Factors and levels of response surface experiment水平 A 水料比
(mL:g)B 超声时间
(min)C 超声功率(W) −1 20:1 25 180 0 25:1 30 240 1 30:1 35 300 1.2.2 裂褶菌胞内多糖的分离纯化
1.2.2.1 裂褶菌胞内多糖DEAE-52离子交换柱层析
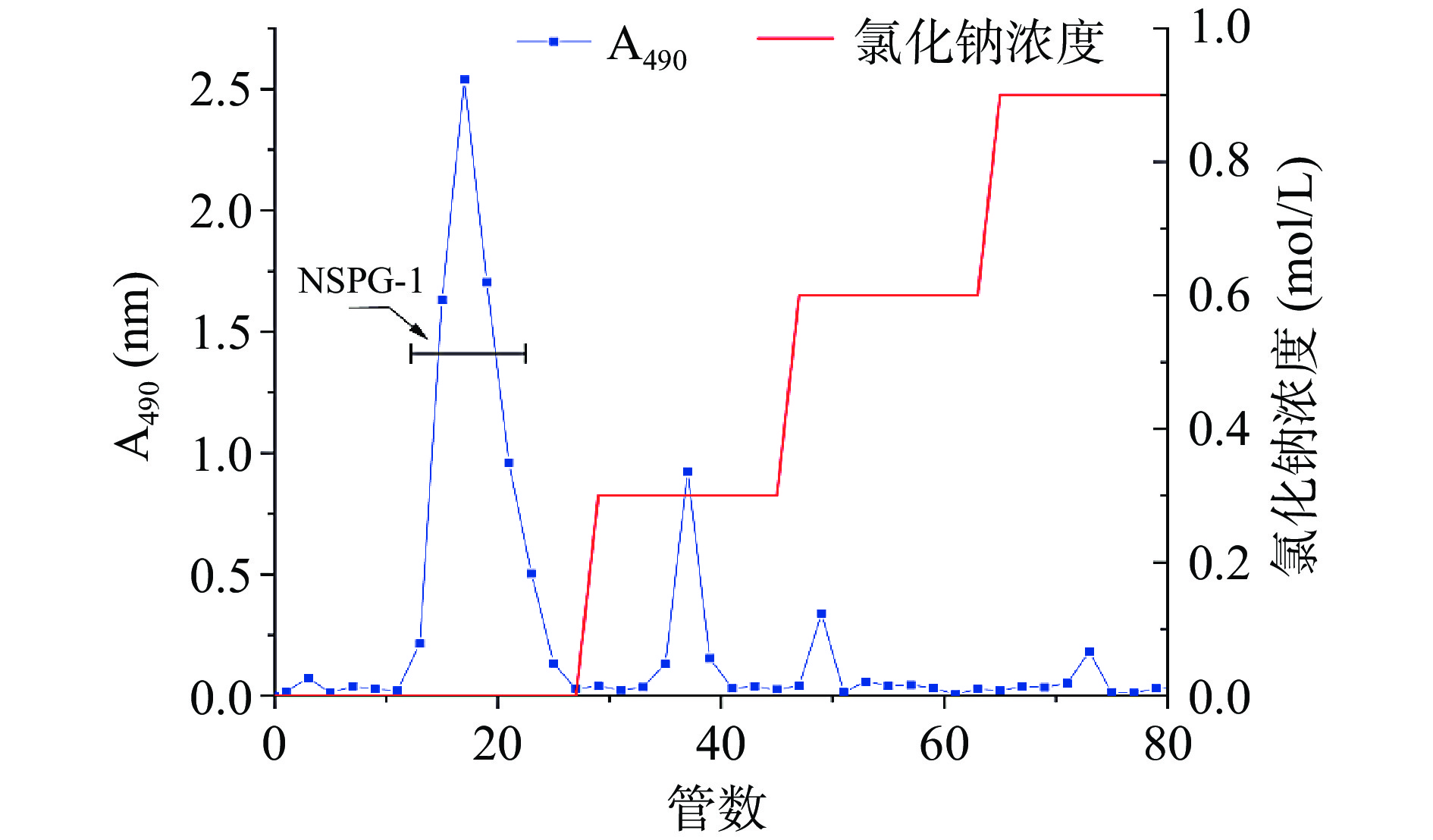
准确称取样品30.0 mg,溶于 8 mL 0.02 mol/L pH=7.4的Tris-HCl缓冲液中,用0.45 µm的滤膜过滤。之后上样,先用 100 mL 0.02 mol/L的Tris-HCl缓冲液洗脱,依次用浓度0、0.3、0.6、0.9 mol/L NaCl的缓冲液洗脱,洗脱速度2 mL/min,4 mL/管收集。用苯酚-硫酸法[20]测定样品中的糖含量,以洗脱管数为横坐标,490 nm处吸光度值为纵坐标,绘制洗脱曲线,根据洗脱曲线收集洗脱峰,冷冻干燥后保存。
1.2.2.2 裂褶菌胞内多糖Sephadex G-100葡聚糖凝胶柱层析
将10 mg经过离子交换柱层析的多糖样品溶于4 mL去离子水中,用0.45 µm滤膜过滤后上样,然后用200 mL去离子水洗脱,流速为1 mL/min,每管收集3 mL,用苯酚-硫酸法每管检测,绘制洗脱曲线,收集洗脱峰,冷冻干燥后保存。
1.2.2.3 裂褶菌胞内多糖纯度鉴定及分子量测定
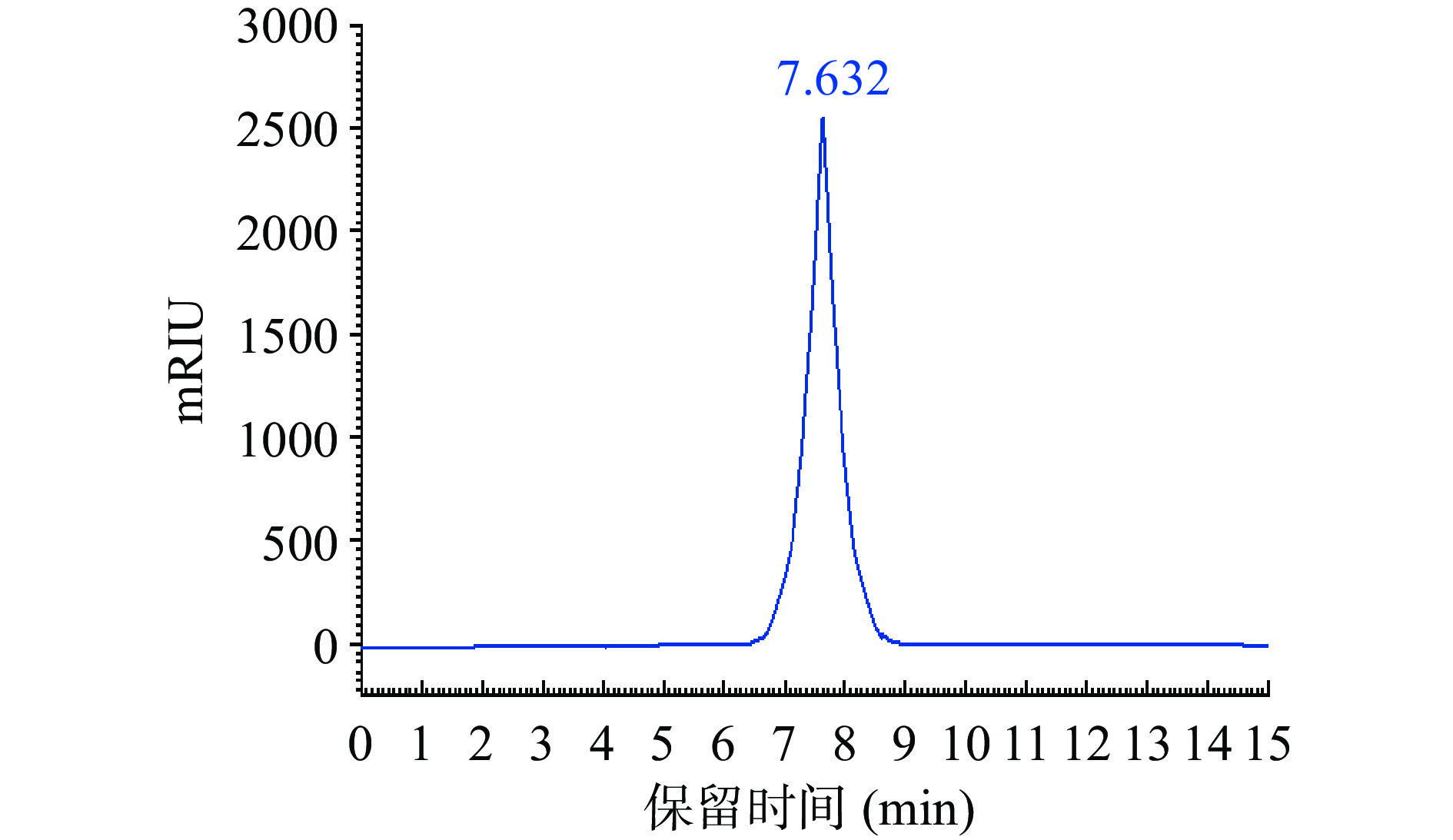
根据高效体积排阻色谱法(HPSEC-RID)[21],对洗脱出的裂褶菌胞内多糖组分进行纯度检验与分子量测定。检测条件如下:高效液相色谱仪Agilent 1206;色谱柱:AgiLent GPC Columns PL MIXED-M(8 μm、300 mm×7.5 mm);检测器:示差折光检测器;流动相:去离子水;工作参数:柱温30 ℃、进样量20 μL,流速1.0 mL/min。
用不同分子量的葡聚糖作为标准品,以保留时间为横坐标,与其对应分子量的对数lg(Mw)为纵坐标,绘制标准曲线;追踪裂褶菌胞内多糖在色谱柱中的保留时间,根据标准曲线计算其分子量。标准曲线为:lg(Mw)=−1.2577x+12.61(n=7,R2=0.9971)。
1.2.2.4 裂褶菌胞内多糖紫外光谱扫描
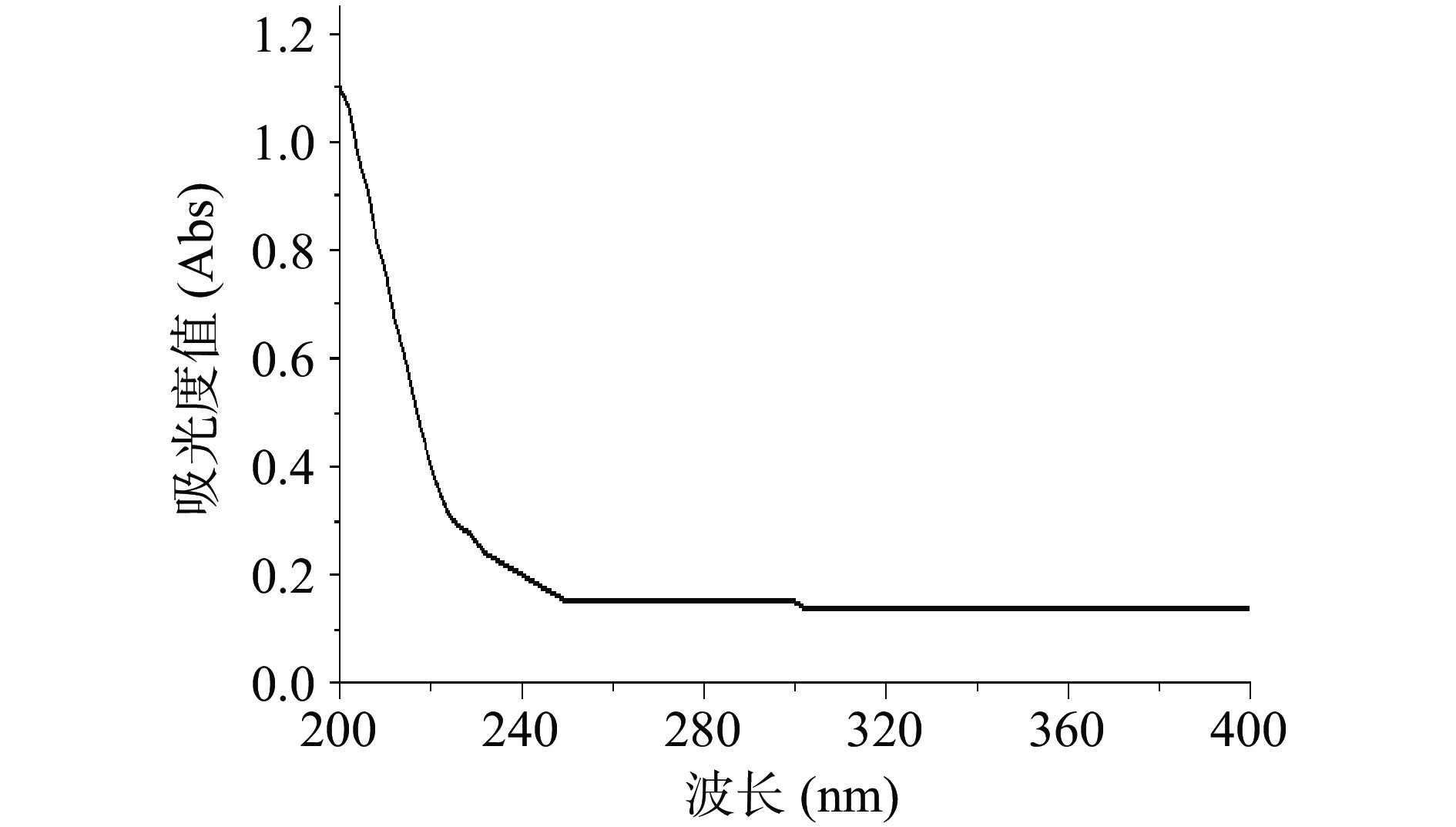
将分离纯化并且干燥好的裂褶菌胞内多糖配制成1.0 mg/mL的溶液,以超纯水为空白对照,在190~400 nm处进行紫外光谱全波长扫描,观察扫描图谱在260和280 nm是否出现吸收峰的情况[22]。
1.2.2.5 裂褶菌胞内多糖红外光谱扫描
准确称取分离纯化后的裂褶菌胞内多糖样品2.0 mg,加入100.0 mg烘干的KBr,在玛瑙研钵中进行充分研磨,然后压片,压力为18 MPa,维持时间5~10 min,将压片置于傅里叶红外光谱仪中在4000~400 cm−1范围内进行扫描[23]。
1.2.3 裂褶菌胞内多糖生物活性探究
1.2.3.1 裂褶菌胞内多糖抗氧化性测定
分别配制1、2、3、4、5 mg/mL的裂褶菌胞内多糖NSPG-1和抗坏血酸(VC)溶液,参照文献[24-26]检测裂褶菌胞内多糖NSPG-1对DPPH自由基、羟基自由基和超氧阴离子自由基的清除率,计算IC50。
1.2.3.2 裂褶菌胞内多糖抑菌性测定
取OD值为0.4~0.6的大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的稀释液8 mL,添加0.625、1.25、2.5、5、10 mg/mL的NSPG-1多糖溶液0.5 mL,以青霉素为对照,37 ℃培养12 h,测定抑菌性,计算IC50[27-28]。
1.3 数据处理
各项指标进行3次独立重复试验,实验结果以平均值±标准差表示。采用Microsoft Excel 2016对数据进行处理,采用IBM SPSS Statistics 23对数据进行ANOVA方差分析,显著水平设为P<0.05;采用Origin 2018进行图形的绘制,不同的字母表示各组间存在显著差异。
2. 结果与分析
2.1 裂褶菌胞内多糖提取工艺优化
2.1.1 不同单因素对裂褶菌胞内多糖得率的影响
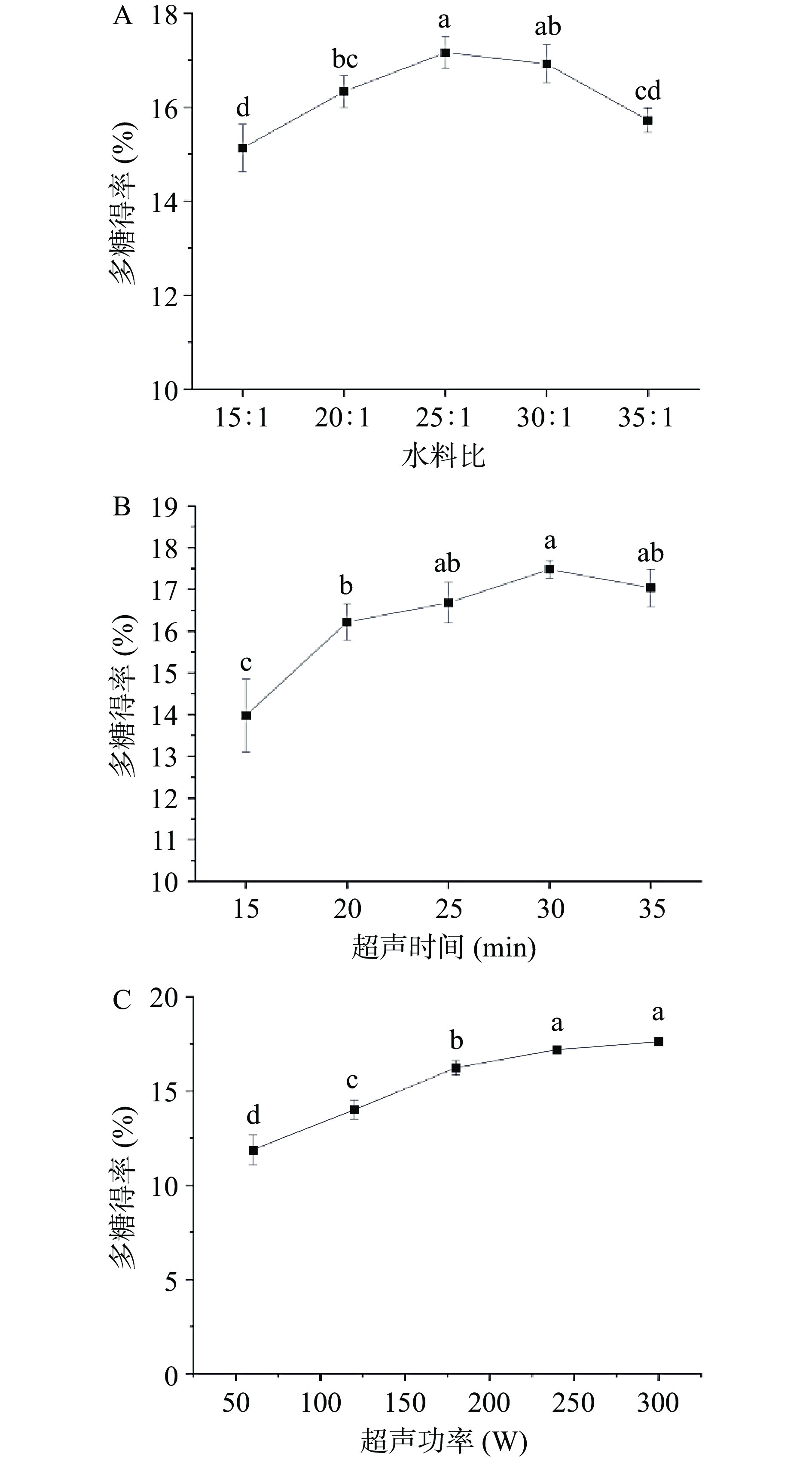
由图1A可知,随着水料比的增加,胞内多糖的得率也随之增加,当水料比为25:1时,多糖得率达到最高,继续增加水料比胞内多糖得率逐渐降低。这是由于提高溶剂用量可增大体系扩散压从而促进了多糖的溶出[29]。而料液比过高,可能会导致超声波的振幅下降,降低空化效应,从而使多糖得率有所下降[30]。
由图1B可知,随着时间的增加,胞内多糖得率随之增加,在超声时间为30 min时,达到最高值,随后缓慢下降。其原因可能是超声波作用时间过长,空化作用力会使得多糖糖链受到破坏,导致得率下降[31]。
由图1C可知,当超声功率为60 W时,胞内多糖得率最低(11.87%)。当超声功率在60~180 W时,得率增速最快,之后随着超声功率增加,胞内多糖得率增速放缓,当超声功率达到300 W时,得率达到最高值。超声波的空化作用会随着超声功率的提高而增强,适当提高提取功率可以提高多糖的溶出。但超声功率过高,其高强度的空化作用可能会导致多糖结构破坏[32],影响提取率,故选择180~300 W作为超声功率的优化范围。
2.1.2 裂褶菌胞内多糖提取工艺的响应面优化
根据单因素试验结果,以裂褶菌胞内多糖得率为响应值,以水料比(A)、超声时间(B)和超声功率(C)为自变量,进行三因素三水平的响应面优化试验。试验编码表和实验结果见表2。
表 2 响应面试验编码表和实验结果Table 2. Response surface test results实验号 A:水料比 B:超声时间 C:超声功率 Y:胞内多糖得率(%) 1 0 −1 −1 16.68 2 1 0 1 16.75 3 0 0 0 17.77 4 1 0 −1 17.38 5 −1 −1 0 17.05 6 0 −1 1 16.12 7 −1 0 −1 16.80 8 0 0 0 17.94 9 0 0 0 18.04 10 0 0 0 18.01 11 −1 0 1 17.04 12 0 0 0 17.89 13 0 1 −1 16.78 14 1 −1 0 17.51 15 −1 1 0 17.66 16 0 1 1 16.85 17 1 1 0 17.63 2.1.2.1 回归方程拟合及方差分析
利用Design Expert8.0对实验结果进行方差分析、3D立体图及相关系数的拟合以及模型回归。通过响应面分析,建立以水料比A、超声时间B、超声功率C为三因素的数字回归模型如下:
Y(%)=17.93+0.09A+0.2B−0.11C−0.12AB−0.22AC+0.16BC−0.041A2−0.43B2−0.9C2
回归系数及显著性检验如表3所示,可以看出,该模型的P=0.0001,说明模型极为显著;失拟项P=0.9283,说明无失拟因素存在,此模型的R2=0.9903,表明二次回归模型选用是适当的。
表 3 回归系数及显著性检验Table 3. Regression coefficient and significance test变异因素 平方和 自由度 均方 F值 P值 模型 5.2 9 0.58 79.67 0.0001 A 0.065 1 0.065 8.94 0.0202 B 0.3 1 0.3 41.96 0.0003 C 0.097 1 0.097 13.35 0.0081 AB 0.06 1 0.06 8.28 0.0237 AC 0.19 1 0.19 26.1 0.0014 BC 0.099 1 0.099 13.69 0.0077 A² 7.16E-03 1 7.16E-03 0.99 0.3533 B² 0.77 1 0.77 105.52 <0.0001 C² 3.38 1 3.38 466.51 <0.0001 残差 0.051 7 7.25E-03 失拟 4.95E-03 3 1.65E-03 0.14 0.9283 误差 0.046 4 1.10E-02 总和 5.25 16 注:R2=0.9903,R2Adj=0.9779,P<0.05说明该项对结果影响显著,P<0.01说明该项对结果影响极显著。 分析模型中各个系数的P值,可知B、C、AC、BC、B2、C2对于裂褶菌胞内粗多糖得率的影响极显著(P<0.01),A、AB对裂褶菌胞内多糖得率影响显著(P<0.05),A2对于裂褶菌胞内粗多糖得率的影响不显著(P>0.05)。各个因素对胞内多糖得率影响程度的大小顺序为:B>C>A。
2.1.2.2 交互作用响应面分析
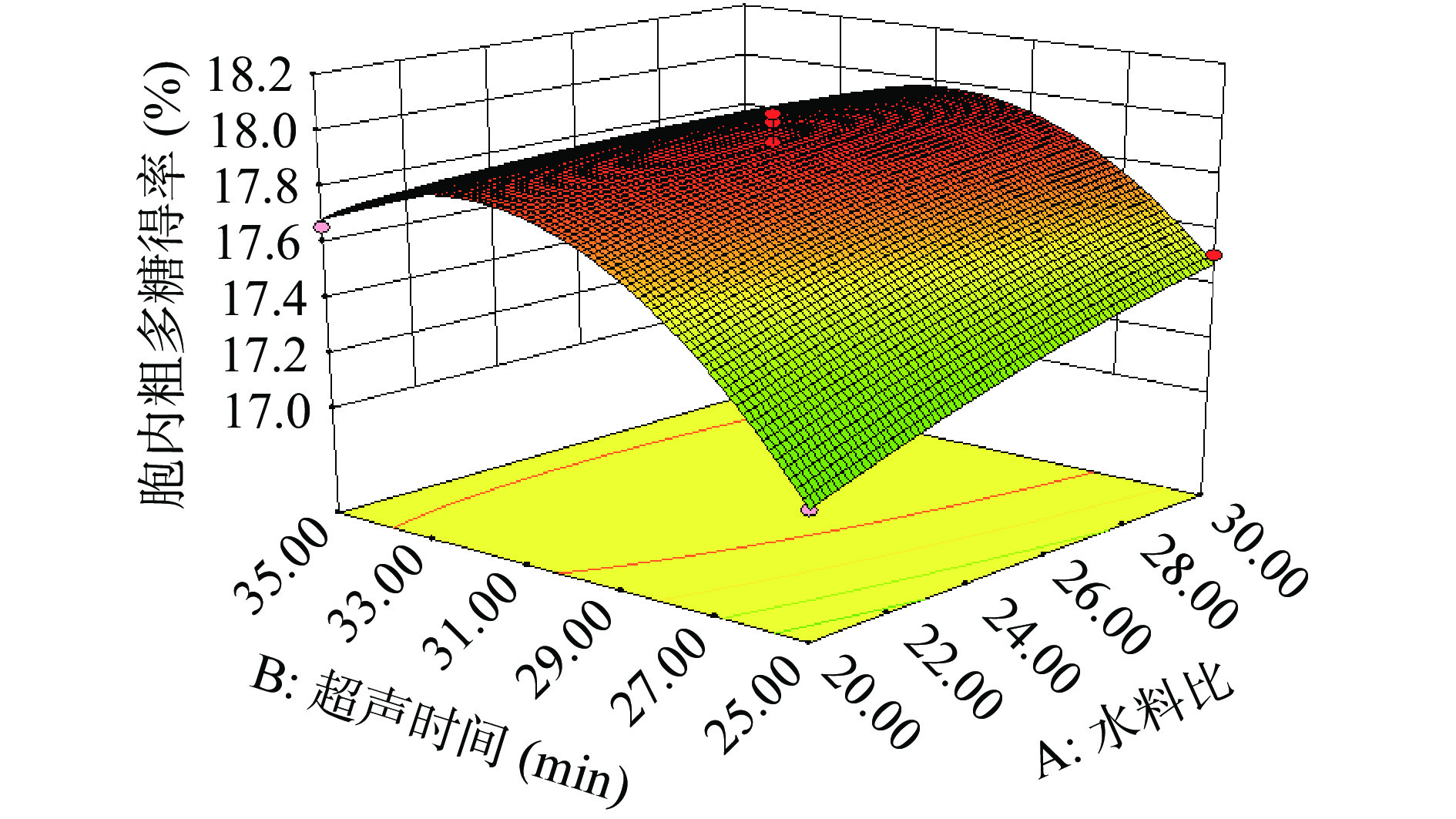
图2为水料比(A)和超声时间(B)对于胞内多糖得率的影响。当超声时间一定时,裂褶菌胞内多糖得率随着水料比的增加而增加;当水料比一定时,裂褶菌胞内多糖得率随着超声时间的增加先增加后减小;响应面坡度陡峭,说明AB之间的交互作用明显。
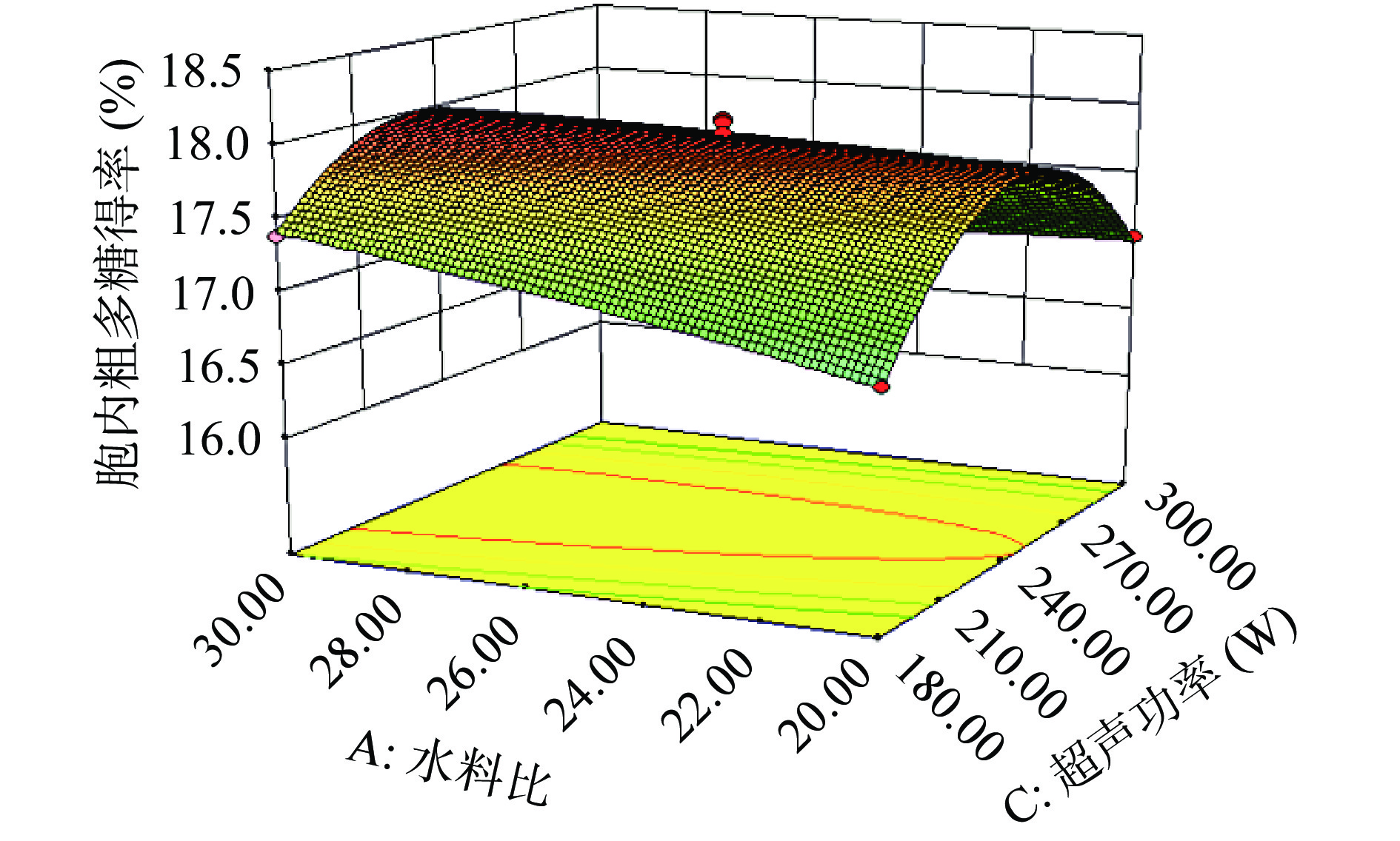
图3为水料比(A)和超声功率(C)对于胞内多糖得率的影响。在一定超声功率条件下,裂褶菌胞内多糖得率随着水料比的增加而增加;在一定水料比条件下,裂褶菌胞内多糖得率随着超声功率的增加先增加后减小;AC之间交互作用显著;且裂褶菌胞内多糖得率随着超声功率的变化幅度明显高于随着水料比的变化幅度,说明超声功率对实验结果的影响比水料比更大。
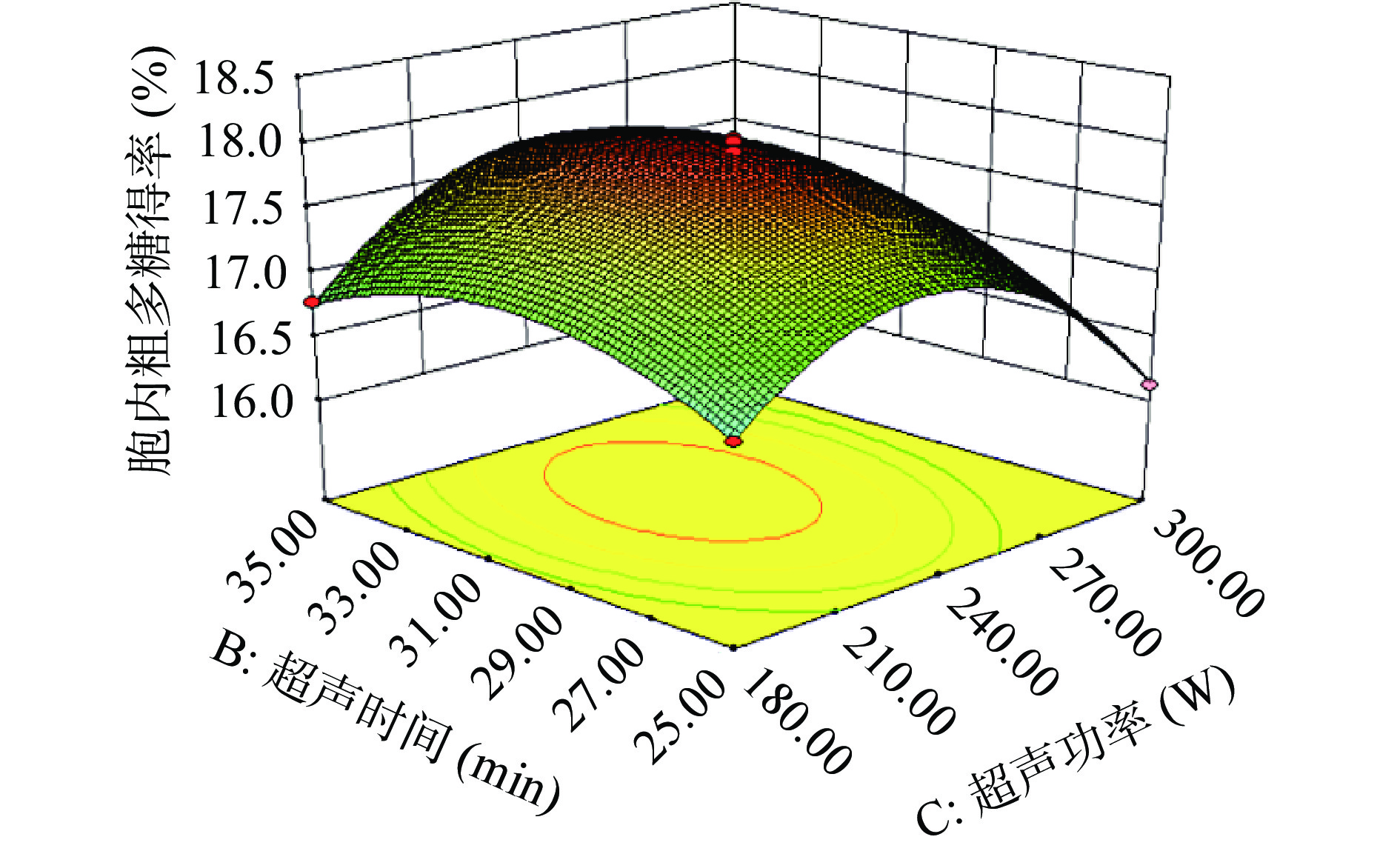
图4为超声时间(B)和超声功率(C)对于胞内多糖得率的影响。裂褶菌胞内多糖得率随着超声时间和超声功率的增加呈现出先上升后下降的趋势。响应面坡度十分陡峭且等高线图呈现出椭圆形,说明二者交互作用十分显著,这与方差分析的结果相符。
2.1.3 验证实验
通过Design Expert 8.0对于超声辅助热水提取裂褶菌胞内多糖的拟合分析,预测出最佳的工艺条件:水料比30:1、超声时间30.26 min、超声功率229.29 W,在此工艺条件下所得到的预测胞内多糖得率为18.01%;考虑到实际操作的情况,对工艺条件进行了些许修正,最终得到的最佳优化工艺为:水料比30:1、超声时间30 min、超声功率230 W;在此工艺条件下得到的实际胞内多糖得率为18.14%±0.33%。预测值与实际值的误差为0.69%,说明通过响应面优化所得的裂褶菌胞内多糖提取工艺参数具有可行性。
2.2 裂褶菌胞内多糖的分离纯化
2.2.1 裂褶菌胞内多糖离子交换柱层析
由图5可知,实验一共获得4种裂褶菌胞内多糖组分,将含量最高的组分命名为NSPG-1并收集。
2.2.2 裂褶菌胞内多糖凝胶柱层析
通过Sephadex G-100对裂褶菌胞内多糖NSPG-1的均一性进行初步鉴定,洗脱曲线如图6所示,洗脱曲线呈现为单一的对称峰,初步证明其为单一组分[33],表明NSPG-1是分子量均一的多糖。
2.2.3 高效体积排阻色谱法纯度鉴定及分子量测定
裂褶菌多糖组分NSPG-1在HPLC上的洗脱曲线如图7所示,胞内多糖NSPG-1经过高效体积排阻色谱法分离后得到的图谱为单一对称峰,说明组分纯度较高且分子量是均一的[34];其出峰时间为7.623 min,根据标准曲线方程计算可得:NSPG-1的分子量为1.05×106 Da。
2.2.4 紫外光谱扫描纯度鉴定结果
如图8所示,NSPG-1在199 nm处含有多糖吸收峰,说明该物质确实是多糖;其在260和280 nm处均不含吸收峰,说明该组分不含蛋白质与核酸,表明裂褶菌胞内多糖得到了分离纯化。
2.2.5 红外光谱扫描结果
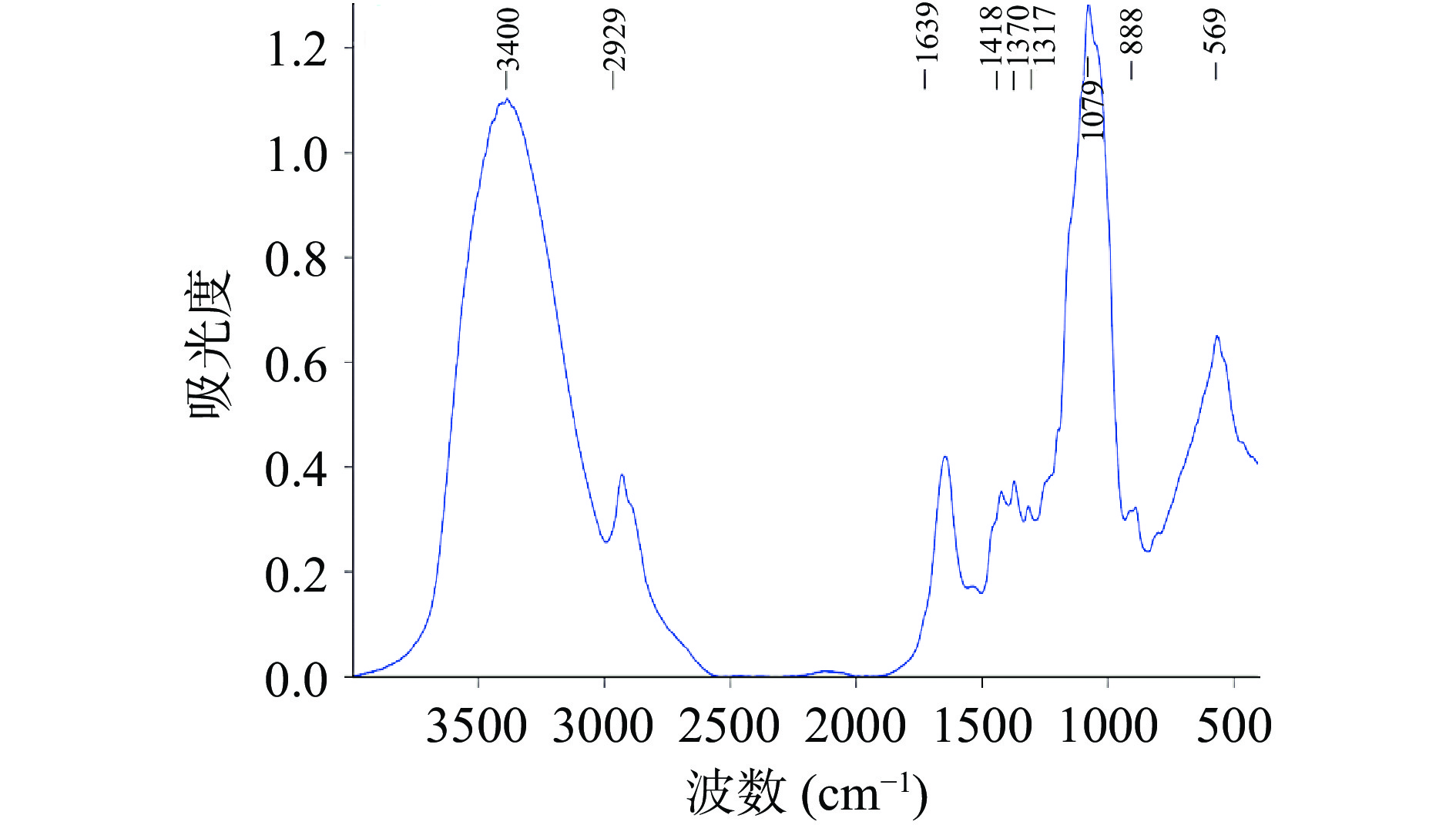
由图9可知,NSPG-1在4000~400 cm−1范围内都具有典型的多糖吸收峰:3400 cm−1处由羟基的变角振动与伸缩振动所引起的吸收峰,2930 cm−1附近由糖类C-H键伸缩振动所产生的吸收峰,1640 cm−1附近糖的水化物的典型吸收峰,1400~1200 cm−1附近由于C-H键的变角振动所引起的糖类特征吸收峰[35-37]。吡喃糖环会在1200~1000 cm−1处产生的强吸收峰[38],而NSPG-1在1079 cm−1处有一个明显的吸收峰,由此判定NSPG-1为吡喃糖;α型多糖在844 cm−1附近处有C-H键的特征吸收峰,β型多糖会在888 cm−1附近处产生C-H键的特征吸收峰[39],而NSPG-1在888 cm−1存在有一个吸收峰,而在844 cm−1附近没有吸收峰,由此可知,NSPG-1为β型吡喃糖。本研究的红外光谱与及多糖构型与某些裂褶菌子实体多糖[40]有很大差异,这可能是由于菌种、培养方式、纯化组分不同等因素导致的。
2.3 裂褶菌多糖生物活性探究
2.3.1 NSPG-1体外抗氧化性测定
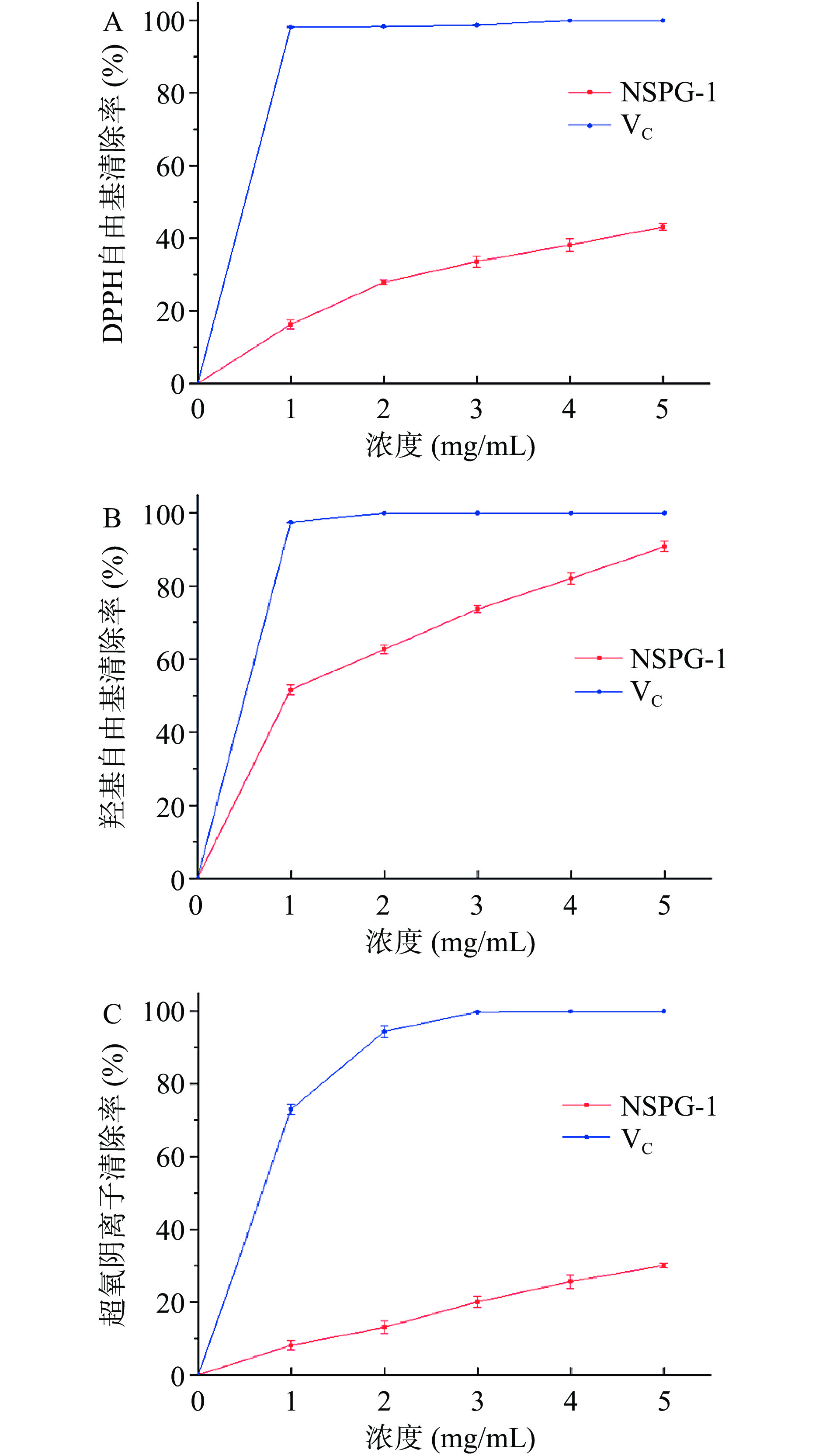
如图10所示,NSPG-1对于DPPH自由基、羟基自由基和超氧阴离子自由基均有一定的清除能力,且在一定浓度范围内,其清除自由基能力与多糖浓度呈正相关。其中NSPG-1对羟基自由基的清除能力最强,在质量浓度5 mg/mL时,清除率高达90.87%。NSPG-1对DPPH自由基和超氧阴离子自由基清除能力稍差,清除率分别为43.12%和30.09%。NSPG-1对DPPH自由基、羟基自由基和超氧阴离子自由基的IC50值分别为6.97、1.08和11.41 mg/mL。
2.3.2 NSPG-1抑菌性测定
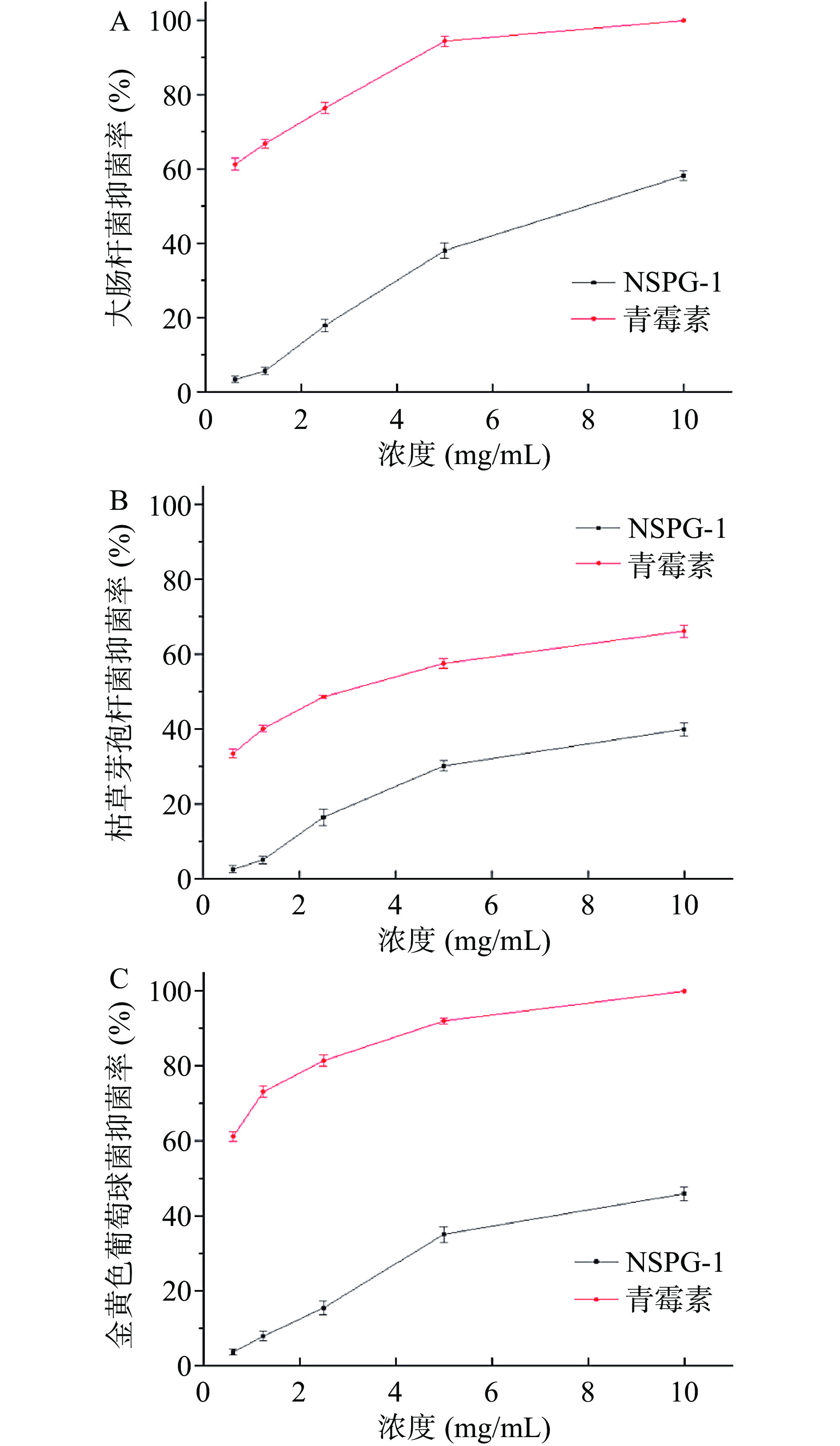
如图11所示,NSPG-1对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌均具有一定的抑制作用,且抑制率随着多糖浓度的增大而增加。NSPG-1对三种菌的IC50值分别为7.56、12.54和10.42 mg/mL。
3. 结论和讨论
本文以裂褶菌菌丝体为原料,利用响应面法对超声辅助热水胞内多糖工艺进行了优化,最佳工艺为水料比30:1、超声时间30 min、超声功率230 W;通过离子交换柱层析和凝胶柱层析成功分离出裂褶菌胞外多糖组分NSPG-1,此多糖为β型吡喃糖,分子量为1.05×106 Da,并具有较好的抗氧化性和抑菌性。
裂褶菌是一种珍稀食用菌,然而较低的产量和高昂的价格,限制了其开发利用。多糖是裂褶菌主要的活性物质,本研究在工艺最适条件下,裂褶菌胞内粗多糖得率达到了18.14%,远大于子实体多糖[41]得率,说明通过液体发酵产生菌丝体,利用菌丝体提取多糖是裂褶菌多糖开发利用的有效方式,此方式具有生产周期短、不受季节和地域的限制、成本低等优势,适于裂褶菌工厂化开发利用。然而,不同的发酵条件对多糖产率影响较大[9],故发酵条件优化也今后裂褶菌多糖研究的重要方向。裂褶菌胞内多糖NSPG-1组分具有较好的抗氧化性和抑菌性,可以应用于食品、化妆品等领域,具有一定的开发价值。本文仅对裂褶菌胞内多糖中含量最高组分的部分性质进行了研究,今后还需对NSPG-1多糖的单糖组分、抗肿瘤提高免疫性等生物学性质、化学改性等以及其他三种多糖开展进一步研究。
-
表 1 响应面试验因素与水平设计
Table 1 Factors and levels of response surface experiment
水平 A 水料比
(mL:g)B 超声时间
(min)C 超声功率(W) −1 20:1 25 180 0 25:1 30 240 1 30:1 35 300 表 2 响应面试验编码表和实验结果
Table 2 Response surface test results
实验号 A:水料比 B:超声时间 C:超声功率 Y:胞内多糖得率(%) 1 0 −1 −1 16.68 2 1 0 1 16.75 3 0 0 0 17.77 4 1 0 −1 17.38 5 −1 −1 0 17.05 6 0 −1 1 16.12 7 −1 0 −1 16.80 8 0 0 0 17.94 9 0 0 0 18.04 10 0 0 0 18.01 11 −1 0 1 17.04 12 0 0 0 17.89 13 0 1 −1 16.78 14 1 −1 0 17.51 15 −1 1 0 17.66 16 0 1 1 16.85 17 1 1 0 17.63 表 3 回归系数及显著性检验
Table 3 Regression coefficient and significance test
变异因素 平方和 自由度 均方 F值 P值 模型 5.2 9 0.58 79.67 0.0001 A 0.065 1 0.065 8.94 0.0202 B 0.3 1 0.3 41.96 0.0003 C 0.097 1 0.097 13.35 0.0081 AB 0.06 1 0.06 8.28 0.0237 AC 0.19 1 0.19 26.1 0.0014 BC 0.099 1 0.099 13.69 0.0077 A² 7.16E-03 1 7.16E-03 0.99 0.3533 B² 0.77 1 0.77 105.52 <0.0001 C² 3.38 1 3.38 466.51 <0.0001 残差 0.051 7 7.25E-03 失拟 4.95E-03 3 1.65E-03 0.14 0.9283 误差 0.046 4 1.10E-02 总和 5.25 16 注:R2=0.9903,R2Adj=0.9779,P<0.05说明该项对结果影响显著,P<0.01说明该项对结果影响极显著。 -
[1] 陈文强, 邓百万, 彭浩. 碳源和氮源对裂褶菌菌丝生长影响的研究[J]. 中国食用菌,2004(6):16−18. [CHEN W Q, DENG B W, PENG H. Effect of C-cources, N-sources on the mycelia growth of Schizophyllum commune[J]. Edible Fungi of China,2004(6):16−18. doi: 10.3969/j.issn.1003-8310.2004.06.006 [2] 马布平, 罗祥英, 刘书畅, 等. 裂褶菌研究进展综述[J]. 食药用菌,2017,25(5):303−307, 322. [MA B P, LUO X Y, LIU S C, et al. Advances in the research of Schizophyllum commune Fr[J]. Edible and Medicinal Mushrooms,2017,25(5):303−307, 322. [3] ALEEM, E. The mushroom extract schizophyllan reduces cellular proliferation and induces G2/M arrest in MCF-7 human breast cancer cells[J]. Life Science Journal,2011,8(4):166−171.
[4] 张献辉, 刘蕾, 尚宁宁. 裂褶菌对有氧性运动疲劳恢复作用[J]. 中国食用菌,2020,39(2):70−72. [ZHANG X H, LIU L, SHANG N N. The recovery effect of Schizophyllum commune on aerobic exercise fatigue[J]. Edible Fungi of China,2020,39(2):70−72. doi: 10.13629/j.cnki.53-1054.2020.02.021 [5] TSUCHIYA Y, IGARASHI M, INOUE M, et al. Cytokine-related immunomodulating activities of an anti-tumor glucan, sizofiran (SPG)[J]. Journal of Pharmacobio-Dynamics,1989,12(10):9−14.
[6] 杨娜, 王鸿飞, 董栓泉, 等. 裂褶菌多糖对小鼠免疫活性作用的研究[J]. 现代食品科技,2014,30(8):1−5. [YANG N, WANG H F, DONG S Q, et al. Immunological effects of Schizophyllum commune ploysaccharides in mice[J]. Modern Food Science and Technology,2014,30(8):1−5. doi: 10.13982/j.mfst.1673-9078.2014.08.013 [7] PAPAVIZAS G C. Liquid fermentation technology for experimental production of biocontrol fungi[J]. Phytopathology,1984,74(10):81−91.
[8] 高利忠. 裂褶菌固体生物发酵及其多糖功能特性研究[D]. 呼和浩特: 内蒙古农业大学, 2008. GAO L Z. Study on the solid biology ferment of Schizophyllum commune and functional properties of its Schizophyllan[D]. Hohhot: Inner Mongolia Agricultural University, 2008
[9] 黄嘉欣, 李岳峰, 马伟锐, 等. 裂褶多糖制备及化学改性研究进展[J]. 广东药科大学学报,2019,35(1):144−148. [HUNG J X, LI Y F, MA W R, et al. Progress of Schizophyllan in preparation and chemical modification[J]. Journal of Guangdong Pharmaceutical University,2019,35(1):144−148. [10] KOJIMA T, TABATA K, ITOH W, et al. Molecular weight dependence of the antitumor activity of Schizophyllan[J]. Agric Biol Chem,1986,50(1):231−232.
[11] 贺凤, 黄龙花, 刘远超, 等. 裂褶菌多糖的研究进展[J]. 食用菌学报,2016,23(2):88−93. [HE F, HUANG L H, LIU C Y, et al. Progress in Schizophyllan research[J]. Acta Edulis Fungi,2016,23(2):88−93. doi: 10.16488/j.cnki.1005-9873.2016.02.018 [12] 耿晓进, 李海清, 刘紫征. 食药用菌多糖提取工艺研究进展[J]. 食用菌,2019,41(6):1−5. [GENG X J, LI H Q, LIU Z Z. Research progress on extraction process of edible and medicinal fungi polysaccharide[J]. Edible Fungi,2019,41(6):1−5. doi: 10.3969/j.issn.1000-8357.2019.06.001 [13] 张沙沙, 罗晓莉, 何容, 等. 基于响应面优化的超声波辅助提取香菇多糖工艺研究[J]. 中国食用菌,2020,39(3):29−33. [ZHANG S S, LUO X L, HE R, et al. Study on ultrasonic-assisted extraction of lentinan based on response surface optimizaion[J]. Edible Fungi of China,2020,39(3):29−33. doi: 10.13629/j.cnki.53-1054.2020.03.008 [14] LI C, HUANG X J, P Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry,2014,21(5):1722−1727. doi: 10.1016/j.ultsonch.2014.03.018
[15] 曹丹, 孙于寒, 彭浩, 等. 均匀设计法优化灰树花多糖超声波辅助提取工艺及其抗氧化活性分析[J]. 食品研究与开发,2021,42(5):113−118. [CAO D, SUN Y H, PENG H, et al. Optimization of ultrasonic-assisted extraction process of polysaccharides from grifola frondosa by uniform design and its antioxidant activity analysis[J]. Food Research and Development,2021,42(5):113−118. doi: 10.12161/j.issn.1005-6521.2021.05.019 [16] 马若影, 李幼梅, 邓志勇, 等. 大孔树脂对红心火龙果茎多糖脱色除蛋白及抗氧化活性的影响[J]. 热带作物学报,2018,39(7):1297−1303. [MA R Y, LI Y M, DENG Z Y, et al. Effect of macroporous resin on decolorization and deproteinization technology and antioxidant activity of polysaccharide from red pulp hylocereusundatus dtem[J]. Chinese Journal of Tropical Crops,2018,39(7):1297−1303. doi: 10.3969/j.issn.1000-2561.2018.07.006 [17] 信传鑫, 杨金涛, 戴晓婧, 等. 大孔树脂吸附桦褐孔菌多糖色素的机理及工艺优化[J]. 食品工业科技,2021,42(22):193−201. [XIN C X, YANG J T, DAI X J, et al. Adsorption mechanism and process optimization of inonotus obliquus polysaccharide pigment by macroporous resin[J]. Science and Technology of Food Industry,2021,42(22):193−201. doi: 10.13386/j.issn1002-0306.2021030304 [18] 江新凤. 乙醇沉淀法提取茶花多糖的研究[J]. 蚕桑茶叶通讯,2013(5):31−33. [JIANG X F. Study on Extraction of Camellia polysaccharide by ethanol precipitation[J]. Newsletter of Sericulture and Tea,2013(5):31−33. doi: 10.3969/j.issn.1007-1253.2013.05.014 [19] JAIN V M, KARIBASAPPA G N, DODAMANI A S, et al. Estimating the carbohydrate content of various forms of tobacco by phenol-sulfuric acid method[J]. Journal of Education and Health Promotion,2017,6(1):107−112. doi: 10.4103/jehp.jehp_20_17
[20] 王晶, 王春国, 李冰, 等. 苯酚-硫酸法测定慈姑中多糖的含量[J]. 吉林中医药,2017,37(12):1258−1260. [WANG J, WANG C G, LI B, et al. Determination of polysaccharides from sagittaria by method of H2SO4-Phenol[J]. Jilin Journal of Chinese Medicine,2017,37(12):1258−1260. [21] HELENA L C, DAVID K J, MELVIN P T, et al. Some aspects of lignin characterization by high performance size exclusion chromatography using styrene divinylbenzene copolymer gels[J]. Holzforschung-International Journal of the Biology, Chemistry, Physics and Technology of Wood,2009,41(2):138−144.
[22] YANG Y F, PENG J L, LI F P, et al. Determination of alkaloid contents in various tissues of coptis chinensis franch. by reversed phase-high performance liquid chromatography and ultraviolet spectrophotometry[J]. Journal of Chromatographic Science,2017,55(5):76−81.
[23] 王爽, 王慧宾, 韩晓丹, 等. 虎奶菇水溶性粗多糖的制备及其红外光谱分析[J]. 化工管理,2019(33):168−169. [WANG S, WANG H B, HAN X D, et al. Preparation and infrared spectrum analysis of water-soluble crude polysaccharide from Pleurotus Tuber-regium Sing[J]. Chemical Management,2019(33):168−169. doi: 10.3969/j.issn.1008-4800.2019.33.112 [24] 景年华, 史俊友, 田照秀, 等. 黑牛肝菌多糖超声提取工艺优化及抗氧化研究[J]. 安徽农业科学,2021,49(8):170−174. [JING N H, SHI J Y, TIAN Z X, et al. Study on optimization of ultrasonic extraction process and antioxidant of polysaccharides from boletus aereus[J]. Journal of Anhui Agricultural Sciences,2021,49(8):170−174. doi: 10.3969/j.issn.0517-6611.2021.08.045 [25] 高雅倩. 茶树菇多糖提取工艺优化及抗氧化活性研究[J]. 现代食品,2022,28(1):200−204. [GAO Y Q. Study on the Optimization of extraction technology of Agrocybe aegerita polysaccharide and its antioxidation activity[J]. Modern Food,2022,28(1):200−204. [26] 向瑞琪, 谢锋, 谭红, 等. 三种食用菌多糖的基本结构与抗氧化活性研究[J]. 食品工业科技,2022,43(14):69−76. [XIANG R Q, XIE F, TAN H, et al. Study on basic structure and antioxidant activity of polysaccharides from three edible fungi[J]. Science and Technology of Food Industry,2022,43(14):69−76. [27] 孟俊龙, 冯翠萍, 常明昌, 等. 香菇多糖抑菌作用的研究[J]. 山西农业大学学报(自然科学版),2012,32(3):261−264. [MENG J L, FENG C P, CHANG M C, et al. Antimicrobial characteristics of poivsaccharide from ganoderma lentinan[J]. Journal of Shanxi Agricultural University (Natural Science Edition),2012,32(3):261−264. doi: 10.3969/j.issn.1671-8151.2012.03.015 [28] 冉棋, 赵卓卓, 刘秀琨, 等. 天然药物抑菌活性实验方法的研究概述[J]. 中国实验方剂学杂志,2019,25(20):214−221. [RAN Q, ZHAO Z Z, LIU X K, et al. Overview of experimental methods for antimicrobial activity of natural drugs[J]. Chinese Journal of Experimental Traditional Medical Formulae,2019,25(20):214−221. doi: 10.13422/j.cnki.syfjx.20191051 [29] 冼丽清, 李珊, 冯彬, 等. 凌云白毫茶多糖超声波提取工艺优化及其抗氧化效果[J]. 食品工业科技,2022,43(9):178−184. [XIAN L Q, LI S, FENG B, et al. Optimization of ultrasonic extraction of polysaccharides in lingyun pekoe and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(9):178−184. [30] 常庆, 吴少雄, 王琦, 等. 超声波辅助提取、纯化滇橄榄多糖的工艺研究[J]. 食品安全质量检测学报,2022,13(6):1755−1763. [CHANG Q, WU S X, WANG Q, et al. Study on process of ultrasonic assisted extraction and purification of polysaccharides from Phyllanthus emblica Linn[J]. Journal of Food Safety & Quality,2022,13(6):1755−1763. doi: 10.3969/j.issn.2095-0381.2022.6.spaqzljcjs202206008 [31] 孙宁云, 姚欣, 张英慧, 等. 鸡蛋花多糖提取工艺优化及生物活性研究[J]. 食品工业科技,2022,43(3):180−187. [SUN N Y, YAO X, ZHANG Y H, et al. Optimization of extraction process of polysaccharides from Plumeria rubra L. cv. acutifolia and evaluation of biological activity[J]. Science and Technology of Food Industry,2022,43(3):180−187. [32] 王君, 陈新, 高文彬, 等. 响应面法优化超声辅助提取金丝皇菊多糖工艺及生理活性研究[J]. 中国食品添加剂,2022,33(2):100−109. [WANG J, CHEN X, GAO W B, et al. Optimization of uItrasonic—assisted extraction process and physiological activity of polysaccharide from Dendranthema morifolium by response surface methodology[J]. China Food Additives,2022,33(2):100−109. [33] 陈红, 杨许花, 查勇, 等. 植物多糖提取、分离纯化及鉴定方法的研究进展[J]. 安徽农学通报,2021,27(22):32−35. [CHEN H, YANG X H, CHA Y, et al. Research progress in extraction, purification and identification of plant polysaccharides[J]. Anhui Agricultural Science Bulletin,2021,27(22):32−35. doi: 10.3969/j.issn.1007-7731.2021.22.011 [34] 戴军, 尹鸿萍, 陈尚卫, 等. 杜氏盐藻多糖的高效体积排阻色谱的保留特性及其分析方法的研究[J]. 色谱,2006(6):560−565. [DAI J, YIN H P, CHEN S W, et al. Study on the retention behaviors and analytical methods of polysaccharides from Duanaliella salna by high performance size-exclusion chromatography[J]. Chinese Journal of Chromatography,2006(6):560−565. doi: 10.3321/j.issn:1000-8713.2006.06.005 [35] 王莹, 申秀娟, 张磊, 等. 火炬树芽多糖提取工艺的响应面优化及红外光谱分析[J]. 粮食与油脂,2019,32(9):96−100. [WANG Y, SHEN X J, ZHANG L, et al. Method optimization of extraction condition and infrared spectroscopy analysis for polysaccharides from sprout of Rhus typhina by response surface[J]. Cereals & Oils,2019,32(9):96−100. doi: 10.3969/j.issn.1008-9578.2019.09.024 [36] SHAHID S, CORROLER D, MOSRATI R, et al. New model development for qualitative and quantitative analysis of microbial polyhydroxyalkanoates: A comparison of fourier transform infrared spectroscopy with gas chromatography[J]. Journal of Biotechnology,2021,329:66−73.
[37] 唐婧, 吉鹏, 汪凯, 等. 不同粒径三七的傅里叶红外光谱分析[J]. 粮食与食品工业,2018,25(5):68−72. [TANG J, JI P, WANG K, et al. Fourier transform infrared spectroscopy analysis of pseudo-ginseng different particle sizes[J]. Cereal & Food Industry,2018,25(5):68−72. doi: 10.3969/j.issn.1672-5026.2018.05.019 [38] MATHEUS A C, BRUNO BR A, LARISSA M S T, et al. Fourier transform near infrared spectroscopy as a tool for predicting antioxidant activity of propolis[J]. Journal of King Saud University-Science,2020,32(1):87−96.
[39] 孙延芳, 李子昂, 梁宗锁, 等. 食用菌多糖及其红外光谱分析[J]. 黑龙江农业科学,2011(10):99−100. [SUN Y F, LI Z A, LIANG Z S, et al. Polysaccharides and Infrared spectral analysis of edible fungus[J]. Heilongjiang Agricultural Sciences,2011(10):99−100. doi: 10.3969/j.issn.1002-2767.2011.10.038 [40] 杨娜, 王鸿飞, 宋佳敏, 等. 超声波辅助提取裂褶菌多糖及分离纯化的研究[J]. 核农学报,2014,28(11):2015−2024. [YANG N, WANG H F, SONG J M, et al. Uitrasonic assisted extraction and purification and determination of Schizophyllian polysaccharose[J]. Journal of Nuclear Agricultural Sciences,2014,28(11):2015−2024. doi: 10.11869/j.issn.100-8551.2014.11.2015 [41] 杨娜, 王鸿飞, 郝艳佳, 等. 裂褶菌多糖提取工艺及抗氧化活性研究[J]. 中国食品学报,2014,14(8):92−98. [YANG N, WANG H F, HAO Y J, et al. Study on extraction technology and antioxidant activity of Schizophyllian polysaccharose[J]. Journal of Chinese Institute of Food Science and Technology,2014,14(8):92−98. doi: 10.16429/j.1009-7848.2014.08.007 -
期刊类型引用(3)
1. 王崑仑,管立军,高扬,严松,李家磊,季妮娜,李波,周野. 裂褶菌发酵西洋参工艺优化及体外抗氧化能力研究. 食品工业科技. 2024(07): 142-151 .  本站查看
本站查看
2. 付府伊,徐钰栋,赖宇谦,段晓雪,刘自逵,贺喜,宋泽和. 人参粗提物与裂褶多糖或葡萄糖氧化酶复配对蛋鸡生产性能和血清生化指标的影响. 饲料研究. 2024(22): 27-33 .  百度学术
百度学术
3. 蒋魁,胡晓娟,徐创文,洪敏娜,刘曦瑶,麦晓勇,陈海谊,杨铿. 裂褶菌多糖对凡纳滨对虾生长、免疫和肠道菌群的影响. 南方水产科学. 2023(05): 95-103 .  百度学术
百度学术
其他类型引用(2)







 下载:
下载:
 下载:
下载:



