Identification of Polyphenols from Mulberry Leaves and Their Antioxidant and α-Amylase Inhibitory Activity
-
摘要: 目的:桑树叶片在传统医学中被用作降糖和降血压的药物,其作用机理与活性成分含量有关。评价桑叶提取物不同生物活性,包括生物活性物质含量、抗氧化活性和抗α-淀粉酶活性。方法:采用SPE(固相萃取技术)将多酚粗提液分离纯化为花色苷、非花色苷多酚和水层三个组分,采用HPLC-PDA和HPLC-ESI/MS2对桑叶中的多酚物质进行系统地定性和定量。利用DPPH(1,1-二苯基-2-三硝基苯肼自由基清除能力)、ABTS(2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸))和FRAP(铁离子还原能力)三种方法测定不同提取物的抗氧化活性,并采用福林酚法、pH差异法和比色法测定桑叶提取物总酚、总花色苷和总原花青素含量。结果:桑叶中共鉴定出6种花色苷、42种非花色苷多酚,其中,矮牵牛素-3-葡萄糖苷和原花青素衍生物含量很高;桑叶中总酚、总花色苷和总原花青素的含量分别为14.09 mg GAE/g DW、0.17 mg C3G/g DW和17.24 μg PA2/g DW;多酚粗提液、花色苷、非花色苷多酚和水层对α-淀粉酶活性的IC50(半抑制浓度)分别为8.31、13.70、0.25和12.00 mg/mL,由此看出非花色苷多酚的抗α-淀粉酶活性最高。结论:桑叶具有较强的抗氧化活性,其中花色苷显示出最高的抗氧化活性。这些数据可以为蒙古桑叶用作功能食品提供重要参考。Abstract: Objectives: Mulberry leaves are used in traditional medicine as hypoglycaemic and hypotensive agents and their mechanism is related to the content of bioactive ingredients. To evaluate the different biological activities of mulberry leaf extracts, including the content of bioactive ingredients, antioxidant activity and α-amylase inhibitory activity. Methods: The crude extracts of polyphenols were separated and purified into three fractions: Anthocyanins, non-anthocyanin polyphenols and water fractions by SPE (solid phase extraction), and the polyphenols in mulberry leaves were systematically characterized and quantified by HPLC-PDA and HPLC-ESI/MS2. The antioxidant activities of the different extracts were determined using three methods: DPPH (1,1-diphenyl-2-picrylhydrazyl), ABTS (2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid)) and FRAP (ferric reducing antioxidant power). The total phenolic, total anthocyanin and total proanthocyanidin contents of the mulberry leaf extracts were determined by the Folin-Ciocalteu's, pH-differential and colorimetric methods. Results: 6 anthocyanins and 42 non-anthocyanin polyphenols were identified in mulberry leaves, among which, petunidin-3-glucoside and proanthocyanidin derivatives were in high content. The total phenolic, total anthocyanin and total proanthocyanidin contents of the mulberry leaves were 14.09 mg GAE/g DW, 0.17 mg C3G/g DW and 17.24 μg PA2/g DW, respectively. The IC50 (semi-inhibitory concentration) values of the polyphenol crude extracts, anthocyanins, non-anthocyanin polyphenols and water fraction against α-amylase were 8.31, 13.70, 0.25 and 12.00 mg/mL, respectively, which showed that the non-anthocyanin polyphenols had the highest α-amylase inhibitory activity. Conclusion: Mulberry leaves had strong antioxidant activity, and anthocyanins showed the highest antioxidant activity. These results can provide an important reference for the use of Mongolian mulberry leaves as functional foods.
-
桑叶是桑树(Morus alba L.)的叶子,产量占桑树年产干物质量的三分之一左右[1]。桑树在中国已有4000多年的历史,但由于其能够在温带到热带等多种气候条件下生长,目前已在全世界种植,世界各地约有80种桑属植物[2]。桑叶不仅是蚕的食物,还被广泛用作食品、食品添加剂和民间药物[3],用于降血糖、降血脂、降血压、抗动脉粥样硬化和抗惊厥剂[4]。蒙古桑(Morus mongolica Schneid.),为白桑的变种,生长期在每年3~5月份,具有良好的抗寒性,在黑龙江地区种植高达上千亩,此品种的果实口感要比大多数品种好,而前人对蒙古桑叶中多酚生物活性的研究较少,其具有较大的开发潜力。
桑叶是一种含有多种功能成分,有益健康的植物材料,一些报道表明桑叶含有高含量的生物活性化合物,包括酚酸、黄酮、生物碱和γ-氨基丁酸[5]。Thabti等[6]揭示了桑叶(Morus rubra L.)黄酮醇类物质的主要成分,如山奈酚-7-O-葡萄糖苷、芦丁、异槲皮苷、黄芪苷和槲皮素-3-(6-丙二酰)葡萄糖苷。这些化合物此前已被证实具有抗氧化、抗高血压和抗炎作用,可预防动脉粥样硬化和降低血糖[7]。Lown等[8]研究了桑叶(英国)提取物对葡萄糖耐量水平的改善。结果表明,桑叶提取物可显著降低摄入麦芽糊精(玉米淀粉)超过120 min后的总血糖升高。然而,由于采收环境,品种,以及分辨技术的差别,桑叶酚类物质的表征仍然是一项复杂的任务。并且大多数研究主要集中在定性上,很少有报告对桑叶特定类型的酚类化合物进行定量。
为了评价蒙古桑叶生物活性成分,分析其抗氧化与降血糖方面的生物活性,本课题组首次将桑叶粗提液分离纯化为花色苷、非花色苷多酚和水层,并分别测定它们的抗氧化,抗α-淀粉酶活性。这些结果为今后桑叶产品的开发提供了有力的证据,作为具有潜在生物特性的绿色化合物的来源。
1. 材料与方法
1.1 材料与仪器
新鲜的蒙古桑叶叶片 东北农业大学园艺站,采后放入−20 ℃的冰箱中冷藏;甲醇、乙酸乙酯、盐酸(HCl,37%)、碳酸钠、氯化钾、乙酸钠 天津市科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、6-羟基-2,5,7,8-四甲基氯代甲烷-2-羧酸(Trolox)、六水合氯化铁(FeCl3·6H2O)、七水合硫酸亚铁(FeSO4·7H2O)、2,4,6-三三嗪基-s-三嗪(TPTZ)、没食子酸(GA,纯度≥98%)、福林酚试剂(Folin-Ciocalteu) 北京博奥拓科技有限公司;α-淀粉酶(2 U/mL)、玉米淀粉、阿卡波糖 美国Sigma公司;色谱级乙腈、甲酸、醋酸铵 加拿大Simark公司;矢车菊素-3-葡萄糖苷 上海安普科学仪器有限公司。
H1750R型冻干机 北京亚泰科隆仪器技术有限公司;EPOCH 2型酶标仪 美国Bio-Teck公司;AMP-12型固相萃取仪 上海安普科学仪器有限公司;LC-20 AD型高效液相色谱仪 HPLC-PDA,LC-20 AD,日本岛津仪器公司;ExionLC型液相色谱质谱联用仪 配有电喷雾离子源(ESI)及Xcalibur1.2数据处理系统,美国赛默飞世尔科技公司;Luna C18分析色谱柱 规格150×46 mm,美国Phenomenex公司;C18 Sep-Pak固相萃取柱 C18 Sep-Pak Waters,爱尔兰。
1.2 实验方法
1.2.1 多酚的提取
将适量的桑叶放入冻干机中冻干48 h,将样品放在研钵中研磨,在−20 ℃下冷藏备用。将10 g冻干粉与100 mL 80%的甲醇溶液混合,在摇床中震荡12 h以上。将摇好的混合溶液离心(8000 r/min,4 ℃,10 min)取上清液。将75 mL 80%的甲醇溶液添加到残渣中,并进行以上步骤。将三次得到的上清液混合,放入旋转蒸发仪中使其浓缩(40 ℃),再通过0.22 μm的有机滤膜,得到多酚粗提液供下一步检测。利用烘干法确定多酚粗提液浓度,计算公式为:
C=M−mV 式中:C为多酚粗提液的浓度(mg/mL);M为烘干后离心管和样品的总质量(mg);m为离心管的质量(mg);V为多酚粗提液的体积(mL)。
1.2.2 多酚组分的分离
通过固相萃取技术(SPE)[9]将多酚粗提液分离为水层、花色苷、非花色苷。首先将C18 Sep-Pak柱依次用10 mL乙酸乙酯、10 mL甲醇、15 mL 0.01 mol/L盐酸冲洗,进行预处理。加入2.0 mL多酚粗提液,用0.01 mol/L盐酸(15 mL)洗脱,得到水层;用乙酸乙酯(40 mL)洗脱得到非花色苷层;用酸性甲醇(0.1% HCl的甲醇溶液,v/v)洗脱柱子中的花色苷,直至洗脱液变为无色。将得到的洗脱液在40 ℃的条件下旋转蒸发浓缩,过0.22 μm的有机滤膜,放于−20℃的冰箱里并测量其浓度,用于后续的分析和鉴定。
1.2.3 HPLC-PDA和HPLC-ESI/MS2多酚成分鉴定
将桑叶多酚粗提液分离纯化得到的花色苷及非花色苷多酚组分分别过0.22 μm的有机滤膜。
花色苷的检测(二元流动相):A相(5% 乙腈,1% 甲酸,v/v),B相(100% 乙腈)。0~20 min,100% A;20~25 min 80% A,20% B;25~30 min 60% A,40% B;30~35 min 100% B。流速为0.6 mL/min,柱温25 ℃,检测波长为520 nm,进样量10 μL。
非花色苷的检测(三元流动相):A相(5 mmol/L醋酸铵),B相(20% A溶于乙腈),C相(60 mmol/L甲酸)。0~12.5 min 14% B,86% C;12.5~17.5 min 16.5% B,83.5% C;17.5~40 min 25% B,75% C;40~60 min 100% A。流速为0.6 mL/min,柱温25 ℃,检测波长为280 nm,进样量10 μL。
质谱检测:电喷雾离子化(ESI),花色苷为正离子模式,非花色苷为负离子模式,全离子扫描,扫描范围为100~1000 m/z,毛细管电压4500 V,碰撞气体为N2,干燥气温度550 ℃,流速为0.6 mL/min,雾化气压3.0 Bar。
1.2.4 总酚含量测定
总酚含量(TPC)的测定方法参考Waterhouse[10]并稍加修改。将样品、去离子水和Folin-Ciocalteu试剂依次加入96孔板中,暗育5 min后加入Na2CO3溶液(80 μL,75 g/L),2 h后测定其在765 nm处的吸光值。用0~100 μg/mL没食子酸(GA)绘制校准曲线:y=5.3815x+0.0003,R2=0.9991。y表示多酚粗提液的吸光度,x表示总酚的含量。结果表示为每g(DW)样品的mg GA当量。
1.2.5 总花色苷含量测定
根据Giusti等的方法,采用pH差异法测量样品的总花色苷含量(TAC)[11]。将样品分别与氯化钾缓冲液(0.025 mol/L,pH1.0)和乙酸钠缓冲液(0.4 mol/L,pH4.5)混合在96孔板中,在510和700 nm下利用酶标仪测量其吸光度。用矢车菊素-3-葡萄糖苷(C3G)当量来表示样品中的TAC,其计算公式如下:
A=(A510nm−A700nm)pH1.0−(A510nm−A700nm)pH4.5 C3G(mg/g)=A×MW×DF×1000ε×1 式中:A表示样品的吸光度;MW是C3G的分子量(449.2);DF是稀释倍数;ε是摩尔吸光系数(26900)。样品中的TAC表示为每g(DW)样品中的mg C3G当量。
1.2.6 总原花青素含量的测定
总原花青素含量(TPAC)根据Rodríguez-Pérez等[12]报告的方法进行测定。将连续稀释的样品与DMAC溶液混合于96孔板中,在25 ℃、640 nm的条件下,每分钟检测一次,检测30 min。用原花青素A2作为标准品制作标准曲线y=24.303x+0.0151,R2=0.997,其中,y表示样品的吸光值,x表示原花青素A2的浓度,单位为μg PA2/g。
1.2.7 抗氧化活性的测定
1.2.7.1 DPPH测定
参考Brand-Williams等[13]的方法,用100~800 μmol/L的Trolox制作标准曲线(Y=0.1608x−10.928,R2=0.9969),将用80%甲醇梯度稀释后的样品(多酚粗提液、花色苷提取物、非花色苷多酚提取物、水层)或Trolox与DPPH溶液依次加入96孔板中混合,在室温下暗育2 h,然后在515 nm处利用酶标仪测量其吸光值。对DPPH的抑制率计算公式为:
Y(%)=(1−OD1OD0)×100 式中:Y为样品(Trolox)对DPPH的抑制率;OD1为样品(Trolox)的吸光值;OD0为对照的吸光值。将Y值代入到标准曲线中,结果表示为每g(DW)样品中的mg Trolox当量。
1.2.7.2 ABTS+自由基清除率测定
参考Re等[14]的方法进行测定,计算方法与DPPH相同。将ABTS配制成ABTS自由基阳离子(ABTS+)溶液,用50~500 μmol/L的Trolox制作标准曲线(y=0.718x+0.6676,R2=0.9994),将样品或Trolox和ABTS+溶液混合于96孔板中,反应6 min后,利用酶标仪测量其在734 nm处的吸光值。
1.2.7.3 FRAP测定
参考Benzie等[15]的方法,用100~1000 μmol/L的FeSO4·7H2O制备标准曲线(y=0.0003x+0.0186,R2=0.9922),将FRAP试剂、样品或标品、去离子水依次加入96孔板中混合,在37 ℃,593 nm的条件下利用酶标仪连续检测30 min,取第30 min的吸光值作为检测值,计算方法同DPPH,结果表示为每g(DW)样品中的mg Fe2+当量。
1.2.8 抗α-淀粉酶活性测定
抗α-淀粉酶活性的测定参考Liu等[16]的方法并稍作修改。磷酸钠缓冲液(0.1 mol/L,pH6.9)用氯化钙(40 ppm)新鲜制备。将用80%甲醇连续稀释的样品(多酚粗提液、花色苷提取物、非花色苷多酚提取物、水层)或阿卡波糖或缓冲液(作为对照)与α-淀粉酶(0.2 mg/mL)在酶标仪中(37 ℃)孵育15 min。随后将混合物与糊化的玉米淀粉溶液(20 mg/mL)混合,在660 nm下检测2 h。
使用阿卡波糖作为标准品,同时通过动力学曲线得到抑制率与样品浓度或阿卡波糖浓度的非线性回归方程,以IC50(抑制率等于50%时的样品浓度)或阿卡波糖当量来衡量各组分的抗α-淀粉酶活性。
AUC=0.5+f2+fn−1f1+0.5×fnf1 抑制率(%)=AUC1−AUCCKAUC1 式中:AUC表示荧光熄灭曲线,f1,f2…fn代表测量的各时间点的荧光强度。AUC1表示样品的抑制曲线下面积,AUCCK表示对照的抑制曲线下面积。
1.3 数据处理
利用SPSS 26.0对数据进行差异分析,通过Xcalibur对HPLC-PDA和HPLC-ESI/MS2获得的数据进行鉴定分析,用Origin 2019软件作图。所有实验都是三组重复,所有结果均以平均值±标准差(SEM)表示。
2. 结果与分析
2.1 桑叶中的多酚组分鉴定
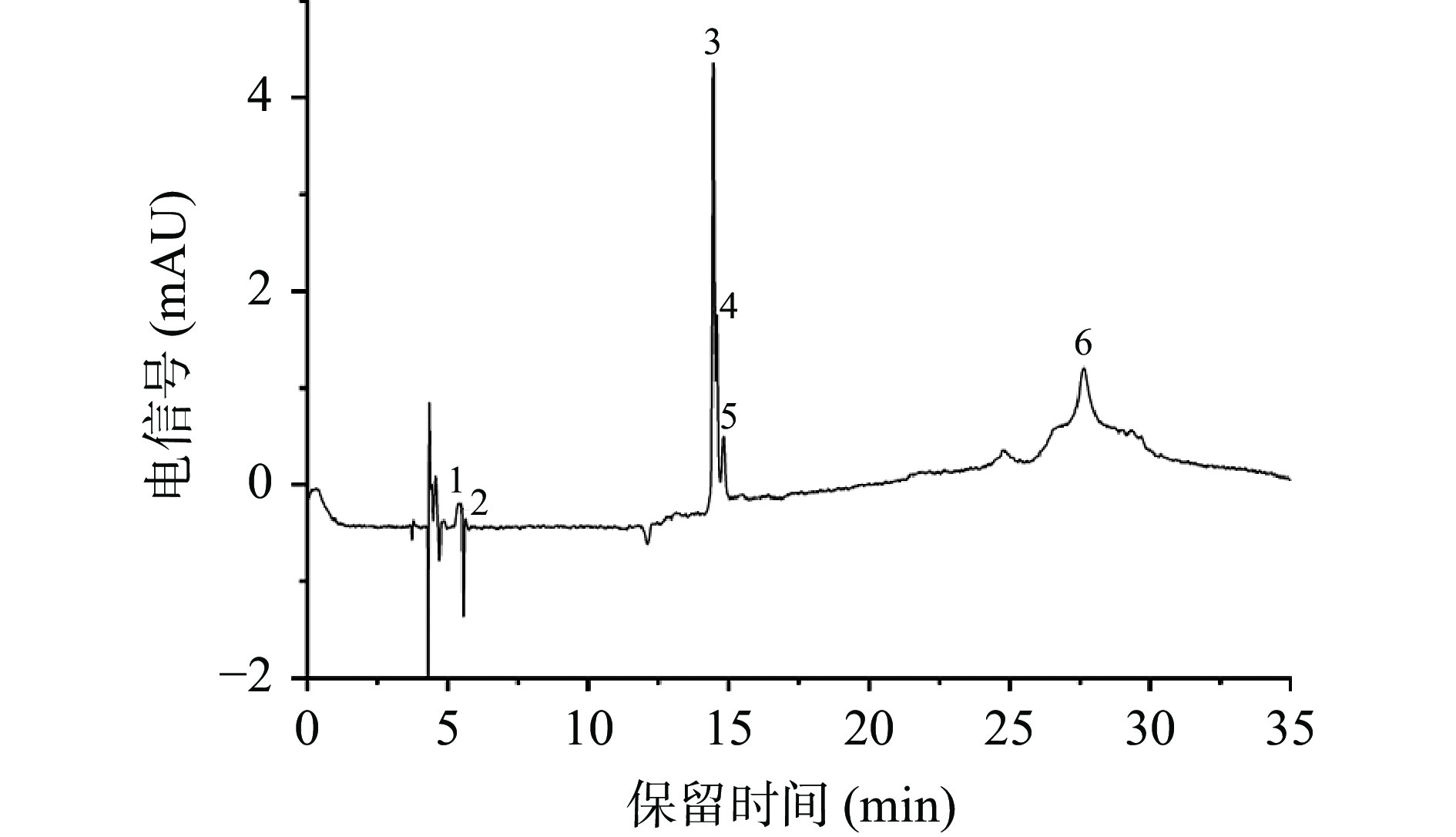
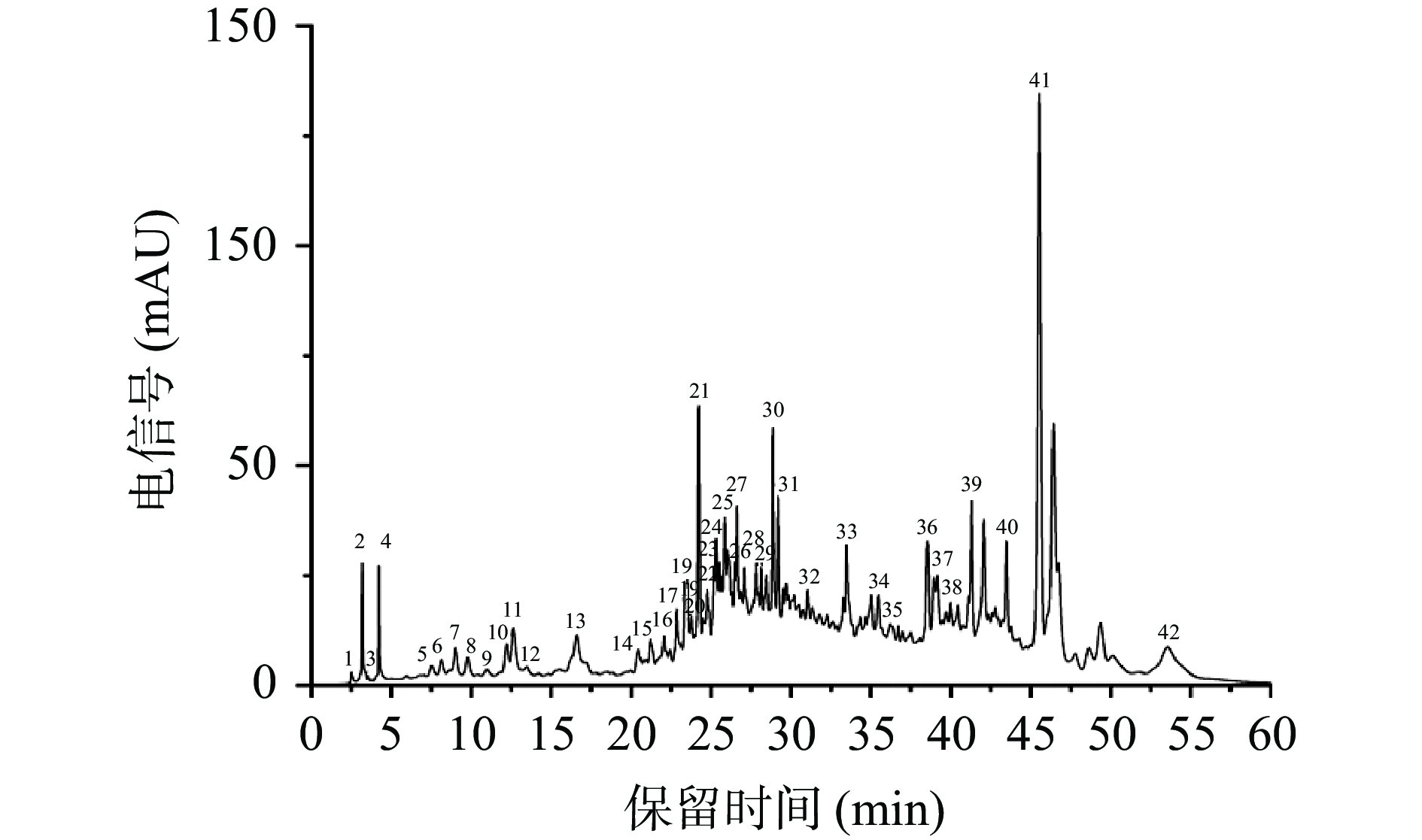
如图1和图2所示,桑叶中存在6种花色苷和42种非花色苷多酚。鉴定结果如表1所示,6种花色苷分别属于飞燕草素、矢车菊素和矮牵牛素,即A1号峰和A5号峰含有m/z 303的碎片离子峰,A2号峰和A4号峰含有m/z 287的碎片离子峰,而A3号峰和A6号峰含有m/z 317的碎片离子峰。A1、A2、A3号峰分别失去了一分子的槐糖基(324 Da),鉴定为飞燕草素-3-槐糖苷、矢车菊素-3-槐糖苷、矮牵牛素-3-槐糖苷。A4和A6号峰分别失去了一分子的葡萄糖基(162 Da),鉴定为矢车菊素-3-葡萄糖苷和矮牵牛素-3-葡萄糖苷。A5号峰失去了一分子的芸香糖基(308 Da),被鉴定为飞燕草素-3-芸香糖苷。
表 1 桑叶中多酚鉴定结果Table 1. Identification of polyphenols from mulberry leaves峰 保留
时间
(min)峰面积 化学式 相对分子质量MW MS期望值
[M]+/
([M-H]-)
(m/z)MS实际值
([M]+/
([M-H]-))
(m/z)MS2(m/z) 结构鉴定 结构鉴定 最大吸收
波长含量
(mg/100 g)参考
文献花色苷 A1 5.478 13.28776 C27H31O17+ 627 627.16 627.11 303.05 Delphinidin-3-sophoroside 飞燕草素-3-槐糖苷 530,269 14.62±0.45 [17] A2 5.662 6.37105 C30H27O14+ 611 611.16 611.16 287.05 Cyanidin-3-sophoroside 矢车菊素-3-槐糖苷 520,245 9.25±0.35 [17] A3 14.462 21.74310 C28H33O17+ 641 641.21 641.39 317.10 Petunidin-3-sophoroside 矮牵牛素-3-槐糖苷 289,311 5.17±0.85 [17] A4 14.576 9.18198 C21H21O11+ 449 449.14 449.11 287.05 Cyanidin-3-glucoside 矢车菊素-3-葡萄糖苷 285 11.07±0.49 [17] A5 14.793 18.17112 C27H31O16+ 611 611.16 611.37 303.05 Delphinidin-3-rutinoside 飞燕草素-3-芸香糖苷 532,280 16.78±1.82 [17] A6 27.677 36.38933 C22H23O12+ 479 479.06 479.34 317.29 Petunidin-3-glucoside 矮牵牛素-3-葡萄糖苷 500,280 33.36±0.72 [17] 黄酮醇和异黄酮醇类化合物 峰4 4.820 75.13943 C27H30O17 626 625.14 625.14 463.09/301.04 Quercetin-3,4-diglucoside 槲皮素-3,4-二葡萄糖苷 228,293,339 0.0086±0.0005 [18] 峰9 11.597 181.19679 C21H20O13 480 479.25 479.12 317.07 Myricetin-3-galactoside 杨梅素-3-半乳糖苷 320 0.018±0.0023 [18] 峰10 12.638 10.26042 C21H20O13 480 481.14 481.13 317.09 Myricetin-3-glucoside 杨梅素-3-葡萄糖苷 271,340 0.0017±0.0001 [18] 峰13 16.444 29.06368 C26H26O18 610 609.15 609.15 179.00/255.03/300.03/
301.03Quercetin hexose-hexoside 槲皮素己糖-己糖苷 281,338 0.0039±0.0002 [19] 峰14 20.879 116.30222 C30H24O13 610 609.15 609.15 300.03/301.03 Quercetin-7-p-coumaroylglucoside 槲皮素-7-p-苯二甲酰葡萄糖苷 230,287,318 0.017±0.004 [17] 峰16 22.414 129.79359 C27H30O15 594 593.15 593.15 284.03/285.04 Kaempferol-3-rutinoside 山奈酚-3-芸香苷 222,319 0.016±0.0007 [18] 峰17 22.791 43.84216 C21H20O11 448 447.15 447.09 175.04/285.04 Kaempferol-3-glucoside 山萘酚-3-葡萄糖苷 319,378 0.0059±0.0005 [18] 峰18 23.242 383.03568 C21H20O12 464 463.16 463.09 300.03/301.04 Quercetin-3-galactoside 槲皮素-3-半乳糖苷 283,322 0.047±0.0038 [18] 峰20 23.614 14.92902 C21H20O12 464 463.16 463.09 151.00/255.03/271.02/300.03/301.04 Hyperoside 金丝桃苷 227,260,311 0.0018±0.0005 [17] 峰21 24.776 110.33363 C21H20O12 464 463.16 463.16 301.11 Quercetin-3-glucoside 槲皮素-3-葡萄糖苷 270,318 0.017±0.0039 [18] 峰22 25.213 78.97507 C21H20O12 464 463.16 463.16 301.11 Quercetin-hexoside 槲皮素-己糖苷 259,360 0.0094±0.0003 [19] 峰24 25.514 49.61058 C21H20O11 448 447.15 447.09 285.04 Kaempferol-7-glucoside 山奈酚-7-葡萄糖苷 322 0.0061±0.0005 [17] 峰25 25.664 18.03053 C24H23O15 534 533.09 533.30 285.04 Kaempferol-malonylglucoside 山奈酚-丙二酰葡萄糖苷 238 0.0022±0.0006 [17] 峰26 26.874 153.58128 C23H22O12 490 489.15 489.10 285.04 Kaempferol-3- acetylglucoside 山奈酚-3-乙酰基葡萄糖苷 281 0.016±0.0016 [17] 峰27 27.061 144.18338 C23H25O13 490 489.15 489.10 285.04 Kaempferol acetyl hexoside 山奈酚乙酰基己糖苷 291 0.019±0.0050 [17] 峰30 28.867 44.54208 C22H22O12 478 477.18 477.18 315.12 Isorhamnetin-3-glucoside 异鼠李素-3-葡萄糖苷 288,369 0.0058±0.0006 [18] 峰31 29.110 82.88288 C22H20O13 520 519.03 519.32 315.12 Isorhamnetin-7-O-(6'-O-acetyl)-glucoside 异鼠李素-7-O-(6'-O-邻乙酰基)-葡萄糖苷 317 0.0092±0.0007 [17] 峰34 35.235 30.22433 C15H10O7 302 301.17 301.17 151.00/301.01 Quercetin 槲皮素 297 0.0046±0.0006 [18] 峰42 53.566 507.49435 C23H22O12 490 490.13 490.13 285.19 Kaempferol-3-acetylglucoside 山奈酚-3-乙酰糖苷 279,283,322 0.059±0.0050 [17] 黄烷酮醇类化合物 峰7 8.657 180.88162 C15H12O6 450 449.11 449.11 125.02/287.06/259.06 Aromadendrin-hexoside 香树素-己糖苷 289 0.022±0.0013 [20] 黄烷醇类化合物 峰36 38.720 6.44894 C15H14O6 290 289.01 288.99 220.98 Epicatechin 表儿茶素 229,285 13.79±0.42 [20] 峰39 42.779 43.31869 C15H14O6 290 289.01 289.14 245.15 (-)-Catechin (-)-儿茶素 241,310 89.67±0.61 [20] 黄酮类化合物 峰19 23.498 22.70310 C15H10O6 448 447.15 447.09 285.04 Luteolin-hexoside 木犀草素-己糖苷 310 0.0029±0.0004 [19] 峰23 25.328 102.19351 C21H20O11 448 448.10 448.10 285.04 Luteolin-6-glucoside 木犀草素-6-葡萄糖苷 229,282,341 0.012±0.0003 [19] 峰33 33.438 78.54156 C21H20O11 448 447.26 447.14 285.09 Luteolin-7-glucoside 木犀草素-7-葡萄糖苷 310 0.010±0.0018 [19] 黄烷酮类化合物 峰8 9.477 18.93921 C21H22O10 434 433.21 433.21 271.06 Naringenin-7-β-D-glucoside 柚皮素-7-β-D-葡萄糖苷 288,319 0.0031±0.0005 [19] 酚酸类化合物 峰1 2.520 18.67607 C7H6O3 138 137.02 137.02 93.03 Hydroxybenzoic acid 水杨酸 218,263 22.15±0.52 [20] 峰2 2.933 132.29228 C7H12O6 192 191.04 191.02 111.01/85.03 Quinic acid 奎宁酸 271 154.08±3.48 [17] 峰3 3.540 32.36152 C7H6O4 316 315.12 315.07 151.04/153.02/109.03 Protocatechuic acid hexoside 原儿茶酸己糖苷 296 37.27±1.55 [20] 峰5 7.591 28.32125 C15H18O8 326 325.14 325.09 163.04 p-Coumaroyl-glucoside p-香豆酰-葡萄糖苷 266,324 32.66±1.12 [21] 峰6 8.017 99.70862 C16H24O10 376 375.05 375.17 375.17 Gentianic acid 龙胆酸 230,295,341 117.43±1.77 [19] 峰11 12.924 71.06280 C25H24O12 516 515.07 515.17 515.17 Isochlorogenic acid isomer 1 异绿原酸 异构体1 280 86.02±1.41 [17] 峰12 13.258 103.07417 C17H20O9 368 367.16 367.10 134.04/191.06 Feruloyl quinic acid 阿魏酰奎宁酸 282,335 125.44±2.23 [21] 峰15 22.086 105.05109 C16H20O9 402 401.15 401.18 193.09 Ferulic acid glucoside 阿魏酸葡萄糖苷 284 126.22±1.19 [21] 峰28 27.482 52.37169 C9H8O4 180 179.06 179.00 135.05/134.99 Caffeic acid 咖啡酸 250,317 62.24±0.57 [19] 峰32 31.649 10.21614 C25H24O12 516 515.07 515.29 353.10 Isochlorogenic acid isomer 2 异绿原酸 异构体2 240,282 15.12±2.74 [17] 峰35 36.492 34.79720 C15H18O8 372 371.15 371.24 119.05/163.04/190.99/
325.24Coumaric acid-glucoside 香豆酸-葡糖苷 220,280 41.91±0.59 [21] 峰37 39.540 711.07288 C16H20O10 372 371.15 371.11 191.32 Trihydroxycinnamoylquinic acid 三羟基肉桂酰奎宁酸 221,318 847.62±2.06 [17] 峰38 40.194 118.17821 C7H6O4 154 153.09 153.02 109.03 Protocatechuic acid 原儿茶酸 281 144.79±3.28 [20] 峰40 43.267 176.97830 C16H18O9 354 353.00 353.14 179.14/191.06 Neochlorogenic acid 新绿原酸 331 214.88±3.13 [17] 峰41 45.529 5027.83203 C16H18O9 354 353.00 353.14 191.06 Chlorogenic acid 绿原酸 316 6004.14±3.59 [17] 原花青素二聚体 峰29 27.923 163.13426 C30H26O13 594 593.15 593.33 467.96/93.03/127.09 Procyanidin derivative 原花青素衍生物 269,347 673.48±2.76 [20] 桑叶中的非花色苷多酚种类十分丰富,根据表1的保留时间和质谱数据,对比非花色苷多酚的一级和二级质谱图和出峰顺序进行推断,和花色苷的推测方法一致,4、13、18、21、34号峰具有相同的碎片离子,m/z 611是槲皮素的特征离子,结合二级质谱碎片,推断4、13、18、21、34号峰分别是槲皮素-3,4-二葡萄糖苷、槲皮素己糖-己糖苷、槲皮素-3-半乳糖苷、槲皮素-3-葡萄糖苷、槲皮素。峰16、17、24、25、26、27和42都在m/z 285处产生特殊的MS2片段,其中峰16在m/z 593处具有分子离子峰,丢失308 Da,为一分子芸香糖基,因此推测为山奈酚-3-芸香苷。峰17在m/z 447处具有分子离子峰,丢失162 Da,为一分子葡萄糖基,因此推测为山奈酚-3-葡萄糖苷。同样的推测方法,可以得到峰24、25、26、27和42所对应的物质。峰9在m/z 479处有一个分子离子峰,丢失了一分子的半乳糖基,推测其为杨梅素-3-半乳糖苷。10号峰依据相同的方法被推测为杨梅素-3-葡萄糖苷。这些化合物都属于黄酮醇类化合物,由表1可知山奈酚-3-乙酰糖苷含量最高。
峰2在m/z 191处具有分子离子峰,因此推测为奎宁酸。峰12在m/z 367处具有分子离子峰,其在m/z 191处产生特殊的MS2片段,丢失176 Da,为一分子阿魏酰基,因此推测为阿魏酰奎宁酸。峰41在m/z 353处具有分子离子峰,其在m/z 191处产生特殊的MS2片段,因此推测为绿原酸。峰5在m/z 325处具有分子离子峰,其在m/z 163处产生特殊的MS2片段,丢失162 Da,为一分子葡萄糖,因此推测为p-香豆酰葡萄糖苷。这些化合物都属于酚酸类化合物。
峰8在m/z 433处具有分子离子峰,其在m/z 271处产生特殊的MS2片段,丢失162 Da,为一分子葡萄糖基,因此推测为柚皮素-7-β-D-葡萄糖苷,它属于黄烷酮类化合物。峰19、23和峰33均在m/z 285处产生特殊的MS2片段,峰33丢失162 Da,为一分子葡萄糖基,因此推测为木犀草素-7-葡萄糖苷,峰19和23分别为木犀草素-己糖苷和木犀草素-6-葡萄糖苷,它们属于黄酮类化合物。
2.2 桑叶中的多酚、花色苷、原花青素含量
为了测定多酚中各部分的生物活性,将多酚粗提液(0.07 g/mL)分离纯化为花色苷(0.0025 g/mL)、非花色苷多酚(0.011 g/mL)、水层(0.0035 g/mL)三部分。表2显示,所用的蒙古桑叶粗提液中的多酚含量为14.09 mg GA/g DW,而在非花色苷多酚中发现了更高的多酚含量(50.06 mg GA/g DW),是其它组分的3~10倍。这表明经过固相萃取之后,会使非花色苷多酚提取液中的总酚含量升高,可能因为去除了多酚粗提液中的糖酸等成分,这一结论在前人的研究中就已经发现[22]。Radojkovic等[23]测定了塞尔维亚几种白桑树和黑桑树桑叶中的总酚含量,从66.76 mg GA/g DW(白桑叶)到115.23(黑桑叶)mg GA/g DW,含量较高。桑叶中多酚含量的差异可能由桑叶的品种、生长环境和使用的提取方法不同决定。
表 2 桑叶中各组分的总酚、总花色苷、总原花青素的含量Table 2. Contents of total phenolic, total anthocyanin, and total proanthocyanidin of each component in mulberry leaves以往的研究并没有涉及总花色苷和总原花青素含量的测定,在这个研究中,桑叶粗提液中的总花色苷含量为0.17 mg C3G/g DW,总原花青素的含量为17.24 μg PA2/g DW,相比于总酚的含量,总花色苷和总原花青素含量占比不高。将粗提液分离后的花色苷多酚中的总花色苷含量为1.66 mg C3G/g DW,是其他组分的10~80倍。定量分析结果显示,桑叶中的原花青素含量较高,经过纯化之后,在非花色苷多酚中含有较高的总原花青素含量,结果一致。
2.3 桑叶提取物的抗氧化活性
前人的研究显示,桑叶提取物具有良好的抗氧化活性。Samuel等[24]对四个品种(S-146、AR-14、BR-2和S-1)的桑叶水提取物进行了研究,结果表明,桑叶水提取物可以降低实验动物大脑中的丙二醛(50.49%、36.14%、41.36%、37.13%)和超氧化物歧化酶(54.01%、40.18%、34.82%、29.74%)水平,具有显著的抗氧化活性。He等[25]利用DPPH法和FRAP法测定了不同地区(河北、江苏、广西、北京)桑叶粗提液的抗氧化性,分别为11.27~30.90 mg Trolox/g DW、14.87~39.46 mg FeSO4·7H2O/g DW。依据同样的方法(DPPH、FRAP),本课题组测定的蒙古桑叶(黑龙江)多酚粗提液中的抗氧化性分别为1.14 mg Trolox/g DW和2.17 mg FeSO4·7H2O/g DW,与上述结果相差较大。Liang等[26]研究表明,由于农业气候条件、土壤条件和地理位置的不同,即使是同一品种,桑叶中多酚也有很大差异,这可能是抗氧化活性相差较大的原因。为了进一步了解桑叶各组分的抗氧化活性,将桑叶粗提液分离纯化为花色苷、非花色苷多酚、水层,分别测定了他们的抗氧化活性,并跟粗提液进行了比较(表3)。相比于其他组分,无论哪种方法花色苷组分都显示出更高的抗氧化活性。可能原因是纯化后的总花色苷含量显著提高,而花色苷是影响植物抗氧化活性的重要因素。不同的测定方法得到的结果有所差异,刘庆庆等[27]通过DPPH和ORAC测定不同黄酮类化合物的抗氧化性,得到的结果相反,其抗氧化性跟C环和B环上的羟基的个数与位置有关。这说明不同多酚组分的不同结构可能对不同自由基的清除程度产生影响。
表 3 桑叶不同组成成分的抗氧化性Table 3. Antioxidant properties of different components of mulberry leaves样品 组成成分 抗氧化活性 DPPH
(mg Trolox/g DW)ABTS
(mg Trolox/g DW)FRAP
(mg FeSO4·7H2O/g DW)桑叶 多酚粗提液 1.14±0.02c 0.45±0.01d 2.17±0.12b 花色苷提取物 48.45±0.47a 12.64±0.07a 5.68±0.19a 非花色苷多酚提取物 10.87±0.04b 2.88±0.01c 0.09±0.03c 水层 0.79±0.10c 9.11±0.02b 0.03±0.01c 2.4 桑叶对α-淀粉酶的抑制作用
桑叶多酚粗提液对α-淀粉酶的抑制活性如表4所示,当其质量浓度为8.31 mg/mL时,表现出对α-淀粉酶的抑制活性(抑制率50%)。而Silva等[28]测定的黑桑叶粗提液的IC50为13.35 mg/mL,相比之下,蒙古桑叶表现出了较高的抗α-淀粉酶活性。在之前的报告中,已研究了分离的亚氨基糖(如1-DNJ)及其衍生物,以及多酚化合物(如桑叶中的类黄酮和二苯乙烯)的有效降血糖作用[29]。Silva等[28]研究发现,桑叶的降血糖作用可能依赖于异槲皮素和山奈酚。上述有效化合物大部分存在于非花色苷多酚中,在本实验中,不同组分对淀粉酶的抑制活性的结果是非花色苷多酚>多酚粗提液>水层>花色苷(表4),结果一致。非花色苷多酚对α-淀粉酶的抑制活性(IC50为0.25 mg/mL)略低于阿卡波糖(IC50为0.081 mg/mL),是多酚粗提液的33倍,水层(IC50为12.00 mg/mL)的48倍,花色苷(IC50为13.70 mg/mL)的55倍。因此,桑叶是预防糖尿病的潜在良好膳食来源,可以补充Ⅱ型糖尿病早期阶段的整体饮食管理。
表 4 桑叶不同组成成分对α-淀粉酶的抑制作用Table 4. Inhibitory effects of different components of mulberry leaves on α-amylase样品 抗α-淀粉酶活性
IC50 (mg/mL)IC50回归方程及决定系数 标准品 阿卡波糖 0.081b Y=435.3x+13.628, R2=0.9679 桑叶 多酚粗提液 8.31±1.32ab Y=6.654x+2.8681, R2=0.9834 花色苷提取物 13.70±11.76a Y=5.2571x+4.922, R2=0.8778 非花色苷多酚提取物 0.25±0.080b Y=203.45x+0.3905, R2=0.9953 水层 12.00±3.05a Y=4.9495x+0.9387, R2=0.9648 3. 结论
HPLC-PDA和HPLC-ESI/MS2分析结果表明,桑叶中含有丰富的多酚类物质,其中矮牵牛素-3-葡萄糖苷和原花青素衍生物含量最高。首次从桑叶中鉴定出香树素-己糖苷、木犀草素-己糖苷、木犀草素-6-葡萄糖苷、木犀草素-7-葡萄糖苷和柚皮素-7-β-D-葡萄糖苷。桑叶中总酚、总花色苷和总原花青素的含量分别为14.09 mg GAE/g DW、0.17 mg C3G/g DW和17.24 μg PA2/g。此外,体外活性实验表明桑叶具有较高的抗氧化能力和对α-淀粉酶的抑制作用,尤其是花色苷组分。这些发现将对进一步开发桑叶产品具有重要意义。在本实验中,首次将桑叶多酚粗提液分离纯化为三个组分,并分别测定了它们的活性,但每个组分都由多个化合物组成,未来的研究应关注哪种或几种化合物影响体外活性结果。有了这些前提,未来蒙古桑叶将会物尽其用,并根据其优势成分进入不同的产品加工领域。
-
表 1 桑叶中多酚鉴定结果
Table 1 Identification of polyphenols from mulberry leaves
峰 保留
时间
(min)峰面积 化学式 相对分子质量MW MS期望值
[M]+/
([M-H]-)
(m/z)MS实际值
([M]+/
([M-H]-))
(m/z)MS2(m/z) 结构鉴定 结构鉴定 最大吸收
波长含量
(mg/100 g)参考
文献花色苷 A1 5.478 13.28776 C27H31O17+ 627 627.16 627.11 303.05 Delphinidin-3-sophoroside 飞燕草素-3-槐糖苷 530,269 14.62±0.45 [17] A2 5.662 6.37105 C30H27O14+ 611 611.16 611.16 287.05 Cyanidin-3-sophoroside 矢车菊素-3-槐糖苷 520,245 9.25±0.35 [17] A3 14.462 21.74310 C28H33O17+ 641 641.21 641.39 317.10 Petunidin-3-sophoroside 矮牵牛素-3-槐糖苷 289,311 5.17±0.85 [17] A4 14.576 9.18198 C21H21O11+ 449 449.14 449.11 287.05 Cyanidin-3-glucoside 矢车菊素-3-葡萄糖苷 285 11.07±0.49 [17] A5 14.793 18.17112 C27H31O16+ 611 611.16 611.37 303.05 Delphinidin-3-rutinoside 飞燕草素-3-芸香糖苷 532,280 16.78±1.82 [17] A6 27.677 36.38933 C22H23O12+ 479 479.06 479.34 317.29 Petunidin-3-glucoside 矮牵牛素-3-葡萄糖苷 500,280 33.36±0.72 [17] 黄酮醇和异黄酮醇类化合物 峰4 4.820 75.13943 C27H30O17 626 625.14 625.14 463.09/301.04 Quercetin-3,4-diglucoside 槲皮素-3,4-二葡萄糖苷 228,293,339 0.0086±0.0005 [18] 峰9 11.597 181.19679 C21H20O13 480 479.25 479.12 317.07 Myricetin-3-galactoside 杨梅素-3-半乳糖苷 320 0.018±0.0023 [18] 峰10 12.638 10.26042 C21H20O13 480 481.14 481.13 317.09 Myricetin-3-glucoside 杨梅素-3-葡萄糖苷 271,340 0.0017±0.0001 [18] 峰13 16.444 29.06368 C26H26O18 610 609.15 609.15 179.00/255.03/300.03/
301.03Quercetin hexose-hexoside 槲皮素己糖-己糖苷 281,338 0.0039±0.0002 [19] 峰14 20.879 116.30222 C30H24O13 610 609.15 609.15 300.03/301.03 Quercetin-7-p-coumaroylglucoside 槲皮素-7-p-苯二甲酰葡萄糖苷 230,287,318 0.017±0.004 [17] 峰16 22.414 129.79359 C27H30O15 594 593.15 593.15 284.03/285.04 Kaempferol-3-rutinoside 山奈酚-3-芸香苷 222,319 0.016±0.0007 [18] 峰17 22.791 43.84216 C21H20O11 448 447.15 447.09 175.04/285.04 Kaempferol-3-glucoside 山萘酚-3-葡萄糖苷 319,378 0.0059±0.0005 [18] 峰18 23.242 383.03568 C21H20O12 464 463.16 463.09 300.03/301.04 Quercetin-3-galactoside 槲皮素-3-半乳糖苷 283,322 0.047±0.0038 [18] 峰20 23.614 14.92902 C21H20O12 464 463.16 463.09 151.00/255.03/271.02/300.03/301.04 Hyperoside 金丝桃苷 227,260,311 0.0018±0.0005 [17] 峰21 24.776 110.33363 C21H20O12 464 463.16 463.16 301.11 Quercetin-3-glucoside 槲皮素-3-葡萄糖苷 270,318 0.017±0.0039 [18] 峰22 25.213 78.97507 C21H20O12 464 463.16 463.16 301.11 Quercetin-hexoside 槲皮素-己糖苷 259,360 0.0094±0.0003 [19] 峰24 25.514 49.61058 C21H20O11 448 447.15 447.09 285.04 Kaempferol-7-glucoside 山奈酚-7-葡萄糖苷 322 0.0061±0.0005 [17] 峰25 25.664 18.03053 C24H23O15 534 533.09 533.30 285.04 Kaempferol-malonylglucoside 山奈酚-丙二酰葡萄糖苷 238 0.0022±0.0006 [17] 峰26 26.874 153.58128 C23H22O12 490 489.15 489.10 285.04 Kaempferol-3- acetylglucoside 山奈酚-3-乙酰基葡萄糖苷 281 0.016±0.0016 [17] 峰27 27.061 144.18338 C23H25O13 490 489.15 489.10 285.04 Kaempferol acetyl hexoside 山奈酚乙酰基己糖苷 291 0.019±0.0050 [17] 峰30 28.867 44.54208 C22H22O12 478 477.18 477.18 315.12 Isorhamnetin-3-glucoside 异鼠李素-3-葡萄糖苷 288,369 0.0058±0.0006 [18] 峰31 29.110 82.88288 C22H20O13 520 519.03 519.32 315.12 Isorhamnetin-7-O-(6'-O-acetyl)-glucoside 异鼠李素-7-O-(6'-O-邻乙酰基)-葡萄糖苷 317 0.0092±0.0007 [17] 峰34 35.235 30.22433 C15H10O7 302 301.17 301.17 151.00/301.01 Quercetin 槲皮素 297 0.0046±0.0006 [18] 峰42 53.566 507.49435 C23H22O12 490 490.13 490.13 285.19 Kaempferol-3-acetylglucoside 山奈酚-3-乙酰糖苷 279,283,322 0.059±0.0050 [17] 黄烷酮醇类化合物 峰7 8.657 180.88162 C15H12O6 450 449.11 449.11 125.02/287.06/259.06 Aromadendrin-hexoside 香树素-己糖苷 289 0.022±0.0013 [20] 黄烷醇类化合物 峰36 38.720 6.44894 C15H14O6 290 289.01 288.99 220.98 Epicatechin 表儿茶素 229,285 13.79±0.42 [20] 峰39 42.779 43.31869 C15H14O6 290 289.01 289.14 245.15 (-)-Catechin (-)-儿茶素 241,310 89.67±0.61 [20] 黄酮类化合物 峰19 23.498 22.70310 C15H10O6 448 447.15 447.09 285.04 Luteolin-hexoside 木犀草素-己糖苷 310 0.0029±0.0004 [19] 峰23 25.328 102.19351 C21H20O11 448 448.10 448.10 285.04 Luteolin-6-glucoside 木犀草素-6-葡萄糖苷 229,282,341 0.012±0.0003 [19] 峰33 33.438 78.54156 C21H20O11 448 447.26 447.14 285.09 Luteolin-7-glucoside 木犀草素-7-葡萄糖苷 310 0.010±0.0018 [19] 黄烷酮类化合物 峰8 9.477 18.93921 C21H22O10 434 433.21 433.21 271.06 Naringenin-7-β-D-glucoside 柚皮素-7-β-D-葡萄糖苷 288,319 0.0031±0.0005 [19] 酚酸类化合物 峰1 2.520 18.67607 C7H6O3 138 137.02 137.02 93.03 Hydroxybenzoic acid 水杨酸 218,263 22.15±0.52 [20] 峰2 2.933 132.29228 C7H12O6 192 191.04 191.02 111.01/85.03 Quinic acid 奎宁酸 271 154.08±3.48 [17] 峰3 3.540 32.36152 C7H6O4 316 315.12 315.07 151.04/153.02/109.03 Protocatechuic acid hexoside 原儿茶酸己糖苷 296 37.27±1.55 [20] 峰5 7.591 28.32125 C15H18O8 326 325.14 325.09 163.04 p-Coumaroyl-glucoside p-香豆酰-葡萄糖苷 266,324 32.66±1.12 [21] 峰6 8.017 99.70862 C16H24O10 376 375.05 375.17 375.17 Gentianic acid 龙胆酸 230,295,341 117.43±1.77 [19] 峰11 12.924 71.06280 C25H24O12 516 515.07 515.17 515.17 Isochlorogenic acid isomer 1 异绿原酸 异构体1 280 86.02±1.41 [17] 峰12 13.258 103.07417 C17H20O9 368 367.16 367.10 134.04/191.06 Feruloyl quinic acid 阿魏酰奎宁酸 282,335 125.44±2.23 [21] 峰15 22.086 105.05109 C16H20O9 402 401.15 401.18 193.09 Ferulic acid glucoside 阿魏酸葡萄糖苷 284 126.22±1.19 [21] 峰28 27.482 52.37169 C9H8O4 180 179.06 179.00 135.05/134.99 Caffeic acid 咖啡酸 250,317 62.24±0.57 [19] 峰32 31.649 10.21614 C25H24O12 516 515.07 515.29 353.10 Isochlorogenic acid isomer 2 异绿原酸 异构体2 240,282 15.12±2.74 [17] 峰35 36.492 34.79720 C15H18O8 372 371.15 371.24 119.05/163.04/190.99/
325.24Coumaric acid-glucoside 香豆酸-葡糖苷 220,280 41.91±0.59 [21] 峰37 39.540 711.07288 C16H20O10 372 371.15 371.11 191.32 Trihydroxycinnamoylquinic acid 三羟基肉桂酰奎宁酸 221,318 847.62±2.06 [17] 峰38 40.194 118.17821 C7H6O4 154 153.09 153.02 109.03 Protocatechuic acid 原儿茶酸 281 144.79±3.28 [20] 峰40 43.267 176.97830 C16H18O9 354 353.00 353.14 179.14/191.06 Neochlorogenic acid 新绿原酸 331 214.88±3.13 [17] 峰41 45.529 5027.83203 C16H18O9 354 353.00 353.14 191.06 Chlorogenic acid 绿原酸 316 6004.14±3.59 [17] 原花青素二聚体 峰29 27.923 163.13426 C30H26O13 594 593.15 593.33 467.96/93.03/127.09 Procyanidin derivative 原花青素衍生物 269,347 673.48±2.76 [20] 表 2 桑叶中各组分的总酚、总花色苷、总原花青素的含量
Table 2 Contents of total phenolic, total anthocyanin, and total proanthocyanidin of each component in mulberry leaves
表 3 桑叶不同组成成分的抗氧化性
Table 3 Antioxidant properties of different components of mulberry leaves
样品 组成成分 抗氧化活性 DPPH
(mg Trolox/g DW)ABTS
(mg Trolox/g DW)FRAP
(mg FeSO4·7H2O/g DW)桑叶 多酚粗提液 1.14±0.02c 0.45±0.01d 2.17±0.12b 花色苷提取物 48.45±0.47a 12.64±0.07a 5.68±0.19a 非花色苷多酚提取物 10.87±0.04b 2.88±0.01c 0.09±0.03c 水层 0.79±0.10c 9.11±0.02b 0.03±0.01c 表 4 桑叶不同组成成分对α-淀粉酶的抑制作用
Table 4 Inhibitory effects of different components of mulberry leaves on α-amylase
样品 抗α-淀粉酶活性
IC50 (mg/mL)IC50回归方程及决定系数 标准品 阿卡波糖 0.081b Y=435.3x+13.628, R2=0.9679 桑叶 多酚粗提液 8.31±1.32ab Y=6.654x+2.8681, R2=0.9834 花色苷提取物 13.70±11.76a Y=5.2571x+4.922, R2=0.8778 非花色苷多酚提取物 0.25±0.080b Y=203.45x+0.3905, R2=0.9953 水层 12.00±3.05a Y=4.9495x+0.9387, R2=0.9648 -
[1] 张媛. 桑叶的营养成分和食用药用开发价值研究进展[J]. 现代农业科技,2012(22):264−266. [ZHANG Y. Research progress on nutritional components and edible and medicinal value of mulberry leaves[J]. Modern Agricultural Science and Technology,2012(22):264−266. [2] HASSAN F, ARSHAD M A, LI M, et al. Potential of mulberry leaf biomass and its flavonoids to improve production and health in ruminants: Mechanistic insights and prospects[J]. Animals,2020,10(11):2076. doi: 10.3390/ani10112076
[3] JI T, LI J, SU S L, et al. Identification and determination of the polyhydroxylated alkaloids compounds with α-glucosidase inhibitor activity in mulberry leaves of different origins[J]. Molecules,2016,21(2):206. doi: 10.3390/molecules21020206
[4] WANG Z, TANG C, DAI F, et al. HPLC determination of phenolic compounds in different solvent extracts of mulberry leaves and antioxidant capacity of extracts[J]. International Journal of Food Properties,2021,24(1):544−552. doi: 10.1080/10942912.2021.1904980
[5] YU Y, LI H, ZHANG B, et al. Nutritional and functional components of mulberry leaves from different varieties: Evaluation of their potential as food materials[J]. International Journal of Food Properties,2018,21(1):1495−1507. doi: 10.1080/10942912.2018.1489833
[6] THABTI I, ELFALLEH W, HANNACHI H, et al. Identification and quantification of phenolic acids and flavonol glycosides in Tunisian Morus species by HPLC-DAD and HPLC–MS[J]. Journal of Functional Foods,2012,4(1):367−374. doi: 10.1016/j.jff.2012.01.006
[7] HAO J Y, WAN Y, YAO X H, et al. Effect of different planting areas on the chemical compositions and hypoglycemic and antioxidant activities of mulberry leaf extracts in Southern China[J]. PLoS One,2018,13(6):e0198072. doi: 10.1371/journal.pone.0198072
[8] LOWN M, FULLER R, LIGHTOWLER H, et al. Mulberry-extract improves glucose tolerance and decreases insulin concentrations in normoglycaemic adults: Results of a randomised double-blind placebo-controlled study[J]. PLoS One,2017,12(2):e0172239. doi: 10.1371/journal.pone.0172239
[9] KIM D, LEE C Y. Extraction and isolation of polyphenolics[J]. Current Protocols in Food Analytical Chemistry,2002,6(1):1−12.
[10] WATERHOUSE A L. Determination of total phenolics[J]. Current Protocols in Food Analytical Chemistry,2002,6(1):I1.1.1−I1.1.8.
[11] GIUSTI M M, WROLSTAD R E. Characterization and measurement of anthocyanins by UV-visible spectroscopy[J]. Current Protocols in Food Analytical Chemistry,2001(1):F1.2.1−F1.2.13.
[12] RODRÍGUEZ-PÉREZ C, QUIRANTES-PINÉ R, CONTRERAS M M, et al. Assessment of the stability of proanthocyanidins and other phenolic compounds in cranberry syrup after gamma-irradiation treatment and during storage[J]. Food Chemistry,2015,174:392−399. doi: 10.1016/j.foodchem.2014.11.061
[13] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25−30. doi: 10.1016/S0023-6438(95)80008-5
[14] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9−10):1231−1237. doi: 10.1016/S0891-5849(98)00315-3
[15] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": The FRAP assay[J]. Analytical Biochemistry,1996,239(1):70−76. doi: 10.1006/abio.1996.0292
[16] LIU T, SONG L, WANG H, et al. A high-throughput assay for quantification of starch hydrolase inhibition based on turbidity measurement[J]. Journal of Agricultural and Food Chemistry,2011,59(18):9756−9762. doi: 10.1021/jf202939d
[17] CARAZZONE C, MASCHERPA D, GAZZANI G, et al. Identification of phenolic constituents in red chicory salads (Cichorium intybus) by high-performance liquid chromatography with diode array detection and electrospray ionisation tandem mass spectrometry[J]. Food Chemistry,2013,138(2-3):1062−1071. doi: 10.1016/j.foodchem.2012.11.060
[18] DE BRITO E S, DE ARAÚJO M C P, LIN L Z, et al. Determination of the flavonoid components of cashew apple (Anacardium occidentale) by LC-DAD-ESI/MS[J]. Food Chemistry,2007,105(3):1112−1118. doi: 10.1016/j.foodchem.2007.02.009
[19] CHEN H J, INBARAJ B S, CHEN B H. Determination of phenolic acids and flavonoids in Taraxacum formosanum Kitam by liquid chromatography-tandem mass spectrometry coupled with a post-column derivatization technique[J]. International Journal of Molecular Sciences,2012,13(12):260−285.
[20] ÁLVAREZ-FERNÁNDEZ M A, CEREZO A B, CANETE-RODRIGUEZ A M, et al. Composition of nonanthocyanin polyphenols in alcoholic-fermented strawberry products using LC-MS (QTRAP), high-resolution MS (UHPLC-Orbitrap-MS), LC-DAD, and antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2015,63(7):2041−2051. doi: 10.1021/jf506076n
[21] HAO M, BETA T. Qualitative and quantitative analysis of the major phenolic compounds as antioxidants in barley and flaxseed hulls using HPLC/MS/MS[J]. Journal of the Science of Food and Agriculture,2012,92(10):2062−2068. doi: 10.1002/jsfa.5582
[22] HAN F L. Principal component regression analysis of the relation between cielab color and monomeric anthocyanins in young cabernet sauvignon wines[J]. Molecules,2008,13(11):2859−2870. doi: 10.3390/molecules13112859
[23] RADOJKOVIĆ M M, ZEKOVIĆ Z P, VIDOVIĆ S S, et al. Free radical scavenging activity and total phenolic and flavonoid contents of mulberry (Morus spp. L., Moraceae) extracts[J]. Hemijska Industrija,2012,66(4):547−552. doi: 10.2298/HEMIND111111002R
[24] SHEEBA SAJI S, ABHISHEK D R R, VENKATESH K R. Anti-oxidant activity of various leaf extracts of mulberry species in rotenone induced oxidative stress model of rat[J]. J Chem Pharm Sci,2016,9:2732−2736.
[25] HE X, CHEN X, OU X, et al. Evaluation of flavonoid and polyphenol constituents in mulberry leaves using HPLC fingerprint analysis[J]. International Journal of Food Science & Technology,2020,55(2):526−533.
[26] LIANG L, WU X, ZHU M, et al. Chemical composition, nutritional value, and antioxidant activities of eight mulberry cultivars from China[J]. Pharmacognosy Magazine,2012,8(31):215−224. doi: 10.4103/0973-1296.99287
[27] 刘庆庆, 张薇娜, 刘琴. 不同方法比较黄酮类化合物抗氧化性及其构效关系分析[J]. 食品工业科技,2016,37(23):109−114. [LIU Q Q, ZHANG W N, LIU Q. Comparison studies on antioxidant capacities of flavonoids by different assays and the structure-activity relationship implication[J]. Science and Technology of Food Industry,2016,37(23):109−114. [28] SILVA D H A, BARBOSA H M, BELTRÃO R L A, et al. Hexane fraction from Brazilian Morus nigra leaves improved oral carbohydrate tolerance and inhibits α-amylase and α-glucosidase activities in diabetic mice[J]. Natural Product Research,2020:1−4.
[29] YANG Z, WANG Y, WANG Y, et al. Bioassay-guided screening and isolation of α-glucosidase and tyrosinase inhibitors from leaves of Morus alba[J]. Food Chemistry,2012,131(2):617−625. doi: 10.1016/j.foodchem.2011.09.040
-
期刊类型引用(5)
1. 袁辛锐,杨其长,王芳,林致通. 紫胡萝卜复合发酵饮料的研制及其挥发性风味物质分析. 食品工业科技. 2024(02): 201-209 .  本站查看
本站查看
2. 林彦,段涵怡,叶敬榕,杨雪,张凤英. 微波辅助热水浸提黄芩茎叶多糖的工艺优化. 饲料工业. 2024(10): 106-112 .  百度学术
百度学术
3. 黄越,黄传书,杨碧文,赵珮,刘艳,王梅,吴均,戴宏杰. 桑椹酒发酵工艺优化及其挥发性成分分析. 食品研究与开发. 2024(12): 111-119 .  百度学术
百度学术
4. 赵港国,李晓晓,张婧靖,王军燕,麻静静,甄攀,贾丽艳. 基于响应面法优化库德毕赤酵母强化发酵工艺生产清香型白酒. 中国酿造. 2024(08): 224-229 .  百度学术
百度学术
5. 崔粲,梁雨璐,黄建梅. 党参酒发酵工艺优化及成分表征. 中国现代中药. 2024(10): 1754-1764 .  百度学术
百度学术
其他类型引用(4)











 下载:
下载:
 下载:
下载:
