Preparation and Characterization of Yak Ghee Microcapsules
-
摘要: 为提高传统牦牛酥油的贮藏稳定性和生物利用率,本实验以海藻酸钠、CaCl2为复合壁材,以锐孔法制备牦牛酥油微胶囊。以包埋率为指标,通过单因素实验和正交试验确定最佳工艺参数,使用差式扫描量热仪(DSC)、热重分析(TGA)、傅里叶红外光谱(FTIR)、扫描电子显微镜(SEM)和激光粒度仪测定其理化性质,并研究微胶囊在胃肠液中的释放特性及贮藏稳定性。结果表明,当海藻酸钠浓度1.5%,CaCl2浓度2.5%,芯壁质量比1.5:1,乳化温度50 ℃,固化时间30 min时,微胶囊包埋率最高为89.41%;含水量为5.25%、溶解度为57.22%、休止角为20.6°;平均粒径为929.773 µm,酥油在微胶囊化后热稳定性提高;释放实验表明,微胶囊在模拟胃液、肠液中释放率分别为11.52%、96.44%;贮藏实验表明,微胶囊货架期较牦牛酥油显著延长。Abstract: To improve the storage stability and bioavailability of traditional yak ghee, sodium alginate and CaCl2 were used as composite wall materials in this experiment, and yak ghee microcapsules were prepared using the sharp hole method. The optimal ghee microcapsule process parameters were determined using single factor experiment and orthogonal test with embedding rate as an index. Differential scanning calorimeter (DSC), thermogravimetric analysis (TGA), Fourier transform infrared spectroscopy (FTIR), scanning electron microscope (SEM), and laser particle size analyzer were used to determine the physicochemical properties of ghee microcapsules. Finally, the characteristics of ghee microcapsule release and storage stability in gastroenteric fluid were investigated. The results showed that when the sodium alginate concentration was 1.5%, the CaCl2 concentration was 2.5%, the core to wall mass ratio was 1.5:1, the emulsification temperature was 50 °C, and the curing time was 30 minutes, the maximum encapsulation rate of microcapsules was 89.41%. The water content, solubility, angle of repose and average particle size of the microcapsules were 5.25%, 57.22%, 20.6° and 929.773 µm, respectively. After microencapsulation, thermal stability of ghee improved. In the release test, microcapsules were released at rates of 11.52% and 96.44% in stomach and intestinal liquids. Microcapsules had a substantially longer shelf life than yak ghee.
-
Keywords:
- microcapsules /
- yak ghee /
- piercing method /
- structure characterization /
- in vitro release /
- shelf life forecast
-
牦牛是西藏高原高寒地区的优势物种[1]。牦牛奶中n-3多不饱和脂肪酸、n-6多不饱和脂肪酸和共轭亚油酸(Conjugated linoleic acid,CLA)等含量比普通牛乳高,CLA含量为0.596 mg/mL,是黑白花奶牛的11.4倍,牦牛酥油营养价值高[2],且功能性脂肪酸含量高[3−4],是优良的高脂肪食品。同时,牦牛酥油中的鞘磷脂能有效预防组织炎症的发生[5]。手工制作的酥油比机械制作的酥油呈香物质(醇类、脂类等)更丰富,更受人们的喜爱[6−7],但其水分含量高会导致在储存过程中脂肪被氧化水解,产生有害的物质[8],造成牦牛酥油质量下降,将其微胶囊化可以降低酥油氧化速率,保持品质。
微胶囊是使用一种或几种稳定的分子材料(壁材)将不稳定物质(芯材)包埋,可以有效防止芯材跟外界接触,起到防止氧化,延缓风味物质在储藏期间释放的作用,还可以控制芯材在特定部位释放[9]。制备微胶囊常用的方法有喷雾干燥法、复合凝聚法、锐孔法等。锐孔法是以可溶性聚合物为壁材,在凝固浴中固化,将芯材封装成微胶囊的方法[10],具有快速简便、资金投入少、产品的粒径和形态都较均匀等优点,适合应用于食品工业中。
目前,牦牛酥油微胶囊主要是采用喷雾干燥法制备[11-12],而喷雾干燥法制成的微胶囊在胃液中没有很好的缓释性,不能很好地保护酥油的功能性脂肪酸经过胃酸而不被破坏且其在高湿环境中容易破裂[13]。因此,本实验选择海藻酸钠和CaCl2的复合产物作为壁材,采用锐孔法将牦牛酥油微胶囊化,通过单因素实验和正交试验来确定其最佳制备工艺,并测定其理化性质,对制备的微胶囊结构进行表征,测定其热稳定性以及在胃肠液中的释放特性,并测定其贮藏稳定性。以获得一种包埋率高,稳定性高的微胶囊产品,并为深入研究酥油微胶囊在胃肠道内的消化吸收能力提供实验依据。
1. 材料与方法
1.1 材料与仪器
酥油(四川红原) 传统手工酥油;海藻酸钠 食品级,连云港天天海藻工业有限公司;无水氯化钙 分析纯,成都市科隆化学品有限公司;HCl、NaOH、磷酸二氢钾、异辛烷、冰乙酸、硫代硫酸钠 均为分析纯,成都市科龙化工试剂厂;胃蛋白酶(1:3000)、胰蛋白酶(1:20) 均为食品级,如吉生物科技公司。
HMS-203D加热型磁力搅拌器 上海沪浙实业有限公司;Master Sizer 2000激光粒度仪 英国Malvern Panalytical公司;Nicolet 380傅里叶变换红外光谱仪 美国Thermo Electron公司;STA 449C同步热分析仪 德国Netzsch公司;Sigma 600场发射扫描电镜 德国Carl Zeiss Jena公司;DSC-60A差示扫描量热仪 岛津国际贸易(上海)有限公司;HR83水分测定仪 瑞士Mettler Toledo公司。
1.2 实验方法
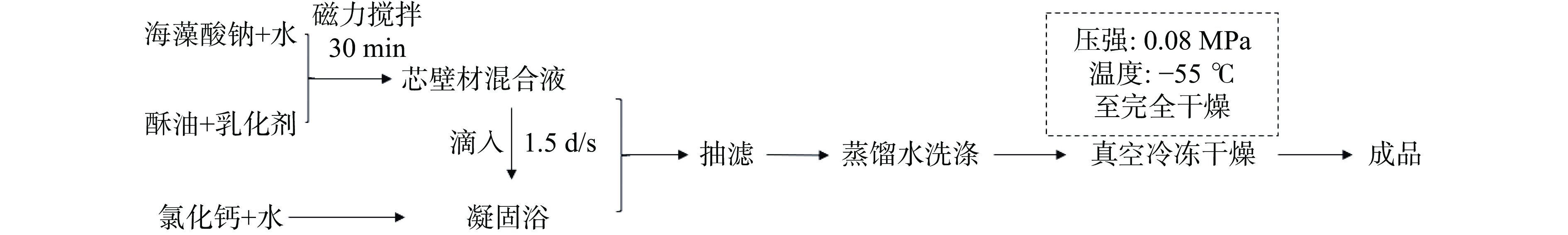
1.2.1 微胶囊制备工艺流程
微胶囊制备工艺流程如图1所示。
1.2.2 单因素实验
按照1.2.1流程制备牦牛酥油微胶囊,固定初始条件:乳化剂3%(单甘酯:蔗糖酯=2:3),海藻酸钠浓度1.5%,芯壁质量比2:1,CaCl2浓度2.5%,乳化温度50 ℃,固化时间35 min。以包埋率为指标,分别以海藻酸钠浓度(0.5%、1.0%、1.5%、2.0%、2.5%)、CaCl2浓度(1.0%、1.5%、2.0%、2.5%、3.0%)、芯壁质量比(1:1.5、1:1、1.5:1、2:1、2.5:1、)、乳化温度(40、45、50、55、60 ℃)、固化时间(25、30、35、40、45 min)5个因素进行单因素实验。
1.2.3 正交工艺优化试验
单因素实验后选取海藻酸钠浓度(A)、CaCl2浓度(B)、芯壁质量比(C),进行三因素三水平正交试验,优化锐孔法制备酥油微胶囊工艺。试验因素水平表见表1。
表 1 正交因素水平表Table 1. Orthogonal factor level table水平 因素 A(%) B(%) C 1 1.0 1.5 1:1 2 1.5 2.0 1.5:1 3 2.0 2.5 2:1 1.2.4 包埋率
以包埋率为指标检测酥油微胶囊化效果。参考陈欣等[14]的方法测定酥油微胶囊的表面油、总油的含量,计算公式见式(1)。
E(%)=(1−E1E2)×100 (1) 式中:E表示包埋率,%;E1表示表面油含量,mg;E2表示总油含量,mg。
1.2.5 基本理化性质测定
1.2.5.1 含水量
含水量参照GB 2009.3-2016进行测定。
1.2.5.2 溶解度
溶解度参照刘斯博[15]的方法进行测定。
1.2.5.3 流动性
休止角的大小参考姚泽晨等[16]的方法进行测定。
1.2.6 粒径分布分析
参照Bee等[17]的方法,以水为分散剂,使用激光粒度分析仪测定微胶囊的粒度分布。
1.2.7 微观形态表征
将酥油微胶囊置于样品室内,采用扫描电子显微镜(SEM)在加速电压20 kV下观察微胶囊的表面形态,并选择分布较均匀的视野进行拍照。
1.2.8 微胶囊的傅里叶红外光谱分析
准确称取2 mg微胶囊、酥油、壁材样品各一份;样品:溴化钾质量比为1:100,在研钵混合研磨后压片,在400~4000 cm−1范围内扫描。
1.2.9 热稳定性分析
1.2.9.1 热重分析
将酥油微胶囊(3~5 mg)放入小坩埚中,设置同步热分析仪参数温度范围30~600 ℃,升温速度10 ℃/min,载气为氮气,速率为20 mL/min,进行微分热重(Derivative thermogravimetry,DTG)分析,测定样品的热释放曲线。
1.2.9.2 差示扫描热分析
参考姜雪等[18]的方法分析胶囊的热力学特性。称取2 mg酥油微胶囊样品置于铝盒中,温度从20 ℃加热到300 ℃,升温速率10 ℃/min。
1.2.10 体外释放模拟实验
按照Chung等[19]的方法配制人工胃液;按照周莉等[20]的方法配制人工肠液。
按照程翎[21]的方法进行体外释放模拟实验并按照下式测定累积释放率,计算公式见式(2)。
Q(%)=Q1Q2×100 (2) 式中:Q表示累计释放率,%;Q1表示过滤液中脂肪含量,mg;Q2表示微胶囊产品中总油含量,mg。
1.2.11 酥油微胶囊贮藏稳定性实验
1.2.11.1 温度对酥油微胶囊贮藏稳定性的影响
将酥油和制备的微胶囊放在25、60 ℃下避光保存,每2 d取1g样品,共五次,参照GB 5009.227-2016的方法,测定其过氧化值(POV)。
1.2.11.2 光照对酥油微胶囊贮藏稳定性的影响
将酥油和制备的微胶囊放在室温下避光和光照保存,每2 d取1g样品,共五次,按照1.2.11.1的方法测定过氧化值(POV)。
1.2.11.3 酥油和酥油微胶囊氧化动力学研究及货架期预测
零级或一级动力学,其方程分别见式(3)、(4):
零级动力学:
A=A0−kt (3) 一级动力学:
A=A0exp(kt) (4) 式中:A表示t时间后样品过氧化值,mmol/kg;A0表示初始过氧化值,mmol/kg;k表示反应速率常数;t表示贮藏时间,d。
将实验数据代入两个方程中,用Origin 2021软件拟合,得到回归方程和回归系数R2,选取R2较大的回归方程,将其代入方程,得到预测贮藏时间。
1.3 数据处理
所有实验均重复3次。使用SPSS 23.0软件对数据进行多重比较分析,以P<0.05为差异显著。采用Origin 2021软件进行绘图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 海藻酸钠浓度对包埋率的影响
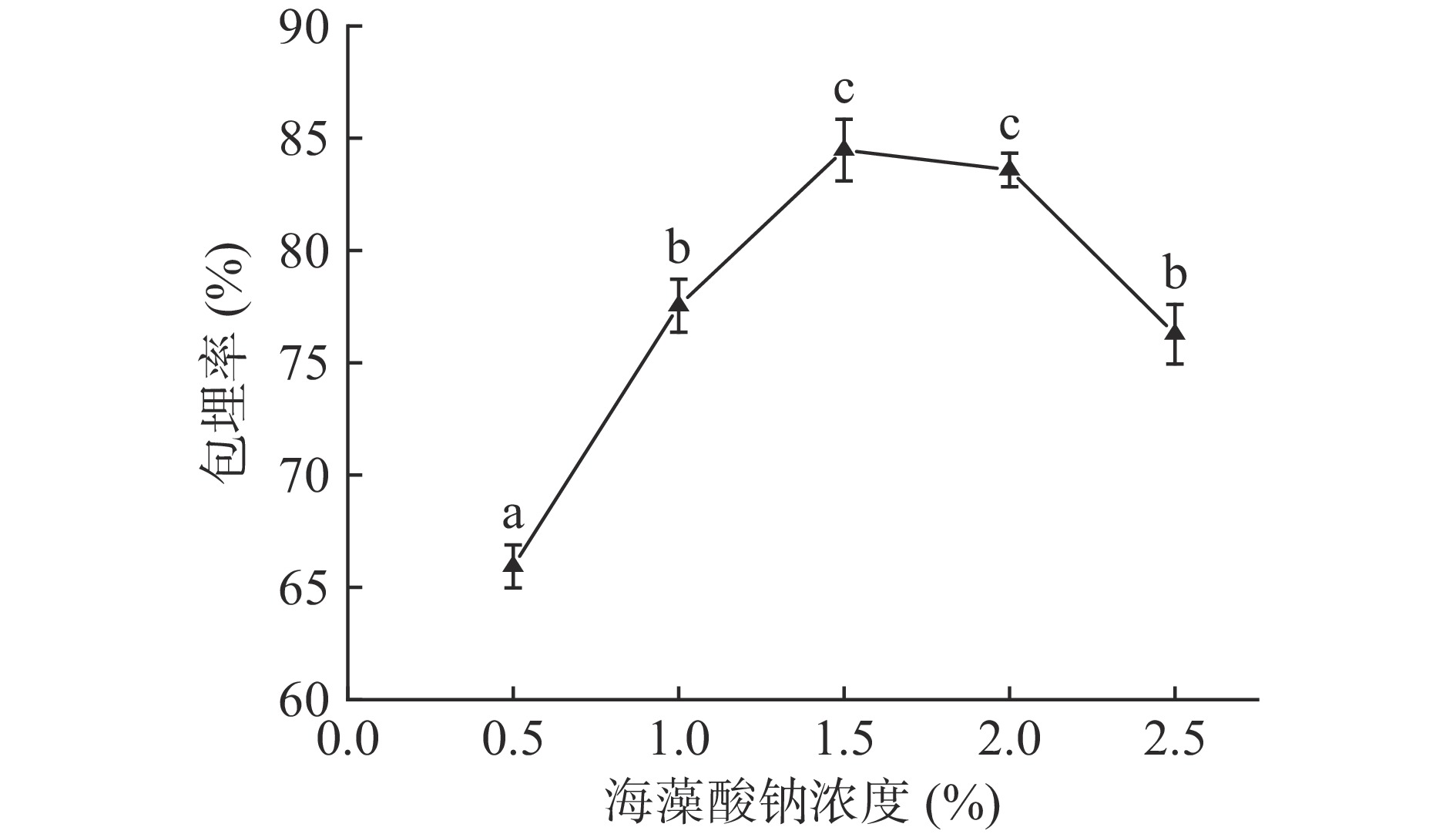
由图2可知,海藻酸钠浓度的变化会导致酥油微胶囊包埋率的变化,总体呈先上升后下降的趋势。海藻酸钠的粘度与浓度呈正相关,浓度低时粘度低,通过注射器时不易成型,且制备出来的微胶囊外壁较薄,在后期的处理中容易被破坏,导致包埋率下降。海藻酸钠浓度增加后,粘度增大,通过注射器形成的微胶囊成型效果越来越好,包埋率上升,在海藻酸钠浓度为1.5%时包埋率达到最大,为84.47%。随后海藻酸钠浓度上升,包埋率下降,主要是因为海藻酸钠浓度增大,粘度也越来越高,使得成型所需要的推进压力越来越高,挤压成型困难[22],导致微胶囊包埋率降低。因此,海藻酸钠浓度选择1.0%、1.5%、2.0%作为正交优化试验的三个水平。
2.1.2 CaCl2浓度对包埋率的影响
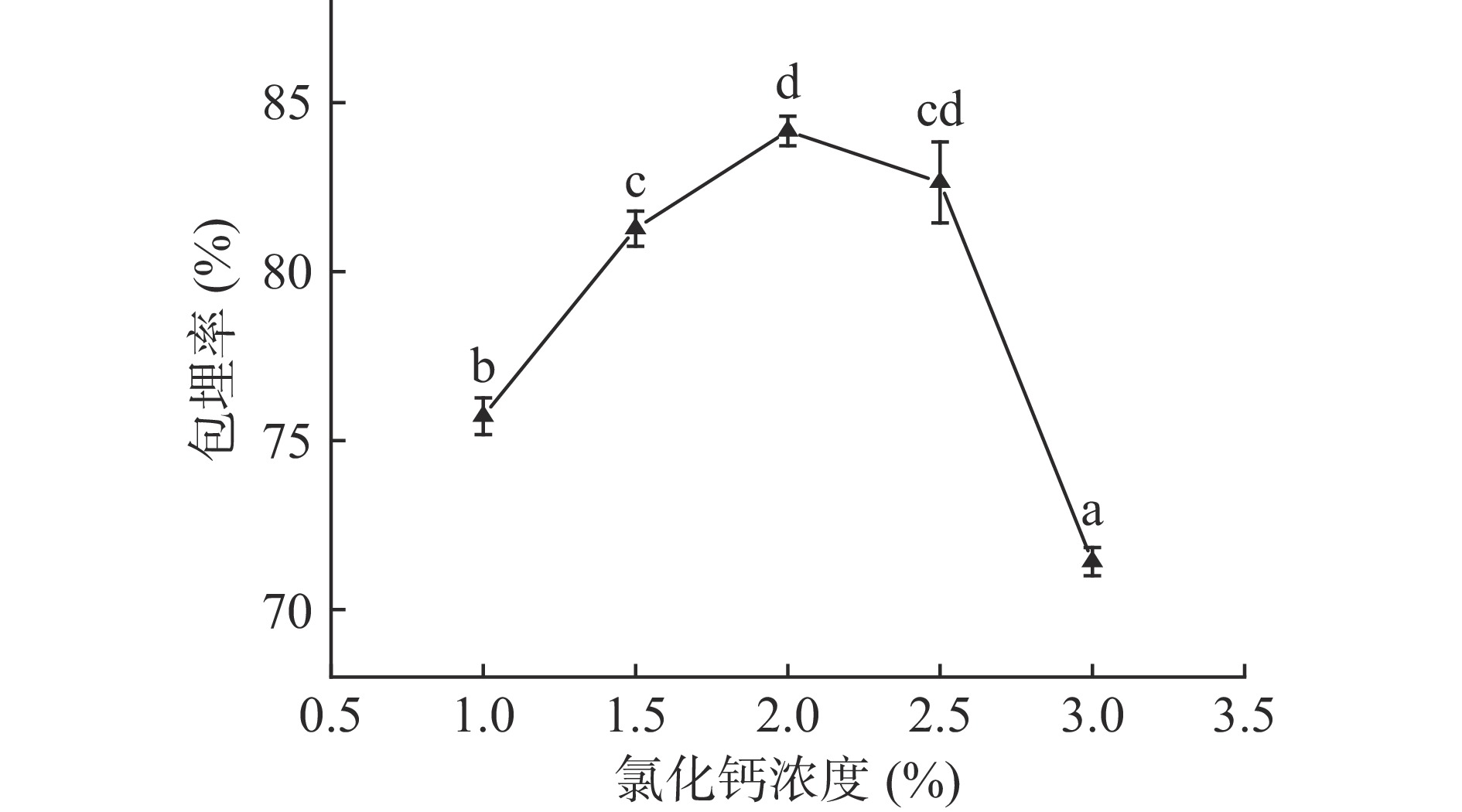
由图3可知,CaCl2浓度升高,包埋率也随之变化,总体呈先上升后下降的趋势。在海藻酸钠中添加CaCl2,两者之间发生反应,形成“蛋盒二聚体”,可以将芯材包埋在壁材里且获得稳定的结构[23]。当CaCl2浓度较低,芯壁材混合液滴入凝固浴时,海藻酸钠和Ca2+没有完全反应,导致成膜速度慢,且形成的膜较薄,不能将酥油有效地包封在微胶囊内部。随着CaCl2浓度逐渐升高,包埋率随之变大,CaCl2浓度为2.0%时,包埋率最大,包埋率为84.16%。当CaCl2浓度继续增加,包埋率开始降低。这是因为CaCl2浓度高,海藻酸钠和CaCl2迅速反应,外层快速凝固,导致CaCl2与海藻酸钠形成的结构过于紧密,不能很好地将酥油包埋进去[24]。因此,CaCl2浓度选1.5%、2%、2.5%作为正交优化试验的三个水平。
2.1.3 芯壁质量比对包埋率的影响
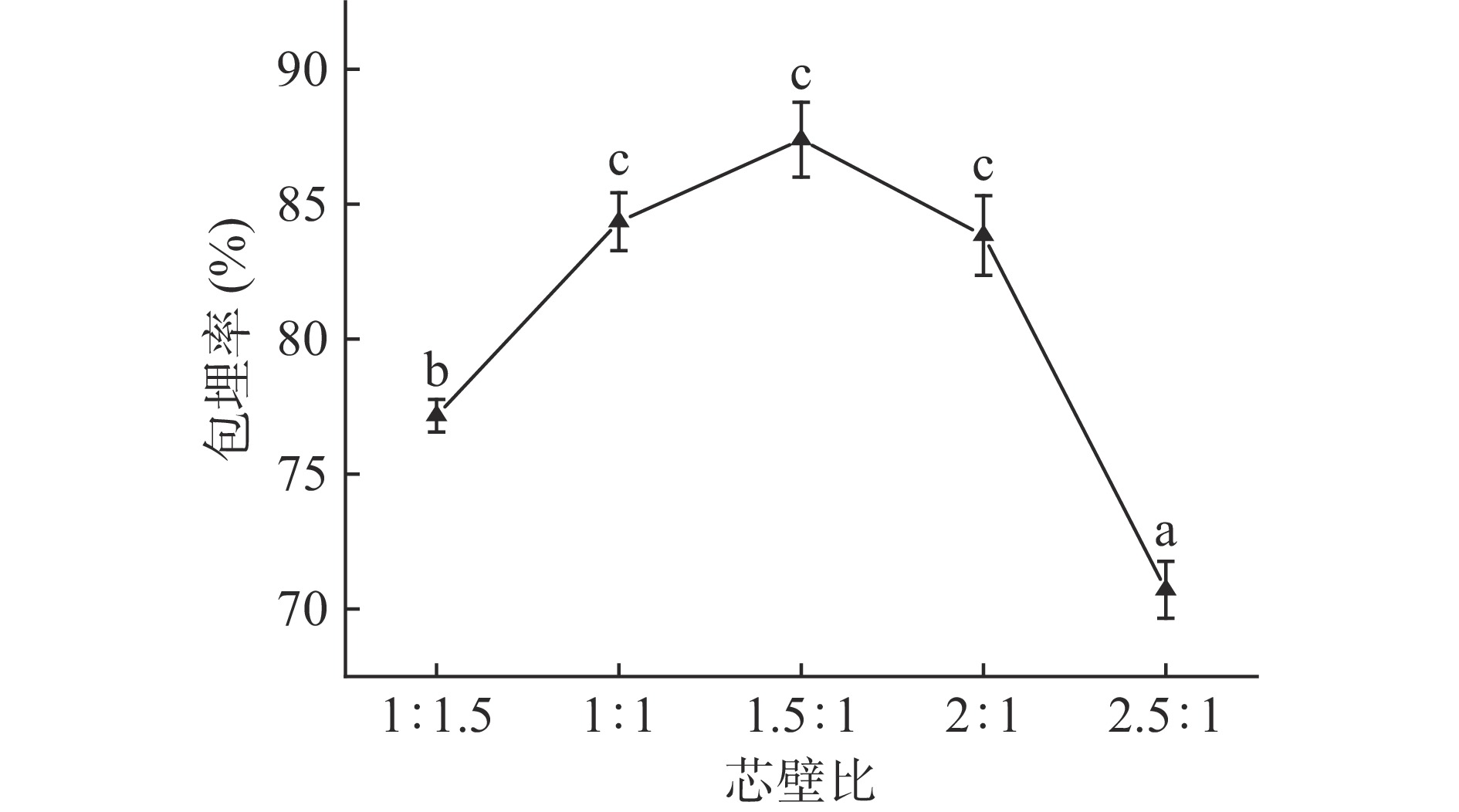
由图4可知,随着芯壁质量比的增大,包埋率总体呈先上升后下降的趋势。芯壁质量比低时,由于没有足够的芯材被包埋,导致包埋率下降。在芯壁质量比为1.5:1时,包埋率最大,为87.39%。芯壁质量比继续上升时,包埋率下降,主要是因为芯材远大于壁材,当包埋物浓度增加时,包埋物会与海藻酸纤维形成弱键,并减少了海藻酸盐链之间的相互作用,降低了复合物的稳定性,从而使包埋率下降[25]。陈丽等[26]的研究也出现同样的结果。因此,芯壁质量比选择1:1、1.5:1、2:1作为正交优化试验的三个水平。
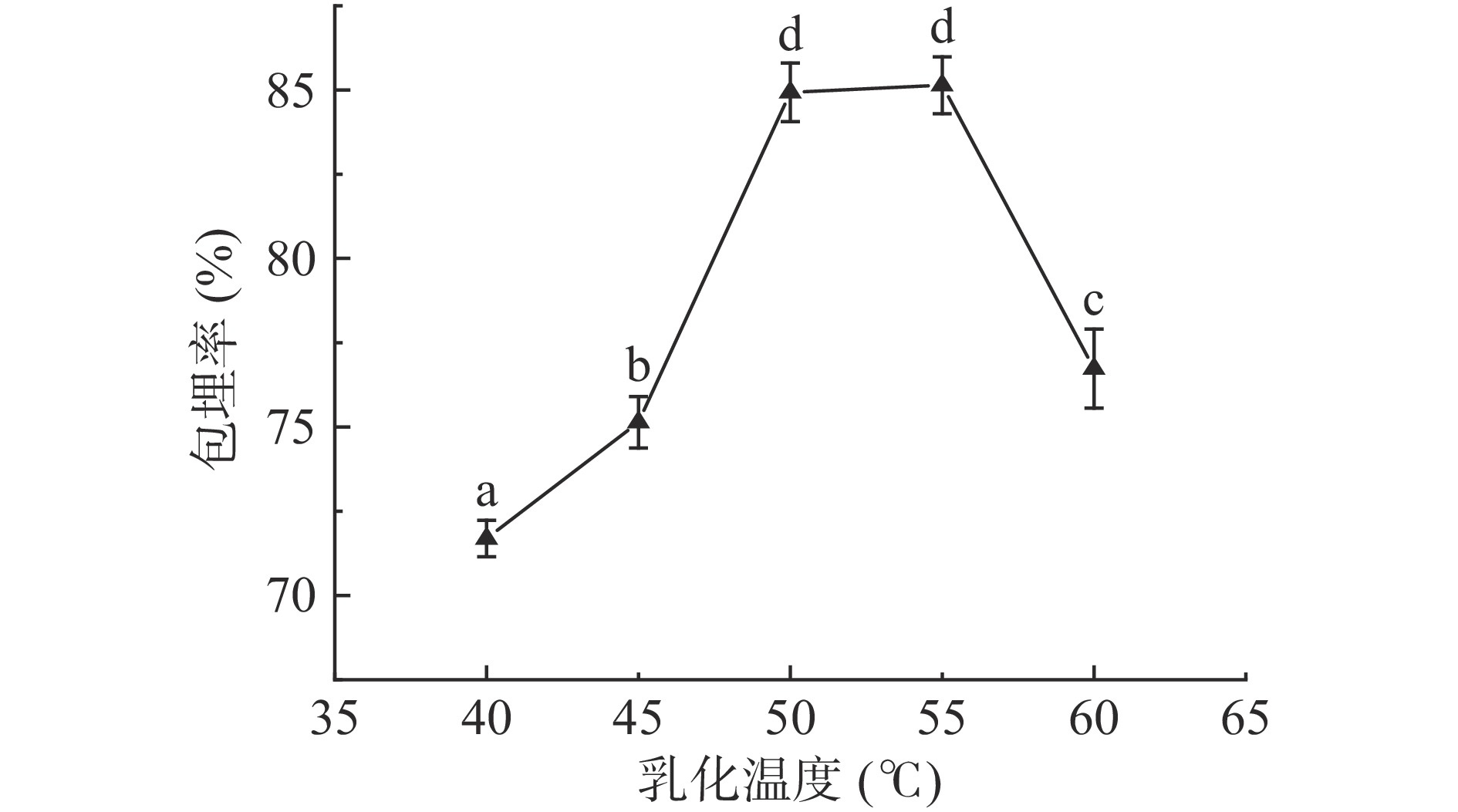
2.1.4 乳化温度对包埋率的影响
由图5可知,随着乳化温度的升高,酥油微胶囊包埋率先上升,接着在一定乳化温度范围内包埋率基本不变,最后包埋率呈下降的趋势。因为在相同固化时间内,较低温度的海藻酸钠粘度大,影响锐孔造粒的效果,乳化温度逐渐升高,海藻酸钠更易于和Ca2+联结。当乳化温度在55 ℃时,包埋率最高,为85.14%。当乳化温度上升到一定程度时,海藻酸钠中的结构单元容易分离,不易与Ca2+联结,外部结构松散,包埋率降低[27]。由于温度过高对酥油中不饱和脂肪酸有不利影响,并且包埋率在乳化温度50和55 ℃时差异不显著(P>0.05),所以确定反应温度为50 ℃,在正交试验中不选择乳化温度进行优化。
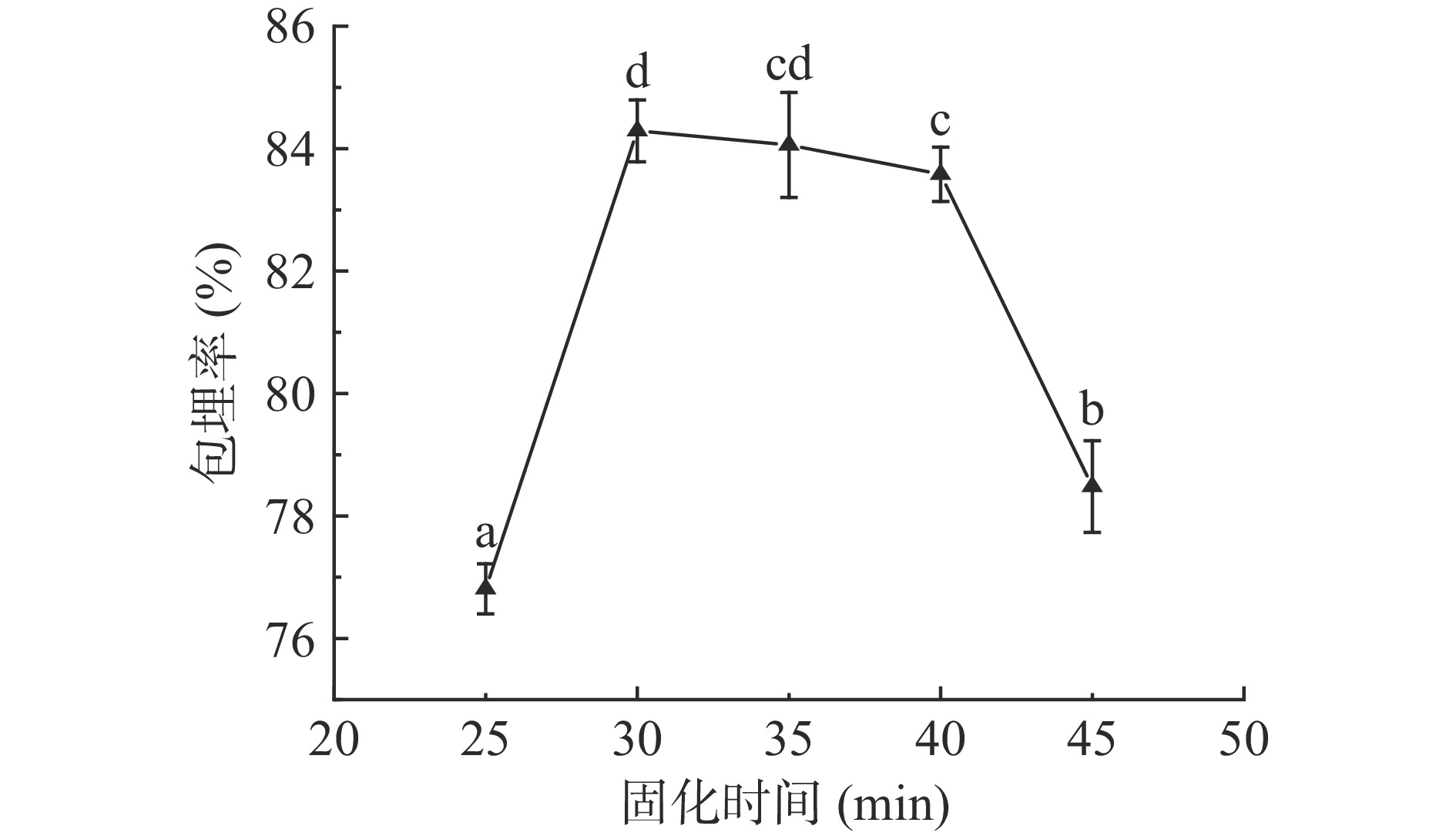
2.1.5 固化时间对包埋率的影响
由图6可知,随着固化时间的增加,酥油微胶囊包埋率呈上升趋势,接着在一定固化时间内包埋率基本不变,最后包埋率下降。固化时间太短,包埋率较低主要是因为海藻酸钠中Na+与CaCl2中的Ca2+置换形成海藻酸钙需要时间,固化时间太短导致微胶囊的壁膜薄弱,包埋效果较差。随着固化时间延长,生成的海藻酸钙越来越多,包埋效果越来越好,包埋率显著提升(P<0.05)。在固化时间30 min时,酥油微胶囊包埋率最高,为84.29%。当固化时间超过30 min,包埋率逐渐降低,这是由于海藻酸钙的置换时间过长,包埋的酥油会通过囊壁上的孔向外扩散,导致包埋率较低[28]。所以微胶囊固化时间确定为30 min,在后续的正交试验中将不再对固化时间进一步优化。
2.2 正交试验优化结果
2.2.1 正交试验分析
由表2的包埋率可知,A3B3C2组的包埋率最高,为84.62%。各因素对制备酥油微胶囊包埋率影响的主次顺序为:A>B>C,最优组合是A2B3C2。
表 2 正交试验结果Table 2. Result of orthogonal test试验号 A B C 包埋率(%) 1 1 1 1 74.07 2 1 2 2 79.91 3 1 3 3 80.91 4 2 1 2 84.03 5 2 2 3 83.84 6 2 3 1 82.64 7 3 1 3 79.13 8 3 2 1 83.59 9 3 3 2 84.62 K1 234.89 237.23 240.30 K2 250.51 247.34 248.56 K3 247.34 248.17 248.53 R 15.62 10.94 8.26 2.2.2 验证实验结果
对上述正交试验得到的最佳微胶囊制备工艺(A2B3C2)进行验证实验,制备酥油微胶囊的最佳条件是:海藻酸钠浓度1.5%,CaCl2浓度2.5%,芯壁比1.5:1,乳化温度50 ℃,固化时间30 min,产品包埋率可达89.41%,高于正交表中包埋率最高的组合(A3B3C2),与正交表的预测相吻合。
2.3 最优工艺制备牦牛酥油微胶囊理化指标结果分析
2.3.1 微胶囊基本理化性质分析
如表3所示,微胶囊的水分含量为5.25%±0.16%,含水量对产品贮藏期有较大影响,水分含量低,贮藏中不易结块和霉变,还会降低油脂的氧化速度,提升产品的贮藏时间。休止角为20.6°±0.35°,表明微胶囊产品表面光滑、流动性好。溶解度为57.22%±2.21%,溶解度良好,可进一步扩大产品的应用范围,为食品工业应用打下良好基础。
表 3 微胶囊的物理指标Table 3. The physical index of microcapsules项目 测定结果 水分含量(%) 5.25±0.16 休止角(°) 20.6±0.35 溶解度(%) 57.22±2.21 2.3.2 微胶囊的扫描电镜和粒径分析
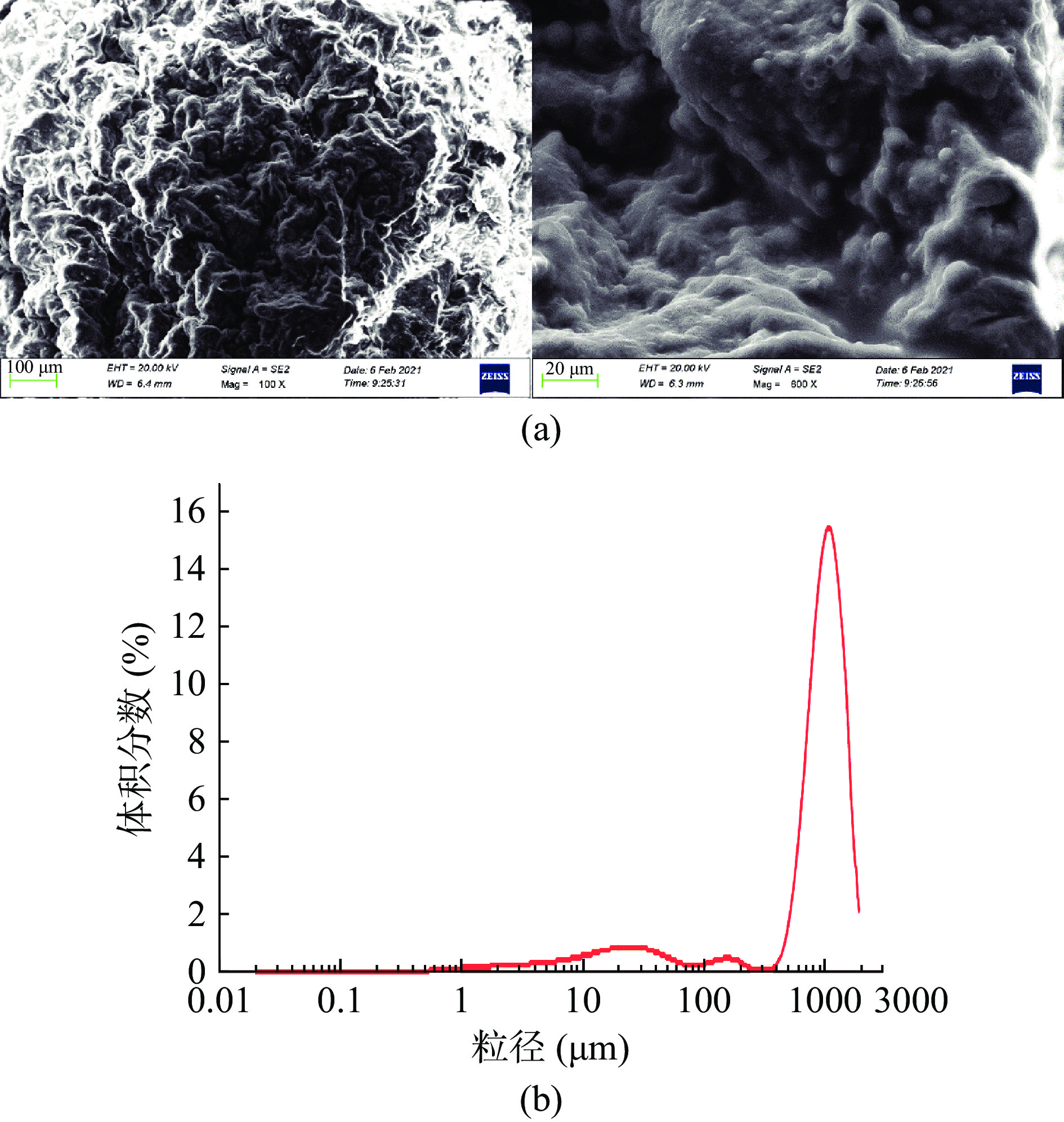
从图7(a)可以看出牦牛酥油微胶囊表面凹凸有致,囊壁清晰没有存在裂纹,说明微胶囊具有良好的包裹性,有效隔绝外部的空气,保持了酥油的稳定性。表面的褶皱是锐孔法微胶囊的特征,主要是因为干燥后失去水分造成聚缩,表面上有些凹凸是由于高温喷金导致的。图7(b)显示,微胶囊平均粒径为929.773 μm,有50%的微胶囊大于974.592 μm,粒径在1002.374~1124.683 μm范围内的微胶囊最多,占11.57%,表明微胶囊粒径较为集中。
2.3.3 傅里叶红外光谱分析结果
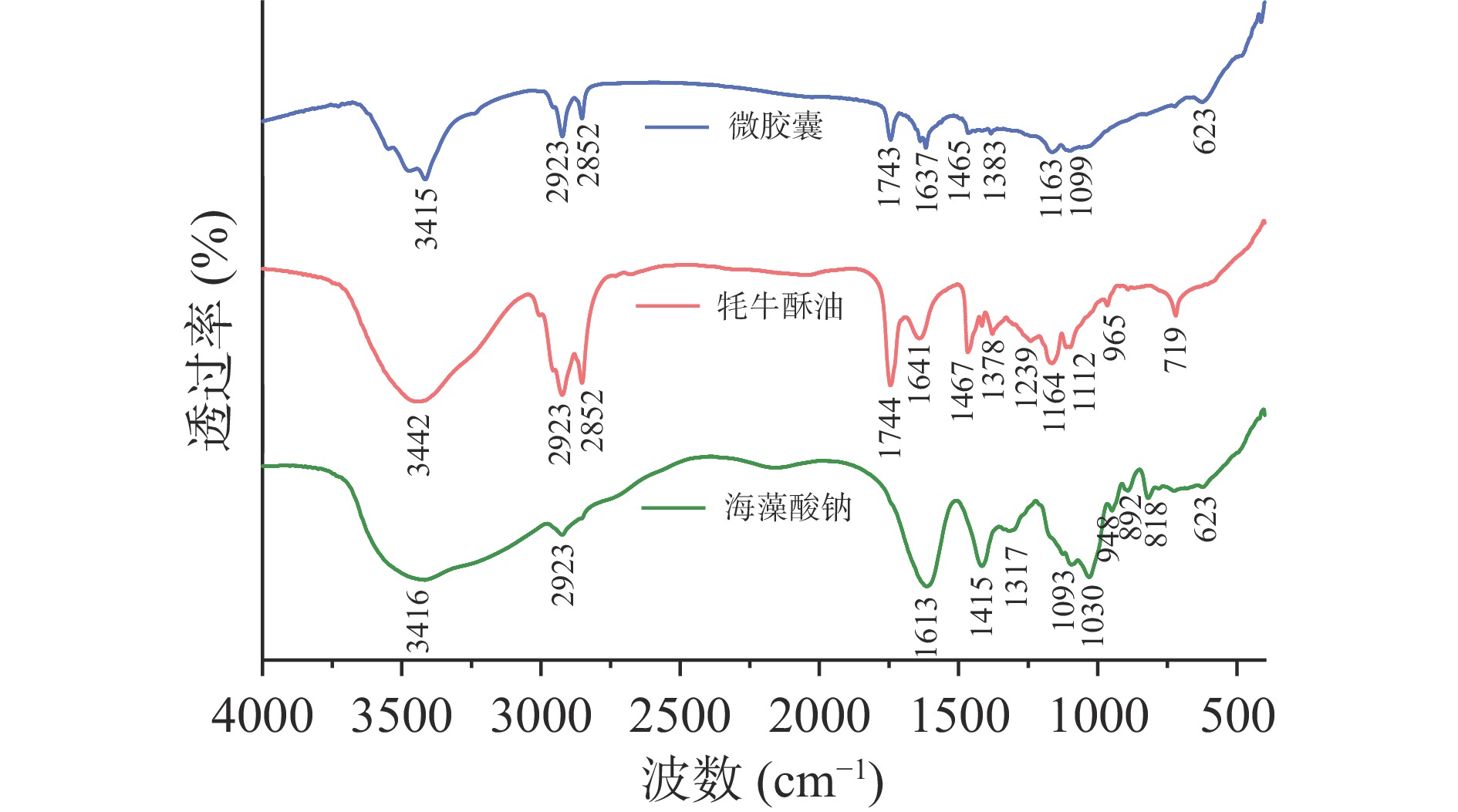
图8为海藻酸钠、酥油和微胶囊的红外光谱图,可以看出酥油在3442 cm−1处存在吸收峰,该峰主要是由-OH和N-H共同引起的,表明酥油中不仅有脂肪,还存在蛋白质。酥油和微胶囊共有的吸收峰为2852 cm−1,此处是脂肪酸的甲基和亚甲基伸缩振动的吸收峰;1744 cm−1处是酥油的醛、酮中的C=O伸缩振动吸收峰;1164 cm−1的吸收峰为酥油中脂肪酸、氨基酸中C-O-C的对称伸缩振动引起的。上述这三个波数在海藻酸钠中均不存在吸收峰,表明微胶囊化后的特征峰是包埋了牦牛酥油引起的,通过微胶囊红外光谱可以看出,微胶囊的出峰位置与酥油基本相同,说明微胶囊的主体结构为酥油,在1743、1637、1465 cm−1等处的吸收峰强度明显降低,719 cm−1处由C-H的弯曲振动产生的吸收峰消失,这些吸收峰是由酥油中脂类、蛋白质引起的,证明脂类、蛋白质的含量减少,酥油被包埋。而微胶囊在623 cm−1处存在海藻酸钠的特征吸收峰Na-O,表明壁材中存在海藻酸钠。
2.3.4 微胶囊的热稳定性分析
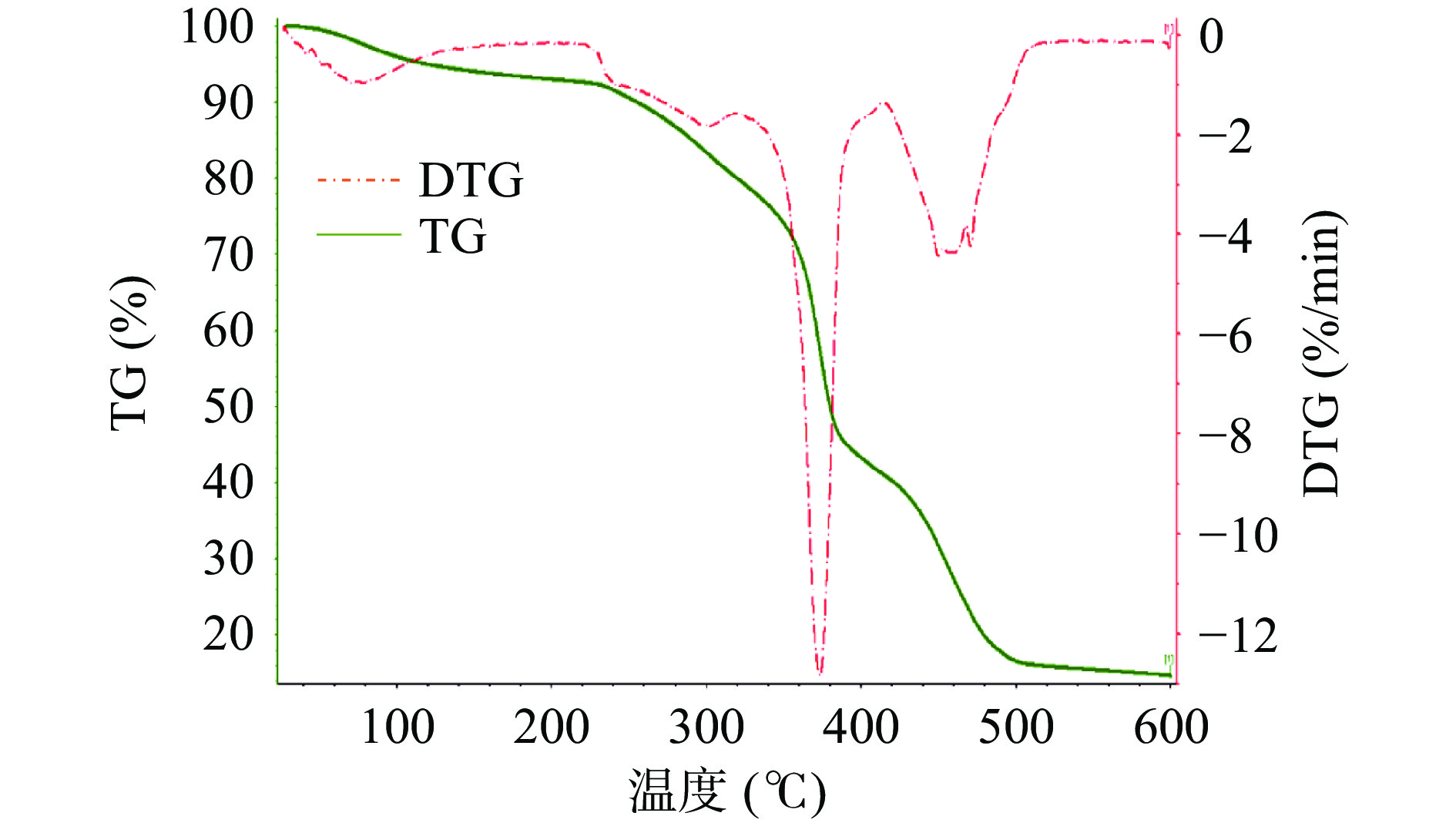
2.3.4.1 热重分析
热重分析可以显示出牦牛酥油微胶囊在不同的温度条件下的损失速率和比例[29]。由图9可知,在215 ℃之前为微胶囊热分解的第一个阶段,质量减少7.33%,此阶段损失的主要是附着在微胶囊表面的酥油以及一些水分;第二个阶段是215~415 ℃,质量减少51.77%,大部分牦牛酥油微胶囊都是在此阶段被破坏,说明外面的膜在高温下被破坏,酥油和海藻酸钠释放出来被分解;最后一个阶段是415~515 ℃,质量减少27.97%,此阶段的损失主要与CaCl2分解有关。
这与赵楠楠[30]、张维等[31]制备的偃松松塔精油、榛子油微胶囊结论一致。牦牛酥油微胶囊在215 ℃前结构稳定,热稳定性良好,在食品加工中有良好的潜能。
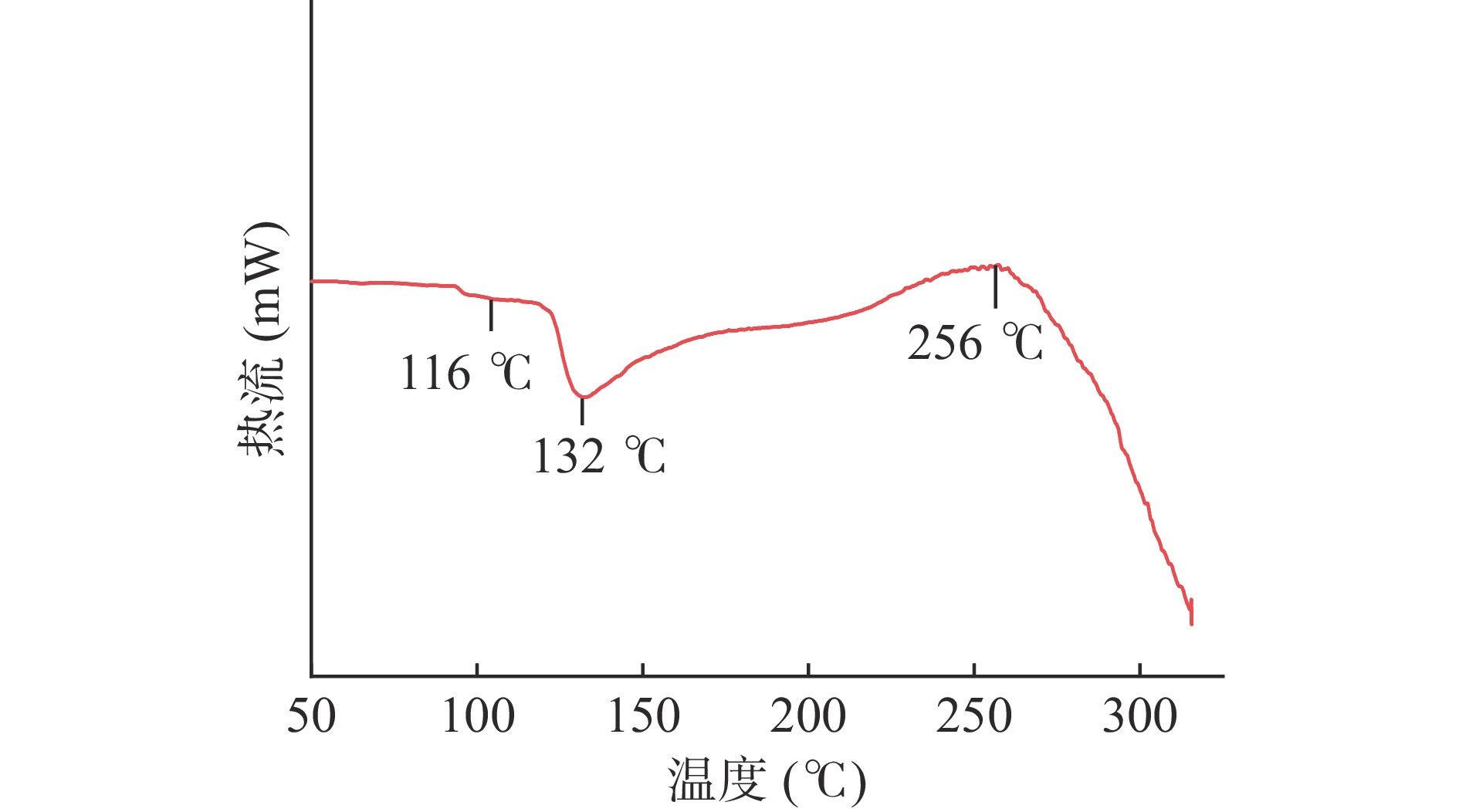
2.3.4.2 DSC分析结果
差示扫描量热仪反映的是物理或化学变化之间与热效应之间的关系[32]。由图10可得,在116 ℃时,牦牛酥油微胶囊开始发生玻璃化转变,其峰值温度为132 ℃,在256 ℃时微胶囊彻底溶解。由此可知,本法制备的牦牛酥油微胶囊在常规的热处理中可以保持良好的热稳定性,保证芯材不被破坏。
2.3.5 微胶囊在人工胃液和肠液中缓释实验分析
2.3.5.1 微胶囊在胃液中的释放曲线拟合
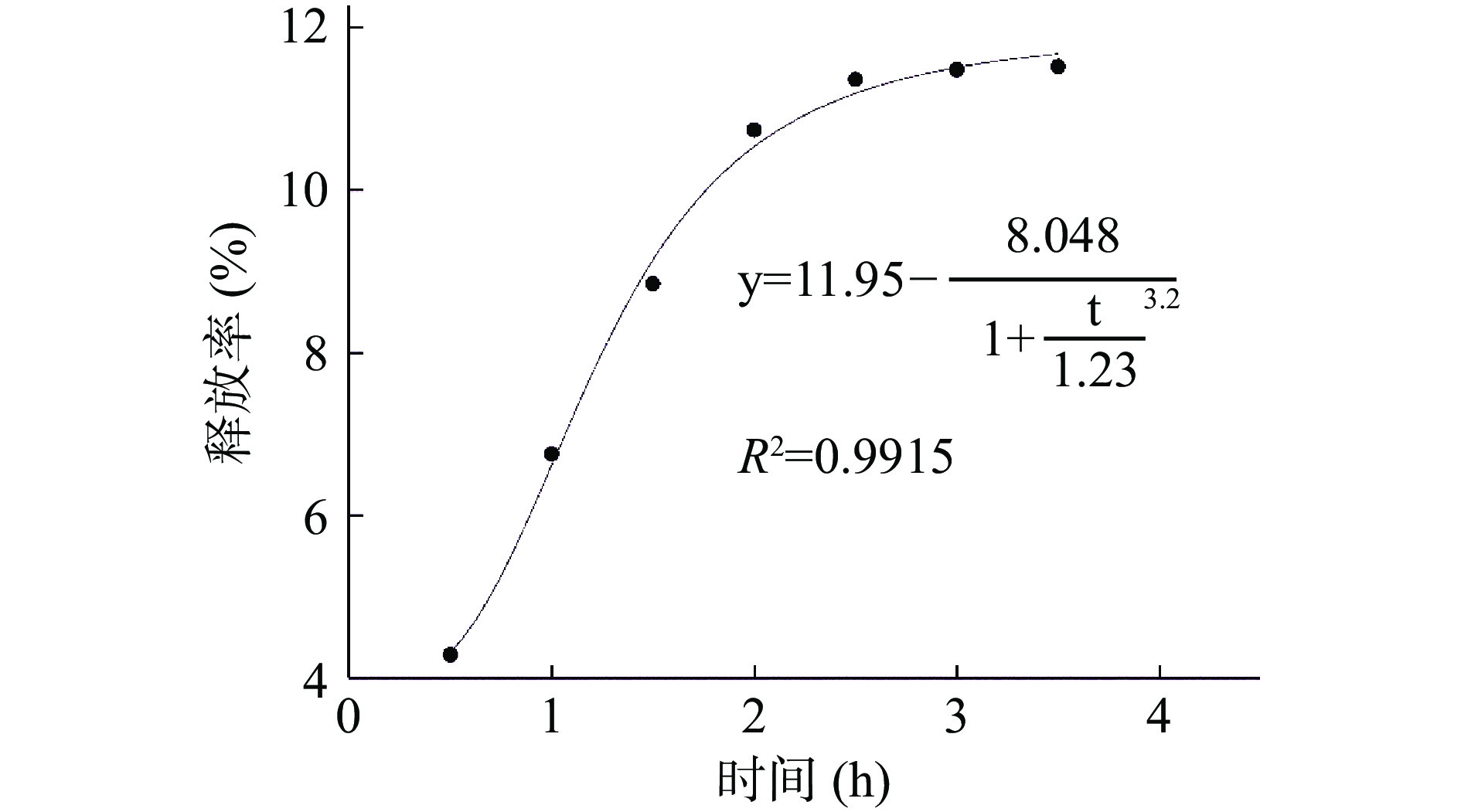
将牦牛酥油微胶囊在体外人工模拟胃液释放情况使用五个模型拟合,由表4可知,其中Logistic模型拟合度最高,拟合方程中R2为0.992最接近1,说明牦牛酥油的释放动力学最符合Logistic模型的运动情况。由图11可知,锐孔法制备的酥油微胶囊最大释放率在11.52%,主要是由于附在微胶囊表面的酥油被消化,而壁材没有被破坏。因为海藻酸钙在胃液较低pH条件下,钙离子与海藻酸盐分子羧基解离,且质子化增加导致排斥力下降从而使壁材收缩,降低其被消化的可能性[33]。这个特性可以保证牦牛酥油能够完整被传递到小肠中,牦牛酥油中的不饱和脂肪酸能更好被利用[34]。
表 4 体外人工模拟胃液释放拟合结果Table 4. Fitting results of in vitro artificial simulation of gastric juice release动力学模型 模型方程式 释放机理 拟合方程 R2 零级 y=a+bt 恒速释放 y=2.402t+4.48 0.8151 一级 y=a(1-et) 一级释放 y=12.578(1-e−0.835t) 0.9824 Higuchi模型 y=a√t Fick扩散 y=6.559√t+0.356 0.9081 Peppas模型 y=atb 扩散 y=7.029t0.46 0.9128 Logistic模型 y=A2+A1−A21+tX0P S型模型 y=11.95−8.0481+t1.233.2 0.9915 2.3.5.2 微胶囊在肠液中的释放曲线拟合
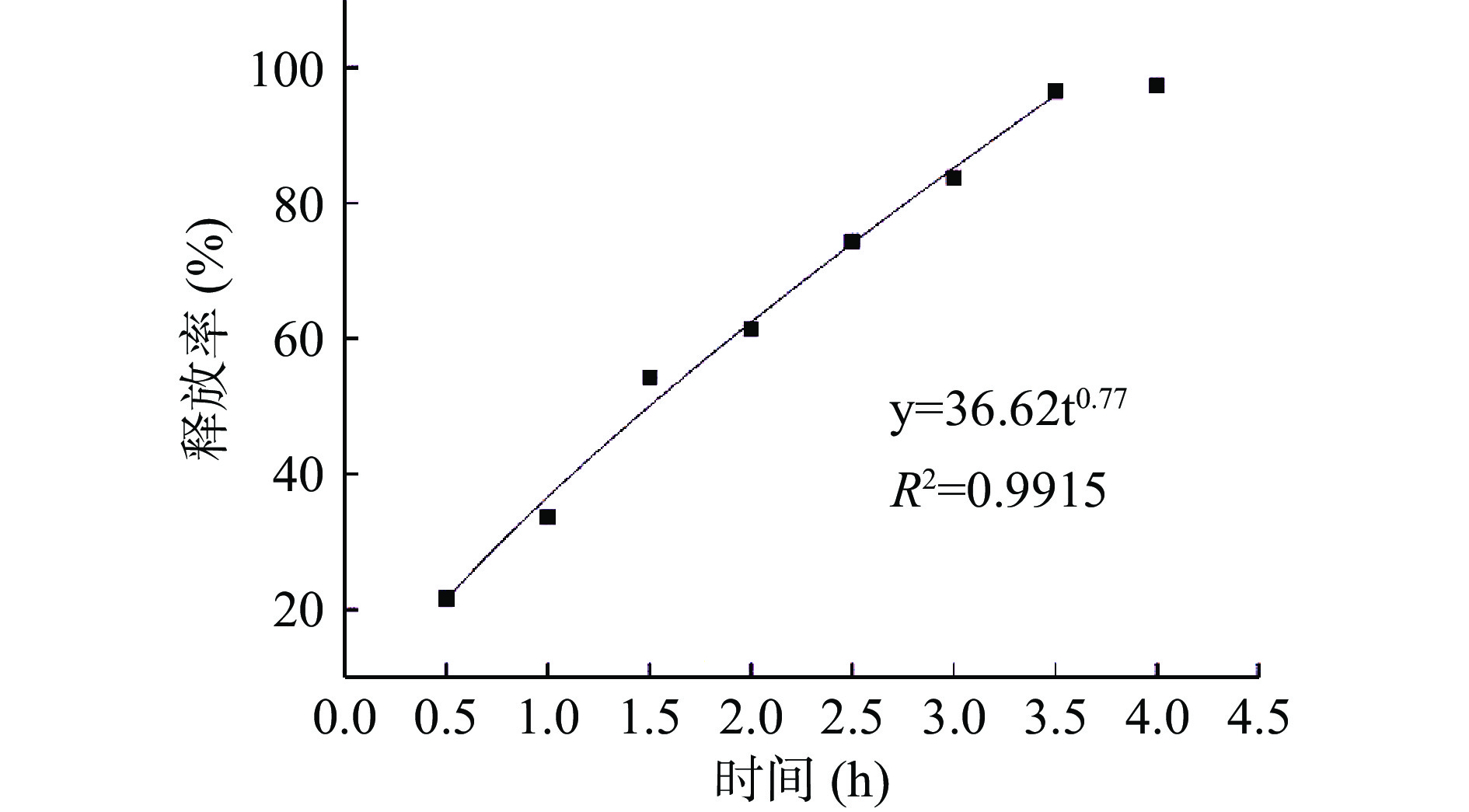
由表5可知,将牦牛酥油微胶囊在体外人工模拟肠液释放情况使用五个模型拟合,其中Peppas模型拟合度最高,拟合方程中R2为0.992最接近1,说明牦牛酥油的释放动力学最符合Peppas模型的运动情况。由图12可知,锐孔法制备的酥油微胶囊在3.5 h基本释放完全,释放率达96.44%,说明牦牛酥油微胶囊能在肠道中被消化。在模拟肠液中,胰蛋白酶破坏囊壁结构,芯材向外扩散和囊壁溶蚀同时进行,最终实现大部分酥油在肠液中释放,释放出来的牦牛酥油功能性物质可以在肠道中被人体所吸收。
表 5 体外人工模拟肠液释放拟合结果Table 5. Fitting results of in vitro artificial simulation of intestinal fluid release动力学模型 模型方程式 释放机理 拟合方程 R2 零级 y=a+bt 恒速释放 y=24.642t+11.477 0.9878 一级 y=a(1-et) 一级释放 y=163.039(1-e−0.247t) 0.9891 Higuchi模型 y=a√t Fick扩散 y=64.427√t−26.952 0.9714 Peppas模型 y=atb 扩散 y=36.62t0.77 0.9915 Logistic模型 y=A2+A1−A21+tX0P S型模型 y=1879.32−1881.1041+t153.760.77 0.9857 2.3.6 微胶囊贮藏稳定性分析
2.3.6.1 温度对微胶囊贮藏稳定性的影响
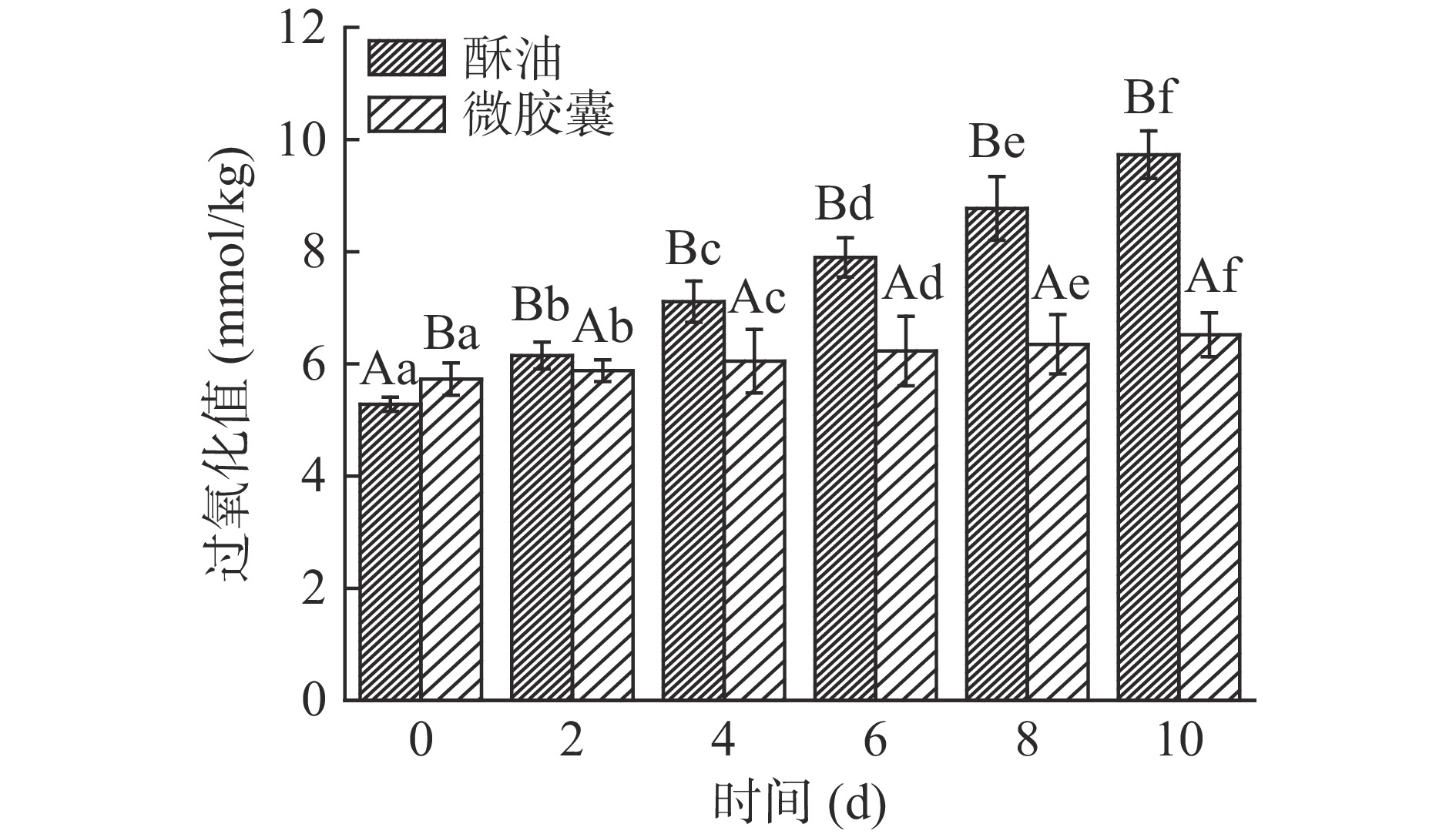
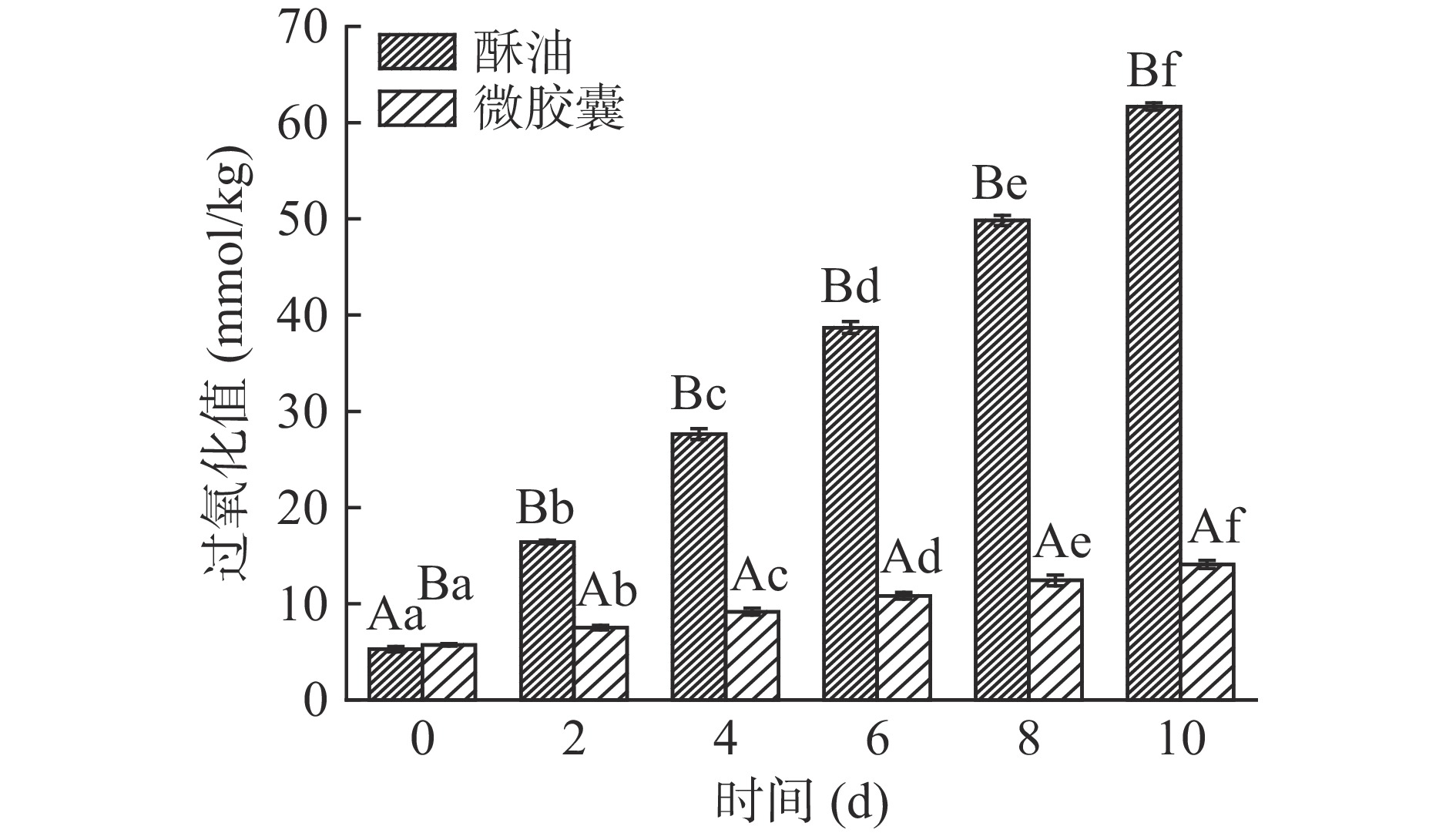
由图13、图14可知,微胶囊初始过氧化值较未包埋的酥油高,主要是因为微胶囊在制备时受外部环境影响,导致部分酥油氧化,后期酥油氧化的速度显著高于微胶囊氧化的速度(P<0.05)。10 d内贮藏温度25和60 ℃酥油过氧化值分别上升了4.45、56.4 mmol/kg,贮藏温度25和60 ℃微胶囊过氧化值分别上升了0.79、8.35 mmol/kg,均显著低于同条件下酥油过氧化值增加量(P<0.05)。且60 ℃条件下,第2 d酥油的过氧化值已经超过了国家标准规定的15.76 mmol/kg。随着贮藏时间增加,酥油过氧化值上升趋势显著高于微胶囊(P<0.05),酥油微胶囊过氧化值低主要是由于酥油被壁材包埋在其中,减少与外部环境接触的机会,从而减少氧化。60 ℃条件下微胶囊的过氧化值也在略微升高,主要是因为海藻酸钠与CaCl2反应,形成立体网状结构存在空隙,微胶囊在保存过程中酥油会有渗出现象,在高温下加速了酥油渗出,渗出的酥油遇到空气则发生了氧化,导致过氧化值上升。以上结果表明微胶囊化可以防止酥油的氧化,显著延长酥油的货架期(P<0.05)。
2.3.6.2 光照对微胶囊贮藏稳定性的影响
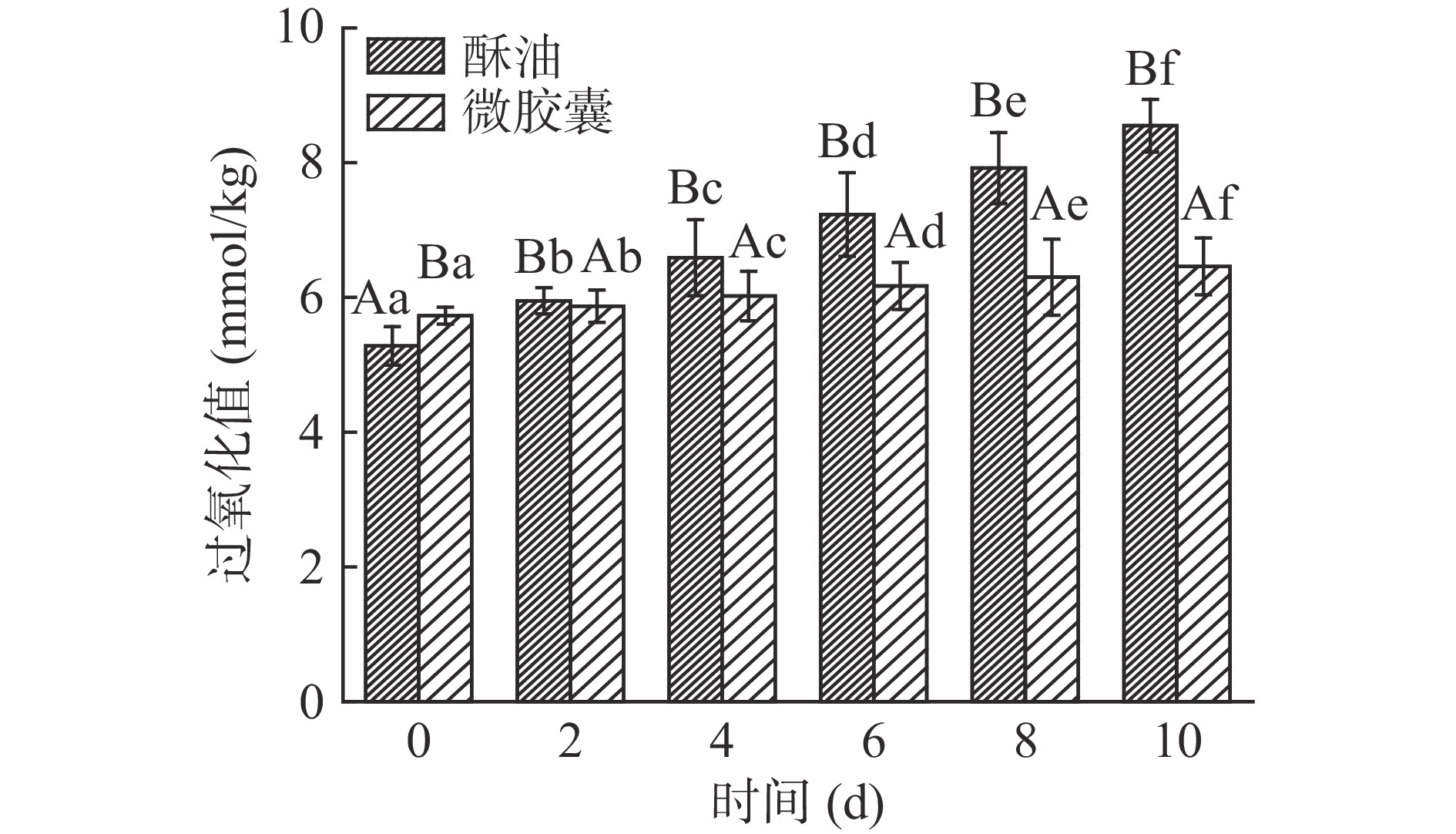
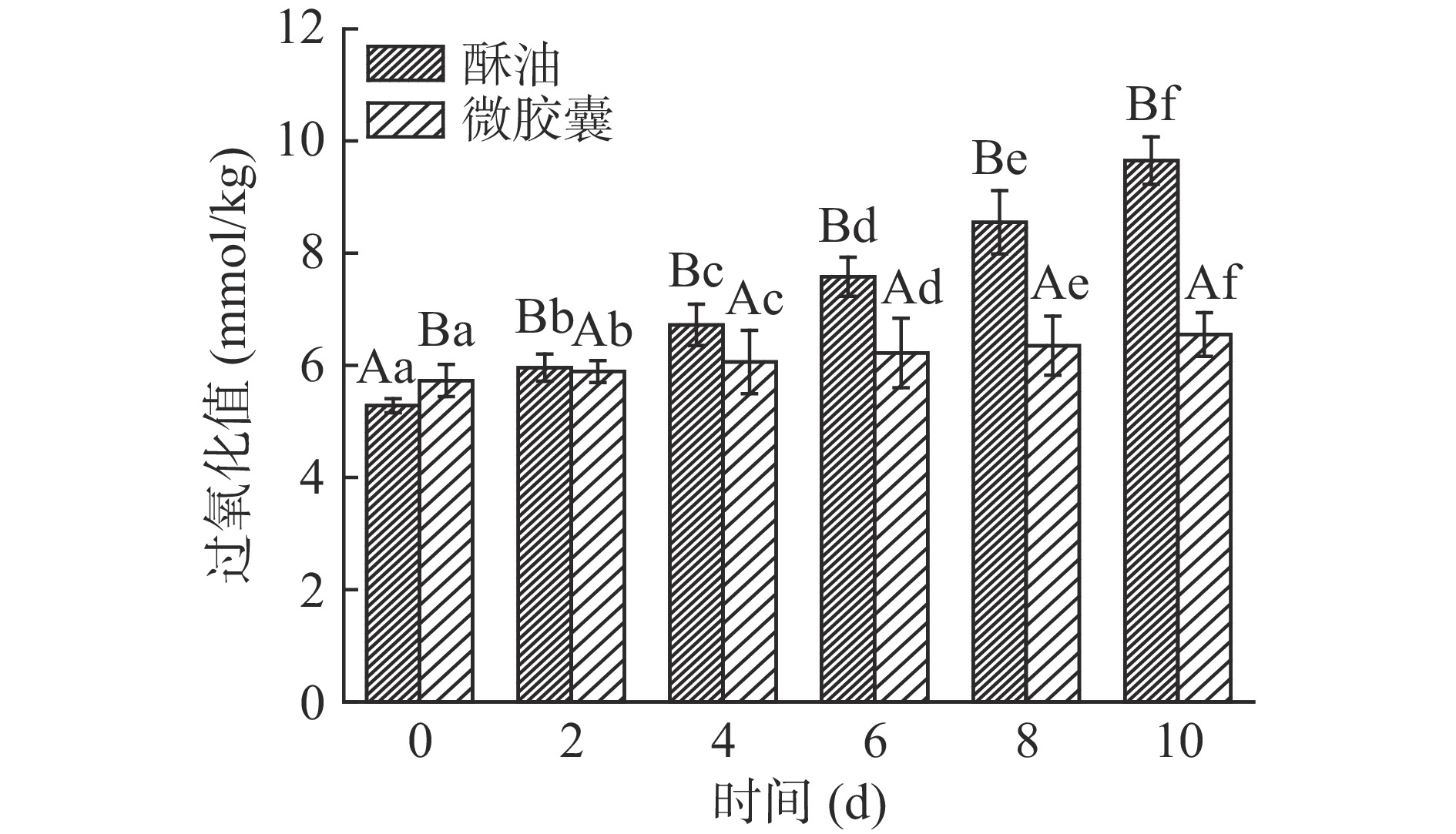
光氧化是脂质氧化变质的主要因素[35]。当牛奶中的光敏剂被激发时,可以诱发乳脂的自动氧化[36]。由图15、图16可知,未包埋酥油的氧化速率比微胶囊的快。10 d内避光和光照条件下酥油过氧化值分别上升了3.27、4.37 mmol/kg,避光和光照条件下微胶囊过氧化值分别上升了0.73、0.82 mmol/kg,均显著低于同条件下酥油过氧化值增加量(P<0.05)。微胶囊过氧化值增长速率慢,主要是因为牦牛酥油微胶囊化后,经壁材包裹,减缓了外部条件对牦牛酥油的影响,从而延长了酥油的保质期,在避光条件下贮存效果更佳。因此建议避光贮藏酥油微胶囊。
2.3.6.3 酥油和酥油微胶囊的氧化动力学研究及货架期预测
由表6可知各个样品在不同环境下的回归方程和拟合系数。表中酥油和酥油微胶囊的零级反应回归系数均大于一级反应回归系数。证明锐孔法制备的微胶囊的氧化反应属于零级氧化动力学反应[37]。预测的货架期最长的是在避光条件贮藏的微胶囊,货架期达136 d,是相同条件下的酥油的4.4倍,说明微胶囊避光贮藏具有更稳定的性质。根据R2可知方程拟合度较好,可以用来预测酥油和酥油微胶囊的贮藏期[38]。
表 6 贮藏实验线性回归分析Table 6. Linear regression analysis of storage test样品 零级反应回归方程 零级R2 一级反应回归方程 一级R2 货架期(d) 避光酥油 y=5.28+0.33t 0.993 y=5.28×exp0.0502t 0.973 31 避光微胶囊 y=5.73+0.073t 0.997 y=5.73×exp0.012t 0.982 136 光照酥油 y=5.28+0.435t 0.997 y=5.28×exp0.0603t 0.991 24 光照微胶囊 y=5.74+0.082t 0.998 y=5.73×exp0.014t 0.987 122 25 ℃酥油 y=5.28+0.441t 0.993 y=5.28×exp0.064t 0.986 23 25 ℃微胶囊 y=5.73+0.0791t 0.994 y=5.73×exp0.013t 0.968 126 60 ℃酥油 y=5.17+5.62t 0.996 y=5.88×exp0.288t 0.822 1 60 ℃微胶囊 y=5.8+0.842t 0.981 y=5.73×exp0.097t 0.962 11 3. 结论
酥油是采用牦牛奶制成的一种藏族食品,但酥油在制作过程中水分含量较高,不易储存,将其微胶囊化可以极大延长其保质期。本实验使用海藻酸钠与CaCl2作为壁材,使用锐孔法成功制备牦牛酥油微胶囊。以包埋率为指标,通过单因素实验和正交试验确定最佳工艺参数,并测定其理化指标、稳定性及释放特性。结果表明,最佳工艺为:海藻酸钠浓度1.5%,CaCl2浓度2.5%,芯壁质量比1.5:1,乳化温度50 ℃,固化时间30 min,所得微胶囊包埋率为89.41%;含水量较低、溶解度、流动性良好,由FTIR分析可知,酥油特征峰在微胶囊化后强度降低,表明酥油被成功包埋;SEM和激光粒度仪分析表明,微胶囊结构完整且粒径分布较为集中,其平均粒径为929.773 µm;DSC、热重分析表明酥油在微胶囊化后热稳定性提高;模拟消化实验表明,微胶囊产品在胃液中释放率为11.52%,在肠液中释放率达96.44%,大部分微胶囊在肠道中释放。对其贮藏条件进行实验,微胶囊在25 ℃和避光下贮藏可以保持其稳定性,预测最长货架期可达136 d。本实验表明使用锐孔法制备牦牛酥油微胶囊具有可行性,可以有效延长其保质期,有利于产品的远距离销售。
-
表 1 正交因素水平表
Table 1 Orthogonal factor level table
水平 因素 A(%) B(%) C 1 1.0 1.5 1:1 2 1.5 2.0 1.5:1 3 2.0 2.5 2:1 表 2 正交试验结果
Table 2 Result of orthogonal test
试验号 A B C 包埋率(%) 1 1 1 1 74.07 2 1 2 2 79.91 3 1 3 3 80.91 4 2 1 2 84.03 5 2 2 3 83.84 6 2 3 1 82.64 7 3 1 3 79.13 8 3 2 1 83.59 9 3 3 2 84.62 K1 234.89 237.23 240.30 K2 250.51 247.34 248.56 K3 247.34 248.17 248.53 R 15.62 10.94 8.26 表 3 微胶囊的物理指标
Table 3 The physical index of microcapsules
项目 测定结果 水分含量(%) 5.25±0.16 休止角(°) 20.6±0.35 溶解度(%) 57.22±2.21 表 4 体外人工模拟胃液释放拟合结果
Table 4 Fitting results of in vitro artificial simulation of gastric juice release
动力学模型 模型方程式 释放机理 拟合方程 R2 零级 恒速释放 0.8151 一级 一级释放 0.9824 Higuchi模型 Fick扩散 0.9081 Peppas模型 扩散 0.9128 Logistic模型 S型模型 0.9915 表 5 体外人工模拟肠液释放拟合结果
Table 5 Fitting results of in vitro artificial simulation of intestinal fluid release
动力学模型 模型方程式 释放机理 拟合方程 R2 零级 恒速释放 0.9878 一级 一级释放 0.9891 Higuchi模型 Fick扩散 0.9714 Peppas模型 扩散 0.9915 Logistic模型 S型模型 0.9857 表 6 贮藏实验线性回归分析
Table 6 Linear regression analysis of storage test
样品 零级反应回归方程 零级R2 一级反应回归方程 一级R2 货架期(d) 避光酥油 0.993 0.973 31 避光微胶囊 0.997 0.982 136 光照酥油 0.997 0.991 24 光照微胶囊 0.998 0.987 122 25 ℃酥油 0.993 0.986 23 25 ℃微胶囊 0.994 0.968 126 60 ℃酥油 0.996 0.822 1 60 ℃微胶囊 0.981 0.962 11 -
[1] GUO X, LONG R, KREUZER M, et al. Importance of functional ingredients in yak milk-derived food on health of Tibetan nomads living under high-altitude stress: A review[J]. Critical Reviews in Food Science and Nutrition,2014,54(3):292−302. doi: 10.1080/10408398.2011.584134
[2] GUO N, WU Q F, SHI F Y, et al. Seasonal dynamics of diet-gut microbiota interaction in adaptation of yaks to life at high altitude[J]. npj Biofilms and Microbiomes,2021,7(1):1−11. doi: 10.1038/s41522-020-00173-5
[3] 雷有娟, 孙万成, 罗毅皓. 牦牛酥油磷脂提取工艺研究及脂肪酸成分分析[J]. 中国乳品工业,2019,47(9):18−23. [LEI Y J, SUN W C, LUO Y H. Study on the extraction process of phospholipids from yak ghee and analysis of fatty acid composition[J]. China Dairy Industry,2019,47(9):18−23. doi: 10.3969/j.issn.1001-2230.2019.09.004 [4] AGYARE A N, LIANG Q. Nutrition of yak milk fat-focusing on milk fat globule membrane and fatty acids[J]. Journal of Functional Foods,2021,83:104404−104424. doi: 10.1016/j.jff.2021.104404
[5] 罗鑫, 孙万成, 罗毅皓. 牦牛酥油鞘磷脂对小鼠脂质代谢紊乱和肝脏组织炎症的调节作用[J]. 食品科学,2022,43(3):161−168. [LUO X, SUN W C, LUO Y H. Modulatory effects of yak ghee sphingolipids on lipid metabolism disorders and liver tissue inflammation in mice[J]. Food Science,2022,43(3):161−168. doi: 10.7506/spkx1002-6630-20210307-085 [6] LIANG J J, ZHOU Q, KWAME A W, et al. Biomarkers of dairy fat intake and risk of cardiovascular disease: A systematic review and meta analysis of prospective studies[J]. Critical Reviews in Food Science and Nutrition,2018,58(7):1122−1130. doi: 10.1080/10408398.2016.1242114
[7] 周小玲, 刘书杰, 崔占洪, 等. 牦牛酥油与普通奶油中脂肪酸组成与含量的比较[J]. 中国饲料,2008(23):21−22, 26. [ZHOU X L, LIU S J, CUI Z H, et al. Comparison of fatty acid composition and content in yak ghee and common cream[J]. China Feed,2008(23):21−22, 26. doi: 10.3969/j.issn.1004-3314.2008.23.009 [8] AYDIN S, TAHMAS KAHYAOĞLU D. Antioxidant effect potential of garlic in vitro and real food system: Effects of garlic supplementation on oxidation stability and sensory properties of butter[J]. European Journal of Lipid Science and Technology,2020,122(3):1900261. doi: 10.1002/ejlt.201900261
[9] GÓMEZ-MASCARAQUE L G, HERNÁNDEZ-ROJAS M, TARANCÓN P, et al. Impact of microencapsulation within electrosprayed proteins on the formulation of green tea extract-enriched biscuits[J]. LWT-Food Science and Technology,2017,81:77−86. doi: 10.1016/j.lwt.2017.03.041
[10] YAN M Y, LIU B, JIAO X D, et al. Preparation of phycocyanin microcapsules and its properties[J]. Food and Bioproducts Processing,2014,92(1):89−97. doi: 10.1016/j.fbp.2013.07.008
[11] 李正涛, 冯平. 黄油粉喷雾干燥微胶囊化的研究[J]. 食品安全导刊,2020(6):151, 153. [LI Z T, FENG P. Study on microencapsulation of butter powder by spray drying[J]. Food Safety Guide,2020(6):151, 153. [12] 熊华, 郑燚. 微胶囊西藏酥油粉的中间试验工艺研究[J]. 中国油脂,2003(3):34−35. [XIONG H, ZHENG Y. Study on the pilot test process of microencapsulated Tibet butter powder[J]. China Grease,2003(3):34−35. [13] MAHAK G, KUMAR B B. Functional characterization of potential probiotic lactic acid bacteria isolated from Kalarei and development of probiotic fermented oat flour[J]. Probiotics and Antimicrobial Proteins,2017,10(4):1−8.
[14] 陈欣, 王志耕, 梅林, 等. 喷雾干燥法制备乳脂微胶囊及其特性的研究[J]. 中国粮油学报,2017,32(1):74−79, 84. [CHEN X, WANG Z G, MEI L, et al. Preparation and characterization of milk fat microcapsules by spray drying method[J]. Chinese Journal of Cereals and Oils,2017,32(1):74−79, 84. doi: 10.3969/j.issn.1003-0174.2017.01.013 [15] 刘斯博. 亚麻籽油微胶囊的制备及其释放性能研究[D]. 郑州: 河南工业大学, 2016 LIU S B. Preparation of flaxseed oil microcapsules and their release properties[D]. Zhengzhou: Henan University of Technology, 2016.
[16] 姚泽晨, 张根义. 植物乳杆菌微胶囊包载效果、物化性质及其胃肠道性能[J]. 食品工业科技,2019,40(14):112−117, 133. [YAO Z C, ZHANG G Y. Encapsulation effect, physical and chemical properties of Lactobacillus plantarum microcapsules and their gastrointestinal properties[J]. Food Industry Science and Technology,2019,40(14):112−117, 133. doi: 10.13386/j.issn1002-0306.2019.14.019 [17] BAE E K, LEE S J. Microencapsulation of avocado oil by spray drying using whey protein and maltodextrin[J]. Journal of Microencapsulation,2008,25(8):549−560. doi: 10.1080/02652040802075682
[18] 姜雪, 段蕾, 包尕红, 等. 酸枣仁油微胶囊的制备与表征[J]. 粮食与油脂,2020,33(9):56−59. [JIANG X, DUAN L, BAO G H, et al. Preparation and characterization of sour date seed oil microcapsules[J]. Grain and Oil,2020,33(9):56−59. doi: 10.3969/j.issn.1008-9578.2020.09.013 [19] CHUNG C, SANGUANSRI L, AUGUSTIN M A. In vitro lipolysis of fish oil microcapsules containing protein and resistant starch[J]. Food Chemistry,2011,124(4):1480−1489. doi: 10.1016/j.foodchem.2010.07.115
[20] 周莉, 王晓瑞, 谭静, 等. 海藻酸钠-乳清蛋白复合益生菌微胶囊的构建及性能评价[J]. 中国食品添加剂,2020,31(4):108−113. [ZHOU L, WANG X R, TAN J, et al. Construction and performance evaluation of sodium alginate-lactalbumin composite probiotic microcapsules[J]. China Food Additives,2020,31(4):108−113. doi: 10.19804/j.issn1006-2513.2020.04.012 [21] 程翎. 白术挥发油微胶囊的制备、表征及释放特性研究[D]. 长沙: 长沙理工大学, 2018 CHENG L. Preparation, characterization and release characteristics of volatile oil microcapsules of Atractylodes macrocephala[D]. Changsha: Changsha University of Technology, 2018.
[22] DAVARCI F, TURAN D, OZCELIK B, et al. The influence of solution viscosities and surface tension on calcium-alginate microbead formation using dripping technique[J]. Food Hydrocolloids,2017,62:119−127. doi: 10.1016/j.foodhyd.2016.06.029
[23] CAO L, LU W, MATA A, et al. Egg-box model-based gelation of alginate and pectin: A review[J]. Carbohydrate Polymers,2020,242:116389. doi: 10.1016/j.carbpol.2020.116389
[24] SOSA-HERRERA M G, LOZANO-ESQUIVEL I E, DE LEÓN-RAMÍREZ Y R P, et al. Effect of added calcium chloride on the physicochemical and rheological properties of aqueous mixtures of sodium caseinate/sodium alginate and respective oil-in-water emulsions[J]. Food Hydrocolloids,2012,29(1):175−184. doi: 10.1016/j.foodhyd.2012.02.017
[25] CASTRO R I, MORALES-QUINTANA L, ALVARADO N, et al. Design and optimization of a self-assembling complex based on microencapsulated calcium alginate and glutathione (Cag) using response surface methodology[J]. Polymers,2021,13(13):2080. doi: 10.3390/polym13132080
[26] 陈丽, 张喻, 谭亦成, 等. 响应面法优化锐孔法制备大米抗氧化肽微胶囊工艺[J]. 食品科学,2014(22):97−103. [CHEN L, ZHANG Y, TAN Y C, et al. Optimization of the process of preparing rice antioxidant peptide microcapsules by sharp pore method with response surface methodology[J]. Food Science,2014(22):97−103. doi: 10.7506/spkx1002-6630-201422018 [27] XIAO Z B, HE L, ZHU G Y. The preparation and properties of three types of microcapsules of sweet orange oil using alginate and chitosan as wall material[J]. Flavour and Fragrance Journal,2014,29(6):350−355. doi: 10.1002/ffj.3212
[28] GOH C H, HENG P W S, CHAN L W. Alginates as a useful natural polymer for microencapsulation and therapeutic applications[J]. Carbohydrate Polymers,2012,88(1):1−12. doi: 10.1016/j.carbpol.2011.11.012
[29] ZHOU D, PAN Y, YE J, et al. Preparation of walnut oil microcapsules employing soybean protein isolate and maltodextrin with enhanced oxidation stability of walnut oil[J]. LWT-Food Science and Technology,2017,83:292−297. doi: 10.1016/j.lwt.2017.05.029
[30] 赵楠楠. 偃松松塔精油抑菌机理的研究及其微囊制备[D]. 哈尔滨: 东北林业大学, 2019 ZHAO N N. Study on the antibacterial mechanism of the essential oil of Pinus pinaster and its microcapsules preparation[D]. Harbin: Northeastern Forestry University, 2019.
[31] 张维, 陈丽蕊, 时孟杰, 等. 榛子油微胶囊的制备及其稳定性研究[J]. 食品工业科技,2022,43(2):206−214. [ZHANG W, CHEN L R, SHI M J, et al. Preparation of microcapsules of hazelnut oil and its stability study[J]. Food Industry Science and Technology,2022,43(2):206−214. [32] LI Y, WU C H, WU T T, et al. Preparation and characterization of citrus essential oils loaded in chitosan microcapsules by using different emulsifiers[J]. Journal of Food Engineering,2018,217:108−114. doi: 10.1016/j.jfoodeng.2017.08.026
[33] BANNIKOVA A, EVTEEV A, PANKIN K, et al. Microencapsulation of fish oil with alginate: In vitro evaluation and controlled release[J]. LWT-Food Science and Technology,2018,90:310−315. doi: 10.1016/j.lwt.2017.12.045
[34] AUGUSTIN M A, SANGUANSRI L, RUSLI J K, et al. Digestion of microencapsulated oil powders:In vitro lipolysis and in vivo absorption from a food matrix[J]. Food & Function,2014,5(11):2905−2912.
[35] WOLD J P, SKARET J, DALSGAARD T K. Assessment of the action spectrum for photooxidation in full fat bovine milk[J]. Food Chemistry,2015,179:68−75. doi: 10.1016/j.foodchem.2015.01.124
[36] MESTDAGH F, KERKAERT B, CUCU T, et al. Interaction between whey proteins and lipids during light-induced oxidation[J]. Food Chemistry,2011,126(3):1190−1197. doi: 10.1016/j.foodchem.2010.11.170
[37] 常馨月, 罗惟, 陈程莉, 等. 奇亚籽油微胶囊贮藏稳定性及缓释动力学[J]. 食品与发酵工业,2020,46(9):108−114. [CHANG X Y, LUO W, CHEN C L, et al. Storage stability and sustained release kinetics of chia seed oil microcapsules[J]. Food and Fermentation Industry,2020,46(9):108−114. doi: 10.13995/j.cnki.11-1802/ts.023136 [38] DONG Z, MA Y, HAYAT K, et al. Morphology and release profile of microcapsules encapsulating peppermint oil by complex coacervation[J]. Journal of Food Engineering,2011,104(3):455−460. doi: 10.1016/j.jfoodeng.2011.01.011





 下载:
下载:




 下载:
下载:
