Comparison of Physicochemical and Structural Properties of Different Varieties of Cassava Starch
-
摘要: 本文以华南9号(SC9)、华南10号(SC10)、华南11号(SC11)、桂热891(GR891)和桂热911(GR911)五个不同品种的木薯为原料,对淀粉进行分离纯化,研究不同品种木薯淀粉理化和结构性质的差异。结果表明,SC9的直链淀粉含量最低(22.56%),GR911的直链淀粉含量最高(27.49%);所有品种木薯淀粉表面光滑呈不规则的球缺形,粒径主要分布在12.43~19.03 μm,SC9具有最小的颗粒粒径(12.43 μm),膨胀度和溶解度(10.35%、28.00%),而GR911表现出最大的粒径(19.03 μm),膨胀度和溶解度(15.21%、35.00%)。所有淀粉显示出典型的A型结晶结构,SC9的相对结晶度最高(26.49%),GR911的相对结晶度最低(21.92%);SC9的短程有序结构最低(0.756),GR911的短程有序结构最高(0.882)。由淀粉的糊化特性可知,SC9、SC10可用作食品增稠剂或胶凝剂,GR911适用于糖果或断奶食品的填充,SC11、GR891可用于粘性食品。本研究结果可为木薯淀粉在食品工业中适宜性加工的品种选择提供理论参考。Abstract: In this paper, five different species of cassava (SC9, SC10, SC11, GR891 and GR911) were used as raw materials and starch was isolated to study the differences in physicochemical and structure properties. The results showed that the amylose content of SC9 was the lowest (22.56%), and GR911 was the highest (27.49%). The surface of all species of cassava starch showed smooth and irregular spherical shape with the particle size of 12.43~19.03 μm. SC9 had the smallest particle size (12.43 μm), solubility and swelling power (10.35%, 28.00%), while GR911 showed the largest particle size (19.03 μm), solubility and swelling power (15.21%, 35.00%). All starches showed typical A-type crystal structure. The SC9 showed the highest (26.49%) relative crystallinity and GR911 was the lowest (21.92%). The SC9 had the lowest (0.756) short-range order structure compared to the highest (0.882) for GR911. According to the gelatinization properties, the species of SC9 and SC10 could be used as food thickeners or gelling agents. The species of GR911 was suitable for filling candy or weaned food. The species of SC11 and GR891 could be used as sticky food. The results of this study could provide a theoretical reference for the selection of cassava starch suitable for processing in the food industry.
-
木薯(Manihot esculenta Crantz),为大戟科(Euphorbiaceae)木薯属植物,是世界三大薯类作物之一,被誉为“淀粉之王”、“地下粮仓”,是世界7~8亿人赖以生存的粮食,原产于美洲亚马孙河流域,目前在亚洲、非洲和拉丁美洲的热带和亚热带地区广泛种植。我国木薯于19世纪20年代引进栽培,截止2019年国内种植面积为28.2万公顷,干薯产量为259.8万吨[1-2]。淀粉是木薯根的主要成分,木薯块根鲜样淀粉含量一般为24%~32%,干样淀粉含量约为73%~83%,木薯肉和木薯皮中也含有较高的粗淀粉。淀粉由直链淀粉和支链淀粉组成,直链淀粉是由α-1,4-糖苷键连接的葡聚糖,支链淀粉由α-1,4-糖苷键连接的葡聚糖作为主链,侧链通过α-1,6-糖苷键连接主链而形成树枝状结构[3-4]。
前人关于木薯淀粉的研究主要集中在粒径、颗粒形态、糊化特性、热力学特性等理化和结构性质方面,杨栋林等[5]研究了三种木薯淀粉的冻融稳定性、凝沉稳定性及淀粉颗粒等理化性质,结果表明大叶白皮面包木薯淀粉、小叶白皮面包木薯淀粉、大叶红皮面包木薯淀粉冻融稳定性及凝沉稳定性差异不大,淀粉的颗粒形态存在差异。古碧等[6]对不同生长期木薯块根淀粉糊化特性进行了研究,结果表明直链淀粉含量和糊化温度因生长期变化而差异性显著。He等[7]研究了中国不同地区木薯淀粉的结构和理化性质,表明木薯淀粉的粒度、短程有序度、吸水吸油能力等受不同地区木薯淀粉的影响显著。Tappiban等[3]研究了不同地点五个品种的泰国木薯淀粉,发现直链淀粉含量、抗性淀粉含量、精细结构等性状在不同品种和生长地之间存在显著差异。Gourilekshmi等[8]研究了不同生长时期木薯块根淀粉的结构和理化特性,结果表明淀粉颗粒形态随根系生长和栽培品种并无明显变化,但平均颗粒大小差异显著。前人研究表明不同木薯淀粉之间的理化性质和结构差异显著,这些差异与木薯生长的环境因素和木薯的基因型等因素有关,可为木薯的深加工和综合利用提供依据。然而,国内关于不同品种木薯淀粉的理化和结构性质的研究鲜有报道,严重阻碍了我国木薯的深加工和综合利用。
因此,本文选取华南9号(SC9)、华南10号(SC10)、华南11号(SC11)、桂热891(GR891)、桂热911(GR911)五个不同品种木薯为原料,提取淀粉,对比五种木薯淀粉在颗粒形态、粒径、热力学特性、有序结构等理化和结构性质的差异,为木薯育种、新品种开发利用和木薯淀粉在食品工业和非食品工业的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
SC9、SC10、SC11、GR891、GR911木薯原料 广西农垦明阳生化集团股份有限公司提供;乙酸、氢氧化钠、无水乙醇、石油醚 西陇科学股份有限公司;碘、碘化钾、硫酸铜、高峰氏淀粉酶、酒石酸钾钠、亚铁氰化钾、亚甲基蓝、甲基红 阿拉丁生化科技股份有限公司。
Phenom ProX型台式显微能谱一体机 荷兰Phenom公司;BECKMAN Avanti JXN-26型高速冷冻离心机 美国Beckman Coulter公司;RVA TecMaster快速粘度糊化测定仪 澳大利亚Perten公司;NDA 701型杜马斯定氮仪 意大利Velp公司;Rigaku+Ultima IV型X射线衍射仪 日本理学公司;MASTERSIZER 300型粒径分析仪 英国Malvern公司;DSC 25差示扫描量热仪 美国Ta公司;XY52MW型水分测定仪 常州市幸运电子设备有限公司。
1.2 实验方法
1.2.1 淀粉提取
木薯去皮、切块、粉碎,胶体磨湿磨10 min,通过200目筛,多次水洗,抽滤,收集淀粉进行冷冻干燥,保存备用[9]。
1.2.2 化学组分测定
粗脂肪测定参照GB 5009.6-2016;灰分测定参照GB 5009.4-2016;直链淀粉测定参照GB 7648-1987;淀粉含量测定参照GB 5009.9-2016;蛋白质测定:取80 mg样品置于锡箔纸中,挤出锡箔纸中空气后放入杜马斯定氮仪样品盘中分析测定。杜马斯仪器实验条件参数:氧化燃烧温度980 ℃,还原温度650 ℃,氧气流速250 mL/min[10];水分测定:将1 g样品置于水分测定仪中,105 ℃测定样品水分含量[9]。
1.2.3 颗粒形态测定
将样品干燥处理后,取适量样品均匀的粘在样品台上,真空镀膜后置于仪器中,加速电压15 kV,观察淀粉颗粒形貌[11]。
1.2.4 粒径测定
采用干法测定样品粒径,取样品0.1 g,分散气压为3.2 bar,振动进样速度为80%,测量时间为15 s,折射率为1.53的实验条件下进行测定[7]。
1.2.5 热力学特性测定
样品与水的比例1:2,将铝盘密封,置于室温平衡24 h,扫描条件:速率为10 ℃/min,温度10~90 ℃。利用Ta软件计算样品的起始凝胶温度(To)、峰值凝胶温度(Tp)、终止凝胶温度(Tc)和焓变值(ΔHg)[12]。
1.2.6 糊化特性测定
取3.0 g样品置于铝罐中,加入去离子水30 mL。测试程序为:首先在50 ℃以960 r/min搅拌10 s,之后以160 r/min搅拌,在50 ℃保持1 min,3.75 min内样品加热至95 ℃后保存2.5 min,再冷却至50 ℃后保持2 min[13]。
1.2.7 溶解度和膨胀度的测定
配制2%的淀粉乳于离心管中,90 ℃水浴30 min,冷却至室温,6000 r/min离心15 min,分离上清液于105 ℃烘干称重,即为可溶性淀粉质量,下层为膨胀淀粉质量,按下式(1)(2)计算溶解度(S)、膨胀度(SP)[14]。
(1) (2) 式中:A代表可溶性淀粉的质量,g;P代表膨胀淀粉的质量,g;W代表干基淀粉的质量,g;S代表淀粉的溶解度。
1.2.8 冻融稳定性测定
配制6%的淀粉乳,90 ℃加热30 min,将糊化后的样品在-25 ℃下冷冻20 h,30 ℃解冻4 h,此冻融循环5次。然后4000 r/min离心15 min,沉淀称重,用析水率(Water separation)表达脱水收缩的程度[15]。
(3) 式中:W1代表淀粉糊的质量,g;W2代表离心后沉淀的质量,g。
1.2.9 长程有序结构测定
利用Rigaku+UltimaIV型X-射线衍射仪对淀粉样品进行测定。实验条件参数为电压40 kV,电流200 mA,扫描范围为4°~40°,扫描速度10°/min,用Jade软件计算样品的相对结晶度(RC)[8]。
(4) 式中:Ac代表结晶区域面积;Aa代表无定形区域面积。
1.2.10 短程有序结构测定
将淀粉与KBr粉末按1:100混合并压制成片,利用红外光谱(FTIR)快速扫描测定,扫描范围为4000~400 cm−1,分辨率为4 cm−1,扫描次数为64次[16]。
1.3 数据处理
所有实验至少重复3次,使用SPSS 23.0对数据在P<0.05水平上进行方差分析和显著性差异分析,使用Origin 2018绘制图表。
2. 结果与分析
2.1 木薯淀粉的化学组分分析
表1可知,木薯淀粉的水分含量均在5%左右,不同品种木薯淀粉之间粗脂肪含量为0.13%~0.46%,蛋白质含量为0.10%~0.15%,灰分含量为0.06%~0.10%,淀粉含量为99.01%~99.57%,说明本研究中水法提取的木薯淀粉纯度较高,这与Zhang等[17]报道的高纯度淀粉结果相一致。直链淀粉含量为22.56%~27.49%,五种不同木薯淀粉的直链淀粉含量差异性显著(P<0.05),GR911的直链淀粉含量最高(27.49%),SC9的直链淀粉含量最低(22.56%),SC10(25.19%)、SC11(24.98%)、GR891(25.66%)的直链淀粉含量没有显著性差异(P>0.05)。本研究表明木薯淀粉的直链淀粉含量表现出品种间差异,这与Moorthy等[18]的报道一致,造成这种差异的原因还可能与生长环境、收获时间、收获季节有关。Tappiban等[3]研究表明,木薯淀粉的直链淀粉含量为28.2%,与本研究中GR911的直链淀粉含量相类似。
表 1 五个品种木薯淀粉化学组分Table 1. Chemical composition of starch isolated from five different varieties of cassava样品 水分(%) 淀粉含量(%,db) 粗脂肪(%,db) 蛋白质(%,db) 灰分(%,db) 直链淀粉含量(%,db) SC9 4.77±0.14c 99.45±0.10a 0.23±0.03b 0.10±0.01b 0.06±0.03b 22.56±0.02c SC10 5.33±0.23ab 99.01±0.12b 0.46±0.05a 0.15±0.02a 0.06±0.02b 25.19±0.01b SC11 5.47±0.32a 99.52±0.14a 0.17±0.02c 0.11±0.01b 0.07±0.01ab 24.98±0.02b GR891 5.01±0.17bc 99.49±0.14a 0.14±0.03c 0.15±0.02a 0.06±0.01b 25.66±0.00b GR911 4.97±0.25bc 99.57±0.21a 0.13±0.02c 0.11±0.02b 0.10±0.02a 27.49±0.00a 注:db:干基淀粉;同列小写字母相同表示差异不显著,不同表示差异显著(P<0.05);表2~表5同。 2.2 颗粒形态和粒径分析
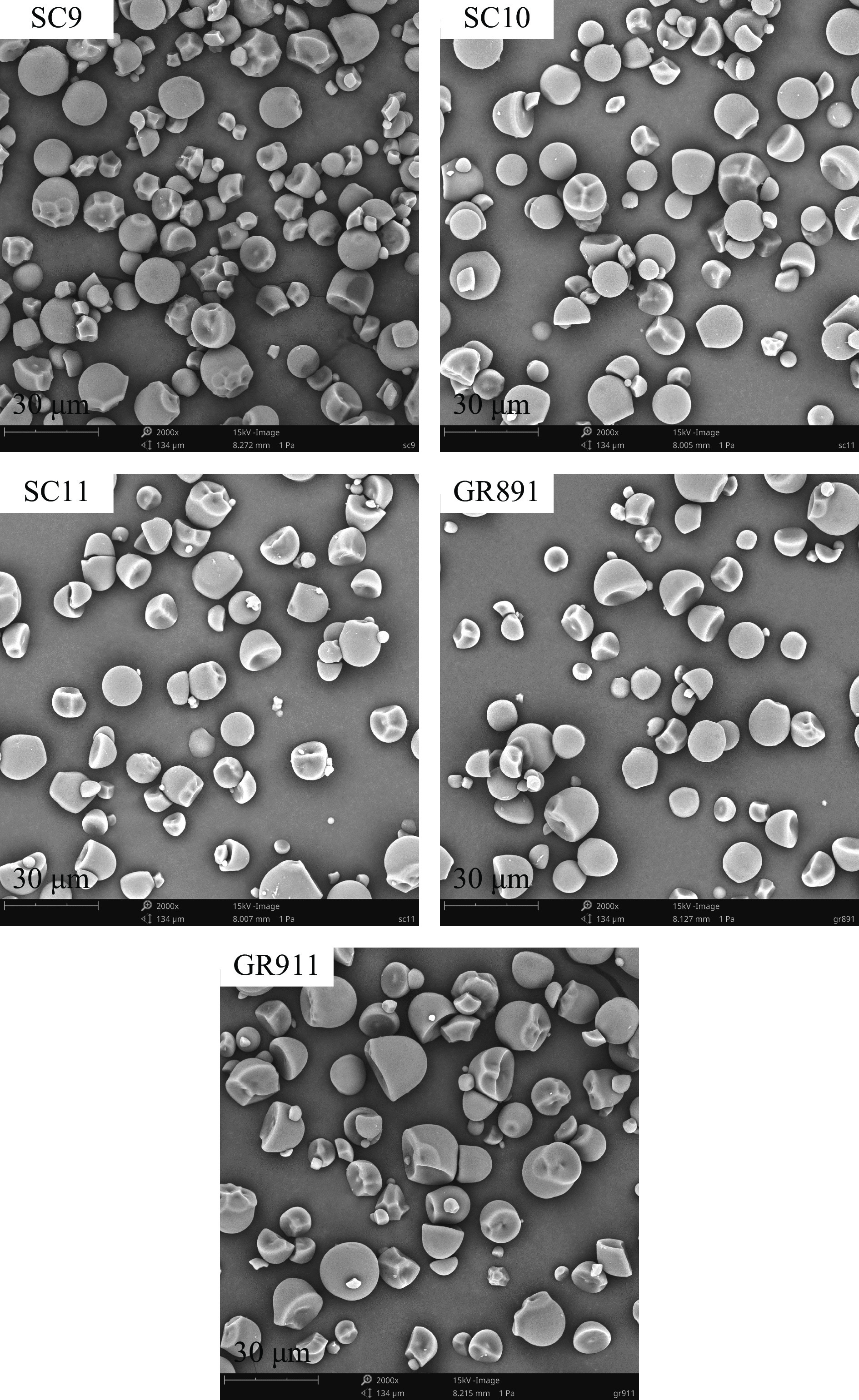
淀粉颗粒大小及其形态特征对淀粉的理化性质具有一定影响,因此对淀粉颗粒大小研究正受到越来越多的重视。由图1可知,木薯淀粉颗粒表面光滑,大小不一,形状多呈球缺形及不规则半球体,与前人报道结果相似[19]。相比于其它两种木薯淀粉(SC9、GR911),SC10、SC11和GR891品种木薯淀粉颗粒形状更加规则,大小均一。表2数据显示,五种木薯淀粉的平均粒径存在一定差异,平均粒径范围为12.43~19.03 μm,GR911平均粒径最大(19.03 μm),SC9平均粒径最小(12.43 μm),SC10、SC11和GR891的平均粒径在P<0.05水平上没有显著性差异。前人报道木薯淀粉平均粒径在13.33~14.67 μm之间[20],与本文研究中SC10、SC11、GR891木薯淀粉的粒径相近,高于SC9木薯淀粉的粒径,低于GR911木薯淀粉的粒径。
表 2 五个品钟木薯淀粉粒径分布Table 2. Granule size and distribution of starch isolated from five different varieties of cassava品种 D[4,3] Dv(10) Dv(50) Dv(90) SC9 12.43±0.12c 7.48±0.14b 12.07±0.12b 18.37±0.25b SC10 13.80±0.24b 8.13±0.09a 13.23±0.17a 20.97±0.88a SC11 13.17±0.12bc 7.97±0.13ab 12.80±0.14a 19.50±0.22ab GR891 14.00±0.73b 7.64±0.50ab 12.60±0.54ab 20.50±1.74a GR911 19.03±0.94a 8.23±0.08a 13.20±0.08a 21.00±0.32a 注:D[4,3]:体积平均直径;Dv(10):10%淀粉颗粒直径小于该值;Dv(50):50%淀粉颗粒直径小于该值;Dv(90):90%淀粉颗粒直径小于该值。 2.3 热力学特性
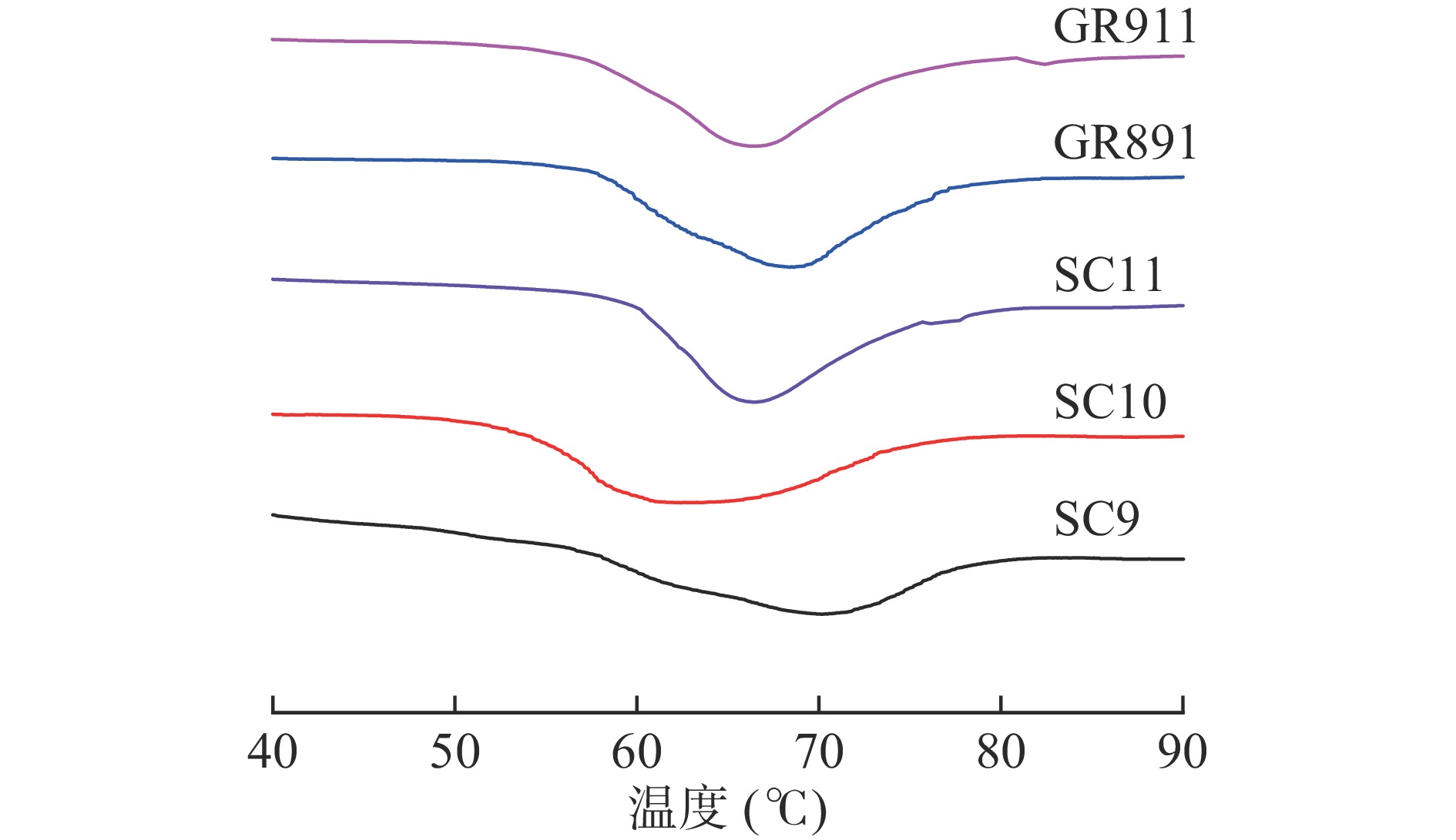
热力学特性能够反映淀粉颗粒的热稳定性和淀粉凝胶的过程,包括淀粉结晶区双螺旋展开和微晶融合[21]。如图2、表3所示,不同品种木薯淀粉的热力学特性存在明显差异。五个不同品种木薯淀粉的To、Tp和Tc的变化范围分别为54.99~60.16、62.43~70.13、73.43~77.01 ℃。本研究中木薯淀粉ΔHg的变化范围为9.96~13.92 J/g,SC9的焓值最低,GR911的焓值最高。焓与淀粉颗粒内双螺旋的损失有关,SC9的焓值最低,可能是因为其双螺旋的有序性低。本研究五个品种木薯淀粉的热力学特性,与梅既强[12]研究报道木薯淀粉的热力学特性基本一致(To、Tp、Tc和ΔHg分别为57.80、67.08、77.29 ℃和10.53 J/g),略低于Wongsagonsup等[13]报道的木薯淀粉热力学特性(To、Tp、Tc和ΔHg分别为64.1、69.9、79.5 ℃和14.9 J/g),产生这些差异的原因可能跟木薯淀粉的直链淀粉含量有关,据Chisenga等[22]报道直链淀粉含量与淀粉凝胶焓成正比,这归因于淀粉颗粒和直链淀粉分子之间对水分子的竞争作用。Zhang等[23]研究表明具有较低凝胶转变温度(To、Tp和Tc)和较高焓值的淀粉代表虽然形成的支链淀粉微晶很多但并不完美。本研究中GR911也显示出同样的现象。本研究中五个品种木薯淀粉的凝胶焓与直链淀粉含量(表1)、粒径(表2)的研究结果一致。
表 3 五个品种木薯淀粉的热力学特性、溶解度和膨胀度Table 3. Thermal properties, swelling power and solubility of starch isolated from five different varieties of cassava品种 To(℃) Tp(℃) Tc(℃) ΔHg(J/g) S(%) SP(g/g) SC9 56.46±0.44bc 70.13±0.15a 77.01±0.40a 9.96±0.09b 10.35±0.40c 28.00±1.33c SC10 54.99±0.46c 62.43±0.31d 74.03±0.16cd 13.64±0.10a 12.87±0.58b 31.53±0.77b SC11 60.16±1.20a 66.23±0.12c 73.43±0.42d 11.85±0.67b 12.57±1.50b 30.94±1.43b GR891 59.43±0.66a 66.44±0.37c 74.63±0.16bc 10.77±0.30b 13.02±0.83b 30.66±1.06b GR911 57.85±0.41b 68.37±0.11b 75.16±0.33b 13.92±0.28a 15.21±0.38a 35.00±1.34a 2.4 糊化特性
淀粉在加热过程中,吸水导致淀粉颗粒膨胀和破裂,直链淀粉溶解并拉伸成线性结构,支链淀粉形成粘性糊状物[24]。不同品种木薯淀粉的糊化特性如表4所示,不同品种木薯淀粉的峰值粘度存在显著差异性(P<0.05),SC9的峰值粘度最高(5534.50 cP),GR911的峰值粘度最低(4867.50 cP),SC10、SC11、GR891介于最高和最低的峰值粘度之间。本研究中峰值粘度与直链淀粉含量(表1)、粒径(表2)研究结果相反,这与前人报道结果一致[25]。崩解值代表糊黏度的热稳定性[26],不同品种木薯淀粉的崩解值为2306.00~3010.50 cP,GR891品种木薯淀粉的崩解值(3010.50 cP)最高,GR911品种木薯淀粉的崩解值(2306.00 cP)最低。崩解值越小代表淀粉糊的热稳定性越强,因此GR911品种木薯淀粉在烹饪过程中承受加热和剪切应力的能力越强。回生值反映了淀粉糊的老化程度和形成凝胶能力的强弱,五个不同品种木薯淀粉的回生值为1176.50~1575.00 cP,SC9的回生值最低(1176.50 cP),SC11的回生值最高(1575.00 cP)。回生值越大,代表着凝胶性越强,更容易老化。因此SC11淀粉形成凝胶的能力更强,更容易老化。
表 4 五个品种木薯淀粉糊化特性Table 4. Pasting profiles of starch isolated from five different varieties of cassava品种 峰值粘度(PV)(cP) 谷值粘度(TV)(cP) 崩解值(BD)(cP) 最终粘度(FV)(cP) 回生值(SB)(cP) 糊化温度(T)(℃) SC9 5534.50±2.50a 2636.50±14.50b 2916.00±35.00a 4025.00±35.00ab 1176.50±50.50b 66.80±0.00d SC10 5329.50±15.50b 2678.00±19.00a 2651.50±34.50b 3904.50±18.50b 1443.50±34.50a 68.40±0.80bc SC11 5077.00±25.00c 2493.00±5.00d 2584.00±30.00b 4068.00±50.00a 1575.00±55.00a 69.20±0.05ab GR891 5077.50±32.50c 2067.00±2.00e 3010.50±30.50a 3318.50±10.50c 1251.50±12.50b 67.58±0.08cd GR911 4867.50±22.50d 2561.50±2.50c 2306.00±20.00c 3968.50±37.50ab 1437.00±10.00a 69.95±0.00a 五个品种木薯淀粉的糊化温度在66.80~69.95 ℃之间,GR911的糊化温度最高,SC9的糊化温度最低,SC10、SC11和GR891的糊化温度处于两者之间。Li等[9]研究报道高直链淀粉含有较厚的半结晶层,因此高直链淀粉的糊化温度较高。本研究中GR911直链淀粉含量最高,因此糊化温度最高。本研究中糊化温度与峰值凝胶温度的研究结果相类似。Oyeyinka等[27]研究报道天然木薯淀粉的糊化温度为74 ℃,高于本研究木薯淀粉的糊化温度,这可能是因为它的直链淀粉含量较高(27%)。根据Falade等[28]的研究,糊化温度与淀粉颗粒大小有关,颗粒越小,淀粉越不易糊化。与本研究中糊化温度和淀粉颗粒大小(表2)的研究结果相反,SC9淀粉颗粒粒径最小,但表现出最低糊化温度,这可能与淀粉颗粒内双螺旋排列的有序性有关,正如2.3中凝胶焓结果所示。
糊化特性是淀粉应用于食品工业时最重要的参考依据。SC9和SC10具有较高峰值粘度、高崩解值和较低糊化温度,可以考虑用作增稠剂或胶凝剂,例如调味酱、水果馅和酸奶;GR911因低峰值粘度、较高的最终粘度和回生值使其适用于需要低糊粘度和澄清度的食品,例如糖果或断奶食品中的填充物;SC11、GR891可以应用于粘性食品(糕点和蛋糕)或者膨化食品。
2.5 膨胀度和溶解度
淀粉颗粒吸水膨胀有助于直链淀粉和支链淀粉的分离,从而促进直链淀粉从颗粒间隙中浸出。淀粉分子在加热过程中会导致半结晶结构的破坏,水分子通过与直链淀粉和支链淀粉分子结合导致淀粉颗粒膨胀,同时增加了淀粉颗粒大小和溶解度[29]。如表3所示,五个品种木薯淀粉的溶解度存在显著性差异(P<0.05),范围为10.35%~15.21%,GR911淀粉的溶解度最高,SC9淀粉的溶解度最低,SC10(12.87%)、SC11(12.57%)、GR891(13.02%)的溶解度在P<0.05的水平上并不显著。Zhang等、Falade等[23,28]研究报道,淀粉颗粒粒径越小,溶解度越低。本研究中同样表现出溶解度与粒径相一致的结果正如表2、表1(直链淀粉含量)的研究结果所示。Romano等[30]研究表明,木薯淀粉的溶解度为16.46%,高于本研究五种木薯淀粉的溶解度,可能是因为它的颗粒粒径比较大(20 μm)。五个品种木薯淀粉的膨胀度如表3所示,GR911的膨胀度最高(35.00 g/g),SC9的膨胀度最低(28.00 g/g),SC10、SC11、GR891的膨胀度(31.53、30.94、30.66 g/g)没有显著性差异(P>0.05)。膨胀度不仅与支链淀粉有关(与短支链含量呈正相关,长支链含量呈负相关)[31],还与淀粉颗粒大小有关[28],淀粉颗粒越大,越有利于与水接触,容易膨胀。本研究中膨胀度与粒径的研究结果(表2)一致。
2.6 冻融稳定性
淀粉凝胶的冻融稳定性反映淀粉与水相互结合的能力。淀粉糊化后经低温处理时淀粉分子重新排列组合,破坏了淀粉凝胶的性质,淀粉和水分子间的作用力变弱,因此离心后淀粉凝胶严重析水,而且直链淀粉含量越高,析水率越大[32]。如表5所示,整个冻融稳定性实验期间,五个不同品种木薯淀粉的析水率均随着冻融次数的增加而增加。GR911的析水率显著高于其余四种木薯淀粉(P<0.05),SC9的析水率最低,SC10、SC11和GR891的析水率介于两者之间。析水率越高代表着淀粉的冻融稳定性越差,因此GR911的冻融稳定性最差,而SC9的冻融稳定性最好,可能是因为SC9的直链淀粉含量最低、粒径最小,GR911的直链淀粉含量最高、粒径最大。本研究中冻融稳定性与直链淀粉含量(表1)、粒径(表2)研究结果相反。Srichuwong等[15]研究表明,木薯淀粉1、3、5次循环时析水率为0%、38.9%、51.5%,与GR911的研究结果基本一致。本研究五种木薯淀粉1、2、3次冻融循环的析水率低于Granza等[33]研究报道木薯淀粉1、2、3次冻融时析水率(9.7%、19.1%、30.0%)。这种水分分离的差异可能是由木薯品种、收获时间和条件的差异导致木薯淀粉理化性质的差异造成的。
表 5 五个品种木薯淀粉的冻融稳定性和相对结晶度Table 5. Freeze-thaw stability and relative crystallinity of starch isolated from five different varieties of cassava品种 冻融循环次数(次) RC(%) A1047/1022 1 2 3 4 5 SC9 0 1.92±0.07d 15.42±0.76c 22.76±0.69c 33.58±0.86c 26.49±0.60a 0.756±0.003d SC10 0 2.32±0.43cd 15.65±1.01c 23.62±2.28c 36.16±0.22b 23.72±0.38b 0.867±0.002b SC11 0 3.13±0.20b 19.52±1.45b 28.89±0.95b 37.07±0.27b 22.42±0.37bc 0.852±0.005bc GR891 0 4.31±0.50a 24.90±1.02a 30.14±1.23b 36.88±1.29b 23.32±0.38bc 0.845±0.010c GR911 0 2.77±0.17bc 26.89±0.93a 51.16±1.25a 59.57±1.28a 21.92±1.06c 0.882±0.007a 注:A1047/1022:1047与1022 cm−1处吸收峰强度的比值。 2.7 长程有序结构
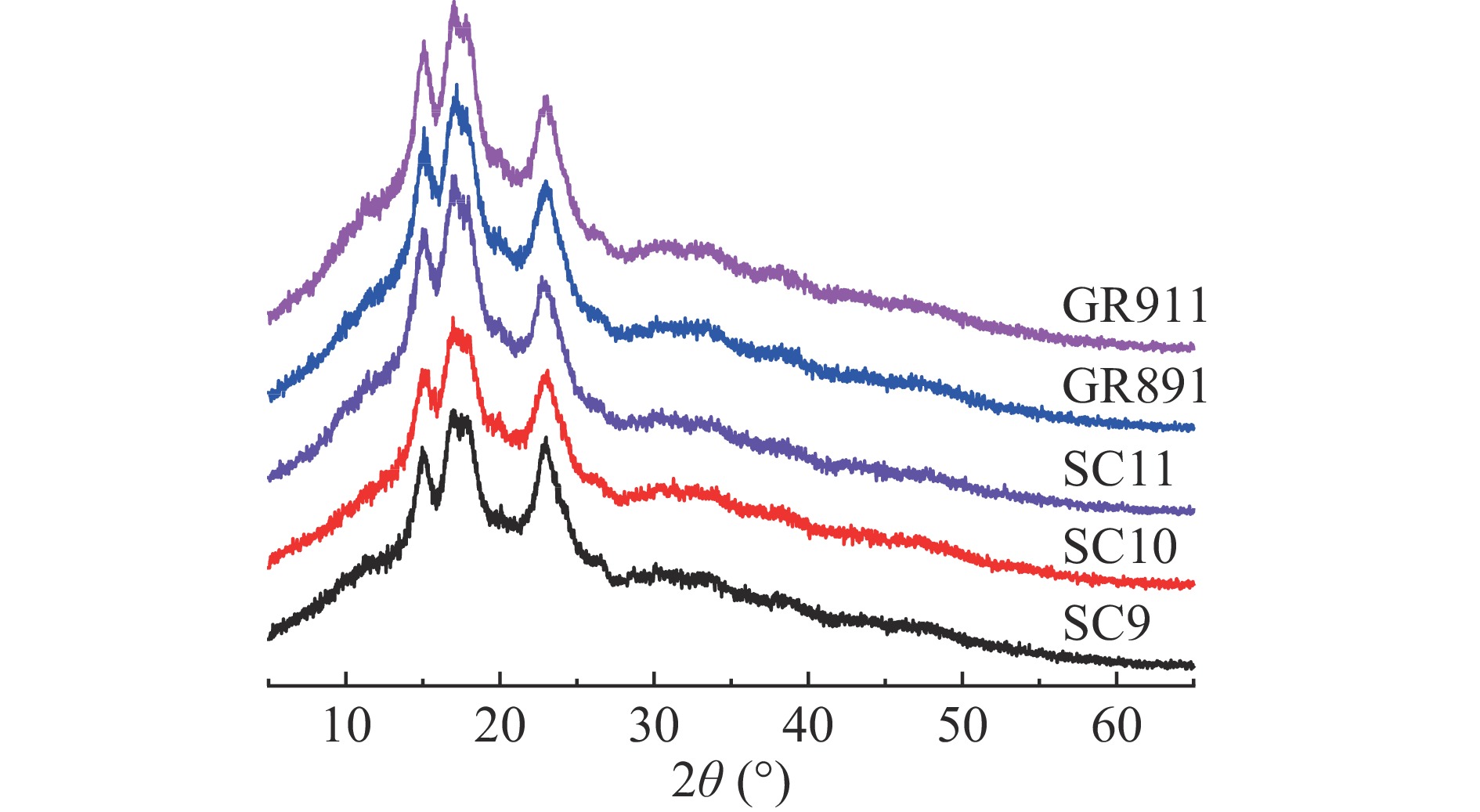
图3为不同品种木薯淀粉的XRD衍射图,五种木薯淀粉在2θ约为15°、17°、18°、23°处出现强的衍射峰,说明木薯淀粉为典型的A型结晶结构。五个不同品种木薯淀粉的相对结晶度存在显著性差异(P<0.05,表5),SC9的相对结晶度为26.49%,显著高于SC10、SC11、GR891和GR911的相对结晶度,GR911相对结晶度最低(21.92%),SC10、SC11和GR891品种之间的相对结晶度无显著性差异(P>0.05)。本研究中相对结晶度结果与直链淀粉含量结果呈反比(表1)。据前人报道,淀粉的相对结晶度与颗粒大小也有关[23],淀粉颗粒越小,淀粉颗粒结构越紧致,结晶度越大。本研究中不同品种木薯淀粉相对结晶度的结果与粒径大小的研究结果呈相反的趋势(表2)。Liu等[34]研究报道天然木薯淀粉为A型结晶结构,相对结晶度为21.82%,与本研究中SC11、GR891和GR911的相对结晶度基本一致,但是低于SC9和SC10品种木薯淀粉的结晶度。He等[7]研究SC9品种的木薯淀粉的结晶度为24.8%,高于本研究SC9的结晶度。梅既强[12]报道木薯淀粉的结晶度(37.64%)显著高于本研究木薯淀粉的结晶度。产生这些差异的原因是淀粉的相对结晶度除与植物来源有关外,还与淀粉的结构和结晶度计算方法等有关。
2.8 短程有序结构
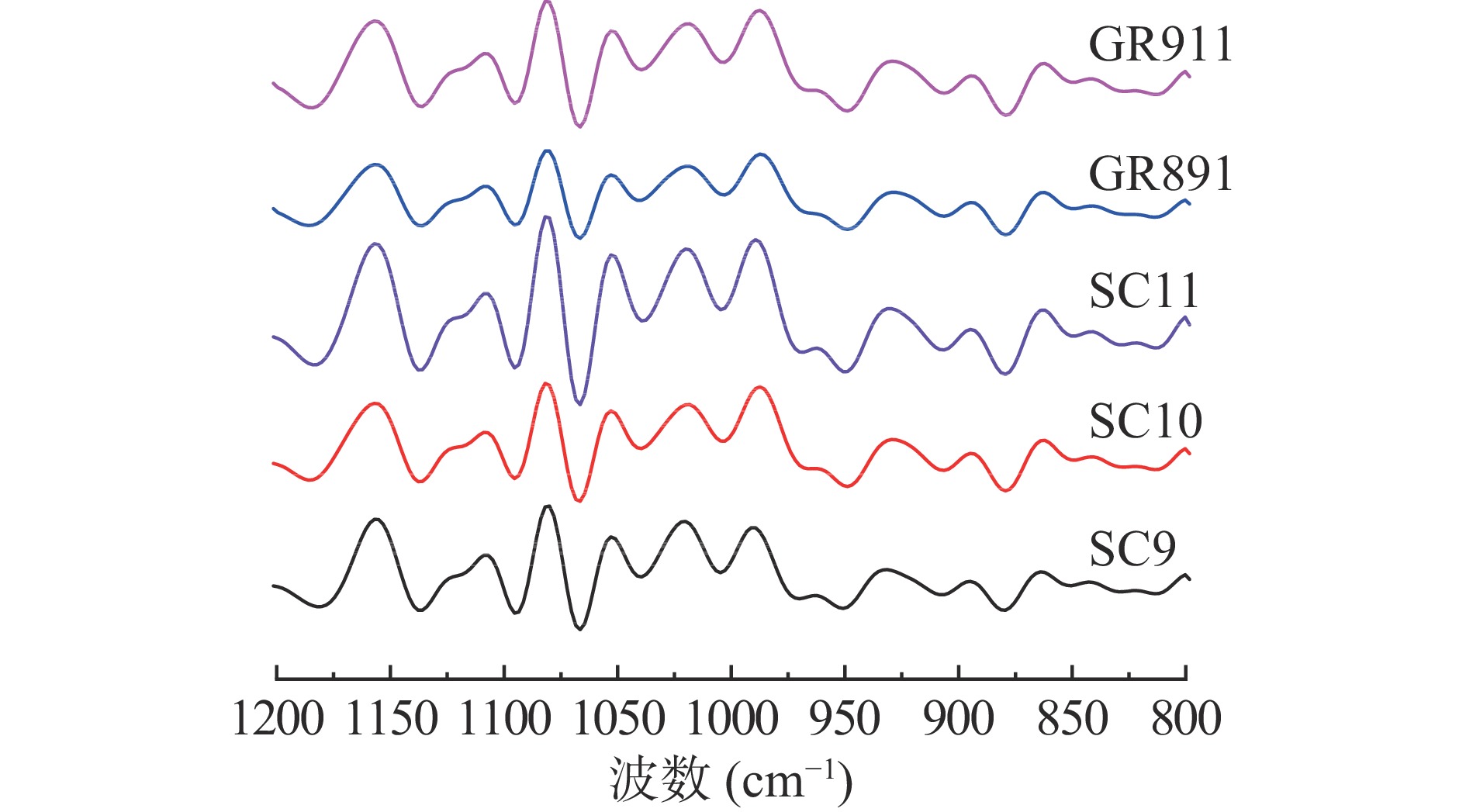
图4为五个品种木薯淀粉的红外光谱去卷积图谱,红外光谱中1047与1022 cm−1处吸收峰强度比值的大小能够代表淀粉结晶区有序结构的变化情况,比值越大,有序性越高[13]。SC9、SC10、SC11、GR891、GR911的A1047/1022的比值(表5)分别为0.756、0.867、0.852、0.845、0.882,GR911的A1047/1022比值最大表明GR911淀粉颗粒结晶区的有序化程度最高,SC9的A1047/1022比值最小,表明SC9淀粉的有序化程度最低。这个结果与相对结晶度的结果正好相反,说明木薯淀粉SC9虽然形成了更多的结晶,但这结晶并不完美。SC9的直链淀粉含量最小,结晶度最高,但A1047/1022比值最小,说明SC9有很多支链淀粉微晶,但结晶区双螺旋排列的有序度很低。Qi等[24]研究报道木薯淀粉A1047/1022比值为0.859,与本研究中五个品种木薯淀粉A1047/1022比值相一致。本研究中短程有序性与凝胶焓(表3)、糊化温度(表4)、粒径(表2)和直链淀粉含量(表1)的研究结果一致,与相对结晶度(表5)的研究结果相反。
2.9 相关性分析
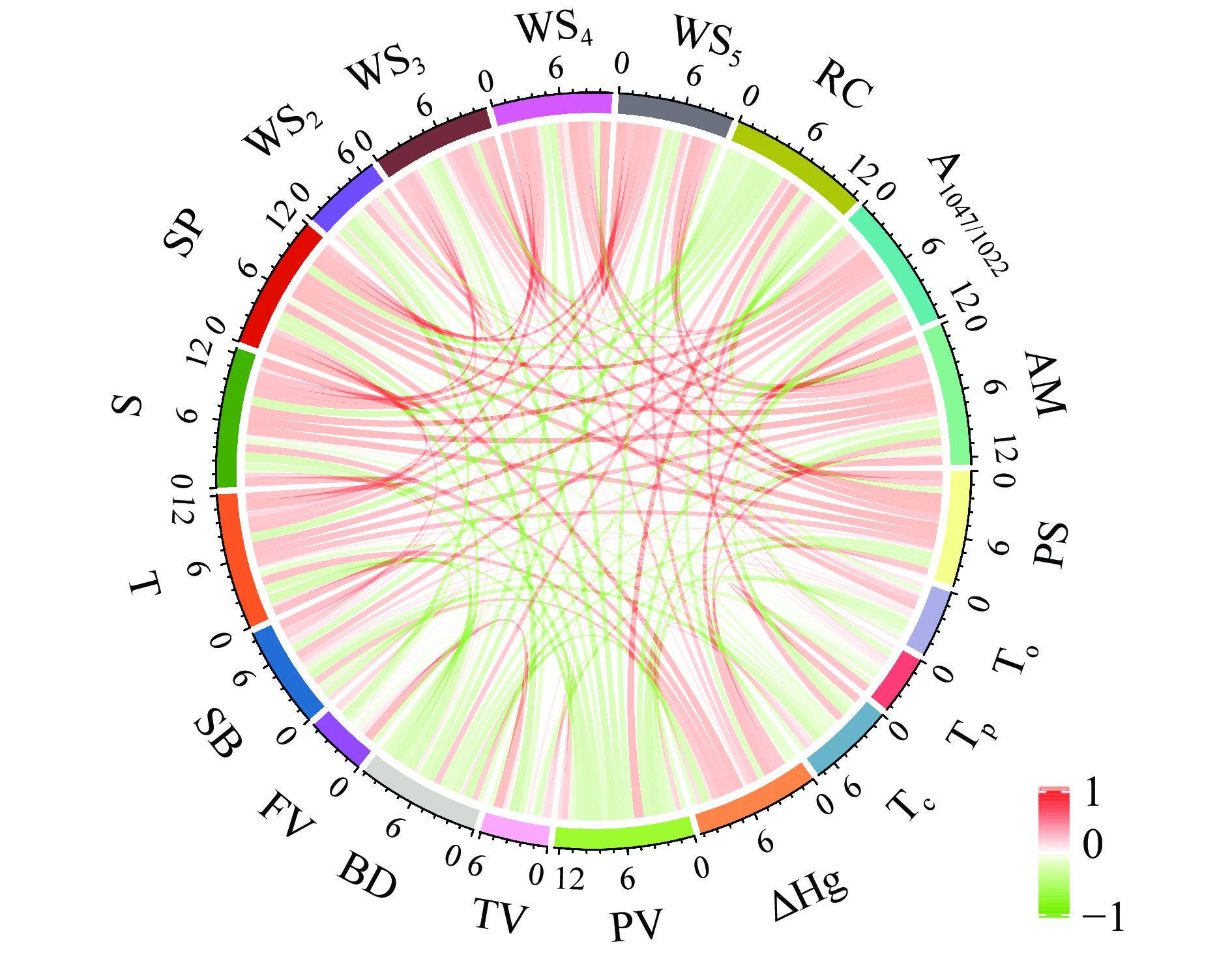
不同品种木薯淀粉理化和结构性质之间的相关性如图5所示,AM、PS与ΔHg、T、S、SP、A1047/1022呈显著性正相关(P<0.05),与PV、BD、RC呈显著性负相关(P<0.05),并且随着冻融次数增加,与WS呈显著性正相关(P<0.05)。表明本研究中直链淀粉含量和粒径大小对淀粉颗粒的理化性质有显著性影响,与2.3~2.8研究结果一致。To、Tp、Tc与其它理化性质之间并没有显著相关性,ΔHg与AM、PS、S、SP、T、A1047/1022之间呈正相关(P<0.05),与RC呈显著性负相关(P<0.05)。本研究中GR911的相对结晶度最低,但凝胶焓和A1047/1022的比值最高,进一步证明了凝胶焓与淀粉颗粒内双螺旋排列的有序性有关。在本研究中T与AM、PS、ΔHg、S、SP、WS、SB、A1047/1022呈显著性正相关(P<0.05),与RC、BD、PV呈显著性负相关(P<0.05),PV与AM、A1047/1022、S、SP、PS、FT、T呈显著性负相关(P<0.05),BD与PV、TV与FV呈显著性正相关(P<0.05)。本研究表明,直链淀粉含量、粒径、相对结晶度、短程有序性对木薯淀粉的糊化特性有显著性影响。此外,木薯淀粉的糊化特性还可能受到淀粉糊化程度、淀粉组分的链长和分子分解程度等其他因素的影响,有待进一步研究。
3. 结论
本研究分离纯化了五个不同品种的木薯淀粉,并对其理化和结构性质进行了对比研究,结果发现不同品种木薯淀粉的化学组成、粒径、直链淀粉含量存在明显差异。五个不同品种的木薯淀粉均呈典型的A型结晶结构,直链淀粉含量为22.56%~27.49%。低直链淀粉含量的木薯淀粉SC9的相对结晶度最高(26.49%),而高直链淀粉含量的木薯淀粉GR911的相对结晶度最低(21.92%),表明直链淀粉含量与淀粉的相对结晶度呈反比。木薯淀粉SC9的凝胶焓(9.96 J/g)、糊化温度(66.80 ℃)和A1047/1022(0.756)均显著低于其余四种木薯淀粉(P<0.05),而GR911的凝胶焓(13.92 J/g)、糊化温度(69.95 ℃)和A1047/1022(0.882)最大,结果表明凝胶焓和糊化温度与淀粉颗粒内双螺旋排列的有序性有关。根据糊化特性可知,SC9、SC10可用作食品增稠剂或胶凝剂,GR911适用于糖果或断奶食品的填充,SC11、GR891可用于粘性食品。本研究结果可为促进木薯淀粉在食品工业中更广泛的应用提供了理论参考。此外,关于不同品种木薯淀粉微观和精细结构及其理化性质之间的相关关系有待进一步研究。
-
表 1 五个品种木薯淀粉化学组分
Table 1 Chemical composition of starch isolated from five different varieties of cassava
样品 水分(%) 淀粉含量(%,db) 粗脂肪(%,db) 蛋白质(%,db) 灰分(%,db) 直链淀粉含量(%,db) SC9 4.77±0.14c 99.45±0.10a 0.23±0.03b 0.10±0.01b 0.06±0.03b 22.56±0.02c SC10 5.33±0.23ab 99.01±0.12b 0.46±0.05a 0.15±0.02a 0.06±0.02b 25.19±0.01b SC11 5.47±0.32a 99.52±0.14a 0.17±0.02c 0.11±0.01b 0.07±0.01ab 24.98±0.02b GR891 5.01±0.17bc 99.49±0.14a 0.14±0.03c 0.15±0.02a 0.06±0.01b 25.66±0.00b GR911 4.97±0.25bc 99.57±0.21a 0.13±0.02c 0.11±0.02b 0.10±0.02a 27.49±0.00a 注:db:干基淀粉;同列小写字母相同表示差异不显著,不同表示差异显著(P<0.05);表2~表5同。 表 2 五个品钟木薯淀粉粒径分布
Table 2 Granule size and distribution of starch isolated from five different varieties of cassava
品种 D[4,3] Dv(10) Dv(50) Dv(90) SC9 12.43±0.12c 7.48±0.14b 12.07±0.12b 18.37±0.25b SC10 13.80±0.24b 8.13±0.09a 13.23±0.17a 20.97±0.88a SC11 13.17±0.12bc 7.97±0.13ab 12.80±0.14a 19.50±0.22ab GR891 14.00±0.73b 7.64±0.50ab 12.60±0.54ab 20.50±1.74a GR911 19.03±0.94a 8.23±0.08a 13.20±0.08a 21.00±0.32a 注:D[4,3]:体积平均直径;Dv(10):10%淀粉颗粒直径小于该值;Dv(50):50%淀粉颗粒直径小于该值;Dv(90):90%淀粉颗粒直径小于该值。 表 3 五个品种木薯淀粉的热力学特性、溶解度和膨胀度
Table 3 Thermal properties, swelling power and solubility of starch isolated from five different varieties of cassava
品种 To(℃) Tp(℃) Tc(℃) ΔHg(J/g) S(%) SP(g/g) SC9 56.46±0.44bc 70.13±0.15a 77.01±0.40a 9.96±0.09b 10.35±0.40c 28.00±1.33c SC10 54.99±0.46c 62.43±0.31d 74.03±0.16cd 13.64±0.10a 12.87±0.58b 31.53±0.77b SC11 60.16±1.20a 66.23±0.12c 73.43±0.42d 11.85±0.67b 12.57±1.50b 30.94±1.43b GR891 59.43±0.66a 66.44±0.37c 74.63±0.16bc 10.77±0.30b 13.02±0.83b 30.66±1.06b GR911 57.85±0.41b 68.37±0.11b 75.16±0.33b 13.92±0.28a 15.21±0.38a 35.00±1.34a 表 4 五个品种木薯淀粉糊化特性
Table 4 Pasting profiles of starch isolated from five different varieties of cassava
品种 峰值粘度(PV)(cP) 谷值粘度(TV)(cP) 崩解值(BD)(cP) 最终粘度(FV)(cP) 回生值(SB)(cP) 糊化温度(T)(℃) SC9 5534.50±2.50a 2636.50±14.50b 2916.00±35.00a 4025.00±35.00ab 1176.50±50.50b 66.80±0.00d SC10 5329.50±15.50b 2678.00±19.00a 2651.50±34.50b 3904.50±18.50b 1443.50±34.50a 68.40±0.80bc SC11 5077.00±25.00c 2493.00±5.00d 2584.00±30.00b 4068.00±50.00a 1575.00±55.00a 69.20±0.05ab GR891 5077.50±32.50c 2067.00±2.00e 3010.50±30.50a 3318.50±10.50c 1251.50±12.50b 67.58±0.08cd GR911 4867.50±22.50d 2561.50±2.50c 2306.00±20.00c 3968.50±37.50ab 1437.00±10.00a 69.95±0.00a 表 5 五个品种木薯淀粉的冻融稳定性和相对结晶度
Table 5 Freeze-thaw stability and relative crystallinity of starch isolated from five different varieties of cassava
品种 冻融循环次数(次) RC(%) A1047/1022 1 2 3 4 5 SC9 0 1.92±0.07d 15.42±0.76c 22.76±0.69c 33.58±0.86c 26.49±0.60a 0.756±0.003d SC10 0 2.32±0.43cd 15.65±1.01c 23.62±2.28c 36.16±0.22b 23.72±0.38b 0.867±0.002b SC11 0 3.13±0.20b 19.52±1.45b 28.89±0.95b 37.07±0.27b 22.42±0.37bc 0.852±0.005bc GR891 0 4.31±0.50a 24.90±1.02a 30.14±1.23b 36.88±1.29b 23.32±0.38bc 0.845±0.010c GR911 0 2.77±0.17bc 26.89±0.93a 51.16±1.25a 59.57±1.28a 21.92±1.06c 0.882±0.007a 注:A1047/1022:1047与1022 cm−1处吸收峰强度的比值。 -
[1] 熊贤坤, 易怀锋, 宋记明, 等. 不同木薯品种生长发育、产量及抗根腐病评价[J]. 中国热带农业,2021(6):44−49. [XIONG X K, YI H F, SONG J M, et al. Evaluation of growth, yield, root rot resistance of different cassava cultivars[J]. China Tropical Agriculture,2021(6):44−49. doi: 10.3969/j.issn.1673-0658.2021.06.009 [2] ZHU F. Composition, structure, physicochemical properties, and modifications of cassava starch[J]. Carbohydrate Polymers,2015,122:456−480. doi: 10.1016/j.carbpol.2014.10.063
[3] TAPPIBAN P, SRAPHET S, SRISAWAD N, et al. Effects of cassava variety and growth location on starch fine structure and physicochemical properties[J]. Food Hydrocolloids,2020,108:106074. doi: 10.1016/j.foodhyd.2020.106074
[4] 曹英, 夏文, 李积华, 等. 超微粉碎处理对木薯淀粉结构及消化特性的影响[J]. 食品工业科技,2019,40(7):30−34,40. [CAO Y, XIA W, LI J H, et al. Effect of micronization on the structure and digestibility of tapioca starch[J]. Science and Technology of Food Industry,2019,40(7):30−34,40. doi: 10.13386/j.issn1002-0306.2019.07.006 [5] 杨栋林, 陈燕珍, 庞月圆, 等. 不同品种的木薯淀粉理化特性研究[J]. 安徽农业科学,2009,37(19):8935−8936, 8938. [YANG D L, CHEN Y Z, PANG Y Y, et al. Research on the physicochemical property of the starch in different cassava varieties[J]. Journal of Anhui Agricultural Sciences,2009,37(19):8935−8936, 8938. doi: 10.3969/j.issn.0517-6611.2009.19.060 [6] 古碧, 林莹, 李凯, 等. 不同生长期木薯块根淀粉糊化特性的差异[J]. 热带作物学报,2011,32(2):334−338. [GU B, LIN Y, LI K, et al. Gelatinization characteristics variation of starch during the growth and development of cassava[J]. Chinese Journal of Tropical Crops,2011,32(2):334−338. [7] HE R, FU N F, CHEN H M, et al. Comparison of the structural characterizatics and physicochemical properties of starches from sixteen cassava germplasms cultivated in China[J]. International Journal of Food Properties,2020,23(1):693−707. doi: 10.1080/10942912.2020.1752714
[8] GOURILEKSHMI S S, JYOTHI A N, SREEKUMAR J. Physicochemical and structural properties of starch from cassava roots differing in growing duration and ploidy level[J]. Starch-Stärke,2020,72(11−12):1900237.
[9] LI B, WANG Y, ZHU L, et al. Starch characterizations of two kinds of seedless Artocarpus altilis (Parkinson) Fosberg originated from China[J]. Food Hydrocolloids,2022,123:107145. doi: 10.1016/j.foodhyd.2021.107145
[10] ITURBIDE-CASAS M A, MOLINA-RECIO G, CÁMARA-MARTOS F. Macronutrients and trace elements in enteral nutrition formulas: Compliance with label, bioaccessibility and contribution to reference intakes through a probabilistic assessment[J]. Journal of Food Composition and Analysis,2019,83:103250. doi: 10.1016/j.jfca.2019.103250
[11] 樊艳叶, 林日辉, 杨慧, 等. 不同碱对木薯淀粉结构的影响[J]. 食品工业科技,2020,41(4):13−18, 24. [FAN Y Y, LIN R H, YANG H, et al. Effect of different alkali on the structure of cassava starch[J]. Science and Technology of Food Industry,2020,41(4):13−18, 24. doi: 10.13386/j.issn1002-0306.2020.04.003 [12] 梅既强. 木薯淀粉的化学改性及其衍生物的结构、性质和体外消化率的研究[D]. 合肥: 合肥工业大学, 2016 MEI J Q. Studies on chemical modification of cassava starch and structure, properties ang in vitro digestibility of its derivatives[D]. Hefei: Hefei University of Technology, 2016.
[13] WONGSAGONSUP R, PUJCHAKARN T, JITRAKBUMRUNG S, et al. Effect of cross-linking on physicochemical properties of tapioca starch and its application in soup product[J]. Carbohydrate Polymers,2014,101:656−665. doi: 10.1016/j.carbpol.2013.09.100
[14] DUDU O E, LI L, OYEDEJI A B, et al. Structural and functional characteristics of optimised dry-heat-moisture treated cassava flour and starch[J]. International Journal of Biological Macromolecules,2019,133:1219−1227. doi: 10.1016/j.ijbiomac.2019.04.202
[15] SRICHUWONG S, ISONO N, JIANG H, et al. Freeze–thaw stability of starches from different botanical sources: Correlation with structural features[J]. Carbohydrate Polymers,2012,87(2):1275−1279. doi: 10.1016/j.carbpol.2011.09.004
[16] LI B, ZHANG Y, ZHANG Y, et al. A novel underutilized starch resource—Lucuma nervosa A. DC seed and fruit[J]. Food Hydrocolloids,2021,120:106934. doi: 10.1016/j.foodhyd.2021.106934
[17] ZHANG Y, HU M, ZHU K, et al. Functional properties and utilization of Artocarpus heterophyllus Lam
seed starch from new species in China[J]. International Journal of Biological Macromolecules,2018,107:1395−1405. doi: 10.1016/j.ijbiomac.2017.10.001 [18] MOORTHY S N, RAMANUJAM T. Variation in properties of starch in cassava varieties in relation to age of the crop[J]. Starch-Stärke,1986,38(2):58−61.
[19] MÉNDEZ P A, MÉNDEZ Á M, MARTÍNEZ L N, et al. Cassava and banana starch modified with maleic anhydride-poly (ethylene glycol) methyl ether (Ma-mPEG): A comparative study of their physicochemical properties as coatings[J]. International Journal of Biological Macromolecules,2022,205:1−14. doi: 10.1016/j.ijbiomac.2022.02.053
[20] TOAE R, SRIROTH K, ROJANARIDPICHED C, et al. Outstanding characteristics of Thai non-GM bred waxy cassava starches compared with normal cassava starch, waxy cereal starches and stabilized cassava starches[J]. Plants,2019,8(11):447. doi: 10.3390/plants8110447
[21] LI P, HE X, DHITAL S, et al. Structural and physicochemical properties of granular starches after treatment with debranching enzyme[J]. Carbohydrate Polymers,2017,169:351−356. doi: 10.1016/j.carbpol.2017.04.036
[22] CHISENGA S M, WORKNEH T S, BULTOSA G, et al. Progress in research and applications of cassava flour and starch: A review[J]. Journal of Food Science and Technology,2019,56(6):2799−2813. doi: 10.1007/s13197-019-03814-6
[23] ZHANG Y, ZHU K, HE S, et al. Characterizations of high purity starches isolated from five different jackfruit cultivars[J]. Food Hydrocolloids,2016,52:785−794. doi: 10.1016/j.foodhyd.2015.07.037
[24] QI Q, HONG Y, ZHANG Y, et al. Effect of cassava starch structure on scalding of dough and baking expansion ability[J]. Food Chemistry,2021,352:129350. doi: 10.1016/j.foodchem.2021.129350
[25] ZHU D, ZHANG H, GUO B, et al. Effects of nitrogen level on structure and physicochemical properties of rice starch[J]. Food Hydrocolloids,2017,63:525−532. doi: 10.1016/j.foodhyd.2016.09.042
[26] LOS F G B, CHEZINI A, PIROSKI C S, et al. Evaluation of physicochemical properties of starch from Brazilian Carioca beans
(Phaseolus vulgaris)[J]. Starch-Stärke,2022,74(1−2):2000281. [27] OYEYINKA S A, ADELOYE A A, OLAOMO O O, et al. Effect of fermentation time on physicochemical properties of starch extracted from cassava root[J]. Food Bioscience,2020,33:100485. doi: 10.1016/j.fbio.2019.100485
[28] FALADE K O, OKAFOR C A. Physicochemical properties of five cocoyam (Colocasia esculenta and Xanthosoma sagittifolium) starches[J]. Food Hydrocolloids,2013,30(1):173−181. doi: 10.1016/j.foodhyd.2012.05.006
[29] MACHADO C M, BENELLI P, TESSARO I C. Effect of acetylated starch on the development of peanut skin-cassava starch foams[J]. International Journal of Biological Macromolecules,2020,165:1706−1716. doi: 10.1016/j.ijbiomac.2020.10.048
[30] ROMANO A, MACKIE A, FARINA F, et al. Characterisation, in vitro digestibility and expected glycemic index of commercial starches as uncooked ingredients[J]. Journal of Food Science and Technology,2016,53(12):4126−4134. doi: 10.1007/s13197-016-2375-9
[31] LI G, ZHU F. Amylopectin molecular structure in relation to physicochemical properties of quinoa starch[J]. Carbohydrate Polymers,2017,164:396−402. doi: 10.1016/j.carbpol.2017.02.014
[32] HSIEH C F, LIU W, WHALEY J K, et al. Structure and functional properties of waxy starches[J]. Food Hydrocolloids,2019,94:238−254. doi: 10.1016/j.foodhyd.2019.03.026
[33] GRANZA A G, HORNUNG P S, ZIELINSKI A A F, et al. Gluten-free baked foods with extended shelf-life[J]. Journal of Food Science and Technology,2018,55(8):3035−3045. doi: 10.1007/s13197-018-3225-8
[34] LIU Y, XU B, AN F, et al. Physicochemical properties of cassava starch-konjac glucomannan composites[J]. Starch-Stärke,2021,73(7−8):2000186.
-
期刊类型引用(2)
1. 汤龙章,邱清华,刘婵娟,付戴波,欧阳克蕙,赵向辉. 一种瘤胃木聚糖酶的酶学特性分析及其对农作物秸秆的水解作用. 微生物学报. 2024(10): 3840-3852 .  百度学术
百度学术
2. 陈康太,杨思文,刁梦月,王宵宵,郭双,李恩中,李同彪. Loop结构引入半胱氨酸对木聚糖酶XynASP热稳定性的影响. 中国酿造. 2022(10): 106-112 .  百度学术
百度学术
其他类型引用(2)









 下载:
下载:
 下载:
下载:



