Research Progress on the Mechanisms of Decreasing Catalytic Activity of Lipase in the Production of Structured Lipids Synthesized by Enzymatic Method
-
摘要: 结构脂质是一类将具有特殊生理功能的脂肪酸结合到甘油三酯骨架上特定位置重新组合生成的新型脂质。酶法催化合成结构脂质具有反应条件温和,能耗低,分离纯化工艺简单,以及可以合成特定酰基位置上的功能性脂肪酸而受到重视。工业上随着酯酶使用次数的增加,酯酶催化活力显著下降,导致目标结构脂质产量降低。本文综述了近年来国内外关于酯酶催化合成结构脂质酯酶结构改变、活性变化和催化活性下降机理,酶活性下降主要是因为分子间强相互作用或弱相互作用破坏酶催化活性中心,本研究可为解决酶法合成结构脂质面临的酯酶活力降低的技术瓶颈提供参考。Abstract: Structured lipids are a new class of lipids recombined by combining fatty acids with special physiological functions at specific positions on the triglyceride backbone. Enzymatic catalyzed synthesis of structured lipids has attracted attention due to its mild reaction conditions, low energy consumption, simple separation and purification process, and the ability to synthesize functional fatty acids at specific acyl positions. However, with the increase of use times of lipases in industry, the catalytic activity of lipase decreases significantly, resulting in a decrease in the production of target structural lipids. This paper reviews the structure change, activity change and decreasing catalytic activity mechanisms of lipase-catalyzed synthesis of structured lipids in China and outside China in recent years. It found that the decrease of enzyme activity is mainly due to the destruction of the catalytic active center by strong or weak intermolecular interaction. This study provides a reference for solving the technical bottleneck of reducing lipase activity in the enzymatic synthesis of structured lipids.
-
结构脂质被称为未来油脂,其特点是将具有特殊生理功能的脂肪酸结合到甘油三酯中特定位置,重新组合生成新型脂质,这种脂质具有天然油脂的性质,在人体内消化、分解、释放的热量比一般油脂少,并可以最大限度地发挥各种脂肪酸的生理功能和营养价值,因此备受人们关注[1]。结构脂质为特定食用和营养目的而设计,是一种特殊的甘油三酯,可以将天然油脂甘油骨架上的脂肪酸如月桂酸、肉豆蔻酸、棕榈酸、硬脂酸等饱和脂肪酸,油酸、亚油酸、亚麻酸及DHA和EPA等不饱和脂肪酸按特定需要优化组合成天然油脂不存在的脂质分子,改善天然油脂的营养功能,满足不同消费群体的营养要求,扩大油脂的应用范围,也促进油脂学科的发展[2]。结构脂质在食品方面的应用包括人造奶油、起酥油等烘焙油脂方面,用于人乳替代脂,用于低能量油脂及脂肪替代物[3]。已经上市的结构脂质产品包括母乳脂肪替代物、可可脂替代物、中长链甘油三酯、甘油二酯、食用油、多不饱和脂肪酸浓缩物等[4]。
在结构脂质合成方面,酶法合成表现出产物特异性高、安全性好、反应条件温和、副产物少、对环境友好等优点,在实践中得到大量应用[5-6]。然而随着市场规模的扩大,酶法大规模合成结构脂质也暴露出较多问题,其中最主要的问题就是脂肪酶使用寿命短,酶活降低,严重影响工业化大规模生产[5]。近年来许多国内外学者在酶法催化机理上做了大量的工作,却忽略了催化活性降低的原因。因此本文概述了近年来脂肪酶合成结构脂质过程中,溶剂分子对脂肪酶结构的影响,分析其催化活性下降的机制,希望可以为油脂工业酶法合成结构脂肪过程中酯酶活性下降的技术难题提供理论依据。
1. 结构脂质的酶法合成
结构脂质的制备方法包括化学合成法和酶法合成法。酶法由于具有反应条件温和,能耗低,分离纯化工艺简单,以及可以合成特定酰基位置上的功能性脂肪酸等优点,酶法酯交换合成在结构脂质研究中应用越来越受到重视[6]。酶法合成克服了化学法的缺陷(化学法催化剂毒性大、反应温度高、反应随机性强、选择性差、后期分离纯化产物困难),通过特异性的固定化脂肪酶选择性地催化合成结构脂质,以满足不同领域的需求[7-8]。酶法催化合成结构脂质包括酸解反应、酯化反应、酯交换反应等[9-11]。结构脂质的合成反应体系成分复杂,产物中主要包括甘油三酯、甘油二酯、甘油一酯、游离脂肪酸和脂肪酸酯等,因此需要采用合适的技术方法来分离纯化,以期获得纯度较高的产品,结构脂的分离纯化中已逐渐得到应用[1]。
酶法合成具有催化专一性、立体结构专一性,可以根据需求对目标产品实现精确控制,设计出具有特定生理功能的定向结构脂质,这些特点使得酶法合成在结构脂质研究应用中引起了人们的广泛关注[12]。自2006年第一款酶法合成的类母乳结构1-3-二油酸-2-棕榈酸甘油三酯(O-P-O)产品问世以来,已相继有上千种酶法合成的结构脂质产品上市销售。然而,酯酶使用寿命短,生产成本高,且随着使用次数的增加,酯酶催化活力显著下降,最终失活,导致目标结构脂质产量降低,副产物增多,严重影响工业化大规模生产[13]。如何有效保持酯酶催化活力,是酶法合成结构脂质所面临的主要技术瓶颈。
为克服酯酶活性降低,目前国内外油脂工作者大量尝试利用响应曲面法[14-15]、单因素法[16-17]以及动力学模型[18]等研究各反应因素对酯酶活性的作用,试图建立各反应因素与酯酶活性的相关作用关系,寻找出酯酶活性最佳的反应条件。如Pacheco等[19]研究通过分析外界因素(如温度、底物摩尔比、酶剂量等)对葵花籽油与游离软脂酸酯化反应中各产物浓度变化,建立动力学方程,求解出酶催化过程中米氏常数Km和反应速率Vmax等参数,证实酶促酯交换反应遵循“Ping-Pong Bi-Bi”机制,得到最佳反应条件。然而,在最佳反应条件下只能短时间内提高目标结构脂质产量,随着反应进行,酶活下降,产量降低。因此,分析酶活的下降原因是关键。
2. 酶法合成结构脂质的催化机理研究
近年来,国内外学者利用X射线衍射、蛋白质结晶、圆二色谱、傅里叶红外光谱、紫外、荧光等方法,探索酶法酯交换反应过程中酯酶催化活性中心的微观结构,研究酯酶催化反应过程的性质,推测其催化机理。
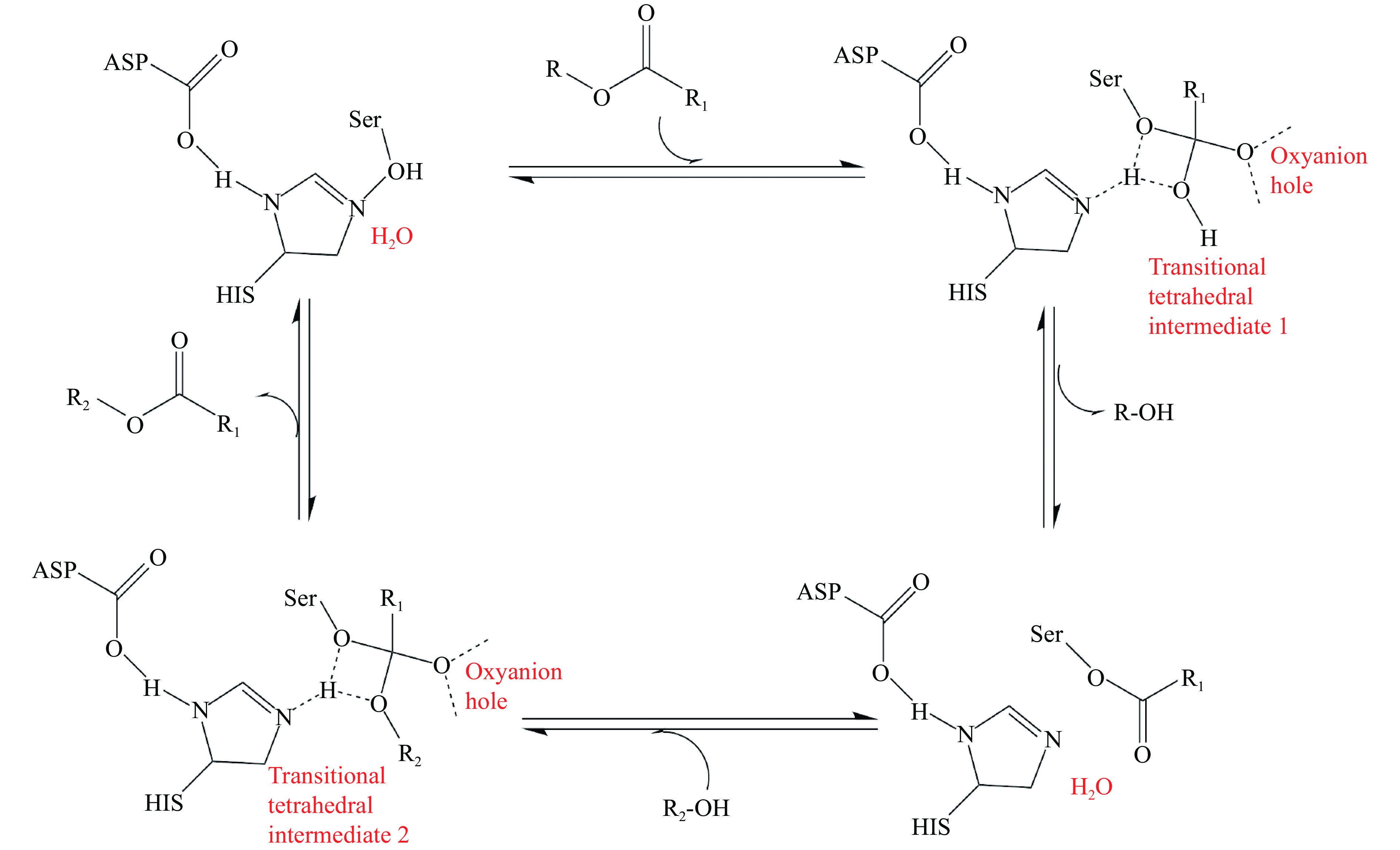
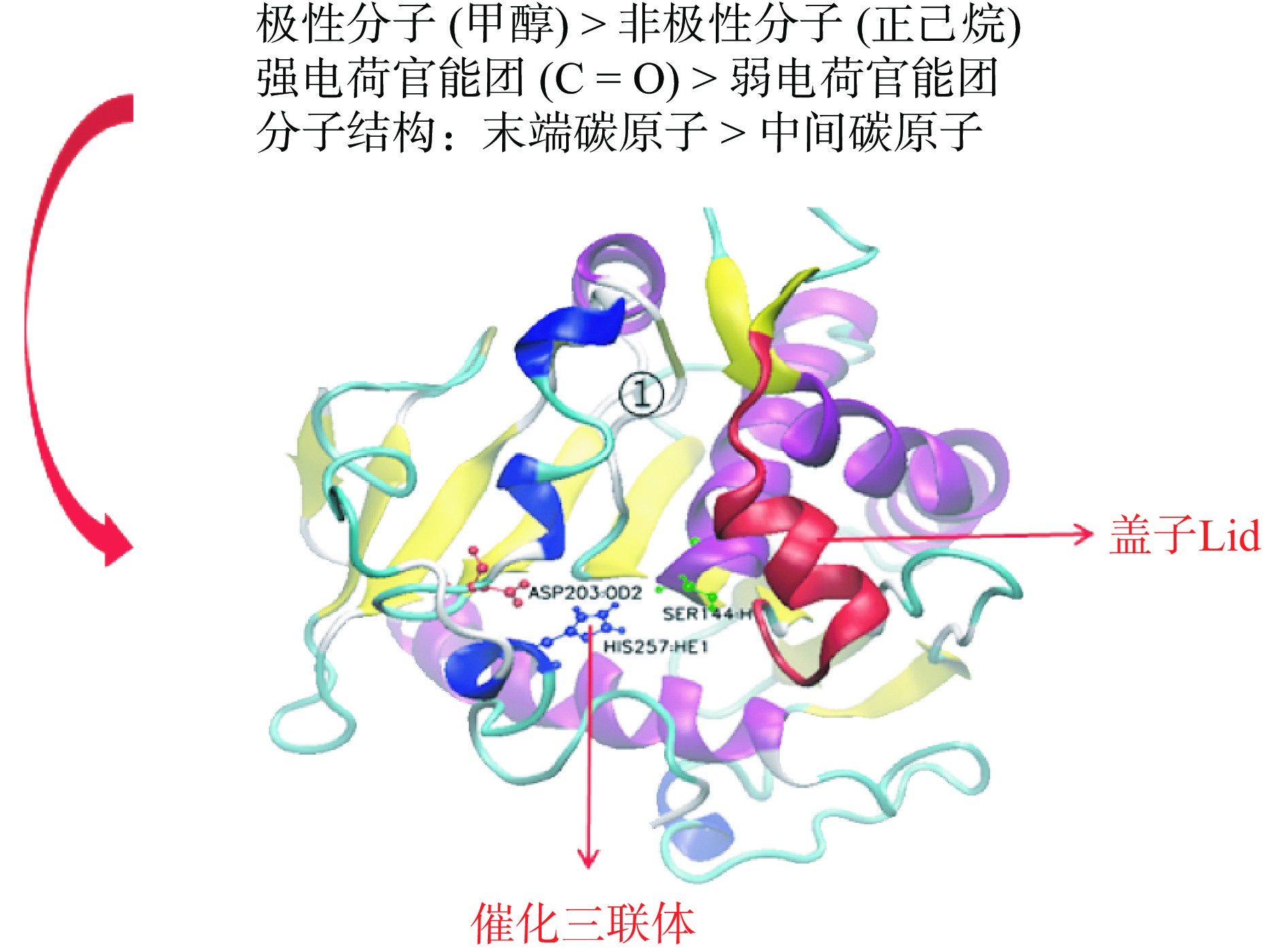
郭诤等[20]综述了脂肪酶催化中心的三重态结构,不同来源的脂肪酶催化中心具有相似或相同的特征区域his-x-y-gly-z-ser-w-gly或y-gly-his-ser-w-gly(w,x,y,z指非特异性氨基酸),脂肪酶氨基酸残基His、Ser和其他氨基酸残基(如Glu、Asp)构成脂肪酶催化活性中心的三重态。Joseph等[21]和Kokkinou等[22]也表明,酯酶催化活性中心是由丝氨酸、组氨酸、天冬氨酸(或谷氨酸)组成的三联体,三联体的稳定有利于催化反应的进行,同时这种三重态结构相当保守,任何氨基酸被修饰或替换,都会导致酯酶失活。孟枭[23]研究了脂肪酶对手性伯醇和手性伯酸的立体分子识别机理,发现洋葱假单胞菌脂肪酶Pseudomonas cepacia lipase (PCL)对不同伯醇酯底物的立体识别符合PCL-Tyr29-OH对手性伯醇通过Oγalc (alc:alcohol moiety)底物氢键识别的定量机理;对米霉Rhizomucor miehei lipase (RML)手性酸酯底物的立体识别表明,环β1-β2-asp61在RML表面上,Arg61-λ2的静电作用极大地限制了酶分子适应不同底物的灵活性,从而实现了手性酸的立体识别。X射线衍射晶体学表明[24-25],酯酶催化过程具有特殊的油-水催化界面现象。当酯酶处于非活性状态时,酯酶三重态的活性中心隐藏在V形结构中,形成由亲水基团组成的“氧阴离子孔”亲电区,其表面被疏水氨基酸残基形成的α-螺旋结构盖覆盖。当酯酶与油水界面接触时,催化活性位点上“盖子Lid”打开,活性中心暴露,酶被激活。Ghanem[26]通过大量实验研究推测,在酯酶与底物结合的过程中,三重态结构中亲核丝氨酸残基上的羟基氧原子攻击甘油三酯键上的羰基碳,形成四面体过渡中间体I,导致酯键断裂,甘油三酯的醇基部分解离,剩余的脂肪酸部分与亲核丝氨酸生成酰化酯酶复合物有关,然后酰化酯酶复合物与H2O结合形成另一个四面体中间体II,该中间体解离生成产物并释放酶以完成催化过程,催化机理如图1所示。
目前,酶法酯交换反应机理的研究主要集中在从酯酶微观结构的变化揭示酶法酯交换反应的可能过程,酯酶催化的关键是酯酶催化前后的构象变化,以及过渡态中间体的形成和解离。仅通过实验手段观察脂肪酶的微观结构变化无法彻底解释酶促反应的机理,近年来随着计算机模拟计算技术(分子动力学模拟MM及量子化学QM)的发展,从原子水平上研究酶催化机制变得越来越容易。有结果表明,酶催化分子模拟能够准确模拟酶催化过程中酶的构象变化和原子间的相互作用,可以准确模拟酶催化过程中各原子的瞬间运动轨迹及其能量变化参数,准确模拟酶催化反应过渡态四面中间体(Transitional tetrahedral intermediate)的形成和解离[27]。Świderek等[28]应用QM/MM理论对L-乳酸脱氢酶催化反应机理进行了研究,结果表明,H-的转移是丙酮酸盐转化为L-乳酸盐反应的限速步骤,反应能垒为168.37 kJ/mol,底物与L-乳酸脱氢酶的活性中心之间存在着较强的静电作用,形成准船式构象的过渡态中间体。伴随着过渡态中间体的形成,底物上羰基的极性逐渐增强,有利于H-的转移,进而发生催化反应。Chen等[29]结合MM及QM测定了铜锌超氧化物歧化酶催化歧化超氧阴离子自由基的反应的基态底物、过渡态中间体及终产物的结构构型,探讨催化反应中各因素对O2-进攻酶活性中心Cu2+形成过渡态中间体复合物的影响,观察反应过程中的能量变化,进而阐明其催化机制。
3. 酯酶催化活性下降的影响因素
3.1 有机溶剂
有机溶剂脂溶性分配系数Partition coefficient(Log P)、极性、官能团和溶剂分子结构等关键因素决定了酯酶分子周围的微环境,影响酯酶的三级和二级结构,进而影响酯酶催化活性。
近年来研究有机溶剂对酯酶结构的影响,进而导致酶催化活性降低的报道,如表1所示。Yang等[30]报道南极假丝酵母脂肪酶A(Candida antarctica lipase A, CALA)在极性有机试剂中活性降低主要是因为水分子与蛋白质表面之间氢键丢失,增加酯酶β-折叠含量,降低α-螺旋含量,从而导致反应后期的酯酶结构更不稳定。Sadaf等[31]发现丁醇和乙醇导致Penicillium chrysogenum lipase脂肪酶三级结构发生变化,并伴随红移,酯酶蛋白极性增强。Li等[32]揭示甲醇、丙酮、四氢呋喃等极性溶剂通过氢键与活性中心相互作用,从而破坏南极假丝酵母脂肪酶B(Candida antarctica lipase B, CALB)催化活性中心,活性降低,在正己烷(log P值高)等无极性有机溶剂中能维持催化活性。必需水的损失有时是酶失活的一个可能原因。在有机溶剂中,极性有机分子取代水,侵入脂肪酶的活性位点,导致脂肪酶结构的破坏和催化活性的降低[32]。Dachuri等[33]发现酯酶Proteus mirabilis和Pseudomonas mandelii在二甲基亚砜(DMSO)、甲醇和乙醇中,官能团电荷干扰表面氨基酸排列,影响结构稳定进而导致活性降低。Jiang等[34]、Haque等[35]观察到酯酶的活性与催化位点的“盖子”结构有关,“盖子”的开闭状态直接影响到酯酶活性,动力学检测在辛醇中酯酶“盖子”打开的速率比在水中快。Secundo等[36]报道酯酶活性在有机溶剂中降低可能是由于嵌合体酶具有较低比例的开放形式的酶分子,阻碍底物和酶活性位点的接触。
表 1 有机溶剂对脂肪酶结构的影响及催化活性降低相关机制Table 1. The effects of organic solvents on the structure of lipase and the related mechanism of catalytic activity reduction脂肪酶 有机试剂 方法 结构变化 活性变化 机制 参考文献 Candida antarctica
lipase A乙腈、丙酮、
乙醇、乙酯,
正庚烷傅里叶红外
光谱用乙腈或丙酮处理CALA,α-螺旋含量增加,无规线圈含量减少。然而,当用乙酯处理时,发现α-螺旋含量减少,β-折叠含量增加 α-螺旋含量的降低可能会
影响CALA的活性位点,
从而对其活性产生
重要影响β-折叠物含量的增加可归因于水分子与蛋白质表面之间氢键相互作用的丧失,从而导致处理后的CALA具有更不稳定的结构 Yang等[30] Penicillium chrysogenum lipase 极性和非极性有机溶剂 圆二色性和
本征荧光光谱天然脂肪酶由一个主要的α-螺旋结构组成,该结构在极性和非极性溶剂中均保持不变,丁酸乙酯除外,丁酸乙酯的
活性降低,结构被破坏在己烷存在下(log P=3.5),螺旋含量增加(~85% α-螺旋),表明脂肪酶的
结构稳定性增强在二氯甲烷存在下观察到显著的荧光猝灭,可能是由于表面色氨酸残基埋藏在蛋白的疏水核心中。丁醇和乙醇导致脂肪酶三级结构发生显著变化,并伴随红移 Sadaf等[31] Candida antarctica
lipase B非极性溶剂如氯仿、环戊烷、己烷;极性溶剂如甲醇、丙酮、四氢呋喃 分子动力学
模拟和量子
力学模拟在有机溶剂中,CALB的整体构象是稳定的。在非极性溶剂中,活性中心的构象保持
稳定氯仿、环戊烷、己烷等非极性溶剂保持活性中心的稳定性,而在极性溶剂中,溶剂分子进入活性中心并与活性中心发生强烈的相互作用 甲醇、丙酮、四氢呋喃等极性溶剂通过氢键与活性中心相互作用,从而破坏活性中心。活性位点区域的构象变化是影响CALB活性的主要因素 Li等[32] PML (Proteus mirabilis) and
Lip S (Pseudomonas mandelii)极性溶剂如二甲基亚砜、甲醇和乙醇 荧光光谱 在PML和Lip S之间,最大酶活性所需的构象灵活性不同,表明PML和Lip S在每种有机溶剂中的构象可获得最大酶活性 极性有机溶剂如DMSO甲醇和乙醇,会导致PML和Lip S的构象变化,从而增加构象灵活性;由于有机溶剂中构象的灵活性增加,PML和Lip S的结构变得不稳定 PML和Lip S的构象变化是由于表面不同氨基酸排列不同,在DMSO存在下构象相似,但在甲醇和乙醇中构象不同 Dachuri等[33] Y. lipolytica lipase 甲醇和己烷 分子动力学
模拟脂肪酶在甲醇中的构象
变化较大Ser274-Asn288和Thr106-His126等区域与lid区域相互作用 Y. lipolytica脂肪酶的闭合机制是在甲醇中的“盖子”运动 Jiang等[34] Double mutant porcine pancreatic lipase 乙醇、甲苯、
辛醇分子动力学
模拟Asp250Val和Glu254Leu突变体在较高温度下表现出“盖子”打开 Asp250Val和Glu254Leu在保持“盖子”处于闭合状态中的重要作用 在辛醇中酯酶“盖子”打开的动力学比在水中快,非极性溶剂有利于“盖子”的开放构造 Haque等[35] chimeric C. rugosa LIP1/lid3 氯乙基-2-羟基己酸酯、甲醇、醋酸乙烯酯与6-甲基-5-庚烯-2-醇 醇解反应 与野生型相比,嵌合C. rugosa LIP1/lid3的活性和对映选择性更低 在有机溶剂中,与野生型相比,嵌合体C. rugosa LIP1/lid3对氯乙基-2-羟基己酸酯与甲醇的醇解反应和醋酸乙烯酯与6-甲基-5-庚烯-2-醇的醇解反应的活性和对映选择性都较低 活性的降低可能是由于嵌合体酶具有较低比例的开放形式的酶分子,阻碍了对酶活性位点的接触 Secundo等[36] Burkholderia cepacia lipase (BCL) 叔戊醇、叔丁醇、石油醚、正己烷和异辛烷 傅里叶红外
光谱,CD在选择性有机溶剂和RTIL中,BCL的二级结构发生了一些改变 BCLα螺旋含量的降低可能
影响脂肪酶活性位点α-螺旋含量越低,活性位点的“开放”构象越高,从而更容易接近底物 Liu等[37] Geobacillus zalihae T1 lipase 甲醇、乙醇、丙醇、丁醇和戊醇)和水的混合物 分子动力学
模拟骨架原子结构偏差阐明水/有机溶剂混合物在降低溶剂极性时对蛋白质平衡状态的动态影响 有机溶剂Mt-OH、Et-OH和Pr-OH中形成更多氢键,蛋白质内氢键的增加最终与蛋白质的稳定性相关 在有机溶剂体系中,活性口袋四面体中间填料的距离变化不守恒,这可能导致催化氢键网络的弱点,很可能导致催化活性下降 Maiangwa等[38] 综上,酯酶在有机溶剂中催化活性降低与催化活性中心结构的改变有关,而催化活性中心结构的改变与有机溶剂极性、电荷官能团、分子结构息息相关(图2)。极性有机分子侵入到酯酶催化活性位点,拉开催化活性氨基酸的距离,同时阻碍底物和酯酶之间的接触,进而无法形成过渡态四面中间体,导致活性降低;酯酶在非极性有机分子中表现更高的催化活性和催化稳定性,不易失活。脂肪酶在极性、强电荷官能团有机溶剂中更容易导致活性降低。
3.2 离子液体
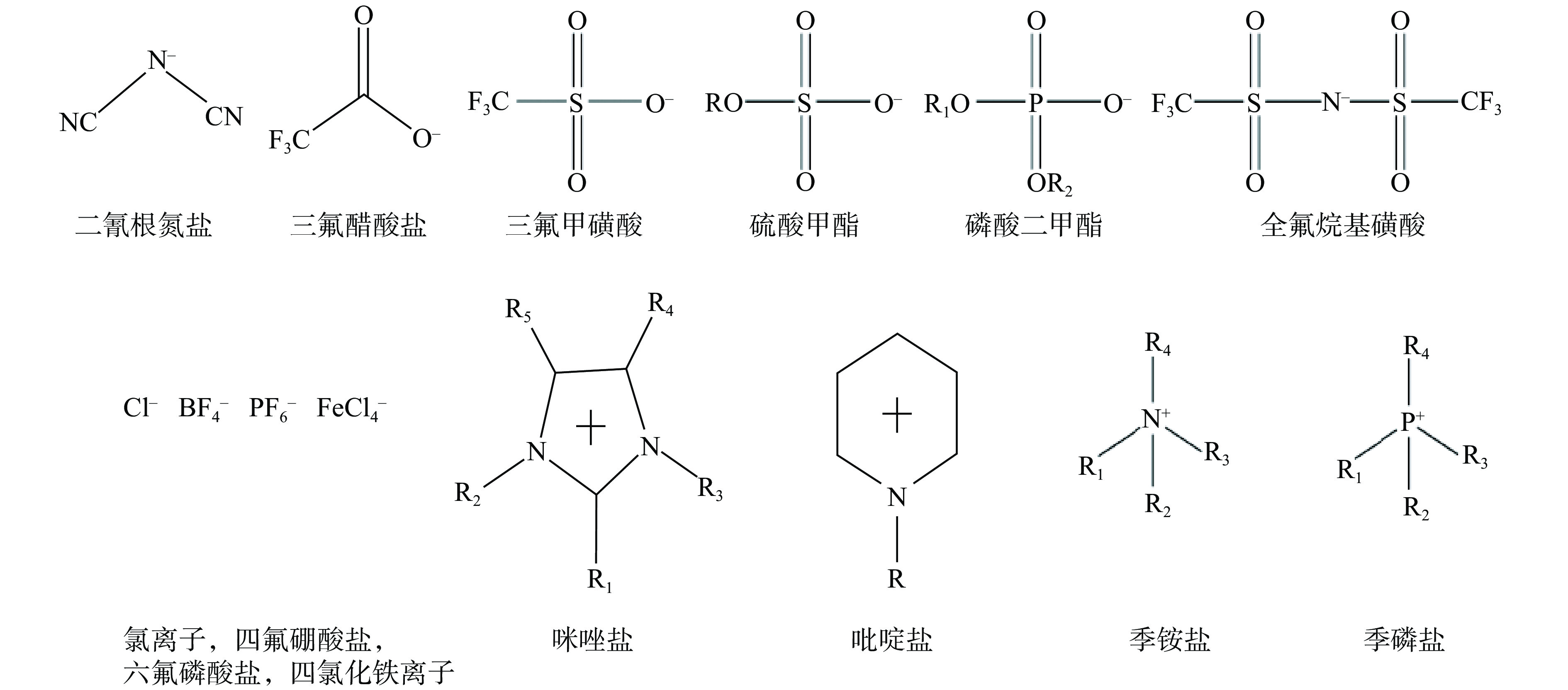
离子液体(Ionic liquids,ILs),是指由特定的有机阳离子与无机或有机阴离子构成的,在室温或近室温下呈液态的熔盐体系。与有机溶剂相比,离子液体体系可以提高脂肪酶的活性、稳定性和选择性,保护脂肪酶的二级结构[33]。但是,脂肪酶的活性、稳定性和二级结构也可能受到离子液体性质的影响,如疏水性、阳离子和阴离子类型、极性和粘度等。离子液体具有低饱和蒸汽压、不易燃、疏水性和可设计性等特殊性质,作为一种新型溶剂,它们广泛应用于酶催化反应中。常见的阴阳离子液体如图3所示[39]。
近年来研究离子液体对酯酶结构的影响,进而导致酶催化活性降低的报道,如表2所示。Liu等[37]发现离子液体中阴离子选择对酯交换活性的影响远大于阳离子选择,且室温离子液体二级结构的改变是导致其催化活性降低的直接原因。Lau等[40]观察到分子大、空间要求高的离子不容易穿透酶蛋白质基质,需要许多分子间氢键的解离来产生部分新的氢键,维持酶活性。Dabirmanesh等[41]报道随着离子液体浓度的变化,酶Bacillus amyloliquefaciens和酶Bacillus lichiniformis的催化活性和稳定性都会降低。Pavlidis等[43]研究形成强氢键的离子液体,尤其是阴离子,可能会解离维持α-螺旋和β-折叠结构完整性的氢键,蛋白质全部或部分展开,导致酯酶活性降低。在离子液体[BMIM][dca]中,CALB的交联酶聚集体的催化活性是在叔丁醇离子液体中的两倍,而游离型酯酶在叔丁醇离子液体中不可逆地失活,原因是叔丁醇离子液体中形成强氢键的离子液体,阴离子液体发挥关键作用,解离酯酶维持α螺旋和β-折叠结构完整性的氢键[43]。Qin等[45]实验研究表明,脂肪酶结构与离子液体性质之间存在相关性,表明随着在离子液体中浸泡时间的增加,Novozym 435的α-螺旋含量减少,β-折叠含量增加。
表 2 离子液体对脂肪酶结构的影响及催化活性降低相关机制Table 2. The effects of ionic liquids on the structure of lipase and the related mechanism of catalytic activity reduction脂肪酶 离子液体 方法 结构变化 活性变化 机制 参考文献 Burkholderia cepacia lipase (BCL) [OMIM][Cl],[EMIM][TfO],[BMIM][Cl],[OMIM][BF4],
[BMIM][CH3SO3],
[EMIM][Cl],[NMP][CH3SO3],
[HMIM][TfO],
[HMIM][CH3SO3],
[BMIM][PF6],
[BMIM][OH],[EMIM][PF6], [HMIM][Cl],[BMIM][Tf2N],
[BMIM][BF4],[OMIM][PF6],
[EMIM][BF4],[HMIM][PF6] and [OmPy][BF4]傅立叶红外
光谱室温离子液体中的BCL二级结构发生部分改变 阴离子对酯交换活性的影响远大于阳离子 [EMIM][Tf2N]会压缩酶RTIL的天然结构,从而阻止其展开 Liu等[37] Candida antarctica
lipase B[BMIM][NO3],[BMIM][lactate],
[EMIM][Et SO4]
and [Et NH3][NO3]傅立叶红外
光谱结构相似的离子液体对酶的行为有很大不同 分子大、空间要求高的离子不容易穿透蛋白质基质,需要许多分子间氢键解离来产生一些新的氢键,维持活性 分子大、空间要求高的离子不容易穿透蛋白质基质,需要许多分子间氢键的解离来产生部分新的氢键,维持酶活性 Lau等[40] Bacillus amyloliquefaciens and Bacillus lichiniformis [BMIM][Cl],[HMIM][Cl] 差示扫描量热法和荧光 与中温酶相比,嗜热酶更稳定 随着离子液体浓度的变化,酶的活性和稳定性都会降低 根据解淀粉芽孢杆菌和地衣芽孢杆菌热展开过程中获得的热谱图,[HMIM][Cl]的抗聚集能力强 Dabirmanesh等[41] Rhizopus oryzae NRRL 3562 1-Hexadecyl-3-methylimidazolium bromide ((C16 MIM)Br) 紫外可见光谱和圆二色谱 在低表面活性剂浓度下,导致β-折叠物含量增加和α-螺旋降低的结构变化 高浓度下的失活与光谱所描述的更大结构变化相关。等温滴定量热研究表明,这种结合在本质上是自发的,涉及非共价相互作用 高的熵负值表示疏水域的暴露和结构刚性的增加,与表面活性剂存在时活性位点更易接近和刚性相关 Adak等[42] Candida rugosa, Chromobacterium viscosum and Thermomyces lanuginosa Water-in-ionic liquid (W/IL) microemulsions/1-butyl-3-methylimidazolium hexafluorophosphate ([BMIM]PF6) 傅立叶红外光谱和圆二色谱 与迄今为止用于各种生物催化反应的其他微多相介质相比,在新体系中,来自C. rugosa、C. viscosum和T. lanuginosa的脂肪酶表现出更高的催化性能和操作稳定性 与传统有机溶剂相比,W/IL微乳液中酶的稳定性增强,易于从反应体系中分离产物,酶的可重复使用性好,以及离子液体独特的溶剂性质 将酶分子包埋在W/IL微乳液中形成的水微滴中,表明基于IL的反应系统为酶提供保护环境 Pavlidis等[43] Candida antarctica
lipase Btert-Butyl alcohol,[BMIM][BF4],
[BMIM][PF6],
[BMIM][lactate],
[BMIM][NO3],
[Et3Me N][Me SO4]傅立叶红外光谱 BMIM[dca]中α-螺旋和β-折叠含量的损失 在含有二氰酰亚胺、烷基硫酸盐、硝酸盐和乳酸阴离子的离子液体中溶解CALB,反应至少比[BMIM][BF4]慢十倍。[Et3Me N][Me SO4]是例外,溶解的CALB在该溶剂中保持其活性 在[BMIM][dca]中,CALB的交联酶聚集体的活性是叔丁醇中的两倍,而游离酶在叔丁醇离子液体中不可逆地失活。形成强氢键的离子液体,尤其是阴离子,可能会解离维持α-螺旋和β-折叠结构完整性的氢键,导致蛋白质全部或部分展开 Pavlidis等[43] Candida antarctica
lipase Bwater-immiscible ionic liquids (ILs),1-ethyl-3-methylimidizolium bis
(trifluoromethylsulfonyl)-
imide and butyltrimethylammonium bis(trifluoromethylsulfonyl)imide圆二色谱和荧光光谱 在50 °C的水和己烷培养基中培养4 d后,CALB的剩余活性损失超过75%,这与α-螺旋和-链二级结构的巨大变化有关 在所研究的两个ILs中观察到的CALB的稳定与维持50%的初始α-螺旋含量和增强-链有关。此外,内在荧光研究清楚地表明,在水和己烷介质中,经典酶的去折叠是如何随时间发生 酶在两种ILs中的培养相关的结构变化可能归因于紧凑而活跃的酶构象,从而提高在非水环境中的稳定性 De等[44] Candida antarctica (Novozyme 435) [BMIM][BF4],[HMIM][BF4],[OMIM][BF4],[BMIM][PF6],[HMIM][PF6],[OMIM][PF6],[EMIM][Tf2N],[BMIM][Tf2N],[HMIM][Tf2N],
[OMIM][Tf2N],
[BMMIM][Tf2N],
[HMMIM][Tf2N],
[OMMIM][Tf2N],[BMIM][N(CN)2],[HMIM][N(CN)2],[BMIM][OAc]傅立叶红外
光谱随着浸泡时间增加,α-螺旋含量降低,β-折叠含量增加 酶435在[BF4]、[PF6]和[TF2N]基离子液体中浸泡24 h后,保留约5%、40%
和100%的空白样品活性,揭示离子液体性质的初始酶活性与疏水性(log P)、极性(Et)、氢键碱性(B)和粘度有关。初始酶活性随log P值增加而增加,随ENT值降低而降低初始酶活性在较窄的范围内(0.24~0.26)随b值的增加而增加,然后随b值的增加而持续下降。对于基于[Tf2N]的离子液体,初始酶活性随粘度增加而增加,而在基于[BF4]
和[PF6]的离子液体中发现了不利关系。诺维信435α-螺旋含量的降低可能会影响脂肪酶活性位点。α-螺旋含量越低,底物越容易接近脂肪酶的活性部位Qin等[45] Candida antarctica lipase B (CALB) [HOOCMMIM][Cl],
[HOOCEMIM][Cl],
[HOOCBMIM][Cl],
[HOOCBMIM][H2PO4],
[HOOCMMIM][PF6]傅立叶红外光谱,圆二色谱和衰减总反射FTIR 与天然酶相比,所有修饰酶的α-螺旋含量均较高 改性在水相中获得更高的活性和催化效率,而含有更多潮向阳离子的ILs改性导致了更高的改性程度和活性 修饰增强脂肪酶的稳定性,尤其是带有疏水性阳离子的离子液体,而接枝到脂肪酶上的疏水性阴离子有助于提高脂肪酶的热稳定性和对有机溶剂的耐受性 Ru等[46] Aspergillus niger lipase [C4MIM]Cl,[C6MIM]Cl,[C8MIM]Cl,[C10MIM]Cl
and [C12MIM]Cl荧光和圆二色光谱 在0.3%(v/v)的[C10MIM]Cl和[C12MIM]Cl水溶液中暴露脂肪酶,不受IL浓度的影响,会导致脂肪酶二级结构发生变化,表明其椭圆度降低 [CnMIM]基于Cl的ILs可以对脂肪酶的活性(增强、维持甚至抑制)和结构构象施加不同的行为,取决于阳离子烷基链长度及其相对浓度 具有自聚集特性的ILs引起蛋白质结构的不可逆变化,导致蛋白质展开 Nascimento
等[47]总之,酯酶在离子液体中催化后期活性降低与维持,取决于离子液体与酯酶蛋白之间相互作用形成的氢键的解离与否。无机或有机阴离子由于静电相互作用,诱导酶蛋白二级结构发生改变,在催化过程中扮演着重要角色。
3.3 超临界二氧化碳流体
不同类型的酶,如脂肪酶、磷酸酶、脱氢酶、氧化酶、淀粉酶等,适合在SC-CO2中进行反应[48]。在高压下暴露于二氧化碳中的酶的稳定性和活性取决于酶的种类、溶液中的水含量以及反应系统的压力、温度、时间和流速[49]。脂肪酶的三维结构在极端条件下可能发生显著变化,导致其变性并随之失去活性。如果条件适宜,酶蛋白原始晶体结构可能会很大程度上保留下来。但微小的结构变化仍可能会导致酶活性、特异性和稳定性发生改变,转换成另一种活性蛋白状态。
近年来研究SC-CO2对酯酶结构的影响,进而导致酶催化活性降低的报道,如表3所示。Habulin等[50]阐述超临界二氧化碳SC-CO2分子和酶Pseudomonas fluorescens,Rhizopus javanicus,Rhizopus niveus,porcine pancreas and Candida rugosa之间发生相互作用,发现SC-CO2插入到酶和水分子之间,导致酯酶催化活性降低。Chen等[51]发现在大多数高压处理中,脂肪酶活性显著增强取决于α-螺旋含量改变。Aucoin等[52]研究发现Lipozyme IM20在重复暴露于SC-CO2和低降压率后表现出最佳的活性。Melgosa等[53]报道SC-CO2处理可以通过构象变化和结构改变来影响酶的活性,高温和强压力以及长暴露时间导致活性损失。
表 3 超临界二氧化碳对脂肪酶结构的影响及催化活性降低相关机制Table 3. The effect of supercritical carbon dioxide on the structure of lipase and the related mechanism of catalytic activity reduction脂肪酶 超临界流体 条件/方法 结构变化 活性变化 机制 参考文献 Pseudomonas fluorescens,Rhizopus javanicus,Rhizopus niveus,porcine pancreas and Candida rugosa 超临界二氧化碳
(SC-CO2)100 bar,40 oC 后期结构稳定性降低 活性下降 SC-CO2分子和酶之间的相互作用;SC-CO2插入到酶和水分子之间 Habulin[50] Candida rugosa lipase(CRL) 亚临界或超临界
二氧化碳傅立叶变换红外光谱和荧光发射光谱 α-螺旋含量改变 在大多数高压处理中,脂肪酶活性显著增强 超临界流体对其酶刚性结构的保护 Chen[51] Lipozyme IM20 SC-CO2,加压/减压循环、减压速率和暴露 酶催化活性 - Lipozyme IM20在重复暴露于SC-CO2和低降压率后表现出最佳活性 提取固定化基质中的抑制成分 Aucoin[52] Palatase 20000 L,Lipozyme CALB L,Lipozyme RM IM and Lipozyme 435 SC-CO2 荧光发射光谱,扫描电子显微照片,红外光谱 蛋白结构发生改变,
形态改变高温度和强压力以及最长的暴露时间导致活性损失 SC-CO2处理可以通过构象变化和结构改变来影响酶的活性 Melgosa[53] 综上所述,酯酶在超临界二氧化碳表现出更佳的结构稳定性,主要取决于超临界流体分子对酯酶结构的保护。反应后期酶活性降低主要是因为超临界二氧化碳高温和强压下引起二级结构变化,SC-CO2分子插入到酶和结晶水分子之间,酶无法通过催化活性三联体和底物形成过渡态四面中间体,导致酯酶催化活性降低。
3.4 微水相
由于脂肪酶油水界面的催化性质,少量的水有利于酶催化反应的进行。一方面,水分子参与酶天然构象中所有的非共价键间的相互作用,包括氢键、静电作用、疏水相互作用和范德华力。另一方面,反应体系中存在着少量的水时可以增加酶的水化程度,在结构上增加酶的柔韧性,提高酶活[54]。一定量的水分子有利于催化过渡态四面中间体的形成,维持“氧负离子洞Oxyanion hole”,促进反应[54]。如Jamir和 Seshagirrao[55]发现微水相中有序二级结构有助于稳定热变性酶的构象。但是,微水相中,脂肪酶与溶剂分子相互作用后,酶蛋白二级结构和氢键的改变可能导致其催化水解活性和结构稳定性发生变化。如洋葱伯克霍尔德菌脂肪酶在水相中放置2 h后,结构稳定性改变,显示出明显的有序二级结构(α-螺旋到β-折叠)降低,导致在表面活性剂叶黄素AT50和二羧酸存在下酯酶催化活性显著下降[56]。脂肪酶二级结构中α-螺旋结构域通常位于酶的表面,对环境因素敏感,易在微水相体系中被破坏;β-折叠结构域往往位于酶的内部,与外界环境因素的接触较少,因此,β-折叠结构域比α-螺旋结构域更具保守性。在微量水相中,脂肪酶的有序二级结构的减少可能引起脂肪酶的逐渐失活。
4. 总结及展望
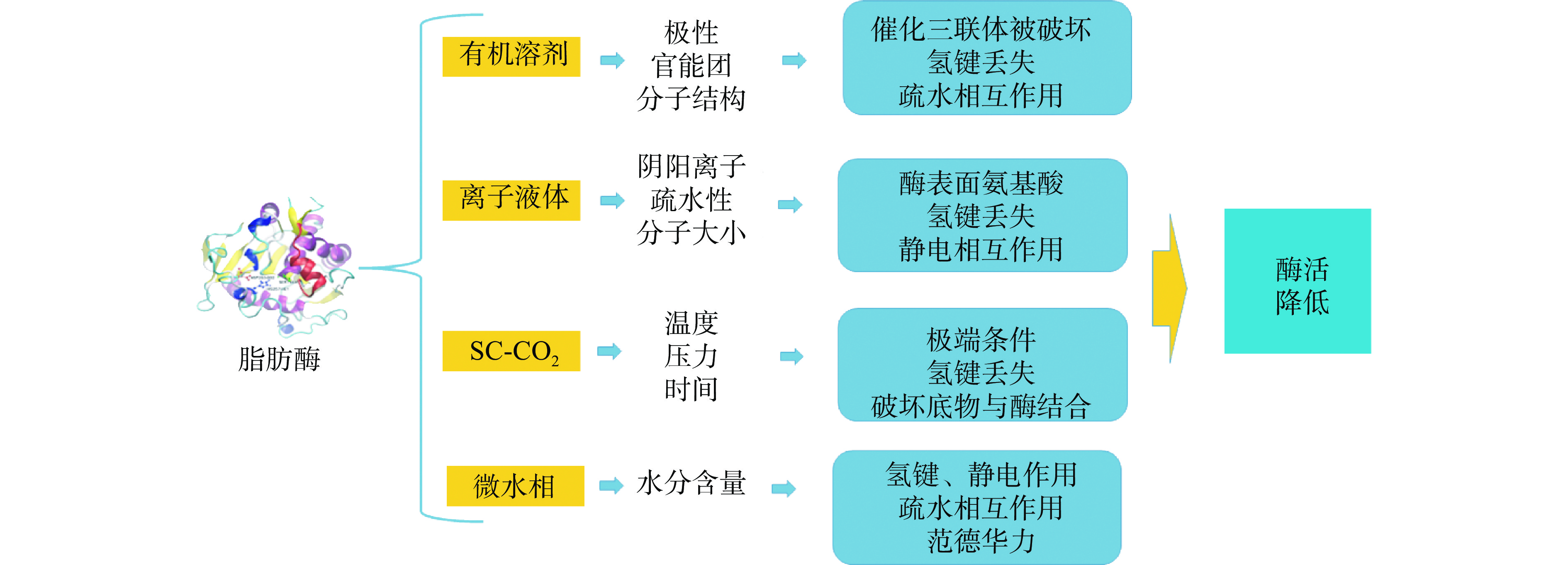
脂肪酶在催化过程中其结构稳定性极易受外界环境因素(反应溶剂、反应时间、反应温度、反应压力、水分含量、底物分子)的影响,外界环境因素主要通过强相互作用或弱相互作用(静电相互作用、氢键、疏水相互作用或范德华力)破坏酶催化活性关键位点,无法形成过渡态四面中间体,导致催化效能降低,最终引起酶活下降(图4)。
然而,外界环境因素形成关键作用力破坏酶与底物形成过渡态中间体;外界环境因素作用酯酶的结构影响产物过渡态中间体形成;外界环境因素通过影响酯酶活性中心构象改变及“氧负离子洞”亲电区电子环境变化,从而导致酯酶的催化活性下降。这些关于酶促酯交换合成结构脂质中外界环境因素和酯酶蛋白作用导致催化活性下降深层次的问题还有待进一步研究。
为了增强酯酶合成结构脂质的催化稳定性,解决酶法合成结构脂质面临的酯酶活力降低的技术瓶颈,未来可通过基因编辑、蛋白质工程、化学修饰、设计两相反应体系、固定化技术和稳定剂介质工程等方法,修饰酯酶催化活性中心不稳定氨基酸残基结构来提高酯酶结构稳定,防止酶活下降,保持酶的长期高效利用,将在一定程度上降低成本,推动酶法合成结构脂肪的工业化进程。
-
表 1 有机溶剂对脂肪酶结构的影响及催化活性降低相关机制
Table 1 The effects of organic solvents on the structure of lipase and the related mechanism of catalytic activity reduction
脂肪酶 有机试剂 方法 结构变化 活性变化 机制 参考文献 Candida antarctica
lipase A乙腈、丙酮、
乙醇、乙酯,
正庚烷傅里叶红外
光谱用乙腈或丙酮处理CALA,α-螺旋含量增加,无规线圈含量减少。然而,当用乙酯处理时,发现α-螺旋含量减少,β-折叠含量增加 α-螺旋含量的降低可能会
影响CALA的活性位点,
从而对其活性产生
重要影响β-折叠物含量的增加可归因于水分子与蛋白质表面之间氢键相互作用的丧失,从而导致处理后的CALA具有更不稳定的结构 Yang等[30] Penicillium chrysogenum lipase 极性和非极性有机溶剂 圆二色性和
本征荧光光谱天然脂肪酶由一个主要的α-螺旋结构组成,该结构在极性和非极性溶剂中均保持不变,丁酸乙酯除外,丁酸乙酯的
活性降低,结构被破坏在己烷存在下(log P=3.5),螺旋含量增加(~85% α-螺旋),表明脂肪酶的
结构稳定性增强在二氯甲烷存在下观察到显著的荧光猝灭,可能是由于表面色氨酸残基埋藏在蛋白的疏水核心中。丁醇和乙醇导致脂肪酶三级结构发生显著变化,并伴随红移 Sadaf等[31] Candida antarctica
lipase B非极性溶剂如氯仿、环戊烷、己烷;极性溶剂如甲醇、丙酮、四氢呋喃 分子动力学
模拟和量子
力学模拟在有机溶剂中,CALB的整体构象是稳定的。在非极性溶剂中,活性中心的构象保持
稳定氯仿、环戊烷、己烷等非极性溶剂保持活性中心的稳定性,而在极性溶剂中,溶剂分子进入活性中心并与活性中心发生强烈的相互作用 甲醇、丙酮、四氢呋喃等极性溶剂通过氢键与活性中心相互作用,从而破坏活性中心。活性位点区域的构象变化是影响CALB活性的主要因素 Li等[32] PML (Proteus mirabilis) and
Lip S (Pseudomonas mandelii)极性溶剂如二甲基亚砜、甲醇和乙醇 荧光光谱 在PML和Lip S之间,最大酶活性所需的构象灵活性不同,表明PML和Lip S在每种有机溶剂中的构象可获得最大酶活性 极性有机溶剂如DMSO甲醇和乙醇,会导致PML和Lip S的构象变化,从而增加构象灵活性;由于有机溶剂中构象的灵活性增加,PML和Lip S的结构变得不稳定 PML和Lip S的构象变化是由于表面不同氨基酸排列不同,在DMSO存在下构象相似,但在甲醇和乙醇中构象不同 Dachuri等[33] Y. lipolytica lipase 甲醇和己烷 分子动力学
模拟脂肪酶在甲醇中的构象
变化较大Ser274-Asn288和Thr106-His126等区域与lid区域相互作用 Y. lipolytica脂肪酶的闭合机制是在甲醇中的“盖子”运动 Jiang等[34] Double mutant porcine pancreatic lipase 乙醇、甲苯、
辛醇分子动力学
模拟Asp250Val和Glu254Leu突变体在较高温度下表现出“盖子”打开 Asp250Val和Glu254Leu在保持“盖子”处于闭合状态中的重要作用 在辛醇中酯酶“盖子”打开的动力学比在水中快,非极性溶剂有利于“盖子”的开放构造 Haque等[35] chimeric C. rugosa LIP1/lid3 氯乙基-2-羟基己酸酯、甲醇、醋酸乙烯酯与6-甲基-5-庚烯-2-醇 醇解反应 与野生型相比,嵌合C. rugosa LIP1/lid3的活性和对映选择性更低 在有机溶剂中,与野生型相比,嵌合体C. rugosa LIP1/lid3对氯乙基-2-羟基己酸酯与甲醇的醇解反应和醋酸乙烯酯与6-甲基-5-庚烯-2-醇的醇解反应的活性和对映选择性都较低 活性的降低可能是由于嵌合体酶具有较低比例的开放形式的酶分子,阻碍了对酶活性位点的接触 Secundo等[36] Burkholderia cepacia lipase (BCL) 叔戊醇、叔丁醇、石油醚、正己烷和异辛烷 傅里叶红外
光谱,CD在选择性有机溶剂和RTIL中,BCL的二级结构发生了一些改变 BCLα螺旋含量的降低可能
影响脂肪酶活性位点α-螺旋含量越低,活性位点的“开放”构象越高,从而更容易接近底物 Liu等[37] Geobacillus zalihae T1 lipase 甲醇、乙醇、丙醇、丁醇和戊醇)和水的混合物 分子动力学
模拟骨架原子结构偏差阐明水/有机溶剂混合物在降低溶剂极性时对蛋白质平衡状态的动态影响 有机溶剂Mt-OH、Et-OH和Pr-OH中形成更多氢键,蛋白质内氢键的增加最终与蛋白质的稳定性相关 在有机溶剂体系中,活性口袋四面体中间填料的距离变化不守恒,这可能导致催化氢键网络的弱点,很可能导致催化活性下降 Maiangwa等[38] 表 2 离子液体对脂肪酶结构的影响及催化活性降低相关机制
Table 2 The effects of ionic liquids on the structure of lipase and the related mechanism of catalytic activity reduction
脂肪酶 离子液体 方法 结构变化 活性变化 机制 参考文献 Burkholderia cepacia lipase (BCL) [OMIM][Cl],[EMIM][TfO],[BMIM][Cl],[OMIM][BF4],
[BMIM][CH3SO3],
[EMIM][Cl],[NMP][CH3SO3],
[HMIM][TfO],
[HMIM][CH3SO3],
[BMIM][PF6],
[BMIM][OH],[EMIM][PF6], [HMIM][Cl],[BMIM][Tf2N],
[BMIM][BF4],[OMIM][PF6],
[EMIM][BF4],[HMIM][PF6] and [OmPy][BF4]傅立叶红外
光谱室温离子液体中的BCL二级结构发生部分改变 阴离子对酯交换活性的影响远大于阳离子 [EMIM][Tf2N]会压缩酶RTIL的天然结构,从而阻止其展开 Liu等[37] Candida antarctica
lipase B[BMIM][NO3],[BMIM][lactate],
[EMIM][Et SO4]
and [Et NH3][NO3]傅立叶红外
光谱结构相似的离子液体对酶的行为有很大不同 分子大、空间要求高的离子不容易穿透蛋白质基质,需要许多分子间氢键解离来产生一些新的氢键,维持活性 分子大、空间要求高的离子不容易穿透蛋白质基质,需要许多分子间氢键的解离来产生部分新的氢键,维持酶活性 Lau等[40] Bacillus amyloliquefaciens and Bacillus lichiniformis [BMIM][Cl],[HMIM][Cl] 差示扫描量热法和荧光 与中温酶相比,嗜热酶更稳定 随着离子液体浓度的变化,酶的活性和稳定性都会降低 根据解淀粉芽孢杆菌和地衣芽孢杆菌热展开过程中获得的热谱图,[HMIM][Cl]的抗聚集能力强 Dabirmanesh等[41] Rhizopus oryzae NRRL 3562 1-Hexadecyl-3-methylimidazolium bromide ((C16 MIM)Br) 紫外可见光谱和圆二色谱 在低表面活性剂浓度下,导致β-折叠物含量增加和α-螺旋降低的结构变化 高浓度下的失活与光谱所描述的更大结构变化相关。等温滴定量热研究表明,这种结合在本质上是自发的,涉及非共价相互作用 高的熵负值表示疏水域的暴露和结构刚性的增加,与表面活性剂存在时活性位点更易接近和刚性相关 Adak等[42] Candida rugosa, Chromobacterium viscosum and Thermomyces lanuginosa Water-in-ionic liquid (W/IL) microemulsions/1-butyl-3-methylimidazolium hexafluorophosphate ([BMIM]PF6) 傅立叶红外光谱和圆二色谱 与迄今为止用于各种生物催化反应的其他微多相介质相比,在新体系中,来自C. rugosa、C. viscosum和T. lanuginosa的脂肪酶表现出更高的催化性能和操作稳定性 与传统有机溶剂相比,W/IL微乳液中酶的稳定性增强,易于从反应体系中分离产物,酶的可重复使用性好,以及离子液体独特的溶剂性质 将酶分子包埋在W/IL微乳液中形成的水微滴中,表明基于IL的反应系统为酶提供保护环境 Pavlidis等[43] Candida antarctica
lipase Btert-Butyl alcohol,[BMIM][BF4],
[BMIM][PF6],
[BMIM][lactate],
[BMIM][NO3],
[Et3Me N][Me SO4]傅立叶红外光谱 BMIM[dca]中α-螺旋和β-折叠含量的损失 在含有二氰酰亚胺、烷基硫酸盐、硝酸盐和乳酸阴离子的离子液体中溶解CALB,反应至少比[BMIM][BF4]慢十倍。[Et3Me N][Me SO4]是例外,溶解的CALB在该溶剂中保持其活性 在[BMIM][dca]中,CALB的交联酶聚集体的活性是叔丁醇中的两倍,而游离酶在叔丁醇离子液体中不可逆地失活。形成强氢键的离子液体,尤其是阴离子,可能会解离维持α-螺旋和β-折叠结构完整性的氢键,导致蛋白质全部或部分展开 Pavlidis等[43] Candida antarctica
lipase Bwater-immiscible ionic liquids (ILs),1-ethyl-3-methylimidizolium bis
(trifluoromethylsulfonyl)-
imide and butyltrimethylammonium bis(trifluoromethylsulfonyl)imide圆二色谱和荧光光谱 在50 °C的水和己烷培养基中培养4 d后,CALB的剩余活性损失超过75%,这与α-螺旋和-链二级结构的巨大变化有关 在所研究的两个ILs中观察到的CALB的稳定与维持50%的初始α-螺旋含量和增强-链有关。此外,内在荧光研究清楚地表明,在水和己烷介质中,经典酶的去折叠是如何随时间发生 酶在两种ILs中的培养相关的结构变化可能归因于紧凑而活跃的酶构象,从而提高在非水环境中的稳定性 De等[44] Candida antarctica (Novozyme 435) [BMIM][BF4],[HMIM][BF4],[OMIM][BF4],[BMIM][PF6],[HMIM][PF6],[OMIM][PF6],[EMIM][Tf2N],[BMIM][Tf2N],[HMIM][Tf2N],
[OMIM][Tf2N],
[BMMIM][Tf2N],
[HMMIM][Tf2N],
[OMMIM][Tf2N],[BMIM][N(CN)2],[HMIM][N(CN)2],[BMIM][OAc]傅立叶红外
光谱随着浸泡时间增加,α-螺旋含量降低,β-折叠含量增加 酶435在[BF4]、[PF6]和[TF2N]基离子液体中浸泡24 h后,保留约5%、40%
和100%的空白样品活性,揭示离子液体性质的初始酶活性与疏水性(log P)、极性(Et)、氢键碱性(B)和粘度有关。初始酶活性随log P值增加而增加,随ENT值降低而降低初始酶活性在较窄的范围内(0.24~0.26)随b值的增加而增加,然后随b值的增加而持续下降。对于基于[Tf2N]的离子液体,初始酶活性随粘度增加而增加,而在基于[BF4]
和[PF6]的离子液体中发现了不利关系。诺维信435α-螺旋含量的降低可能会影响脂肪酶活性位点。α-螺旋含量越低,底物越容易接近脂肪酶的活性部位Qin等[45] Candida antarctica lipase B (CALB) [HOOCMMIM][Cl],
[HOOCEMIM][Cl],
[HOOCBMIM][Cl],
[HOOCBMIM][H2PO4],
[HOOCMMIM][PF6]傅立叶红外光谱,圆二色谱和衰减总反射FTIR 与天然酶相比,所有修饰酶的α-螺旋含量均较高 改性在水相中获得更高的活性和催化效率,而含有更多潮向阳离子的ILs改性导致了更高的改性程度和活性 修饰增强脂肪酶的稳定性,尤其是带有疏水性阳离子的离子液体,而接枝到脂肪酶上的疏水性阴离子有助于提高脂肪酶的热稳定性和对有机溶剂的耐受性 Ru等[46] Aspergillus niger lipase [C4MIM]Cl,[C6MIM]Cl,[C8MIM]Cl,[C10MIM]Cl
and [C12MIM]Cl荧光和圆二色光谱 在0.3%(v/v)的[C10MIM]Cl和[C12MIM]Cl水溶液中暴露脂肪酶,不受IL浓度的影响,会导致脂肪酶二级结构发生变化,表明其椭圆度降低 [CnMIM]基于Cl的ILs可以对脂肪酶的活性(增强、维持甚至抑制)和结构构象施加不同的行为,取决于阳离子烷基链长度及其相对浓度 具有自聚集特性的ILs引起蛋白质结构的不可逆变化,导致蛋白质展开 Nascimento
等[47]表 3 超临界二氧化碳对脂肪酶结构的影响及催化活性降低相关机制
Table 3 The effect of supercritical carbon dioxide on the structure of lipase and the related mechanism of catalytic activity reduction
脂肪酶 超临界流体 条件/方法 结构变化 活性变化 机制 参考文献 Pseudomonas fluorescens,Rhizopus javanicus,Rhizopus niveus,porcine pancreas and Candida rugosa 超临界二氧化碳
(SC-CO2)100 bar,40 oC 后期结构稳定性降低 活性下降 SC-CO2分子和酶之间的相互作用;SC-CO2插入到酶和水分子之间 Habulin[50] Candida rugosa lipase(CRL) 亚临界或超临界
二氧化碳傅立叶变换红外光谱和荧光发射光谱 α-螺旋含量改变 在大多数高压处理中,脂肪酶活性显著增强 超临界流体对其酶刚性结构的保护 Chen[51] Lipozyme IM20 SC-CO2,加压/减压循环、减压速率和暴露 酶催化活性 - Lipozyme IM20在重复暴露于SC-CO2和低降压率后表现出最佳活性 提取固定化基质中的抑制成分 Aucoin[52] Palatase 20000 L,Lipozyme CALB L,Lipozyme RM IM and Lipozyme 435 SC-CO2 荧光发射光谱,扫描电子显微照片,红外光谱 蛋白结构发生改变,
形态改变高温度和强压力以及最长的暴露时间导致活性损失 SC-CO2处理可以通过构象变化和结构改变来影响酶的活性 Melgosa[53] -
[1] 马敏, 邱斌, 孙琪, 等. 中长链结构脂质MLCT的研究进展[J]. 食品工业科技,2021,42(5):322−327. [MA M, QIU B, SUN Q, et al. Research progress of medium and long chain structured lipids MLCT[J]. Science and Technology of Food Industry,2021,42(5):322−327. doi: 10.13386/j.issn1002-0306.2020040207 [2] 李亚, 时杰, 黄凤洪. 酶催化法制备新型结构脂质研究进展[J]. 生物产业技术,2019(4):42−47. [LI Y, SHI J, HUANG F H. Advances in the preparation of novel structural lipids by enzymatic catalysis[J]. Biotechnology & Business,2019(4):42−47. [3] 李君, 崔怀田, 刘瑞琦, 等. 脂肪替代物在低脂人造黄油中的应用研究进展[J]. 中国粮油学报,2021(6):173−180. [LI J, CUI H T, LIU R Q, et al. Research progress on application of fat substitute in low-fat margarine[J]. Journal of the Chinese Cereals and Oils Association,2021(6):173−180. [4] 唐立伟, 周昱婧, 周芷寒, 等. 脂肪替代物在奶酪中的应用研究进展[J]. 食品安全导刊,2020(9):168−171. [TANG L W, ZHOU Y J, ZHOU Z H. et al. Research progress on the application of fat substitutes in cheese[J]. China Food Safety Magazine,2020(9):168−171. doi: 10.16043/j.cnki.cfs.2020.09.130 [5] SPERANZA P, MACEDO G A. Lipase-mediated production of specific lipids with improved biological and physicochemical properties[J]. Process Biochemistry,2012,47(12):1699−1706. doi: 10.1016/j.procbio.2012.07.006
[6] FERNANDEZ-LAFUENTE R. Lipase from Thermomyces lanuginosus: Uses and prospects as an industrial biocatalyst[J]. Journal of Molecular Catalysis B Enzymatic,2010,62(3):197−212.
[7] 何川. 酶法酯交换与化学酯交换[J]. 粮食与油脂,2003,5(5):24−25. [HE C. Enzymatic and chemical transesterification[J]. Grain and Oil,2003,5(5):24−25. doi: 10.3969/j.issn.1008-9578.2003.05.008 [8] 曹茜, 王丹, 袁永俊. 脂肪酶位置选择性及其应用在功能性结构甘油三酯合成中的研究进展[J]. 食品与发酵工业,2020,46(11):295−301. [CAO X, WANG D, YUAN Y J. Advances in lipase regioselectivity and its applications in synthesis of functional structured triacylglycerols[J]. Food and Fermentation Industries,2020,46(11):295−301. doi: 10.13995/j.cnki.11-1802/ts.023932 [9] NOOR LIDA H M D, SUNDRAIN K, SIEW W L, et al. TAG composition and solid fat content of palm oil, sunflower oil, and palm kernel olein blends before and after chemical interesterification[J]. JAOCS,2002,79(11):1137−1144. doi: 10.1007/s11746-002-0617-0
[10] LOPEZ-HERNANDEZ A, GARCIA H S, HILL C G. Lipase-catalyzed transesterification of medium-chain triacylglycerols and a fully hydrogenated soybean oil[J]. Journal of Food Science,2005,70(6):c365−c372.
[11] SHUANG D, JIANG K Y, YAN Y J. Optimization of lipase-catalyzed acidolysis of soybean oil to produce structured lipids[J]. Journal of Food Biochemistry,2009,33(3):442−452. doi: 10.1111/j.1745-4514.2009.00227.x
[12] 季圣阳, 鞠兴荣, 徐斐然, 等. 功能性油脂-结构脂质酶法合成的研究进展[J]. 粮食科技与经济,2018,43(10):4. [JI S Y, JU X R, XU F R. Research progress on enzymatic synthesis functional oils-structured lipids[J]. Grain Science and Technology and Economy,2018,43(10):4. doi: 10.16465/j.gste.cn431252ts.20181020 [13] 李成, 王胜杰, 季敏, 等. 脂肪酶在催化酯交换过程中的稳定性[J]. 上海大学学报(自然科学版),2017,23(4):623−627. [LI C, WANG S J, JI M, et al. Stability of lipase in the process of catalytic interesterification reaction[J]. Journal of Shanghai University (Natural Science),2017,23(4):623−627. [14] KHODADADI M, KERMASHA S. Modeling lipase-catalyzed interesterification of flaxseed oil and tricaprylin for the synthesis of structured lipids[J]. Journal of Molecular Catalysis B: Enzymatic,2014,102:33−40. doi: 10.1016/j.molcatb.2014.01.011
[15] TURAN D, YESILCUBUK N S, AKOH C C. Enrichment of sn-2 position of hazelnut oil with palmitic acid: Optimization by response surface methodology[J]. LWT-Food Science and Technology,2013,50(2):766−772. doi: 10.1016/j.lwt.2012.07.009
[16] LIU S L, DONG X Y, WEI F, et al. Ultrasonic pretreatment in lipase-catalyzed synthesis of structured lipids with high 1, 3-dioleoyl-2-palmitoylglycerol content[J]. Ultrasonics Sonochemistry,2015,23:100−108. doi: 10.1016/j.ultsonch.2014.10.015
[17] ZHAO M L, TANG L, ZHU X M, et al. Enzymatic production of zero-trans plastic fat rich in α-linolenic acid and medium-chain fatty acids from highly hydrogenated soybean oil, Cinnamomum camphora seed oil, and perilla oil by lipozyme TL IM[J]. Journal of Agricultural and Food Chemistry,2013,61(6):1189−1195. doi: 10.1021/jf305086j
[18] PALLA C A, CARRIN M E. Kinetics modeling of the acidolysis with immobilized Rhizomucor miehei lipases for production of structured lipids from sunflower oil[J]. Biochemical Engineering Journal,2014,90(15):184−194.
[19] PACHECO C, CRAPISTE G H, CARRIN M E. Lipase-catalyzed acidolysis of sunflower oil: Kinetic behavior[J]. Journal of Food Engineering,2010,98(4):492−497. doi: 10.1016/j.jfoodeng.2010.01.032
[20] 郭诤, 张根旺. 脂肪酶的结构特征和化学修饰[J]. 中国油脂,2003,7:5−10. [GUO Z, ZHANG G W. Structural characteristics and chemical modification of lipase[J]. China Oils and Fats,2003,7:5−10. doi: 10.3321/j.issn:1003-7969.2003.03.001 [21] JOSEPH B, RAMTEKE P W, THOMAS G. Cold active microbial lipases: Some hot issues and recent developments[J]. Biotechnology Advance,2008,26:457−470. doi: 10.1016/j.biotechadv.2008.05.003
[22] KOKKINOU M, THEODOROU L G, PAPAMICHAEL E M. Aspects on the catalysis of lipase from porcine pancreas (type VI-s) in aqueous media: Development of ion-pairs[J]. Brazil Archive Biological Technology,2012,55:231−236. doi: 10.1590/S1516-89132012000200007
[23] 孟枭. 脂肪酶的结构修饰、分子识别机理解析及性能强化[D]. 杭州: 浙江大学, 2014 MENG X. Study on stereo-recognition mechanism and performance enhancement of lipase by structure modification[D]. Hangzhou: Zhejiang University, 2014
[24] PREIS K, HOLMBERGO H, WATZKE M E, et al. Lipase at interfaces: A review[J]. Advance Colloid Interface Science,2009,147:237−250.
[25] VAN TILBEURGH H, EGLOFF M P, MARTINEZ C, et al. Interfacial activation of the lipase-procolipase complex by mixed micelles revealed by X-ray crystallography[J]. Nature,1993,362:814−820. doi: 10.1038/362814a0
[26] GHANEM A. Trends in lipase-catalyzed asymmetric access to enantiomerically pure/enriched compounds[J]. Tetrahedron,2007,63(8):1721−1754. doi: 10.1016/j.tet.2006.09.110
[27] ESCORCIA A M, DAZA M C, DOERR M. Computational study of the enantioselectivity of the O-acetylation of (R, S)-propranolol catalyzed by candida antarctica lipase B[J]. Journal of Molecular Catalysis B: Enzymatic,2014,108:21−31. doi: 10.1016/j.molcatb.2014.06.010
[28] ŚWIDEREK K, PANETH P. Differences and similarities in binding of pyruvate and l-lactate in the active site of M4 and H4 isoforms of human lactate dehydrogenase[J]. Archives of Biochemistry and Biophysics,2011,505(1):33−41. doi: 10.1016/j.abb.2010.10.010
[29] CHEN D Z, WANG Q L, ZHANG H H, et al. Theoretical mechanisms of the superoxide radical anion catalyzed by the copper-zinc superoxide dismutase[J]. Internatinal Journal of Quantum Chemistry,2010,110(7):1394−1401. doi: 10.1002/qua.22025
[30] YANG C, WANG F, LAN D, et al. Effects of organic solvents on activity and conformation of recombinant Candida antarctica lipase A produced by Pichia pastoris[J]. Process Biochemistry,2012,47(3):533−537. doi: 10.1016/j.procbio.2011.11.017
[31] SADAF A, GREWAL J, JAIN I, et al. Stability and structure of Penicillium chrysogenum lipase in the presence of organic solvents[J]. Preparative Biochemistry and Biotechnology,2018:1−6.
[32] LI C, TAN T, ZHANG H, et al. Analysis of the conformational stability and activity of Candida antarctica lipase B in organic solvents insight from molecular dynamics and quantum mechanics/simulations[J]. Journal of Biological Chemistry,2010,285(37):28434−28441. doi: 10.1074/jbc.M110.136200
[33] DACHURI V, BOYINENI J, CHOI S, et al. Organic solvent-tolerant, cold-adapted lipases PML and LipS exhibit increased conformational flexibility in polar organic solvents[J]. Journal of Molecular Catalysis B: Enzymatic,2016,131:73−78. doi: 10.1016/j.molcatb.2016.06.003
[34] JIANG Y, LI L, ZHANG H, et al. Lid closure mechanism of Yarrowia lipolytica lipase in methanol investigated by molecular dynamics simulation[J]. Journal of Chemical Information & Modeling,2014,54(7):2033−2041.
[35] HAQUE N, PRABHU N P. Lid dynamics of porcine pancreatic lipase in non-aqueous solvents[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2016: S0304416516301350.
[36] SECUNDO F, CARREA G, TARABIONO C, et al. Activity and enantioselectivity of wildtype and lid mutated Candida rugosa lipase isoform 1 in organic solvents[J]. Biotechnology & Bioengineering,2004,86(2):236−240.
[37] LIU Y, CHEN D, YAN Y, et al. Biodiesel synthesis and conformation of lipase from Burkholderia cepacia in room temperature ionic liquids and organic solvents[J]. Bioresource Technology,2011,102(22):10414−10418. doi: 10.1016/j.biortech.2011.08.056
[38] MAIANGWA J, ALI M S M, SALLEH A B, et al. Lid opening and conformational stability of T1 lipase is mediated by increasing chain length polar solvents[J]. PeerJ,2017,5:e3341. doi: 10.7717/peerj.3341
[39] 秦杰, 邹孝强, 金青哲, 等. 离子液体体系对脂肪酶性质和结构的影响研究进展[J]. 中国油脂,2017,42(1):26−30. [QIN J, ZOU X Q, JIN Q Z, et al. Advance in influence of ionic liquids system on properties and structure of lipase[J]. China Oils and Fats,2017,42(1):26−30. doi: 10.3969/j.issn.1003-7969.2017.01.007 [40] LAU R M, SORGEDRAGER M J, CARREA G, et al. Dissolution of Candida antarctica lipase B in ionic liquids: Effects on structure and activity[J]. Green Chemistry,2004,6(9):483−487. doi: 10.1039/b405693k
[41] DABIRMANESH B, DANESHJOU S, SEPAHI A A, et al. Effect of ionic liquids on the structure, stability and activity of two related α-amylases[J]. International Journal of Biological Macromolecules,2011,48(1):0−97.
[42] ADAK S, DATTA S, BHATTACHARYA S, et al. Imidazolium based ionic liquid type surfactant improves activity and thermal stability of lipase of Rhizopus oryzae[J]. Journal of Molecular Catalysis B: Enzymatic,2015,119:12−17. doi: 10.1016/j.molcatb.2015.05.010
[43] PAVLIDIS I V, GOURNIS D, PAPADOPOULOS G K, et al. Lipases in water-in-ionic liquid microemulsions: Structural and activity studies[J]. Journal of Molecular Catalysis B: Enzymatic,2009,60(1-2):50−56. doi: 10.1016/j.molcatb.2009.03.007
[44] DE DIEGO T, LOZANO P, GMOUH S, et al. Understanding structure-stability relationships of Candida antartica lipase B in ionic liquids[J]. Biomacromolecules,2005,6(3):1457−1464. doi: 10.1021/bm049259q
[45] QIN J, ZOU X Q, LV S T, et al. Influence of ionic liquids on lipase activity and stability in alcoholysis reactions[J]. Rsc Advances, 2016.
[46] JIA R, HU Y, LIU L, et al. Chemical modification for improving activity and stability of lipase B from Candida antarctica with imidazolium-functional ionic liquids[J]. Organic & Biomolecular Chemistry,2013,11:7192−7198.
[47] NASCIMENTO P A M, PEREIRA J F B, DE CARVALHO S E V. Insights into the effect of imidazolium-based ionic liquids on chemical structure and hydrolytic activity of microbial lipase[J]. Bioprocess and Biosystems Engineering,2019,42(7):1235−1246.
[48] WIMMER Z, ZAREVÚCKA M. A review on the effects of supercritical carbon dioxide on enzyme activity[J]. International Journal of Molecular Sciences,2010,11(1):233−253. doi: 10.3390/ijms11010233
[49] 张佳欣. 超临界二氧化碳下酶催化非专一性反应的研究[D]. 长春: 吉林大学, 2020 ZHANG J X. Enzyme catalytic promiscuous reactions in supercritical carbon dioxide[D]. Changchun: Jilin University, 2020.
[50] HABULIN M, KNEZ Z. Activity and stability of lipases from different sources in supercritical carbon dioxide and near-critical propane[J]. Journal of Chemical Technology & Biotechnology,2001,76(12):1260−1266.
[51] CHEN D, PENG C, ZHANG H, et al. Assessment of activities and conformation of lipases treated with sub- and supercritical carbon dioxide[J]. Applied Biochemistry and Biotechnology,2013,169(7):2189−2201. doi: 10.1007/s12010-013-0132-3
[52] AUCOIN M G, LEGGE R L. Effects of supercritical CO2 exposure and depressurization on immobilized lipase activity[J]. Biotechnology Letters,2001,23:1863−1870. doi: 10.1023/A:1012730105393
[53] MELGOSA R, SANZ M T, GSOLAESA Á, et al. Enzymatic activity and conformational and morphological studies of four commercial lipases treated with supercritical carbon dioxide[J]. The Journal of Supercritical Fluids,2015,97:51−62. doi: 10.1016/j.supflu.2014.11.003
[54] 廖凯波, 曾虹燕, 邓欣, 等. 微水相超声波协同固定化脂肪酶催化酯交换过程优化[J]. 天然产物研究与开发,2009,21(5):871−874, 865. [LIAO K B, ZENG H Y, DENG X. et al. Optimized process of biodiesel on immobilized lipase catalyst assisted with ultrasonic radicalization in micro aqueous media[J]. Natural Product Research and Development,2009,21(5):871−874, 865. doi: 10.3969/j.issn.1001-6880.2009.05.035 [55] JAMIR K, SESHAGIRIRAO K. Fluorescence quenching, structural and unfolding studies of a purified cysteine protease, ZCPG from Zingiber montanum rhizome[J]. International Journal of Biological Macromolecules,2018,106:277−283. doi: 10.1016/j.ijbiomac.2017.08.019
[56] PFLUCK A C D, DE BARROS D P C, FONSECA L P, et al. Stability of lipases in miniemulsion systems: Correlation between secondary structure and activity[J]. Enzyme and Microbial Technology,2018,114:7−14. doi: 10.1016/j.enzmictec.2018.03.003
-
期刊类型引用(3)
1. 李亚俐,王雪莉,石柳,吴文锦,陈胜,陈朗,郭晓嘉,熊光权,汪兰,孙智达. 壳聚糖-绿原酸复合保鲜剂对冷藏鮰鱼片食用品质的影响. 肉类研究. 2025(01): 42-50 .  百度学术
百度学术
2. 武玫怡,焦文娟,赵甜甜,刘俊,周芳,刘伟峰,张业辉,南海军,陈晓瑛,黄利华. 高静水压与水煮处理对热带海参品质的影响. 肉类研究. 2025(01): 25-33 .  百度学术
百度学术
3. 崔燕,刘韩欣,朱麟,尚海涛,林旭东,陈曙颖,宣晓婷. 超高压杀菌对大黄鱼理化性质及滋味、风味的影响. 食品工业科技. 2025(05): 44-55 .  本站查看
本站查看
其他类型引用(3)





 下载:
下载:
 下载:
下载:



