Quality Changes of Grass Carp Visceral Fish Oil under Different Storage Temperatures
-
摘要: 为探究草鱼内脏鱼油在不同贮藏温度下的品质变化,以草鱼内脏为原料,采用酶法提取鱼油,将草鱼内脏鱼油分别置于冷藏(4 ℃)、常温(25 ℃)和37 ℃条件下贮藏60 d,定期测定其酸价和过氧化值,并运用指纹特征分析、主成分分析(PCA)、线性判别分析(LDA)和载荷分析等电子鼻技术定期分析其挥发性成分的变化。结果表明:在贮藏期内,低温贮藏时(4 ℃ )的草鱼内脏粗鱼油酸价、过氧化值和挥发性气味成分变化均不明显;在常温(25 ℃)及37 ℃贮藏温度下草鱼内脏粗鱼油的酸价、过氧化值均明显升高,挥发性气味成分变化较大,尤其37 ℃时变化显著;以酸价和过氧化值作为鱼油是否变质的评判标准,4 ℃时保质期约为55 d,25 ℃时保质期约为40 d,37 ℃时保质期约为30 d;鱼油贮藏过程中的挥发性成分主要为氮氧化合物、硫化物和芳香成分等物质。本研究为草鱼内脏的有效利用提供了理论基础。Abstract: In order to explore the quality changes of grass carp visceral fish oil under different storage temperatures, the grass carp visceral fish oil was extracted by enzymatic method. The visceral fish oil of grass carp was stored at cold storage (4 ℃), normal temperature (25 ℃) and 37 ℃ for 60 days at constant temperature, and its acid value and peroxide value were determined regularly. Fingerprint characteristic analysis, principal component analysis (PCA) and linear discriminant analysis (LDA) and load analysis and other electronic nose technologies regularly were used to analyze the changes of volatile components. The results showed that the changes of acid value, peroxide value and volatile odor components of grass carp viscera were not obvious during storage at low temperature (4 ℃); The acid value and peroxide value of grass carp visceral crude oil increased significantly at room temperature (25 ℃) and 37 ℃, and the volatile odor components changed significantly, especially at 37 ℃; Taking the acid value and peroxide value as the criteria for judging whether the fish oil was deteriorated, the shelf life was about 55 days at 4 ℃, 40 days at 25 ℃ and 30 days at 37 ℃; The volatile components of fish oil during storage were mainly nitrogen oxides, sulfides and aromatic components. This study provides a theoretical basis for the effective utilization of grass carp viscera.
-
Keywords:
- grass carp visceral fish oil /
- electronic nose /
- acid value /
- peroxide value /
- quality change
-
近年来,我国淡水产品的产量呈现逐年增长的趋势,2019年全国淡水产品产量为3198万吨,其中淡水鱼占绝大多数,产量达到2686万吨[1-3]。在淡水鱼加工过程中鱼头、鱼皮、鱼骨及鱼内脏常常被丢弃,造成资源的浪费和环境的污染[4-6]。草鱼作为淡水鱼中的主要鱼类,其内脏中含有丰富的鱼油,富含EPA和DHA等人体必需的多不饱和脂肪酸[7-9],但在加工、贮藏和运输过程中极易发生氧化酸败而导致其营养和感官品质下降、货架期缩短[10-12],朱迎春等[13]将鲶鱼下脚料中提取的鱼油分别在37 ℃、室温(25 ℃)及4 ℃下贮藏,发现鱼油在0~4 ℃冷藏或添加100 mg/kg VE后常温下贮存稳定性较高。因此研究不同贮藏温度下草鱼内脏鱼油品质变化对判定其酸败程度和延长货架期具有非常重要意义。
鱼油挥发性成分主要由醛、醇、酮、酸和烃类组成,对鱼油品质具有很大的影响。目前,检测样品挥发性成分变化的方法主要有气相色谱-质谱联用仪测定法和电子鼻测定法。气相色谱-质谱联用仪测定方法分析时间长、成本高,测定结果通常是样品经分离纯化后的结果,很难代表样品的整体性。电子鼻主要由气敏传感器阵列、信号预处理和模式识别三部分组成,它主要利用传感器阵列的电信号变化实现对样品气味成分的监测,因此电子鼻测定法具有响应时间短、检测速度快、价格适中、能代表整体气味信息等优点[14]。陈娜等[15]进行了基于电子鼻分析鱼油储藏过程中酸败程度的研究,试验表明,电子鼻可作为酸价、过氧化值预测的辅助手段。但目前利用酸价及过氧化值等鱼油稳定性指标结合电子鼻技术分析不同贮藏温度下草鱼内脏鱼油挥发性成分的变化还未见报道。
考虑到实际生活中鱼油的贮藏条件,本研究以酶法提取的草鱼内脏粗鱼油为研究对象,利用酸价、过氧化值的测定及电子鼻技术探究草鱼内脏鱼油在冷藏(4 ℃)、常温(25 ℃)和37 ℃不同贮藏温度下的酸败程度及挥发性成分变化,以期为草鱼内脏鱼油贮藏及货架期提供基础数据和科学依据。
1. 材料与方法
1.1 材料与仪器
溱湖草鱼 购自泰州大润发超市;胰蛋白酶(250 U/g) 上海伯奥生物科技有限公司;氢氧化钠、乙醚、异丙醇、酚酞指示剂、95%无水乙醇、三氯甲烷、冰乙酸、硫代硫酸钠、碘化钾、无水硫酸钠、可溶性淀粉 所有试剂均购于上海国药集团,均为分析纯。
AL204型电子天平 梅特勒-托利多仪器有限公司;SSW-420-2S型恒温水浴锅 苏州江东精密仪器有限公司;DS-1型组织捣碎机 上海精密仪器仪表有限公司;HPX-9162MB型恒温培养箱 上海恒勤仪器设备有限公司;PEN3.0 型电子鼻 德国Airsense 公司。
1.2 实验方法
1.2.1 原料预处理
取新鲜草鱼内脏,去除内脏中的残留物,洗净,沥干,在组织捣碎机中捣碎,混匀,置于4 ℃冰箱冷藏备用。
1.2.2 粗鱼油的制备
称取适量草鱼内脏,按固液比(1:1)加入蒸馏水,再用NaOH(200 g/L)溶液调节pH至8.0,然后加入2%的胰蛋白酶,在50 ℃条件下保温酶解2.5 h,将酶提取液在5000 r/min下离心10 min,收集上层油脂相,得到草鱼内脏粗鱼油[16-17]。酶法制备完成后的草鱼内脏鱼油立即测定其酸价和过氧化值,并置于−18 ℃冷冻备用
1.2.3 实验设计
草鱼内脏鱼油品质变化试验分为三组,分别在4、25、37 ℃下贮藏,4 ℃试验组置于恒温冰箱中,25和37 ℃试验组置于恒温培养箱中,贮藏期为60 d。三个试验组每隔5 d测定酸价、过氧化值和挥发性成分。
1.2.4 酸价的测定
参照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》[18]中的第一法(冷溶剂指示剂滴定法)进行测定。
1.2.5 过氧化值的测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》[19]中的第一法(滴定法)进行测定。
1.2.6 电子鼻检测方法
具体如下[20-23]:回温后称取5 g草鱼内脏粗鱼油样品置于100 mL烧杯中,双层保鲜膜封口,室温下静置30 min后上机测试。利用电子鼻(含10种金属传感器)顶空直接分析,每个样品重复检测3次。测定条件:载体流量400 mL/min,气体进样流量400 mL/min,传感器清洗时间80 s,采样时间间隔1 s,归零时间5 s,测试时间80 s。传感器具体名称及性能见表1所示。
表 1 电子鼻传感器性能Table 1. Electronic nose sensor performance序号 传感器
名称响应特性 成分(mL/m3) 1 W1C 芳香成分aromatic 苯类,10 2 W5S 灵敏度大,对氮氧化合物灵敏broadrange 二氧化氮,1 3 W3C 对芳香成分灵敏,氨类aromatic 苯,10 4 W6S 对氢气有选择性hydrogen 氢气,100 5 W5C 烷烃芳香成分arom-aliph 丙烷,1 6 W1S 对甲基类成分灵敏broad-methane 甲烷,100 7 W1W 对硫化物灵敏sulphur-organic 硫化氢,1 8 W2S 对醇类成分灵敏broad-alcohol 一氧化碳,100 9 W2W 对有机硫化物和芳香成分灵敏sulph-chlor 硫化氢,1 10 W3S 对烷烃类成分灵敏methane-aliph 甲烷,10 1.3 数据处理
所有实验进行3次平行实验,取其平均值±标准差;采用Excel 2010软件对实验数据进行整理;采用SPSS Statistics 17.0统计分析软件对实验数据进行差异显著性分析,差异显著性水平为P<0.05。电子鼻数据处理采用PEN3.0仪器自带的WinMuster软件处理数据,对采集挥发性气味信息进行统计分析,包括指纹特征分析、主成分分析(PCA)、线性判别分析(LDA)以及载荷分析(Loadings)等[24-25]。
2. 结果与分析
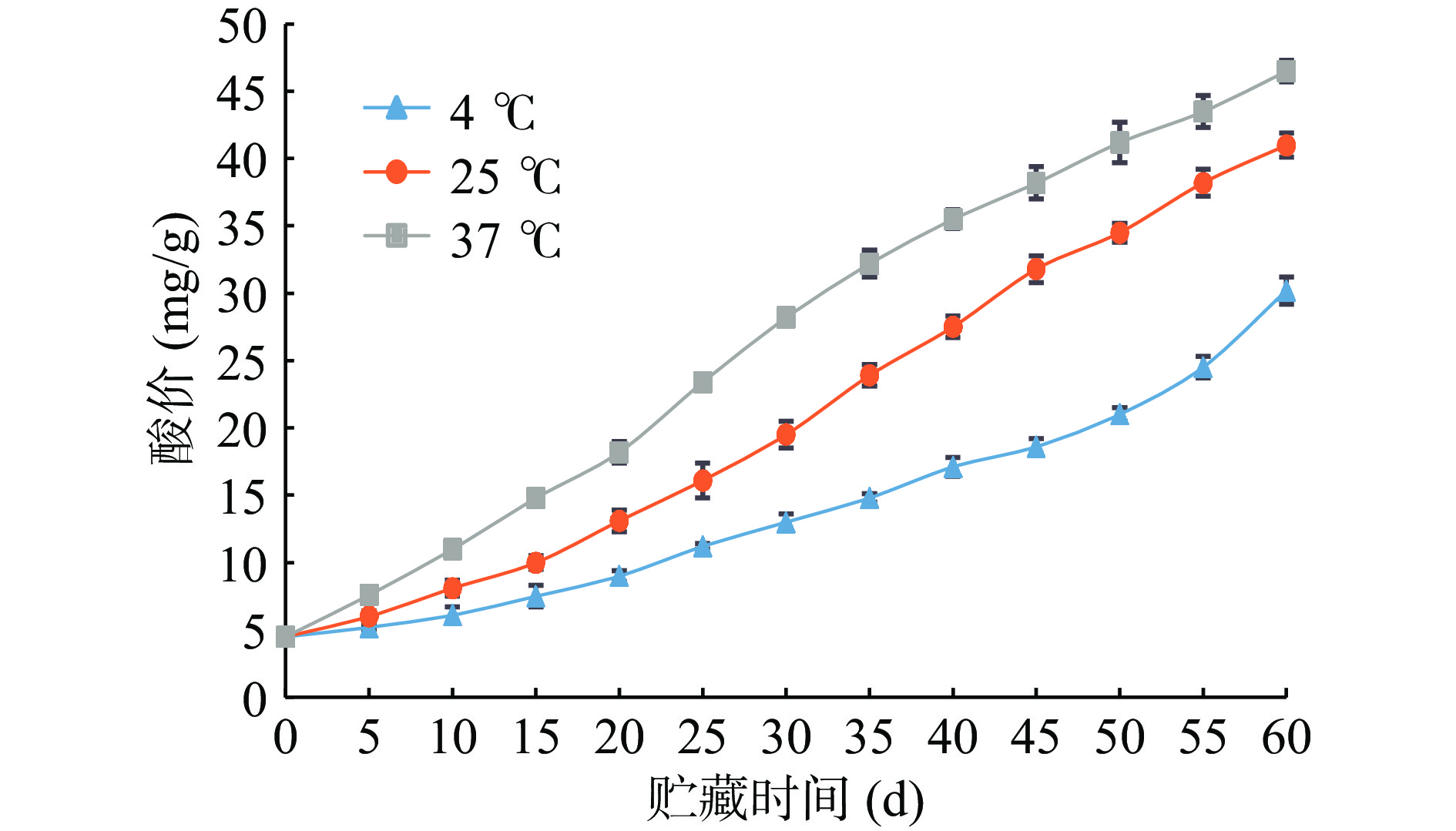
2.1 草鱼内脏鱼油贮藏过程中酸价的变化
酸价是脂肪中游离脂肪酸含量的标志[9],可通过测定酸价的高低来检验油脂的品质。氧化作用会导致油脂中酯键断裂而产生大量游离脂肪酸,故鱼油酸价升高。因此酸价越高,鱼油的品质越低。根据SC/T 3502—2016《中华人民共和国水产行业标准 鱼油》[25]规定:一级粗鱼油酸价≤8.0 mg/g、二级粗鱼油酸价≤15.0 mg/g、三级粗鱼油酸价≤30.0 mg/g。
由图1知,草鱼内脏粗鱼油初始酸价为4.5 mg/g,随着贮藏期延长,酸价逐渐升高,在25和37 ℃贮藏条件下鱼油酸价增幅度明显快于4 ℃。4 ℃贮藏条件下的草鱼内脏粗鱼油酸价在前55 d贮藏期内增幅比较小,这可能是因为低温贮藏条件下鱼油氧化酸败比较缓慢,当贮藏时间达到60 d时酸价增加明显,达到了30.2 mg/g,超过了30.0 mg/g,不再符合粗鱼油三级标准。草鱼内脏粗鱼油在25 ℃条件下贮藏45 d后酸值为31.8 mg/g,超过了粗鱼油三级标准规定值。草鱼内脏粗鱼油在37 ℃条件下酸价增幅明显,贮藏35 d后酸值高达32.2 mg/g,已不符合粗鱼油三级标准。由粗鱼油酸价标准可初步判断:草鱼内脏鱼油在低温贮藏环境下贮存较好,4 ℃时粗制鱼油贮藏期约为55 d;25 ℃时粗制鱼油贮藏期约为40 d;37 ℃时粗制鱼油贮藏期约为30 d。
2.2 草鱼内脏鱼油贮藏过程中过氧化值的变化
过氧化值是表示油脂和脂肪酸等被氧化程度的一种指标。油脂中不饱和脂肪酸由于氧气等作用,其不饱和链断开形成过氧化物。过氧化物不稳定,又会再次分解为低级脂肪酸、醛类和酮类等物质,导致油脂酸败变质[26-27]。因此过氧化值越高,油脂的品质也就越低。根据SC/T 3502—2016《中华人民共和国水产行业标准 鱼油》[25],一级粗鱼油过氧化值≤12.0 meq/kg(6.0 mmol/kg)、二级及三级粗鱼油过氧化值≤20.0 meq/kg(10.0 mmol/kg)。
由图2可知,草鱼内脏粗鱼油初始过氧化值较低,仅为1.8 mmol/kg,说明样品未被高度氧化。随着贮藏期延长,过氧化值逐渐升高,在25和37 ℃贮藏条件下鱼油过氧化值增幅度明显快于4 ℃。草鱼内脏粗鱼油在25和37 ℃条件下分别贮藏45 d和35 d后,过氧化值开始超过10.0 mmol/kg,分别达到10.8 mmol/kg和11.2 mmol/kg,不再符合粗鱼油最低标准要求,说明已发生了氧化变质。而草鱼内脏粗鱼油在4 ℃贮藏条件下其过氧化值变化不大,贮藏55 d时过氧化值为8.9 mmol/kg,低于10.0 mmol/kg,但在贮藏60 d时过氧化值迅速升高到10.6 mmol/kg,超过了标准规定的粗鱼油过氧化值。因此贮藏温度越高,贮藏时间越长,草鱼内脏鱼油氧化作用越明显。参照上述标准可知:4 ℃时粗制鱼油贮藏期约为55 d;25 ℃时粗制鱼油贮藏期约为40 d;37 ℃时粗制鱼油贮藏期约为30 d,与酸价指标测定一致。
2.3 草鱼内脏鱼油贮藏过程中挥发性成分变化
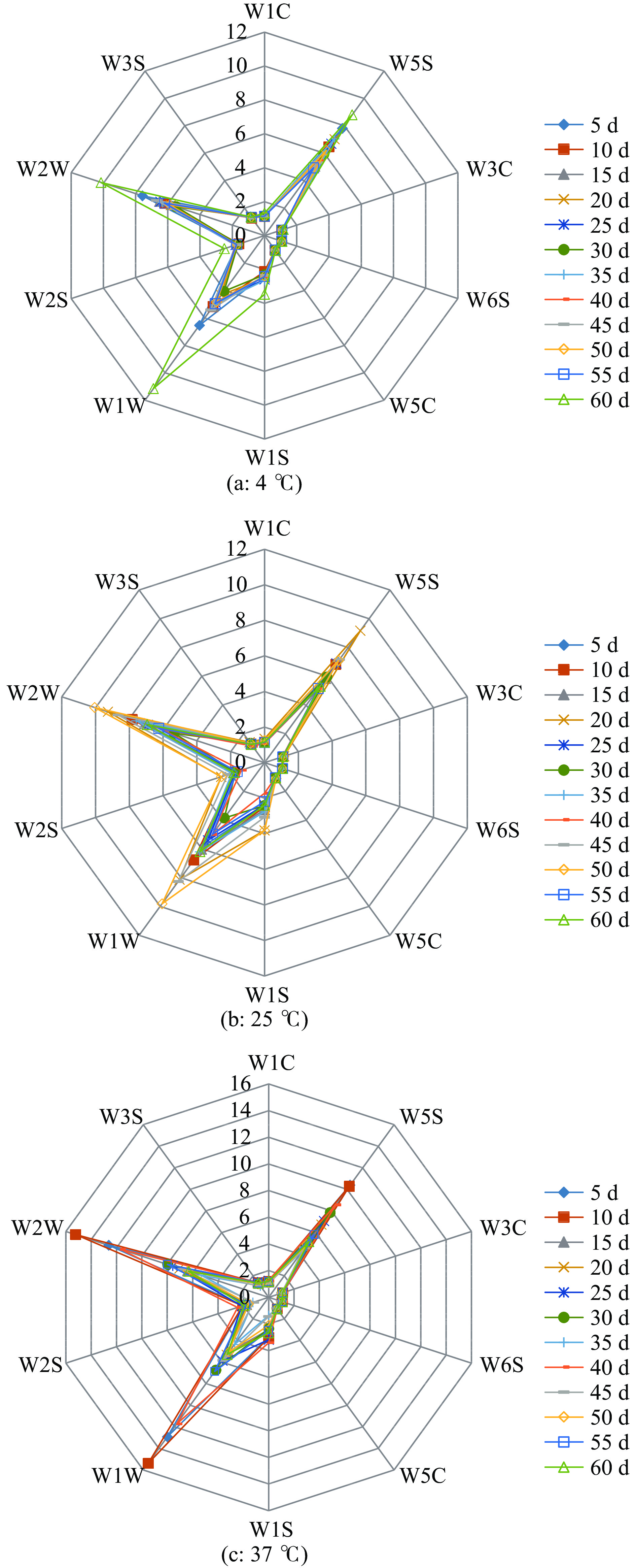
2.3.1 草鱼内脏粗鱼油贮藏过程中挥发性成分的指纹特征分析
鱼油挥发性成分主要由醛、醇、酮、酸和烃类组成[28-30]。雷达图能直观地观察到不同贮藏条件下样品挥发性成分在不同传感器中响应信号的差异。由图3可知,不同贮藏时间和不同贮藏温度均会影响草鱼内脏鱼油样品对各传感器的响应。贮藏温度越高,在60 d的贮藏期内传感器响应信号变化幅度就越大,但总体变化不明显。其中传感器W1W的响应值最大,其次依次是传感器W2W和W5S。因此,通过雷达图可以初步判定出草鱼内脏粗鱼油中的挥发性成分主要是硫化物、芳香成分和氮氧化合物等物质。
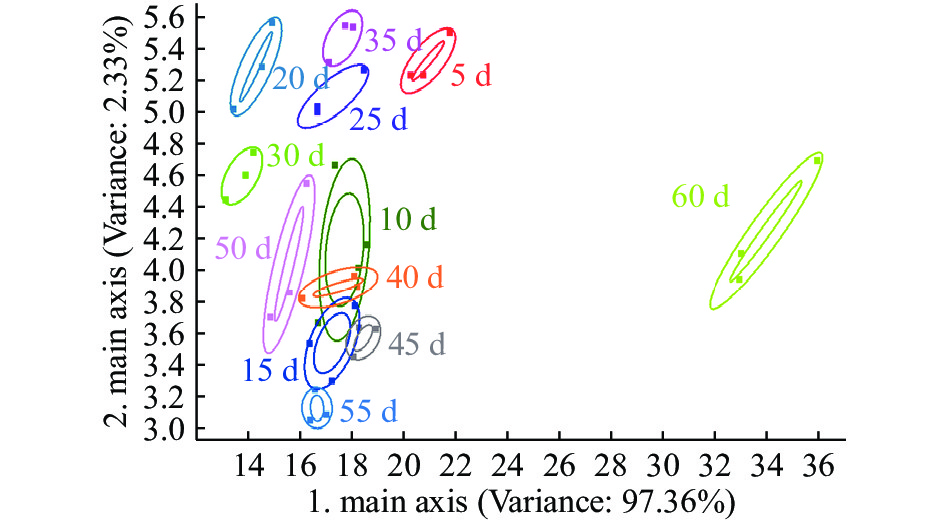
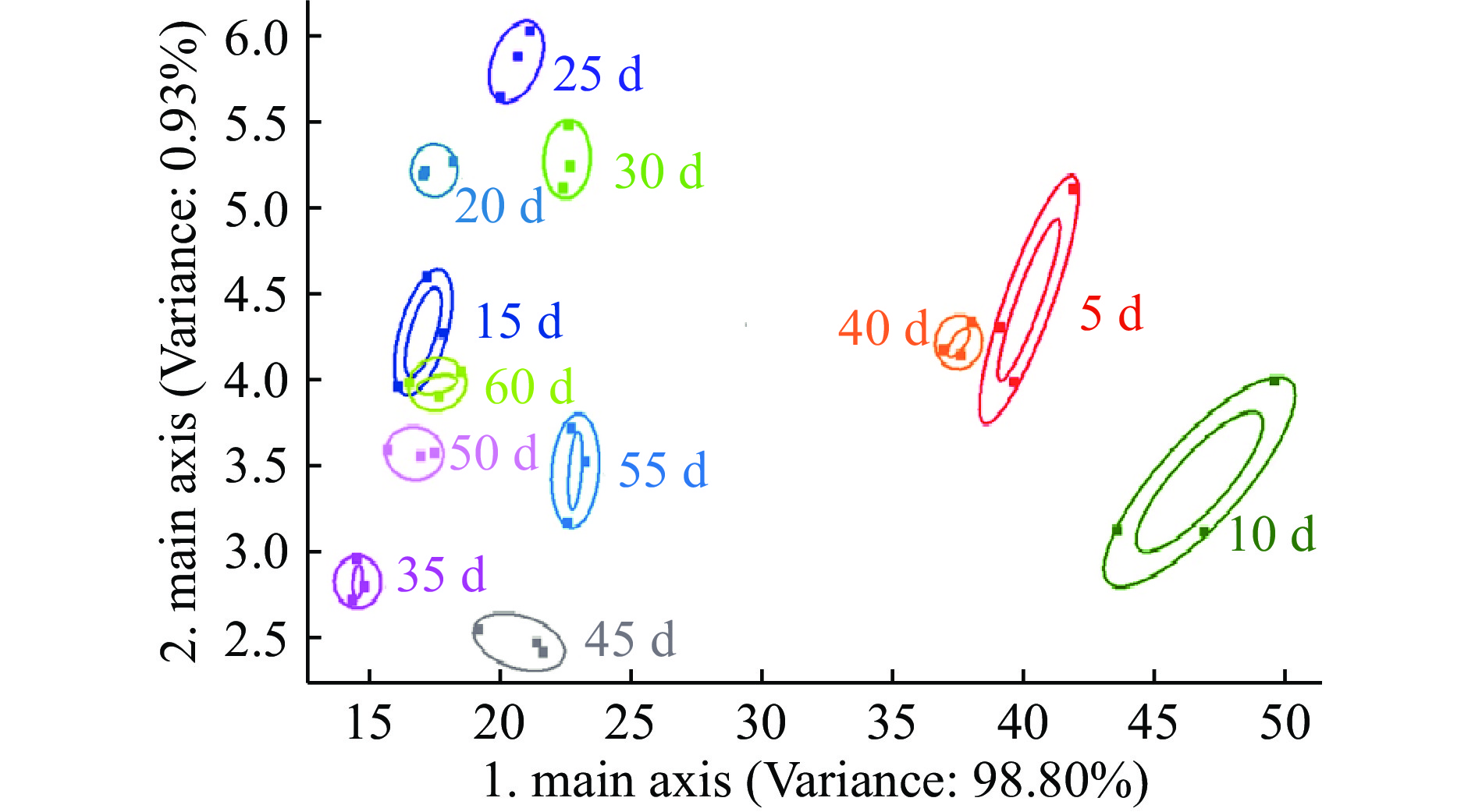
2.3.2 草鱼内脏粗鱼油贮藏过程中挥发性成分的主成分分析(PCA)
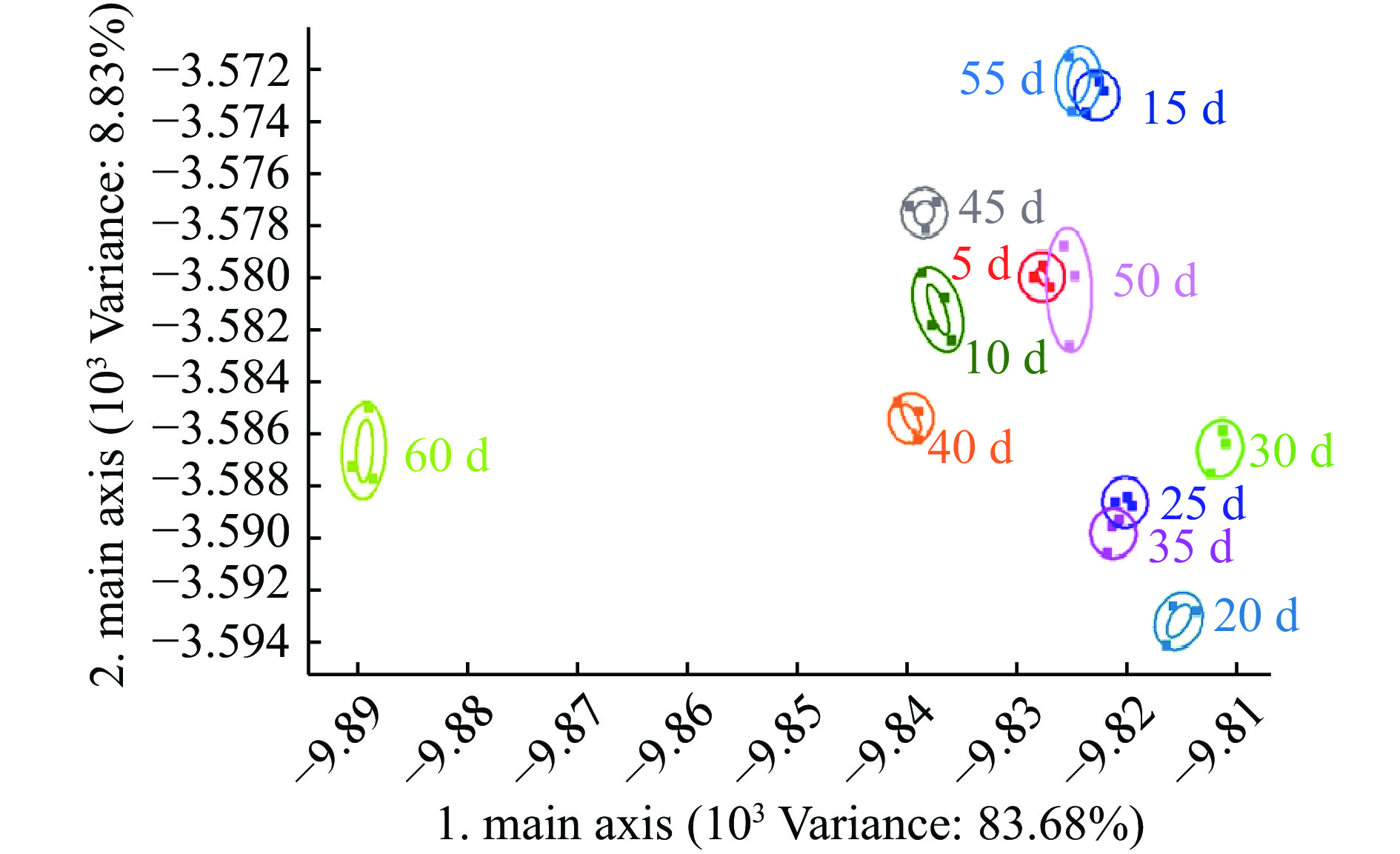
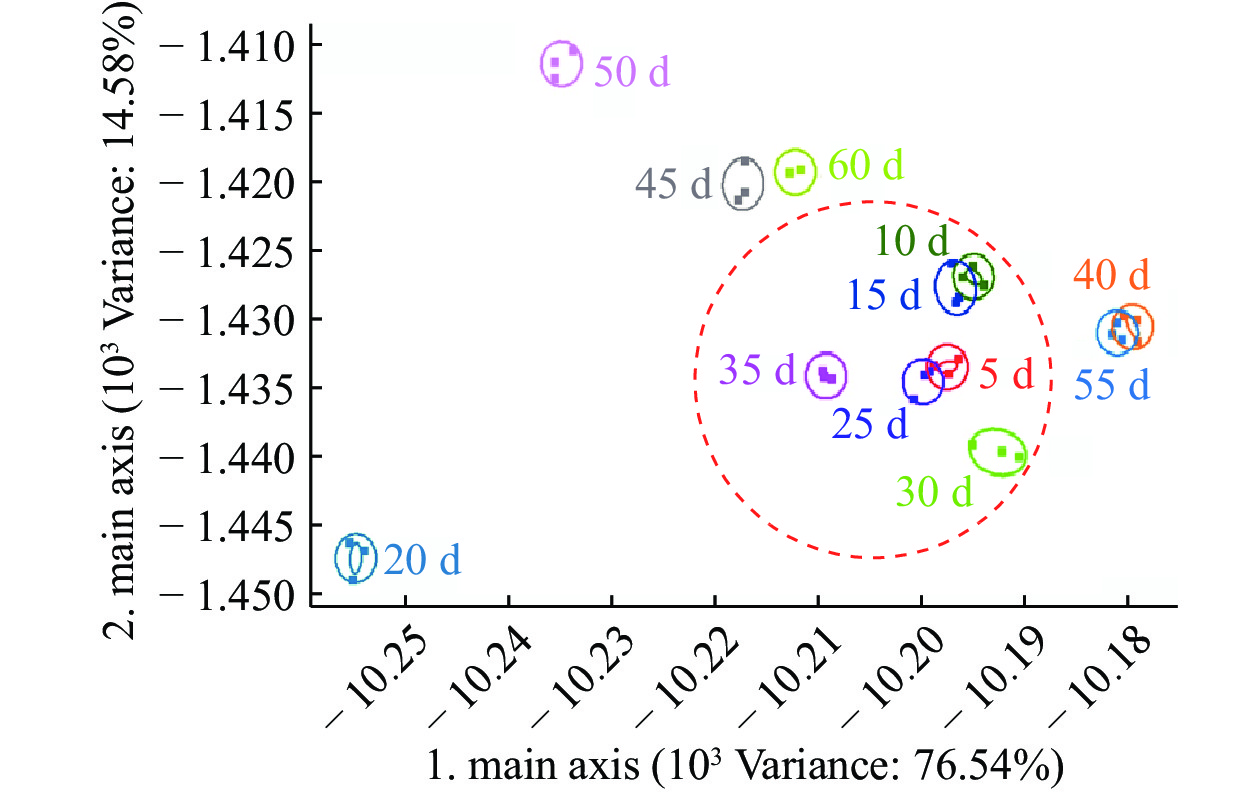
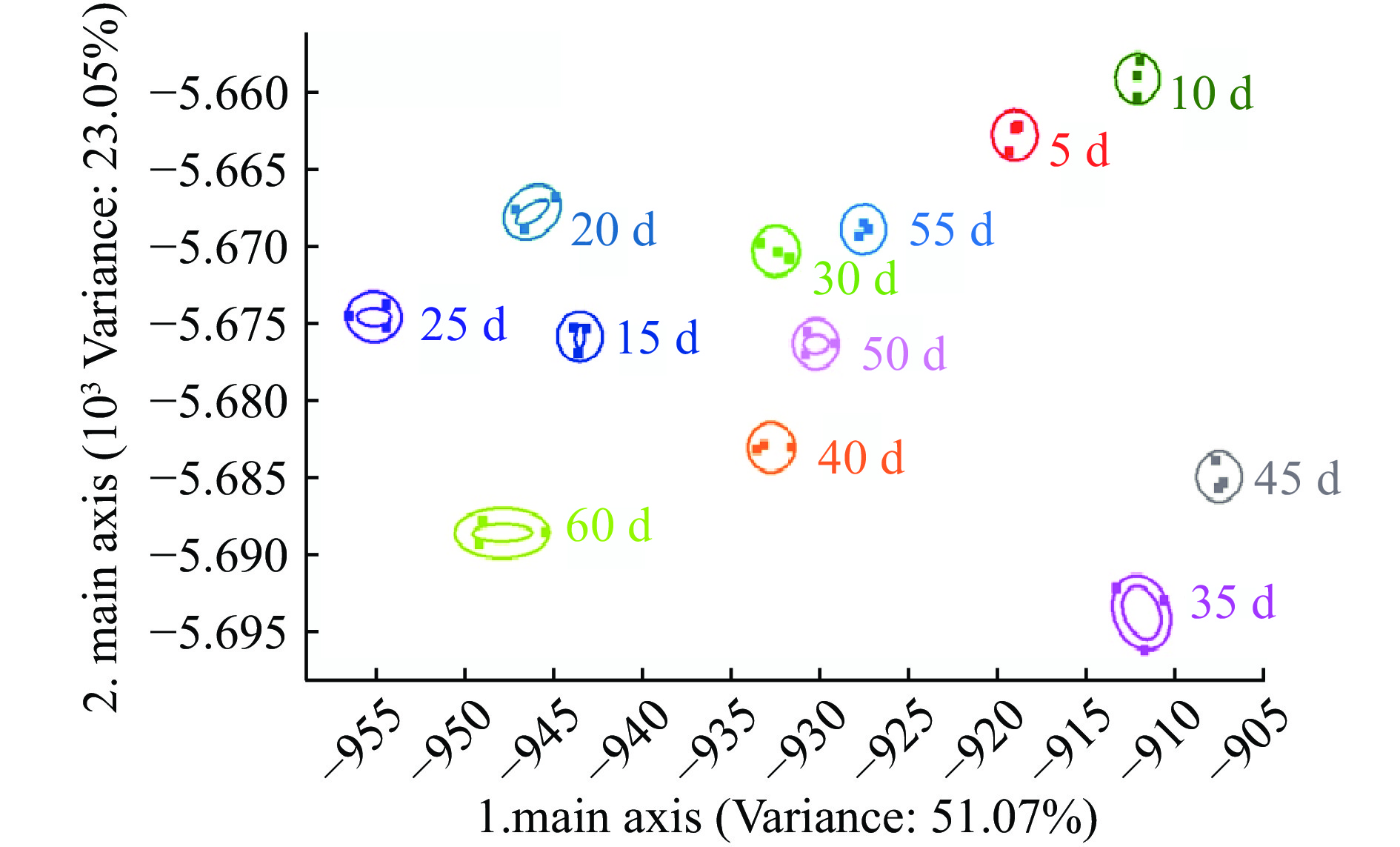
图4、图5和图6分别为草鱼内脏粗鱼油在4、25和37 ℃贮藏条件下贮藏60 d内的PCA图谱。4 ℃贮藏条件下第一、第二主成分的贡献率分别为97.36%和2.33%,总贡献率达99.69%;25 ℃贮藏条件下第一、第二主成分的贡献率分别为96.91%和2.73%,总贡献率达99.64%;37 ℃贮藏条件下第一、第二主成分的贡献率分别为98.80%和0.93%,总贡献率达99.73%。说明主成分可以较好地反映在4、25、37 ℃贮藏条件下不同贮藏时间内草鱼内脏粗鱼油挥发性气味的特征信息。
取测试结果传感器的峰值做鱼油储藏期间的PCA分析,由图4、图5和图6可看出:4 ℃下储藏55 d内鱼油在气味上并不会发生太大的变化,在图中分布集中,挥发性气味的聚集可能是由于低温环境下鱼油氧化反应缓慢引起的,与陈娜等[14]研究结果一致;而储藏达到60 d时气味与前55 d的样品表现出较明显差异。在25 ℃和37 ℃下储藏时,整个储藏期间鱼油气味的变化均较为明显,从横坐标的跨度来看,气味成分没有明显的聚集现象,贮藏期间的气味成分基本能区分开来,可见高温下鱼油气味很快就会发生较大的变化,这可能是由于高温下鱼油开始加速发生了氧化酸败造成的。
2.3.3 草鱼内脏粗鱼油贮藏过程中挥发性成分的线性判别分析(LDA)
LDA图谱中,不同样品横坐标距离越大代表样品间差异越大。取测试结果传感器的峰值做鱼油储藏期间的LDA分析,图7、图8和图9分别表示草鱼内脏粗鱼油在4、25和37 ℃贮藏条件下贮藏60 d内的LDA图。从图中可以看出,总贡献率分别为92.51%、91.12%和74.12%,说明在4、25、37 ℃贮藏条件下不同贮藏时间内草鱼内脏粗鱼油线性判别分析结果能代表绝大部分挥发性气味信息。
从图 7、图 8和图 9可看出:4 ℃ 下储藏 55 d内鱼油在气味上未发生太大的变化,在图中分布集中,而储藏达到60 d时气味与前55 d的样品表现出明显的差异;25 ℃下储藏条件下,贮藏35 d内气味成分比较集中,40 d后鱼油气味的变化明显;37 ℃下储藏期间鱼油气味的变化区别于4 ℃和25 ℃,在LDA图中12个时间段的鱼油分布更为分散,气味成分完全区分,说明37 ℃贮藏条件下的挥发性气味成分变化明显,更容易发生氧化酸败。虽然PCA法总贡献率高于LDA法,但是LDA法区分效果比PCA方法好,可以更加直观地看到草鱼内脏鱼油在不同贮藏温度和时间内挥发性气味成分的变化。
2.3.4 草鱼内脏粗鱼油贮藏过程中挥发性成分的载荷分析(Loadings)
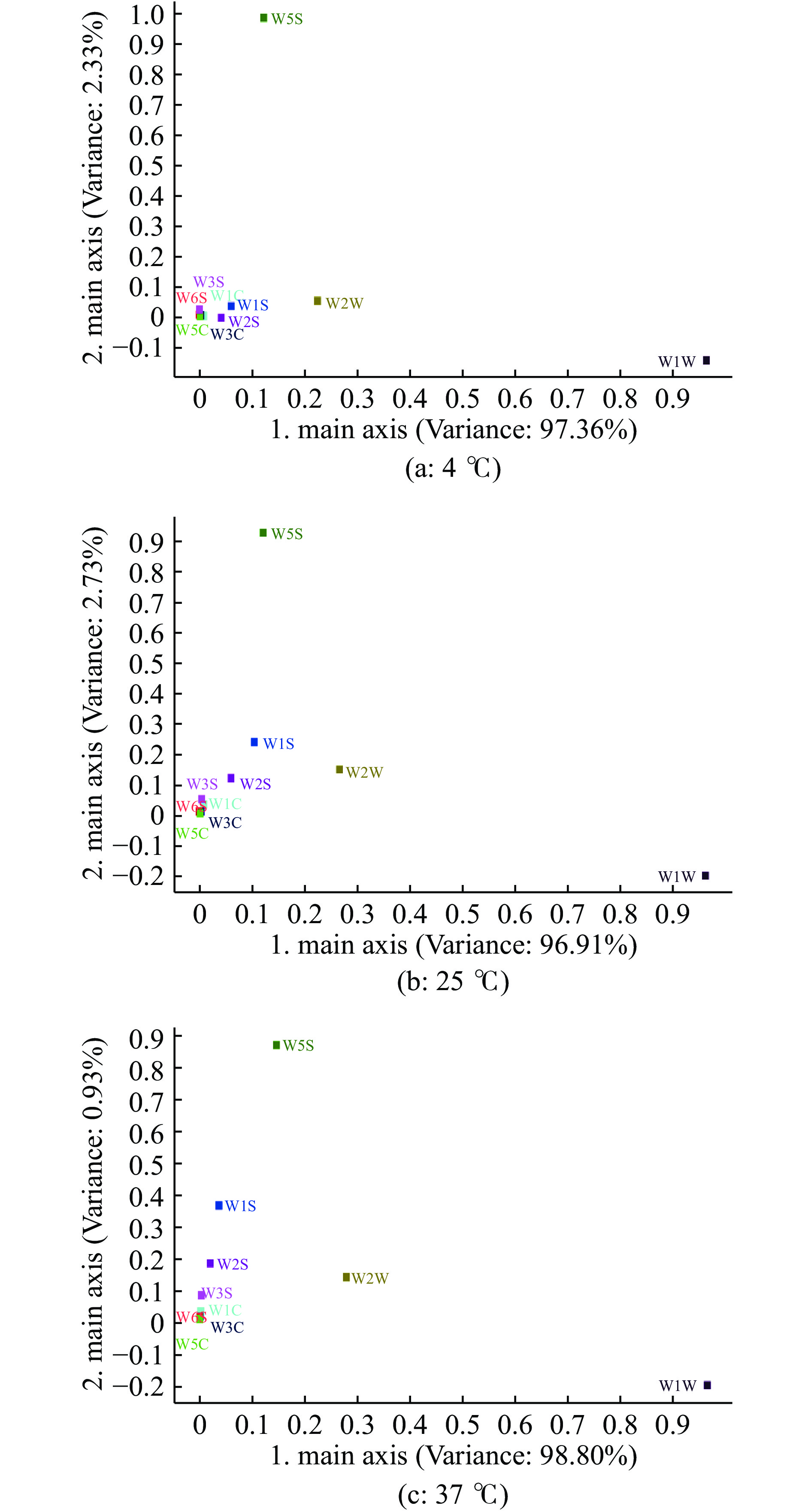
从图10可以看出,在贮藏温度为4 ℃时,对第一主成分贡献最大的是7号W1W传感器,其次是9号W2W和2号W5S传感器(对第二主成分有很大的贡献);在贮藏温度为25 ℃时,对第一主成分贡献最大仍是7号W1W传感器,其次是9号W2W和2号W5S传感器(对第二主成分有很大的贡献),此时6号W1S和8号W2S传感器对第二主成分的贡献也较为明显;而在贮藏温度为37 ℃时,对第一主成分贡献最大仍是 7 号 W1W 传感器,其次是 9 号 W2W 和 2 号 W5S(对第二主成分有很大的贡献),6号W1S和8号W2S传感器对第二主成分的贡献相对25 ℃时更大。考虑到第一主成分的贡献率要远高于第二主成分的贡献率,传感器W1S和W2S对鱼油气味的影响可忽略不计,因此,对草鱼内脏鱼油气味的影响较大的主要为W1W,其次为W2W和W5S,与雷达图分析结果一致,可见鱼油气味上的变化主要来自于硫化物、芳香成分和氮氧化合物等物质。
3. 结论
不同贮藏温度和时间对草鱼内脏粗鱼油品质变化影响较大,温度越高或时间越长,越容易发生氧化酸败,以酸价和过氧化值作为鱼油是否变质的评判标准,4 ℃时保质期约为55 d,25 ℃时保质期约为40 d,37 ℃时保质期约为30 d。
利用电子鼻技术分析草鱼内脏粗鱼油在不同贮藏温度和时间条件下挥发性气味成分的变化。通过指纹特征分析、主成分分析(PCA)、线性判别分析(LDA)以及载荷分析可知:在低温贮藏条件下(4 ℃)草鱼内脏粗鱼油的挥发性气味成分变化不明显,25 ℃和37 ℃下草鱼内脏粗鱼油的挥发性气味成分发生了明显变化,并且气味成分的变化趋势与其对应的过氧化值和酸值基本一致;LDA分析方法优于PCA分析,鱼油贮藏过程中的挥发性成分主要为氮氧化合物、硫化物和芳香成分等物质。
-
表 1 电子鼻传感器性能
Table 1 Electronic nose sensor performance
序号 传感器
名称响应特性 成分(mL/m3) 1 W1C 芳香成分aromatic 苯类,10 2 W5S 灵敏度大,对氮氧化合物灵敏broadrange 二氧化氮,1 3 W3C 对芳香成分灵敏,氨类aromatic 苯,10 4 W6S 对氢气有选择性hydrogen 氢气,100 5 W5C 烷烃芳香成分arom-aliph 丙烷,1 6 W1S 对甲基类成分灵敏broad-methane 甲烷,100 7 W1W 对硫化物灵敏sulphur-organic 硫化氢,1 8 W2S 对醇类成分灵敏broad-alcohol 一氧化碳,100 9 W2W 对有机硫化物和芳香成分灵敏sulph-chlor 硫化氢,1 10 W3S 对烷烃类成分灵敏methane-aliph 甲烷,10 -
[1] 顾盼祺, 魏晓倩, 赵利, 等. 酶法提取淡水鱼内脏鱼油的工艺优化[J]. 中国调味品,2021,46(3):95−99. [GU Panqi, WEI Xiaoqian, ZHAO Li, et al. Optimization of enzymatic extraction of visceral fish oil from freshwater fish[J]. Chinese Condiment,2021,46(3):95−99. doi: 10.3969/j.issn.1000-9973.2021.03.019 [2] 王文婷, 苏博, 杜丹丹, 等. 酶解法提取鲫鱼下脚料中鱼油的工艺研究[J]. 兰州文理学院学报(自然科学版),2019,33(3):48−52. [WANG Wenting, SU Bo, DU Dandan, et al. Study on the technology of enzymatic extraction of fish oil from crucian carp waste[J]. Journal of Lanzhou University of Arts and Sciences (Natural Science Edition),2019,33(3):48−52. [3] 汪学荣, 周玲, 吴青. 三文鱼油超声波辅助提取工艺及脂肪酸组成分析[J]. 中国油脂,2019,44(2):23−26. [WANG Xuerong, ZHOU Ling, WU Qing. Ultrasonic assisted extraction process and fatty acid composition analysis of salmon oil[J]. China Oil and Fat,2019,44(2):23−26. doi: 10.3969/j.issn.1003-7969.2019.02.006 [4] 赵保堂, 孙栋, 刘东, 等. 虹鳟鱼油的超声波辅助法提取及其脂肪酸组成分析[J]. 中国油脂,2019,44(3):20−24. [ZHAO Baotang, SUN Dong, LIU Dong, et al. Ultrasonic assisted extraction of rainbow trout oil and its fatty acid composition analysis[J]. China Oil and Fat,2019,44(3):20−24. [5] 李雪, 曹君, 白新鹏, 等. 微波辅助萃取罗非鱼鱼油工艺优化及脂肪酸分析[J]. 食品工业科技,2018,39(4):159−165. [LI Xue, CAO Jun, BAI Xinpeng, et al. Microwave assisted extraction of tilapia fish oil and fatty acid analysis[J]. Science and Technology of Food Industry,2018,39(4):159−165. [6] CREXI V T, MONTE M L, DE SOUZA SOARES L A, et al. Production and refinement of oil from carp (Cyprinus carpio) viscera[J]. Food Chemistry,2010,119(3):945−950. doi: 10.1016/j.foodchem.2009.07.050
[7] ADEOTI I A, HAWBOLDT K. A review of lipid extraction from fish processing by-product for use as a biofuel[J]. Biomass and Bioenergy,2014,63:330−340. doi: 10.1016/j.biombioe.2014.02.011
[8] 刘晓丽, 魏长庆, 詹晓北, 等. 超声辅助制备草鱼鱼油微胶囊及其贮藏稳定性和降血脂作用研究[J]. 食品与机械,2019,38(9):163−168. [LIU Xiaoli, WEI Changqing, ZHAN Xiaobei, et al. Ultrasound assisted preparation of grass carp fish oil microcapsules and their storage stability and lipid-lowering effects[J]. Food and Machinery,2019,38(9):163−168. doi: 10.13652/j.issn.1003-5788.2019.09.032 [9] DAS U N. Estrogen, statins, and polyunsaturated fatty acids: Similarities in their actions and benefits-is there a common link?[J]. Nutrition,2002,18(18):178−188.
[10] 陈静茹, 王梁, 吕学泽, 等. 北京油鸡肉4 ℃贮藏过程中的品质及风味变化[J]. 肉类研究,2018,32(8):1−6. [CHEN Jingru, WANG Liang, LÜ Xueze, et al. Quality and flavor changes of Beijing chicken oil during storage at 4 ℃[J]. Meat Research,2018,32(8):1−6. [11] HARALDSSONl G G, HJALTASON B. Fish oils as sources of important polyunsaturated fatty acids[M]. Structured and Modified Lipids. New York: Marcel Dekker, Inc. 2001: 313-350.
[12] 宋恭帅, 张蒙娜, 彭茜, 等. 不同贮藏温度下鱼油品质的变化[J]. 食品科学,2018,39(21):237−244. [SONG Gongshuai, ZHANG Mengna, PENG Qian, et al. Changes of fish oil quality under different storage temperatures[J]. Food Science,2018,39(21):237−244. doi: 10.7506/spkx1002-6630-201821036 [13] 朱迎春, 张坤生, 霍乃蕊, 等. 鲶鱼下脚料中鱼油的提取及贮藏稳定性研究[J]. 天津科技大学学报,2015,30(3):29−33. [ZHU Yingchun, ZHANG Kunsheng, HUO Nairui, et al. Study on extraction and storage stability of fish oil from catfish offal[J]. Journal of Tianjin University of Science and Technology,2015,30(3):29−33. [14] 陈娜, 陈小娥, 方旭波, 等. 基于电子鼻和气质联用技术分析鱼油挥发性成分[J]. 中国粮油学报,2017,32(10):179−184. [CHEN Na, CHEN Xiaoe, FANG Xubo, et al. Analysis of volatile components in fish oil based on electronic nose and GC-MS[J]. Chinese Journal of Cereals and Oils,2017,32(10):179−184. doi: 10.3969/j.issn.1003-0174.2017.10.030 [15] 陈娜, 陈小娥, 方旭波, 等. 基于电子鼻分析鱼油储藏过程中酸败程度的研究[J]. 中国粮油学报,2016,31(10):125−130. [CHEN Na, CHEN Xiao'e, FANG Xubo, et al. Study on the rancidity of fish oil during storage based on electronic nose[J]. Chinese Journal of Cereals and Oils,2016,31(10):125−130. doi: 10.3969/j.issn.1003-0174.2016.10.021 [16] JOSEPHSON D B, LINDSAY R C, STUIBER D A. Volatile compounds characterizing the aroma of fresh Atlantic and Pacific oysters[J]. Journal of Food Science,1984,50(1):5−9.
[17] 何定芬, 谢超, 李桂芬, 等. 响应面法优化鲣鱼(Katsuwonus pelamis)内脏鱼油酶法提取工艺[J]. 食品工业科技,2019,40(7):179−184. [HE Dingfen, XIE Chao, LI Guifen, et al. Optimization of enzymatic extraction process of skipjack (Katsuwonus pelamis) visceral fish oil by response surface methodology[J]. Science and Technology of Food Industry,2019,40(7):179−184. [18] 国家卫生和计划生育委员会. 食品安全国家标准 食品中酸价的测定: GB 5009.229—2016[S]. 北京: 中国标准出版社, 2016: 1−2 National Health and Family Planning Commission. National food safety standard Determination of acid value in food: GB 5009.229-2016[S]. Beijing: China Standards Press, 2016: 1−2.
[19] 国家卫生和计划生育委员会. 食品安全国家标准 食品中过氧化值的测定: GB 5009.227—2016[S]. 北京: 中国标准出版社, 2016: 1−2 National Health and Family Planning Commission. National food safety standard Determination of peroxide value in food: GB 5009.227-2016[S]. Beijing: China Standards Press, 2016: 1−2.
[20] 杨震, 贡慧, 刘梦, 等. 基于电子鼻技术的秋刀鱼新鲜度评价[J]. 肉类研究,2017,31(3):40−44. [YANG Zhen, GONG Hui, LIU Meng, et al. Evaluation of saury freshness based on electronic nose technology[J]. Meat Research,2017,31(3):40−44. doi: 10.7506/rlyj1001-8123-201703008 [21] 谢云辉, 李国辉. 电子鼻在食品快速检测方面的应用[J]. 食品安全导刊,2019(9):114−115. [XIE Yunhui, LI Guohui. Application of electronic nose in rapid food detection[J]. Food Safety Guide,2019(9):114−115. [22] ZHANG M X, WANG X C, LIU Y, et al. Species discrimination among three kinds of puffer fish using an electronic nose combined with olfactory sensory evaluation[J]. Sensors,2012,12:12562−12571. doi: 10.3390/s120912562
[23] 蒋强, 郑丽敏, 田立军, 等. 电子鼻应用于猪肉丸子香味预测[J]. 食品科学,2018,39(10):228−233. [JIANG Qiang, ZHENG Limin, TIAN Lijun, et al. Application of electronic nose in prediction of pork meatball flavor[J]. Food Science,2018,39(10):228−233. doi: 10.7506/spkx1002-6630-201810035 [24] 王霞, 黄健, 侯云丹, 等. 电子鼻结合气相色谱-质谱联用技术分析黄鳍金枪鱼肉的挥发性成分[J]. 食品科学,2012,33(12):268−272. [25] 中华人民共和国农业部. 中华人民共和国水产行业标准 鱼油: SC/T 3502-2016[S]. 北京: 中国标准出版社, 2016: 2−3 Ministry of Agriculture of the People's Republic of China. Fishery industry standard of the People's Republic of China fish oil: SC/T 3502-2016[S]. Beijing: China Standards Press, 2016: 2−3.
[26] SKARA T, SIVERTSVIK M, BIRKELAND S. Production of salmon oil from filleting byproducts-effects of storage conditions on lipid oxidation and content of ω-3 polyunsaturated fatty acids[J]. Journal of Food Science,2015,69(8):E417−E421.
[27] FONTAGNÉ S, BAZIN D, BRÈQUE J, et al. Effects of dietary oxidized lipid and vitamin A on the early development and antioxidant status of Siberian sturgeon (Acipenser baeri) larvae[J]. Aquaculture,2006,257:400−411. doi: 10.1016/j.aquaculture.2006.01.025
[28] MENEGAZZO M L, PETENUCI M E, FONSECA G G. Production and characterization of crude and refined oils obtained from the co-products of Nile tilapia and hybrid sorubim processing[J]. Food Chemistry,2014,157:100−104. doi: 10.1016/j.foodchem.2014.01.121
[29] RAMAKRISHNAN T V, FRANCIS F J. Coupled oxidation of carotenoids in fatty acid esters of varying unsaturation[J]. Journal of Food Quality,1979,2(4):277−287. doi: 10.1111/j.1745-4557.1979.tb00679.x
[30] 董小林, 董桂芳, 朱晓鸣, 等. 不同温度条件下鱼油氧化的动态变化[J]. 中国油脂,2012,37(7):36−40. [DONG Xiaolin, DONG Guifang, ZHU Xiaoming, et al. Dynamic changes of fish oil oxidation under different temperature conditions[J]. China Grease,2012,37(7):36−40. doi: 10.3969/j.issn.1003-7969.2012.07.010





 下载:
下载:


 下载:
下载:



