Optimization of Extraction Process of Polysaccharides from Olea europaea L. Leaves and Its Physicochemical Properties and Antioxidant Activity
-
摘要: 为增加油橄榄叶多糖的开发利用价值,以油橄榄叶为实验材料,采用正交试验优化油橄榄叶多糖(OLP)的提取工艺,高效凝胶渗透色谱-多角度激光光散射仪联用(HPGPC-MALLS)测定分子量,PMP柱前衍生高效液相色谱法分析OLP的单糖组成,并评价其抗氧化活性。结果显示,OLP的最佳提取工艺条件为料液比1:27.5 g/mL,温度95 ℃,提取时间3.5 h,在此条件下OLP的得率为2.75%;OLP的重均分子量(Mw)为25.36 kDa,数均分子量(Mn)为19.32 kDa,多分散系数为1.313;OLP主要由葡萄糖(Glc)、半乳糖(Gal)和氨基半乳糖(GalN)组成,还含有鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、甘露糖(Man)和氨基葡萄糖(GlcN)等单糖,各单糖的相对摩尔比为56.2:15.9:10.3:8.3:5.9:2.6:0.5:0.3;抗氧化活性实验结果发现,OLP具有较好的抗氧化活性,对羟自由基、超氧阴离子自由基和DPPH自由基的半数抑制浓度(IC50)分别为0.422、0.302和0.268 mg/mL。本研究所得油橄榄叶多糖的提取工艺简单、得率高、抗氧化活性好,为油橄榄叶多糖的进一步研究和开发利用提供了重要参考。Abstract: In order to increase the development and utilization value of polysaccharides from Olea europaea L. leaves, the extraction process of polysaccharides from Olea europaea L. leaves (OLP) was optimized by orthogonal experiment, the molecular weight was determined by high performance gel permeation chromatography combined with multi-angle laser light scattering (HPGPC-MALLS), and the monosaccharide composition of OLP was analyzed by PMP pre-column derivatization and its antioxidant activity was evaluated. The results showed that the optimal extraction conditions were material-liquid ratio of 1:27.5 g/mL, extraction temperature of 95 ℃ and extraction time of 3.5 h. Under these conditions, the yield of OLP was 2.75%. The average weight molecular weight (Mw) of OLP was 25.36 kDa, the average number molecular weight (Mn) was 19.32 kDa, and the polydispersity was 1.313. OLP was mainly composed of glucose (Glc), galactose (Gal) and galactose amino (GalN), but also contains rhamnose (Rha), arabinose (Ara), xylose (Xyl), mannose (Man) and glucosamine (GlcN), and the relative molar ratio of monosaccharide was 56.2:15.9:10.3:8.3:5.9:2.6:0.5:0.3. The results showed that OLP had good antioxidant activity, with IC50 of 0.422, 0.302 and 0.268 mg/mL for hydroxyl free radical, superoxide anion free radical and DPPH free radical, respectively. The optimum technology of OLP is simple, the yield is high, and the antioxidant activity is good, which provides an essential reference for the further research, development and utilization of OLP.
-
油橄榄(Olea europaea L.)系木犀科木犀榄属常绿乔木,是重要的木本油料和果用树种,原产于地中海地区,在我国甘肃、云南、四川和福建等地有广泛分布[1-3],现有种植面积已超过120万亩。油橄榄树在进行修剪和果实采摘过程中会产生大量的副产物油橄榄叶,目前对于油橄榄叶没有进行有效的利用。研究发现,油橄榄叶中含有黄酮、多酚、多糖等生物活性成分[4-6],多糖作为生物大分子具有重要的生理活性,在食品、化妆品、保健品、药品和医用材料等领域已有广泛应用[7-9]。
多糖由于其多羟基的结构特点,易溶于水,不溶于乙醇等有机溶剂。热水提取法是目前多糖提取中最常用的方法,材料经过粉碎、脱脂等前处理后经热水提取,提取液加入一定浓度的乙醇,收集沉淀可获得粗多糖。除此之外,微波、超声波、超临界萃取、超高压等技术也可用于多糖的辅助提取,也有通过酶的作用破坏细胞壁来提高多糖的提取效果[10]。利用油橄榄叶提取多糖,不仅能够充分利用油橄榄叶这一资源,同时也可以为功能性多糖提供新的来源。邓建梅等[11]通过微波辅助提取油橄榄叶多糖,在最佳工艺条件下油橄榄叶的多糖得率为12.4535 mg/g。原姣姣等[12]通过响应面优化了超声-酶辅助油橄榄叶多糖的提取工艺,发现先用酶解处理,之后再进行超声提取可以提高提取率,在优化的工艺条件下油橄榄叶多糖的提取率可以达到4.50%。王布雷等[13]从油橄榄叶提取了一种由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成的酸性杂多糖,活性研究发现该多糖具有良好的抗氧化作用,对革兰氏阴性细菌的抑制能力强于革兰氏阳性细菌。而对于油橄榄叶多糖的精细结构及活性方面的深入研究相对较少,多糖的结构复杂,活性与结构密切相关,研究发现不同的方法提取获得的多糖组成不同,结构和性质存在差异,造成多糖的活性不稳定及质量控制难度大。热水提取是多糖最常用的提取方法,方法稳定,重复性好,获得的多糖结构稳定。因此,本研究采用正交试验优化油橄榄叶多糖的热水提取工艺,通过红外光谱、分子量及单糖组成分析进行多糖结构的初步分析,并评价多糖的抗氧化活性,为油橄榄叶多糖的进一步开发利用提供参考,为油橄榄叶的综合利用奠定基础。
1. 材料与方法
1.1 材料与仪器
油橄榄叶 采于甘肃省陇南市,经鉴定为木犀科植物油橄榄(Olea europaea L.)的叶子;乙腈 色谱纯,德国Merck公司;1-苯基-3-甲基-5-吡唑啉酮(PMP) 分析纯,上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、系列单糖标准品(甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、氨基半乳糖、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖) 分析纯,Sigma-Aldrich公司;其它化学试剂均为国产分析纯。
AB104-N型分析天平 梅特勒-托利多仪器公司;FD-1-55型冷冻干燥机 北京博医康实验仪器有限公司;RE-52CS-2型旋转蒸发仪 上海亚荣生化仪器厂;SHB-IIIA型循环水式真空泵 郑州长城科工贸有限公司;UV-9200紫外可见分光光度计 北京瑞利分析仪器公司;Agilent1260高效液相色谱仪、Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm) 美国安捷伦公司;Frontier红外光谱仪 美国Perkin Elmer公司;Dawn型多角度激光光散射仪 美国Wyatt公司;OHpak SB-806M HQ凝胶色谱柱(8.0 mm×300 mm) 日本昭和电工;TG16-WS型低速大容量离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 油橄榄叶前处理
油橄榄叶阴凉处晾干后粉碎机粉碎,过60目筛,用80%乙醇80 ℃加热回流脱脂4次,每次2 h,脱脂后的油橄榄叶粉末干燥后备用[14]。
1.2.2 油橄榄叶多糖提取单因素实验
以影响多糖得率的料液比、温度和时间为考察因素,研究不同单因素对油橄榄叶多糖得率的影响。分别称取脱脂后油橄榄叶粉末2 g于三口烧瓶中,置恒温磁力加热搅拌器水浴中分别按以下条件提取:在80 ℃、提取时间为3 h条件下,考察提取料液比(1:20、1:25、1:30、1:35和1:40 g/mL)对多糖得率的影响;在料液比为1:30 g/mL、提取时间为3 h的条件下,考察提取温度(50、60、70、80、90、95 ℃)对多糖得率的影响;在料液比为1:30 g/mL、提取温度为80 ℃的条件下,考察提取时间(1、2、3、4和5 h)对多糖得率的影响[15]。每组实验重复3次,计算多糖得率。
1.2.3 正交试验设计
在1.2.2单因素实验的基础上,对3个影响因素进行三因素三水平L9(34)正交试验,根据多糖得率对结果进行分析[16],正交试验设计因素水平见表1。
表 1 正交试验因素水平Table 1. Orthogonal assay factors and levels水平 因素 A 料液比
(g/mL)B 温度
(℃)C 时间
(h)1 1:27.5 85 2.5 2 1:30.0 90 3.0 3 1:32.5 95 3.5 1.2.4 多糖得率的计算
采用硫酸-苯酚法[17]测定总糖含量,参考文献[18]按以下公式计算不同条件下油橄榄叶的多糖得率:
多糖得率(%)=多糖质量/原料质量×100 1.2.5 油橄榄叶多糖的纯化
根据正交试验优化的提取工艺条件提取油橄榄叶多糖,提取液经减压浓缩,乙醇沉淀后复溶于蒸馏水,用透析袋(截留分子量为7 kDa)对蒸馏水透析3 d,透析液减压浓缩后冷冻干燥,得油橄榄叶多糖OLP,用于后续理化性质分析及抗氧化活性评价[18]。
1.2.6 红外光谱分析
油橄榄叶多糖置于装有P2O5的真空干燥箱中,50 ℃真空干燥至恒重,后取2~3 mg用KBr压片,在4000~400 cm−1范围内进行红外光谱扫描,记录红外光谱图[19]。
1.2.7 分子量分析
高效凝胶渗透色谱-多角度激光光散射仪联用(HPGPC-MALLS)测定分子量,OLP用0.1 mol/L Na2SO4溶液溶解为5 mg/mL,0.22 μm微孔滤膜过滤后备用。分析用色谱柱为OHpak SB-806M HQ,流动相为0.1 mol/L Na2SO4溶液,进样量100 μL,流速0.6 mL/min,柱温35 ℃,示差检测器(RID)和多角激光光散射仪(MALLS)串联在线检测,用Astra 5.3.4.20工作软件进行数据处理,计算OLP重均分子量(Mw)、数均分子量(Mn)以及分散系数[20-21]。
1.2.8 单糖组成分析
采用PMP柱前衍生高效液相色谱法测定油橄榄叶多糖的单糖组成。取OLP 3 mg溶于300 μL 2 mol/L三氟乙酸(TFA),加入安瓿瓶后封口,在105 ℃条件下水解6 h,水解液氮吹仪吹干后反复加甲醇3次吹干,除去TFA[22]。水解产物溶解于100 μL蒸馏水中,加入100 μL 0.3 mol/L NaOH和120 μL 0.5 mol/L PMP溶液在70 ℃水浴中反应1 h,反应物冷却后加入100 μL 0.3 mol/L HCl溶液中和,后用三氯甲烷萃取3次以除去未反应的PMP,收集水相经0.22 μm微孔滤膜过滤,备用。不同单糖标准品采用同样方法进行衍生和处理[23-24]。
HPLC测定单糖组成色谱分析条件:色谱柱为Eclipse XDB-C18 (4.6 mm×150 mm,5 μm),流动相为磷酸盐缓冲液:乙腈=83:17(V/V),流速1.0 mL/min,柱温25 ℃,紫外检测器245 nm在线检测,根据标准品和样品出峰时间确定单糖种类,根据峰面积计算各单糖相对摩尔比[23-24]。
1.2.9 抗氧化活性的评价
取1.2.5所得OLP,用蒸馏水配制浓度分别为0.1、0.25、0.5、1、2.5和3 mg/mL溶液,按以下方法进行抗氧化活性评价。
羟自由基清除能力测定:分别取不同浓度OLP 1 mL于试管中,等体积蒸馏水作为空白对照,依次加入9 mmol/L Fe2SO4溶液1 mL、8.8 mmol/L H2O2 1 mL和9 mmol/L水杨酸溶液1 mL后混匀,在37 ℃水浴恒温反应15 min,VC作为阳性对照,在510 nm处测定吸光值[25-26]。用公式(1)计算样品对羟基自由基的清除率:
清除率(%)=(1−A/A0)×100 (1) 式中:A0:空白对照组吸光值;A:样品吸光值。
超氧阴离子清除能力测定:分别取不同浓度OLP 1 mL于试管中,等体积蒸馏水为空白对照,立即加入3 mL 0.05 mol/L Tris-HCl (pH8.2)溶液混匀,37 ℃水浴加热10 min后加入2 mL 30 mmol/L邻苯三酚溶液反应5 min,加入1 mL 8 mol/L HCl中止反应,VC作为阳性对照,320 nm处测定吸光值[25-26]。代入公式(1)计算样品对超氧阴离子自由基的清除率。
DPPH自由基清除能力测定:分别取不同浓度OLP 2 mL于试管中,等体积蒸馏水为空白对照,分别加入2 mL 0.1 mmol/mL DPPH乙醇溶液混匀,避光静置30 min,VC作为阳性对照。517 nm处测定吸光值[25-26]。代入公式(1)计算样品对DPPH自由基的清除率。
1.3 数据处理
实验均进行3次重复,结果用平均值±标准偏差表示,采用Origin 9.0软件进行数据处理和作图;利用SPSS 17.0软件进行IC50计算。
2. 结果与分析
2.1 单因素实验结果
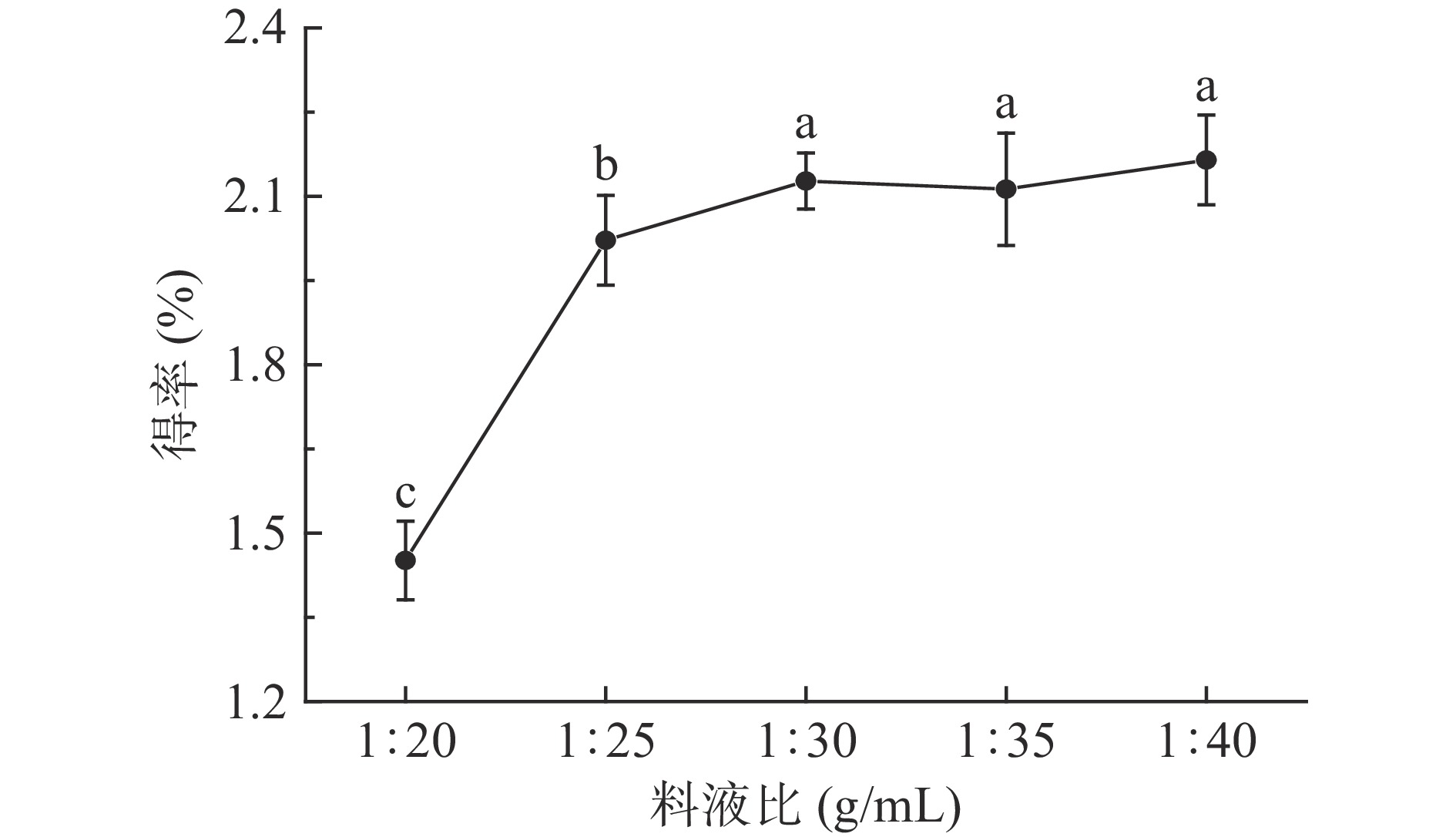
2.1.1 料液比对多糖得率的影响
从图1可以看出,在料液比为1:20~1:30 g/mL时,随着提取溶剂量的增加,油橄榄叶多糖的得率在不断增加,当料液比达到1:30 g/mL时多糖得率为2.13%,经过显著性检验发现继续增加提取溶剂的量多糖得率没有明显增加,说明多糖的溶出达到了平衡,从节约溶剂以及后续多糖提取液浓缩能耗的角度考虑,选择料液比1:30 g/mL为正交试验设计的中心值。
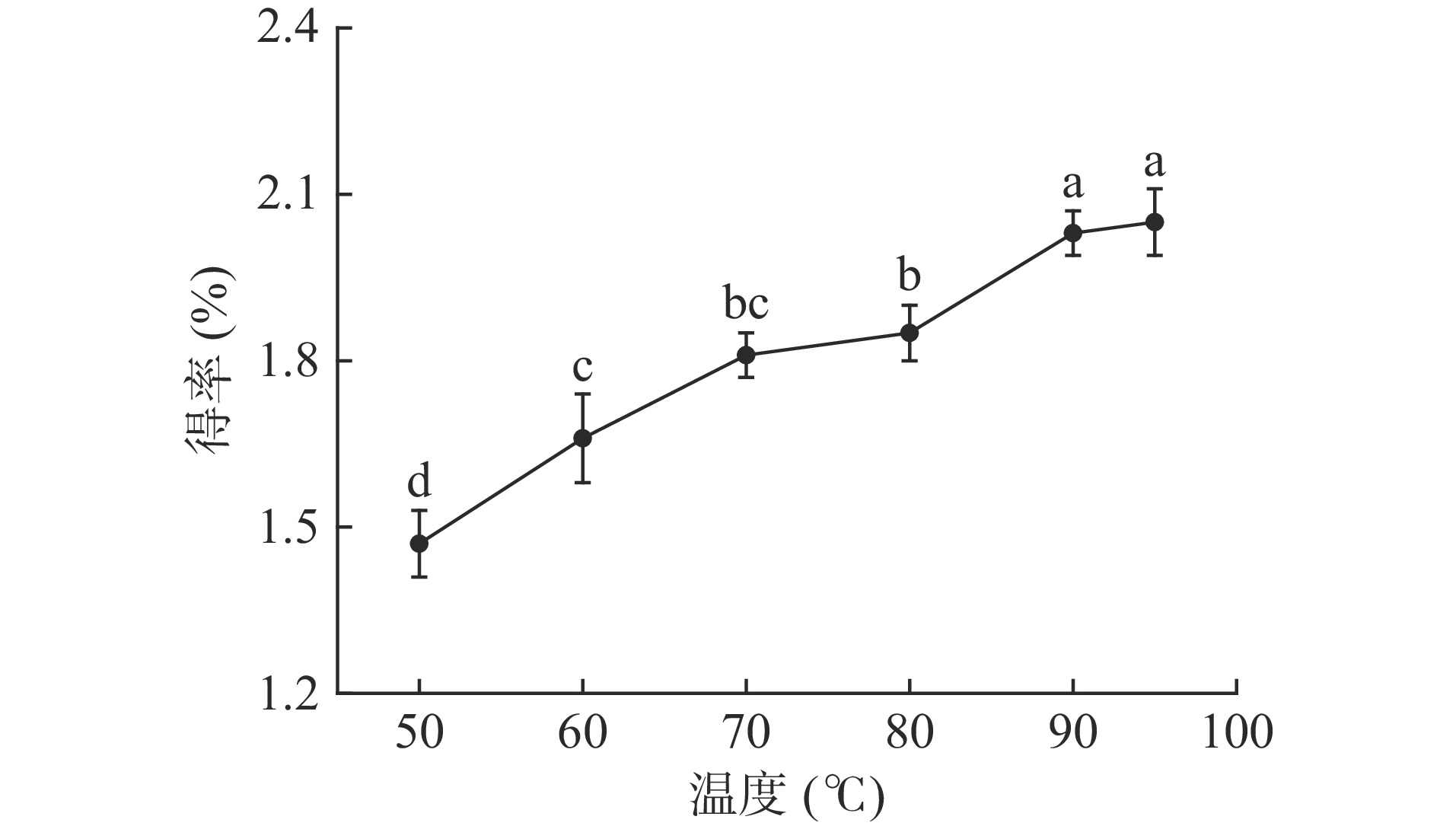
2.1.2 温度对多糖得率的影响
从图2可以看出,提取温度对OLP得率有明显的影响,随着温度的升高,多糖得率也在增加,随着温度的升高油橄榄叶细胞壁的破坏程度也增加,有利于多糖的溶出,当温度达到90 ℃时多糖得率为2.03%,从提取过程水浴加热方式温度的限制及提取温度升高造成溶剂挥发等方面考虑,选择90 ℃为正交试验工艺优化的中心值。
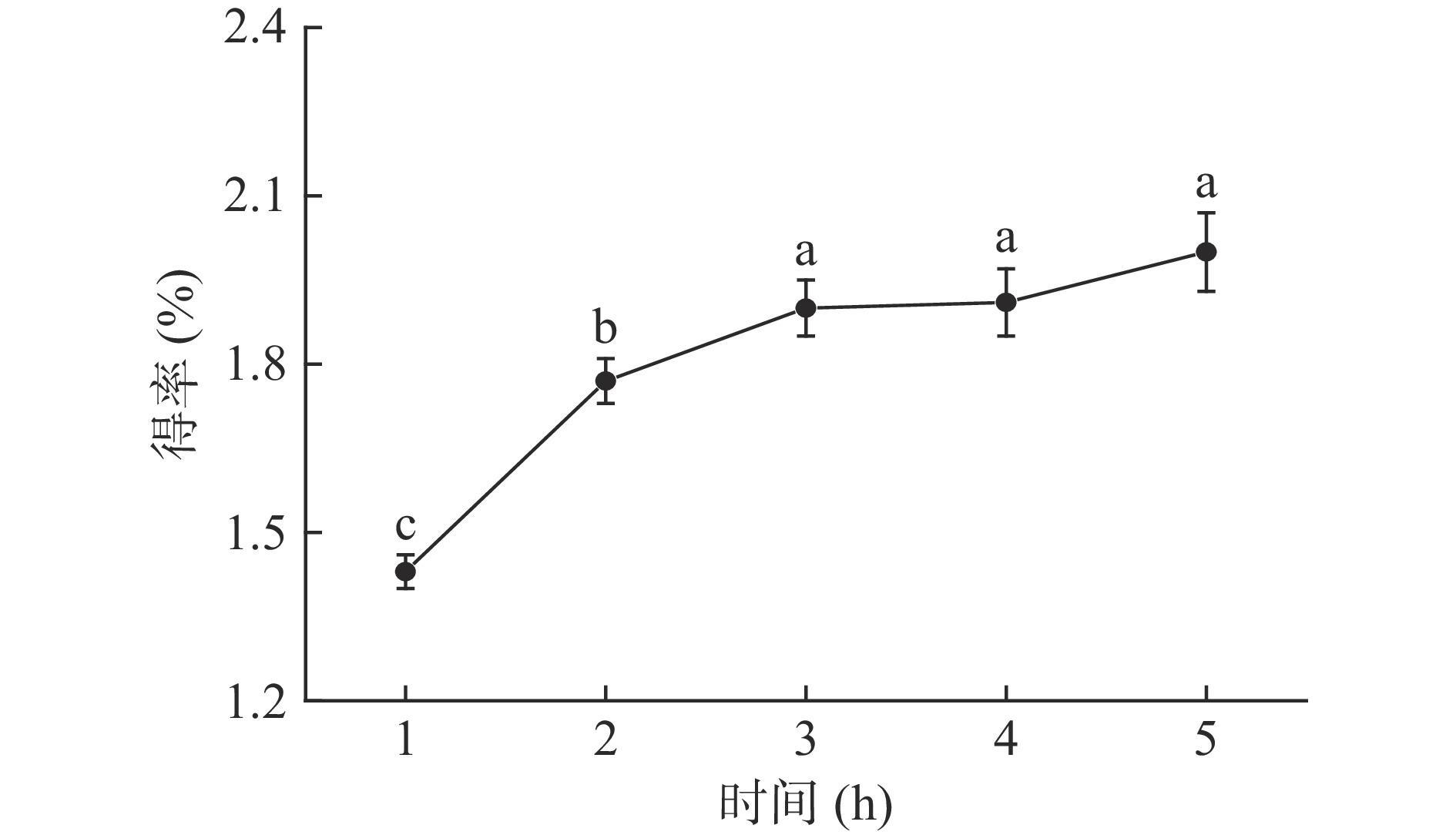
2.1.3 时间对多糖得率的影响
从图3可以看出,随着提取时间的延长OLP得率明显增加,在1~3 h范围内,时间的延长对OLP得率影响显著(P<0.05),提取时间达到3 h时,多糖得率为1.95%,经过显著性检验发现3 h后继续延长提取时间多糖得率增加不显著(P>0.05),从节约成本和时间考虑,选择3 h为后续正交试验工艺优化的中心值。
2.2 正交试验结果及分析
2.2.1 正交试验结果
根据2.1单因素实验结果可知,选取影响OLP得率的料液比、温度和时间三个因素,采用标准L9(34)正交试验设计进行提取工艺优化,正交试验及试验结果见表2。
表 2 L9(34)正交实验及结果Table 2. L9(34) orthogonal design and experiment results序号 影响因素 多糖得
率(%)A 料液比 B 温度 C 时间 D (空白列) 1 1 1 1 1 2.10 2 1 2 2 2 2.51 3 1 3 3 3 2.74 4 2 1 2 3 2.07 5 2 2 3 1 2.42 6 2 3 1 2 2.24 7 3 1 3 2 2.19 8 3 2 1 3 2.44 9 3 3 2 1 2.46 K1 7.35 6.36 6.78 6.98 K2 6.73 7.37 7.04 6.94 K3 7.09 7.44 7.35 7.25 k1 2.45 2.12 2.26 2.33 k2 2.24 2.46 2.35 2.31 k3 2.36 2.48 2.45 2.42 R 0.21 0.36 0.19 0.11 从表2正交试验结果极差分析可以看出,3个提取因素对OLP得率影响的顺序为B>A>C,即温度对OLP得率的影响最大,其次是料液比和时间,最佳提取条件为A1B3C3,即料液比为1:27.5 g/mL,在温度95 ℃下提取3.5 h。
2.2.2 工艺验证试验
根据2.2.1正交试验工艺优化结果,取油橄榄脱脂粉末2.0 g,3份,按照A1B3C3条件进行OLP提取工艺验证试验,测定提取液多糖含量,计算OLP得率。计算结果得率分别为2.77%、2.75%和2.74%,平均得率为2.75%,高于正交试验设计中所有条件下OLP得率,表明工艺优化成功。该工艺油橄榄叶多糖的得率高于邓建梅等[11]采用微波辅助提取的多糖得率(12.4535 mg/g),低于原姣姣等[12]采用的超声-酶辅助提取的得率(4.50%),相比而言,本研究多糖的得率较高,并且提取条件简单,成本较低,易于大规模制备。
2.3 油橄榄叶多糖红外光谱分析结果
从图4可知,OLP的红外光谱图中可以看出OLP具有多糖的一般吸收特征峰,3427 cm−1处的吸收峰为糖结构中-OH的O-H的伸缩振动吸收峰,2935 cm−1处吸收峰为糖结构中C-H特征吸收峰,1747、1631、1439 cm−1这3处为C=O和O-H特征吸收峰,1100~1022 cm−1为吡喃糖残基糖环C-O-C和C-O-H吸收[7]。通过红外光谱分析说明所制备的OLP为糖类化合物[19]。
2.4 分子量分析结果
采用HPGPC-MALLS法对OLP的分子量进行了分析测定,结果见表3。
表 3 OLP分子量分析结果Table 3. OLP molecular weight analysis resultsOLP Mw(kDa) Mn(kDa) 多分散系数(Mw/Mn) 25.36 19.32 1.313 从表3可知,OLP的重均分子量(Mw)和数均分子量分别为25.36和19.32 kDa,多分散系数为1.313,表明OLP的分子量分布范围较窄。
2.5 油橄榄叶单糖组成分析结果
采用PMP柱前衍生-HPLC法分析OLP的单糖组成,单糖组成HPLC结果见图5,单糖组成分析结果及相对摩尔比见表4。
表 4 OLP单糖组成及相对摩尔比分析结果Table 4. The analysis results of monosaccharide composition and relative mole ratio样品 单糖组成及其相对摩尔比 Man GlcN Rha GalN Glc Gal Xyl Ara OLP 0.5 0.3 8.3 10.3 56.2 15.9 2.6 5.9 从图5和表4可知,OLP为含有8种单糖的杂多糖,主要由葡萄糖(Glc)、半乳糖(Gal)和氨基半乳糖(GalN)组成,此外还含有鼠李糖(Rha)和阿拉伯糖(Ara),以及少量的木糖(Xyl)、甘露糖(Man)和氨基葡萄糖(GlcN),各种单糖的相对摩尔比如表4,其中Glc所占比例最大。王布雷等[13]也对提取的油橄榄叶多糖的单糖组成进行了分析,发现其由7种单糖组成,其中Gal占比最大,为31.17%,其次是Glc和Ara,占比分别为29.30%和21.64%,此外还含有GalA(6.95%)、Rha(5.67%)、GlcA(3.11%)和Man(2.17%),为含有糖醛酸的酸性多糖。研究发现,原料的产地、年限及处理工艺[27-28]、多糖的提取方法等均会对多糖的单糖组成和活性产生影响[29-30],该研究与本研究所获油橄榄叶多糖在单糖组成上存在明显不同,可能是该研究所用油橄榄叶为四川西昌所产,与本研究所用材料的产地以及提取方法等不同有关,这也说明多糖的来源及提取方法会对多糖的结构产生影响。
2.6 油橄榄叶多糖抗氧化活性
2.6.1 对羟自由基的清除活性
OLP和VC对羟自由基的清除活性见图6。
从图6可知,OLP对羟自由基有一定的清除活性,且呈现明显的浓度依赖关系,在浓度0.1~3 mg/mL范围内随着浓度的增加,清除活性明显增强,浓度为3 mg/mL时,清除率达到了83.32%,经计算OLP和VC对羟自由基的半数抑制浓度(IC50)分别为0.422和0.044 mg/mL,表明OLP对羟自由基具有较好的清除活性,在一定浓度范围内可以发挥清除羟基自由基的活性。
2.6.2 对超氧阴离子自由基的清除活性
OLP和VC对超氧阴离子自由基的清除活性见图7。
由图7可知,OLP对超氧阴离子自由基有明显的清除活性,在浓度0.1~1 mg/mL范围内随着浓度的增加清除活性明显增强,呈现浓度依赖关系,当浓度为2.5 mg/mL时,清除率达到了85.13%,经计算OLP和VC对超氧阴离子自由基的IC50分别为0.302和0.139 mg/mL,表明OLP对超氧阴离子自由基具有较好的清除活性。
2.6.3 对DPPH自由基的清除活性
OLP和VC对DPPH自由基的清除活性见图8。
由图8可知,随着OLP浓度的增加对DPPH自由基的清除活性与VC具有相同的作用趋势,均表现出明显的浓度依赖关系,浓度达到3 mg/mL时清除率达到82.26%,经计算OLP和VC对DPPH自由基的IC50分别为0.268 mg/mL和0.073 mg/mL,表明OLP对DPPH自由基有较好的清除活性。
通过比较发现OLP对DPPH的清除活性最强,其次是超氧阴离子自由基和羟自由基,表明OLP对不同类型的自由基均有较好的清除活性,可以用于天然抗氧化剂的开发,保护机体免受自由基损伤,有进一步开发和应用的前景。
3. 结论
本研究在单因素实验的基础上通过正交试验优化了油橄榄叶多糖的提取工艺,发现提取时间对多糖得率影响最大,在最佳提取工艺条件料液比1:27.5 g/mL,温度95 ℃,提取时间3.5 h下,多糖得率为2.75%,分析发现油橄榄叶多糖主要是由Glc、Gal和GalN等单糖组成的杂多糖,分子量分布窄,纯度较好,能够清除羟自由基、超氧阴离子自由基和DPPH自由基,具有较好的体外抗氧化活性。本研究为油橄榄叶多糖的进一步研究以及开发利用提供了参考。
-
表 1 正交试验因素水平
Table 1 Orthogonal assay factors and levels
水平 因素 A 料液比
(g/mL)B 温度
(℃)C 时间
(h)1 1:27.5 85 2.5 2 1:30.0 90 3.0 3 1:32.5 95 3.5 表 2 L9(34)正交实验及结果
Table 2 L9(34) orthogonal design and experiment results
序号 影响因素 多糖得
率(%)A 料液比 B 温度 C 时间 D (空白列) 1 1 1 1 1 2.10 2 1 2 2 2 2.51 3 1 3 3 3 2.74 4 2 1 2 3 2.07 5 2 2 3 1 2.42 6 2 3 1 2 2.24 7 3 1 3 2 2.19 8 3 2 1 3 2.44 9 3 3 2 1 2.46 K1 7.35 6.36 6.78 6.98 K2 6.73 7.37 7.04 6.94 K3 7.09 7.44 7.35 7.25 k1 2.45 2.12 2.26 2.33 k2 2.24 2.46 2.35 2.31 k3 2.36 2.48 2.45 2.42 R 0.21 0.36 0.19 0.11 表 3 OLP分子量分析结果
Table 3 OLP molecular weight analysis results
OLP Mw(kDa) Mn(kDa) 多分散系数(Mw/Mn) 25.36 19.32 1.313 表 4 OLP单糖组成及相对摩尔比分析结果
Table 4 The analysis results of monosaccharide composition and relative mole ratio
样品 单糖组成及其相对摩尔比 Man GlcN Rha GalN Glc Gal Xyl Ara OLP 0.5 0.3 8.3 10.3 56.2 15.9 2.6 5.9 -
[1] 赵德刚, 吕立堂, 赵懿琛, 等. 油橄榄研究进展及其在贵州的发展建议[J]. 贵州农业科学,2018,46(3):146−152. [ZHAO D G, LYU L T, ZHAO Y C, et al. Olea europaea developing situation and suggestions for industry development in Guizhou Province[J]. Guizhou Agricultural Sciences,2018,46(3):146−152. doi: 10.3969/j.issn.1001-3601.2018.03.034 [2] 徐纬英. 中国油橄榄种质资源与利用[M]. 长春: 长春出版社, 2001 XU W Y. Germplasm resources and utilization of olive in China[M]. Changchun: Changchun Press, 2001.
[3] 王成章, 陈强, 罗建军, 等. 中国油橄榄发展历程与产业展望[J]. 生物质化学工程,2013,47(2):41−46. [WANG C Z, CHEN Q, LUO J J, et al. Development and industrial prospect of China’s olive[J]. Biomass Chemical Engineering,2013,47(2):41−46. doi: 10.3969/j.issn.1673-5854.2013.02.009 [4] 周盼. 油橄榄叶主要化学成分分析及降脂功效研究[D]. 合肥: 安徽农业大学, 2018 ZHOU P. Analysis of main chemical components of olive leaf and lipid-lowering efficacy[D]. Hefei: Anhui Agricultural University, 2018.
[5] GUINDA A, CASTELLANO J M, SANTOS-LOZANO J M, et al. Determination of major bioactive compounds from olive leaf[J]. LWT-Food Science and Technology,2015,64(1):431−438.
[6] 李 楠, 赵兴文, 郭美佳, 等. 油橄榄叶有效成分的提取及药理活性的研究进展[J]. 食品工业科技,2020,41(10):327−331, 338. [LI N, ZHAO X W, GUO M J, et al. Advances in extraction and pharmacological activities of effective constituents from Olea europaea Leaf[J]. Science and Technology of Food Industry,2020,41(10):327−331, 338. [7] 于广利, 赵峡. 糖药物学[M]. 青岛: 中国海洋大学出版社, 2012: 1−21 YU G L, ZHAO X. Carbohydrate-based drugs[M]. Qingdao: Ocean University of China Press, 2012: 1−21.
[8] PATRICIA C, GONZALO V, JOSE A, et al. Polysaccharide-based films and coatings for food packaging: A review[J]. Food Hydrocolloids,2017,68:136−148. doi: 10.1016/j.foodhyd.2016.09.009
[9] YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: A review[J]. Carbohydrate Polymers,2018,183:91−101. doi: 10.1016/j.carbpol.2017.12.009
[10] 谭婉碧, 王琴飞, 余厚美, 等. 植物源功能活性多糖的提取及其研究进展[J]. 热带农业科学,2022,42(7):90−98. [TAN W B, WANG Q F, YU H M, et al. Research progress, extraction and functional activity of plant polysaccharides[J]. Chinese Journal of Tropical Agriculture,2022,42(7):90−98. [11] 邓建梅, 余传波, 刘心怡. 响应面法优化微波辅助提取油橄榄叶多糖工艺研究[J]. 饲料研究,2020,43(6):73−77. [DENG J M, YU C B, LIU X Y. Optimization of microwave-assisted extraction of polysaccharides from olive leaves by response surface method[J]. Feed Research,2020,43(6):73−77. doi: 10.13557/j.cnki.issn1002-2813.2020.06.019 [12] 原姣姣, 陈锦璇, 张帆, 等. 响应面优化超声-酶辅助强化油橄榄叶多糖的提取[J]. 中国油脂,2019,44(4):128−132. [YUAN J J, CHEN J X, ZHANG F, et al. Ultrasound-assisted enzymatic extraction of polysaccharide from olive leaf optimized by response surface methodology[J]. China Oils and Fats,2019,44(4):128−132. doi: 10.3969/j.issn.1003-7969.2019.04.028 [13] 王布雷, 王玉洁, 李杨美汇, 等. 油橄榄叶多糖的体外抗氧化和抑菌活性分析[J]. 天然产物研究与开发,2016,28(8):1284−1288, 1261. [WANG B L, WANG Y J, LIYANG M H, et al. Antioxidant and antimicrobial activities of polysaccharide from Olea europaea L. leaf[J]. Natural Product Research and Development,2016,28(8):1284−1288, 1261. doi: 10.16333/j.1001-6880.2016.8.020 [14] 张璐, 杨莹莹. 高效液相色谱法测定党参多糖的单糖组成及含量[J]. 中国食品添加剂,2021,32(12):163−169. [ZHANG L, YANG Y Y. Determination of monosaccharide composition and content of Codonopsis pilosula polysaccharide by HPLC[J]. China Food Additives,2021,32(12):163−169. doi: 10.19804/j.issn1006-2513.2021.12.022 [15] 杨海玲, 黄文男, 林婕, 等. 姜黄多糖提取工艺优化研究[J]. 食品研究与开发,2015,36(10):23−25. [YANG H L, HUANG W N, LIN J, et al. Study on the optimal extraction technology of polysaccharide in Curcuma longa L doi: 10.3969/j.issn.1005-6521.2015.10.007 J]. Food Research and Development,2015,36(10):23−25. doi: 10.3969/j.issn.1005-6521.2015.10.007
[16] 鲁斌, 张凤明, 蔡正达, 等. 梨园块菌多糖提取工艺优化及其单糖组成分析[J]. 食品工业科技,2022,43(13):218−224. [LU B, ZHANG F M, CAI Z D, et al. Optimization of polysaccharide extraction process from Tuber liyuanum and analysis of its monosaccharide composition[J]. Science and Technology of Food Industry,2022,43(13):218−224. doi: 10.13386/j.issn1002-0306.2021100234 [17] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[18] 赵小亮, 吕友晶, 李苗苗, 等. 杜梨 (Pyrus betulifolia Bge.) 多糖提取工艺及其清除自由基活性[J]. 食品与生物技术学报,2012,31(3):276−282. [ZHAO X L, LYU Y J, LI M M, et al. Extracting technology and free radical scavenging activity of polysaccharide from Pyrus betulifolia Bge. fruits[J]. Journal of Food Science and Biotechnology,2012,31(3):276−282. doi: 10.3969/j.issn.1673-1689.2012.03.009 [19] HONG T, YIN J Y, NIE S P, et al. Applications of infrared spectroscopy in polysaccharide structural analysis: Progress, challenge and perspective[J]. Food Chemistry,2021,12:1−16.
[20] CHEONG K L, WU D T, ZHAO J, et al. A rapid and accurate method for the quantitative estimation of natural polysaccharides and their fractions using high performance size exclusion chromatography coupled with multi-angle laser light scattering and refractive index detector[J]. Journal of Chromatography A,2015,1400:98−106. doi: 10.1016/j.chroma.2015.04.054
[21] ZHAO X L, JIAO G L, YANG Y, et al. Structure and immunomodulatory activity of a sulfated agarose with pyruvate and xylose substitutes from Polysiphonia senticulosa Harvey[J]. Carbohydrate Polymers,2017,176:29−37. doi: 10.1016/j.carbpol.2017.08.065
[22] YANG Y, ZHAO X, LI J, et al. A beta-glucan from Durvillaea antarctica has immunomodulatory effects on RAW264.7 macrophages via toll-like receptor 4[J]. Carbohydrate Polymers,2018:255−265.
[23] 金鑫, 嵇国利, 赵小亮, 等. 一种刺松藻来源的硫酸阿拉伯聚糖的制备及特征结构表征[J]. 高等学校化学学报,2019,40(4):733−739. [JIN X, JI G L, ZHAO X L, et al. Sulfated arabinose from Codium fragile: Preparation and extensive structural characterization[J]. Chemical Journal of Chinese Universities,2019,40(4):733−739. doi: 10.7503/cjcu20180583 [24] WANG X J, ZHAO X L, LYU Y J, et al. Extraction, isolation and structural characterization of a novel polysaccharide from Cyclocarya paliurus[J]. International Journal of Biological Macromolecules,2019,132:864−870. doi: 10.1016/j.ijbiomac.2019.03.148
[25] WANG F F, YE S H, DING Y, et al. Research on structure and antioxidant activity of polysaccharides from Ginkgo biloba leaves[J]. Journal of Molecular Structure,2022,1252:132185. doi: 10.1016/j.molstruc.2021.132185
[26] MA L Y, XU R, LIN H F, et al. Structural characterization and antioxidant activities of polysaccharides from okra (Abelmoschus esculentus (L.) Moench) pericarp[J]. Bioactive Carbohydrates and Dietary Fibre,2021,26:100277. doi: 10.1016/j.bcdf.2021.100277
[27] 于小芳. 不同产地、不同年限铁皮石斛多糖中单糖组成的 HPLC 分析[J]. 临床研究,2022,30(5):36−39. [YU X F. HPLC analysis of monosaccharide composition in polysaccharides from dendrobium officinale with different origins and years[J]. Clinical Research,2022,30(5):36−39. [28] 吴丰鹏, 李芹英, 吴彦超, 等. 九蒸九制对黄精多糖单糖组成及其抗氧化性的影响[J]. 食品工业科技,2021,42(2):42−46. [WU F P, LI Q Y, WU Y C, et al. Effects of nine-steam-nine-bask on the monosaccharide composition and antioxidant activities of Polygonatum sibiricum polysaccharide[J]. Science and Technology of Food Industry,2021,42(2):42−46. doi: 10.13386/j.issn1002-0306.2020030160 [29] 杨月娇, 马智玲, 白英. 提取方法对马铃薯渣果胶结构特征及特性的影响[J]. 食品与发酵工业,2021,47(7):146−152. [YANG Y J, MA Z L, BAI Y. Extraction methods on structure and properties of pectin from potato residue[J]. Food and Fermentation Industries,2021,47(7):146−152. doi: 10.13995/j.cnki.11-1802/ts.025710 [30] 郭淑娟, 朱晟永, 贾悦, 等. 基于主成分分析微波提取圆头蒿多糖工艺中单糖组分变化[J]. 食品工业科技,2020,41(22):267−274. [GUO S J, ZHU S Y, JIA Y, et al. Changes of monosaccharide components in microwave extraction of Artemisia sphaerocephala polysaccharides based on principal component analysis[J]. Science and Technology of Food Industry,2020,41(22):267−274. doi: 10.13386/j.issn1002-0306.2020020089





 下载:
下载:







 下载:
下载:



