pH Coupled Citric Acid Feeding Strategy to Promote Spore Production of Bacillus licheniformis
-
摘要: 在30 L罐水平研究了耦合pH补加柠檬酸对地衣芽孢杆菌生长、代谢以及芽孢形成的影响,通过qPCR检测了细胞对数期能量代谢、氧化应激效应、氨基酸转运相关基因表达水平差异。结果表明,发酵19.5~28 h耦合pH7.5补入78 μmol/L的柠檬酸,延长了细胞生长和芽孢生成周期,峰值生物量(36 h)达到4.2×1010 CFU/mL,较对照(未补柠檬酸)提高42.9%;芽孢数(36 h)达到4.1×1010 CFU/mL,较对照(24 h峰值1.3×1010 CFU/mL)提高215.4%。qPCR测定发现icd、zwf和cydA表达量分别是对照的2.6、4.1和1.9倍,而brnQ、vpr、yvbW、katA、yqjM、ahpF、sodA和abrB分别较对照下调88%、18%、65%、89%、10%、90%、41%和60%。说明柠檬酸的补加增强了TCA循环、HMP途径以及电子传递效率,同时减弱了氧化胁迫效应、提高了Spo0A的磷酸化水平,促进了芽孢形成效率。研究结果为芽孢杆菌工业化高效发酵生产提供了理论支撑。Abstract: The effects of citric acid addition coupled with pH on cell growth, metabolism, and spore yield of B. licheniformis were studied in a 30 L bioreactor, and the gene expression differences related to energy metabolism, oxidative stress effect, and amino acid transport at the log-phase were examined by qPCR. Results showed that: Citric acid supplement coupled with pH7.5 during 19.5~28 h was conducted, reaching a final content of 78 μmol/L in the medium. The feeding strategy prolonged the periods of cell growth and spore formation, and the peak cells (36 h) reached 4.2×1010 CFU/mL that was 42.9% higher than the control (without citric acid supplement). Meanwhile, spore yield (36 h) reached 4.1×1010 CFU/mL, increased by 215.4% compared with the control (24 h, 1.3×1010 CFU/mL). The qPCR assays showed that the expression levels of icd, zwf and cydA was 2.6, 4.1 and 1.9 times higher than that of the control, respectively. Meanwhile, brnQ, vpr, yvbW, katA, yqjM, ahpF, sodA and abrB were decreased by 88%, 18%, 65%, 89%, 10%, 90%, 41% and 60% compared with the control, respectively. The data suggested that citric acid supplementation enhanced the efficiencies of TCA cycle, HMP pathway and electron transport, weakened the oxidative stress effects on cells, and improved the phosphorylation level of Spo0A, thus promoting the sporulation efficiency. The results would provide theoretical supports for the industrial production of Bacillus fermentation efficiently.
-
Keywords:
- Bacillus licheniformis /
- citric acid /
- biomass /
- spores /
- qPCR
-
地衣芽孢杆菌是一种兼性厌氧的革兰氏阳性菌,其生长代谢过程中能产生淀粉酶、蛋白酶、纤维素酶、葡聚糖酶[1-2]、生物活性物质、促生长因子[3]等。由于其丰富的产酶能力和食品安全性,地衣芽孢杆菌长期应用于食品工业和微生态[4]等领域。如:地衣芽孢杆菌强化大曲酒醅发酵能效抑制异味酚类物质合成、提高芳香类和吡嗪类物质含量[5]。地衣芽孢杆菌还被应用于治疗肠易激综合征[6]。
豆粕是地衣芽孢杆菌高密度发酵(细胞数1.0×1010~2.0×1010 CFU/mL,芽胞率90%左右)常用氮源[7-9],但一味提高豆粕浓度并不能提高芽胞产量[10]。因为芽孢形成还与Spo0A含量及其磷酸化水平[11]以及调控蛋白AbrB有关,余志强[12]和Takeko[13]分别构建了B. subtilis的spo0A缺失突变株均不产芽孢。而焦晓阳[14]过表达B.subtilis的abrB则芽孢率降低了73.1%。因而,芽孢的形成是Spo0A-AbrB调控系统对培养环境响应平衡的结果。另外,蛋白是芽孢重要组分[15-17],因而氨基酸透过酶[18]和能量供应[19]是芽孢形成的重要条件。第三,芽孢杆菌发酵过程产生的活性氧(H2O2等)对细胞产生氧化胁迫[20-21],引起能量供应效率下降,细胞以NADPH作为最终电子受体[22]进行氧化应激反应[23]。但是,发酵中后期芽孢杆菌氧化应激与芽孢形成(如:能量、氨基酸转运等)的代谢体系是否匹配尚未明确。
高芽孢率是地衣芽孢杆菌应用于食品发酵工业和微生态领域的基础条件,培养基[7-10]和发酵参数优化在一定程度上能提高生长和芽孢率,如:枯草芽孢杆菌发酵过程添加柠檬酸可抑制磷酸果糖激酶和丙酮酸激酶活性、促进6-磷酸葡萄糖脱氢酶的活力,并促进细胞生长[24]。但是工业生产过程芽孢形成的限制因素尚不明确,特别是氧化应激与能量和氨基酸的供应效率与芽孢生成体系之间的代谢匹配性。因而,本文研究了柠檬酸对碳中心代谢、能量代谢、氧化应激以及氨基酸供应和芽孢形成过程关键基因表达的影响,为提高芽孢形成效率提供理论依据和技术支持。
1. 材料与方法
1.1 材料与仪器
地衣芽孢杆菌M52(Bacillus licheniformis M52) 发酵工程教育部重点实验室保藏;2×SYBR Green qPCR Mix、Trizol、First Strand cDNA Synthesis Kit Genenode公司;DL2000 DNA Marker TIANGEN公司;ddH2O(DNase/RNase Free) Genecopoeia公司;其他实验试剂 均为国产分析纯。
BIOTECH-30JS 发酵罐 上海保兴生物设备有限公司;7900HT实时荧光定量PCR仪 美国罗氏公司;Nano-100微量分光光度计 杭州奥盛仪器有限公司;EDC-810PCR仪 东胜创新生物科技有限公司;JY300水平电泳仪器、JY02S紫外分析仪 北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 培养基配制
试管、茄子瓶斜面和平板计数培养基(g/L):酵母浸膏20,NaCl 5,琼脂粉20,调pH7.5,123 ℃,灭菌30 min。
30 L发酵罐培养基(g/L):玉米淀粉35,豆粕40,蛋白胨8,葡萄糖5,酵母浸粉3,轻质碳酸钙3,七水硫酸镁0.5,氯化钠2,三水磷酸氢二钾2,一水合硫酸锰0.3。
1.2.2 地衣芽孢杆菌培养方法
从本实验保存的地衣芽孢杆菌甘油管转接到试管斜面中,37 ℃培养36 h。将活化后的菌种转接至新鲜茄子瓶斜面(60 mL培养基/250 mL茄子瓶),37 ℃培养24 h,再向茄子瓶中加入50 mL无菌水,制备菌悬液80 ℃水浴10 min后接种。
发酵液体积按罐容积的60%(18 L)计,121℃,蒸汽灭菌30 min。发酵条件:35 ℃,转速500 r/min,通风量1.0 m3/h,发酵罐压维持在0.04~0.05 MPa,发酵周期36 h。
取样:发酵24 h开始,每3 h取样,分别测定活菌数和芽孢数。取27 h样进行qPCR测定。
1.2.3 柠檬酸补料实验
柠檬酸溶液(质量浓度50%)121 ℃灭菌后备用。发酵pH回升至7.5时,罐上设置反向耦合(pH大于7.5自动补料启动)流加柠檬酸,至28 h停止,罐内柠檬酸终浓度78 μmol/L。对照为不进行柠檬酸补料的发酵培养。
1.2.4 细胞数和芽孢数的测定
细胞数:发酵液中细胞数(CFU/mL)采用稀释涂布平板法[25]测定。
芽孢数:将经过适当稀释后的菌液80 ℃水浴15 min,后进行平板涂布对芽孢进行计数。
产芽孢率计算公式:产芽孢率(%)=(芽孢数/活菌数)×100
1.2.5 实时荧光定量PCR(qPCR)
1.2.5.1 提取RNA
在Trizol试剂中用移液管反复吹打来裂解细胞,每1.0×107细菌加1 mL的Trizol。研磨混匀后样本在室温(15~30 ℃)下放置5 min使核蛋白体完全解离,4 ℃,12000 r/min离心10 min,取上清。每1 mL Trizol加0.2 mL氯仿。盖紧样品管盖,振荡混匀15 s并将其在4 ℃下静置2~3 min,4 ℃、12000 r/min离心10~15 min。取上清后,加同体积氯仿盖紧样品管盖,振荡混匀15 s并将其在室温下静置2~3 min。4 ℃、12000 r/min离心10~15 min,吸上层清液,至新1.5 mL EP管中,加入等体积异丙醇,轻轻颠倒混匀,4 ℃放置10 min。剩余步骤参照说明书。
1.2.5.2 逆转录成cDNA
逆转录反应体系1。反应条件:42 ℃ 2 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min,反应试剂:Total RNA/mRNA(≤2 µg),4 µL的4×gDNA Eraser Mix,加ddH2O(RNase free)至16 µL。
逆转录反应体系2。反应条件:42 ℃ 20 min,85 ℃ 5 min,4 ℃ 10 min,反应试剂:16 µL(体系1)加4 µL的5×TRUE RT Master Mix。逆转录完成的cDNA用于荧光定量PCR。
1.2.5.3 实时荧光定量 PCR 检测
反应体系如表1所示。反应条件:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,40 cycles。绘制溶解曲线,最终数据以2-Δ(ΔCt)进行分析。
表 1 实时荧光定量 PCR 反应体系Table 1. Real-time fluorescence quantitative PCR reaction systemcDNA 2 µL Forward Primer(10 μmol/L) 0.4 µL Reverse Primer(10 μmol/L) 0.4 µL 2×SYBR Green qPCR Mix 10 µL ddH2O Up to 20 µL 1.2.5.4 引物设计
根据地衣芽孢杆菌生长代谢、氨基酸转运以及芽孢形成相关基因序列信息,以icd、zwf、cydA、relA、brnQ、vpr、yvbW、katA、yqjM、ahpF、sodA以及abrB的基因组序列为模板,以rpSE-F、rpSE-R为内参基因,按照qPCR的要求设计特异性引物,引物序列如表2所示。
表 2 扩增引物列表Table 2. List of amplified primers序号 引物名称 引物序列 产物长度(bp) 1 perR-F TATAAAGCTCTGGAAGGGAA 151 2 perR-R CGTGATAATGCTCGGATG 3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30brnQ-F
brnQ-R
yqjM-F
yqjM-R
zwf-F
zwf-R
sodA-F
sodA-R
relA-F
relA-R
icd-F
icd-R
citZ-F
citZ-R
yvbW-F
yvbW-R
vpr-F
vpr-R
katA-F
katA-R
cydA-F
cydA-R
ahpF-F
ahpF-R
abrB-F
abrB-R
rpSE-F
rpSE-RTGATGCCCTTGTCGCTTTTG
TTCGCTAAAACCTCGGCTCC
TTTTTATCACCGCTTTCCAACAA
ATCCATTTGGCGAAACCGAC
GGATGTTTTACTTGGCGATGGC
CGCTCTGTCTTCCACACCCAA
TCACCATACGAAGCACCATAACAC
TTGGTTTGGCGTGCTTGTGA
TGATGTGGTGGAAGATACGAGC
GGATGTCCTGAGCCATAGCCAC
CAACAAAACAGGCGAATGGCT
ACAGGACGCAGGCATGTAAACA
TTCGGACAGCCGTTTCTTTACTC
CAAACGCTTCCACTTCAACAGG
AACCCTGAGAAGGTCGTGCC
AGGACTCTCCGACACACCGTTG
GTCAGCACCATTCCGACCCAT
TGCGTATTGTGAGGGAGAGGCT
CGGATGCCGTATGGGATTTT
TTTCAATCGCCTCATACAAGTCCT
GGTGTTCGGTATTTTGACAACGG
CCCGCACAAACAAGTAGACAAGAA
GGTGTCGCATACTGCCCTCA
ACCGATTTGGACGAAGACGC
AGTTACAGGTGAAGTTTCTGATGACA
TTATTTTTGAGATTGAAGTTGTGCTTG
TGGTCGTCGTTTCCGCTTCG
TCGCTTCTGGTACTTCTTGTGCTT216
194
338
370
176
162
240
132
212
276
134
327
1211.3 数据处理
本文所有试验数据为3个平行试验的平均值,用平均值±标准差(SD)表示。采用Origin 9.0进行作图以及数据分析。
2. 结果与分析
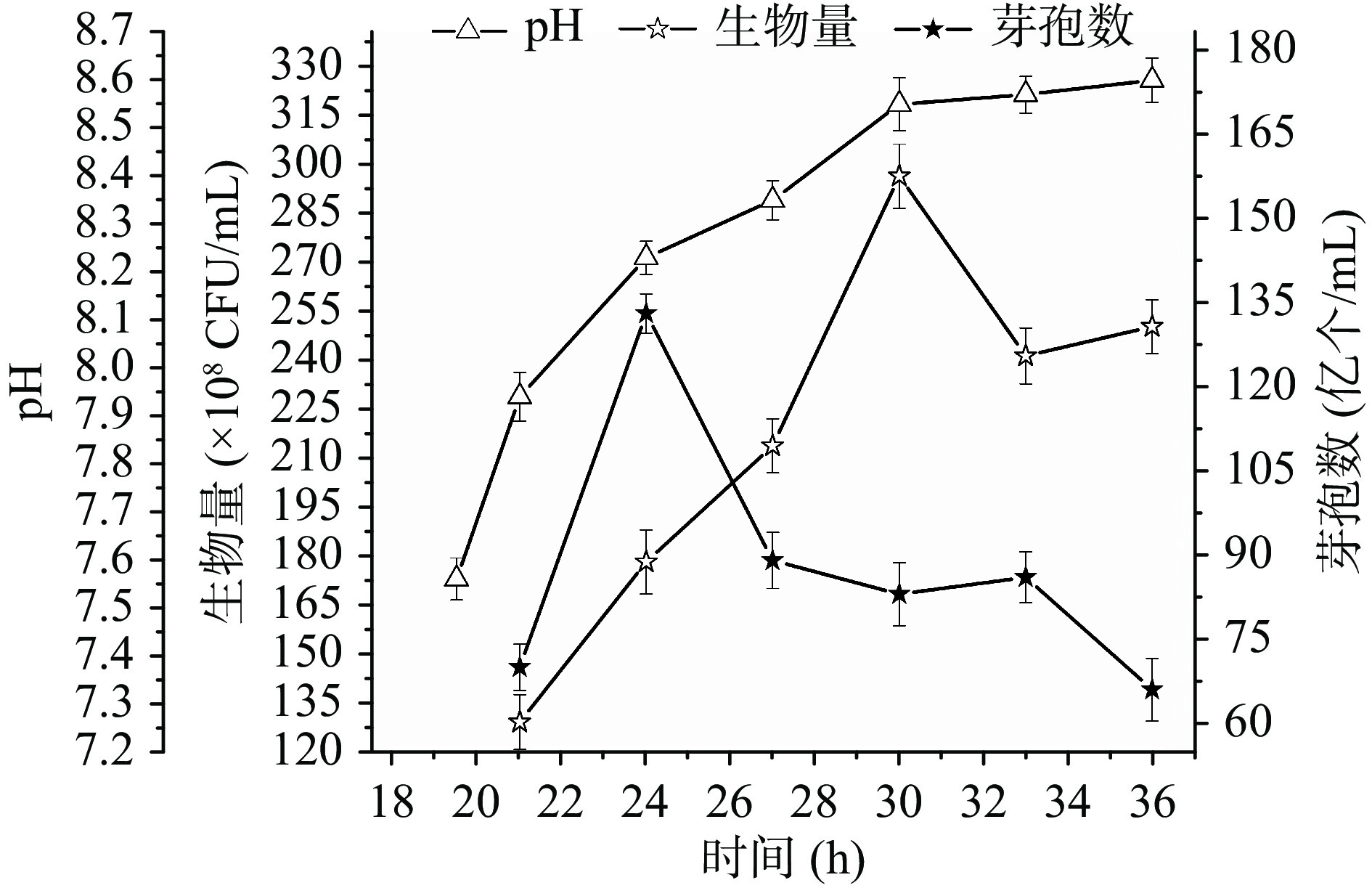
2.1 地衣芽孢杆菌在30 L罐发酵生长和芽孢形成特征
地衣芽孢杆菌在30 L罐发酵生长和芽孢形成的特征如图1所示:细胞24~36 h处于对数生长期,细胞数由24 h的1.8×1010 CFU/mL对数生长至30 h的峰值(3.0×1010 CFU/mL),后自溶至33 h的2.4×1010 CFU/mL,并维持稳定。同时,芽孢数由24 h的1.3×1010 CFU/mL快速下降至27 h的8.9×109 CFU/mL后稳定维持到8.6×109 CFU/mL(33 h),后缓慢下降至36 h的6.6×109 CFU/mL。24 h获得最大芽孢率72.2%,后降至30 h芽孢率27.7%。30 h峰值细胞数是付维来等[26]报道的(30 h,1.2×1010 CFU/mL)2.5倍,反映了本发酵条件完全满足高密度发酵的要求。
芽孢杆菌高糖浓度生长会发生溢流代谢,合成如乙酸等溢流分子[27],使发酵前期pH下降。发酵中后期葡萄糖耗尽后,细胞吸收溢流代谢产物[28]及氨基酸进行二次利用,因而pH开始回升。本批次发酵19.5 h时pH已经回升至7.5(如图1所示),说明培养基中糖已基本耗尽[29]。
以上数据说明实验条件下细胞生长可以达到较高细胞数,但发酵中后期细胞生长或芽孢仍存在不利因素。如:对数生长中后期细胞氧化应激效率、碳源不足等。芽孢杆菌中NADPH主要由磷酸戊糖途径(HMP)和三羧酸循环(如异柠檬酸脱氢酶ICD催化)生成,而NADPH是氧化应激反应中最终的电子受体。因而,后期碳不足引起的NADPH供应下降不利于菌体应对氧化胁迫[26]。柠檬酸作为ICD底物,经代谢可产生NADPH,可能在一定程度上缓解氧化胁迫。因此,在30 L罐水平后续研究了发酵19.5 h耦合pH流加柠檬酸对M52生长以及芽孢生成的影响。
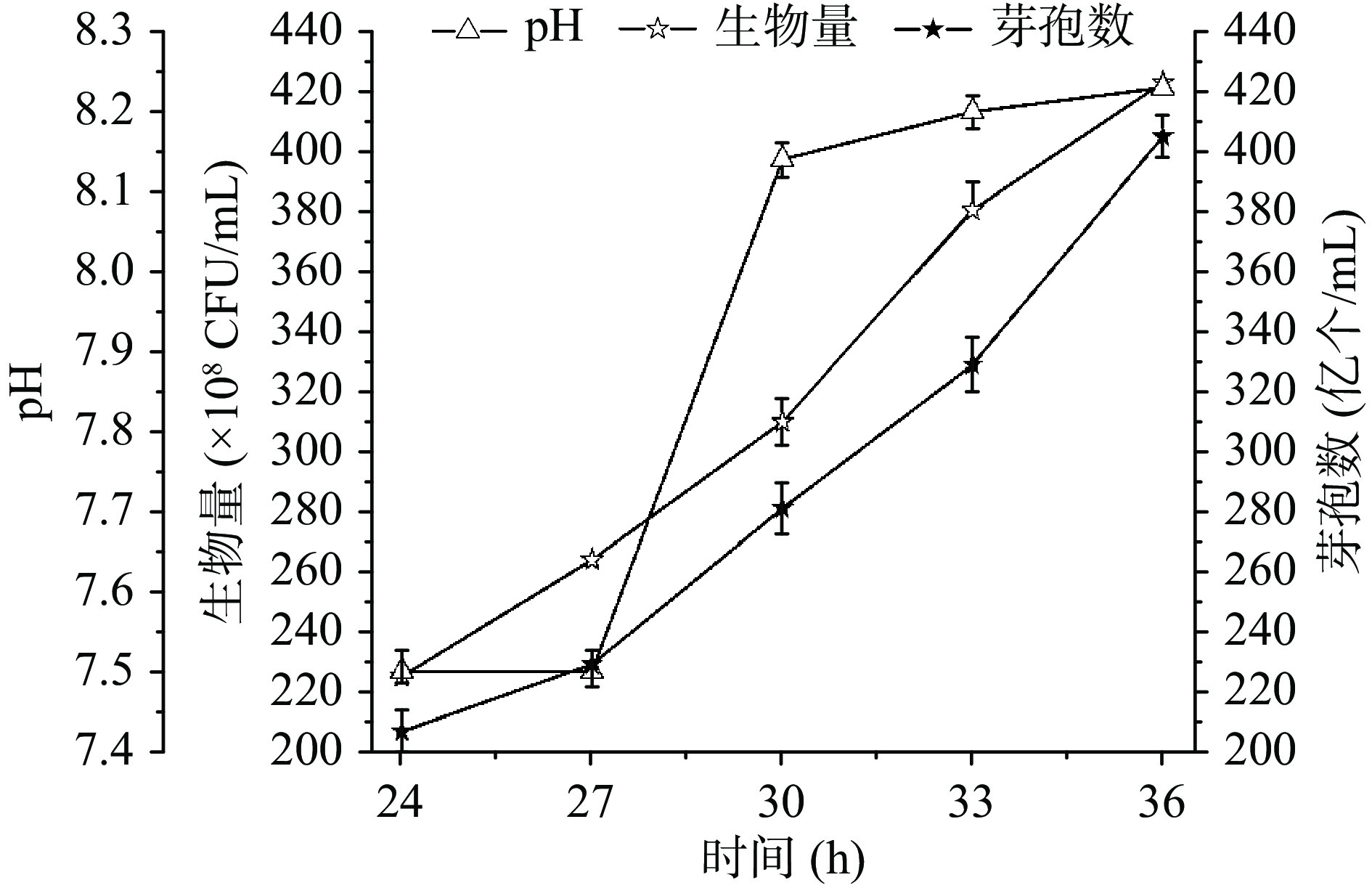
2.2 pH耦合补加柠檬酸对地衣芽孢杆菌生长和芽孢数的影响
发酵19.5 h耦合pH流加柠檬酸溶液对M52生长以及芽孢生成的影响如图2所示:19.5~28 h耦合pH7.5补入柠檬酸,24~36 h细胞处于对数生长期,24 h的细胞数2.3×1010 CFU/mL(较不流加柠檬酸的对照发酵提高了27.8%),30 h细胞数3.1×1010 CFU/mL,与对照(30 h峰值3.0×1010 CFU/mL)接近。但是,与对照生长30 h后剧烈自溶不同的是:流加柠檬酸支撑了细胞生长至36 h的4.2×1010 CFU/mL,较对照峰值提高40.0%。同时,24 h芽孢数2.1×1010 CFU/mL,较对照(24 h芽孢数1.3×1010 CFU/mL)提高了61.5%;30 h芽孢数为2.8×1010 CFU/mL,较对照(30 h,8.3×109 CFU/mL)提高了250.0%;36 h的芽孢数是4.1×1010 CFU/mL,比对照(24 h芽孢数1.3×1010 CFU/mL、芽孢率72.2%)分别提高了215.4%和25.4%,生长期较对照明显延长。结果表明在对数生长期耦合pH7.5补加柠檬酸可能促进了TCA循环,降低了菌体受到的氧化胁迫,进而有效促进了生物量和芽孢地持续增长。
2.3 柠檬酸对地衣芽孢杆菌能量代谢途径关键基因表达的影响
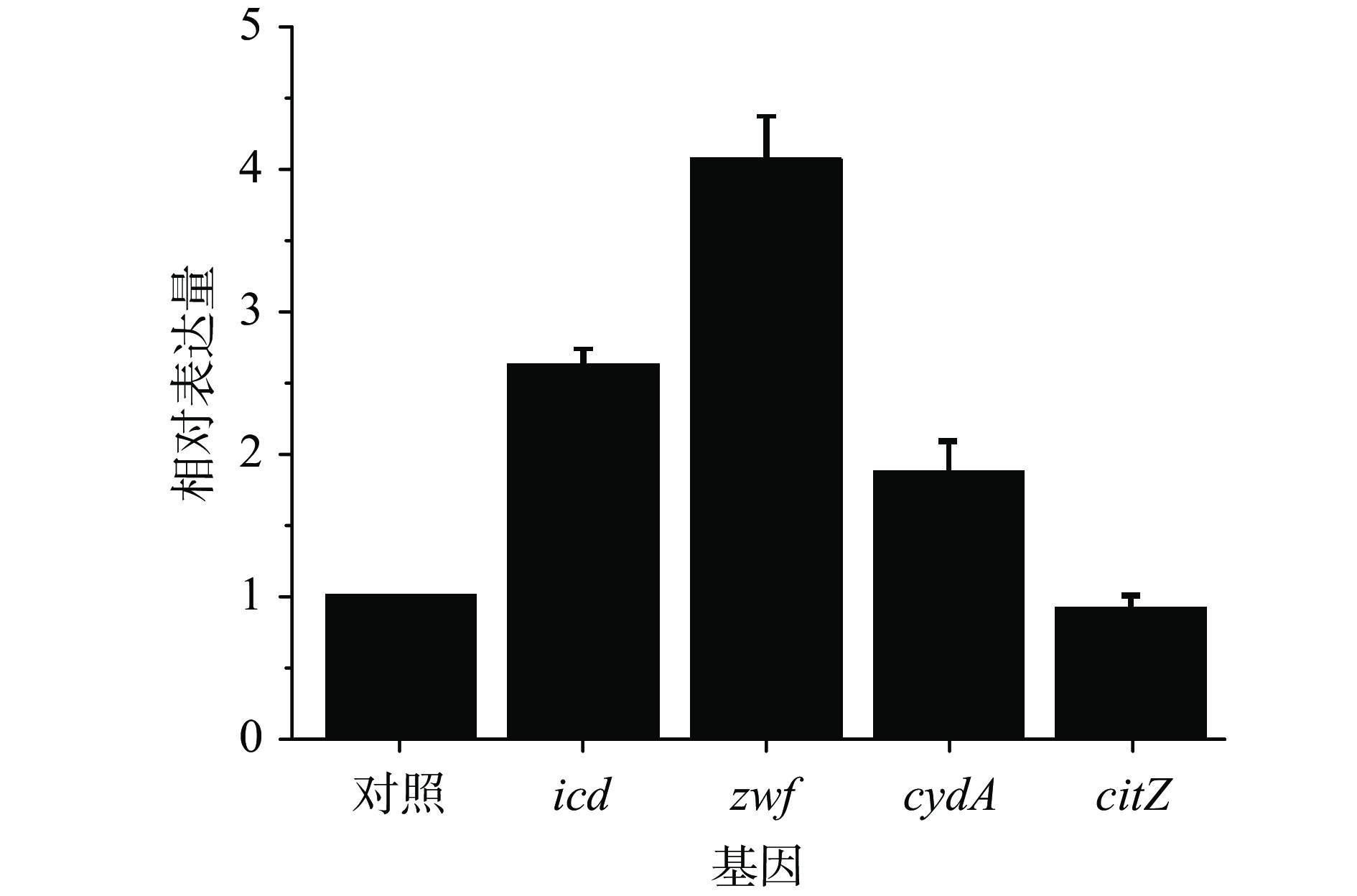
刘钊远[30]过表达icd(编码异柠檬酸脱氢酶),显著提升地衣芽胞杆菌ATP和NADPH的供应。蔡冬波[31]构建地衣芽孢杆菌WX/pHY-zwf使胞内NADPH较对照提高了2.4倍,也增强了TCA循环icd等基因的表达。因而,考虑到NADPH在氧化应激中的作用[32]以及胞子衣蛋白质合成、氨基酸转运对能量的需求[20],需要考察柠檬酸流加对icd、zwf、cydA、citZ等能量代谢相关基因表达的影响,如图3所示。
流加柠檬酸组citZ(编码柠檬酸合酶)表达量较对照下调9%,而icd的表达量是对照的2.6倍,说明柠檬酸流加能够提高TCA循环和NADPH的生成效率。葡萄糖-6-磷酸脱氢酶(zwf编码)是HMP途径限速酶,催化生成5-磷酸核酮糖和NADPH,zwf表达量是对照组的4.1倍,说明补加柠檬酸能够提高菌体NADPH供应。cydA参与编码电子传递链中细胞色素a氧化酶,其表达量较对照提高了1.9倍,表明补加柠檬酸后细胞有氧呼吸能力加强,能合成更多ATP,提高细胞的能量供应水平。
2.4 柠檬酸补加对地衣芽孢杆菌氧化应激相关基因表达的影响
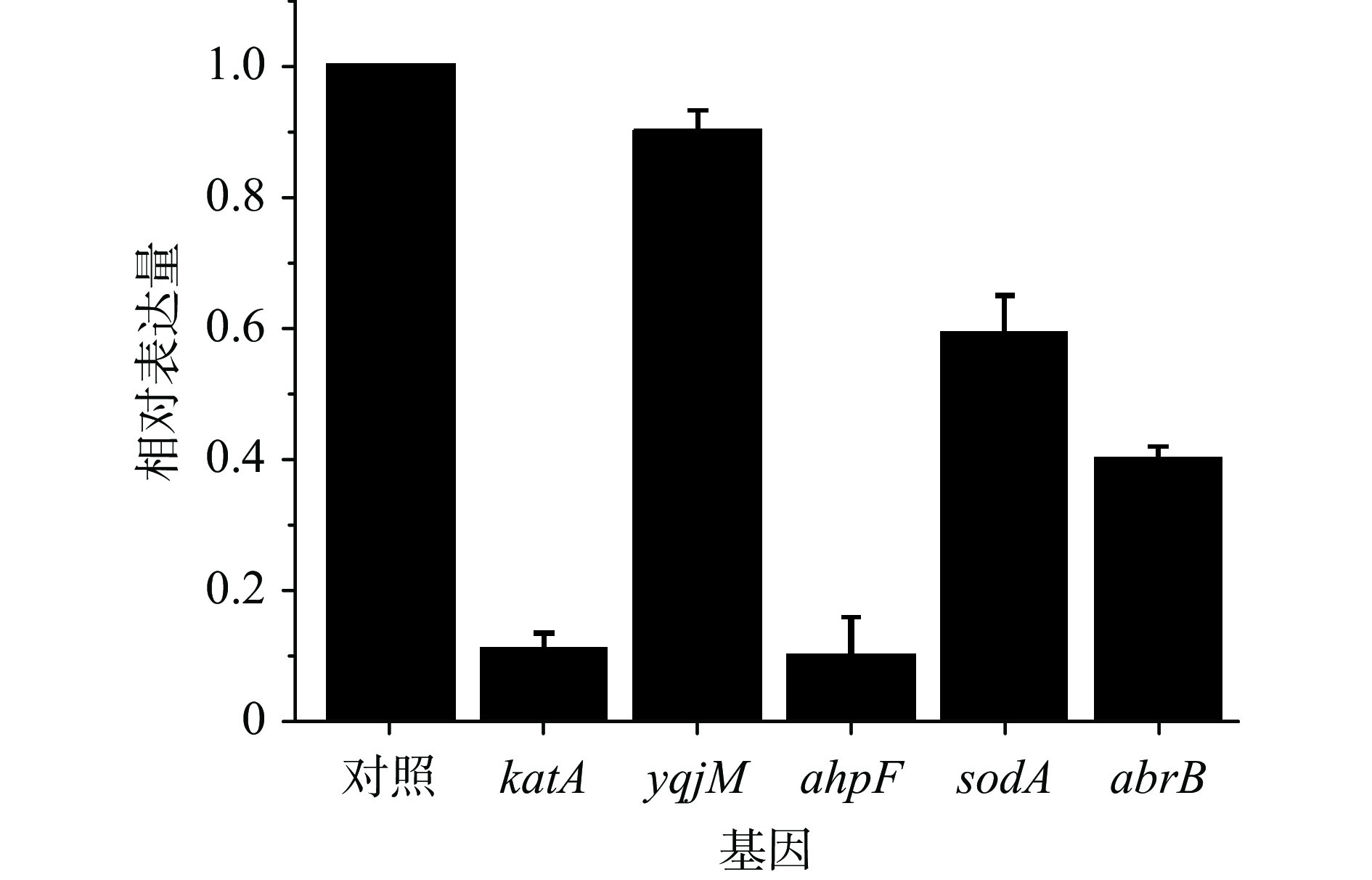
芽孢杆菌高密度发酵过程中会产生大量活性氧(H2O2等),它们会对胞内蛋白质、DNA等物质造成氧化损伤以及引起电子传递和ATP合成效率下降,诱导了细胞氧化应激。芽孢杆菌细胞拥有一套氧化胁迫应激体系来应对发酵过程中产生的活性氧,如:H2O2与调控蛋白PerR互作引起PerR失活[33],使katA(编码过氧化氢酶)、ahpF(编码烷基氢过氧化物还原酶)、sodA(编码超氧化物歧化酶)、yqjM(编码黄素氧化还原酶)等基因脱阻遏而大量表达[34-36],而且NADPH是氧化应激反应的最终电子受体[23]来消除氧化损伤。柠檬酸显著促进了细胞的生长和芽孢的形成效率(图1~图2),因而需要考察柠檬酸对氧化应激相关基因表达的影响,如图4所示。
与对照相比,katA、yqjM、ahpF和sodA分别较对照下调89%、10%、90%和41%。说明柠檬酸补料发酵过程中,发酵体系的氧化胁迫效应减弱,这可能与icd和zwf比对照表达提高2.6和4.1倍有关,因为NADPH是氧化应激反应的最终电子受体,柠檬酸流加引起了icd与zwf的过量表达,NADPH的供应得到显著增强,进而有效地降低了细胞的氧化损伤、促进了细胞生长效率(图1~图2)。同时,细胞也下调自身氧化应激的应答水平。这与曾昕[22]关于NADPH供应水平升高时,氧化胁迫水平降低、抗氧化酶相关基因以及DNA修复基因均下调的报道一致。
转录调控因子AbrB直接或间接调控的基因多达上百个,包括细胞壁(细胞膜)的合成、氨基酸的合成和运输等[37-38]。如:AbrB在对数期阻遏sigH的表达,使sigH处于一个较低水平,进而影响spo0A基因的表达。当芽孢形成条件适宜时,磷酸化的Spo0A又通过阻遏abrB的表达间接促进SigH水平上升,进而增强spo0A自身表达和芽孢的形成效率。因而,芽孢形成是Spo0A-AbrB调控系统对培养环境响应平衡的结果。柠檬酸对abrB表达的影响如图4所示,abrB表达量较对照下调60%,说明补料组的Spo0A磷酸化水平较高,进而促进了芽胞生成,使得流加组芽孢数在36 h达到4.1×1010 CFU/mL,比对照峰值提高了204.5%。
2.5 氨基酸转运蛋白相关基因表达差异分析
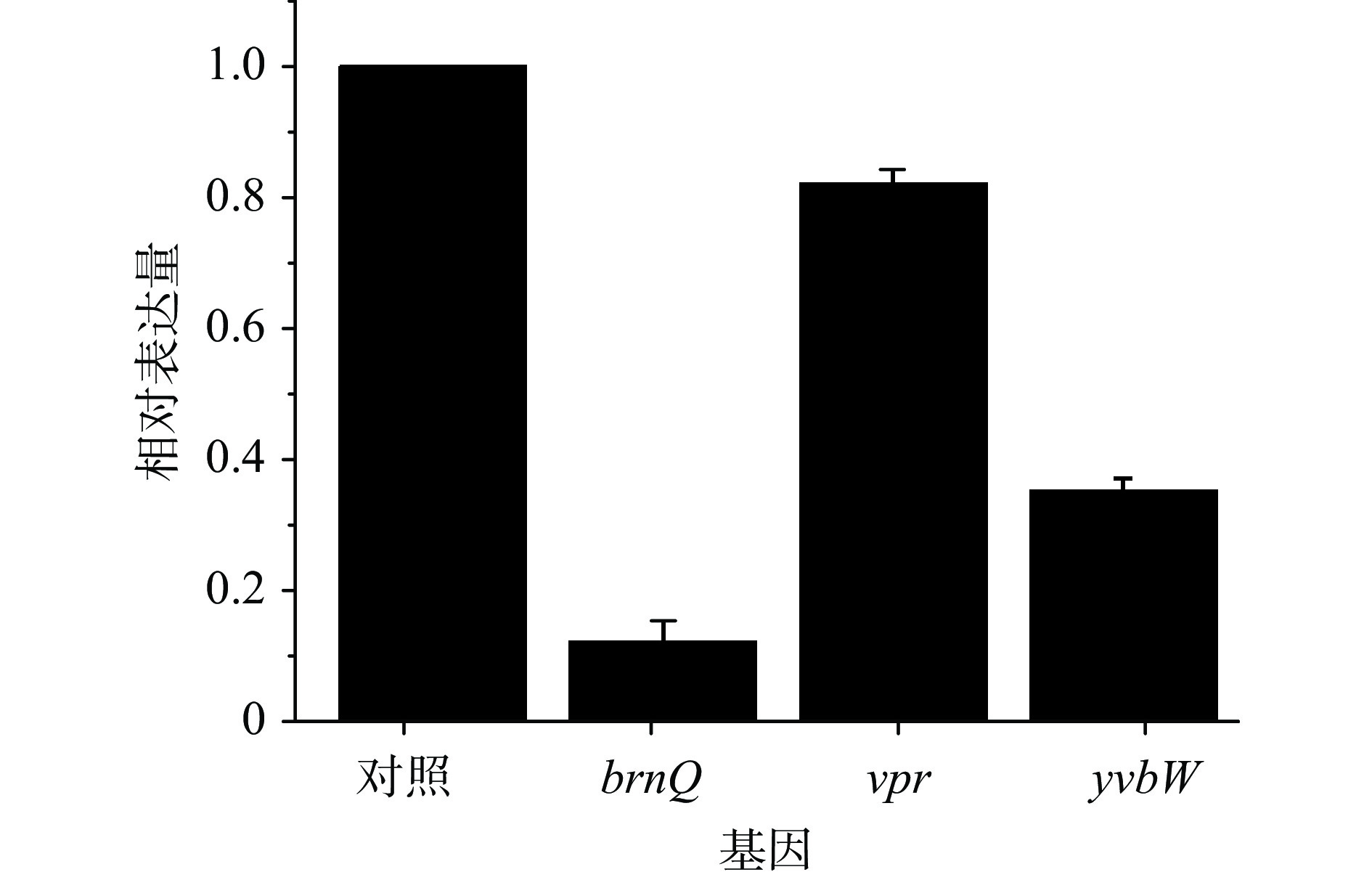
芽孢杆菌的孢子衣是芽孢蛋白质的主要组分,其含量占芽孢总蛋白的80%,因而氨基酸的有效转运是提高芽孢形成效率的前提条件,涉及到蛋白质的分解(Vpr蛋白酶)、支链氨基酸转运蛋白BrnQ、通用氨基酸转运酶YvbW等,另外,由于氨基酸的跨膜转运为次级主动运输方式,因而其转运效率又受到能量供应的影响。柠檬酸对brnQ、vpr和yvbW基因表达的影响如图5所示。
补料组brnQ(编码BCAA转运蛋白)、vpr(编码丝氨酸蛋白酶)和yvbW(编码通用氨基酸转运酶)的表达量较对照分别下调88%、18%和65%。但24~36 h补料组生物量均高于对照组,说明培养条件下,胞外氨基酸的浓度不是细胞生长的限制因素。这也与解顺昌[9]和赵国纬[10]等的报道一致,也说明了芽孢杆菌发酵中一味地提高豆粕浓度来促进细胞和芽孢增长的方法是不尽合理的。
3. 结论
为了提高地衣芽孢杆菌芽孢率,研究了反向耦合pH流加柠檬酸对地衣芽孢杆菌生长、代谢以及芽孢形成的影响(发酵pH回升至7.5时启动流加柠檬酸至28 h,罐内柠檬酸终浓度78 μmol/L)。结果表明:柠檬酸的流加增强了TCA循环、HMP途径以及电子传递链效率,减弱了氧化胁迫效应、abrB表达量较对照下调60%提高了Spo0A的磷酸化水平。
高豆粕、蛋白胨等氮源浓度芽孢杆菌高密度发酵一定程度上能提高生物量和芽孢数,但芽孢杆菌高芽孢率工业发酵的瓶颈并不是氮源不足,而是发酵过程产生的氧化胁迫限制了氮源(如胞外氨基酸)的利用效率,进而影响了细胞和芽孢的生成效率。
-
表 1 实时荧光定量 PCR 反应体系
Table 1 Real-time fluorescence quantitative PCR reaction system
cDNA 2 µL Forward Primer(10 μmol/L) 0.4 µL Reverse Primer(10 μmol/L) 0.4 µL 2×SYBR Green qPCR Mix 10 µL ddH2O Up to 20 µL 表 2 扩增引物列表
Table 2 List of amplified primers
序号 引物名称 引物序列 产物长度(bp) 1 perR-F TATAAAGCTCTGGAAGGGAA 151 2 perR-R CGTGATAATGCTCGGATG 3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30brnQ-F
brnQ-R
yqjM-F
yqjM-R
zwf-F
zwf-R
sodA-F
sodA-R
relA-F
relA-R
icd-F
icd-R
citZ-F
citZ-R
yvbW-F
yvbW-R
vpr-F
vpr-R
katA-F
katA-R
cydA-F
cydA-R
ahpF-F
ahpF-R
abrB-F
abrB-R
rpSE-F
rpSE-RTGATGCCCTTGTCGCTTTTG
TTCGCTAAAACCTCGGCTCC
TTTTTATCACCGCTTTCCAACAA
ATCCATTTGGCGAAACCGAC
GGATGTTTTACTTGGCGATGGC
CGCTCTGTCTTCCACACCCAA
TCACCATACGAAGCACCATAACAC
TTGGTTTGGCGTGCTTGTGA
TGATGTGGTGGAAGATACGAGC
GGATGTCCTGAGCCATAGCCAC
CAACAAAACAGGCGAATGGCT
ACAGGACGCAGGCATGTAAACA
TTCGGACAGCCGTTTCTTTACTC
CAAACGCTTCCACTTCAACAGG
AACCCTGAGAAGGTCGTGCC
AGGACTCTCCGACACACCGTTG
GTCAGCACCATTCCGACCCAT
TGCGTATTGTGAGGGAGAGGCT
CGGATGCCGTATGGGATTTT
TTTCAATCGCCTCATACAAGTCCT
GGTGTTCGGTATTTTGACAACGG
CCCGCACAAACAAGTAGACAAGAA
GGTGTCGCATACTGCCCTCA
ACCGATTTGGACGAAGACGC
AGTTACAGGTGAAGTTTCTGATGACA
TTATTTTTGAGATTGAAGTTGTGCTTG
TGGTCGTCGTTTCCGCTTCG
TCGCTTCTGGTACTTCTTGTGCTT216
194
338
370
176
162
240
132
212
276
134
327
121 -
[1] 焉兆萍, 宋士良, 陆克文. 地衣芽孢杆菌在畜牧生产中应用研究进展[J]. 中国饲料添加剂,2018(12):18−21. [YAN Z P, SONG S L, LU K W. Review on the application of Bacillus licheniformis in animal production[J]. China Feed Additive,2018(12):18−21. [2] 许慧, 丁健, 史仲平. 地衣芽孢杆菌BF-002高产芽孢的氮源流加工艺研究[J]. 中国生物工程杂志,2022,42(3):47−54. [XU H, DING J, SHI Z P. Research on a Fed-batch of nitrogen source fermentation process to improve the spores of Bacillus licheniformis BF-002[J]. China Biotechnology,2022,42(3):47−54. [3] MURAS A, ROMRO M, MAYR C, et al. Biotechnological applications of Bacillus licheniformis[J]. Critical Reviews in Biotechnology,2021,41(4):609−627. doi: 10.1080/07388551.2021.1873239
[4] KURIBAYASHI L M, DO RIO RIBIRO V P, DE SANTANA R C, et al. Immobilization of β-galactosidase from Bacillus licheniformis for application in the dairy industry[J]. Applied Microbiology and Biotechnology,2021,105(9):3601−3610. doi: 10.1007/s00253-021-11325-8
[5] 王鹏. 地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D]. 无锡: 江南大学, 2017 WANG P. Effects of Bacillus licheniformis inoculation on the microbial community structure and metabolism during strong flavored liquor brewing process[D]. Wuxi: Jiangnan University, 2017.
[6] 张小玲, 白小玲. 地衣芽孢杆菌联合双歧杆菌三联活菌治疗便秘型肠易激综合征效果观察[J]. 中国肛肠病杂志,2020,40(12):46−47. [ZHANG X L, BAI X L. Bacillus licheniformis combined with bifidobacterium tripletvaccine in the treatment of IBS of constipation type: Effect observation[J]. China J Coloproctol,2020,40(12):46−47. doi: 10.3969/j.issn.1000-1174.2020.12.021 [7] 熊慧, 张雅婷, 羊晨, 等. 高效除磷菌的筛选与培养条件优化[J]. 环境科学与技术,2020,43(12):125−130. [XIONG H, ZHANG Y T, YANG C, et al. Screening and optimization of culture conditions of high efficient phosphorus removal organism[J]. Environmental Science & Technology,2020,43(12):125−130. doi: 10.19672/j.cnki.1003-6504.2020.12.017 [8] 张红艳, 李忠玲, 张强, 等. 地衣芽孢杆菌MYS68的鉴定及发酵培养基优化[J]. 粮食与饲料工业,2018(2):50−53. [ZHANG H Y, LI Z L, ZHANG Q, et al. Identification and optimization of fermentation medium for Bacillus licheniformis MYS68[J]. Cereal & Fee Industry,2018(2):50−53. [9] 解顺昌, 刘扬科, 胡国春, 等. 地衣芽孢杆菌YTDY_01高产芽孢的培养基优化[J]. 生物技术世界,2015(10):1−3. [XIE C S, LIU Y K, HU G C, et al. Optimization of culture medium for high-yield spores of Bacillus licheniformis YTDY_01[J]. Biotech World,2015(10):1−3. [10] 赵国纬. 地衣芽孢杆菌L3发酵工艺优化及应用研究[D]. 武汉: 华中农业大学, 2009 ZHAO G W. Optimization of Bacillus licheniformis L3 fermentation optimization of Bacillus licheniformis L3 fermentation techniques and it's application research[D]. Wuhan: Huazhong Agricultural University, 2009.
[11] LIANG Q, LIU J, WEI J. The effect of Clostridium tyrobutyricum Spo0A
overexpression in the intestine of mice[J]. Benef Microbes,2020,11(6):573−589. doi: 10.3920/BM2019.0131 [12] 余志强, 杨明明, 杨朝霞, 等. 同源重组法构建枯草杆菌spoOA基因缺失突变株[J]. 武汉大学学报·理学版,2004(2):229−233. [YU Z Q, YANG M M, YANG Z X, et al. The construction of Bacillus subtilis spoOA-Mutant by homologous recombination method[J]. J Wuhan Univ (Nat Sci Ed),2004(2):229−233. [13] TAKKO K, KEIJI E, KATSUTOSHI A, et al. Effect of Bacillus subtilis spo0A mutation on cell wall lytic enzymes and extracellular proteases, and prevention of cell lysis[J]. Journal of Bioscience and Bioengineering,2007,103(1):13−21. doi: 10.1263/jbb.103.13
[14] 焦晓阳. 调控蛋白AbrB对枯草芽孢杆菌B579芽孢生成影响的研究[D]. 天津: 天津科技大学, 2014 JIAO X Y. Research of effect of regulatory protein AbrB on the spore formation of Bacillus subtilis B579[D]. Tianjin: Tianjin University of Science and Technology, 2014.
[15] BODIK M, KRAJCIKOVA D, HAGARA J, et al. Diffraction pattern of Bacillus subtilis CotY spore coat protein 2D crystals[J]. Colloids and Surfaces B: Biointerfaces,2021,197:111425. doi: 10.1016/j.colsurfb.2020.111425
[16] HENRY S, JOSE A C, ADAM D. Diversity and evolutionary dynamics of spore-coat proteins in spore-forming species of Bacillales[J]. Microbial Genomics,2020,6(11):mgen000451.
[17] FREITAS C, PlANNIC J, ISTICATO R, et al. A protein phosphorylation module patterns the Bacillus subtilis spore outer coat[J]. Molecular Microbiology,2020,114(6):934−951. doi: 10.1111/mmi.14562
[18] JIANG Z, DONGBO C, HAIXIA X, et al. Enhancement of precursor amino acid supplies for improving bacitracin production by activation of branched chain amino acid transporter BrnQ and deletion of its regulator gene lrp in Bacillus licheniformis[J]. Synthetic and Systems Biotechnology,2018,3(4):236−243. doi: 10.1016/j.synbio.2018.10.009
[19] 马蓉, 张立军, 丁锐, 等. 大肠杆菌氨基酸转运蛋白的研究进展[J]. 科技通报,2012,28(3):49−56. [MA R, ZHANG L J, DING R, et al. Research progress of amino acid transporter in Escherichia coli[J]. Bulletin of Science and Technology,2012,28(3):49−56. doi: 10.3969/j.issn.1001-7119.2012.03.010 [20] IMLAY J A. Where in the world do bacteria experience oxidative stress?[J]. Environmental Microbiology,2019,21(2):521−530. doi: 10.1111/1462-2920.14445
[21] El-KHOURY T, NGUYEN H, CANDUSSO M, et al. UbK is involved in the resistance of Bacillus subtilis to oxidative stress[J]. Current Microbiology,2020,77(12):4063−4071. doi: 10.1007/s00284-020-02239-1
[22] 曾昕. 小白链霉菌同步代谢葡萄糖和甘油合成ε-聚赖氨酸的生理机制研究[D]. 无锡: 江南大学, 2016. ZENG X. Physiological analysis of the ε-poly-L-lysine biosynthesis in Streptomyces albulus used glucose and glycerol as mixed carbon source[D]. Wuxi: Jiangnan University, 2016.
[23] 李纾然, 谌翰林. 细菌氧化应激反应的研究进展[J]. 化工管理,2020(28):107−108. [LI S R, CHEN H L. Research progress of bacterial oxidative stress response[J]. Chemical Enterprise Management,2020(28):107−108. doi: 10.3969/j.issn.1008-4800.2020.28.052 [24] 刘新星, 陈双喜, 储炬, 等. 柠檬酸钠对枯草杆菌生长代谢及肌苷积累的影响[J]. 微生物学报,2004(5):627−630. [LIU X X, CHEN S X, CHU J, et al. Effect of sodium citrate on the growth metabolism and inosine accumulation by Bacillus subtilis[J]. Acta Microbiological Sinica,2004(5):627−630. doi: 10.3321/j.issn:0001-6209.2004.05.016 [25] 龚军辉, 王晶. 稀释涂布平板法计数活菌的方法简介[J]. 生物学教学,2018,43(2):70−71. [GONG J H, WANG J. Brief introduction of counting viable bacteria by dilution coating plate method[J]. Biology Teaching,2018,43(2):70−71. doi: 10.3969/j.issn.1004-7549.2018.02.036 [26] 付维来, 杜建涛, 刘鹏, 等. 地衣芽孢杆菌M109高密度发酵条件的优化[J]. 中国畜牧兽医,2012,39(11):215−219. [FU W L, DU J T, LIU P, et al. Optimization of culture medium and fermentation conditions of Bacillus licheniformis M109[J]. China Animal Husbandry & Veterinary Medicine,2012,39(11):215−219. doi: 10.3969/j.issn.1671-7236.2012.11.050 [27] WON H I, WATSON S M, AHN J, et al. Inactivation of the Pta-AckA pathway impairs fitness of Bacillus anthracis during overflow metabolism[J]. Journal of Bacteriology,2021,203(9):e00660−20.
[28] PACZIA N, NILGEN A, LEHMANN T, et al. Extensive exometabolome analysis reveals extended overflow metabolism in various microorganisms[J]. Microbial Cell Factories,2012,11(1):122. doi: 10.1186/1475-2859-11-122
[29] 何俊杰, 宋光均, 邓慧萍, 等. 补料工艺对乳杆菌CHU-R产虾青素的影响[J]. 食品与发酵工业,2019,45(12):146−151. [HE J J, SONG G J, DENG H P, et al. Effects of fed process on astaxanthin production in Lactobacillus CHU-R[J]. Food and Fermentation Industries,2019,45(12):146−151. [30] 刘钊远. 增强地衣芽胞杆菌TCA循环代谢水平高产杆菌肽[D]. 武汉: 湖北大学, 2018 LIU Z Y. Enhance bacitracin production by in creasing the TCA cycle in Bacillus licheniformis[D]. Wuhan: HuBei University, 2018.
[31] 蔡冬波. 地衣芽胞杆菌高产聚γ-谷氨酸的代谢调控及辅酶能量工程[D]. 武汉: 湖北大学, 2018 CAI D B. Metabolic regulation mechanism and cofactor energy engineering for high-level production of poly-γ-glutamic acid in Bacillus licheniformis[D]. Wuhan: Hubei University, 2018.
[32] 王路平, 徐建中, 张伟国. 不同辅因子NADPH水平对谷氨酸棒杆菌生长及产物合成的影响[J]. 食品与生物技术学报,2021,40(4):44−57. [WANG L P, XU J P, ZHANAG G W. Different NADPH levels affected growth and metabolites accumulation in Corynebacterium glutamicum[J]. Journal of Food Science and Biotechnology,2021,40(4):44−57. [33] HERBIG A F, HELMANN J D. Roles of metal ions and hydrogen peroxide in modulating the interaction of the Bacillus subtilis PerR peroxide regulon repressor with operator DNA[J]. Molecular Microbiology,2001,41(4):849−859.
[34] BSAT N, HERBIG A, CASILLAS-MARTINEZ L, et al. Bacillus subtilis contains multiple Fur homologues: Identification of the iron uptake (Fur) and peroxide regulon (PerR) repressors[J]. Molecular Microbiology,1998,29(1):189−198. doi: 10.1046/j.1365-2958.1998.00921.x
[35] CHEN L, KERAMATI L, HELMANN J D. Coordinate regulation of Bacillus subtilis peroxide stress genes by hydrogen peroxide and metal ions[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(18):8190−8194. doi: 10.1073/pnas.92.18.8190
[36] BSAT N, CHEN L, HELMANN J D. Mutation of the Bacillus subtilis alkyl hydroperoxide reductase (ahpCF) operon reveals compensatory interactions among hydrogen peroxide stress genes[J]. Journal of Bacteriology,1996,178(22):6579−6586. doi: 10.1128/jb.178.22.6579-6586.1996
[37] QIAN Q, LEE C Y, HELMANN J D, et al. AbrB is a regulator of the sigma (W) regulon in Bacillus subtilis[J]. FEMS Microbiology Letters,2002,211(2):219−223.
[38] STRAUCH M A, BOBAY B G, CAVANANGH J, et al. Abh and AbrB control of Bacillus subtilis antimicrobial gene expression[J]. Journal of Bacteriology,2007,189(21):7720−7732. doi: 10.1128/JB.01081-07
-
期刊类型引用(13)
1. 高树财,闫格,胡桂芳,高火亮. 茶饮料中茶多酚含量测定方法的研究. 标准科学. 2025(01): 99-103 .  百度学术
百度学术
2. 邓婷婷,皮锦蝉,彭小平,姚于飞,李义全,李文娟. 茶多酚基于活性氧-线粒体途径发挥心血管保护作用的研究进展. 食品工业科技. 2025(04): 434-442 .  本站查看
本站查看
3. 蔡妙莹,钟雪莲,胡新涛,袁炎茹,梁花. 改性纤维中总多酚含量的测定. 中国纤检. 2025(03): 66-69 .  百度学术
百度学术
4. 苟祎,夏丽飞,马玉青,杨恺清,吴致远,普金霞,叶红,申时全. 不同花期紫娟茶树花的品质分析及加工工艺研究. 食品科技. 2025(02): 96-104 .  百度学术
百度学术
5. 黄珊由美,林东艺,马成英,荣杰峰,孙威江,黄艳. 茶饮料泡沫生成机理及控制技术研究进展. 茶叶科学. 2025(02): 181-190 .  百度学术
百度学术
6. 田宝明,叶芃,孔俊涛,杨开,孙培龙,陈红平,王舰,张相春. 茶多酚自组装纳米泡腾片的研制. 中国茶叶加工. 2024(02): 33-40 .  百度学术
百度学术
7. 陈俊婕,劳颖仪,陈晓维,余元善,温靖,吴继军,徐玉娟,肖更生,杨继国,唐延天,胡腾根. 茶多酚的功能活性及稳态化研究进展. 中国果菜. 2024(08): 25-31 .  百度学术
百度学术
8. 葛天睿,黄雪君,张娜,陈小强,沙如意,毛建卫. 茶多酚在医药和食品领域的应用研究进展. 食品安全质量检测学报. 2024(17): 176-184 .  百度学术
百度学术
9. 朱旋,田芸,孙海燕,王瑞,金文刚,陈琛. 茶多酚结合超高压处理对鲜切天麻贮藏品质的影响. 北方园艺. 2024(20): 83-90 .  百度学术
百度学术
10. 韩舒婷,华梓延,房耀维,杨光,侯晓月,周文梅,唐明,刘姝. 嗜热链球菌FUA329发酵绿茶浸提液及贮藏特性评价. 食品工业科技. 2024(21): 322-328 .  本站查看
本站查看
11. 辛皎瑜,钟雅静,沈启东,敖娜,梁玉文,付晶,刘春朋. 鹧鸪源大肠杆菌分离鉴定及茶多酚抑菌效果研究. 东北农业大学学报. 2024(07): 51-59 .  百度学术
百度学术
12. 陈晓真,韦怡含,蓝平,封余贤,黎笑笑,关欣,冯杰,何日梅. 茶多酚的提取纯化技术研究进展. 中国酿造. 2024(11): 20-25 .  百度学术
百度学术
13. 吴彤,刘丽莉,程伟伟,丁玥,徐宝成. NaCl和茶多酚对碱诱导鸡蛋清凝胶流变学特性及结构的影响. 食品与发酵工业. 2024(23): 194-201 .  百度学术
百度学术
其他类型引用(8)





 下载:
下载:
 下载:
下载:



