Isolation and Identification of Condensed Tannins from Ziziphus jujuba Leaves and Their Inhibition Mechanism for Melanogenesis
-
摘要: 目的:研究酸枣叶缩合单宁的结构特征及其对酪氨酸酶的效应和黑色素生成的抑制机制。方法:利用Sephadex LH-20凝胶柱色谱技术分离制备酸枣叶缩合单宁纯化物,采用硫醇降解结合高效液相色谱-电喷雾电离质谱(Thiolysis-HPLC-ESI-MS)解析酸枣叶缩合单宁的结构单元组成,运用酶动力学、紫外光谱、荧光猝灭等方法系统研究酸枣叶缩合单宁对酪氨酸酶的抑制作用机理,应用CCK-8法、多巴氧化法、NaOH裂解法和实时荧光定量PCR检测酸枣叶缩合单宁对小鼠黑色素瘤细胞(B16F10)的增殖、酪氨酸酶活性、黑色素合成及其相关基因表达水平的影响。结果:构成酸枣叶缩合单宁的主要结构单元是(表)儿茶素和(表)棓儿茶素;酸枣叶缩合单宁具有较强的酪氨酸酶单酚酶和二酚酶抑制活性,是二酚酶可逆的混合型抑制剂;酸枣叶缩合单宁可有效抑制B16F10细胞的增殖、酪氨酸酶活性、黑色素生成量以及酪氨酸酶(TYR)、酪氨酸酶相关蛋白-1(TRP-1)、小眼畸形相关转录因子(MITF)等基因的表达。结论:通过在酶水平和细胞水平的综合分析,阐明酸枣叶缩合单宁对B16F10细胞黑色素合成的分子抑制机制,为后期酸枣叶缩合单宁开发为新的美白化妆品添加剂和果蔬保鲜剂提供理论依据。Abstract: Objective: To explore the structural characteristics of condensed tannins from Ziziphus jujuba leaves and their effect on tyrosinase and the inhibition mechanism for melanogenesis. Methods: The condensed tannins from Z. jujuba leaves were isolated and purified on the basis of Sephadex LH-20 gel column chromatography, and their structural features were identified by thiolysis coupled with high-performance liquid chromatography-electrospray ionization mass spectrometry (Thiolysis-HPLC-ESI-MS). Besides, the inhibitory mechanism of Z. jujuba leaves condensed tannins on tyrosinase was also systematically investigated by enzyme kinetics, UV-vis absorption and fluorescence spectroscopy. Finally, CCK-8 assay, L-DOPA oxidation assay, NaOH cleavage assay and real-time fluorescence quantitative PCR were employed to probe into the effects of Z. jujuba leaves condensed tannins on the proliferation, tyrosinase activity, melanogenesis and the level of melanogenesis-related gene expression of mouse melanoma cells (B16F10). Results: The condensed tannins from Z. jujuba leaves were mainly composed of (epi)catechin and (epi)gallocatechin. Z. jujuba leaves condensed tannins were found to strongly inhibit on both monophenolase and diphenolase of tyrosinase, and the inhibition against diphenolase was proved to be reversible and mixed-type. It was also observed that the condensed tannins from Z. jujuba leaves could effectively inhibit the cell viability, tyrosinase activity, melanin content, as well as the mRNA expression of TYR, TRP-1 and MITF genes in B16F10 cells. Conclusion: Based on the comprehensive analysis of the biological effects of condensed tannins from Z. jujuba leaves at enzyme level and cell level, we could clarify the molecular inhibition mechanism of Z. jujuba leaves condensed tannins on melanogenesis in B16F10 cells. This study would provide a theoretical basis for the later development of Z. jujuba leaves condensed tannins as new whitening cosmetic additives and preservatives for fruits and vegetables.
-
Keywords:
- Zizyphus jujuba leaves /
- condensed tannins /
- tyrosinase /
- melanin /
- inhibition mechanism
-
酪氨酸酶是黑色素物质合成的关键限速酶,具有独特的单酚酶和二酚酶双重催化功能,它可以在氧气存在的情况下将酪氨酸羟基化形成L-多巴,然后生成多巴醌,最终生成黑色素[1]。黑色素在体内的异常积累不仅会导致色斑等皮肤色素沉着性疾病的产生[2],而且在水果和蔬菜的储存和运输过程中,也会造成水果和蔬菜的褐变,降低它们的营养价值[3]。已有研究表明,以酪氨酸酶为靶标的抑制剂,通过抑制酪氨酸酶的活性,能有效降低生物体黑色素的含量[4]。近年来,对酪氨酸酶抑制剂的研究一直受到国内外的关注,人工合成的抑制剂如氢醌、曲酸等经研究发现对人体均有不同程度的毒副作用,刺激性大,在应用上受到诸多限制[5-6]。因此,寻找安全无毒、刺激性小以及疗效显著的天然酪氨酸酶抑制剂日益成为化妆品和食品行业的研究趋势。
植物单宁是植物代谢过程中产生的一类次生物质,属于天然有机化合物,广泛存在于植物的叶、皮、果等部位[7]。根据化学结构的不同,植物单宁主要分为水解单宁和缩合单宁两大类。前者主要是由棓酸或棓酸衍生的酚羧酸与多元醇通过酯键形成;后者又称原花色素,主要是一类以黄烷-3-醇为基本结构单元通过C-C单键(B型连接)或C-C和C-O-C双键(A型连接)缩合形成的寡聚物或多聚物[8]。
近年来,通过体外酪氨酸酶抑制实验,发现鱼尾葵果皮和果肉[9]、鳄梨果实[10]、高山榕叶[11]、茶树叶[12]、银合欢叶和果[13]等植物的缩合单宁均有明显的酪氨酸酶抑制作用。花生衣缩合单宁提取物可以降低人体HMV-II黑色素瘤细胞中黑色素的生成[14]。杨梅叶中的缩合单宁能有效抑制小鼠B16黑色素瘤细胞的增殖和黑色素的生成[15]。但上述研究多集中于探讨植物缩合单宁对酪氨酸酶的体外抑制情况,或简单地分析植物缩合单宁对黑色素瘤细胞的增殖、黑色素含量等影响方面,而涉及植物缩合单宁对黑色素瘤细胞黑色素合成调控机理的研究还鲜有报道。
酸枣(Ziziphus jujuba Mill. var. spinosa)是一种鼠李科枣属的落叶灌木,多分布于我国华北地区,具有较高的营养和药用价值,是我国传统的中药资源,具有极大的开发潜力及市场前景[16]。其中酸枣仁已被作为治疗失眠的临床药材被广泛使用,酸枣叶提取物也具有明显的镇静安神作用[17]。目前酸枣叶中被鉴定的化合物主要是黄酮及皂苷类化合物,包括芦丁、儿茶素、棓儿茶素、表儿茶酚、大枣皂苷等[18-19]。孙艳等[20-21]的研究表明,酸枣叶黄酮及皂苷均具有良好的抗氧化损伤的功效。然而,目前国内外针对酸枣叶中以儿茶素或棓儿茶素为结构单元构成的缩合单宁的研究尚未见报道。基于此,本文旨在提取分离酸枣叶缩合单宁,鉴定其结构特征,研究其对酪氨酸酶的抑制动力学和作用机理,并利用细胞生物学和分子生物学技术探讨酸枣叶缩合单宁对小鼠黑色素瘤黑色素合成的影响和抑制机制,为酸枣叶资源在食品保鲜、美容医药等行业的利用提供理论基础。
1. 材料与方法
1.1 材料与仪器
蘑菇酪氨酸酶(3030 U/mg)、3,4-二羟基苯丙氨酸(L-多巴)、表儿茶素、棓儿茶素、苄硫醇、苯基硫脲、二甲基亚砜、Triton X-100 美国Sigma公司;L-酪氨酸、氯化铜、高碘酸钠 上海生工生物工程有限公司;Invitrogen TRIzol 赛默飞世尔科技公司;SYBR Premix Ex Taq 宝日医生物技术(北京)有限公司;乙腈 色谱纯,上海迈瑞尔化学技术有限公司;甲醇、乙醇、丙酮、石油醚、乙酸乙酯、盐酸、三氟乙酸等 分析纯,国药集团化学试剂有限公司;小鼠黑色素瘤细胞(B16F10) 厦门大学陈清西课题组馈赠;DMEM完全多糖培养基 江苏凯基生物技术股份有限公司;胎牛血清 上海逍鹏生物科技有限公司;CCK-8 上海炎熙生物科技有限公司;酸枣幼叶 采自河南省平顶山市祥云公园。
18N/A冷冻干燥机 宁波新芝生物科技股份有限公司;N-1200BV-W旋转蒸发仪 深圳市科力易翔仪器设备有限公司;Nanodrop 2000/2000 C紫外分光光度计、Varioskan LUX多功能酶标仪、II 3110型CO2培养箱 赛默飞世尔科技(中国)有限公司;Agilent 1200高效液相色谱仪 安捷伦科技有限公司;QTRAP3200离子阱质谱仪 SCIEX公司;F-4600荧光分光光度计 日立高新技术公司;Guava easyCyte流式细胞仪 密理博(中国)有限公司;BKE-1002HT小型超声波清洗仪 杭州博可超声波设备有限公司。
1.2 实验方法
1.2.1 酸枣叶缩合单宁的提取与纯化
酸枣幼叶经纯水清洁干净,冷冻干燥研磨粉碎,置于−20 ℃待用。酸枣叶缩合单宁的提取与纯化参照Chen等[13]的方法,将样品粉末与70%的丙酮水溶液以1:3的比例混合均匀,30 ℃ 40 kHz超声提取3次,每次30 min,溶液进行真空抽滤除去残渣,合并所有滤液后旋转蒸发除去丙酮。将获得的粗提液依次经石油醚、乙酸乙酯分别萃取3次,包含缩合单宁粗提物的水相部分经旋转蒸发去有机溶剂后上Sephadex LH-20(30×2.5 cm i.d.)凝胶柱,先用500 mL 50%甲醇水溶液作洗脱液去除糖类、氨基酸、非酚类苷等杂质,再用500 mL 70%丙酮水溶液洗脱并收集纯化的单宁组分,并于38 ℃旋转蒸发除去有机溶剂丙酮,水相冷冻干燥得到酸枣叶缩合单宁纯化物样品,纯度约为98.9%。
1.2.2 酸枣叶缩合单宁结构特征的鉴定
参照Song等[22]的方法,运用硫醇降解结合高效液相色谱-电喷雾电离质谱(Thiolysis-HPLC-ESI-MS)鉴定酸枣叶缩合单宁的结构特征。首先在2 mL棕色瓶中依次加入250 μL含3.3% HCl的甲醇溶液、250 μL 10 mg/mL酸枣叶缩合单宁的甲醇溶液以及500 μL含5%苄硫醇的甲醇溶液,混匀后于40 ℃水浴30 min,然后冷却至室温,使用0.22 μm滤膜过滤后的苄硫醇解产物进行反相HPLC-ESI-MS分析。
采用的反相HPLC-ESI-MS条件如下:色谱仪Agilent 1200;质谱仪QTRAP 3200,负离子模式;色谱柱Hypersil ODS(5.0 µm,4.6 mm×250 mm);流动相:A为水(含0.5%三氟乙酸)、B为乙腈;梯度洗脱条件:0~45 min,12%~80% B;45~50 min,80%~12% B;检测条件:DAD,280 nm;进样量:20 μL;流速:l mL/min;柱温:25 ℃。
1.2.3 酸枣叶缩合单宁对酪氨酸酶抑制作用的研究
1.2.3.1 酪氨酸酶单酚酶抑制活性的测定
参照Cui等[23]的方法,以L-酪氨酸为底物,在Na2HPO4-NaHPO4缓冲液(pH6.8)中,加入浓度为2 mmol/L的底物溶液、0.2 mg/mL的酪氨酸酶溶液及不同浓度的酸枣叶缩合单宁溶液,立即混合均匀,在30 ℃恒温条件下检测475 nm 处光密度值随反应时间的增长曲线,由反应曲线直线部分的斜率计算出单酚酶的稳态活力。在此测活体系中,酪氨酸酶的终浓度为6.67 μg/mL。
1.2.3.2 酪氨酸酶二酚酶抑制活性的测定
参照Singh等[24]的方法,以L-多巴为底物,将不同浓度的酸枣叶缩合单宁溶液及0.1 mg/mL的酪氨酸酶溶液加入到底物浓度为0.5 mmol/L的Na2HPO4-NaHPO4缓冲液(pH6.8)溶液中,立即混合均匀,在30 ℃恒温条件下检测475 nm 处光密度值随反应时间增长的直线,由直线的斜率计算出二酚酶的活力。在此测活体系中,酪氨酸酶的终浓度为3.33 μg/mL。
1.2.3.3 酪氨酸酶二酚酶抑制机理的判定
固定L-多巴的浓度,改变酪氨酸酶的加入量,测定不同浓度酸枣叶缩合单宁对酪氨酸酶催化L-多巴氧化活力的影响,以剩余酶活力对加入的酶量作图,如果得到一组通过原点的直线,说明酸枣叶缩合单宁对酪氨酸酶二酚酶的抑制作用是可逆的,如果得到一组平行的直线,则说明抑制作用是不可逆的。
1.2.3.4 酪氨酸酶二酚酶抑制类型的判定
固定酪氨酸酶的浓度,改变L-多巴的加入量,测定不同浓度酸枣叶缩合单宁对酪氨酸酶催化L-多巴氧化活力的影响,利用Lineweaver-Burk双倒数法,以底物浓度的倒数为X轴,反应速率的倒数为Y轴,来判定抑制剂的抑制类型。同时,计算出直线的斜率和Y轴的截距,并根据它们对酸枣叶缩合单宁浓度的二次作图推测效应物对酪氨酸酶的抑制常数和对酶-底物络合物的抑制常数。
1.2.4 无酶条件下多巴氧化检测
L-多巴可被NaIO4氧化产生多巴醌,在475 nm处会产生特征吸收峰。参照Song等[22]的方法检测无酪氨酸酶体系中,不同浓度的酸枣叶缩合单宁(0、200和400 μg/mL)抑制L-多巴氧化的效果。反应体系如表1所示,采用紫外可见分光光度计记录多巴醌的产率,扫描波长段为240~800 nm。
表 1 无酶条件下L-多巴氧化反应体系Table 1. Oxidation reaction systems of L-3,4-dihydroxyphenylalanine without tyrosinase组别 L-多巴浓度(mg/mL) NaIO4浓度(mg/mL) 缩合单宁浓度(mg/mL) 1 1.0 0 0 2 1.0 0 0.2 3 1.0 0 0.4 4 1.0 1.0 0 5 1.0 1.0 0.2 6 1.0 1.0 0.4 1.2.5 荧光光谱检测
参照Song等[25]的研究,采用荧光分光光度计研究酸枣叶缩合单宁对酪氨酸酶的荧光淬灭作用。将0.05 mL不同浓度的酸枣叶缩合单宁(0、50、100、150和200 μg/mL)加入终体积为0.35 mL的酪氨酸酶溶液(0.10 mg/mL)中,充分混匀,于30 ℃水浴中温育1 min后,测定荧光光谱。荧光发射波长设定为290~500 nm,激发波长290 nm,激发和发射的狭缝宽度均设置为5 nm。
1.2.6 细胞培养
使用DMEM高糖培养基(含有10%的胎牛血清和1%的青霉素-链霉素溶液)在37 ℃、5% CO2环境中培养B16F10细胞,细胞长至对数生长期时,进行传代及后续实验。
1.2.7 B16F10细胞增殖抑制率的测定
参照杨安全等[26]的方法,将生长至对数期的B16F10细胞接种进96孔板中,37 ℃常规培养12 h后,更换为含不同药物浓度的新培养液继续培养24 h,每个浓度设置5个复孔,药物处理24 h后,加入10 μL的CCK-8溶液,培养3 h后,在450 nm处测量每个孔的吸光值。
1.2.8 B16F10细胞酪氨酸酶活性的测定
参照Chatatikun等[27]的方法,收集B16F10细胞沉淀,加入含有1% Triton X-100的磷酸缓冲液,超声后在4 ℃下抽提1 h。4 ℃12000 g离心20 min,所收集的上清,即为B16F10细胞中的酪氨酸酶粗提液。将20 μL不同浓度的酸枣叶缩合单宁溶液、130 μL恒温30 ℃的L-多巴溶液、30 μL B16F10细胞中的酪氨酸酶粗提液加入96孔酶标板中,混合均匀后,30 ℃反应30 min。最后每孔加入6 μL苯基硫脲的饱和溶液。测定475 nm处的OD值,每一浓度设3个复孔,取平均值。细胞内相对酶活力的计算公式如下:
1.2.9 B16F10细胞相对黑色素含量的测定
参照Nikomatsu等[28]的方法,将B16F10细胞接种在10 cm培养板中,常规培养12 h后换为含有不同浓度酸枣叶缩合单宁的培养液,继续培养24 h,pH7.2的磷酸缓冲液洗涤3次,加入1.0 mL含10% DMSO的浓度为1.0 mol/L NaOH溶液,80 ℃水浴孵育2 h,1000 g离心10 min,取上清液分别测定570和405 nm处的吸光度值。相对黑色素含量的计算公式为:
1.2.10 实时定量荧光PCR检测
参考Song等[25]的方法,根据GenBank中小鼠酪氨酸酶基因(Tyrosinase, TYR)、酪氨酸酶相关蛋白-1(Tyrosinase related protein 1, TRP-l)基因及小眼畸形相关转录因子基因(Microphthalmia-associated transcription factor, MITF)的序列,利用Oligo 7软件设计引物,并在NCBI软件中检测其特异性,由上海生工股份有限公司合成,引物具体序列如表2所示。采用异硫氰酸胍-苯酚法抽提B16F10细胞中总RNA,将总RNA反转录成cDNA。在PCR体系中加入SYBR荧光染料,实时监测反应进程。使用β-肌动蛋白(β-actin)基因作为内参,检测酸枣叶缩合单宁处理后B16F10细胞内TYR、TRP-l及MITF等基因的相对表达。
表 2 黑色素生成相关基因的引物序列Table 2. Primer sequences of melanogenesis-related genes基因 上游引物序列 下游引物序列 β-actin 5'--ACCGTGAAAAGATGACCCAG-3' 5'-TACGGATGTCAACGTCACAC-3' TYR 5'-GGCCAGCTTTCAGGCAGAGGT-3' 5'-TGGTGCTTCATGGGCAAAATC-3' TRP-1 5'--GCTGCAGGAGCCTTCCTC-3' 5'--AAGACGCTGCACTGCTGGTCT-3' MITF 5'-GCTGGAGATGCAGGCTAGAG-3' 5'-GAGAGGGCATCGTCCATCAG-3' 1.3 数据处理
实验结果以平均值±标准差(n=3)的形式表示,采用SPSS 19.0统计软件进行数据分析,使用SigmaPlot 12.0进行绘图。
2. 结果与分析
2.1 Thiolysis-HPLC-ESI-MS分析
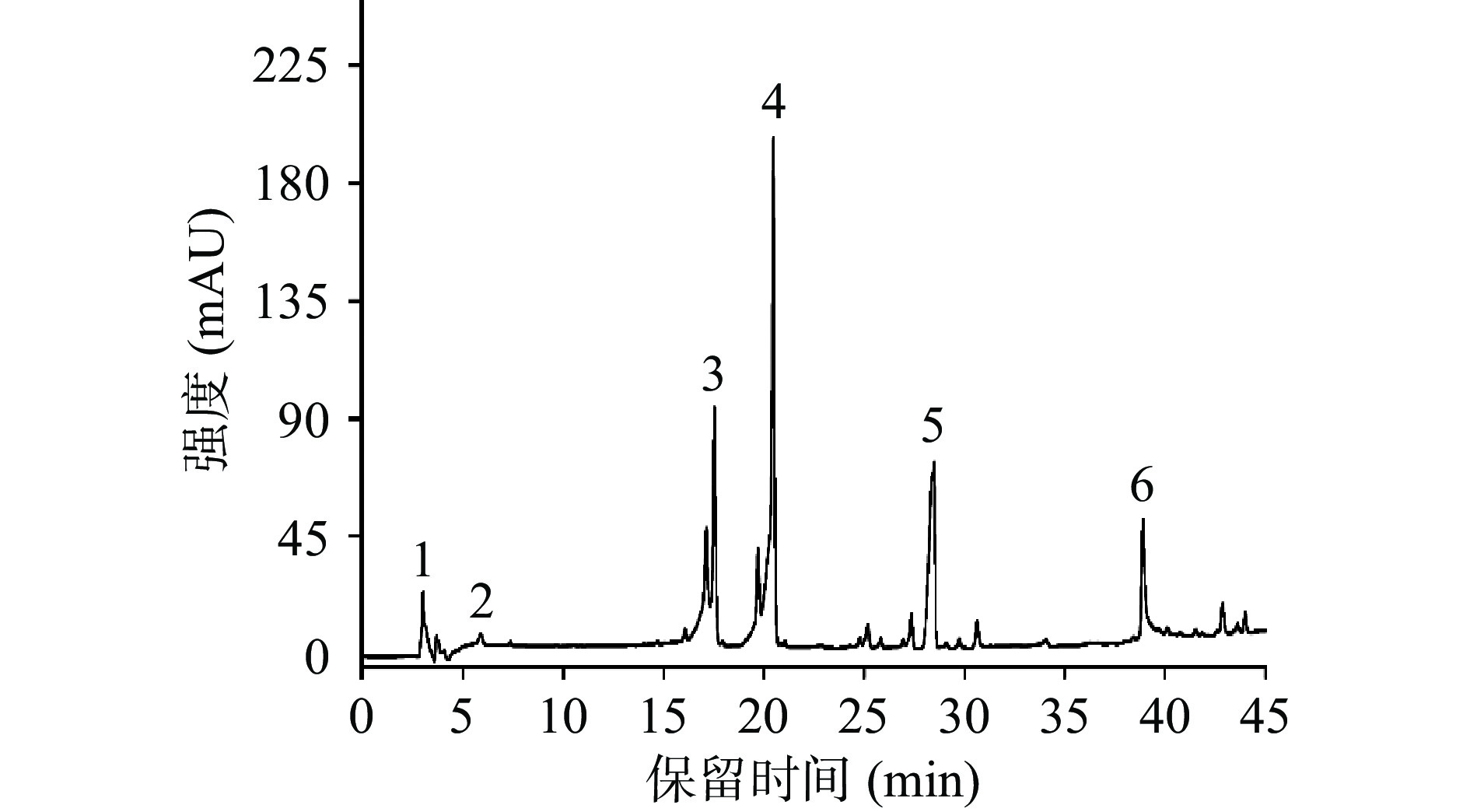
图1为酸枣叶缩合单宁硫醇降解产物的反相HPLC色谱图。通过与标样的保留时间及其质谱数据进行比对,可以确定峰1和2分别为棓儿茶素(m/z 305)和表儿茶素(m/z 289),为酸枣叶缩合单宁的末端单元。另外,质谱数据显示峰3和4的分子离子[M – H]– 分别为m/z 427和411。参考Chen等[13]的研究,可以认定它们为(表)棓儿茶素苄硫醚衍生物和(表)儿茶素苄硫醚衍生物,为酸枣叶缩合单宁的延伸单元。由于缺乏相应的降解产物标准品,仅仅根据这些质谱数据难以确定它们的立体化学结构。峰5和6则为过量的苄硫醇和硫醇降解副产物。结果表明,酸枣叶缩合单宁主要是由(表)儿茶素构成的原花青素类型,同时还伴有由(表)棓儿茶素构成的原翠雀素类型。
2.2 酸枣叶缩合单宁对酪氨酸酶单酚酶的抑制效果
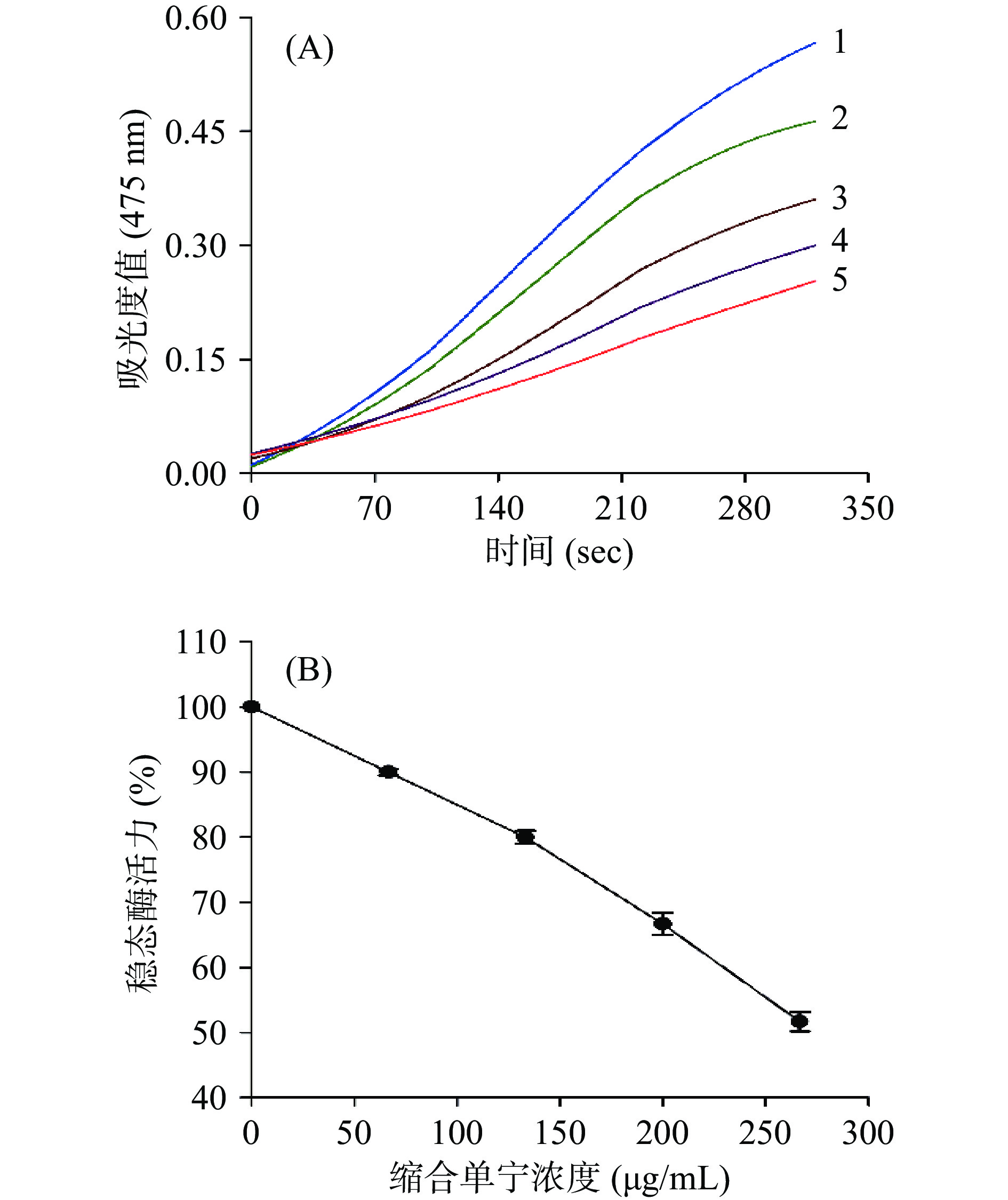
通过L-酪氨酸的氧化反应测定酸枣叶缩合单宁对酪氨酸酶单酚酶的影响。该反应有一个明显的滞后期,反应速率在滞后期过后快速增大,随着反应进行,逐渐趋于平缓。将产物生成的曲线延长至X轴,延长曲线的斜率即为反应的稳态斜率。如图2所示,随着酸枣叶缩合单宁浓度的增加,300 s反应时间内生成产物的量逐渐降低,稳态酶活力逐渐下降。从图2B中可以看出,当枣叶缩合单宁浓度为266.67 μg/mL时,相较于缩合单宁浓度为0 μg/mL时,相对稳态酶活力从100%降低了48.33%。由此可见,酸枣叶缩合单宁能够通过降低单酚酶的稳态酶活性抑制酪氨酸酶的活性。据Chai等[29]的报道,推测酸枣叶缩合单宁对酪氨酸酶的抑制活性依赖于其含有酚羟基的基本结构单元,其与L-酪氨酸结构相似,因此酸枣叶缩合单宁可以与底物竞争酶的结合位点,阻碍L-酪氨酸的羟基化进程,从而抑制酪氨酸酶的催化活性。
2.3 酸枣叶缩合单宁对酪氨酸酶二酚酶的抑制效果、机理及类型
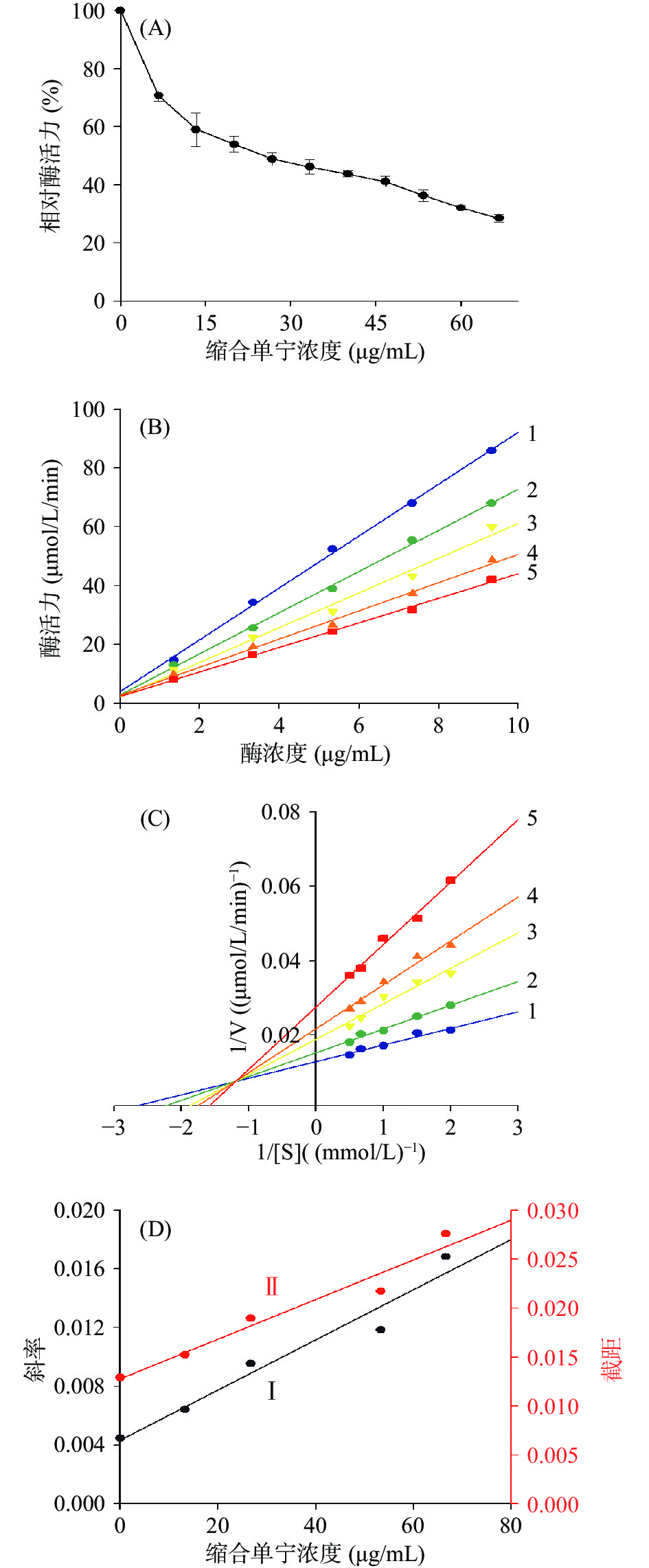
如图3A所示,随着酸枣叶缩合单宁浓度的增加,二酚酶的活性呈剂量依赖性下降的趋势。根据酸枣叶缩合单宁浓度曲线,测定导致酪氨酸酶二酚酶活性下降一半时的抑制剂浓度IC50的值为24.28±1.61 μg/mL。相比于常用的美白化妆品添加剂熊果苷(IC50=2.97 mg/mL)及甘草提取物(IC50=2.94 mg/mL)[30],酸枣叶缩合单宁对酪氨酸酶的抑制作用更强,具有较高的开发潜力。另外,表3还列出了酸枣叶缩合单宁与其它缩合单宁对酪氨酶抑制效果的比较。从中可以看出,酸枣叶缩合单宁具有更强的酪氨酸酶抑制活性,这可能与其结构单元组成相关。从结构层面上比较,苯环上含有酚羟基的量从高到低依次为:(表)棓儿茶素>(表)儿茶素>(表)阿福豆素。酸枣叶缩合单宁结构单元中由于(表)棓儿茶素含量较高,酚羟基含量也更多,因此抑酶效果更强[31]。
以酸枣叶缩合单宁为效应物,固定底物浓度,改变酶的添加量,进一步研究酸枣叶缩合单宁对二酚酶的抑制机理。如图3B所示,酶浓度相同时,随着酸枣叶缩合单宁浓度的增大,酶活力逐渐下降。以不同缩合单宁浓度下的剩余酶活力相对于酶浓度作图,得到了一组穿过原点的直线。这些直线的斜率随着抑制剂浓度的增加而减小,说明酸枣叶缩合单宁对酪氨酸酶的抑制作用是可逆的,抑制剂并没有减少有效的酶量,而是通过降低酶的催化效率达到抑制酶活性的效果。
采用Lineweaver-Burk作图法判定酸枣叶缩合单宁对酪氨酸酶二酚酶的抑制类型。如图3C所示,1/V对1/[S]作图得到一组相交于第二象限的直线。根据已有报道[33-34]可知,酸枣叶缩合单宁是酪氨酸酶二酚酶的混合型抑制剂,该抑制剂不仅能与游离酶结合,也与酶-底物复合物结合。酸枣叶缩合单宁对酪氨酸酶的抑制常数KI和对酶-底物复合物的抑制常数KIS分别为25.10和60.82 μg/mL。KI值低于KIS值,说明酸枣叶缩合单宁与游离酶的亲和力强于和酶-底物复合物的亲和力[10]。通过与不同化合物的比较可以看出(表3),大部分缩合单宁及黄酮类化合物对酪氨酸酶的抑制类型多为混合型,而熊果苷、紫红素等单体化合物的抑制类型多为单一的竞争型。Chen等[32]认为,当抑制剂结构组成单一时,可能会产生竞争性抑制;而缩合单宁这种由黄烷-3-醇为基本结构单元构成的多聚物,往往会产生混合型抑制类型。综上所述,酸枣叶缩合单宁是一个高效的、可逆的混合型酪氨酸酶抑制剂。
2.4 酸枣叶缩合单宁对高碘酸钠氧化L-多巴反应的影响
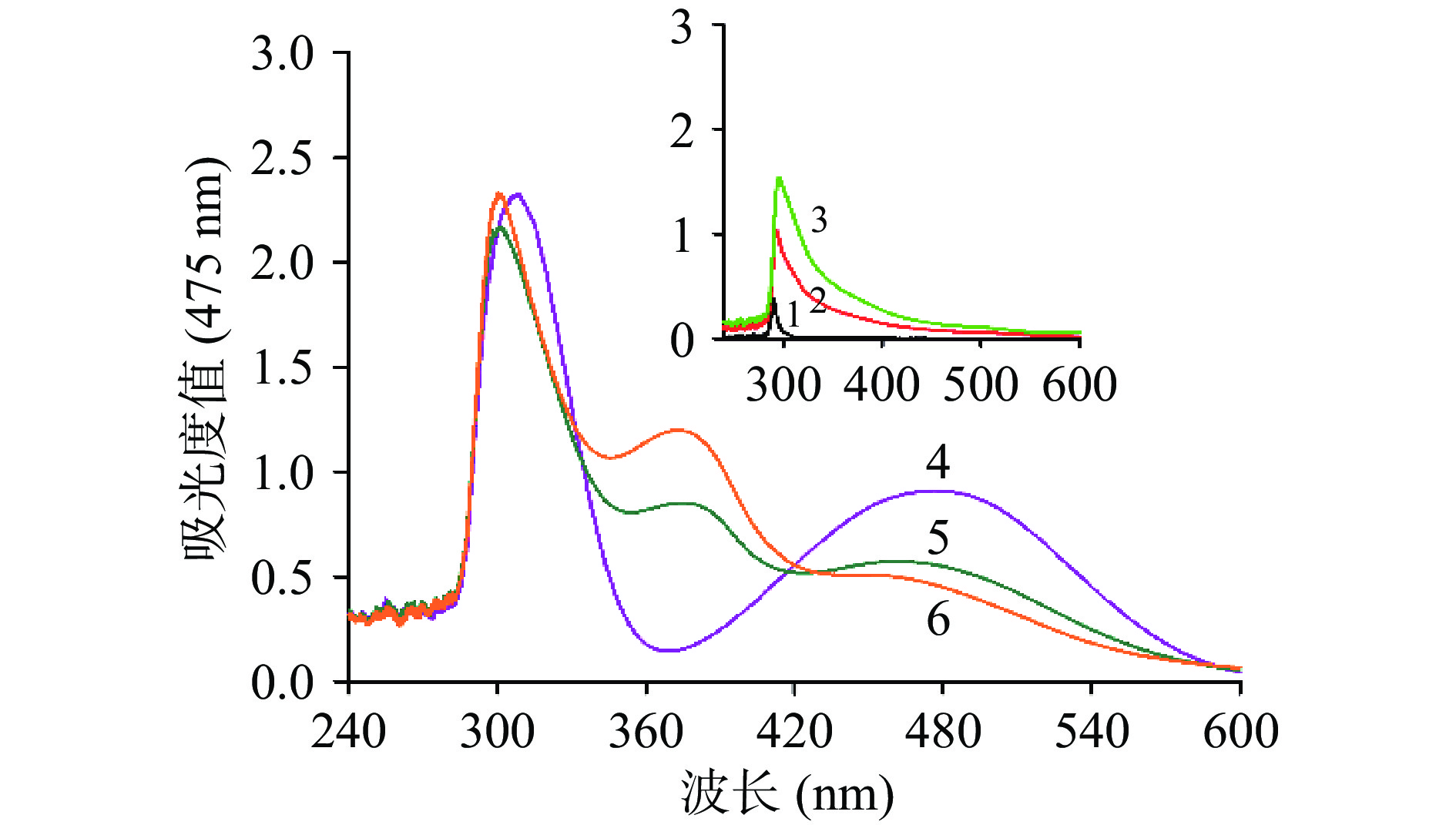
L-多巴可被氧化生成多巴醌,多巴醌经过分子内环化可生成无色多巴色素,进而被另一分子的多巴醌氧化生成多巴色素,最终产生黑色素[35]。为了阐述酸枣叶缩合单宁对酪氨酸酶的抑制机制,采用强氧化剂高碘酸钠氧化L-多巴,检测L-多巴在不同浓度酸枣叶缩合单宁存在时的的反应情况。如图4所示,前三组反应中不加入高碘酸钠,发现L-多巴不能被氧化;后三组反应体系中加入高碘酸钠时,L-多巴被氧化为多巴醌,进而生成多巴色素,因此在475 nm出现多巴色素的特征吸收峰。随着酸枣叶缩合单宁的加入,特征峰的吸光值明显降低,表明酸枣叶缩合单宁可以抑制高碘酸钠的氧化能力。酪氨酸酶催化L-多巴生成多巴醌的过程是一个氧化的过程,而酸枣叶缩合单宁可以通过抑制L-多巴的氧化进而抑制酪氨酸酶的活性。
2.5 荧光猝灭法分析酸枣叶缩合单宁对酪氨酸酶的作用机理
酪氨酸酶具有色氨酸、酪氨酸、苯丙氨酸等氨基酸残基,可以激发内源性荧光[25]。根据这一特性,采用荧光淬灭实验来探究酪氨酸酶和酸枣叶缩合单宁的相互作用。酪氨酸酶的荧光发射光谱如图5所示,随着酸枣叶缩合单宁浓度的增大,激发的荧光强度也逐渐降低,且特征峰也产生轻微蓝移。由此证明酸枣叶缩合单宁不仅能与酪氨酸酶结合,淬灭其固有的荧光,而且影响了发生荧光淬灭的氨基酸残基的疏水性环境。
2.6 酸枣叶缩合单宁对B16F10细胞增殖的影响
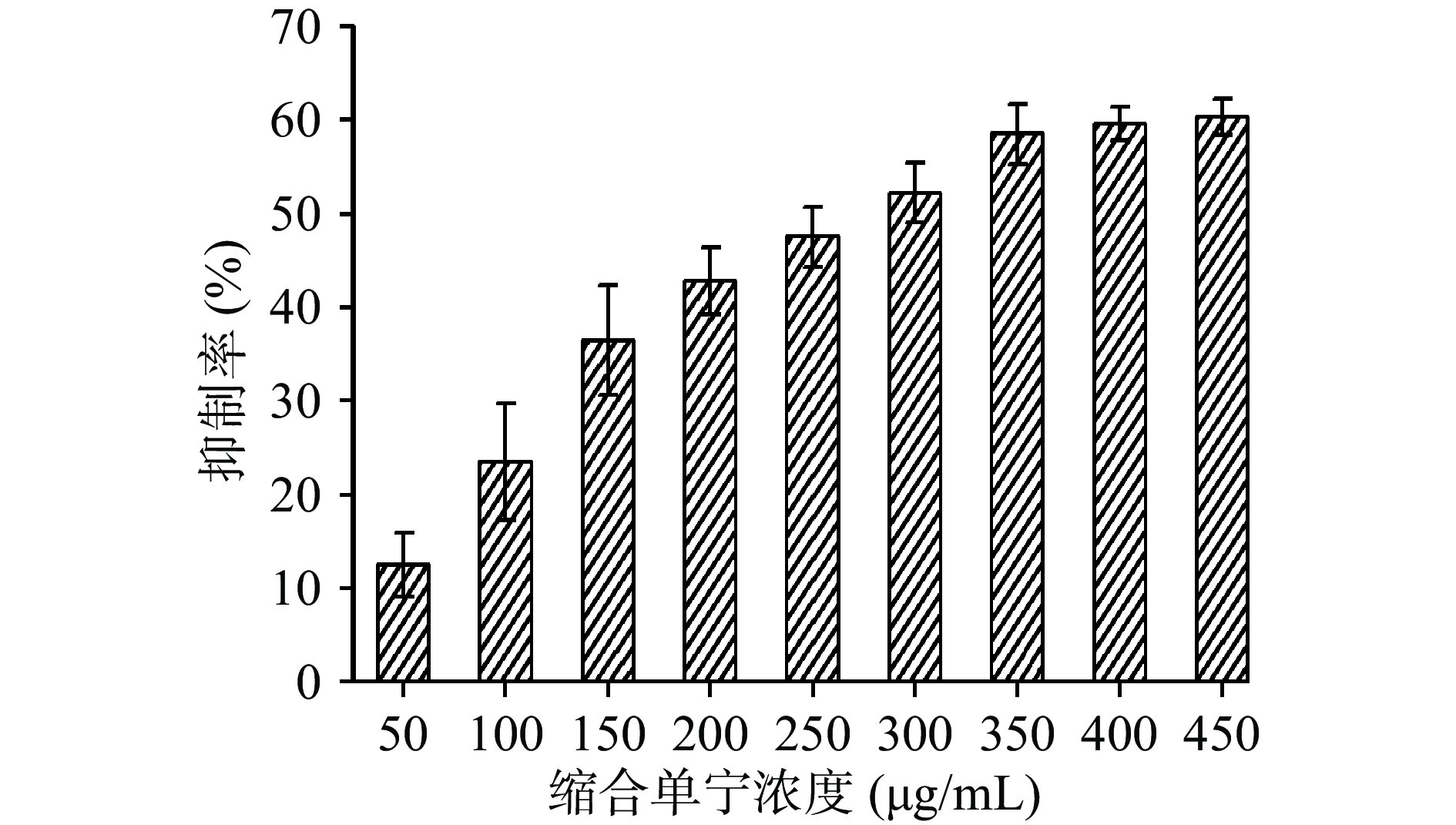
已有报道表明,植物缩合单宁对B16F10细胞的增殖具有明显的抑制效果[25]。本研究以酸枣叶缩合单宁为效应物,研究B16F10细胞在不同浓度效应物作用下抑制率的变化。如图6所示,酸枣叶缩合单宁浓度由0 μg/mL增加至350 μg/mL的过程中,细胞活性的抑制率由13.44%迅速增加至58.45%,而继续增大浓度后,抑制率增加的速度明显减缓。
2.7 酸枣叶缩合单宁对B16F10细胞酪氨酸酶活力和黑色素生成量的影响
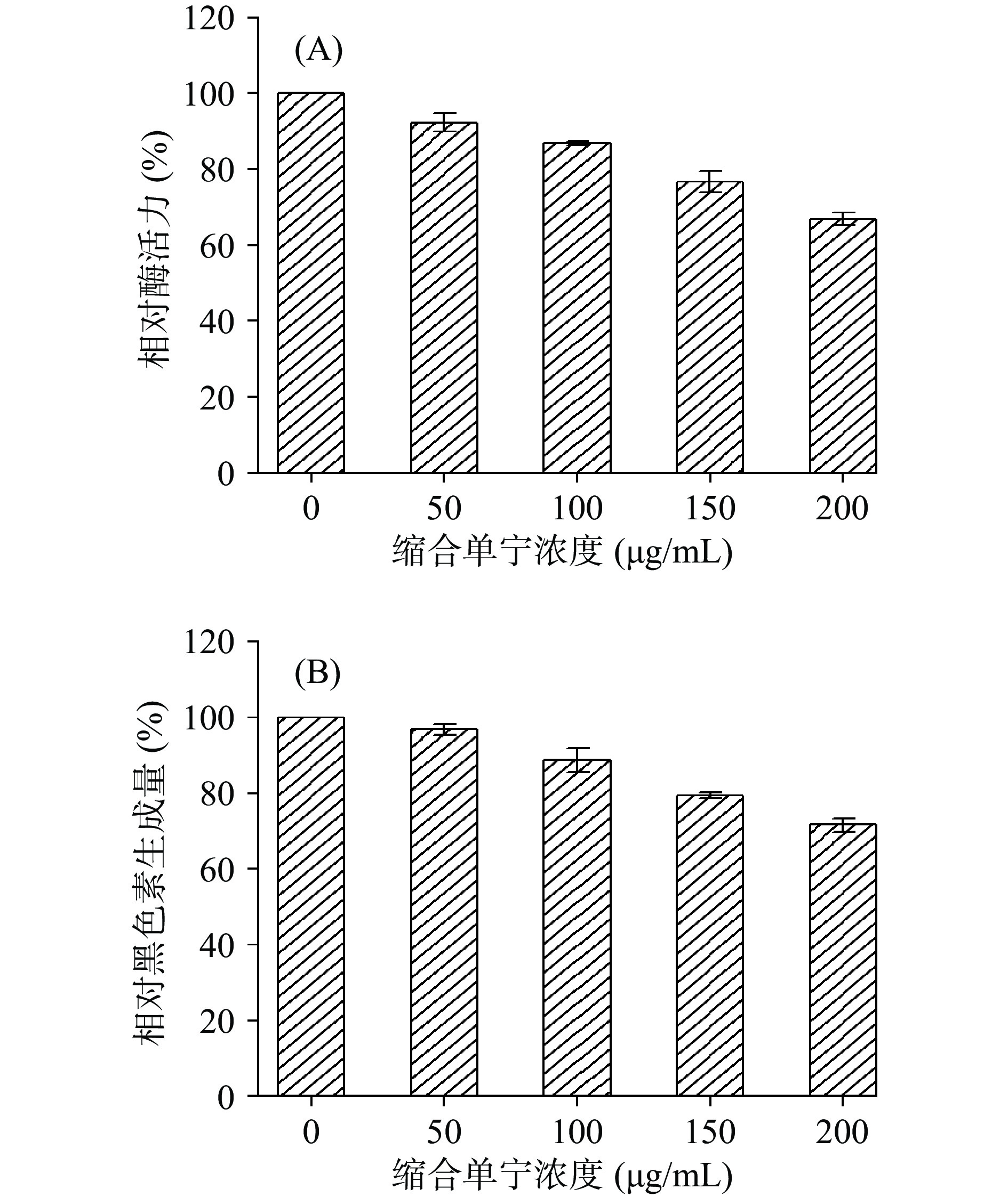
由图7可知,酸枣叶缩合单宁能明显抑制B16F10细胞酪氨酸酶活性和黑色素生成;当酸枣叶缩合单宁浓度由0 μg/mL增加至200 μg/mL时,B16F10细胞内相对酪氨酸酶的活性由100%降低至66.81%,而黑色素相对生成量也降低了28.35%,且抑制效果都呈现出一定的剂量依赖性。结果表明,B16F10细胞酪氨酸酶与蘑菇酪氨酸酶的活性都可被酸枣叶缩合单宁抑制,但抑制效果与细胞外酶活检测相比偏弱,这可能是由于B1F10细胞酪氨酸酶与蘑菇酪氨酸酶活性中心的结构差异及酶活测定方法不同导致[15]。
2.8 酸枣叶缩合单宁对B16F10细胞黑色素生成相关基因表达的影响
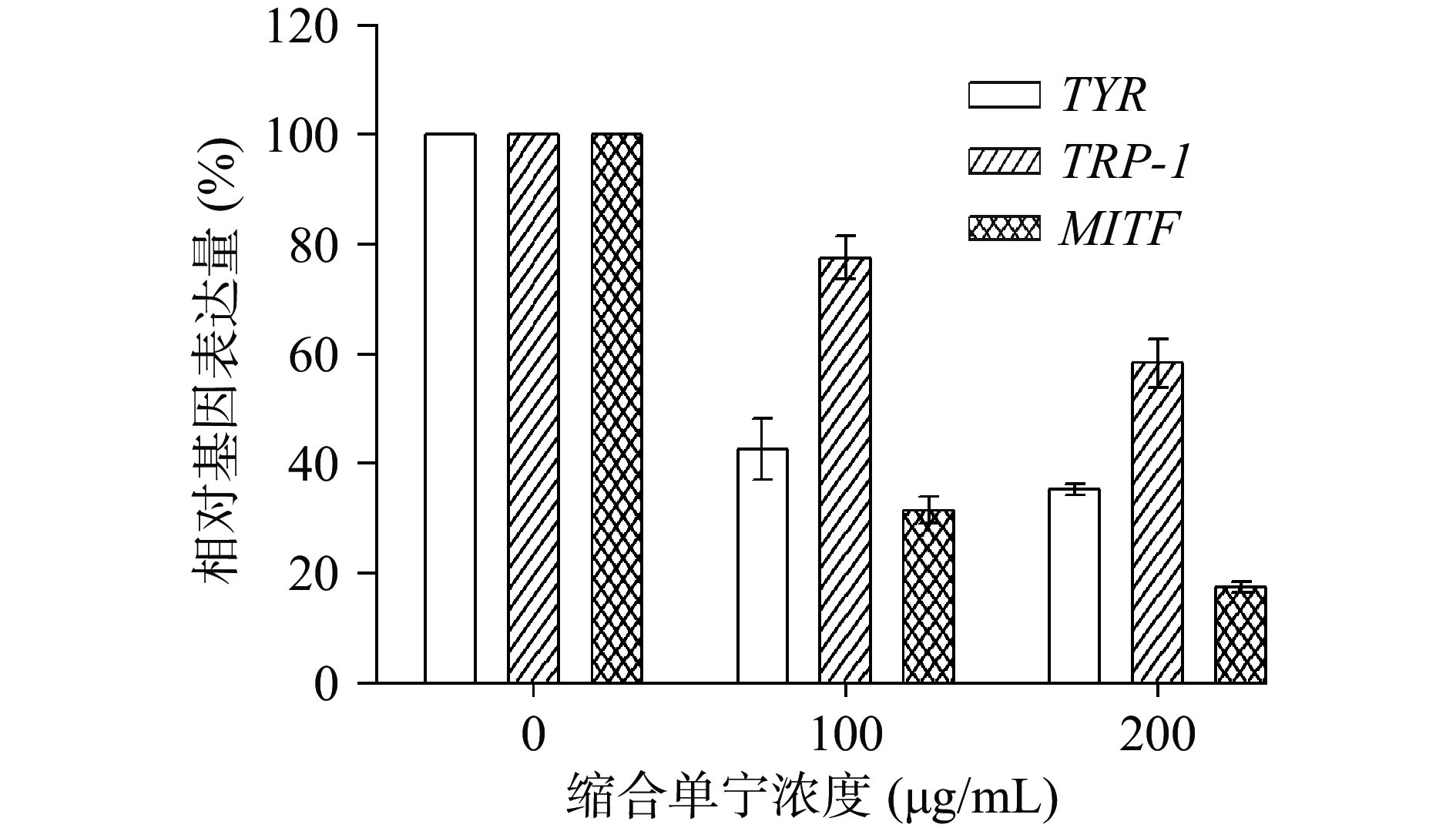
具有螺旋-环-螺旋-亮氨酸拉链结构的MITF可以通过调节TYR和TRP-1的表达来调控黑色素细胞的增殖分化及黑色素的合成过程[36]。B16F10细胞能在酪氨酸酶家族的调控下,经由黑色素生成相关基因MITF、TYR、TRP-1的介导,产生大量黑色素。本研究以酸枣叶缩合单宁为效应物,探究不同浓度效应物对B16F10细胞内TYR、TRP-1、MITF的mRNA表达量的影响。如图8所示,与对照组相比(0 μg/mL),200 μg/mL的酸枣叶缩合单宁处理B16F10细胞后,TYR、TRP-1、MITF基因的相对表达量分别降低了65%、38%和83%。结果表明,酸枣叶缩合单宁可通过抑制B16F10细胞内黑色素生成相关基因的表达来调控黑色素的合成。
3. 结论
综上所述,酸枣叶缩合单宁主要是由(表)儿茶素构成的原花青素类型,同时伴有由(表)棓儿茶素构成的原翠雀素类型。酸枣叶缩合单宁可有效抑制酪氨酸酶单酚酶和二酚酶的活性,是二酚酶的可逆混合型抑制剂。酸枣叶缩合单宁可能通过抑制B16F10细胞的增殖、降低细胞内的氨酸酶活性以及黑色素合成相关基因的表达水平来调控细胞中黑色素生成量。实验结果表明酸枣叶缩合单宁具有开发为酪氨酸酶抑制剂的潜力,为后期酸枣叶资源的综合利用提供了实验依据和理论基础。
-
表 1 无酶条件下L-多巴氧化反应体系
Table 1 Oxidation reaction systems of L-3,4-dihydroxyphenylalanine without tyrosinase
组别 L-多巴浓度(mg/mL) NaIO4浓度(mg/mL) 缩合单宁浓度(mg/mL) 1 1.0 0 0 2 1.0 0 0.2 3 1.0 0 0.4 4 1.0 1.0 0 5 1.0 1.0 0.2 6 1.0 1.0 0.4 表 2 黑色素生成相关基因的引物序列
Table 2 Primer sequences of melanogenesis-related genes
基因 上游引物序列 下游引物序列 β-actin 5'--ACCGTGAAAAGATGACCCAG-3' 5'-TACGGATGTCAACGTCACAC-3' TYR 5'-GGCCAGCTTTCAGGCAGAGGT-3' 5'-TGGTGCTTCATGGGCAAAATC-3' TRP-1 5'--GCTGCAGGAGCCTTCCTC-3' 5'--AAGACGCTGCACTGCTGGTCT-3' MITF 5'-GCTGGAGATGCAGGCTAGAG-3' 5'-GAGAGGGCATCGTCCATCAG-3' -
[1] ZOLGHADRI S, BAHRAMI A, HASSAN KHAN M T, et al. A comprehensive review on tyrosinase inhibitors[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2019,34(1):279−309. doi: 10.1080/14756366.2018.1545767
[2] KUMARI S, THNG S, VERMA N K, et al. Melanogenesis inhibitors[J]. Acta Dermato-Venereologica,2018,98(10):924−931. doi: 10.2340/00015555-3002
[3] SHAO Y, JIANG Z, ZENG J, et al. Effect of ethanol fumigation on pericarp browning associated with phenol metabolism, storage quality, and antioxidant systems of wampee fruit during cold storage[J]. Food Science and Nutrition,2020,8(7):3380−3388. doi: 10.1002/fsn3.1617
[4] CHAI W M, WEI Q M, DENG W L, et al. Anti-melanogenesis properties of condensed tannins from Vigna angularis seeds with potent antioxidant and DNA damage protection activities[J]. Food and Function,2019,10(1):99−111. doi: 10.1039/C8FO01979G
[5] KIM J H, KIM M R, LEE E S, et al. Inhibitory effects of calycosin isolated from the root of Astragalus membranaceus on melanin biosynthesis[J]. Biological and Pharmaceutical Bulletin,2009,2:264−268.
[6] ZHANG X, HU X, HOU A, et al. Inhibitory effect of 2, 4, 2', 4'-tetrahydroxy-3-(3-methyl-2-butenyl)-chalcone on tyrosinase activity and melanin biosynthesis[J]. Biological and Pharmaceutical Bulletin,2009,32(1):86−90. doi: 10.1248/bpb.32.86
[7] 林益明, 向平, 林鹏. 红树林单宁的研究进展[J]. 海洋科学,2005,29:59−63. [LIN Y M, XIANG P, LIN P. Studies on tannins of mangroves-a review[J]. Marine Sciences,2005,29:59−63. [8] SALMINEN J P. Two-dimensional tannin fingerprints by liquid chromatography tandem mass spectrometry offer a new dimension to plant tannin analyses and help to visualize the tannin diversity in plants[J]. Journal of Agricultural and Food Chemistry,2018,66(35):9162−9171. doi: 10.1021/acs.jafc.8b02115
[9] CHEN X X, LIANG G, CHAI W M, et al. Antioxidant and antityrosinase proanthocyanidins from Polyalthia longifolia leaves[J]. Journal of Bioscience and Bioengineering,2014,118(5):583−587. doi: 10.1016/j.jbiosc.2014.04.015
[10] CHAI W M, WEI M K, WANG R, et al. Avocado proanthocyanidins as a source of tyrosinase inhibitors: Structure characterization, inhibitory activity, and mechanism[J]. Journal of Agricultural and Food Chemistry,2015,63(33):7381−7387. doi: 10.1021/acs.jafc.5b03099
[11] DENG Y T, LIANG G, SHI Y, et al. Condensed tannins from Ficus altissima leaves: Structural, antioxidant, and antityrosinase properties[J]. Process Biochemistry,2016,51(8):1092−1099. doi: 10.1016/j.procbio.2016.04.022
[12] SONG W, ZHU X F, DING X D, et al. Structural features, antioxidant and tyrosinase inhibitory activities of proanthocyanidins in leaves of two tea cultivars[J]. International Journal of Food Properties,2017,20:1348−1358. doi: 10.1080/10942912.2016.1209682
[13] CHEN H, SONG W, SUN K K, et al. Structure elucidation and evaluation of antioxidant and tyrosinase inhibitory effect and mechanism of proanthocyanidins from leaf and fruit of Leucaena leucocephala[J]. Journal of Wood Chemistry and Technology,2018,38(6):430−444. doi: 10.1080/02773813.2018.1533975
[14] TATSUNO T, JINNO M, ARIMA Y, et al. Anti-inflammatory and anti-melanogenic proanthocyanidin oligomers from peanut skin[J]. Biological and Pharmaceutical Bulletin,2012,35(6):909−916. doi: 10.1248/bpb.35.909
[15] 傅瑜. 杨梅叶原花色素的结构鉴定以及对黑色素生成和细胞凋亡的作用研究[D]. 杭州: 浙江大学, 2015 FU Y. Structural elucidation and effect on melanogenesis and apoptosis of proanthocyanidins extracted from Chinese bayberry leaves[D]. Hangzhou: Zhejiang University, 2015.
[16] 闫艳, 付彩, 杜晨辉. 酸枣叶的营养成分、保健功能及产品开发研究进展[J]. 食品工业科技,2018,39(20):330−336. [YAN Y, FU C, DU C H. Research progress on nutrient composition, health functions and product development of Ziziphi spinosae folium[J]. Science and Technology of Food Industry,2018,39(20):330−336. doi: 10.13386/j.issn1002-0306.2018.20.056 [17] 赵新华, 伊丽楠. 酸枣叶提取物对中枢神经系统作用的实验研究[J]. 时珍国医国药,2009,20(2):463−464. [ZHAO X H, YI L N. Effect of Ziziphus jujube leaf extract on the central nervous system[J]. Lishizhen Medicine and Materia Medica Research,2009,20(2):463−464. doi: 10.3969/j.issn.1008-0805.2009.02.110 [18] ZHANG L, LIU P, LI L, et al. Identification and antioxidant activity of flavonoids extracted from Xinjiang jujube (Ziziphus jujube Mill.) leaves with ultra-high pressure extraction technology[J]. Molecules,2018,24(1):122−136. doi: 10.3390/molecules24010122
[19] 王迎进, 闫军, 周俊丽, 等. 酸枣叶多糖抗氧化性研究[J]. 食品研究与开发,2013,34(7):92−94. [WANG Y J, YAN J, ZHOU J L, et al. Study on antioxidant activities of polysaccharides from the leaves of Ziziphus jujuba var.spinosa[J]. Food Research and Development,2013,34(7):92−94. [20] 孙艳. 酸枣叶皂苷的制备及其抗氧化损伤作用的研究[D]. 天津: 天津商业大学, 2019 SUN Y. Preparation of saponins from sour jujube leaves and its antioxidative damage effect[D]. Tianjin: Tianjin University of Commerce, 2019.
[21] 孙艳, 崔旭盛, 刘静, 等. 酸枣叶黄酮的提取工艺优化及其抗秀丽隐杆线虫氧化损伤活性[J]. 食品工业科技,2020,41(8):143−150. [SUN Y, CUI X S, LIU J, et al. Optimization of extraction process of flavonoids from Ziziphus jujuba Mill var.spinosa leaves and its antioxidant damage activity in Caenorhabditis elegans[J]. Science and Technology of Food Industry,2020,41(8):143−150. doi: 10.13386/j.issn1002-0306.2020.08.023 [22] SONG W, LIU L L, REN Y J, et al. Inhibitory effects and molecular mechanism on mushroom tyrosinase by condensed tannins isolation from the fruit of Ziziphus jujuba Mill. var.spinosa (Bunge)
Hu ex H. F. Chow [J]. International Journal of Biological Macromolecules,2020,165(Pt B):1813−1821. [23] CUI Y, LIANG G, HU Y H, et al. Alpha-substituted derivatives of cinnamaldehyde as tyrosinase inhibitors: Inhibitory mechanism and molecular analysis[J]. Journal of Agricultural and Food Chemistry,2015,63(2):716−722. doi: 10.1021/jf505469k
[24] SINGH L R, CHEN Y L, XIE Y, et al. Functionality study of chalcone-hydroxypyridinone hybrids as tyrosinase inhibitors and influence on anti-tyrosinase activity[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2020,35(1):1562−1567. doi: 10.1080/14756366.2020.1801669
[25] SONG W, ZHAO Y Y, REN Y J, et al. Proanthocyanidins isolated from the leaves of Photinia×fraseri block the cell cycle and induce apoptosis by inhibiting tyrosinase activity in melanoma cells[J]. Food and Function,2021,12(9):3978−3991. doi: 10.1039/D1FO00134E
[26] 杨安全, 王菁, 沈玥琦, 等. 珍珠提取物对黑色素细胞酪氨酸酶活性和黑色素合成的影响[J]. 药物生物技术,2018,25(4):312−315. [YANG A Q, WANG J, SHEN Y Q, et al. Effects of pearl extract on the tyrosinase activity and melanogenesis of melanoma cells[J]. Pharmaceutical Biotechnology,2018,25(4):312−315. doi: 10.19526/j.cnki.1005-8915.20180407 [27] CHATATIKUN M, YAMAUCHI T, YAMASAKI K, et al. Anti-melanogenic effect of Croton roxburghii and Croton sublyratus leaves in alpha-MSH stimulated B16F10 cells[J]. Journal of Traditional and Complementary Medicine,2019,9(1):66−72. doi: 10.1016/j.jtcme.2017.12.002
[28] NIKOMATSU L, LEUNG J K, WILLIAMS D, et al. Trizene-based tyrosinase inhibitors identified by chemical genetic screening[J]. Pigment Cell Research,2016,18(6):447−453.
[29] CHAI W M, HUANG Q, LIN M Z, et al. Condensed tannins from longan bark as inhibitor of tyrosinase: Structure, activity, and mechanism[J]. Journal of Agricultural and Food Chemistry,2018,66:908−917. doi: 10.1021/acs.jafc.7b05481
[30] 吴颖, 王佳其, 唐文, 等. 蒲公英黄酮对酪氨酸酶的抑制机理[J]. 食品工业,2021,42(6):283−287. [WU Y, WANG J Q, TANG W, et al. Inhibitory effect of tyrosinase on flavonoids from dandelion[J]. The Food Industry,2021,42(6):283−287. [31] WANG M T, JIANG J, TIAN J H, et al. Inhibitory mechanism of novel allosteric inhibitor, Chinese bayberry (Myrica rubra Sieb. et Zucc.) leaves proanthocyanidins against α-glucosidase[J]. Journal of Functional Foods,2019,56:286−294. doi: 10.1016/j.jff.2019.03.026
[32] CHEN X X, SHI Y, CHAI W M, et al. Condensed tannins from Ficus virens as tyrosinase inhibitors: Structure, inhibitory activity and molecular mechanism[J]. Plos One,2014,9(3):e91809. doi: 10.1371/journal.pone.0091809
[33] MU Y, LI L, HU S Q. Molecular inhibitory mechanism of tricin on tyrosinase[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2013,107:235−240. doi: 10.1016/j.saa.2013.01.058
[34] BISWAS R, MUKHERJEE P K, DALAI M K, et al. Tyrosinase inhibitory potential of purpurin in Rubia cordifolia—A bioactivity guided approach[J]. Industrial Crops and Products,2015,74:319−326. doi: 10.1016/j.indcrop.2015.04.066
[35] 石嘉怿. 青梅花提取物的酪氨酸酶抑制作用及机理研究[J]. 食品工业科技,2011,32(10):205−211. [SHI J Y. Inbihition effect and mechanism of Prunus mume flowers extracts on tyrosinase[J]. Science and Technology of Food Industry,2011,32(10):205−211. doi: 10.13386/j.issn1002-0306.2011.10.014 [36] LECLERC J, BALLOTTI R, BERTOLOTTO C. Pathways from senescence to melanoma: Focus on MITF sumoylation[J]. Oncogene,2017,36(48):6659−6667. doi: 10.1038/onc.2017.292





 下载:
下载:




 下载:
下载:



