Analysis of Microbial Diversity of Crayfish under Different Culture Modes in Different Provinces Based on High-throughput Sequencing and Traditional Culture Methods
-
摘要: 本研究以安徽霍邱、江苏盱眙、湖北荆州三地的小龙虾作为研究对象,在荆州另取稻虾互作和养殖塘两种模式的环境样本。利用高通量技术做菌相分析,利用培养基鉴定法进行分离纯化鉴定,验证优势菌种类和数量。结果表明:荆州两组小龙虾初始菌数略低于盱眙和霍邱小龙虾,选择培养基上差别较小。高通量测序结果表明,科水平上三地小龙虾的优势菌主要为气单胞菌科和肠杆菌科;稻虾塘土壤菌群丰度远高于养殖塘,水体菌群较相似。属水平上,荆州稻虾塘、养殖塘、盱眙和霍邱四组小龙虾样本菌群丰度存在差异,但气单胞菌属和不动杆菌属都占较高比例,依次为41.8%、1.8%,12.4%、11.4%,24.5%、27.5%,40.1%,13.0%。荆州稻虾塘小龙虾优势菌还包括乳球菌属和柠檬酸杆菌属,养殖塘样本存在哈夫尼亚菌属和乳球菌属,盱眙与霍邱小龙虾样本优势菌均有微小杆菌属和柠檬酸杆菌属。培养基结果表明三地小龙虾优势菌均主要为气单胞菌属、哈夫尼亚菌属和柠檬酸杆菌属,与高通量结果相符。Abstract: In this study, crayfish from Huoqiu in Anhui Province, Xuyi in Jiangsu Province, and Jingzhou in Hubei Province were selected as the research objects. Environmental samples of two modes of rice-shrimp co-cropping and aquaculture ponds were taken from Jingzhou. High throughput technology was used to analyze the bacterial diversity, and culture-dependent method was used to isolate, purify and identify the bacteria to verify the type and quantities of dominant bacteria. The results showed that the initial bacterial count of Jingzhou crayfish was slightly lower than that of Xuyi and Huoqiu crayfish, and the difference in the selection medium was small. The results of high-throughput sequencing showed that the dominant of four samples groups bacteria were Aeromonadaceae and Enterobacteriaceae. The abundance of soil microbial community in rice shrimp pond was much higher than that in aquaculture pond, and the microbial community in water was similar. At the genus level, there were differences in the abundance of bacteria in four samples groups of crayfish samples from Jingzhou rice shrimp pond, aquaculture pond, Xuyi and Huoqiu, However, both Aeromonas and Acinetobacter accounted for a higher proportion, followed by 41.8%, 1.8%, 12.4%, 11.4%, 24.5%, 27.5%, 40.1%, 13.0%. The dominant bacteria of crayfish in Jingzhou rice shrimp pond also included Lactococcus and Citrobacter, and the strains of Hafnia and Lactococcus were found in the aquaculture pond samples. The predominant bacteria in Xuyi and Huoqiu crayfish samples were Exiguobacterium and Citrobacter. The culture-dependent results showed that the dominant bacteria were Aeromonas, Hafnia and Citrobacter, which were consistent with the high-throughput results.
-
克氏原螯虾俗称小龙虾(Procambarus clarkii),原产北美地区,20世纪80年代起国内将之作为养殖对象引至各地,现分布在国内十多个省市[1]。近年来,小龙虾产业发展迅速,2020年全国小龙虾养殖总产量达239.37万吨,主要养殖省份沿长江分布,包括湖北、江苏、安徽等[2]。小龙虾的养殖及食品安全卫生问题在这几年随之增多,常见情况如养殖细菌病害[3]和横纹肌溶解综合征,2020年广州市白云区共发生25例小龙虾相关横纹肌溶解综合征[4]。由于小龙虾的市场逐渐增长,因此需要对小龙虾的养殖质量和在保藏运输中的存活与污染投入更多的关注,而这一过程中重要的影响因素就是小龙虾所携带的菌群情况[5-6]。目前,小龙虾养殖模式以稻虾互作为主,2020年稻虾互作占86.61%,小龙虾营养丰富且主要生活在稻塘水体环境中[7-8]。鲜活小龙虾自身携带多种微生物,极不耐运输储藏[9-10]。因此除应季小龙虾外,多以龙虾制品的形式进行运输,包括冻虾尾[11]、虾仁[12]和熟制小龙虾等形式[13-14]。小龙虾生长偏好湿热条件的环境,不同产地的气候、水土情况与饲养原料都存在一定差别,小龙虾出塘后携带的微生物也由此存在差别,需要对多种影响因素进行研究[15]。
培养基鉴定法是使用根据营养成分和抑制物质表现出选择性的培养基对样品中的微生物进行筛选,从而分离出多种细菌菌株,通过提取和扩增细菌DNA进行测序,使用NCBI Blast查询并确定细菌种类[16]。该方法在实施过程中主观影响较大,仅凭实验人员自主挑选菌株,容易出现重复与漏选的情况,影响菌群丰富度和菌种占比的测定。此外,存在多种细菌无法在培养基上进行培养的情况,自然条件下生长的细菌可通过培养基筛选的仅占总数的1%[17]。
高通量测序法不存在受限于人为培养的缺点,作为一种高效且全面的测定方式,高通量测序法(二代测序法)所需时长远低于传统培养的时长,在较短的时间内能同时对上百万条DNA分子进行检测,由于不需要进行培养增菌,无法培养或丰度较低的微生物同样会被检出,相对培养基鉴定法更为全面[18]。现在已在分析肉制品和水生生物等的微生物组成有广泛应用,Li等[19]应用高通量技术分析得冷藏后期猪肉中的优势菌属为假单胞菌属、不动杆菌属和发光杆菌属。该方法同样被逐渐应用于鉴定水产品携带或腐败微生物方面,如Xing等[20]利用高通量测序法分析得毛尾鱼微生物群落的丰富度和多样性在冷藏条件下先下降后短暂上升后下降的动态变化。汤纯等[15]通过高通量测序法得浦口小龙虾携带的优势菌为柠檬酸杆菌和气单胞菌,太湖东山小龙虾携带优势菌为蜂房哈夫尼菌。
本研究使用培养基鉴定法和高通量测序法共同实验,对湖北荆州、江苏盱眙和安徽霍邱三地的小龙虾的微生物情况进行研究,其中荆州两组样本分别来自稻虾互作塘与养殖塘,分析鲜活小龙虾整体和虾尾肉部位的菌群组成,同时研究分析两种养殖模式下的养殖环境中的微生物,确认小龙虾携带的菌群情况,分析小龙虾菌群与养殖环境的关系,为小龙虾在流通过程中的微生物防治措施研究提供参考。
1. 材料与方法
1.1 材料与仪器
本实验选取六月份可上市生鲜小龙虾 在荆州、盱眙和霍邱三个地区的当地养殖塘通过五点取样法取小龙虾,每个取样点选取大小相近(25±2 g)的5尾小龙虾冷藏打包,通过快递送至实验室备用,其中荆州小龙虾捕捞自稻虾塘与养殖池塘两种养殖模式,盱眙和霍邱小龙虾均取自养殖池塘。采用同样方法,使用灭菌封口袋对荆州稻虾塘和养殖池塘的土壤和水体进行取样,置于冰盒送至实验室备用。PCA菌落计数培养基、结晶紫中性红胆盐葡萄糖琼脂(VRBGA)、甘露醇氯化钠琼脂(MSA)、乳酸菌琼脂基础培养基(MRS)、假单胞菌琼脂基础培养基(CN琼脂)、LB肉汤(LB)、细菌DNA提取试剂盒 山东青岛海博生物技术有限公司。
SW-CJ-1D型无菌操作台 浙江苏净净化有限公司;ME204E电子分析天平 梅特勒-托利多仪器(上海)有限公司;SHP-250型生化培养箱 上海精宏实验设备有限公司;Microfuge 20R高速冷冻离心机 德国Beckman coulter公司;超纯水系统 上海和泰仪器有限公司。
1.2 实验方法
1.2.1 样品处理
参考Özogul等[21]的方法并略有改动。对三产地的四组小龙虾分别做出如下2种处理:a. 称取75 g鲜活小龙虾,均质破碎混匀后取任意25 g加入225 mL生理盐水得到小龙虾整体样品;b. 无菌条件下取出不带虾线的虾尾肉碾碎混匀,取25 g加入225 mL生理盐水均质充分得到小龙虾尾肉(不带肠)样品处理液。每组样品处理3个平行。对荆州两组土样均质后放入−80 ℃冷冻保藏,水样则用0.22 μm滤膜过滤,在滤膜上得到菌群样本,将滤膜放入−80 ℃冰箱保存。
1.2.2 菌落计数与优势菌种保藏
根据GB 4789.2-2016[22]测定每组样品整体与虾尾肉的菌落总数。将1.2.1节中的样品稀释液通过平板涂布的方式涂布于PCA琼脂表面培养30 ℃培养24 h后计数,同时涂布在VRBGA、CN琼脂、MSA和MRS琼脂平板上,30 ℃培养24 h后挑取菌落。在4种培养基平板上选取不同的菌落,在对应的培养基上进行划线培养直至纯化得单菌落,挑取单菌落至10 mL LB肉汤中,30 ℃,120 r/min振荡培养至菌液混浊(此时OD600 nm=1)时,取1 mL菌液与0.2 mL无菌甘油至2 mL无菌离心管中混匀密封,放入−80 ℃冰箱保存。
1.2.3 样品总DNA提取
取1.2.1节中的小龙虾整体样品和虾尾肉均质液各50 mL于100 mL无菌离心管中,4 ℃,2000 r/min条件下离心10 min,取上清液在4 ℃,12000 r/min条件下再次离心10 min,倒掉上清液,取沉淀置于无菌袋中。挑取少量沉淀使用细菌基因组DNA提取试剂盒提取DNA进行检测,将检测合格的沉淀样品放于−80 ℃下保存。
1.2.4 高通量测序和数据分析
将保存在−80 ℃冰箱中的样品处理产物置于干冰箱中送至诺禾致源有限公司的Illumina PE100高通量测序平台进行检测。使用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGACTTAACCCCAATCGC-3’)对样品菌群进行扩增,对扩增产物在16S rDNA V3~V4区的DNA信息进行鉴定[23]。完成后用High Performance Computing平台处理数据,分析获取可用序列[24]。以各样品的序列作为基础单元,以相似性在98%以上为标准,将各个单元分类得操作分类单元(Operational Taxonomic Units,OTU)。将各个OTU比对High Performance Computing平台数据库,获得相应物种信息。Alpha多样性分析选用Mothur软件(version 1.31.2)。汇总比较三个产地四组生鲜小龙虾携带的菌群,统计微生物群落结构。
1.3 数据处理
方差分析使用SPSS 16.0软件,进行显著性分析。所有实验重复3次。
2. 结果与分析
2.1 三地区小龙虾初始菌落数分析
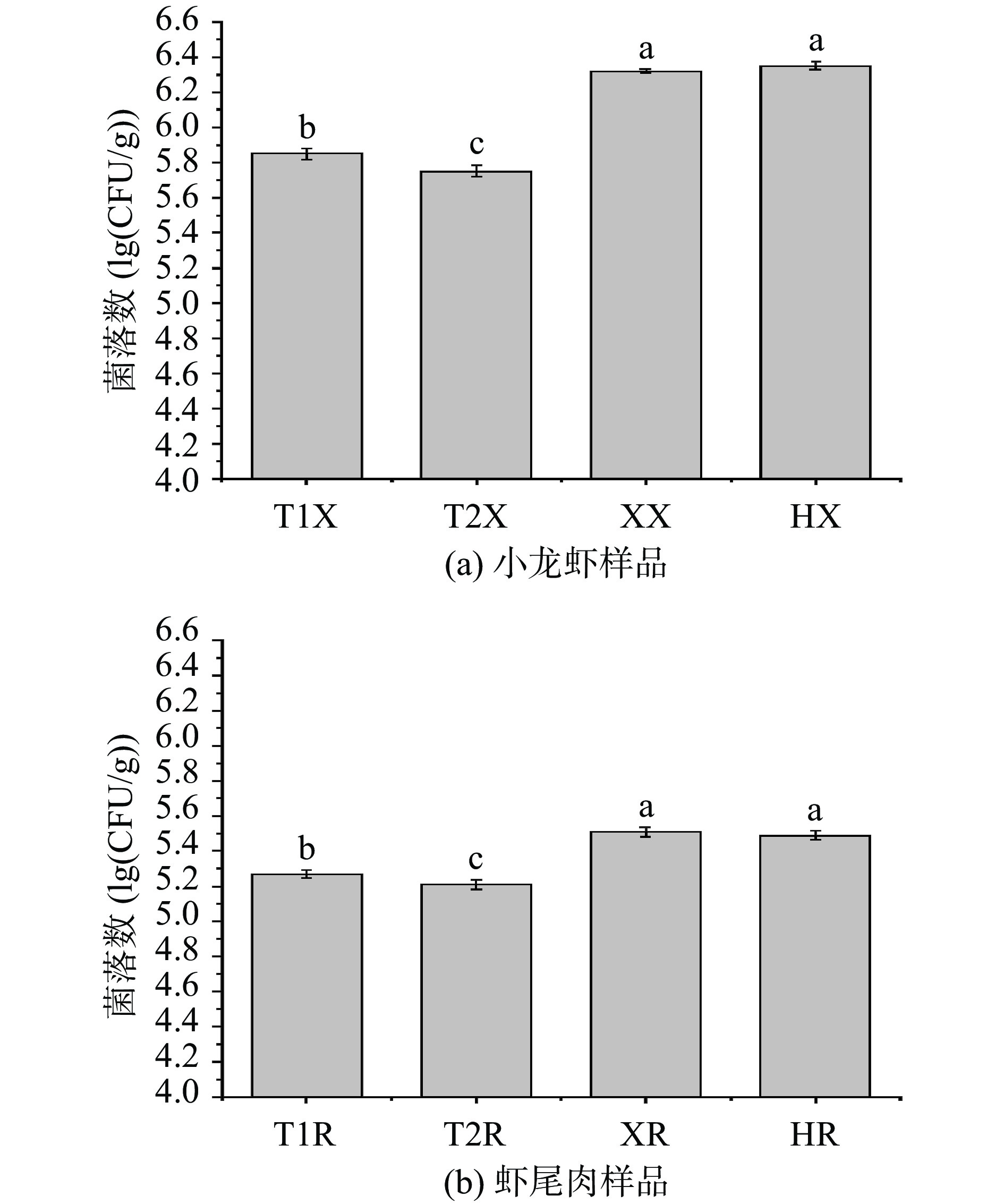
图1为三个产地四组小龙虾初始菌落数。由图1a可知,荆州稻虾塘和养殖塘两种小龙虾整体样品相比江苏盱眙小龙虾整体样品、安徽霍邱小龙虾整体样品的菌落总数较少,分别为5.85 lg(CFU/g)和5.75 lg(CFU/g);而后两者菌落总数相近,分别为6.32 lg(CFU/g)和6.35 lg(CFU/g)。由于在捕捞后盱眙和霍邱小龙虾运输至实验室所用时间相近且均高于荆州小龙虾运输时间,而同为池塘养殖的荆州小龙虾样本菌落总数显著低于前两者,因此推测可能菌落总数差别与运输时间与运输温度相关,这也说明活体小龙虾在运输中仍存在微生物菌群生长情况[25]。
从图1b可知,荆州稻虾塘小龙虾尾肉的菌落数为5.27 lg(CFU/g),荆州养殖塘小龙虾尾肉的菌落数为5.21 lg(CFU/g),盱眙地区小龙虾尾肉菌落数为5.51 lg(CFU/g),霍邱地区小龙虾尾肉菌落数为5.49 lg(CFU/g)。三地小龙虾尾肉初始菌落数均高于5 lg(CFU/g),这可能与小龙虾整体的菌落数有关,同时受到小龙虾出塘是在环境温度较高的6月的影响[26]。
结合图1a与图1b两图可以看出,小龙虾虾尾肉的菌落数相比整体样品略低。这可能是由于小龙虾表面的甲壳中含有致密的几丁质,可以减少环境微生物入侵体内,也可能是由于虾头与甲壳被去除而导致微生物含量的减少。
2.2 优势携带菌的分离与鉴定
挑取特征菌落在同类培养基上进行划线分离得单菌株,共分离209株菌。提取各个菌株的DNA后通过PCR扩增后检测产物的质量。扩增的样品的特异性条带在1500 bp附近,对扩增产物使用NCBI Blast进行比对,通过同源性高于98%的已知序列来确定菌株。209株菌株中包括荆州稻虾塘29种,荆州养殖塘30种,盱眙74种,霍邱76种。其中大多菌株属于肠杆菌科,包括柠檬酸杆菌、哈夫尼亚菌和粘质沙雷氏菌,有22株属于柠檬酸杆菌科。Pan等[27]从患病鲫鱼中提取出致病性弗氏柠檬酸杆菌。Liu等[28]发现有弗氏柠檬酸杆菌株对小龙虾存在高毒性会造成死亡。因此对柠檬酸杆菌这类条件致病菌,需要注意防范。
2.3 Alpha多样性指数分析
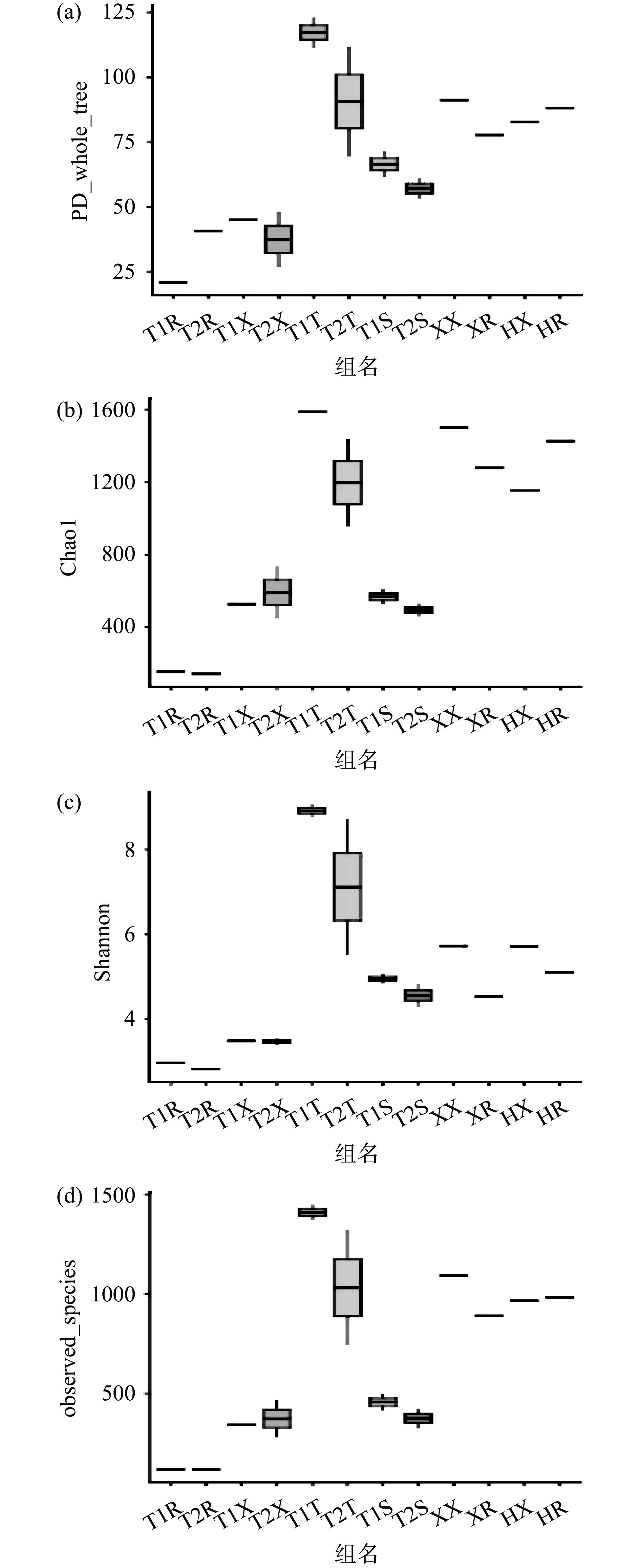
Alpha多样性指数(包括Chao1、PD whole tree、observed species及Shannon指数)分析通过不同指数的指标表现各个样品菌群的丰度和均匀度等数据。其中Chao1及observed species指数表现各个菌群的丰度水平(Species Richness)。而Shannon指数与菌群多样性(Species Diversity)呈正相关,PD whole tree指数表现各个样品对进化历史的留存差别,如图2所示。
由于Shannon指数反映出各样品微生物菌落的均匀度和丰度,受各样品微生物菌落的多样性的直接影响,因此本研究通过分析Shannon指数确认各样品的菌群多样性[29]。根据图2可以看出,荆州两处小龙虾整体和虾肉Shannon指数的色块位置相对低于另外两组。这表明荆州小龙虾整体和虾尾肉的菌群多样性均较低。而盱眙和霍邱两处小龙虾整体Shannon指数的色块位置都较高,霍邱样品的尾肉部分Shannon指数色块高于盱眙样品虾尾肉部分。这表明盱眙和霍邱的样品菌群多样性均高于荆州的两组样品,四组样本虾尾肉的微生物多样性又以霍邱的最多,盱眙样本虾尾肉相较略低。
而就养殖环境微生物多样性而言,荆州稻虾塘水样与土样的Shannon指数色块均高于荆州养殖塘对应的Shannon指数色块,即稻虾塘养殖环境的微生物多样性高于养殖塘。
2.4 物种组成和聚类分析
分类并归纳各个OTU的物种所属信息,对样品中的微生物在科和属两个水平进行菌株种属分类。
2.4.1 基于科水平的分析
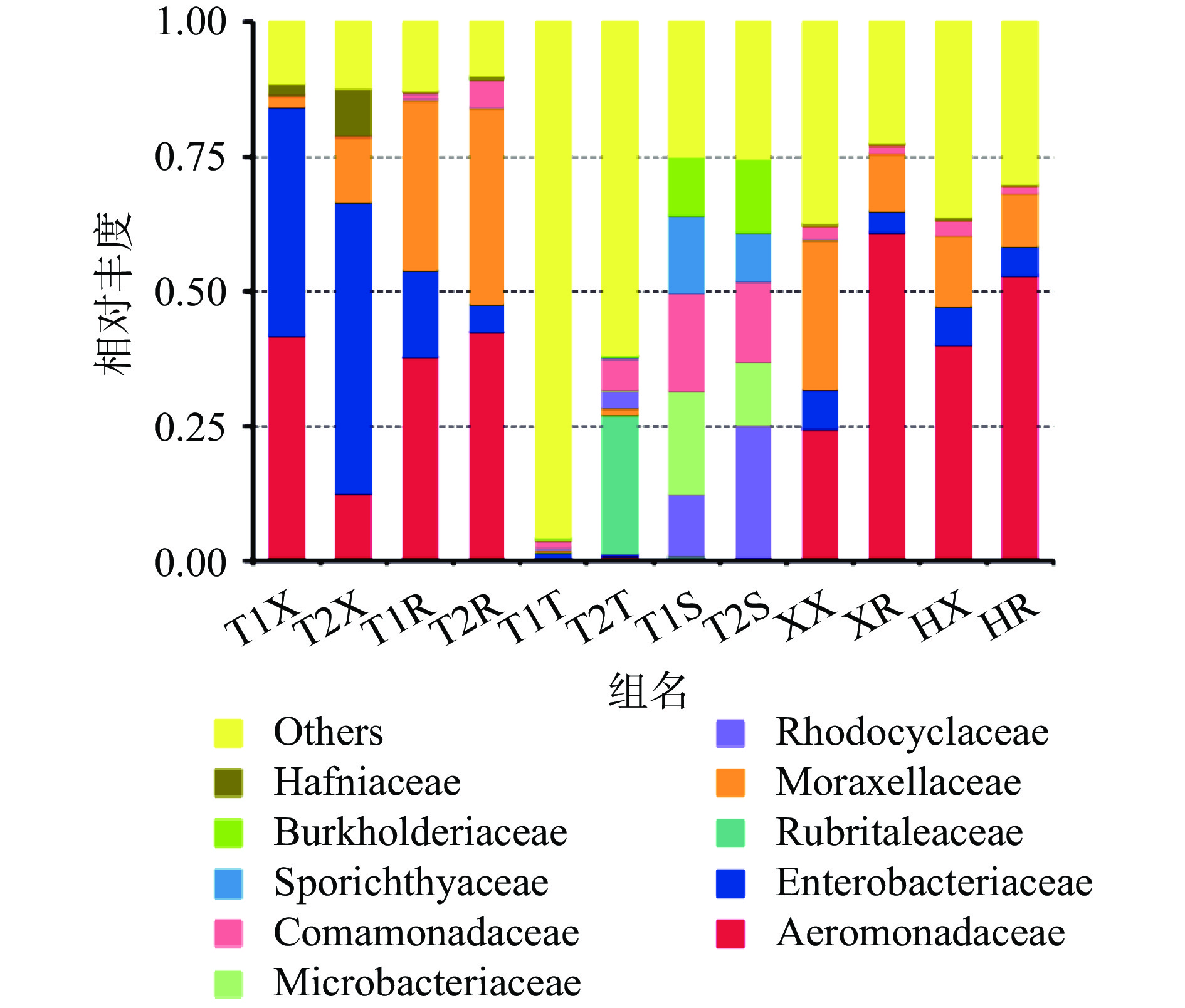
由图3可得,三个产地的四组小龙虾样本的携带微生物菌落的主要菌株组成属于气单胞菌科(Aeromonadaceae)、肠杆菌科(Enterobacteriaceae)、莫拉菌科(Moraxellaceae)和丛毛单胞菌科(Comamonadaceae)4种菌科,不同产地小龙虾携带菌相有一定差别。气单胞菌科(Aeromonadaceae)存在于三个产地小龙虾菌群中并占据优势,但在荆州两组整虾样本中占比接近或低于肠杆菌科(Enterobacteriaceae)。而莫拉菌科(Moraxellaceae)和丛毛单胞菌科(Comamonadaceae)也是盱眙和霍邱两组小龙虾整体的优势菌群。
就龙虾与虾尾肉的菌相关系来看,相对于在小龙虾整体菌群的占比,虾尾肉中肠杆菌科(Enterobacteriaceae)占比均较低,丛毛单胞菌科(Comamonadaceae)的占比则相近或相对较大。气单胞菌科(Aeromonadaceae)在小龙虾和虾尾肉中均为优势菌群。莫拉菌科(Moraxellaceae)也在虾尾肉中占一定比例。
就养殖环境的菌群来看,荆州稻虾塘的土壤菌群丰富度明显高于荆州养殖塘,而水体菌群组成则比较相似,优势菌占比较为均匀,与小龙虾和虾肉的菌群组成差别较大,其中丛毛单胞菌科(Comamonadaceae)是养殖环境和小龙虾都存在的优势菌种。
2.4.2 基于属水平的分析
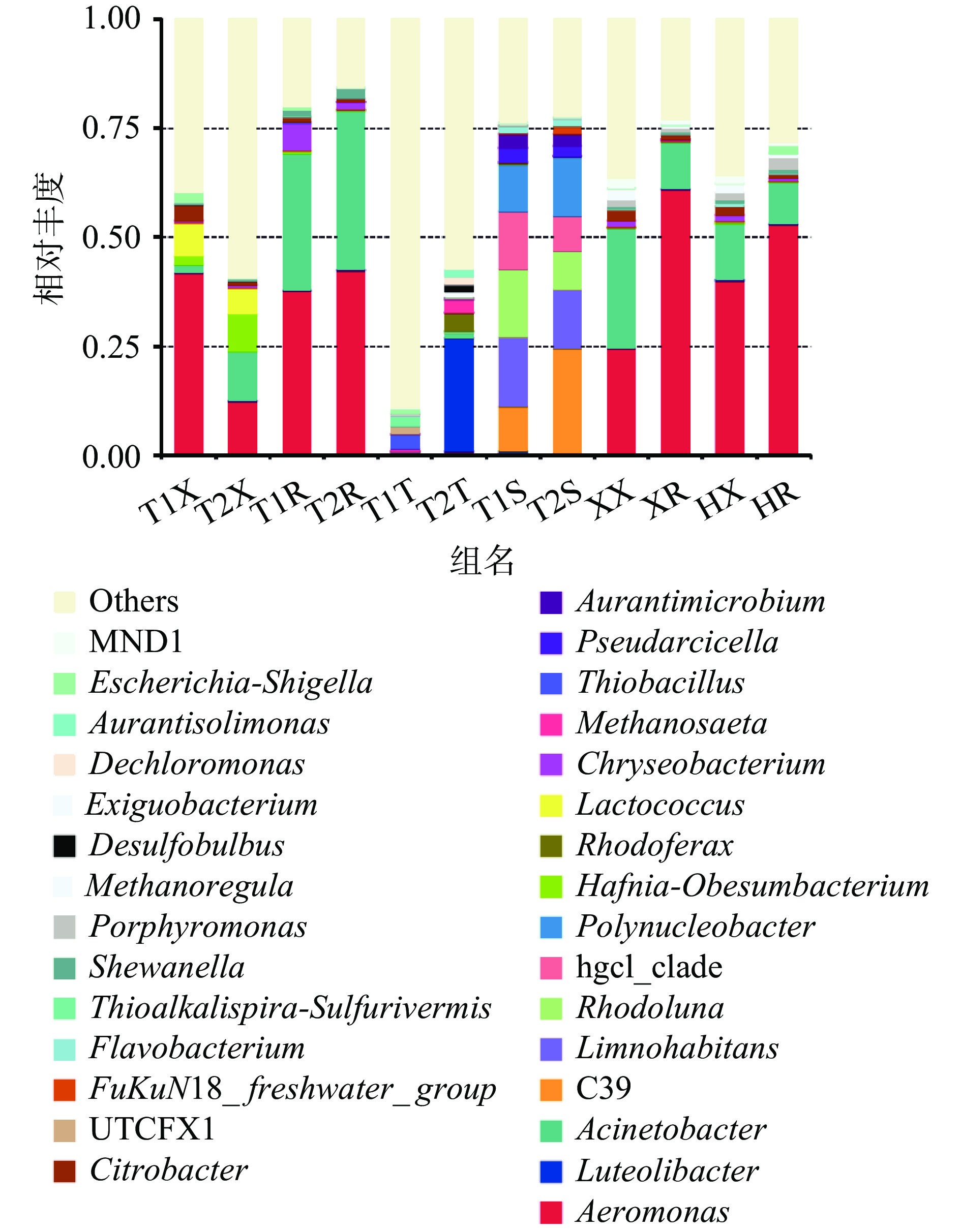
从图4可以发现,各样品微生物多样性丰富,丰度较高的有气单胞菌属(Aeromonas)、乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)、金黄杆菌属(Chryseobacterium)、哈夫尼亚-肥胖杆菌(Hafnia-Obesumbacterium)、柠檬酸杆菌属(Citrobacter)、卟啉单胞菌属(Porphyromonas)和志贺氏菌属(Escherichia-Shigella)等,三产地的四组样品菌相大体类似,但菌群丰度差异大,其中荆州稻虾塘小龙虾整体携带菌为气单胞菌属、乳球菌属、柠檬酸杆菌属和志贺氏菌属;荆州养殖塘小龙虾整体携带菌主要有气单胞菌属、不动杆菌属、哈夫尼亚-肥胖杆菌属和乳球菌属;盱眙小龙虾整体携带菌为不动杆菌属、气单胞菌属、微小杆菌属(Exiguobacterium)和柠檬酸杆菌属;霍邱小龙虾整体携带菌主要有气单胞菌属、不动杆菌属、微小杆菌属和柠檬酸杆菌属。这些差异主要与养殖所在地区环境有关。可以看出,不同地区不同养殖模式下小龙虾携带的优势菌株较为一致,在菌群占比中存在差异,而菌群中其他菌株的差别可能受养殖环境和模式的影响存在一定差异,推测可能与所在水系有关,荆州两组小龙虾均处于长江干流地区水域,不同养殖模式导致菌种占比存在差异;而盱眙和霍邱则处于下游的支流淮河水系,因此两组小龙虾携带菌群相似度更高[30]。
而小龙虾尾肉部分,三产地四组样本的携带菌均以气单胞菌属、不动杆菌属为主,菌群占比略有差别。其中荆州两组样本菌群组成比较接近,含有的微生物有气单胞菌属、不动杆菌属、金黄杆菌属及希瓦氏菌属(Shewanella),其中虾尾肉与小龙虾整体的菌群差别主要在黄金杆菌属和希瓦氏菌属的菌群占比上,而这两种菌属于小龙虾的常见腐败菌和条件致病菌,因此对虾尾肉产品,应更加注意这两种菌的防治。而盱眙和霍邱的两组样本小龙虾整体菌相与虾尾肉菌相相近,虾尾肉中的气单胞杆菌属的占比相对小龙虾整体则较高。本实验结果验证了汤纯等[15]的研究的结论:淡水小龙虾的携带菌主要包括希瓦氏菌和柠檬酸杆菌等。
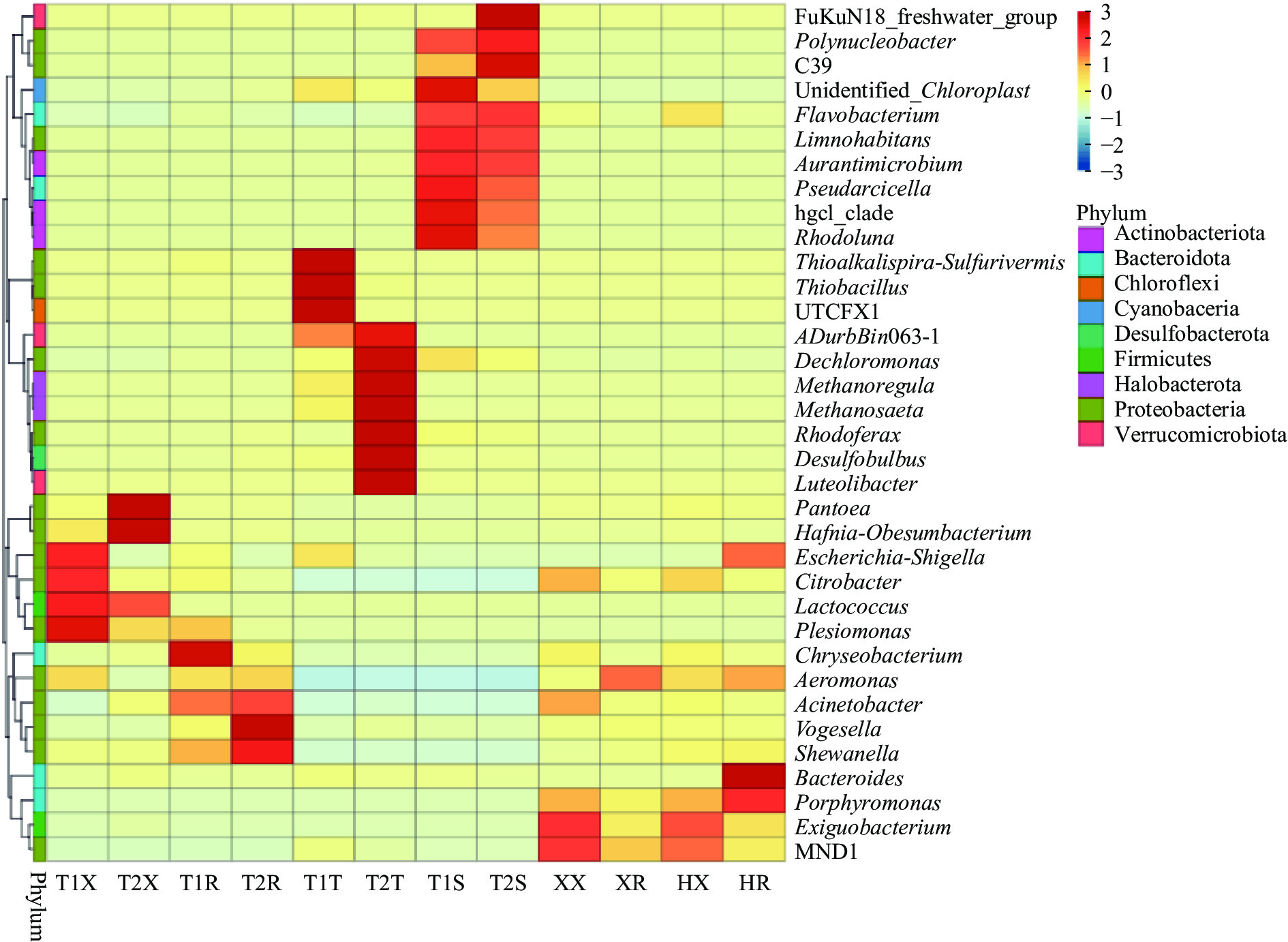
2.5 样品菌群多样性变化的热图分析
将表格中数据的差异与信息在一张图中用颜色的不同与深浅进行表达即可得到热图,图5中对12组样品数据表达的信息以不同深浅的颜色进行呈现,较为直接清晰。图中共12组样品以携带菌的丰度差异进行了划分与对比的标准,可以看出,各组小龙虾样品携带的菌群:荆州稻虾塘小龙虾的柠檬酸杆菌属、乳球菌属和志贺氏菌属等丰度较高,而荆州养殖塘小龙虾样本的哈夫尼亚菌属丰度较高。盱眙和霍邱样品中微小杆菌属的丰度较荆州地区样品高。虾尾肉的情况,荆州两组样品中希瓦氏菌属的相对丰度比盱眙和霍邱地区样品高。其中希瓦氏菌被验证为是低温贮藏的大黄鱼中的优势腐败菌[31]。而腐败希瓦氏菌会引起南美白对虾黑变及品质劣变[32]。李婷婷等[33]发现哈夫尼亚菌是一种耐寒的腐败菌。样品携带的菌株的差异可能是水产品的养殖方式、地理环境和以及运输方式等的因素导致优势携带菌的差异[34]。
3. 结论
对不同产地不同养殖模式下的小龙虾进行研究,运用Illumina二代高通量测序法研究得出生鲜小龙虾整体和虾尾肉样品及其生长环境的菌相构成情况。
培养基鉴定法的结果表明不同来源小龙虾的主要携带菌种均包括柠檬酸杆菌、哈夫尼亚菌和粘质沙雷氏菌等。主要菌种多数为肠杆菌科,其中柠檬酸杆菌作为一类条件致病菌需要注意防范。
宏基因组测序显示,四组小龙虾所携带的优势菌种较为一致,但菌群比例存在一定差异,在科水平上主要属于气单胞菌科(Aeromonadaceae)、肠杆菌科(Enterobacteriaceae)、莫拉菌科(Moraxellaceae)和丛毛单胞菌科(Comamonadaceae)4种菌科。在属水平上,四组小龙虾携带菌中均存在气单胞菌属和不动杆菌属等菌属,具有较高一致性,但也存在一定差异。荆州不同养殖模式的两组小龙虾携带优势菌以气单胞菌属、乳球菌属和哈夫尼亚菌属为主,其中稻虾塘小龙虾的优势菌株占比较高;盱眙和霍邱两地小龙虾主要携带菌株较为相似,以气单胞杆菌属和不动杆菌属为主,出现这些差异可能是养殖模式、地理位置和所在水系等因素造成的。
此外,小龙虾整体的菌群多样性高于虾尾肉,这可能是因为整体菌群包括虾尾肉中的菌群,且在生长运输过程中受到环境的影响,因此相对虾尾肉菌群更为丰富,而虾尾肉中优势菌的占比则更大,四组小龙虾的虾尾肉携带菌均以气单胞菌属和不动杆菌属为主,在虾尾肉的加工和保鲜中应重点关注。
而不同养殖模式下的小龙虾的菌群,稻虾互作模式下,土壤微生物种类更丰富更均衡,养殖塘土壤微生物种类略低,优势菌占比较为明显。而两种模式下水体微生物菌群存在差异较小。
本研究对不同地区不同养殖环境下生鲜小龙虾及加工品携带微生物的进行研究,对携带菌的情况进行了探索,为携带优势菌种的防治等研究提供理论依据。
-
-
[1] 汤靓颖. 小龙虾产业发展研究[J]. 现代农业科技,2009(22):308−309. [TANG L Y. Research on the development of crayfish industry[J]. Modern Agricultural Science and Technology,2009(22):308−309. doi: 10.3969/j.issn.1007-5739.2009.22.203 [2] 中国水产学会. 中国小龙虾产业发展报告(2021)[J]. 中国水产,2021(7):27−33. [Chinese Fisheries Society. China crayfish industry development report (2021)[J]. China Fisheries,2021(7):27−33. [3] 赵楠, 武秀丽, 赵桂华. 小龙虾细菌病害研究进展[J]. 水产养殖,2018,39(11):44−46. [ZHAO N, WU X L, ZHAO G H. Research progress on bacterial diseases of crayfish[J]. Journal of Aquaculture,2018,39(11):44−46. doi: 10.3969/j.issn.1004-2091.2018.11.018 [4] 林虹, 陈梁发, 谭伟煊, 等. 广州市白云区小龙虾相关横纹肌溶解综合征病例流行病学特征及相关影响因素分析[J]. 公共卫生与预防医学,2021,32(4):71−74. [LIN H, CHEN L F, TAN W X, et al. Epidemiological characteristics and related influencing factors of crayfish-associated rhabdomyolysis syndrome cases in Baiyun District, Guangzhou City[J]. Public Health and Preventive Medicine,2021,32(4):71−74. doi: 10.3969/j.issn.1006-2483.2021.04.016 [5] 江杨阳, 杨水兵, 余海霞, 等. 基于培养基法和高通量测序法分析冷藏小龙虾优势腐败菌[J]. 食品科学,2019,40(16):130−136. [JIANG Y Y, YANG S B, YU H X, et al. Analysis of predominant spoilage bacteria in refrigerated crayfish based on culture medium method and high-throughput sequencing method[J]. Food Science,2019,40(16):130−136. doi: 10.7506/spkx1002-6630-20180718-229 [6] 金璇, 俞兴伟, 杨章力, 等. 小龙虾重金属和微生物含量检测及食用建议[J]. 分析仪器,2020(2):61−69. [JIN X, YU X W, YANG Z G, et al. Detection of heavy metals and microorganisms in crayfish and suggestions for consumption[J]. Analytical Instruments,2020(2):61−69. doi: 10.3969/j.issn.1001-232x.2020.02.013 [7] 欧仁建, 李家胜. 一例小龙虾气单胞菌病的诊治分析[J]. 渔业致富指南,2017(11):47−48. [OU R J, LI J S. Analysis of the diagnosis and treatment of a case of crayfish Aeromonas disease[J]. Fisheries Guide to Prosperity,2017(11):47−48. [8] 赵考诚, 马军, 叶迎, 等. 稻虾生态种养综合效应研究进展[J]. 作物杂志,2021(2):22−27. [ZHAO K C, MA J, YE Y, et al. Research progress on the comprehensive effect of ecological planting and breeding of rice and shrimp[J]. Crop Journal,2021(2):22−27. doi: 10.16035/j.issn.1001-7283.2021.02.003 [9] 佀国涵, 彭成林, 徐祥玉, 等. 稻–虾共作模式对涝渍稻田土壤微生物群落多样性及土壤肥力的影响[J]. 土壤,2016,48(3):503−509. [QI G H, PENG C L, XU X Y, et al. Effects of rice-shrimp co-cropping mode on soil microbial community diversity and soil fertility in waterlogged paddy fields[J]. Soil,2016,48(3):503−509. doi: 10.13758/j.cnki.tr.2016.03.013 [10] 邱秉慧, 王海帆, 秦乐蓉, 等. 小龙虾加工和流通过程中的食品安全与品质控制技术研究进展[J]. 肉类研究,2021,35(9):43−50. [QIU B H, WANG H F, QIN L R, et al. Research progress on food safety and quality control technology in crayfish processing and distribution[J]. Meat Research,2021,35(9):43−50. doi: 10.7506/rlyj1001-8123-20210406-092 [11] 张艳凌, 向俊飞, 朱亚军, 等. 鲜活和死后小龙虾的冷藏特性比较[J]. 食品科学,2022,43(1):206−212. [ZHANG Y L, XIANG J F, ZHU Y J, et al. Comparison of refrigerated characteristics of fresh and dead crayfish[J]. Food Science,2022,43(1):206−212. doi: 10.7506/spkx1002-6630-20201019-167 [12] 殷允旭. 虾仁的超高压杀菌工艺研究[D]. 合肥: 合肥工业大学, 2007. YIN Y X. Research on ultra-high pressure sterilization process of shrimp[D]. Hefei: Hefei University of Technology, 2007.
[13] 周涛, 吴晓营, 罗海波, 等. 贮藏温度对即食小龙虾品质及微生物菌群多样性的影响[J]. 食品与机械,2019,35(9):141−146. [ZHOU T, WU X Y, LUO H B, et al. Effects of storage temperature on quality and microbial flora diversity of ready-to-eat crayfish[J]. Food and Machinery,2019,35(9):141−146. doi: 10.13652/j.issn.1003-5788.2019.09.028 [14] 邓灵, 赵康, 夏开, 等. 小龙虾(Procambarus clarkii)加工前后优势腐败菌的分离与鉴定[J]. 食品工业科技,2020,41(18):100−104. [DENG L, ZHAO K, XIA K, et al. Isolation and identification of dominant spoilage bacteria in crayfish (Procambarus clarkii) before and after processing[J]. Food Industry Science and Technology,2020,41(18):100−104. [15] 汤纯, 刘芳, 诸永志, 等. 基于传统分离培养和宏基因组测序分析不同产地小龙虾菌群的多样性[J]. 中国食品学报,2021,21(2):260−268. [TANG C, LIU F, ZHU Y Z, et al. Analysis of the diversity of crayfish flora from different origins based on traditional isolation and culture and metagenomic sequencing[J]. Chinese Journal of Food Science,2021,21(2):260−268. [16] LI L Z. Isolation and identification cultivable microbes from the antarctic krill (Euphausia superba) and other Antarctic samples[J]. International Journal of Ecology,2018,7(1):29−36. doi: 10.12677/IJE.2018.71005
[17] 刘晓红, 李嘉文, 翟平平, 等. 卤鸭脖中优势腐败菌和致病菌的分离与鉴定[J]. 肉类工业,2012(6):32−34. [LIU X H, LI J W, ZHAI P P, et al. Isolation and identification of dominant spoilage bacteria and pathogenic bacteria in braised duck neck[J]. Meat Industry,2012(6):32−34. doi: 10.3969/j.issn.1008-5467.2012.06.015 [18] WANG X, ZHANG Y, REN H, et al. Comparison of bacterial diversity profiles and microbial safety assessment of salami, Chinese dry-cured sausage and Chinese smoked-cured sausage by high-throughput sequencing[J]. LWT,2018,90:108−115. doi: 10.1016/j.lwt.2017.12.011
[19] LI N, ZHANG Y X, WU Q P, et al. High-throughput sequencing analysis of bacterial community composition and quality characteristics in refrigerated pork during storage[J]. Food Microbiology,2019:83.
[20] XING J L, XU X R, LUO X H, et al. Characterization of microbial community in cold-chain hairtail fish by high-throughput sequencing technology[J]. Journal of Food Protection,2021,84(6):1080−1087. doi: 10.4315/JFP-20-393
[21] ÖZOGUL F, POLAT A, ÖZOGUL Y. The effects of modified atmosphere packaging and vacuum packaging on chemical, sensory and microbiological changes of sardines (Sardinapilchardus)[J]. Food Chemistry,2004,85(1):49−57. doi: 10.1016/j.foodchem.2003.05.006
[22] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. GB 4789.2-2016 食品安全国家标准 食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社, 2016: 1−5. State Food and Drug Administration, National Health and Family Planning Commission. GB 4789.2-2016 National food safety standard Food microbiological inspection determination of total colony[S]. Beijing: China Standards Press, 2016: 1−5.
[23] PARLAPANI F F, MEZITI A, KORMAS K A, et al. Indigenous and spoilage microbiota of farmed sea bream stored in ice identified by phenotypic and 16S rRNA gene analysis[J]. Food Microbiology,2013,33:85−89. doi: 10.1016/j.fm.2012.09.001
[24] ANDREEVSKAYA M, JOHANSSON P, LAINE P, et al. Genome sequence and transcriptome analysis of meat-spoilage-associated lactic acid bacterium Lactococcus piscium MKFS47[J]. Applied and Environmental Microbiology,2015,81(11):3800−3811. doi: 10.1128/AEM.00320-15
[25] 高晓光, 吕蒙, 臧芳波, 等. 小龙虾加工与保鲜技术研究进展[J]. 保鲜与加工,2021,21(12):126−131, 139. [GAO X G, LÜ M, ZANG F B, et al. Research progress of crayfish processing and preservation technology[J]. Preservation and Processing,2021,21(12):126−131, 139. doi: 10.3969/j.issn.1009-6221.2021.12.018 [26] 邓祥宜, 李池茜, 张涵池, 等. 养殖塘和市售小龙虾肠道细菌多样性的比较[J]. 微生物学杂志,2021,41(3):44−52. [DENG X Y, LI C Q, ZHANG H C, et al. Comparison of gut bacterial diversity between culture ponds and commercial crayfish[J]. Journal of Microbiology,2021,41(3):44−52. doi: 10.3969/j.issn.1005-7021.2021.03.007 [27] PAN L F, YANG Y H, PENG Y N, et al. The novel pathogenic Citrobacter freundii (CFC202) isolated from diseased crucian carp (Carassius auratus) and its ghost vaccine as a new prophylactic strategy against infection[J]. Aquaculture,2021:533.
[28] LIU X, HE X, AN Z, et al. Citrobacter freundii infection in red swamp crayfish (Procambarus clarkii) and host immune-related gene expression profiles[J]. Aquaculture,2020,515(C):734499.
[29] FERANCHUK S, BELKOVA N, POTAPOVA U, et al. Evaluating the use of diversity indices to distinguish between microbial communities with different traits[J]. Research in Microbiology,2018,169(4-5):254−261. doi: 10.1016/j.resmic.2018.03.004
[30] 贾丽娟, 王广军, 夏耘, 等. 不同地区稻虾综合种养系统的微生物群落结构分析[J]. 水产学报: 1−13[2022-10-18]. http://kns.cnki.net/kcms/detail/31.1283.s.20211122.1401.004.html. JIA L J, WANG G J, XIA Y, et al. Microbial community structure analysis of integrated rice and shrimp farming systems in different regions[J]. Chinese Journal of Fisheries: 1−13[2022-10-18]. http://kns.cnki.net/kcms/detail/31.1283.s.20211122.1401.004.html.
[31] FU L L, WANG C, LIU N N, et al. Quorum sensing system-regulated genes affect the spoilage potential of Shewanella baltica[J]. Food Research International,2018,107:1−9. doi: 10.1016/j.foodres.2018.01.067
[32] 林婷, 杨胜平, 郁佳怡, 等. 腐败希瓦氏菌对南美白对虾黑变及品质劣变的影响[J]. 食品与发酵工业,2021,47(20):161−167. [LIN T, YANG S P, YU J Y, et al. Effects of Shewanella spoilage on melanosis and quality deterioration of Penaeus vannamei[J]. Food and Fermentation Industry,2021,47(20):161−167. doi: 10.13995/j.cnki.11-1802/ts.026489 [33] 李婷婷, 马艳, 李学鹏, 等. 腐败希瓦氏菌及其与蜂房哈夫尼亚菌共培养对冷藏大菱鲆的致腐能力[J]. 食品科学,2018,39(13):29−34. [LI T T, MA Y, LI X P, et al. The spoilage ability of Shewanella putrefying and its co-culture with Hafnia apiary on refrigerated turbot[J]. Food Science,2018,39(13):29−34. doi: 10.7506/spkx1002-6630-201813005 [34] 张小敏, 周国燕, 郭全友, 等. 水产品特定腐败菌及其在鲜度评估中的应用[J]. 食品与发酵科技,2020,56(6):100−107. [ZHANG X M, ZHOU G Y, GUO Q Y, et al. Specific spoilage bacteria in aquatic products and their application in freshness evaluation[J]. Food and Fermentation Science and Technology,2020,56(6):100−107.





 下载:
下载:
 下载:
下载:



