A Newly Isolated of Thermophilic Cyanobacterium and the Stability of Its Phycocyanin
-
摘要: 目的:明确新分离的一株嗜热微藻的分类地位,观察其所含藻蓝蛋白的稳定性,从而了解其藻蓝蛋白可能的应用价值。方法:采用光学显微镜进行细胞形态观察,基于16S rDNA序列建立系统发育树,从而对藻株进行分类鉴定;通过超声波破碎的方法获得藻蓝蛋白粗提液,改变温度、光照强度、pH等条件存放藻蓝蛋白溶液,用分光光度计观察溶液吸光度的变化来反映藻蓝蛋白的稳定性。结果:该藻为杆状单细胞结构,直或有时弯曲,二分裂殖,系统发育树显示该分离藻株为嗜热聚球藻属的一支。提取得到纯度为0.941,色价为196.53的藻蓝蛋白粗提物,得率为11.37%(对藻干物质)。该藻蓝蛋白在60 ℃保持3.5 h,色值不变;6000 lux光照7 d色值可保持在91.4%左右;在pH4.0~8.0保持3.5 h色值稳定,但在强酸和强碱性环境下藻蓝蛋白的稳定性明显下降。结论:所分离的藻株为嗜热聚球藻属的一支,其所含的藻蓝蛋白具有良好的热、光和酸碱稳定性,在食品加工领域具有良好的应用前景。Abstract: Objects: The object of this paper was to determine the taxonomic status of a newly isolated of thermophilic microalga, and to study the stability of its phycocyanin to evaluate its possibility of application in food. Methods: The newly isolated algal strain was morphologically observed by optical microscope, and identified its taxonomic status based on its 16S rDNA sequence and the phylogenetic tree analysis. The phycocyanin of the alga was obtained by ultrasound-assisted extraction, and the stability of phycocyanin was investigated and evaluated based on the changes of the optical density measured with spectrophotometer under different levels of temperature, illumination and pH. Results: The alga cell was rod shape, straight or arc sometimes, binary fission, and was a branch of genus Thermosynechococcus. A crude extract of phycocyanin with a purity of 0.941 and a color value of 196.53 was obtained from the alga, and the yield was 11.37% (for dry mass weight). The stability tests showed that the phycocyanin was stable for 3.5 h at the temperature 60 ℃, its optical density retained 91.4% after illumination of 6000 lux for 7 d, the color was stable kept pH4.0~8.0 for 3.5 h, but it exhibited a poor stability in strong acid or strong alkali. Conclusion: The isolated microalga is a strain of the genus Thermosynechococcus. Its phycocyanin has good thermal-stability, photo-stability and acid-base-stability, exhibiting encouraging possibility for food application.
-
Keywords:
- thermophilic cyanobacterium /
- 16S rDNA /
- phycocyanin /
- stability
-
蓝藻(Cyanobacteria),又名蓝细菌、蓝绿藻,是一种形态简单的产氧光合原核微生物,是重要的初级生产者,是地球上最原始的生命形式之一,距今已有超过30亿年的生活历史[1-3]。蓝藻分布范围广、适应性强、生长快速,几乎栖息在所有环境中,甚至包括各种极端环境,如高温温泉、寒冷冰川、碱性湖泊、干旱沙漠等[4-5]。蓝藻应用于食品领域已有很长的历史,其包含多种生物活性成分,如天然色素、蛋白质、脂肪酸、多糖、维生素、微量元素等,具有极高的营养价值[6];部分蓝藻还因能产生具有抗菌、抗病毒和抗癌活性的次生代谢产物而被广泛应用于药物开发[7]。蓝藻是一大门类的微藻,有大量的藻种具有各种优良特性,但绝大多数蓝藻尚未被开发研究。嗜热蓝藻是一类能在50 ℃以上生长的高温藻,在食品领域的研究很少,由于其具有高温适应性,其细胞内生物活性成分往往可能具有某些特殊性质。
藻蓝蛋白是藻胆蛋白家族的一员。藻胆蛋白是存在于蓝藻、红藻及隐藻等藻类中的色素蛋白,是光合作用的捕光天线[8]。藻胆蛋白有三种类型,即藻红蛋白(phycoerythrin, PE)、藻蓝蛋白(phycocyanin, PC)和别藻蓝蛋白(allophycocyanin, APC)[9]。藻蓝蛋白是天然的蓝色素,其吸收波长范围为610~630 nm,主要存在于蓝藻中,由脱辅基蛋白和开链四吡咯发色团组成[10-11]。藻蓝蛋白是我国批准的可以食用天然蓝色色素,目前主要用作着色剂添加在食品及化妆品行业[12-13],同时还具有一定的抗氧化、抗肿瘤和增强免疫力等功能[14-15]。藻蓝蛋白在食品加工领域具有广阔的应用前景,但由于目前市场上的藻蓝蛋白热稳定性差,即使在巴氏杀菌条件下,藻蓝蛋白也不能耐受,因此现在主要应用于冷饮或冷制食品中[16]。除此以外,藻蓝蛋白对光照强度及酸碱环境也非常敏感,限制了其在食品领域更广泛的应用[17]。为了提高藻蓝蛋白的稳定性及拓宽其在食品加工领域的使用范围,有人通过使用添加剂(糖、柠檬酸、氯化钠、乳清蛋白等)来延长藻蓝蛋白的半衰期[18-20];有人通过对蛋白质构象进行修饰以保持蛋白质的高级结构稳定从而达到稳定色素的目的[21];也有人通过将藻蓝蛋白微胶囊化,通过包衣保护的方式来提高稳定性[22],这些方法虽然能取得一定的效果,但改善作用有限,不足以满足食品加工的要求。因此,若能找到一种不会在严苛的食品加工环境中褪色的藻蓝蛋白,那么将具有非常广阔的潜在市场。
目前,国内外对藻蓝蛋白的研究主要集中在中温藻,关于利用高温藻提取藻蓝蛋白的研究较少,高温藻由于生长环境特殊,其藻蓝蛋白可能具有某些独特的性质。本文从湖南一处高温温泉采集的样品中分离纯化得到一株嗜热微藻,初步试验表明其生长温度范围为40~65 ℃,具有很好的高温适应性。本研究拟采用形态学观察和分子生物学分类研究的方法,确定所分离藻株的生物学分类地位。通过提取该藻的藻蓝蛋白,研究其温度、光照及酸碱稳定性,为该藻的潜在应用提供研究数据。
1. 材料与方法
1.1 材料与仪器
藻株来源 2019年8月,从湖南一处温泉中采集了藻液样本,采样时水温为70 ℃,采样地点位于东经113°54′59.05′′、北纬25°32′6.86′′;BG11培养基:NaNO3 1.5 g/L,K2HPO4 0.04 g/L,MgSO4·7H2O 0.075 g/L,CaCl2·2H2O 0.036 g/L,柠檬酸0.006 g/L,柠檬酸铁铵0.006 g/L,乙二胺四乙酸二钠0.001 g/L,Na2CO3 0.02 g/L,H3BO3 2.86×10−3 g/L,MnCl2·4H2O 1.81×10−3 g/L,ZnSO4·7H2O 0.22×10−3 g/L,Na2MoO4·2H2O 0.39×10−3 g/L,CuSO4·5H2O 0.79×10−4 g/L,Co(NO3)2·6H2O 0.49×10−4 g/L;2×Taq Master Mix、DL2000 DNA marker、6×Loading buffer、植物DNA提取试剂盒 南京诺唯赞生物科技股份有限公司;琼脂糖、50×TAE缓冲液 生工生物工程(上海)股份有限公司;Gold View Ⅰ型核酸染色剂 北京索莱宝科技有限公司;其他试剂均为分析纯 国药集团化学试剂有限公司;
HZQ-F280恒温摇床培养箱 江苏省金坛市万花实验仪器厂;DV320光学显微镜 重庆奥特光学仪器有限责任公司;752紫外可见分光光度计 上海菁华科技仪器有限公司;X-30R 高速冷冻离心机 贝克曼库尔特商贸(中国)有限公司;SC300梯度PCR仪 上海启前科技有限公司;DYY-8C型电泳仪 北京市六一仪器厂;EVOS XL Co凝胶成像仪 广州誉为生物科技有限公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 藻种的分离纯化
先将从温泉采集的水样用滤纸过滤掉杂质,再将其接种至BG11培养基中,置于温度50 ℃,光照强度4000 lux,转速150 r/min,光照周期12 h:12 h的培养箱中培养。培养液逐渐变成蓝绿色即富集培养完成,取少量样品采用稀释涂布平板法接种于加入琼脂的BG11固体培养基上,培养7 d后,挑取绿色的单藻落,再采用划线分离法接种于新鲜固体培养基上,待藻落长出,挑取长势优良的单藻落接种于96孔板,然后逐步扩大培养,按10%的接种量进行接种,全过程均在50 ℃条件下培养,直至最终完成藻种的分离纯化。
1.2.2 分离藻株的形态观察
取对数生长期的藻液50 μL,置于光学显微镜下观察,并拍照记录。根据《中国淡水藻类——系统、分类及生态》进行初步分类鉴定[23]。
1.2.3 DNA提取、PCR扩增及测序
取适量对数生长期的藻液,3500 r/min离心5 min,弃上清,用液氮将藻泥冻结后研磨成藻粉,采用植物DNA提取试剂盒提取微藻DNA,具体步骤按试剂盒说明书进行。
以提取的微藻DNA为模板,PCR扩增16S rRNA基因DNA序列片段,引物序列为:27f(5’-AGAGTTTGATCCTGGCTCAG-3’),1492r(5’-GGTTACCTTGTTACGACTT-3’)[24-26], PCR反应体系为:模板2.5 μL、引物1 μL、2×Taq PCR Master Mix 12.5 μL,用ddH2O将体系补至25 μL。PCR扩增条件为:94 ℃预变性4 min、94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,30个循环,72 ℃再延伸10 min。
扩增完成后,扩增产物用1%的琼脂糖凝胶,100 V电泳25 min,电泳完成后,将其置于凝胶成像仪中观察结果。PCR扩增产物送至上海生工生物公司进行测序。
1.2.4 系统发育树的构建
测序完成后,用DNAMAN8.0软件将测序结果进行序列拼接,并于NCBI网站上(https://www.ncbi.nlm.nih.gov/)进行Blast同源性比对分析,选取同源序列,使用MEGA7.0软件进行序列比对分析,并采用M-L法构建系统发育树,bootstrap值1000次重复计算以评估分支可信度。
1.2.5 藻粉的制备
取1.2.1中分离的藻种,按10%接种量接种至BG11培养基,以0.4 L/min的恒定流量连续通气并搅拌培养物,在50 ℃、通入含15% CO2的空气、4000 lux光照条件下培养,在指数生长期结束时(第5 d)收集藻液,4500 r/min离心5 min,收集藻体,用去离子水洗去残留的盐分,经冷冻干燥48 h后获得藻粉。
1.2.6 藻蓝蛋白的提取
称取0.1 g藻粉于50 mL离心管,加入10 mL水,浸泡2 h,使用超声破碎仪在冰水浴中破碎细胞,超声功率550 W,超声2 s,间隔3 s,总时间15 min,超声完毕后,藻液在8000 r/min离心10 min(4 ℃),收集上清液即为藻蓝蛋白粗提液[15]。整个实验过程保持样品避光。
1.2.7 藻蓝蛋白色价
将上述藻蓝蛋白粗提液经冷冻干燥获得藻蓝蛋白粉。准确称取0.025 g藻蓝蛋白粉,用磷酸盐缓冲液(pH6.8)溶解并定容至10 mL,稀释10倍后,测定620 nm的吸光值[27]。将测定结果带入式(1),计算色价值:
E10%1cm620=A620m×f (1) 式中:
E10%1cm620 表示试样浓度10%,用1 cm比色皿,在620 nm处的吸光度;A620为待测试样液在620 nm处的吸光度读数;m为藻蓝蛋白的质量,g;f为稀释倍数。1.2.8 藻蓝蛋白稳定性试验
1.2.8.1 温度稳定性试验
取上述1.2.6中提取得到的藻蓝蛋白粗提液(浓度为1.137 mg/mL),分别置于4、30、40、50、60、70、80 ℃下,避光放置,每隔0.5 h取样,每组3个平行,测定其在620 nm下的吸光度。
1.2.8.2 光照稳定性试验
取上述1.2.6中提取得到的藻蓝蛋白粗提液(浓度为1.137 mg/mL),分别置于1000、2000、3000、4000、5000和6000 lux的光照强度下,室温放置,每隔1 d取样,每组3个平行,测定其在620 nm下的吸光度。
1.2.8.3 酸碱稳定性试验
用0.01 mol/L的HCl和0.01 mol/L的NaOH溶液调节藻蓝蛋白粗提液的pH,调节pH为2.0、4.0、6.0、8.0、10.0、12.0,在4 ℃避光放置,每隔0.5 h取样,每组3个平行,测定其在620 nm下的吸光度。
1.2.9 藻蓝蛋白分析方法
在280、620、650 nm处测定粗提液的吸光值(A),由式(2)~(4)分别计算藻蓝蛋白纯度(P)[28]、浓度(C)[29]和得率(Q)[29]。
P=A620A280 (2) C=A620−0.7×A6507.38 (3) Q(%)=C×V×Km×100 (4) 式中:P为藻蓝蛋白纯度;C为藻蓝蛋白浓度,mg/mL;Q为藻蓝蛋白得率,%;K为样品稀释倍数;V为提取液总体积,mL;m为原料质量,mg。
1.3 数据处理
每组实验重复三次,采用SPSS 23.0和Excel 2010对数据进行分析处理,实验数据以平均值和标准差表示。采用GraphPad Prism 8.0.2 和Origin 2018进行绘图。
2. 结果与分析
2.1 分离藻株的形态观察
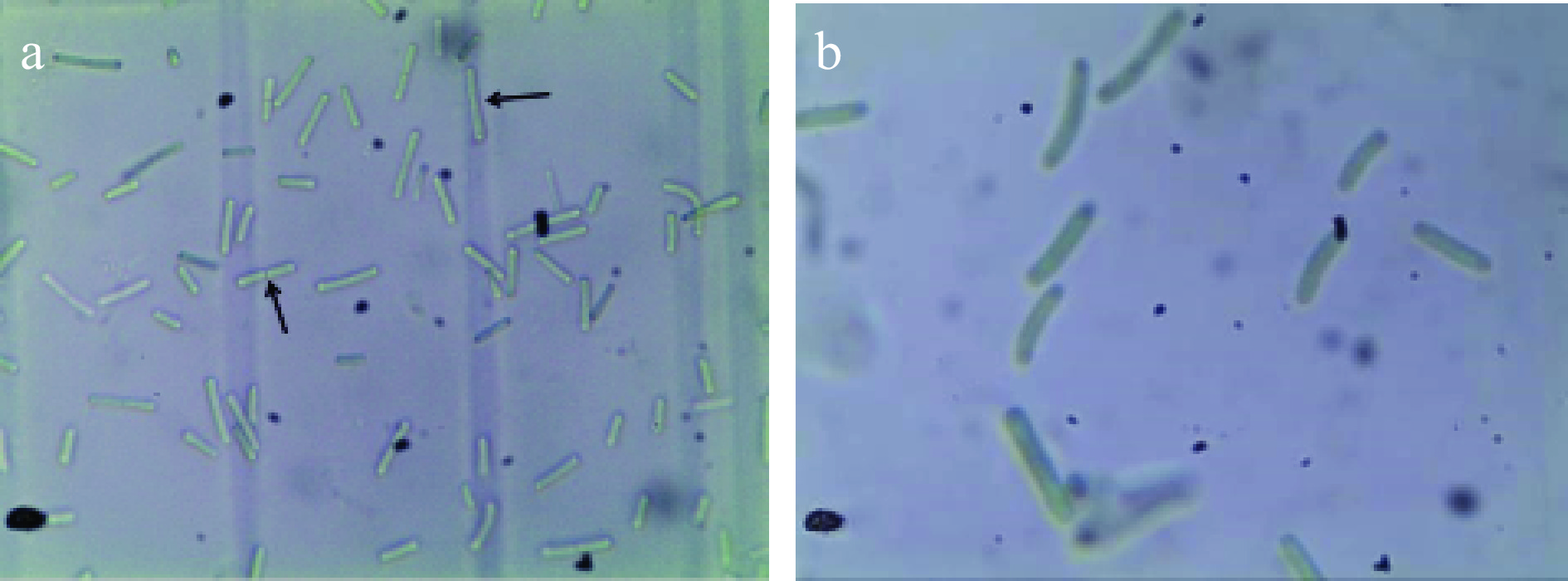
本研究室将从湖南高温温泉采集样品中分离得到的微藻进行纯培养,建立起株系,将其命名为HN-54。经光学显微镜观察,藻细胞为细长杆状的单细胞,直或有时弯曲,细胞繁殖的方式为二分裂,如图1所示。
2.2 PCR扩增
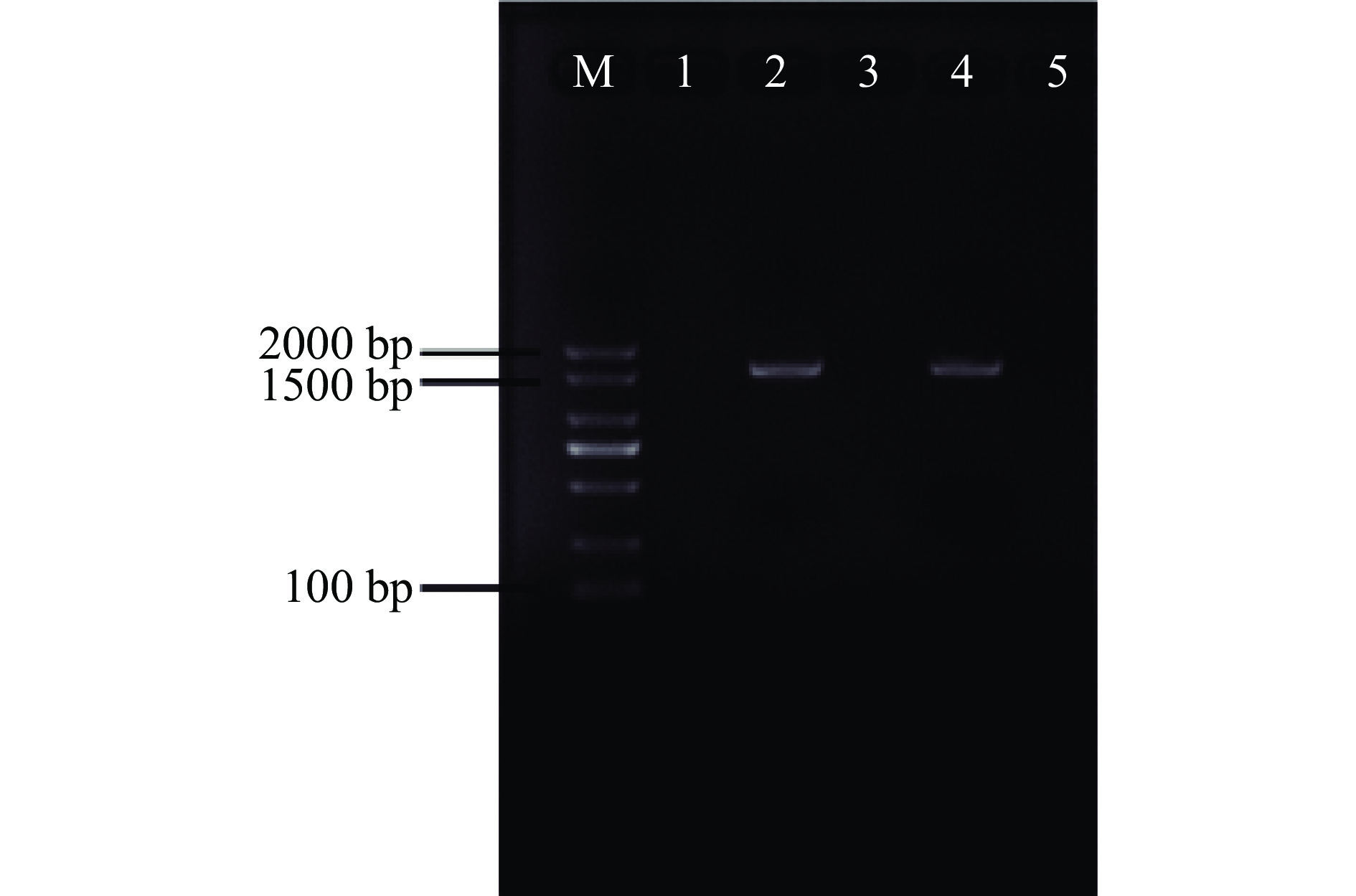
琼脂糖凝胶电泳结果显示,经PCR扩增出的16S rRNA基因目的片段是单一条带,片段大小在1500 bp左右,结果如图2。
2.3 系统发育树的构建
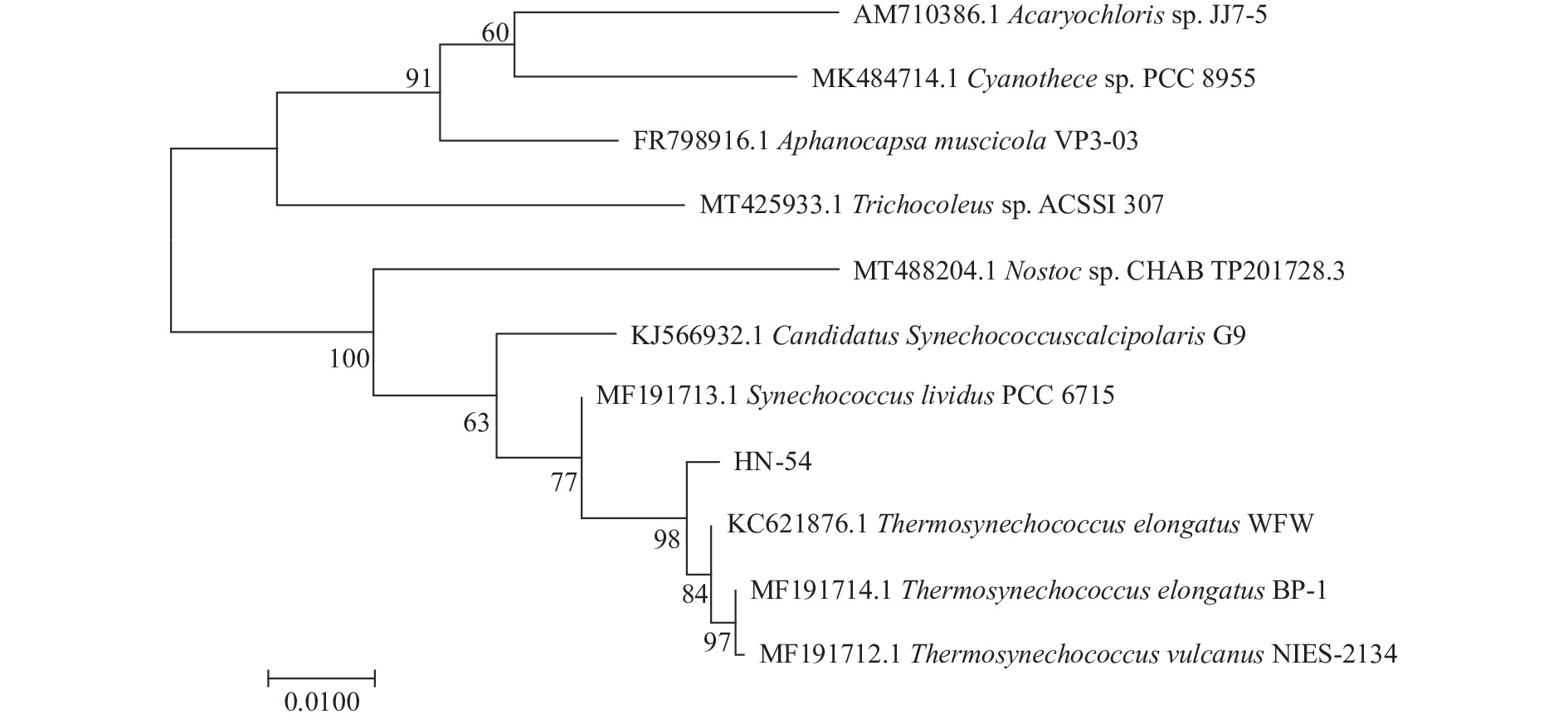
采用双向测序的方法得到的序列长度为1395 bp,完整序列在NCBI网站上经Blast同源性比对,再使用MEGA7.0软件构建系统发育树,结果如图3所示。
系统发育树显示其与Thermosynechococcus elongatus WFW(KC621876.1)、Thermosynechococcus elongatus BP-1(MF191714.1)、Thermosynechococcus vulcanus NIES-2134(MF191712.1)同源性最高,该分离藻株与蓝藻门中的嗜热聚球藻属最为接近,结合形态学观察结果分析,应将其定为嗜热聚球藻属的一支,将其命名为Thermosynechococcus sp. HN-54(NCBI登录号:ON212490)。由于16S rRNA基因在整个遗传进化过程中相对保守,不足以提供关于不同藻株之间关系的充足信息,无法鉴定至种水平,因此种一级的分类学地位鉴定尚需要依赖于进一步的研究结果。
2.4 藻蓝蛋白的提取得率和纯度
在超声辅助条件下从HN-54中得到的色素粗提物中藻蓝蛋白纯度为0.941,得率为11.37%,相较于行业标准螺旋藻藻蓝蛋白的含量10%~20%而言[30],HN-54藻蓝蛋白含量较高,可以作为提取藻蓝蛋白的来源。
2.5 藻蓝蛋白色价
经计算,藻蓝蛋白的色价为196.53,与宾美生物科技有限公司中产品藻蓝蛋白E18的企业标准(E10%618 nm≥180)相比,达到其色值指标,说明本研究的藻蓝蛋白可以达到目前市场上同类产品的色值标准。
2.6 藻蓝蛋白稳定性试验
2.6.1 热稳定性试验
环境温度对藻蓝蛋白稳定性的影响如图4所示。以藻蓝蛋白溶液在620 nm处的吸光值为指标来表达色值的高低,通过A620的变化来反应藻蓝蛋白的稳定性,从图4的结果可见HN-54的藻蓝蛋白在60 ℃以内的温度条件下非常稳定,吸光值随着时间的延长基本保持不变。但在70和80 ℃时,藻蓝蛋白的吸光值随着时间的延长不断下降,2 h后逐渐趋于稳定。温度越高,色值下降越迅速,当温度为70 ℃时吸光度下降了26.7%;而在80 ℃时吸光度下降了75.4%。欧瑜等[30]研究发现,钝顶螺旋藻藻蓝蛋白在温度升高到50 ℃时稳定性就会降低,60 ℃时保持3.5 h吸光值下降约66.7%,70 ℃时几乎完全褪色。Martelli等[18]在钝顶螺旋藻藻蓝蛋白溶液中添加62%的果糖,在80 ℃时加热1 h后色值也只能保留50%,HN-54藻蓝蛋白在未添加任何稳定剂的情况下经80 ℃时加热1 h色值仍能保留39%。由此可知,HN-54藻蓝蛋白耐热性能良好,与市场上所使用的藻蓝蛋白耐热性相比有较明显的优势,这一特性很可能与HN-54藻株具有高温适应性有关,在高温状态时其细胞内蛋白质非常稳定,因此藻蓝蛋白发色团的整体构象在高温时也能保持稳定状态。
2.6.2 光照稳定性试验
光照对藻蓝蛋白色值稳定性的影响如图5所示。光照强度不同,对藻蓝蛋白色值稳定性的影响不同。当光照强度为1000和2000 lux时,藻蓝蛋白的吸光值在7 d的保存期内基本保持不变。当光照强度为3000和4000 lux时,吸光值在第3 d时有所下降随后逐渐趋于稳定,吸光值分别保留了94.1%和94.8%。当光照强度为5000和6000 lux时,吸光值在第7 d时均保留了91.4%。由此可见,在7 d的观察时间内,藻蓝蛋白对光照较为稳定,没有发生严重的褪色现象。张岩等[31]研究表明,螺旋藻藻蓝蛋白置于室内自然光环境下2 d吸光值就下降了约50.0%。Wu等[32]将钝顶螺旋藻藻蓝蛋白连续暴露于100 μmol/m2·s环境下36 h,最终藻蓝蛋白浓度下降约21.6%,且光照强度越高,降解程度越高。可见HN-54藻蓝蛋白在光照稳定性方面与其他藻蓝蛋白相比具有更好的表现。藻蓝蛋白吸光度的降低可能是因为当藻蓝蛋白置于强光下或是长期暴露在光照下,会导致其失去发色团,从而导致其稳定性降低,蓝色逐渐消失[19]。因此,为延长藻蓝蛋白的保存时间,最好避光放置,以防止藻蓝蛋白结构被光破坏。
2.6.3 酸碱稳定性试验
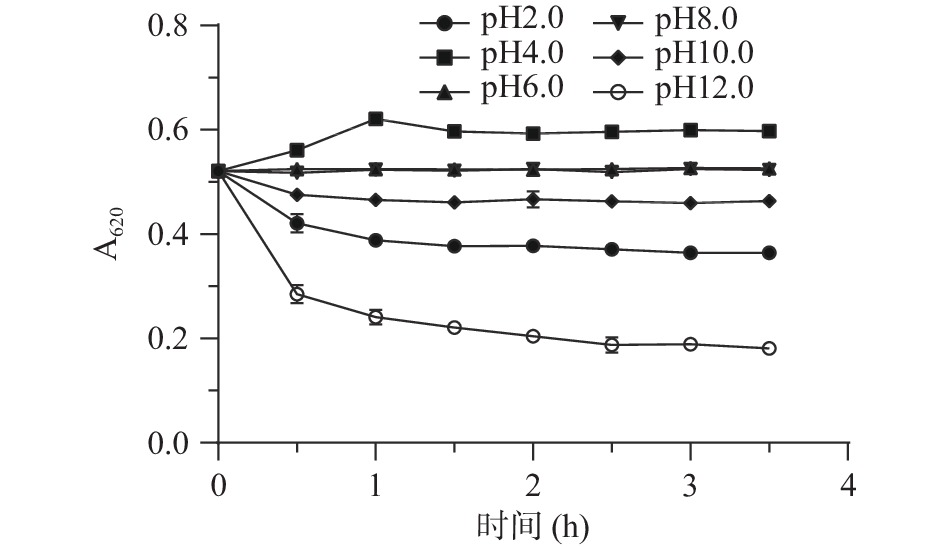
酸碱对藻蓝蛋白稳定性影响结果如图6所示。在pH6.0和pH8.0时,藻蓝蛋白吸光值基本保持不变,藻蓝蛋白非常稳定。在酸性条件下,pH4.0时藻蓝蛋白吸光值比中性条件下的吸光值高14.8%;pH2.0时,藻蓝蛋白在3.5 h后吸光值下降了28.8%。在碱性条件下,pH10.0时在1 h吸光值下降了10.6%,此后直至3.5 h基本保持稳定;pH12.0时吸光值明显下降,在3.5 h后吸光值下降了65.3%。结果表明,藻蓝蛋白在pH4.0~10.0的范围内较为稳定,但在极端酸性和碱性条件下稳定性较差,特别是在碱性条件下对色值影响较大。刘杨等[33]研究表明,钝顶螺旋藻藻蓝蛋白在中性环境下(pH7.0~8.0)稳定性良好,超出此范围稳定性开始下降;在碱性环境下,HN-54藻蓝蛋白与钝顶螺旋藻藻蓝蛋白类似,稳定性下降较明显。pH是影响藻蓝蛋白在溶液中以单体、三聚体、六聚体形式聚集比例的主要因素。藻蓝蛋白的稳定性依赖于蛋白质的聚集状态,有报道表明,六聚体是最稳定的结构,能避免藻蓝蛋白发生变性,而在较高或较低的pH下,这种结构很容易解离,从而导致稳定性降低,发生褪色[21, 34]。本试验表明,该藻蓝蛋白在pH4.0~8.0范围内高度稳定,可能是溶液中六聚体占主导地位,从而导致观察到较高的稳定性。因此,为了保护藻蓝蛋白的高溶解度和吸光度,最好在弱酸性和中性的环境下使用。
图7是藻蓝蛋白溶液在不同pH条件下的吸收光谱图,从图中可见,藻蓝蛋白的特征吸收峰波长在较强酸碱条件下发生了偏移,pH4.0、pH6.0、pH8.0的特征吸收峰保持在620 nm,pH2.0的吸收峰红移到625 nm,pH10.0的吸收峰蓝移到615 nm,该结果表明pH会影响藻蓝蛋白特征吸收峰的位置,另外,从特征吸收峰的吸收强度可以看出,在强酸和强碱环境下,藻蓝蛋白发生了较明显的褪色。
3. 结论
本研究从湖南一处温泉分离得到的藻株为嗜热聚球藻属(Thermosynechococcus)的一支,但其种一级的分类学地位尚不能确定。该藻为杆状单细胞结构,直或有时弯曲,二分裂殖。该藻可以得到纯度为0.941、色价为196.53的藻蓝蛋白粗提物,得率为11.37%(对藻干物质)。该藻所含藻蓝蛋白具有良好的热、光和酸碱稳定性。在60 ℃保持3.5 h色值不变,在70 ℃处理3.5 h仍保留73.3%的吸光值,在6000 lux光照7 d,色值可保持91.4%,在pH4.0~8.0保持3.5 h色值稳定,该藻蓝蛋白在食品加工领域具有良好的应用前景。
热不稳定是藻蓝蛋白市场开发应用最主要的限制条件之一,HN-54藻蓝蛋白表现出比市场上绝大多数藻蓝蛋白更好的耐热性,可以作为耐热性藻蓝蛋白的一个潜在来源,尽管目前的热稳定水平尚需要进一步提高才能满足食品工业更广泛的应用,但是其在较高热稳定性的基础上具备更好的条件进一步优化以满足严苛的食品加工条件。
-
-
[1] 古扎丽阿依·牙生, 库热西·马木提汗, 艾山江. 5株塔克拉玛干沙漠蓝藻的形态学与分子生物学鉴定[J]. 分子植物育种,2019,17(19):6525−6529. [YASIN G, MAMUTHAN K, AI S J. Morphological and molecular biology identification of 5 cyanobacteria from the Taklimakan desert[J]. Molecular Plant Breeding,2019,17(19):6525−6529. doi: 10.13271/j.mpb.017.006525 [2] SINGH S, KATE B N, BANERJEE U C. Bioactive compounds from cyanobacteria and microalgae: An overview[J]. Critical Reviews in Biotechnology,2005,25(3):73−95. doi: 10.1080/07388550500248498
[3] GHASEMI Y, YAZDI M T, SHAFIEE A, et al. Parsiguine, a novel antimicrobial substance from Fischerella ambigua[J]. Pharmaceutical Biology,2008,42(4-5):318−322.
[4] 雒义凡, 李俐珩, 李玫锦, 等. 不同培养条件对嗜热蓝细菌生长及活性物质的影响研究[J]. 可再生能源,2020,38(1):1−7. [LUO Y F, LI L H, LI M J, et al. Effects of different culture conditions on the growth and active substances of thermophilic cyanobacteria[J]. Renewable Energy,2020,38(1):1−7. doi: 10.3969/j.issn.1671-5292.2020.01.002 [5] SCIUTO K, ANDREOLI C, RASCIO N, et al. Polyphasic approach and typification of selected Phormidium strains (Cyanobacteria)[J]. Cladistics,2011,28(4):1−18.
[6] PRIYADARSHANI I, RATH B. Bioactive compounds from microalgae and cyanobacteria: Utility and applications[J]. International Journal of Pharmaceutical Sciences and Research,2012,3(11):4123.
[7] NAINANGU P, ANTONYRAJ A P M, SUBRAMANIAN K, et al. In vitro screening of antimicrobial, antioxidant, cytotoxic activities, and characterization of bioactive substances from freshwater cyanobacteria Oscillatoria sp. SSCM01 and Phormidium sp. SSCM02[J]. Biocatalysis and Agricultural Biotechnology,2020,29:101772. doi: 10.1016/j.bcab.2020.101772
[8] ERIKSEN N T. Production of phycocyanin-a pigment with applications in biology, biotechnology, foods and medicine[J]. Applied Microbiology and Biotechnology,2008,80(1):1−14. doi: 10.1007/s00253-008-1542-y
[9] SILVEIRA S T, BURKERT J F M, COSTA J A V, et al. Optimization of phycocyanin extraction from Spirulina platensis using factorial design[J]. Bioresource Technology,2007,98(8):1629−1634. doi: 10.1016/j.biortech.2006.05.050
[10] CARFAGNA S, LANDI V, CORAGGIO F, et al. Different characteristics of C-phycocyanin (C-PC) in two strains of the extremophilic Galdieria phlegrea[J]. Algal Research,2018,31:406−412. doi: 10.1016/j.algal.2018.02.030
[11] MOON M, MISHRA S K, KIM C W, et al. Isolation and characterization of thermostable phycocyanin from Galdieria sulphuraria[J]. Korean Journal of Chemical Engineering,2014,31(3):490−495. doi: 10.1007/s11814-013-0239-9
[12] 张成武, 曾昭琪, 张媛贞. 钝顶螺旋藻藻胆蛋白的分离、纯化及其理化特性[J]. 天然产物研究与开发,1996,8(2):29−34. [ZHANG C W, ZENG Z Q, ZHANG Y Z. Purification and physicochemical properties of phycobiliprotein of Spirulina platensis var. nanjingensis[J]. Natural Product Research and Development,1996,8(2):29−34. doi: 10.16333/j.1001-6880.1996.02.007 [13] SANTIAGO-SANTOS M C, PONCE-NOYOLA T, OLVERA-RAMÍREZ R, et al. Extraction and purification of phycocyanin from Calothrix sp.[J]. Process Biochemistry,2004,39(12):2047−2052. doi: 10.1016/j.procbio.2003.10.007
[14] 余佳, 陈颖, 马淑梅, 等. 葛仙米藻胆蛋白和藻蓝蛋白对S180荷瘤小鼠肿瘤生长的影响及其作用机制[J]. 食品工业科技,2022,43(8):399−405. [YU J, CHEN Y, MA S M, et al. Effects of phycobiliprotein and phycocyanin from Nostoc sphaeroides Kützing on the growth of S180 tumor-bearing mice and its mechanism[J]. Science and Technology of Food Industry,2022,43(8):399−405. [15] 李思梦, 高风正, 曾名湧. 聚球藻7002藻蓝蛋白的分离纯化研究[J]. 食品工业科技,2016,37(23):96−102,108. [LI S M, GAO F Z, ZENG M Y. Study on extraction and purification of C-phycocyanin in Synechococcus sp. PCC 7002[J]. Science and Technology of Food Industry,2016,37(23):96−102,108. doi: 10.13386/j.issn1002-0306.2016.23.010 [16] ZHANG Z, CHO S, DADMOHAMMADI Y, et al. Improvement of the storage stability of C-phycocyanin in beverages by high-pressure processing[J]. Food Hydrocolloids,2021,110:106055. doi: 10.1016/j.foodhyd.2020.106055
[17] 李俐珩, 梁园梅, 李玫锦, 等. 嗜热蓝细菌PKUAC-E542藻蓝蛋白耐热性以及不同光照条件对其含量影响研究[J]. 北京大学学报(自然科学版),2021,57(3):529−535. [LI L H, LIANG Y M, LI M J, et al. Thermophilic cyanobacteria PKUAC-E542 phycocyanin heat resistance and effects of different light conditions on its accumulation[J]. Acta Scientiarum Naturalium Universitatis Pekinensis,2021,57(3):529−535. doi: 10.13209/j.0479-8023.2021.029 [18] MARTELLI G, FOLLI C, VISAI L, et al. Thermal stability improvement of blue colorant C-Phycocyanin from Spirulina platensis for food industry applications[J]. Process Biochemistry,2014,49(1):154−159. doi: 10.1016/j.procbio.2013.10.008
[19] GOYUDIANTO B A, MELIANA C, MULIANI D, et al. The stability of phycocyanin, phycoerythrin, and astaxanthin from algae towards temperature, pH, light, and oxygen as a commercial natural food colorant[J]. Indonesian Journal of Life Sciences,2021,3(2):28−42.
[20] ZHANG Z, LI Y, ABBASPOURRAD A. Improvement of the colloidal stability of phycocyanin in acidified conditions using whey protein-phycocyanin interactions[J]. Food Hydrocolloids,2020,105:105747. doi: 10.1016/j.foodhyd.2020.105747
[21] CHAIKLAHAN R, CHIRASUWAN N, BUNNAG B. Stability of phycocyanin extracted from Spirulina sp: Influence of temperature, pH and preservatives[J]. Process Biochemistry,2012,47(4):659−664. doi: 10.1016/j.procbio.2012.01.010
[22] PRADEEP H N, NAYAK C A. Enhanced stability of C-phycocyanin colorant by extrusion encapsulation[J]. Journal of Food Science and Technology,2019,56(10):4526−4534. doi: 10.1007/s13197-019-03955-8
[23] 胡鸿钧, 魏印心. 中国淡水藻类--系统、分类及生态[M]. 科学出版社, 2006 HU H J, WEI Y X. The freshwater algae of China-systematics, taxonomy and ecology[M]. Science Press, 2016.
[24] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D]. 无锡: 江南大学, 2015 HU X L. Illumination the correlation between anaerobic clostridial community diversity and quality of pit mud used for the production of Chinese strong-flavor liquor[D]. Wuxi: Jiangnan University, 2015.
[25] 杜金城, 徐敏, 李柏良, 等. 具有抑制大肠杆菌作用的乳酸菌的初步筛选及其益生潜能的研究[J]. 食品工业科技,2016,37(13):152−156. [DU J C, XU M, LI B L, et al. Preliminary screening of lactic acid bacteria against Escherichia coli and the research of probiotic potential for the screening bacteria[J]. Science and Technology of Food Industry,2016,37(13):152−156. doi: 10.13386/j.issn1002-0306.2016.13.022 [26] 范德朋, 胡亚冬, 杨敏志, 等. 鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性[J]. 广东海洋大学学报,2021,41(6):9−17. [FAN D P, HU Y D, YANG M Z, et al. Identification and algicidal characteristics of an algicidal bacterium BWFA55 in anabaena bloom water[J]. Journal of Guangdong Ocean University,2021,41(6):9−17. doi: 10.3969/j.issn.1673-9159.2021.06.002 [27] 沈向阳. 钝顶螺旋藻藻蓝蛋白的提取纯化精制研究及应用[D]. 南宁: 广西大学, 2019 SHEN X Y. Study on extraction and purification of phycocyanin from Spiraulina platensis and it's application[D]. Nanning: Guangxi University, 2019.
[28] HERRERA A, BOUSSIBA S, NAPOLEONE V, et al. Recovery of C-phycocyanin from the cyanobacterium Spirulina maxima[J]. Journal of Applied Phycology,1989,1(4):325−331. doi: 10.1007/BF00003469
[29] SONI B, KALAVADIA B, TRIVEDI U, et al. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata—isolated from the rocky shores of Bet-Dwarka, Gujarat, India[J]. Process Biochemistry,2006,41(9):2017−2023. doi: 10.1016/j.procbio.2006.04.018
[30] 欧瑜, 叶瑞玲. 钝顶螺旋藻藻蓝蛋白稳定性研究[J]. 食品研究与开发,2013,34(4):11−14. [OU Y, YE R L. Study on the stability of phycocyanin from Spirulina platensis[J]. Food Research and Development,2013,34(4):11−14. doi: 10.3969/j.issn.1005-6521.2013.04.004 [31] 张岩, 王风, 陈炼红. 螺旋藻藻蓝素的提取及其稳定性研究[J]. 食品工业,2014,35(11):16−20. [ZHANG Y, WANG F, CHEN L H. The extraction of Spirulina phycocyanobilin and the study of its stability[J]. The Food Industry,2014,35(11):16−20. [32] WU H L, WANG G H, XIANG W Z, et al. Stability and antioxidant activity of food-grade phycocyanin isolated from Spirulina platensis[J]. International Journal of Food Properties,2016,19(10):2349−2362. doi: 10.1080/10942912.2015.1038564
[33] 刘杨, 王雪青, 庞广昌, 等. 钝顶螺旋藻藻蓝蛋白的富集分离及其稳定性研究[J]. 食品科学,2008,29(7):39−42. [LIU Y, WANG X Q, PANG G C, et al. Enrichment separation and stability of C-phycocyanin from Spirulina platensis[J]. Food Science,2008,29(7):39−42. doi: 10.3321/j.issn:1002-6630.2008.07.002 [34] HSIEH-LO M, CASTILLO G, OCHOA-BECERRA M A, et al. Phycocyanin and phycoerythrin: Strategies to improve production yield and chemical stability[J]. Algal Research,2019,42:101600. doi: 10.1016/j.algal.2019.101600
-
期刊类型引用(4)
1. 乔增辉,位璐璐,卢祺,史羽瑶,尹明雨,王锡昌. 保活方式对中华绒螯蟹活力和生理代谢的影响. 水产科学. 2025(01): 56-64 .  百度学术
百度学术
2. 张亮子,黄泽南,尤娟,刘茹,尹涛,马华威. 保活运输应激对水产动物肌肉品质影响的研究进展. 广东海洋大学学报. 2024(01): 35-43 .  百度学术
百度学术
3. 阮记明,钟智威,黄建珍,温娇萍,王朝,傅雪军,王润萍. 克氏原螯虾低温休眠保活技术研究. 中国水产科学. 2024(07): 810-819 .  百度学术
百度学术
4. 李彤彤,赵玲,王善宇,刘淇,曹荣. 太平洋牡蛎活体冷藏过程中脂质及挥发性物质变化. 肉类研究. 2024(10): 23-29 .  百度学术
百度学术
其他类型引用(2)










 下载:
下载:



 下载:
下载:



