Research Progress on Types, Detection and Desensitization Technology of the Main Allergens in Nuts
-
摘要: 近年来由于摄入坚果而导致的过敏反应屡见报道,已成为影响和威胁人体健康的一类重要的食品安全问题。本文对坚果中常见的过敏原的性质及危害进行了介绍,列举了目前国内外用于坚果过敏原检测的主要技术、特点及其应用,对比分析了不同处理方式对坚果中过敏原脱敏效果以及优缺点,指出目前坚果中过敏原检测及脱敏技术的不足和今后发展展望,旨在为坚果的加工和消费提供理论基础,助推坚果产业发展。Abstract: In recent years, allergic reactions caused by eating nuts have been reported frequently, which has become an important food safety problem that affects and threatens human health. This paper introduces the properties and hazards of common allergens in nuts, lists the main technologies, characteristics and applications used in nut allergen detection at home and abroad, compares and analyzes the desensitization effects, advantages and disadvantages of different treatment methods on allergens in nuts, and points out the shortcomings and future development prospects of allergen detection and desensitization technology in nuts, in order to provide a theoretical basis for nut processing and consumption, and promote the development of the nut industry.
-
Keywords:
- nuts /
- allergen /
- types /
- detection /
- desensitization
-
坚果是植物的精华部分,不仅含有丰富的脂肪、蛋白质、维生素,还含有许多矿物质和天然活性物质,研究表明,坚果对调节血脂、防治冠心病、增强大脑记忆、降低癌症、预防心脏、神经和肺部疾病有重要作用[1-2]。Marta等[3]研究表明每周食用核桃1次或1次以上,脑血管疾病风险降低19%,冠心病风险降低21%,中风风险降低17%。近年来,随着消费者对坚果营养价值认识的深入,坚果的销售量和市场份额正在逐年递增,但同时由于坚果摄入所引发的过敏性食品安全事故也逐年增加,据2021年世界过敏组织期刊报道,花生/树坚果过敏事故比例在食物诱发过敏反应死亡案例中高达70%~90%[4],因此,由于摄入花生以及树坚果过敏所带来的潜在食品安全问题更加值得关注。
食物过敏是指食物进入机体后,机体对食物抗原产生可重复出现的异常免疫反应,导致机体生理功能紊乱和/或组织损伤,进而引发一系列临床症状[5]。根据其免疫特点可分为免疫球蛋白E(Immunoglobulin E,IgE)介导、非IgE介导及这两种反应的混合型。坚果所引发的过敏反应属于IgE介导类型,即一定量的坚果致敏物质进入易感人群机体后,诱导机体产生对这一致敏物质特异性的IgE,并与受体细胞结合,若这种坚果致敏物质再次接触机体,便会与受体细胞上的IgE结合并发生反应,进而释放出多种过敏物质,引起身体系统过敏反应[5-6]。主要表现为皮疹、咽喉肿胀、恶心呕吐,严重时会出现急性哮喘、过敏性休克等危及生命的症状。
据中国海关数据显示,2020年中国水果及坚果进口金额为116亿美元,同比增长2.5%;中国水果及坚果出口金额为68亿美元,同比增长14.7%。由于各国坚果销量不同,所引发的致敏率也各不相同,花生所引起的致敏率在0.5%~3%之间,树坚果所引起的致敏率在0.05%~4.9%之间,其中,巴西坚果、核桃、杏仁、腰果、榛子等树坚果已成为英、美和欧洲大陆上最主要的过敏坚果[4]。尽管经过多年理论和临床研究,但仍未发现有效防治坚果过敏的方法。目前对于食物过敏性消费者而言,最有效的预防方式就是避免食用含有致敏原的过敏物质,因此世界各国对于食品标签中过敏原的标注都有着严格的法律规定,但从消费者饮食营养、口味、多样性的需求以及食品安全性的角度来看,明确坚果中过敏原的种类及检测以及有效的脱敏技术研究尤为重要。
本文针对一些常见坚果过敏原,阐述了其性质和特点,介绍了常见检测方法,并对目前国内外坚果主要脱敏方式进行综述,以期为促进坚果脱敏技术开发提供参考。
1. 坚果中的主要过敏原
食源性过敏原主要是食物中的水溶性或盐溶性糖蛋白,分子量范围为10~70 kDa,等电点大多为酸性,无生物化学和免疫化学共性,也无统一氨基酸序列,倾向于耐热、耐酸、耐酶解。根据来源不同,又可以分为植物性食物过敏原和动物性食物过敏原,坚果即属于植物性食物过敏原。植物性食物过敏原主要包含醇溶谷蛋白超家族、Cupin超家族、发病机制相关蛋白(Pathogenesis-related protein,PR)和profilins家族。醇溶谷蛋白超家族由非特异性脂质转移蛋白、2S白蛋白、胰蛋白酶抑制剂、α-淀粉酶和谷类醇溶蛋白组成,有很强的耐水性、耐热性和耐脂性;Cupin超家族由7S球蛋白和11S球蛋白体组成,其三级结构可能具有耐热性;发病机制相关蛋白不是蛋白质超家族,而是代表14个不相关植物蛋白质家族的特异性集合并与许多植物性食物过敏原具有同源性。profilins家族主要为蔬菜和水果中过敏原,对热以及胃消化非常敏感,因此由profilins家族引起的食物过敏通常为生食引起的口腔过敏综合征[7-8]。
坚果种类较多,每种坚果中又含有多种过敏原且所属蛋白种类不同,因而一种坚果所包含的过敏原又可分为不同蛋白质家族。世界卫生组织和国际免疫学会联盟(IUIS)过敏原命名小组委员会已发现并命名多种坚果过敏原,并且还在持续更新中,其命名原则为Ggg(g) s(s) n,其中g表示属(2~3个字母),s表示种(1~2个字母),n表示过敏原编号。表1为IUIS公布的常见坚果中的主要过敏原。
表 1 坚果中的主要过敏原Table 1. Major allergens in nuts主要过敏原 分子量(kDa) 蛋白质家族 蛋白种类 花生 Ara h 1 64 Cupin 7S球蛋白 Ara h 2 17 醇溶谷蛋白 2S白蛋白 Ara h 3 60,
37Cupin 11S球蛋白 Ara h 6 15 醇溶谷蛋白 2S白蛋白 核桃 普通核桃 Jug r 1 15~16 醇溶谷蛋白 2S白蛋白 Jug r 2 44 Cupin 7S球蛋白 Jug r 4 58.1 Cupin 11S球蛋白 Jug r 5 20 PR-10 Bet v 1 Jug r 7 13 profilins Profilin 黑核桃 Jug n 1 醇溶谷蛋白 2S白蛋白 Jug n 2 Cupin 7S球蛋白 榛子 Cor a 1 17 PR-10 Bet v 1 Cor a 2 14 profilins 肌动蛋白结合蛋白 Cor a 8 9 醇溶谷蛋白 非特异性脂质转移蛋白 Cor a 9 40 Cupin 11S球蛋白 Cor a 11 48 Cupin 7S球蛋白 Cor a 14 10 醇溶谷蛋白 2S白蛋白 腰果 Ana o 1 50 Cupin 类7S球蛋白 Ana o 2 55 Cupin 类11S球蛋白 Ana o 3 14 醇溶谷蛋白 2S白蛋白 杏仁 Pru du 3 9 醇溶谷蛋白 非特异性脂质转移蛋白1型 Pru du 4 14 profilins 肌动蛋白结合蛋白 Pru du 5 10 PR-10 60S酸性核糖体蛋白P2 Pru du 6 360 Cupin 11S球蛋白 开心果 Pis v 1 7 醇溶谷蛋白 2S白蛋白 Pis v 2 32 Cupin 11S球蛋白亚基 Pis v 3 55 Cupin 7S球蛋白 Pis v 4 25.7 PR-9 锰超氧化物歧化酶 Pis v 5 36 Cupin 11S球蛋白亚基 巴西坚果 Ber e 1 9 醇溶谷蛋白 2S富含硫贮藏蛋白 Ber e 2 29 Cupin 11S球蛋白 板栗 Cas s 5 PR-3 几丁质酶 Cas s 8 12~13,
9醇溶谷蛋白 非特异性脂质转移蛋白1型 Cas s 9 17 热休克蛋白20 松籽 Pin p 1 6,
15醇溶谷蛋白 2S白蛋白 1.1 花生
花生是最常见的致敏性坚果,对于花生过敏的人群,只要30~100 μg的致敏蛋白就能够引起轻微的过敏反应,如嘴唇和舌头肿胀、皮疹、呕吐和腹泻等[9]。在美国,2001年至2017年间,花生年致敏率从1.7%增至5.2%,2017年4~17岁致敏人群为125万人(2.2%,美国医疗索赔数据库患者纵向数据),2018年0至17岁致敏人群为160万人(2.8%,美国医疗索赔数据库患者纵向数据)[10],每年因花生过敏而死亡的人数为50~100人。花生过敏不仅对过敏人群身体带来不同程度伤害,对个人及家庭也产生巨大负担,所造成的心理问题比身体健康问题更加严重[11]。
目前WHO/IUIS过敏原命名小组共收录花生过敏原物质18种,分别命名为Ara h 1~18。主要过敏原为Ara h 1、Ara h 2、Ara h 3和Ara h 6,都属于种子贮藏蛋白,分别占花生总蛋白的12%~16%、10%、3.7%~4.3%和6%~9%。据报道,超过95%的花生过敏人群至少对Ara h 1、Ara h 2和Ara h 3三种过敏原中的一种过敏,超过95%的花生过敏人群可以通过血清IgE识别Ara h 1、Ara h 2和Ara h 6[12]。
Ara h 1是花生子叶中的一种可溶性蛋白,在花生总蛋白中含量最高,烘焙处理后分子间可交联形成高度稳定的三聚体而不易被破坏;Ara h 2与胰蛋白酶抑制剂具有同源性,主要由α螺旋和无规则卷曲组成,结构中存在二硫键,因此在高温和胰蛋白酶处理下都较为稳定,还可保护花生第二大过敏原Ara h 1不被胰蛋白酶降解[12];Ara h 3是一种可水解蛋白,但耐热性较强[13];Ara h 6和Ara h 2一样富含二硫键,具有耐高温和蛋白酶水解的性质[14]。
此外,不同地域的人群对花生过敏原的敏感度不同,在一项来自3个国家的115例花生过敏人群的研究中,美国过敏者(n=30)经常对Ara h 1、Ara h 2和Ara h 3敏感,致敏率为56.7%~90.0%;荷兰对花生过敏人群的一项研究中,最常见的过敏原为Ara h 2,近来研究表明,Ara h 1和Ara h 3为中国花生过敏人群主要的过敏原[15]。
1.2 核桃
核桃是继花生之后最常涉及过敏性反应的食物。在美国,花生和树坚果过敏登记处收集的5149名患者中,核桃是引起树坚果过敏反应的首要原因(34%)[16]。2008年在韩国进行的一项调查中,没有任何个人对核桃过敏。然而,在过去10年中,随着核桃的进口量增加,现已是韩国儿童过敏反应的第三种常见食物。核桃过敏主要表现为口腔过敏、上呼吸道、皮肤、消化系统症状[17]。在WHO/IUIS过敏原命名小组中被分为两大类,分别是黑核桃和普通核桃。黑核桃中包含Jug n 1、Jug n 2 、Jug n 4三种过敏性物质。普通核桃中包含Jug r 1~8八种过敏性物质。Jug r 1、Jug r 2、Jug r 4、Jug r 5、Jug r 7和Jug n 1、Jug n 2分别被鉴定为普通核桃和黑核桃中的主要过敏原[18-19]。
Jug r 1和Jug n 1属于2S白蛋白,是低盐浓度下的水溶性蛋白,紧凑的球状结构使其有较高的pH和热稳定性[20]。Jug r 1含有二硫键,所以在碱性(pH8.0)条件下对胰蛋白酶和糜蛋白酶的水解具有高抗性、且90 ℃加热后仍能保持蛋白质螺旋和折叠结构[20];Jug r 2属于7S球蛋白,具有较高的热稳定性,在70~75 ℃时仍能保持稳定构象;Jug r 5属于致病相关蛋白(PR-10)家族,过敏后通常引发轻微的口腔反应,主要由于摄入生食品而发生,对热和胃消化较为敏感[18]。
核桃中不同类型过敏原在不同地域的发病率是不同的,Jug r 5是在北欧和中欧占主导地位的核桃过敏原,Jug r 3是在南欧占主导地位的过敏原,Jug r 7是在整个欧洲都很突出的核桃过敏原类型,所有核桃过敏原中,致敏率最高的是Jug r 5和Jug r 7这两种过敏性物质[18]。
1.3 榛子
榛子是EuroPrevall诊所调查的24种常见致敏食物(包括花生、核桃、芝麻、瓜子、大豆、小麦、桃、苹果、虾、鱼、牛奶等)中被报道最多的致敏食物(32%),也是IgE介导食物过敏最常见的食品诱因之一,调查数据发现在8个欧洲中心城市、20~57岁普通人口中过敏率达9.3%[21]。美国7390万儿童中147800名儿童会受到榛子过敏影响。过敏人群通常表现出口腔粘膜、上气道、皮肤和消化反应,部分有哮喘,心血管或神经症状[22]。
榛子中过敏原包括Cor a 1、Cor a 2、Cor a 6、Cor a 8~Cor a 15十一种。主要过敏原有Cor a 1、Cor a 2、Cor a 8、Cor a 9、Cor a 11和Cor a 14六种[23]。Cor a 1属于PR-10家族,是美国东北部成人的主要过敏原物质,IgE水平比其他榛子过敏原人群水平平均高5到10倍,并且对消化道和胃中极端pH条件较为敏感;Cor a 2是与花粉相关的主要过敏原,因地区不同而引发不同的致敏率[24];Cor a 8作为一种脂质转移蛋白是地中海地区榛子中的主要过敏原[25],在170 ℃烘烤时可丧失免疫活性;Cor a 9作为球蛋白在所有加工技术处理中稳定性最高,即使在94 ℃条件下加热,蛋白质二级结构仍基本保持不变[26];Cor a 11是一种糖基化的储存球蛋白,在中欧榛子过敏人群中被鉴定为轻微过敏原,对食品加工敏感,耐热性较差,在70 ℃时已经表现出结构变化[27]。Cor a 14对热处理具有高稳定性,处理温度需要超过80 ℃才开始展开,且体外消化实验表明,Cor a 14对蛋白水解具有抗性[28]。此外,不同年龄段对过敏原敏感性不同,Cor a 9和Cor a 14的致敏性反应在儿童中最为常见,随着年龄的增长,Cor a 1敏感作用逐渐增加[23]。
1.4 腰果
腰果过敏在婴儿和成年女性中发生较多。在美国被报告为仅次于核桃的第二普遍的树坚果过敏物;英国大约0.08%的4岁以下婴儿由于摄入腰果过敏而导致健康受损,法国大约41%的坚果过敏者被发现对腰果敏感,此外,腰果过敏在亚洲人群中也较为普遍,Luyt等[29]的一项研究比较了白人儿童和南亚儿童,发现后者更容易对腰果过敏,相对风险分别为1.94%和2.59%。而Chitta等[30]在一项新加坡儿童对腰果过敏反应的研究中对99名受试儿童进行临床反应试验,发现52名儿童对腰果过敏,其中47名儿童在此之前从未接触过腰果,并普遍表现出呼吸道和胃肠道不适等症状。
腰果中过敏原包括Ana o 1、Ana o 2和Ana o 3三种。在西方国家的免疫抑制检查过敏人群中,Ana o 3敏感性占81%,Ana o 2占62%,Ana o 1占50%,因此,Ana o 3可作为腰果过敏的最佳检测原。Ana o 1、Ana o 2和Ana o 3对热都具有一定抵抗能力,但Ana o 3和Ana o 2对热更加稳定,150 ℃下烘烤16 min后Ana o 2分子量仍未显著降低,甚至有所增加。三种过敏原对pH也较为稳定,Ana o 1仅在pH13时敏感,Ana o 2在极端pH条件下(pH1~3或pH13)与IgE结合度略有降低,Ana o 3在pH1~11范围内都较为稳定,因此都可一定程度抵抗胃和肠道消化而产生致敏效果[31-32]。
1.5 杏仁
在美国,关于树坚果过敏反应人群统计的百分比中,杏仁排名第三(15%的树坚果过敏人群有反应性),仅次于核桃和腰果[33-34]。主要过敏症状表现为咽喉瘙痒、鼻塞、荨麻疹、腹痛、血管性水肿等[35],WHO/IUIS过敏原命名小组中将杏仁中过敏原分为6种:Pru du 3~6、Pru du 8及Pru du 10,主要过敏原为Pru du 3~6。Pru du 5又称60S酸性核糖体蛋白P2,等电点在3~5之间[36]。Pru du 6属于11S球蛋白,对胃蛋白酶敏感,热稳定性好,高于94 ℃温度才会部分展开,在食物中聚集形成不同的结构[37-38]。
1.6 其他坚果
坚果种类多样,除上述较为普遍的坚果外,开心果、巴西坚果、松籽、板栗等也可引起过敏反应。在土耳其,食物过敏人群中的6.7%对开心果过敏,由于摄入开心果所导致的过敏发生率要高于许多国家,这与土耳其是世界上主要的开心果种植和消费地区之一密切相关[39]。开心果中包含5种过敏原:Pis v 1、Pis v 2、Pis v 3、Pis v 4和Pis v 5。Pis v 4 是一种锰超氧化物消解剂,其余为坚果种子储存的主要蛋白成分。Pis v 1 为 2S 白蛋白,Pis v 3、Pis v 2 和 Pis v 5为球蛋白,分别占总蛋白的25%和66%[40];目前,巴西坚果中仅发现两种过敏原 Ber e 1和Ber e 2,均属于种子贮藏蛋白,有一定耐热性;在Cas s 5、Cas s 8、Cas s 9这三种板栗食入性过敏原中,Cas s 8、Cas s 9更易致敏,且Cas s 9更耐高温[41];松籽与核桃、花生被报道为韩国儿童过敏反应的三种最常见坚果[42],其Pin p 1(2S白蛋白)被报道为松籽主要的过敏原物质,分子量为15 kDa,但其对还原剂敏感,易被还原为6 kDa小分子量物质并失去与IgE结合特性[43]。
在坚果市场扩大的同时,坚果类食品也更加多样化,除常见的蛋糕、冰淇凌、糖果外,一些坚果酱、饮料等产品也相继出现,但因部分人群对坚果过敏,所以限制了消费者对于此类产品的摄入。此外,生产加工中共用生产线或原料运输中的交叉感染也为过敏人群带来极大隐患,因此,更应明确过敏原信息,加强过敏原检测及消费者健康保障。
2. 坚果中过敏原的检测方法
目前在世界范围内,过敏性疾病的发生率仍呈现不断上升的趋势,明确食品中过敏原并建立相关检测方法对预防食物过敏的发生至关重要。目前坚果中过敏原的检测方法主要分为“体内诊断”和“体外检测”两种形式。
2.1 体内诊断
体内诊断主要利用皮肤敏感试验或双盲对照食物激发试验等手段评价某一坚果中某种过敏原能否使过敏人群产生过敏反应,由于过敏人群为直接检测对象,此方法可能会为他们带来痛苦或引发过敏反应而产生风险,结果也可能受检测对象心理或其他因素影响[44],从伦理以及安全学角度而言都存在一定问题。所以,相对于坚果中过敏原的体外检测来说,应用较窄,相关研究报道也较少。
2.2 体外检测技术
体外检测技术主要分为两类:基于蛋白质水平和基因水平的检测技术。蛋白质水平检测技术主要包括酶联免疫吸附技术(Enzyme linked immunosorbent assay,ELISA)、免疫印迹技术(Western blotting,WB)、免疫层析技术及生物传感器技术在内的免疫学检测技术和非免疫学检测技术-质谱技术等。基因水平检测技术主要包括聚合酶链式反应(Polymerase chain reaction,PCR)及基于PCR技术而发展的多重PCR技术和实时荧光定量PCR技术,环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)等。
2.2.1 基于蛋白质水平的检测技术
2.2.1.1 酶联免疫吸附技术
酶联免疫吸附技术通过显色程度来反映待测样品中抗原或抗体的含量。根据免疫反应动力学类型可分为竞争ELISA和双抗体夹心ELISA两类。Zhao等[45]将腰果过敏原Ana o 3作为蛋白标记,研发出两种夹心ELISA检测方法,检测限分别为0.04 mg/kg和0.06 mg/kg,均低于其他坚果检测报告中含量,且该方法能检测出加工过的巧克力中腰果残留物痕迹,为检测食品中低剂量过敏原提供有效依据。Joana等[46]开发了一种高度特异性和敏感性的夹心ELISA检测方法,用于检测和量化复杂食品体系中的榛子过敏原,榛子检出限达到1 mg/kg,并且量化检出添加已知榛子量为50 mg/kg的榛子巧克力模型,强化了ELISA作为检测食品中过敏原快速且可靠的价值。ELISA检测技术因特异性强、灵敏度高、操作方便快速被广泛应用于坚果过敏原定性和定量分析,检测试剂盒的应用也为研究过敏物质提供了便捷途径,虽然加工处理过程对蛋白造成变化时会对检测结果造成影响,但目前仍是坚果过敏原检测中应用最广泛的方法[46]。
2.2.1.2 免疫印迹技术
蛋白质免疫印迹是在凝胶电泳基础上利用酶或放射性标记的抗体对过敏原进行检测的技术,主要用于坚果过敏原的鉴定以及半定量分析。Chen等[47]利用蛋白质免疫印迹与免疫层析结合的方法开发了一种花生过敏原筛选和确认系统,通过多克隆抗体联合胶体金标记免疫层析试纸条,可在过敏蛋白浓度为5 ng/mL~2.5 μg/mL范围时呈现强阳性结果,用于快速鉴定花生过敏原成分,同时使用Ara h 1特异性单克隆抗体进行蛋白质印迹以排除假阳性结果。利用此方法对海关监测测试的285个样本进行分析,检测结果与原始标记样本相比多出五例阳性样本,对阳性样本进一步进行蛋白质印迹验证试验后发现,只有一例被证实为阳性。总体来说,这种方法有效地将电泳技术与免疫检测技术相结合,从混杂抗原中检测出特异性抗原,特异性强、灵敏度高、试剂用量少,但在分析样品时花费时间过长,且检测食品样本的复杂性对其结果会产生影响。
2.2.1.3 质谱技术
质谱技术是对样品离子的质量和强度进行定性、定量和结构分析的方法,常与液相色谱、气相色谱、毛细管电泳技术相结合。近年来,随着质谱技术的快速发展,在坚果过敏原检测领域也得到越来越多的关注。洪宇伟等[48]通过超高效液相色谱-电喷雾质谱法分别检测10、40、80 μg/g三个浓度花生过敏原Ara h 2时,发现其检测限达1.87 μg/g,定量限达6.23 μg/g。同时从某超市购买10种烘培食品以验证该方法的适用性,结果在食品标签或配料表中未标明花生的食品中检测出花生蛋白残留,说明某些食品在生产、加工、运输、销售过程发生了交叉感染,同时也验证了该方法的可行性。Gu等[49]通过使用MonoSpin PBA离心柱引入快速固相萃取的方式优化了LC-MS/MS检测方法。结果发现巧克力中致敏成分的检测限范围为0.05~1.3 μg/g,定量极限值在0.2~4 μg/g。其中花生和坚果定量限值分别为2.5~4 μg/g、1~3 μg/g,证明了所利用的样品处理方法结合LC-MS/MS分析的出色能力。最后,利用该方法对市售24种不同品牌的巧克力样品中过敏原存在性进行评估,结果标签上标示的过敏原均检出,且在其中六款不同品牌的巧克力样品种分别发现未标注的牛奶、花生及榛子隐藏性过敏原,证明该方法的可靠性和真实性,为食品过敏原含量与食品过敏原标签之间可能存在的差异提供有利的检测依据。检测方法存在高灵敏度和高准确性,克服了坚果加工过程过敏原结构变化产生的假阴性结果,虽然检测设备昂贵,可实现多种过敏原同时检测,具有广阔的应用前景[50]。但同时,由于质谱检测是基于化合物离子化并通过特定的质荷比来检测和定量的,因此任何干扰待测物离子化的物质都可能影响检测方法的灵敏度和准确性。
2.2.2 基于DNA水平的检测技术
2.2.2.1 多重PCR检测技术
多重PCR检测技术检测量大且精确,可大量节省成本和时间。在食品致病菌检测中应用较多,对于食品真伪鉴别如肉制品加工中效果也较好。采用多重PCR技术进行坚果检测方面也有一定研究和报道,王守法等[51]通过三重PCR法同时检测榛子磷酸葡糖异构酶、榛子致敏蛋白Cor a 1及Cor a 8三种成分,结果DNA含量为10 ng/μL的榛子模板清晰可见,为检测榛子及坚果过敏原提供可行方法。Cheng等[52]开发了一种与毛细纤维电泳相结合的多重PCR检测法,可同时检测来自榛子、开心果、燕麦、芝麻、花生、腰果、大麦、小麦、大豆和山核桃的10种常见食物过敏原,该方法的绝对检测限在2~20个单倍体基因组之间,为坚果过敏原检测技术提供了另一种途径。
2.2.2.2 实时荧光定量PCR技术
实时荧光定量PCR技术不仅可定量检测且结果更加精确,操作性强,可以实现多种复杂坚果中过敏原的鉴定,应用范围更广,但实验仪器较昂贵。孙敏等[23]通过实时荧光定量PCR技术对榛子中的致敏原进行检测,结果表明对榛子热休克蛋白设计合成引物DNA的检出限可达0.11 ng。Silvia等[53]通过实时PCR方法,对巴西坚果进行检测,针对2S白蛋白基因,检测限为2.5 mg/kg,通过对66种不同商业食品样品的分析,评估了巴西坚果特定系统的适用性,为检测巴西坚果DNA提供了一种有效工具,并可用作常规检测分析,以判定相关食品标签的准确性。这种利用荧光探针的优化PCR技术,不但可实时监测目标产物扩增变化,而且无需再次染色,减少产物污染和假阳性误差,实现多重样品检测的同时提供了更快速和精确的结果。
2.2.2.3 环介导等温扩增技术
LAMP操作简单、快捷、准确,在分子生物学检测领域应用较多。Shyang-chwen等[54]采用LAMP快速检测加工食品中的过敏性花生蛋白,当以ITS作为LAMP引物时,对花生基因组DNA检出限为1 pg,与特异性靶向ITS序列的PCR引物相比,检出限提高了10倍。而以Ara h 1为LAMP引物时,对花生基因组DNA检出限为100 pg,同样高出PCR检测技术10倍。此外,当其他坚果如核桃,榛子等存在时不会对检测结果产生影响。刘昊等[55]通过此方法对开心果中过敏成分进行检测,发现该方法对开心果基因组DNA的检出限为0.2 ng,且检测时间不超过1 h。此方法对过敏成分的检测限远低于PCR检测技术,这便为食品交叉污染而产生的痕量过敏原检测提供了新的选择方式,且在检测过程中不受其他成分干扰,具有更高灵敏度和特异性。
3. 坚果中脱敏技术研究现状
坚果已成为现代饮食结构中不可缺少的部分,同时坚果过敏也正成为全世界普遍存在的食品安全问题,一些微量或痕量存在的致敏成分就足以对过敏者的健康带来严重伤害。尽管世界各国已对食物过敏出台多项管理措施,但由于没有统一标准且部分国家相关法律法规尚不健全,所以实施过程中仍存在诸多问题。在我国,不仅出现标识不完整、不正确等造成消费者误食致敏或因过度避免致敏食物而导致营养不良的问题,同时在出口贸易中也造成巨大经济损失,所以研究坚果中致敏成分并通过相应技术手段降低或消除坚果中的致敏原就变得尤为重要。
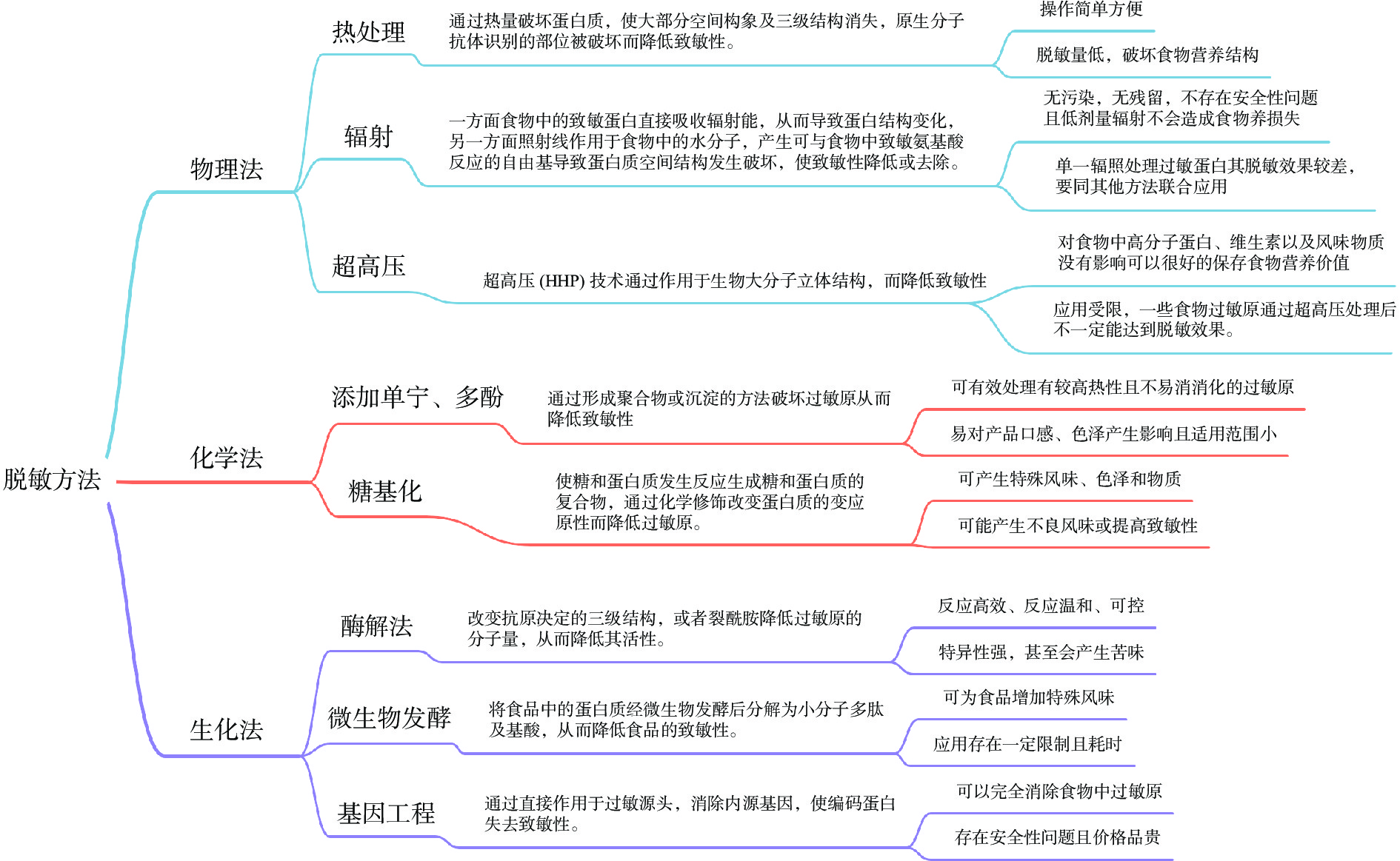
根据处理原理及方式的不同,降低坚果中致敏原的方法主要分为三种:物理法、化学法和生化法。不同处理方式产生的效果不同,为了提高脱敏效果,往往采用多种方式联合处理。在国外,坚果脱敏研究较为普遍,因而其研究方法相对成熟且研究方面也较为广泛。我国主要采用物理方法对相关坚果中的致敏原进行脱敏研究,且原料多为花生,虽然已有部分报道但仍处于起步阶段。
3.1 物理法
3.1.1 热处理
热处理是最普遍的食品加工方式,包括蒸、煮、烤、炸、烘、煎、微波加热、高温高压和巴氏灭菌等。李坤等[56]对花生过敏原研究时发现,随着温度升高致敏蛋白二级结构会发生变化,主要表现为α-螺旋相对含量降低,β-折叠和β-转角相对含量增加,三级结构部分展开,因此可通过热处理改变蛋白质结构和性质,破坏原生分子抗体识别部位而降低花生致敏性。但坚果中致敏原多样且复杂,不同过敏原对热处理耐受性不同,如李颖超等[57]研究发现160 ℃、5 min油炸处理后样品中几乎检测不到Ara h 1,121 ℃、0.1 MPa、30 min高温高压处理也可明显降低Ara h 3的含量,但两种方式对Ara h 2的影响却都很小;Zhang等[58]研究表明,加热可改变花生中Ara h 2二级结构,但程度不同,经过100 ℃,水煮20 min后Ara h 2含量减少,而170 ℃,烘烤15 min后,Ara h 2含量会增加;而李坤等[56]发现通过半胱氨酸还原协同加热处理可大幅改变蛋白二级结构和三级结构,使抗原性明显降低,热处理过敏蛋白Ara h 2抗原性的IC50值为1.66 μg/mL,还原处理过敏蛋白Ara h 2抗原性的IC50值为1.75 μg/mL,而热处理和还原联合处理后过敏蛋白Ara h 2抗原性的IC50值为7.92 μg/mL,高出4倍以上,极大降低了Ara h 2的致敏性。此外,Jongh等[59]研究发现90 ℃加热及高压121 ℃分别处理花生20 min,对Ara h 6两种异构体二级结构都没有明显影响,但高压灭菌条件下可使Ara h 6与IgE亲和力明显减少。由此可见,多种方式联合处理可明显提升脱敏效果,但也应根据不同致敏原性质采取针对性措施。
3.1.2 辐射处理
辐射处理属于冷加工,低能耗,不需添加化学药物,不存在药物残留问题,同时可以保持食品原有的色泽、香气和风味。罗春萍等[60]研究发现,与单一热处理不同,60Co-γ辐照处理可破坏Ara h 2蛋白的表位,使其失去与抗体结合的能力,且在辐照剂量为10 kGy时,可完全破坏溶液中稳定的Ara h 2和Ara h 6的蛋白结构。此外,辐照与其他方式联合作用更能明显降低坚果致敏性。Lamberti等[26]采用热空气和红外线处理榛子中过敏蛋白,在170 ℃下烘烤可降低与IgE结合能力,而红外辅助处理后过敏性几乎完全消失。Kasera等[61]研究发现,对于四季豆、黑豆和花生中可溶性蛋白,单一煮沸情况下致敏性分别降低7倍、3倍、26倍,煮沸+辐照处理后致敏性可降低10倍、3倍、47倍(P<0.001);两种方式联合处理对四季豆、黑豆和花生中不溶性蛋白的影响更加明显,单一煮沸情况下致敏性分别降低6倍、4倍、8倍,煮沸+辐照处理后致敏性可降低13倍、11倍、23倍(P <0.001)。与单独煮沸相比,联合处理能更有效地降低可溶性和不可溶性蛋白,而更适合于坚果脱敏的应用。
3.1.3 超高压处理
超高压技术通过作用于生物大分子立体结构而改变致敏性,同样也对食品的营养价值、色泽和天然风味具有保护效果。美国大杏仁与苦杏仁中含有同种热稳定性较好,且不受辐射影响的过敏原,但研究发现超高压可对其致敏性产生破坏,朱乾乾等[62]对杏仁分离蛋白进行不同压力处理后发现蛋白样品的二级结构未受影响,但三级结构展开,表面疏水性增强,在500 MPa下处理900 s后,苦杏仁分离蛋白的致敏性可以降低到25.69%。另外,Yang等[63]研究了高静液压HHP/热处理对核桃的影响,通过竞争抑制ELISA方法进行评估,与HHP或沸腾处理相比,核桃在650 MPa、100 ℃条件下经HHP和热处理,能够更高效降低过敏原与IgE结合能力,最高降幅可达86.37%,为多种方法联合处理坚果过敏蛋白提供有效思路。
3.2 化学法
因为添加试剂可能会存在残留,对食物风味及安全性造成潜在的影响,因此坚果脱敏研究中化学方法相关的研究及报道较少。Chung等[64]用单宁结合间接ELISA检测法对花生产品进行研究时发现,当单宁浓度为0.5、1和2 mg/mL时,与未经处理的花生酱相比IgE结合能力分别减少约55%、75%和100%,将不同最终浓度(0.25、0.5、1和2 mg/mL)的单宁添加到花生酱提取液(5 mg/mL,pH7.2)时,添加的单宁浓度越高,花生主要过敏原Ara h 1和Ara h 2含量就越少。当浓度为2 mg/mL时,提取液中几乎没有过敏原存在。但单宁属于食品添加剂,其使用计量受到严格规定,且单宁的加入会影响食物口感和色泽。张华[65]在对杏仁脱敏研究中通过添加石榴、蓝莓和康科德葡萄果汁使其与杏仁过敏蛋白形成多酚-杏仁复合物的方法,结果表明,果汁中的多酚可使杏仁蛋白过敏原形成粒径增大38倍的沉淀,以降低其与IgG和IgE的结合。虽然通过添加果汁引入多酚的方法可起到降低致敏性且改善口感的作用,但此方法多倾向于复配饮料类产品使用,应用范围小,局限较大。Tatiana等[66]分别用热处理和加入葡萄糖引发美拉德反应的两种方式对榛子进行处理,发现这两种方式均可对过敏原Cor a 1产生影响,Cor a 11即使没有糖也受热影响,而Cor a 9过敏原对这两种方法均有耐性。史云凤[67]在糖基化反应对花生过敏原Ara h 1影响的研究中发现,糖基化修饰后的蛋白可使对Ara h 1 过敏的小鼠产生严重过敏反应,说明美拉德反应也可增强Ara h 1蛋白的致敏性。可见糖基化反应只能对部分坚果过敏原产生消减作用,而对于某些过敏原可起到加强作用,因此,只能针对性使用。
3.3 生化法
3.3.1 酶解法
酶解法以其反应高效、温和、可控等优点广泛应用于过敏蛋白的修饰中,但在坚果脱敏中研究相对较少。石振鹏等[68]在对花生仁浆中致敏原研究时发现,当碱性蛋白酶:中性蛋白酶:木瓜蛋白酶:风味酶的体积比为2:2:1:1,酶用量4%,酶解温度60 ℃,pH 7.0,酶解时间4 h的条件下,花生仁浆中的致敏蛋白Ara h 1和Ara h 2的平均消减率高达92.91%。Meng等[69]利用木瓜蛋白酶、无花果酶、菠萝蛋白酶对花生水解处理后,发现其与IgE结合能力可降低85%~95%;Carmen等[70]通过酶解法处理腰果和开心果中过敏原物质时,发现高压灭菌和超声波下酶水解分别诱导处理的腰果和开心果制成的膏体与IgE结合特性也会显著降低。但酶的添加会在一定程度上提高生产成本,同时也存在缺乏专一性、不能够与底物充分接触而充分发挥其高效性,以及水解产物对食品产生苦味等负面影响[71]。
3.3.2 微生物发酵及基因工程
微生物发酵这种传统方法是将坚果中的过敏蛋白质分解为小分子的肽和氨基酸而降低坚果的致敏性的,同时可以为食品增加特殊风味。王金水等[72]通过枯草芽孢杆菌对花生蛋白粉进行液态发酵,发现高压灭菌处理和持续发酵能显著降低Ara h 1和Ara h 2的含量,且发酵16~32 h可产生诱人色泽及令人舒服的微酸味。Pi等[73]在利用纳豆芽孢杆菌对花生浆发酵研究时发现,发酵可使花生蛋白降解、构象发生变化并减少α螺旋结构,通过间接ELISA评估,表明该方法可将花生蛋白与IgE结合性降低超过77.3%。但目前,微生物发酵在坚果脱敏研究中应用较少,对发酵后产物特性如氨基酸含量、乳化性、稳定性还不够了解,对其研究还有待加强。基因工程通过对过敏原氨基酸序列编辑,一定程度上可以完全消除坚果食物中致敏原,但专业技术性强且存在安全性问题。目前,基因工程对坚果脱敏研究主要体现在花生过敏原中。易海涛等[74]将花生主要过敏原Ara h 2基因序列进行颠换合成,克隆导入Origami宿主表达菌中并诱导其表达,结果表明经基因工程改造后的Ara h 2蛋白仍可被花生过敏患者血清中的IgE抗体特异性识别,相比于突变之前,其免疫原应性已明显降低。Merima等[75]对花生主要过敏原Ara h 2和Ara h 6进行修饰改造,与天然过敏原相比,超过60%的血清鉴定显示突变过敏原结合IgE的能力可降低50%~94%,但一些过敏者的血清对修饰过敏原仍保持较高水平的IgE反应活性。Ramos等[76]对花生过敏原Ara h 2异构体Ara h 2.01上的五个不同位点进行突变,发现Ara h 2.01与IgE结合能力降低了56%~99%,不影响有效的免疫治疗必须保留的T细胞表位。但基因工程在坚果脱敏上的研究还未成熟,且处理后过敏原可能存在较高水平的IgE反应活性。
综上所述,每种脱敏方法都存在优缺点(图1),不同种类坚果所需脱敏技术也不尽相同,无法仅通过一种脱敏方法完整、高效、经济的去除坚果中过敏物质,因而有针对性的进行多种技术联合作用仍将是今后坚果脱敏研究的重点方向。
4. 结论与展望
本文首先对坚果中常见的过敏原的性质及危害进行了介绍,列举了目前国内外用于坚果过敏原检测的主要技术、特点及其应用,并进一步的对比分析了不同处理方式对坚果中过敏原脱敏效果以及优缺点。目前在全球范围内,过敏性疾病的发生率仍呈现不断上升的趋势,明确坚果中的过敏原并建立相关的检测技术对于预防食物过敏的发生至关重要。目前的食物过敏原检测技术的检出限均在食品标签管理规定之下,并且多种方式联合检测技术在达到高灵敏度的同时实现了高通量和高特异性检测,但昂贵的仪器成本以及对检测人员的高素质要求在一定程度上限制了其进一步的发展。
坚果中过敏原种类多样且性质稳定,简单的加工方式难以产生破坏作用,还可能因暴露内部隐藏的抗原而提高致敏物含量。单一的脱敏技术也易出现过敏物残留、改变食品风味、破化营养价值等缺点。在脱敏的相关研究中,针对不同过敏原性质而采用的多种技术联合脱敏表现出显著优势,在极大破坏致敏成分的同时又保留了食品中营养成分,而一些方法还起到了为食品添加特殊风味的作用。由于致敏成分的特殊性,针对性的研发多种方式联合处理的脱敏技术仍是未来科研发展方向的热点及难点。此外,还应加强对坚果脱敏新兴技术的研究,以便向消费者提供信息准确、安全的食物,提高过敏人群生活质量、打破贸易保护、促进进出口贸易及交流等。
-
表 1 坚果中的主要过敏原
Table 1 Major allergens in nuts
主要过敏原 分子量(kDa) 蛋白质家族 蛋白种类 花生 Ara h 1 64 Cupin 7S球蛋白 Ara h 2 17 醇溶谷蛋白 2S白蛋白 Ara h 3 60,
37Cupin 11S球蛋白 Ara h 6 15 醇溶谷蛋白 2S白蛋白 核桃 普通核桃 Jug r 1 15~16 醇溶谷蛋白 2S白蛋白 Jug r 2 44 Cupin 7S球蛋白 Jug r 4 58.1 Cupin 11S球蛋白 Jug r 5 20 PR-10 Bet v 1 Jug r 7 13 profilins Profilin 黑核桃 Jug n 1 醇溶谷蛋白 2S白蛋白 Jug n 2 Cupin 7S球蛋白 榛子 Cor a 1 17 PR-10 Bet v 1 Cor a 2 14 profilins 肌动蛋白结合蛋白 Cor a 8 9 醇溶谷蛋白 非特异性脂质转移蛋白 Cor a 9 40 Cupin 11S球蛋白 Cor a 11 48 Cupin 7S球蛋白 Cor a 14 10 醇溶谷蛋白 2S白蛋白 腰果 Ana o 1 50 Cupin 类7S球蛋白 Ana o 2 55 Cupin 类11S球蛋白 Ana o 3 14 醇溶谷蛋白 2S白蛋白 杏仁 Pru du 3 9 醇溶谷蛋白 非特异性脂质转移蛋白1型 Pru du 4 14 profilins 肌动蛋白结合蛋白 Pru du 5 10 PR-10 60S酸性核糖体蛋白P2 Pru du 6 360 Cupin 11S球蛋白 开心果 Pis v 1 7 醇溶谷蛋白 2S白蛋白 Pis v 2 32 Cupin 11S球蛋白亚基 Pis v 3 55 Cupin 7S球蛋白 Pis v 4 25.7 PR-9 锰超氧化物歧化酶 Pis v 5 36 Cupin 11S球蛋白亚基 巴西坚果 Ber e 1 9 醇溶谷蛋白 2S富含硫贮藏蛋白 Ber e 2 29 Cupin 11S球蛋白 板栗 Cas s 5 PR-3 几丁质酶 Cas s 8 12~13,
9醇溶谷蛋白 非特异性脂质转移蛋白1型 Cas s 9 17 热休克蛋白20 松籽 Pin p 1 6,
15醇溶谷蛋白 2S白蛋白 -
[1] 廖英. 坚果营养价值知多少[J]. 知识就是力量,2019(4):88−89. [LIAO Y. What is the nutritional value of nuts[J]. Knowledge is Power,2019(4):88−89. doi: 10.3969/j.issn.0529-150X.2019.04.030 [2] BÁRBARA R C, GRAZIELA B S D, BRUNA Z R, et al. Brazil nuts: Nutritional composition, health benefits and safety aspects[J]. Food Research International,2017,100(2):9−18.
[3] MARTA G, XIAORAN L, VASANTI S M, et al. Nut consumption and risk of cardiovascular disease[J]. Journal of the American College of Cardiology,2017,70(20):2519−2532. doi: 10.1016/j.jacc.2017.09.035
[4] MIDUN E, RADULOVIC S, BROUGH H, et al. Recent advances in the management of nut allergy[J]. World Allergy Organization Journal,2021,14(1):100491. doi: 10.1016/j.waojou.2020.100491
[5] 赵京. 中国儿童食物过敏现况[J]. 中华临床免疫和变态反应杂志,2019,13(4):271−275. [ZHAO J. Current situation of food allergy among children in China[J]. Chinese Journal of Allergy and Clinical Immunology,2019,13(4):271−275. [6] 李阳, 薛文通. 食物致敏蛋白研究进展[J]. 食品研究与开发,2013,34(1):113−116. [LI Y, XUE W T. Advances on allergic protein in food[J]. Food Research and Development,2013,34(1):113−116. [7] JENKINS J A, GRIFFITHS-JONES S, SHEWRY P R, et al. Structural relatedness of plant food allergens with specific reference to cross-reactive allergens: An in silico analysis[J]. The Journal of Allergy and Clinical Immunology,2005,115(1):163−70. doi: 10.1016/j.jaci.2004.10.026
[8] HEIMO B, CHRISTIAN R. A classification of plant food allergens[J]. The Journal of Allergy and Clinical Immunology,2004,113(5):821−830. doi: 10.1016/j.jaci.2004.01.779
[9] HSIN-YI Y, TONY J F, YI-TING L, et al. Rapidly detecting major peanut allergen-Ara h 2 in edible oils using a new immunomagnetic nanoparticle-based lateral flow assay[J]. Food Chemistry,2019,271:505−515. doi: 10.1016/j.foodchem.2018.07.064
[10] MAHR T A, LIEBERMAN J A, HASELKORN T, et al. Characteristics of peanut allergy diagnosis in a US healthcare claims database (2011-2017)[J]. The Journal of Allergy and Clinical Immunology: In Practice,2020,9(4):1683−1694.
[11] MENGYAO Z, PING W, JUN W, et al. Advanced DNA-based methods for the detection of peanut allergens in processed food[J]. Trends in Analytical Chemistry,2019,114:278−292. doi: 10.1016/j.trac.2019.01.021
[12] NOWAK-WEGRZYN A, HASS S L, DONELSON S M, et al. The peanut allergy burden study: Impact on the quality of life of patients and caregivers[J]. World Allergy Organization Journal,2021,14(2):100512. doi: 10.1016/j.waojou.2021.100512
[13] MALEKI S J, VIQUEZ O, JACKS T, et al. The major peanut allergen, Ara h 2, functions as a trypsin inhibitor, and roasting enhances this function[J]. Journal of Allergy and Clinical Immunology,2003,112(1):190−195. doi: 10.1067/mai.2003.1551
[14] HEMMINGS O, DUTOIT G, RADULOVIC S, et al. Ara h 2 is the dominant peanut allergen despite similarities with Ara h 6[J]. The Journal of Allergy and Clinical Immunology,2020,146(3):621−630. doi: 10.1016/j.jaci.2020.03.026
[15] PALLADINO C, BREITENEDER H. Peanut allergens[J]. Molecular Immunology,2018,100:58−70. doi: 10.1016/j.molimm.2018.04.005
[16] SCOTT H S, TERENCE J F, ANNE M, et al. A voluntary registry for peanut and tree nut allergy: Characteristics of the first 5149 registrants[J]. The Journal of Allergy and Clinical Immunology,2001,108(1):128−132. doi: 10.1067/mai.2001.115755
[17] LEE J, JEONG K, JEON S, et al. Component resolved diagnosis of walnut allergy in young children: Jug r 1 as a major walnut allergen[J]. Asian Pacific Journal of Allergy and Immunology,2019,39(3):190−196.
[18] LYONS S A, DATEMA M R, LE THUY M, et al. Walnut allergy across Europe: Distribution of allergen sensitization patterns and prediction of severity[J]. The Journal of Allergy and Clinical Immunology:In Practice,2020,9(1):225−235.
[19] COSTA J, CARRAPATOSD I, OLIVEIRA M, et al. Walnut allergens: Molecular characterization, detection and clinical relevance[J]. Clinical & Experimental Allergy,2014,44(3):319−341.
[20] CAMILLE S, RAPHAËL C, CLAUDE G, et al. Expression of Jug r 1, the 2S albumin allergen from walnut (Juglans regia), as a correctly folded and functional recombinant protein[J]. Peptides,2009,30(7):1213−1221. doi: 10.1016/j.peptides.2009.03.007
[21] BLANC F, BERNARD H, AH-LEUNG S, et al. Further studies on the biological activity of hazelnut allergens[J]. Clinical and Translational Allergy,2015,5(1):26. doi: 10.1186/s13601-015-0066-7
[22] MAREEN R D, LAURIAN Z, RICCARDO A, et al. Hazelnut allergy across Europe dissected molecularly: A EuroPrevall outpatient clinic survey[J]. The Journal of Allergy and Clinical Immunology,2015,136(2):1−10. doi: 10.1016/S0091-6749(15)00886-6
[23] 孙敏, 梁君妮, 徐彪, 等. 实时荧光PCR法检测食物中榛子过敏原成分[J]. 食品工业科技,2011,32(1):293−295. [SUN M, LIANG J N, XU B, et al. Detection of hazelnut allergens by real time PCR assay[J]. Science and Technology of Food Industry,2011,32(1):293−295. doi: 10.13386/j.issn1002-0306.2011.01.082 [24] VALCOUR A, LIDHOLM J, BORRES M P, et al. Sensitization profiles to hazelnut allergens across the United States[J]. Annals of Allergy, Asthma & Immunology,2019,122(1):111−116.
[25] INOUE Y, SATO S, TAKAHASHI K, et al. Component-resolved diagnostics can be useful for identifying hazelnut allergy in Japanese children[J]. Allergology International,2020,69(2):239−245. doi: 10.1016/j.alit.2019.10.001
[26] LAMBERTI C, NEBBIA S, ANTONIAZZI S, et al. Effect of hot air and infrared roasting on hazelnut allergenicity[J]. Food Chemistry,2021,342:128174. doi: 10.1016/j.foodchem.2020.128174
[27] KAATJE V V, MAXIME G, MARC D, et al. Selection of universal peptide biomarkers for the detection of the allergen hazelnut in food trough a comprehensive, high resolution mass spectrometric (HRMS) based approach[J]. Food Chemistry,2020,309:125679. doi: 10.1016/j.foodchem.2019.125679
[28] PFEIFER S, BUBLIN M, DUBIELA P, et al. Cor a 14, the allergenic 2S albumin from hazelnut, is highly thermostable and resistant to gastrointestinal digestion[J]. Molecular Nutrition & Food Research,2015,59(10):2077−2086.
[29] LUYT D K, VAUGHAN D, OYEWOLE E, et al. Ethnic differences in prevalence of cashew nut, pistachio nut and almond allergy[J]. Pediatric Allergy and Immunology,2016,27(6):651−654. doi: 10.1111/pai.12582
[30] CHITTA S, LIAN B X, RAO R, et al. Cashew nut allergy in Singaporean children[J]. Asia Pacific Allergy,2018,8(3):1−7.
[31] CÍNTIA M, JOANA C, ANTÓNIO A V, et al. Cashew nut allergy: Clinical relevance and allergen characterisation[J]. Clinical Reviews in Allergy & Immunology,2019,57(1):22.
[32] YAN X, WANG Y, CHEN Y, et al. Effect of roasting duration on the solubility, structure, and IgE-binding capacity of cashew nut proteins[J]. Innovative Food Science and Emerging Technologies,2021,68:102635. doi: 10.1016/j.ifset.2021.102635
[33] LEANNA N W, QIAN Z, MENGNA S, et al. Conformational epitope mapping of Pru du 6, a major allergen from almond nut[J]. Molecular Immunology,2013,55(3-4):253−263. doi: 10.1016/j.molimm.2013.02.004
[34] COSTA J, MAFRA I, CARRAPATOSO I, et al. Almond allergens: molecular characterization, detection, and clinical relevance[J]. Journal of Agricultural and Food Chemistry,2012,60(6):1337−1349. doi: 10.1021/jf2044923
[35] KABASSER S, HAFNER C, CHINTHRAJAH S, et al. Identification of Pru du 6 as a potential marker allergen for almond allergy[J]. Allergy,2020,76(5):1−10.
[36] JOANA C, ISABEL M, MB P P O. High resolution melting analysis as a new approach to detect almond DNA encoding for Pru du 5 allergen in foods[J]. Food Chemistry,2012,133(3):1062−1069. doi: 10.1016/j.foodchem.2012.01.077
[37] SATHE S K, WOLF J W, ROUX K H, et al. RouxSathe biochemical characterization of amandin, the major storage protein in almond (Prunus dulcis L.)[J]. Agricultural and Food Chemistry,2002,50(15):4333−4341. doi: 10.1021/jf020007v
[38] BEZERRA M, RIBEIRO M, IGREJAS G. An updated overview of almond allergens[J]. Nutrients,2021,13(8):2578. doi: 10.3390/nu13082578
[39] WEINBERGER T, SICHERER S. Current perspectives on tree nut allergy: A review[J]. Journal of Asthma and Allergy,2018,11:41−51. doi: 10.2147/JAA.S141636
[40] ÁFRICA S, ISABEL B, ANA M, et al. Detection of pistachio allergen coding sequences in food products: A comparison of two real time PCR approaches[J]. Food Control,2016,75:262−270.
[41] ÁFRICA S, ISABEL B, ADRIÁN L, et al. Chestnut allergen detection in complex food products: Development and validation of a real-time PCR method[J]. LWT,2020,123:109067. doi: 10.1016/j.lwt.2020.109067
[42] JEONG K, LEE S, AHN K, et al. A multicenter study on anaphylaxis caused by peanut, tree nuts, and seeds in children and adolescents[J]. Allergy,2017,72(3):507−510. doi: 10.1111/all.13096
[43] GARCÍA-MENAYA J M, GONZALO-GARIJO M A, MONEO I, et al. A 17-kDa allergen detected in pine nuts[J]. Allergy,2000,55(3):291−293. doi: 10.1034/j.1398-9995.2000.00291.x
[44] 张洁琼. 杏仁过敏原ELISA方法的建立及加工方式对致敏性的影响[D]. 天津: 天津科技大学, 2013 ZHANG J Q. Development of enzyme-linked immunoassay and effects of processing for almond allergen, amandin[D]. Tianjin: Tianjin University of Science and Technology, 2013.
[45] ZHAO Y Q, XIN S, CHRISTOPHER P M, et al. Development of a sensitive sandwich ELISA specific to 2S albumin (Ana o 3) as a stable protein marker for cashew nut residue detection in pre-packaged food products[J]. Food Control,2019,96:432−440. doi: 10.1016/j.foodcont.2018.09.038
[46] JOANA C, PARISA A, ISABEL M, et al. Development of a sandwich ELISA-type system for the detection and quantification of hazelnut in model chocolates[J]. Food Chemistry,2015,173:257−265. doi: 10.1016/j.foodchem.2014.10.024
[47] CHEN J J, XIA L X, WU X L, et al. A practical test system for sensitive, rapid screening and authentication of peanut allergens in imported and exported food products in Chinese customs[J]. Food Control,2012,23(1):154−158. doi: 10.1016/j.foodcont.2011.07.002
[48] 洪宇伟, 陈启, 张京顺, 等. 超高效液相色谱-电喷雾质谱法检测花生过敏原Ara h 2[J]. 食品安全质量检测学报,2015,6(5):1895−1902. [HONG Y W, CHEN Q, ZAHNG J S, et al. Identification and quantification of peanut allergen Ara h 2 using ultra-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality,2015,6(5):1895−1902. [49] GU S Q, CHEN N N, ZHANG YAO, et al. A rapid solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for simultaneous screening of multiple allergens in chocolates[J]. Food Control,2018,84:89−96. doi: 10.1016/j.foodcont.2017.07.033
[50] 宁晖, 房芳, 邵亮亮, 等. 食品过敏法规及其检测技术现状[J]. 食品安全质量检测学报,2020,11(12):3768−3772. [NING H, FANG F, SHAO L L, et al. Regulations and current detection technology of food allergen[J]. Journal of Food Safety & Quality,2020,11(12):3768−3772. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.12.012 [51] 王守法, 巢强国, 葛宇, 等. 多重PCR法检测食品中的榛子致敏原[J]. 食品工业,2011,32(4):95−97. [WANG S F, CHAO Q G, GE Y, et al. Using multiple PCR to detect hazelnut allergens in food[J]. The Food Industry,2011,32(4):95−97. [52] CHENG F, WU J, ZHANG J, et al. Development and inter-laboratory transfer of a decaplex polymerase chain reaction assay combined with capillary electrophoresis for the simultaneous detection of ten food allergens[J]. Food Chemistry,2016,199:799−808. doi: 10.1016/j.foodchem.2015.12.058
[53] SILVIA D L C, INÉS M L, MARCOS A, et al. TaqMan real-time PCR assay for detection of traces of Brazil nut (Bertholletia excelsa) in food products[J]. Food Control,2013,33(1):105−113. doi: 10.1016/j.foodcont.2013.01.053
[54] SHYANG-CHWEN S, PO-CHUAN T, YI-YANG L, et al. Development of loop-mediated isothermal amplification (LAMP) assays for the rapid detection of allergic peanut in processed food[J]. Food Chemistry,2018,257:67−74. doi: 10.1016/j.foodchem.2018.02.124
[55] 刘昊, 黄文胜, 邓婷婷, 等. LAMP法检测食品中开心果过敏原成分[J]. 食品科学,2013,34(22):128−132. [LIU H, HUANG W S, DENG T T, et al. Detection of pistachio allergen in foods by Loop-Mediated isothermal amplification method[J]. Food Science,2013,34(22):128−132. [56] 李坤, 连君, 朱瑾, 等. 还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响[J]. 食品科学,2017,38(11):89−94. [LI K, LIAN J, ZHU J, et al. Synergistic effect of cysteine reduction and thermal treatment on structure and antigenicity of peanut allergen Ara h 2 [J]. Food Science,2017,38(11):89−94. doi: 10.7506/spkx1002-6630-201711015 [57] 李颖超, 钱和, 孙秀兰, 等. 典型热加工对花生致敏蛋白及其免疫反应性的影响[J]. 食品工业科技,2015,36(5):95−98. [LI Y C, QIAN H, SUN X L, et al. Effect of thermal processing on the immunoreactive properties of allergenic proteins from peanut seeds[J]. Science and Technology of Food Industry,2015,36(5):95−98. doi: 10.13386/j.issn1002-0306.2015.05.011 [58] ZHANG T, SHI Y F, ZHAO Y Q, et al. Boiling and roasting treatment affecting the peanut allergenicity[J]. Annals of Translational Medicine,2018,6(18):357−357. doi: 10.21037/atm.2018.05.08
[59] JONGH H H J, JONG G A H, APOSTOLOVIC D, et al. Effect of heat treatment on the conformational stability of intact and cleaved forms of the peanut allergen Ara h 6 in relation to its IgE-binding potency[J]. Food Chemistry,2020,326:127027. doi: 10.1016/j.foodchem.2020.127027
[60] 罗春萍, 胡纯秋. (60)Co-γ辐照对花生过敏原Ara h 2蛋白构象及致敏活性的影响[J]. 核农学报,2019,33(7):1349−1355. [LUO C P, HU C Q. 60 Co-γ Effects of irradiation on conformation and sensitization activity of peanut allergen Ara h 2 protein[J]. Journal of Nuclear Agricultural Sciences,2019,33(7):1349−1355. doi: 10.11869/j.issn.100-8551.2019.07.1349 [61] KASERA R, SINGH A B, KUMAR R, et al. Effect of thermal processing and γ-irradiation on allergenicity of legume proteins[J]. Food and Chemical Toxicology,2012,50(10):3456−3461. doi: 10.1016/j.fct.2012.07.031
[62] 朱乾乾, 陈静静, 张涛, 等. 超高压处理对苦杏仁分离蛋白结构和致敏性的影响[J]. 食品与生物技术学报,2020,39(10):34−39. [ZHU Q Q, CHEN J J, ZHANG T, et al. Effect of ultra-high pressure on structure and immunoreactivity of bitter apricot kernel protein isolate[J]. Journal of Food Science and Biotechnology,2020,39(10):34−39. doi: 10.3969/j.issn.1673-1689.2020.10.005 [63] YANG XIN, SUN J, TAO J M, et al. The allergenic potential of walnuts treated with high pressure and heat in a mouse model of allergy[J]. Innovative Food Science and Emerging Technologies,2017,39:165−170. doi: 10.1016/j.ifset.2016.12.001
[64] CHUNG S Y, SHAWNDRIKA R. Removing peanut allergens by tannic acid[J]. Food Chemistry,2012,134(3):1468−1473. doi: 10.1016/j.foodchem.2012.03.057
[65] 张华. 杏仁主要过敏原鉴定及其脱敏方法研究[D]. 天津: 天津农学院, 2019 ZHANG H. Identification of major allergens in almonds and their desensitization methods[D]. Tianjin: Tianjin Agricultural University, 2019.
[66] TATIANA C, BRUNO D M, CHRIS B, et al. Impact of thermal processing and the Maillard reaction on the basophil activation of hazelnut allergic patients[J]. Food and Chemical Toxicology,2012,50(5):1722−1728. doi: 10.1016/j.fct.2012.02.069
[67] 史云凤. 糖基化反应对花生过敏原Ara h 1致敏性的影响及机理研究[D]. 上海: 上海大学, 2019 SHI Y F. Study on effect of advanced glycation on allergenicity of peanut allergen Ara h 1 and its mechanism involved[D]. Shanghai: Shanghai University, 2019.
[68] 石振鹏, 吴子健, 刘敏尧, 等. 酶法消减花生浆中两种主要过敏蛋白的研究[J]. 食品研究与开发,2018,39(21):44−48. [SHI Z P, WU Z J, LIU M R, et al. Enzymolysis conditions for alleviating tow important allergic proteins of peanut pulp[J]. Food Research and Development,2018,39(21):44−48. doi: 10.3969/j.issn.1005-6521.2018.21.008 [69] MENG S, TAN Y, CHANG S, et al. Peanut allergen reduction and functional property improvement by means of enzymatic hydrolysis and transglutaminase crosslinking[J]. Food Chemistry,2019,302:125186.
[70] CARMEN C, HSIAOPO C, AFRICA S, et al. Influence of enzymatic hydrolysis on the allergenic reactivity of processed cashew and pistachio[J]. Food Chemistry,2018,241:372−379. doi: 10.1016/j.foodchem.2017.08.120
[71] 毕井辉, 汪何雅, 钱和, 等. 酶解法脱除食品过敏原[J]. 食品工业科技,2011,32(8):432−436. [BI J H, WANG H Y, QIAN H, et al. Reducing food allergen by enzyme hydrolysis[J]. Science and Technology of Food Industry,2011,32(8):432−436. doi: 10.13386/j.issn1002-0306.2011.08.120 [72] 王金水, 周阳, 蔺丹华. 发酵对花生蛋白中致敏因子影响的研究[J]. 河南工业大学学报(自然科学版),2014,35(2):1−5. [WANG J S, ZHOU Y, LIN D H, et al. Effect of fermentation on sensitizing factors in peanut protein[J]. Journal of Henan University of Technology (Natural Science Edition),2014,35(2):1−5. doi: 10.16433/j.cnki.issn1673-2383.2014.02.005 [73] PI X, FU G, DONG B, et al. Effects of fermentation with Bacillus natto on the allergenicity of peanut[J]. LWT,2021,141(12):110862.
[74] 易海涛, 刘芳, 贾梦阳, 等. 经基因工程改造的花生主要过敏原Ara h 2制备及其低致敏原性鉴定[J]. 江西农业大学学报,2011,33(5):993−998. [YI H T, LIU F, JIA M Y, et al. Preparation and characterization of the genetically engineered hypoallergenic derivative of the major peanut allergen Ara h 2[J]. Acta Agriculturae Universitatis Jiangxiensis,2011,33(5):993−998. doi: 10.3969/j.issn.1000-2286.2011.05.030 [75] MERIMA B, MARIA K, CHRISTIAN R, et al. Engineering of structural variants of the major peanut allergens Ara h 2 and Ara h 6 for allergen-specific immunotherapy[J]. The Journal of Allergy and Clinical Immunology,2019,143(3):1226−1229. doi: 10.1016/j.jaci.2018.10.039
[76] RAMOS M L, HUNTLEY J J, MALEKI S J, et al. Identification and characterization of a hypoallergenic ortholog of Ara h 2.01[J]. Plant Molecular Biology,2009,69(3):325−35. doi: 10.1007/s11103-008-9428-z
-
期刊类型引用(2)
1. 西尔力·阿不都热哈曼,何晓露,庞润涛,刘河疆. 不同地区枸杞真菌毒素含量特征分析. 食品安全质量检测学报. 2024(17): 92-100 .  百度学术
百度学术
2. 黄康惠,卢鑫,周璇,王文富,杨福兴,朱桂芳,孙宇. 高效液相色谱串联质谱法测定食品中双丙酚丁等致泻药物. 食品科技. 2023(06): 301-307 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



