Activity Evaluation of Alcohol Extract of Ginseng-Clove in Inhibiting Lipid Synthesis of Mortierella alpina
-
摘要: 探究人参-丁香醇提物抑制脂质合成并对其机制进行初步研究。通过建立丰产脂肪酸的高山被孢霉(Mortierella alpina,MA)脂质筛选模型,利用2,3,5-氯化三苯基四氮唑(TTC)筛选出脂质合成抑制最优的人参丁香药对用药比例和提取溶媒,测定MA内甘油三酯含量、电镜观察其形态并进行脂肪酸气质(GC-MS)分析,通过RT-PCR法测定乙酰辅酶A羧化酶(ACC)、ATP-柠檬酸裂解酶(ACLY)、脂肪酸合酶(FAS)和苹果酸酶(ME)基因的mRNA表达并对相关酶活力进行检测,对3T3-L1前脂肪细胞采用MTT法测定其增殖活力同时采用油红O染色法测定细胞分化中脂质积累的能力并加以论证。结果显示,人参丁香药对抑制脂质合成的最优比例和提取溶媒是人参-丁香质量比为1:2的100%乙醇提取物(alcohol extract of genseng and clove,AEGC),AEGC在0~30 μg/mL浓度内对3T3-L1前脂肪细胞的增殖、分化无细胞毒性,能抑制脂肪细胞分化过程中甘油三酯的形成和积累;RT-PCR结果显示,较空白组AEGC干预后,MA内ACC、ACLY、FAS和ME的mRNA水平显著下调(P<0.05),且ME、葡萄糖-6-磷酸脱氢酶(G-6-P)、ACLY和FAS的酶活力受到显著抑制(P<0.05)。筛选所得的AEGC能抑制高山被孢霉和3T3-L1前脂肪细胞的脂质合成。Abstract: The inhibitory of lipid synthesis by the alcohol extract of ginseng-clove was explored and its mechanism was preliminarily studied. A lipid screening model of Mortierella alpina (MA) which is rich in fatty acids was established, and 2,3,5-triphenyltetrazolium chloride (TTC) was used to screen out the optimal proportion and extraction solvent of ginseng-clove for inhibiting lipid synthesis. Then the content of triglyceride in MA was measured, its morphology was observed by electron microscope, and fatty acid was analyzed by GC-MS. The mRNA expressions of acetyl-CoA carboxylase (ACC), ATP-citric acid lyase (ACLY), fatty acid synthase (FAS) and malic enzyme (ME) were determined by RT-PCR, and the activities of related enzymes were detected. 3T3-L1 preadipocytes were demonstrated by MTT to determine proliferation viability and oil red O staining to determine the ability of lipid accumulation in cell differentiation. The results showed that the optimal ratio and extraction medium for the inhibition of lipid synthesis was the 100% alcohol extract of ginseng and clove (AEGC) with a 1:2 mass ratio of ginseng and clove. The extract was not cytotoxic to the proliferation and differen-tiation of 3T3-L1 preadipocytes at concentrations ranging from 0~30 μg/mL, and inhibited the formation and accumulation of triglycerides during the differentiation of adipocytes. The RT-PCR showed that the mRNA levels of ACC, ACLY, FAS and ME in MA were significantly downregulated (P<0.05) and the enzymatic activities of ME, glucose-6-phosphate dehydrogenase (G-6-P), ACLY and FAS were significantly inhibited (P<0.05) compared with the blank group after AEGC intervention. The AEGC obtained from the screening inhibited lipid synthesis in MA and 3T3-L1.
-
Keywords:
- Mortierella alpina /
- adipose cells /
- lipid synthesis /
- ginseng /
- clove
-
肥胖是目前全球最主要的公共健康问题之一,主要是机体长期能量摄入超过能量消耗,使能量经各种脂肪酸合成相关酶的作用合成脂肪酸,并最终以甘油三酯的形式在白色脂肪或其他器官中过度堆积。临床上很多疾病都是因长期肥胖而衍生来的,由肥胖所引起的疾病可谓遍及全身各个系统,尤以糖尿病、高血压、高尿酸血症等疾病与肥胖关系更为密切,对人类健康构成巨大威胁[1-2]。
人参,五加科植物人参Panax ginseng C. A. Meyer的干燥根和根茎,具有大补元气、复脉固脱、补脾益肺之功,用于体虚欲脱、脾虚食少、久病虚赢之证[3],于2012年被批准为新资源食品。丁香,桃金娘科植物丁香Eugenia caryophullata Thunb.的干燥花蕾,具有温中降逆、补肾助阳之效,用于脾胃虚寒、呃逆止呕、食少吐泄之证[3-5],是2002年被批准的首批药食同源的中药材。中医学认为,肥胖之人往往脾肾阳虚、嗜食肥甘、喜静少动,主要病机为脾气两虚,在古代经方中就有许多人参丁香互相配伍用于补气健脾的记载,比例常为1:1、1:2和2:1,且常用方法为水煎煮和酒浸泡。研究发现人参、丁香单味用药在抗氧化、抗肿瘤、抗炎、以及治疗肥胖有较好的成效[6-12],而其配伍共同作用于治疗肥胖的研究鲜有报导。
高山被孢霉(Mortierella alpina,MA)是白色丝状真菌,一种重要的产油微生物,其油脂含量是其干重的50%以上[13-14],高山被孢霉的脂肪酸合成酶(FASN)由乙酰基转移酶、丙二酸单酰基转移酶、β-烯脂酰还原酶、β-羟脂酰脱水酶、β-酮脂酰还原酶、β-酮脂酰合酶和1个酰基载体蛋白组成,在相关酶和载体蛋白的作用下使得脂肪酸合成,这与哺乳动物类似[15-16],哺乳动物的FASN是一类多功能酶[17],是机体内脂质合成过程中的一个关键酶,能够催化细胞中长链脂肪酸的从头合成,通过抑制FASN活性抑制脂质从头合成,一定程度上维持机体能量的平衡,也因其所含FASN与哺乳动物具有的相似性而被评为一种脂质合成抑制剂筛选的平台[18];而奥利司他(Olistat),能够与FASN相关酶结合,阻止FASN催化的最后一步棕榈酸的释放,被美国食品和药物管理局(FDA)认证为减肥药物[19]。
本文借助高山被孢霉和3T3-L1脂肪细胞研究人参-丁香抑制脂质合成作用,并对其机制进行初步探索,为从药食同源食品中寻找以膳食补充剂达到食疗缓解肥胖提供一定的数据支撑。
1. 材料与方法
1.1 材料与仪器
高山被孢霉(ATCC32222) 购于中国微生物菌种保藏管理中心;3T3-L1前脂肪细胞(Procell CL-0006)、3T3-L1专用培养基、DMEM/F12培养基 购于武汉普诺赛生命科技有限公司;TTC(2,3,5-氯化三苯基四氮唑)、MTT(四甲基偶氮唑蓝)、麦芽汁琼脂培养基 购于北京索莱宝科技有限公司;BCA试剂盒 购于碧云天生物技术公司;青霉素-链霉素溶液(双抗)、胰酶(0.25%胰酶-EDTA(600 U/mL))、胎牛血清 购于美国Hyclone公司;引物 由吉林省库美生物科技有限公司合成;逆转录试剂盒 购于Takara。
Infinite M200 PR0全自动酶标仪 瑞士Tecan公司;CFX Connect PCR仪 美国Bio-rad公司;6700F型扫描电镜 日本电子;GCMS-TQ8040NX气相色谱-质谱联用仪、UV-2550型紫外可见光度计 日本岛津公司;Innova 40摇床 德国Eppendorf公司;SX-700蒸汽灭菌器 日本Tomy Digital Biology公司;T10 bcsic型分散器 德国IKA公司;Kendro CO2细胞培养箱 美国Thermo公司。
1.2 实验方法
1.2.1 原料处理
1.2.1.1 不同药材比例
将人参、丁香分别粉碎后按不同比例1:1、1:2、2:1混匀,每种比例4份,共12份待用。
1.2.1.2 不同提取溶剂
将上述混匀药材分别以1:10料液比进行水煎煮,并用100%乙醇、70%乙醇和50%乙醇分别进行回流提取,保持沸腾状态提取1.5 h后过滤,重复两次,合并两次滤液旋转蒸发至溶剂去除,得到12种固体提取物。
1.2.2 人参丁香提取物对高山被孢霉脂肪合成的抑制作用研究
1.2.2.1 菌株的培养及提取物的筛选
将高山被孢霉在麦芽汁琼脂固体培养基中培养后,取之于肯德里克肉汤(Kendrick Broth)培养液(20 g/L葡萄糖,5 g/L酵母提取物,1 g/L KH2PO4,0.25 g/L MgSO4·7H2O,10 g/L KNO3)中活化三代,将活化的MA按1%接种量转接至100 mL Broth培养液,28 ℃培养72 h,分散器打散,稀释至0.5光密度(OD)值后接种于96孔板中。每孔加入0.1% TTC和5 μg/mL上述不同提取物,并设置溶剂阴性的空白对照组与5 μg/mL奥利司他阳性对照组,将96孔板放置于28 ℃培养箱中,暗处培养72 h后于酶标仪在485 nm处测OD值[5,18]。
1.2.2.2 给药扩大培养及保存
将1.2.2.1中菌液以1%的接种量转接于新的Broth液体培养基用于扩大培养。实验组加入1.2.2.1筛选出的人参丁香比为1:2的100%乙醇提取物(alcohol extract of genseng and clove,AEGC),设置给药量为5 mg/L AEGC的给药组,空白对照组加入相同体积的DMSO溶剂和5 mg/L奥利司他阳性对照组,在28 ℃、200 r/min的摇床中培养5 d。用分散机打散菌体,吸取5 mL混匀的菌液过滤,洗涤3遍,收集菌体于离心管中,冷冻干燥后获得干重。过滤出剩余菌体,洗涤3遍,取约1/3菌体−80 ℃保存,用于酶活分析,剩余约2/3菌体经冷冻干燥得到干菌−80 ℃保存,用于单试剂GPO-PAP法测定甘油三酯含量、BCA法测定蛋白含量,以及总脂肪酸含量测定、脂肪酸组分分析和RNA提取、反转录及RT-qPCR。
1.2.2.3 电镜观察
取上述1.2.2.2中扩大培养的高山被孢霉挑取少量菌丝转接至L-多聚赖氨酸包被细胞爬片,并用戊二醛固定吹干后做为扫描电镜的样品,离子溅射仪喷金制片,在扫描电镜下以3000 V电压、7.6~7.7 mm工作距离下,使用500~2000倍放大倍数观察拍照[20]。
1.2.2.4 酶活分析
取1.2.2.2中适量菌体于研钵,倒入液氮研磨并不断添加液氮研磨,重复多次,加入适量含有20%甘油的酶提取缓冲液(100 mmol/L KH2PO4/KOH,pH7.5,1 mmol/L苯甲脒盐酸,1 mmol/L DTT),5 min,10000 r/min,4 ℃离心两次,取上清液即得到酶提取液,用BCA法测定破碎上清液中的蛋白浓度,并测定苹果酸酶(Malic enzyme,ME)、葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G-6-P)和ATP柠檬酸裂解酶(ATP citrate lyase,ACLY)活力[21-23],严格按照ELISA试剂盒测定脂肪酸合成酶(Fatty acid synthase,FAS)活力。
1.2.2.5 脂肪酸分析
将1.2.2.2中冻干后的菌体置于研钵中进行研磨粉碎,称取50 mg菌粉置于已加入2 mL 4 mol/L盐酸的冻存管中,对菌体进行破壁处理,随后置于80 ℃水浴1 h后迅速转至−80 ℃中冷冻15 min,如此重复三次后,萃取得无色液体至氮气吹干得粗脂,再经盐酸-甲醇甲酯化后萃取得到得脂肪酸甲酯经GC-MS检测[5,18],与37种混合脂肪酸标品比较进行分析。
1.2.2.6 RT-qPCR
用Trizol从上述1.2.2.2的MA中分离出总RNA,利用逆转录试剂盒将RNA反向转录到cDNA。引物序列见表1。采用CFX连接实时系统(Bio-Rad,美国)进行RT-qPCR,采用以下实验条件:阶段1(1次循环)95 ℃ 30 s,阶段2(40次循环)95 ℃ 5 s;54 ℃ 15 s;72 ℃ 30 s;扩增完毕后,以18sRNA为内参照基因,与对照组相比,得到目的基因表达的CT值,采用2−△△CT法进行相对基因表达量分析。
表 1 引物序列Table 1. Primer sequence基因 序列 18S rDNA 上游 CTATTGGCGGAGGTCTATTCGT 下游 GCACGCATTCGGATAATTGGT ACC 上游 GATCATTGAGGAGGCTCCCG 下游 CAGAGACGTATCCGACCAGC ACLY 上游 GTGCGTATTTTCGTCCGTCG 下游 GTGTTGTTGCCCAAGAGCTG FAS 上游 GATCCGAGGGTGACGCTAAG 下游 CATCATCGCGTTCTGCTTGG ME 上游 TCGTCGACGCTGTTATCGAG 下游 TGGGTTGGTACTTGTCGAGC 1.2.3 人参丁香提取物对3T3-L1前脂肪细胞作用研究
1.2.3.1 增殖抑制作用测定
采用MTT法来测定AEGC对细胞的毒性作用,将胰酶消化培养液重悬的3T3-L1前脂肪细胞以5×103个/孔接种于96孔板,100 μL专用培养基每孔,平行6个孔,于37 ℃、5% CO2培养箱中静置培养24 h,倒掉培养液,更换为100 μL加有不同浓度AEGC和奥利司他阳性对照的专用培养基继续培养48 h后,参照细胞存活率(%)=[(实验组OD−不含细胞的等量培养基OD)/(空白组OD−不含细胞的等量培养基OD)]×100常规方法[24-26],于每孔中加MTT溶液20 μL,孵育4 h后,吸去培养液和MTT,加入DMSO后,于490 nm处测吸光密度(OD)值。
1.2.3.2 给药干预诱导分化
将脂肪细胞以5×103个/孔接种于96孔板,专用培养基培养待细胞接触抑制,将其放置在含10% FBS的Dulbecco's Modified Eagle Medium(DMEM)高糖培养基中培养2 d,换于含10% FBS、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1 μmol/L地塞米松和10 μg/mL胰岛素的DMED高糖培养基中培养2 d,换于含10%胎牛血清和10 μg/mL胰岛素的DMEM培养2 d,随后以10% FBS培养基中继续培养,每2 d更换一次培养液。将加入地塞米松等诱导剂算作分化第1 d,从第1 d起,实验组分别给予含不同浓度的AEGC和奥利司他,全程干预细胞分化过程,之后对其抑制作用进行测定。
1.2.3.3 细胞分化抑制作用测定
取上述1.2.3.2中第8 d分化的细胞每孔加MTT溶液20 μL,孵育4 h后,吸去培养液和MTT,加入DMSO于酶标仪在490 nm处测吸光密度(OD)值,检测AEGC对细胞分化过程中细胞的毒性。细胞分化的第8 d严格按照试剂盒方法[25-27]每孔加入油红,进行油红O染色拍照和异丙醇洗脱油红半定量检测脂质生成率(%)=[(实验组OD−空白组OD)/(对照组OD−空白组OD)]×100。
1.3 数据处理
所有数据均用“
ˉx±s ”表示,统计学分析应用GraphPad Prism6和SPSS17.0软件完成,数据分析采用单因素方差分析(ANOVA)方法作差异分析,显著性检验标准为P<0.05。2. 结果与分析
2.1 人参丁香提取物对高山被孢霉脂肪合成的抑制作用
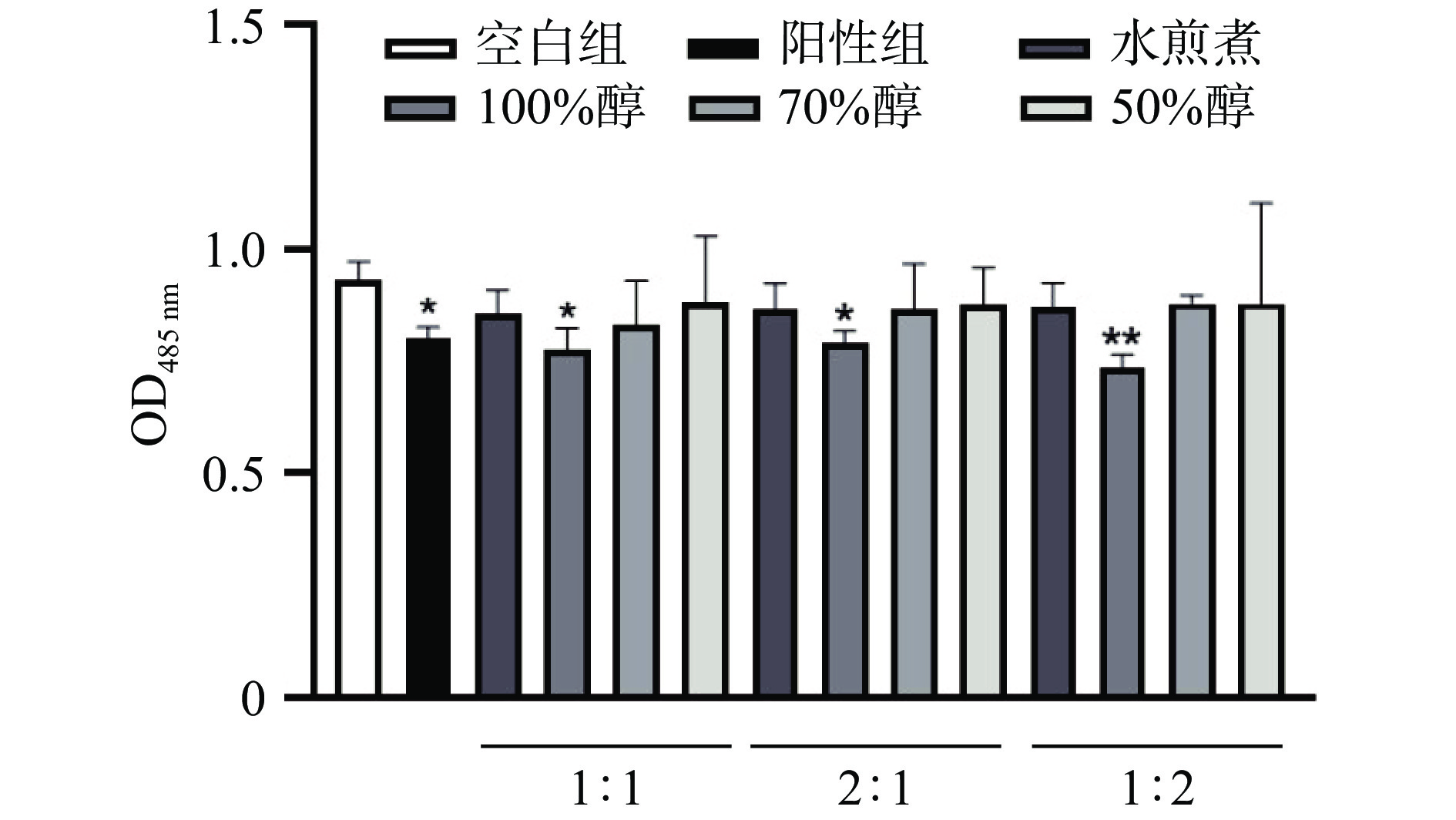
使用脂溶性光敏感复合物TTC试剂[28-29]筛选抑制高山被孢霉脂肪合成的结果如图1所示,人参-丁香比为1:1、1:2、2:1的100%乙醇提取物在72 h干预后的OD值和空白组有显著差异(P<0.05),其中,1:2的人参丁香100%乙醇提取物(AEGC)差异最大(P<0.01)显著优于阳性结果(P<0.05),说明此提取物在所有提取物中最大的抑制了MA的脂质合成,结合表2所示的提取率,1:2人参丁香的100%乙醇提取物提取率在同层次中最高,且抑制脂质合成能力最强,故使用AEGC进行后续实验探索抑制脂质合成机制。
表 2 人参丁香不同比例和不同溶媒的提取率Table 2. Extraction rate of different proportions of ginseng cloves and different solvents人参丁香质量比 1:1 1:2 2:1 水 16% 18.6% 16.7% 100%乙醇 9% 9.2% 7.9% 70%乙醇 12% 10.9% 9.8% 50%乙醇 14% 10.7% 10.1% 2.2 AEGC作用高山被孢霉后电镜下形态变化
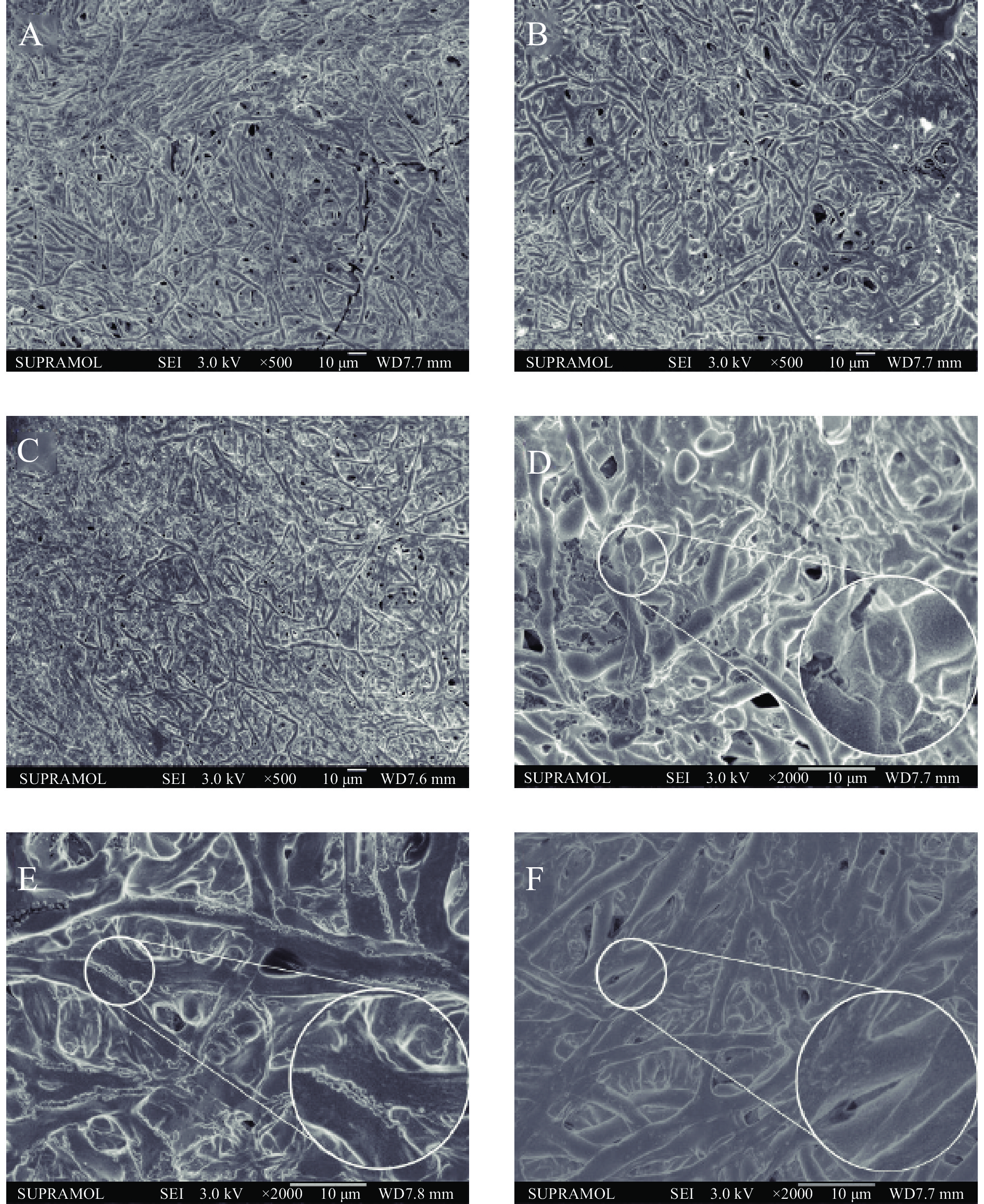
高山被孢霉形态如图2所示,在放大500倍镜下总体形态无明显差异,而在放大2000倍镜下,阳性组和给药组菌丝的粗细度更均匀,内含油脂的藕节状菌丝较空白组几乎不可见。通过对高山被孢霉的给药扩大培养,提取物AEGC可能会减少MA的脂质积累。
2.3 AEGC作用高山被孢霉后甘油三酯和蛋白含量
MA中所含的甘油三酯含量和蛋白含量如图3所示,给药组和阳性组的甘油三酯含量极显著小于空白组甘油三酯含量(P<0.01),而MA所含的蛋白质含量无显著差异(P>0.05),由此推测,提取物AEGC能不减少蛋白含量而抑制甘油三酯的积累以免对高山被孢霉产生损伤。
2.4 AEGC作用高山被孢霉后酶活分析
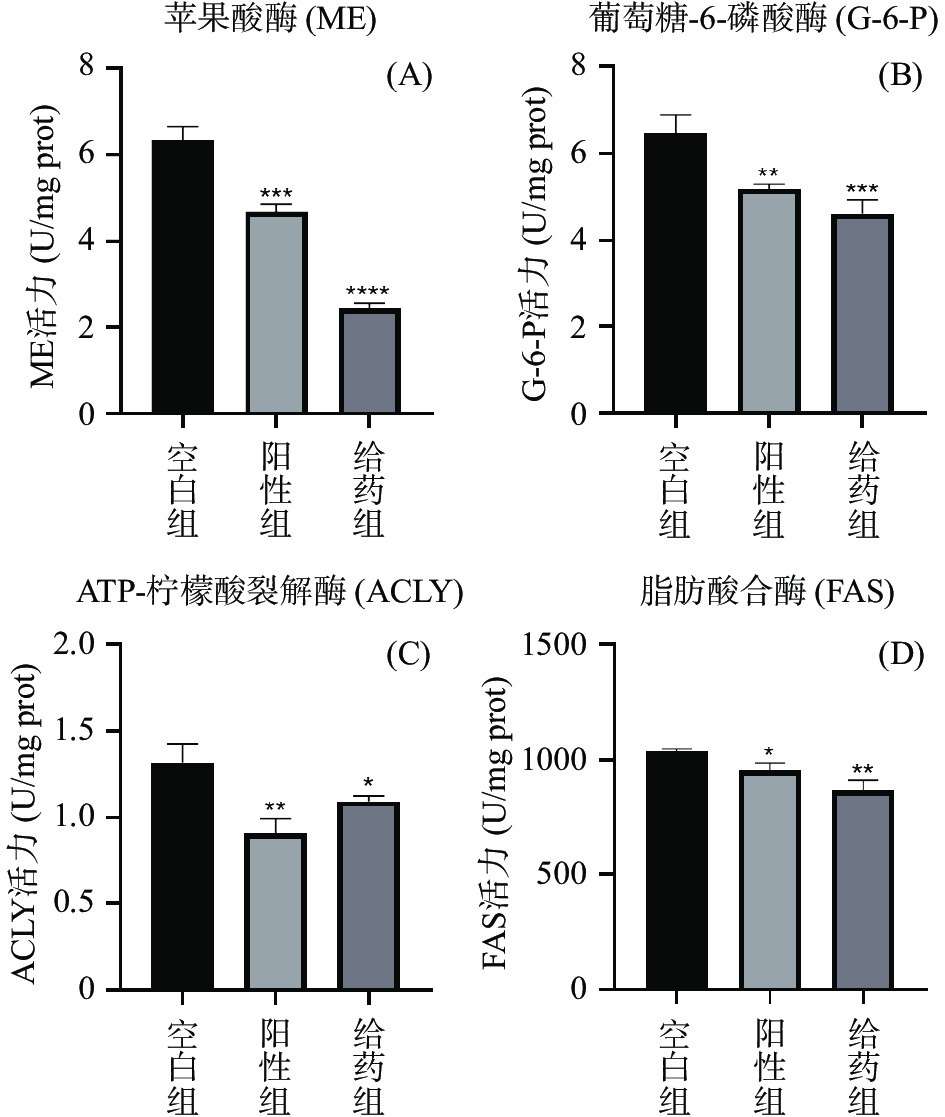
高山被孢霉中苹果酸酶(ME)、ATP-柠檬酸裂解酶(ACLY)、葡萄糖-6-磷酸脱氢酶(G-6-P)和脂肪酸合酶(FAS)酶活力如图4所示,给药组和阳性组的酶活力较空白组显著降低(P<0.05),因丙二酸单酰辅酶A与乙酰辅酶A在FAS的催化下合成脂肪酸;ACLY在丙酮酸进入线粒体合成柠檬酸再进入细胞质产生乙酰CoA过程中发挥着十分重要的作用;G-6-P和ME共同提供脂肪酸合成所需的NADPH,ME产生的NADPH很多将用于脂肪酸的合成[30-32],故推测AEGC能通过抑制ME、ACLY、G-6-P和FAS的酶活力,从而抑制高山被孢霉脂质的合成与积累。
2.5 AEGC干预扩大培养高山被孢霉脂肪酸含量分析
扩大培养高山被孢霉的脂肪酸含量气质分析如表3所示,共检出25种不同的脂肪酸,发现实验组中高山被孢霉C14:0、C16:0、C18:0和C20:0脂肪酸以及多种脂肪酸含量显著减少(P<0.05),同时总脂肪酸的含量也明显减少,与奥利司他阳性结果趋势一致,以此推测AEGC可能是潜在的脂质合成抑制剂。
表 3 高山被孢霉脂肪酸含量GC-MS分析(mg/g)Table 3. GC-MS analysis of fatty acid content of Mortierella alpina (mg/g)种类 空白 阳性 AEGC C8:0(辛酸甲酯) 0.014±0.000 0.015±0.000 0.010±0.000* C10:0(葵酸甲酯) 0.007±0.000 0.008±0.000* 0.004±0.000* C12:0(十二碳酸甲酯) 0.031±0.001 0.020±0.000* 0.018±0.000* C13:0(十三碳酸甲酯) 1.544±0.045 1.226±0.019* 1.200±0.031* C14:0(十四碳酸甲酯) 1.071±0.023 0.839±0.007* 0.846±0.019* C14:1n5(顺-9-十四碳一烯酸甲酯) 0.038±0.002 0.027±0.002* 0.025±0.001* C15:0(十五碳酸甲酯) 1.124±0.039 0.945±0.008* 0.810±0.022* C16:0(十六碳酸甲酯) 3.603±0.076 3.213±0.017* 3.233±0.063* C16:1n7(顺-9-十六碳一烯酸甲酯) 0.948±0.119 0.565±0.033* 0.637±0.027* C17:0(十七碳酸甲酯) 1.162±0.037 0.873±0.012* 0.802±0.016* C17:1n7(顺-10-十七碳一烯酸甲酯) 2.364±0.057 1.648±0.017* 1.620±0.043* C18:0(十八碳酸甲酯) 2.176±0.042 1.849±0.011* 1.937±0.048* C18:1n9c(反-9-十八碳一烯酸甲酯) 0.903±0.035 0.745±0.014* 0.435±0.350 C18:2n6c(顺,顺-9,12-十八碳二烯酸甲酯) 0.930±0.048 0.887±0.011 0.711±0.045* C18:2n6t(反,反-9,12-十八碳二烯酸甲酯) 13.931±0.298 12.415±0.307* 11.107±0.485* C18:3n6(顺,顺,顺-6,9,12-十八碳三烯酸甲酯) 11.682±0.244 9.860±0.121* 9.288±0.214* C20:0(二十碳酸甲酯) 0.321±0.007 0.254±0.003* 0.247±0.006* C20:2(顺,顺-11,14-二十碳二烯酸甲酯) 0.110±0.016 0.099±0.006 0.063±0.002* C20:3n6(顺,顺,顺-8,11,14-二十碳三烯酸甲酯) 6.612±0.456 5.427±0.211* 5.133±0.182* C20:4n6(顺-5,8,,11,14-二十碳四烯酸甲酯) 23.876±0.484 22.953±0.220* 19.944±0.444* C20:5n3(顺-5,8,11,14,17-二十碳五烯酸甲酯) 23.102±0.578 22.482±0.195 19.377±0.405* C21:0(二十一碳酸甲酯) 0.086±0.001 0.058±0.000* 0.054±0.002* C22:0(二十二碳酸甲酯) 0.690±0.007 0.594±0.009* 0.529±0.014* C23:0(二十三碳酸甲酯) 0.206±0.002 0.144±0.001* 0.117±0.002* C24:0(二十四碳酸甲酯) 2.006±0.021 1.961±0.017* 1.537±0.024* TFA(总脂肪酸) 98.536±2.481 89.104±0.452* 79.683±2.115* 注:与空白组相比,*P<0.05表示有显著性差异。 2.6 AEGC作用高山被孢霉后相关基因PCR分析
为了进一步研究AEGC对脂质合成的机制,选择了ACC、ACLY、ME和FAS作用于脂质合成机制中重要的因子,结果如图5所示,给药组和阳性药组的这些基因表达量均显著减少(P<0.05),因ACC和FAS是脂质生成的必需和限速底物,ACLY亦是脂质合成重要酶之一,且ME为脂肪酸的合成提供了NADPH[30-32],故推测AEGC对高山被孢霉脂质合成的抑制作用可能是通过下调相关mRNA的表达以影响高山被孢霉从头合成脂肪生成。
2.7 细胞增殖
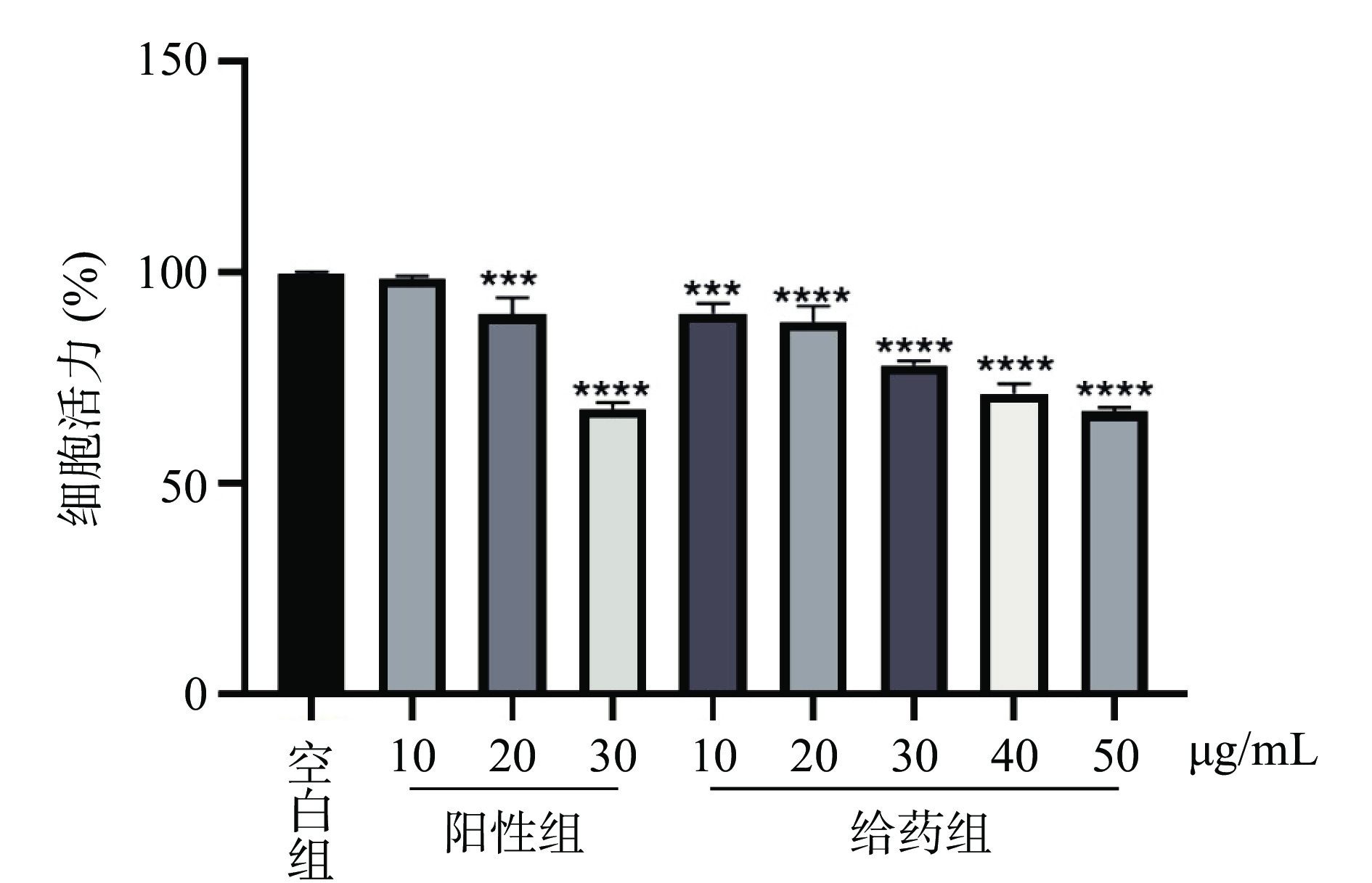
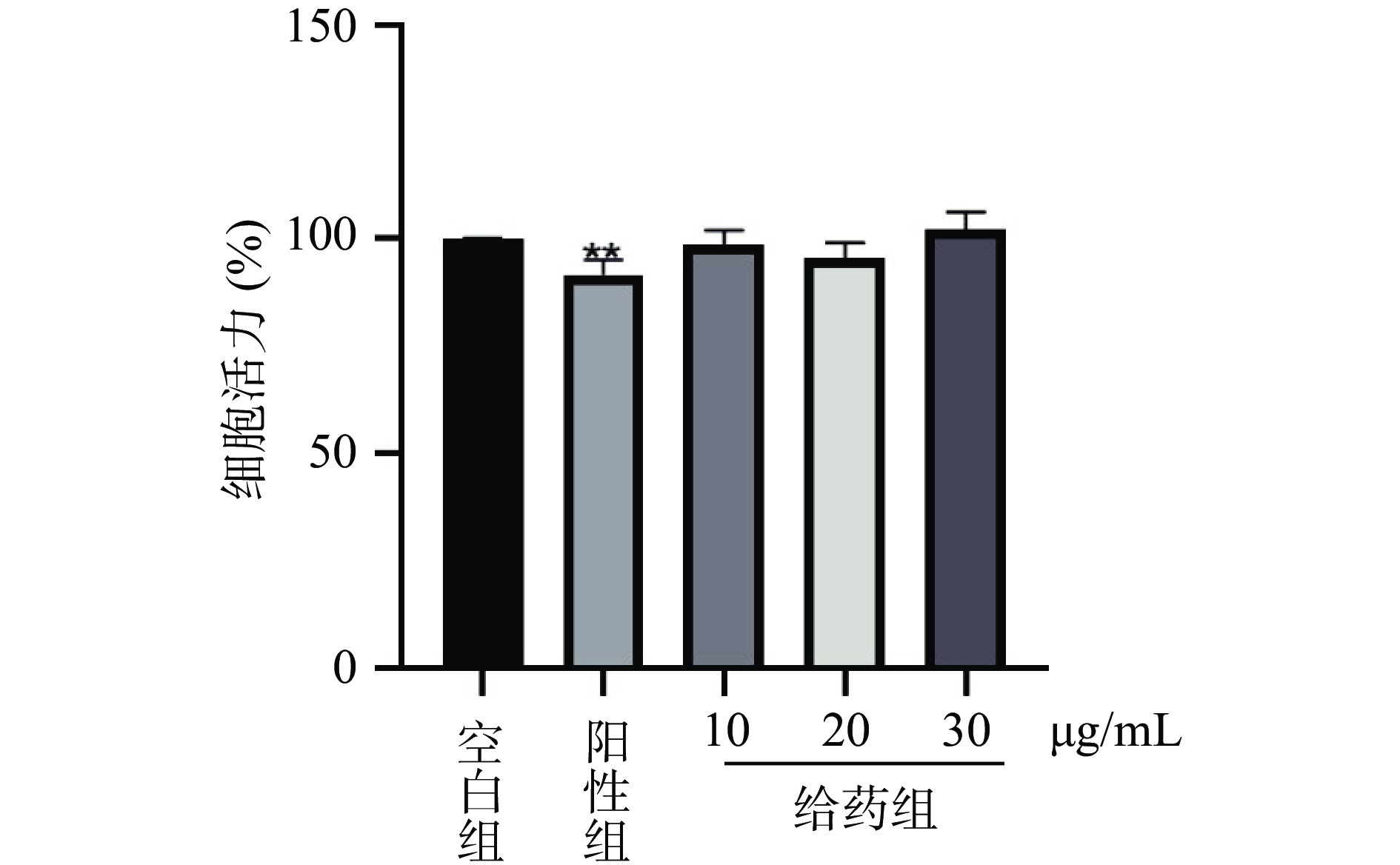
MTT法检测AEGC对3T3-L1脂肪细胞增殖抑制作用结果如图6所示,在加入不同浓度(10、20、30、40和50 μg/mL)的AEGC培养48 h后,和空白对照组相比,AEGC给药组以及浓度为20、30 μg/mL的阳性组脂肪细胞活力显著下降(P<0.05),均表现出对脂肪细胞增殖有较强的抑制作用,并且随着药物浓度的升高对细胞增殖的抑制作用越强。
2.8 细胞分化
MTT法检测3T3-L1脂肪细胞分化后细胞的活力结果如图7所示,在给药干预诱导后,和空白对照组相比较,给药干预脂肪细胞的分化并不会对脂肪细胞产生明显的细胞毒性。
2.9 3T3-L1脂肪细胞油红染色及半定量分析
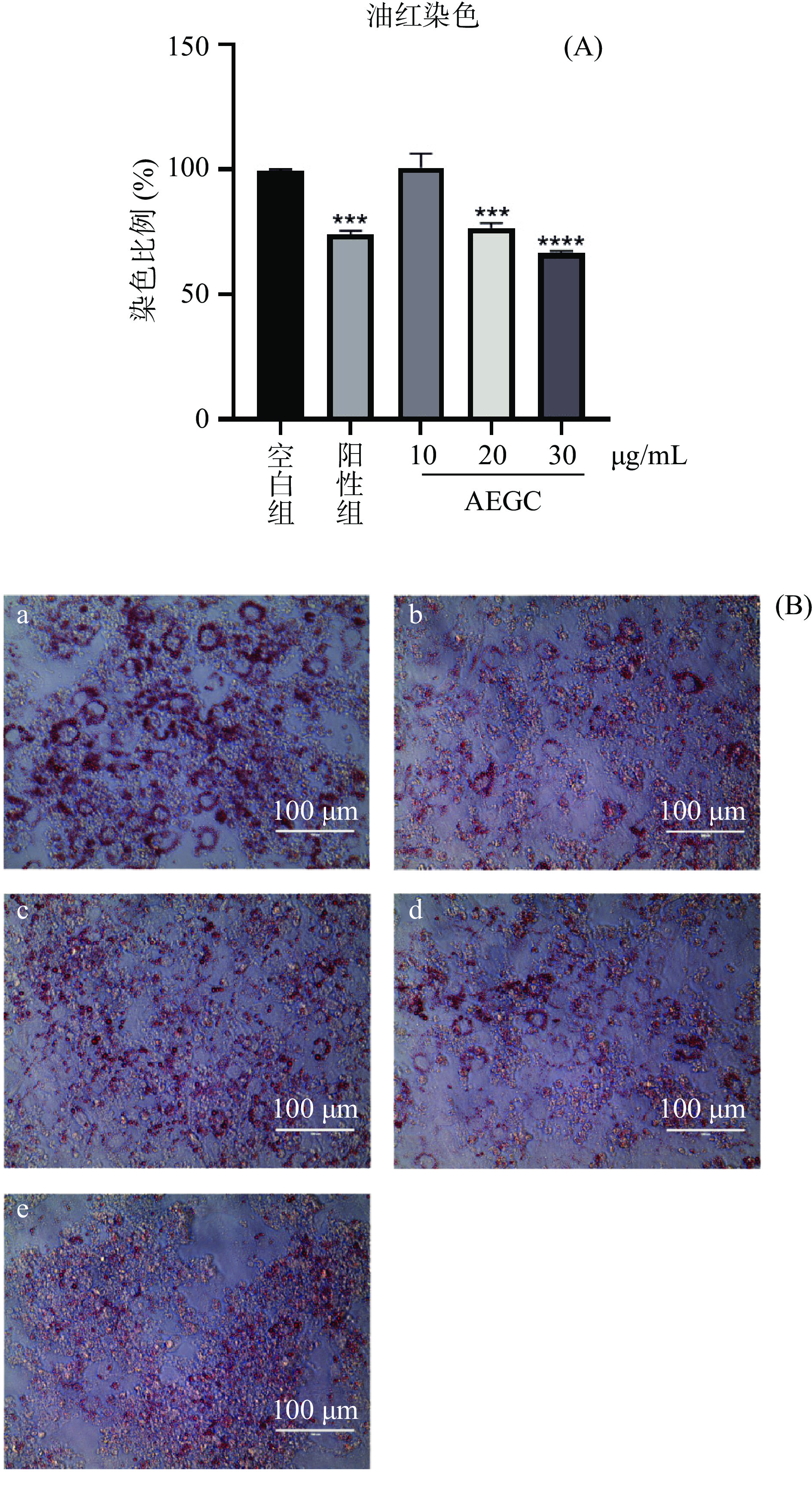
油红O染色法半定量分析诱导后3T3-L1脂肪细胞胞内的脂质含量,结果如图8所示,较空白对照组,给药组(20、30 μg/mL)和阳性药组被油红染色的红色戒环明显减少,通过异丙醇洗脱,给药组和阳性药组脂肪细胞的脂质含量显著减少(P<0.05),表明AEGC能抑制3T3-L1分化为脂肪细胞的脂质合成和积累。
3. 结论
本次研究在微生物方面,利用TTC初步筛选出用于抑制脂质合成的人参丁香比为1:2的100%乙醇提取物,在给药干预后通过扫面电镜观察和脂肪酸气质分析,发现霉内脂质减少,也发现脂质合成途径中ACC、FAS、ME等重要因子其酶活被抑制及其mRNA表达量减少,AEGC表现出较好的抑制高山被孢霉脂质合成能力;在细胞水平,通过经典鸡尾酒诱导方式,在AEGC干预诱导3T3-L1前脂肪细胞分化的脂肪细胞在经油红O染色半定量分析,发现其对3T3-L1前脂肪细胞分化过程中脂质的积累起到了一定程度的抑制作用。综上AEGC能够抑制高山被孢霉的脂质合成和3T3-L1细胞分化的成脂积累,本结果评估了AEGC对高山被孢霉脂质代谢的影响和细胞层面的初步探究,对治疗肥胖症提供了一个新的可选方案。
-
表 1 引物序列
Table 1 Primer sequence
基因 序列 18S rDNA 上游 CTATTGGCGGAGGTCTATTCGT 下游 GCACGCATTCGGATAATTGGT ACC 上游 GATCATTGAGGAGGCTCCCG 下游 CAGAGACGTATCCGACCAGC ACLY 上游 GTGCGTATTTTCGTCCGTCG 下游 GTGTTGTTGCCCAAGAGCTG FAS 上游 GATCCGAGGGTGACGCTAAG 下游 CATCATCGCGTTCTGCTTGG ME 上游 TCGTCGACGCTGTTATCGAG 下游 TGGGTTGGTACTTGTCGAGC 表 2 人参丁香不同比例和不同溶媒的提取率
Table 2 Extraction rate of different proportions of ginseng cloves and different solvents
人参丁香质量比 1:1 1:2 2:1 水 16% 18.6% 16.7% 100%乙醇 9% 9.2% 7.9% 70%乙醇 12% 10.9% 9.8% 50%乙醇 14% 10.7% 10.1% 表 3 高山被孢霉脂肪酸含量GC-MS分析(mg/g)
Table 3 GC-MS analysis of fatty acid content of Mortierella alpina (mg/g)
种类 空白 阳性 AEGC C8:0(辛酸甲酯) 0.014±0.000 0.015±0.000 0.010±0.000* C10:0(葵酸甲酯) 0.007±0.000 0.008±0.000* 0.004±0.000* C12:0(十二碳酸甲酯) 0.031±0.001 0.020±0.000* 0.018±0.000* C13:0(十三碳酸甲酯) 1.544±0.045 1.226±0.019* 1.200±0.031* C14:0(十四碳酸甲酯) 1.071±0.023 0.839±0.007* 0.846±0.019* C14:1n5(顺-9-十四碳一烯酸甲酯) 0.038±0.002 0.027±0.002* 0.025±0.001* C15:0(十五碳酸甲酯) 1.124±0.039 0.945±0.008* 0.810±0.022* C16:0(十六碳酸甲酯) 3.603±0.076 3.213±0.017* 3.233±0.063* C16:1n7(顺-9-十六碳一烯酸甲酯) 0.948±0.119 0.565±0.033* 0.637±0.027* C17:0(十七碳酸甲酯) 1.162±0.037 0.873±0.012* 0.802±0.016* C17:1n7(顺-10-十七碳一烯酸甲酯) 2.364±0.057 1.648±0.017* 1.620±0.043* C18:0(十八碳酸甲酯) 2.176±0.042 1.849±0.011* 1.937±0.048* C18:1n9c(反-9-十八碳一烯酸甲酯) 0.903±0.035 0.745±0.014* 0.435±0.350 C18:2n6c(顺,顺-9,12-十八碳二烯酸甲酯) 0.930±0.048 0.887±0.011 0.711±0.045* C18:2n6t(反,反-9,12-十八碳二烯酸甲酯) 13.931±0.298 12.415±0.307* 11.107±0.485* C18:3n6(顺,顺,顺-6,9,12-十八碳三烯酸甲酯) 11.682±0.244 9.860±0.121* 9.288±0.214* C20:0(二十碳酸甲酯) 0.321±0.007 0.254±0.003* 0.247±0.006* C20:2(顺,顺-11,14-二十碳二烯酸甲酯) 0.110±0.016 0.099±0.006 0.063±0.002* C20:3n6(顺,顺,顺-8,11,14-二十碳三烯酸甲酯) 6.612±0.456 5.427±0.211* 5.133±0.182* C20:4n6(顺-5,8,,11,14-二十碳四烯酸甲酯) 23.876±0.484 22.953±0.220* 19.944±0.444* C20:5n3(顺-5,8,11,14,17-二十碳五烯酸甲酯) 23.102±0.578 22.482±0.195 19.377±0.405* C21:0(二十一碳酸甲酯) 0.086±0.001 0.058±0.000* 0.054±0.002* C22:0(二十二碳酸甲酯) 0.690±0.007 0.594±0.009* 0.529±0.014* C23:0(二十三碳酸甲酯) 0.206±0.002 0.144±0.001* 0.117±0.002* C24:0(二十四碳酸甲酯) 2.006±0.021 1.961±0.017* 1.537±0.024* TFA(总脂肪酸) 98.536±2.481 89.104±0.452* 79.683±2.115* 注:与空白组相比,*P<0.05表示有显著性差异。 -
[1] JUNG U N, CHOI M S. Obesity and its metabolic complications: The role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease[J]. IJMS,2014,15(4):6184−223. doi: 10.3390/ijms15046184
[2] WALI J A, SOLON-BIET S M, FREIRE T, et al. Macronutrient determinants of obesity, insulin resistance and metabolic health[J]. Biology,2021,10(4):336. doi: 10.3390/biology10040336
[3] 国家药典编委会. 中华人民共和国药典[M]. 一部. 北京: 中国医药科技出版社, 2020: 4, 8. National Pharmacopoeia Editorial Board. Pharmacopoeia of the people's Republic of China[M]. Volume One. Beijing: China Medical Science and Technology Press, 2020: 4, 8.
[4] ZHOU J, ZHANG J, LI J Y, et al. Ginsenoside F2 suppresses adipogenesis in 3T3-L1 cells and obesity in mice via the AMPK pathway[J]. Journal of Agricultural and Food Chemistry,2021,69(32):9299−9312. doi: 10.1021/acs.jafc.1c03420
[5] DING Y R, GU Z N, WANG Y H, et al. Clove extract functions as a natural fatty acid synthesis inhibitor and prevents obesity in a mouse model[J]. Food & Amp Function,2017,8(8):2847−2856.
[6] ZHAO C, QU Q, YANG F, et al. Monascus ruber fermented Panax ginseng ameliorates lipid metabolism disorders and modulate gut microbiota in rats fed a high-fat diet[J]. Journal of Ethnopharmacology,2021,278:114300. doi: 10.1016/j.jep.2021.114300
[7] ZHOU S S, AUYEUNG K K, YIP K M, et al. Stronger anti-obesity effect of white ginseng over red ginseng and the potential mechanisms involving chemically structural/compositional specificity to gut microbiota.[J]. Phytomedicine,2020,74:152761. doi: 10.1016/j.phymed.2018.11.021
[8] LEE K, JIN H, CHEI S, et al. The gintonin-enriched fraction of ginseng regulates lipid metabolism and browning via the cAMP-protein kinase a signaling pathway in mice white adipocytes[J]. Biomolecules,2020,10(7):1048. doi: 10.3390/biom10071048
[9] LADURNER A, ZEHL M, GRIENKE U, et al. Allspice and clove as source of triterpene acids activating the G protein-coupled bile acid receptor TGR5[J]. Frontiers in Pharmacology,2017,8:468. doi: 10.3389/fphar.2017.00468
[10] OH I, BAEK E J, LEE D H, et al. Anti-obesity and anti-inflammatory effects of ginseng vinegar in high-fat diet fed mice[J]. Food Science and Biotechnology,2019,28(6):1829−1836. doi: 10.1007/s10068-019-00624-6
[11] LI Z, JI G E. Ginseng and obesity[J]. Journal of Ginseng Research,2018,42(1):1−8. doi: 10.1016/j.jgr.2016.12.005
[12] CHEN G, LI H, ZHAO Y, et al. Saponins from stems and leaves of Panax ginseng prevent obesity via regulating thermogenesis, lipogenesis and lipolysis in high-fat diet-induced obese C57BL/6 mice[J]. Food and Chemical Toxicology,2017,106(Pt A):393−403.
[13] JANG H D, LIN Y Y, YANG S S. Effect of culture media and conditions on polyunsaturated fatty acids production by Mortierella alpina[J]. Bioresource Technology,2004,96(15):1633−1644.
[14] STREEKSTRA H. On the safety of Mortierella alpina for the production of food ingredients, such as arachidonic acid[J]. Journal of Biotechnology,1997,56(3):153−165. doi: 10.1016/S0168-1656(97)00109-0
[15] MAIER T, JENNI S, BAN N. Architecture of mammalian fatty acid synthase at 4.5 A resolution[J]. Science (New York, N. Y.),2006,311(5765):1258−1262. doi: 10.1126/science.1123248
[16] MAIER T, LEIBUNDGUT M, BAN N. The crystal structure of a mammalian fatty acid synthase[J]. Science,2008,321(5894):1315−1322. doi: 10.1126/science.1161269
[17] BARRETT E J, SCHWARTZ R G, FRANCIS C K, et al. Regulation by insulin of myocardial glucose and fatty acid metabolism in the conscious dog[J]. The Journal of Clinical Investigation,1984,74(3):1073−1079. doi: 10.1172/JCI111474
[18] AZAM M S, GU Z, CHEN H, et al. Using Mortierella alpina as a novel platform for lipid synthesis inhibitor screening[J]. Advances in Bioscience and Bioengineering,2015,3(1):1−10. doi: 10.11648/j.abb.20150301.11
[19] KRIDEL S J, AXELROD F, ROZENKRANTZ N, et al. Orlistat is a novel inhibitor of fatty acid synthase with antitumor activity[J]. Cancer Res,2004,64(6):2070−2075. doi: 10.1158/0008-5472.CAN-03-3645
[20] ANDES D, NETT J, OSCHEL P, et al. Development and characterization of anin vivo central venous catheter Candida albicans biofilm model[J]. Infection and Immunity,2004,72(10):6023−6031. doi: 10.1128/IAI.72.10.6023-6031.2004
[21] HSU R Y, LARDY H A. Malic enzyme[J]. Methods in Enzymology,1969,13:230−235.
[22] LANGDON R G. Glucose 6-phosphate dehydrogenase from erythrocytes[J]. Methods in Enzymology, 1966, 9: 126-131.
[23] SRERE P A. The citrate cleavage enzymeⅠ. Distribution and purification[J]. The Journal of Biological Chemistry,1959,234:2544−2547. doi: 10.1016/S0021-9258(18)69735-2
[24] 胡盼盼. 沙棘叶多糖的提取优化及对CT-26细胞增殖的影响[J]. 食品工业科技,2021,42(24):159−164. [HU P P. Optimization of extraction of polysaccharide from Hippophae rhamnoides leaves and its proapoptotic effect on CT-26 Cells[J]. Science and Technology of Food Industry,2021,42(24):159−164. doi: 10.13386/j.issn1002-0306.2021040022 [25] LÜ X, QIU J, HAO T, et al. HDAC inhibitor trichostatin A suppresses adipogenesis in 3T3-L1 preadipocytes.[J]. Aging,2021,13(13):17489−17498. doi: 10.18632/aging.203238
[26] CHE L, REN B, JIA Y, et al. Feprazone displays antiadipogenesis and antiobesity capacities in in vitro T3-L1 cells and in vivo mice[J]. ACS Omega,2021,6(10):6674−6680. doi: 10.1021/acsomega.0c05470
[27] 郭莉霞, 孔淑贞, 殷钟意, 等. 新橙皮苷对3T3-L1前脂肪细胞分化的影响及其作用机制[J]. 食品工业科技,2021,42(12):125−132. [GUO L X, KONG S Z, YIN Z Y, et al. Effects of neohesperidin on the differentiation of adipocyte and the underlying mechanism in 3T3-L1 preadipocytes[J]. Science and Technology of Food Industry,2021,42(12):125−132. doi: 10.13386/j.issn1002-0306.20201001641 [28] PALTA J P, LEVITT J, STADELMANN E Q. Plant viability assay[J]. Cryobiology,1978,15(2):249−255. doi: 10.1016/0011-2240(78)90035-4
[29] MUSSER D A, OSEROFF A R. The use of tetrazolium salts to determine sites of damage to the mitochondrial electron transport chain in intact cells following in vitro photodynamic therapy with photofrin II[J]. Photochemistry and Photobiology,1994,59(6):621−626. doi: 10.1111/j.1751-1097.1994.tb09666.x
[30] RATLEDGE C, WYNN J P. The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J]. Advances in Applied Microbiology,2002,51:1−51.
[31] SUN T J, HAYAKAWA K, BATEMAN K S, et al. Identification of the citrate-binding site of human ATP-citrate lyase using X-ray crystallography[J]. Journal of Biological Chemistry,2010,285(35):27418−27428. doi: 10.1074/jbc.M109.078667
[32] LUISA S, LAURA G, MARIANGELA T, et al. In steatotic cells, ATP-citrate lyase mRNA is efficiently translated through a cap-independent mechanism, contributing to the stimulation of de novo lipogenesis[J]. International Journal of Molecular Sciences,2020,21(4):1206. doi: 10.3390/ijms21041206





 下载:
下载:



 下载:
下载:



