Exploring the Beneficial Effects of Guangxi Longevity Dietary Patterns on Human Body Based on Metabolomics
-
摘要: 为了深入探究饮食与机体健康状态的关系,本研究试图从代谢组学的角度,评估所构建的广西长寿饮食模式对人体的有益影响。筛选志愿者在经过2周习惯性饮食后,高依从性地遵循这种饮食模式2周,在习惯性饮食前,广西长寿饮食前(习惯性饮食后)和广西长寿饮食后3次分别采集志愿者的血液和粪便样品,进行代谢组学分析。归纳所得结果发现,广西长寿饮食干预后志愿者血清组氨酸、甘油、α-葡萄糖和β-葡萄糖相对丰度显著增加(P<0.05),胆碱和乳酸的相对丰度显著降低(P<0.05)。此外还发现,粪便中的乙酸盐和丁酸盐含量显著上升(P<0.05)。代谢物组富集分析和途径分析结果表明,这些代谢物的变化可能与糖酵解/糖异生途径、丙酮酸代谢和半乳糖代谢3条途径密切相关。通过对差异代谢物的分析,认为广西长寿饮食模式对改善机体炎症水平、调节机体健康状态、预防机体罹患心血管疾病具有一定的作用。上述结果也从代谢组学角度对饮食促进机体健康长寿的关系提供了一定机制方面的阐释。
-
关键词:
- 饮食模式 /
- 益生效果 /
- 代谢组学 /
- 核磁共振氢谱(1H NMR) /
- 气相色谱-质谱法(GC-MS) /
- 短链脂肪酸(SCFAs)
Abstract: To explore the relationship between diet and human health, this study aimed to evaluate the beneficial effects of the existing Guangxi longevity dietary pattern on the human body from metabolomics. After 2 weeks of habitual diet, the selected volunteers followed this dietary pattern with high adherence for the same period. The blood and fecal samples were collected 3 times then performed metabolomics analysis, including before the habitual diet, the beginning (which was also the ending point of habitual diet) and the end of Guangxi longevity dietary pattern. The results showed that after the Guangxi longevity dietary intervention of volunteers, the relative abundance of serum histidine, glycerol, α-glucose and β-glucose was significantly increased (P<0.05), but the relative richness of choline and lactic acid reduced obviously (P<0.05). In addition, the fecal acetate and butyrate increased apparently (P<0.05). Moreover, the analysis of metabolome enrichment and pathway revealed that these metabolites' variations might be closely related to three pathways, including glycolysis/gluconeogenesis pathway, pyruvate metabolism, and galactose metabolism. Through the analysis of differential metabolites, it was considered that Guangxi longevity dietary pattern played a promoted role in improving the level of inflammation, regulating the health status and preventing the organism from developing cardiovascular diseases. The above results also provide a mechanical explanation of the relationship between dietary patterns and healthy longevity from human metabolism. -
作为系统生物学的下游,代谢组学能够准确捕捉机体状态的变化,识别可能的信号或生物标志物,已成为了解机体健康机制的重要手段。Ke等[1]通过血清代谢组学鉴定出了中国高度近视老年人的血清生物标志物,并研究了与高度近视相关的代谢改变;Floegel等[2]使用靶向代谢组学鉴定了与2型糖尿病风险相关的血清代谢标志物。核磁共振氢谱(Nuclear magnetic resonance hydrogen spectroscopy,1H NMR)因具有对样品的非侵入性、非破坏性且重现性高等特点,在代谢组学研究中被广泛使用[3]。Rawat等[4]通过1H NMR血清代谢分析揭示了罹患糖尿病及糖尿病相关并发症患者的生物标志物;Zhang等[3]通过1H NMR代谢组学揭示了无症状性高尿酸血症(HUA)和痛风患者的代谢特征,并确定了从HUA到痛风的潜在病理。报道显示更多的研究着重于将代谢组学技术应用于某些具体病例中代谢标志物的判定,而用代谢组学技术来揭示饮食干预对机体健康状况的改善及代谢物特征变化的研究相对较少。
饮食是影响人体健康的重要因素[5]。通过整体的饮食模式而非单一食物或营养素干预被认为是改善机体健康状态更有效的方法[6],美国心脏协会对健康饮食的定义也侧重于整体的饮食模式[7]。健康的饮食模式可以有效延长寿命,增强机体免疫力,减缓与年龄相关的慢性疾病的发生[8-9]。然而,饮食如何影响健康长寿是极其复杂的。过去的研究侧重于从饮食干预对机体生理生化指标,或者某种针对性病症的改善状况来判定饮食对机体的调节作用[10-11]。从代谢组学的角度来判断饮食干预对机体相关代谢的生物标志物和代谢途径,从而剖析饮食对机体的营养治疗影响的研究并不常见。此外,短链脂肪酸(short chain fatty acids,SCFAs)在调节宿主健康状态,改善机体罹患心血管疾病风险因素中发挥着重要作用[12]。SCFAs作为微生物发酵的产物,其主要产生在肠道。故本研究使用气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)靶向检测了粪便中SCFAs的变化,以更好地分析所构建饮食模式对机体代谢的影响。
基于团队前期成果,本研究试图从人体试验的角度,分析所构建的广西长寿饮食模式对机体代谢物的影响,探究饮食引起的血清代谢组学与粪便SCFAs的变化,进一步分析二者共同影响的潜在通路和对机体健康状态的有益作用,评估广西长寿饮食模式作为改善机体健康状况、降低心血管疾病风险的饮食的适宜性,也为进一步阐明用饮食促健康的生理生化机制提供理论参考。
1. 材料与方法
1.1 材料与仪器
氘代重水(纯度≥99.9%)、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸标准品(色谱纯) 上海阿拉丁生化科技股份有限公司;乙酸乙酯 分析纯,天津市大茂化学试剂厂;磷酸氢二钾、磷酸二氢钠、偏磷酸、氯化钠 分析纯,天津市科密欧化学试剂有限公司;实验所需新鲜食材 当地农贸市场购买。
Bruker Avance 500 MHz核磁共振光谱仪 德国Bruker光谱仪器公司;7890B气质联用色谱仪 美国安捷伦公司;Pico17低温冷冻离心机 美国Thermo公司。
1.2 实验方法
1.2.1 广西长寿饮食模式食谱的凝炼
通过团队前期对广西长寿地区高寿人群队列的饮食及代谢物特征、肠道菌群等方面研究后,得知长寿地区老人饮食以粥类、粗杂粮类、深色蔬菜类食物为主,具有高膳食纤维、高VA、低能量、低脂肪、低蛋白、低胆固醇的特征[13]。据此,本团队用D-半乳糖致衰小鼠、自然衰老小鼠等对长寿老人饮食中的特征营养素进行探究,主要强调了膳食纤维和能量的摄入量,同时结合一定的维生素、微量元素等优化设计,发现在10%能量限制,且包含较高水平膳食纤维摄入的组别中所构建的饮食模式降低炎症,抵抗衰老的效果最好[14-15]。
本研究所设计的广西长寿饮食模式主要基于团队前期调研所得的百岁老人饮食特征以及动物实验结果,结合《中国居民膳食指南2016版》和《中国老年人膳食指南2010》中各营养素推荐量,在能量、脂肪、蛋白质、碳水化合物和膳食纤维上对广西长寿饮食模式进行了设计和优化。其中,能量摄入以膳食指南推荐量为基础,结合团队前期的动物实验结果(10%能量限制)计算得出[14]。膳食纤维摄入量根据小鼠实验中的最佳剂量,结合对百岁老人的饮食调查结果计算得出[13-15]。脂肪、蛋白质、碳水化合物的摄入量均基于百岁老人饮食特点[13],结合膳食指南推荐量优化设计而得,符合膳食指南推荐范围。以年龄60~70岁,BMI = 21.25(18.5~24.0 的中位数)的轻体力活动男性志愿者为例,设计其平均每日所需营养素摄入量如下:能量(1710±38)kcal/day、蛋白质15%、脂肪25%、碳水化合物60%、膳食纤维摄入量为(32.91±0.73)g/day。该模式实施过程中,首先根据对志愿者进行调查和测量得到的性别、体重、每日劳动强度等信息,对志愿者的营养素摄入量进行针对性的设计。菜单是根据所设计的营养素摄入量,结合广西长寿地区高寿人群队列饮食的偏好及广西长寿地区的特色食物设定的。饮食中包括当地种植的季节性水果、蔬菜和谷物,而肉类摄入较少。志愿者的饮食在符合要求的特定地点准备和供应,所有食物都经过精确计量。
1.2.2 研究设计
本研究是一项为期4周的单臂研究,参与者作为自己的对照。于2020年10月8日至2020年12月1日通过传单、电子邮件和个人交流等方式招募志愿者。志愿者纳入标准为:年龄50~75岁;身体状态稳定;未长期服用且实验前一个月未服用影响免疫系统的药物及抗生素;试验前两周未补充益生元、益生菌或维生素;对本研究涉及的试验不出现过敏现象。在筛选过程中,参与者被告知试验中涉及的内容和潜在风险,并签署书面知情同意书。研究方案已获得广西大学伦理委员会批准(No. GXU-2020-136)。
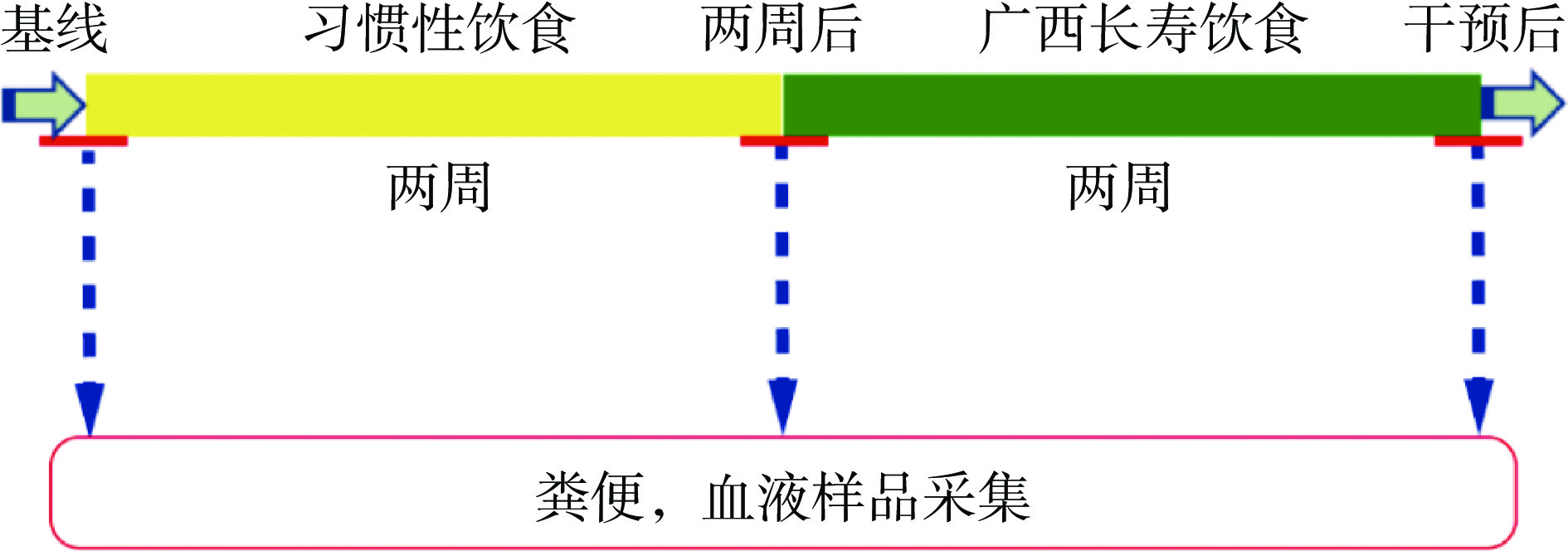
为排除其他因素的影响,在试验过程中,志愿者被要求先进行两周稳定的习惯性饮食,然后接受为期2周的高依从性广西长寿饮食干预,并在基线(Day 1:习惯性饮食开始前)、第2周结束(Day 15:习惯性饮食结束/广西长寿饮食开始)和第4周结束(Day 29:饮食干预结束后)采集志愿者的粪便样品和禁食一夜后的血液样品(图1)。在习惯性饮食阶段,志愿者可自由进食,但被要求保持稳定的饮食;在广西长寿饮食干预期间,志愿者需食用课题组提供的食物,包括早餐、中餐、晚餐、水果和坚果。且要求其除自由饮水外,不再食用其他食物。此外,所有志愿者都被要求在参与试验期间保持稳定的身体活动量。
1.2.3 血清样本的制备
用静脉穿刺抽取法采集志愿者的空腹血液样品,在室温(25 ℃)下静置30 min,然后在4 ℃、3000 r/min下离心15 min以分离血清,并将分离好的血清样品储存在−80 °C冰柜。在核磁共振试验前,将血清样本在室温(25 ℃)下解冻后,准确吸取200 μL血清样品至2 mL无菌离心管中,加入400 μL含重水的磷酸盐缓冲溶液(100% D2O,0.9% NaCl,50 mmol/L磷酸盐,pH7.4),混匀后于4 ℃、12000 ×g下离心10 min,取550 μL上清液转移到5 mm NMR管中进行1H NMR光谱分析。
1.2.4 血清1H NMR的测定及代谢标志物分析
所有血清样品在298 K下用核磁共振光谱仪进行分析,工作的1H共振频率为500.13 MHz。使用标准Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列[RD-90º-(t-180º-t)n-ACQ]采集一维光谱,同时采用预饱和法抑制水峰。采集参数为:扫描次数NS=64,采样点数TD=65536,谱宽SWH=10000 Hz,驰豫延迟RD=2 s。使用MestReNova 14.0软件(Mestrelab Research,Spain)对1H核磁共振波谱进行相位和基线校正。以α-葡萄糖左锋的化学位移5.233 ppm定标,同时对化学位移区间δ0.00~9.00 ppm的区域以δ0.004 ppm进行分段积分,排除水共振区δ4.70~5.10 ppm以消除水信号的影响,最后将积分数据归一化处理。
使用SIMCA-P 13.0 (Umetrics, Sweden) 软件进行多变量统计分析。用无监督的主成分分析(principal components analysis,PCA)评价志愿者血清代谢物的内在聚类。为了最大限度地实现两组之间代谢物的分离,使用了正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)。使用置换检验(permutation tests,重复次数n=200次)来验证模型的有效性。根据变量投影重要度(variable importance for projection,VIP)>1初步筛选出差异代谢物,再进一步采用配对t检验或者配对Wilcoxon非参数检验,选择VIP>1且P<0.05的代谢物作为具有显著性差异的代谢标志物。
1.2.5 粪便样品的制备及其短链脂肪酸的测定
在测定SCFAs之前,参照祁波等[16]的方法,稍作修改。将乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸标准品用乙酸乙酯配制为梯度混合溶液,进行GC-MS分析,计算并绘制各SCFAs的标准曲线。志愿者需根据培训要求规范收集新鲜的粪便样本。粪便立即放进冰盒并尽快转存在−80 ℃冰柜等待分析。取0.2 g粪便样品加入2 mL超纯水中,涡旋2 min,然后以 10000×g离心15 min。取1 mL上清液加入250 μL的25%偏磷酸溶液酸化,混匀后加入2 mL乙酸乙酯萃取,于4 ℃,12000×g离心5 min,取上层有机相用0.22 μm微孔膜过滤并转移至样品瓶中,用于GC-MS分析。
GC-MS分析采用DB-WAX(30 m×0.25 mm×0.25 μm)毛细管柱,柱温:初温110 ℃保持1 min,以10 ℃/min升至160 ℃,再以4 ℃/min升至240 ℃,保持1 min,进样口温度:240 ℃;载气流速:3 mL/min;分流比:18:1;离子源温度:230 ℃,传输线温度:250 ℃。质谱:EI源轰击电压:70 eV,单离子扫描模式:定量离子60、73。
1.2.6 代谢途径分析
在MetaboAnalyst 5.0平台上,利用代谢组学途径分析(MetPA)软件结合京都基因与基因组百科全书(KEGG;http://www.genome.jp/kegg/)构建和富集分析代谢途径,以可视化代谢物网络,并确认饮食干预对机体代谢物影响所涉及的靶向代谢通路。
1.3 样本量计算
因未曾有用本饮食模式做过类似的人体研究,故本研究参考Brons等[17]的方式,使用R语言进行“事后功率”计算。已有研究证明血液乳酸水平可作为代谢健康状态的重要标志物,故选取乳酸作为主要的预后指标[18]。根据本研究的结果,设置显著性水平为0.05,平均差差值为1.53,标准偏差差值为1.07,本研究计算出12名受试者即可满足90%的统计功效。因此,本研究中14名志愿者能够满足试验需要。
1.4 数据处理
采用SPSS 25.0软件进行试验数据统计分析,数据分析结果表示为
ˉx±s 。对于志愿者代谢物的差异变化,正态分布的数据采用配对样本t检验,非正态分布的数据采用配对的Wilcoxon非参数检验,显著性水平为P<0.05。使用Heatmapper进行代谢标志物聚类分析,志愿者代谢标志物特征曲线分析(receiver operating characteristic curve,ROC)使用R语言进行,以评估所筛选代谢物的性能和准确性。使用GraphPad Prism 8.0软件对数据进行绘图。2. 结果与分析
2.1 受试者基础特征
经过初步筛查,14名受试者符合纳入标准且完成了实验。受试者基础特征指标如表1所示。
表 1 基线时志愿者临床和人口统计学特征Table 1. Clinical and demographic characteristics of volunteers at baseline基线特征 参数 年龄(岁) 62.93±9.36 性别(男/女) 7/7 BMI(kg/m2) 25.42±3.75 2.2 广西长寿饮食模式对志愿者血清代谢物的影响
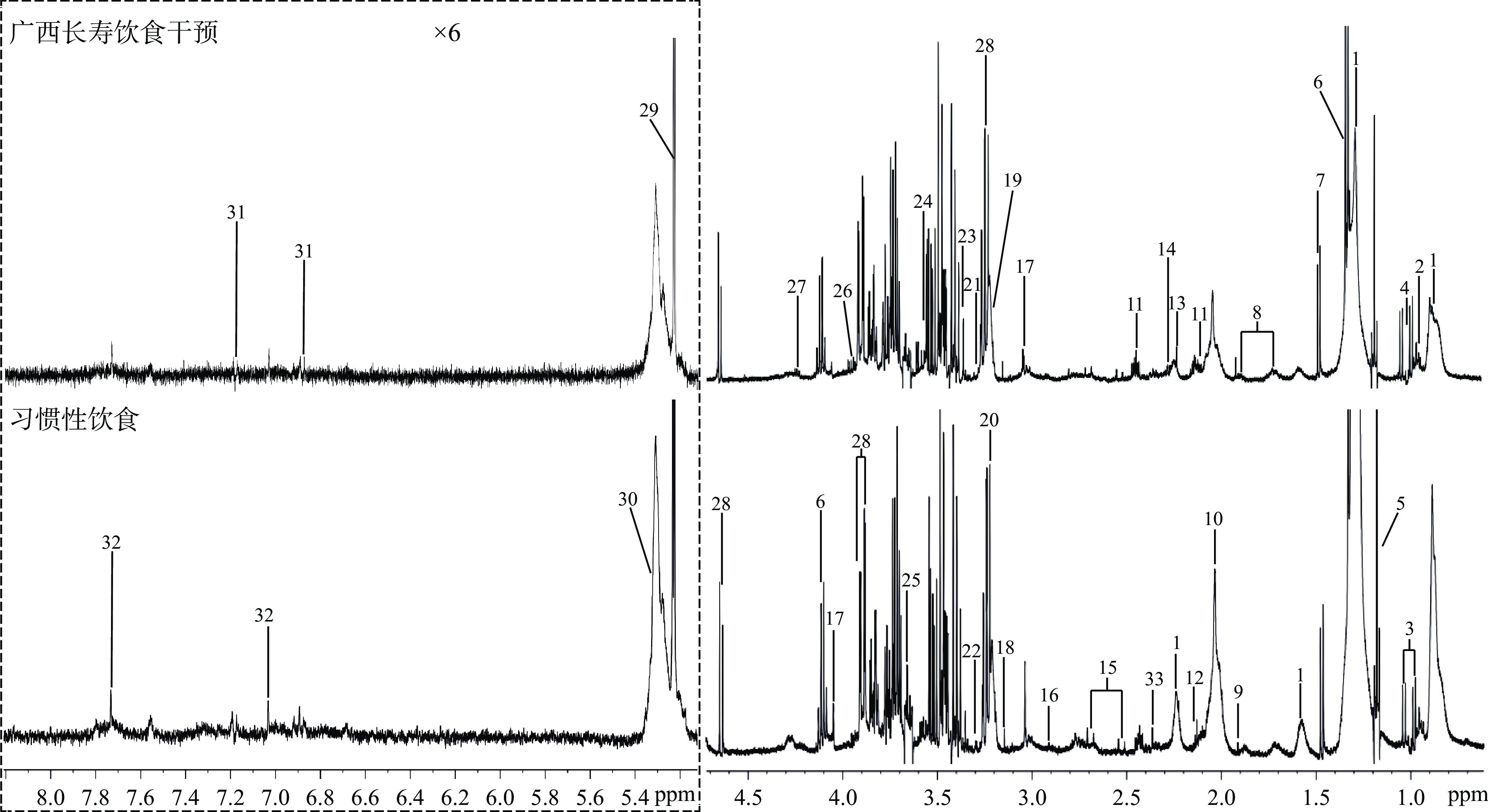
图2显示了志愿者习惯性饮食阶段和广西长寿饮食阶段血清样本代表性的500 MHz 1H-NMR光谱图。根据每种代谢物的化学位移和信号多样性,结合先前文献[4,19-20]和人类代谢组数据库(HMDB;http://www.hmdb.ca/)鉴定并量化了33种不同的代谢物。
![]() 图 2 志愿者习惯性饮食阶段和广西长寿饮食阶段的代表性CPMG 1H NMR血清光谱注:与δ0.5~4.6相比,δ5.0~.4区域的光谱垂直扩大了6倍。1.脂质;2.异亮氨酸;3.亮氨酸;4.缬氨酸;5.乙醇;6.乳酸;7.丙氨酸;8.赖氨酸;9.乙酸;10.N-乙酰糖蛋白;11.谷氨酰胺;12.蛋氨酸;13.丙酮;14.乙酰乙酸盐;15.柠檬酸;16.三甲胺;17.肌酐;18. N-亚硝基二甲胺;19.胆碱;20.磷酸胆碱;21.三甲胺-N-氧化物;22.脯氨酸;23.鲨肌醇;24.甘氨酸;25.甘油;26.丝氨酸;27.苏氨酸;28. β-葡萄糖;29.α-葡萄糖;30.不饱和脂肪酸;31.组氨酸;32.酪氨酸;33.丙酮酸。Figure 2. Typical 500 MHz 1H NMR spectra of serum extracts for the volunteer with habitual diet and Guangxi longevity dietary
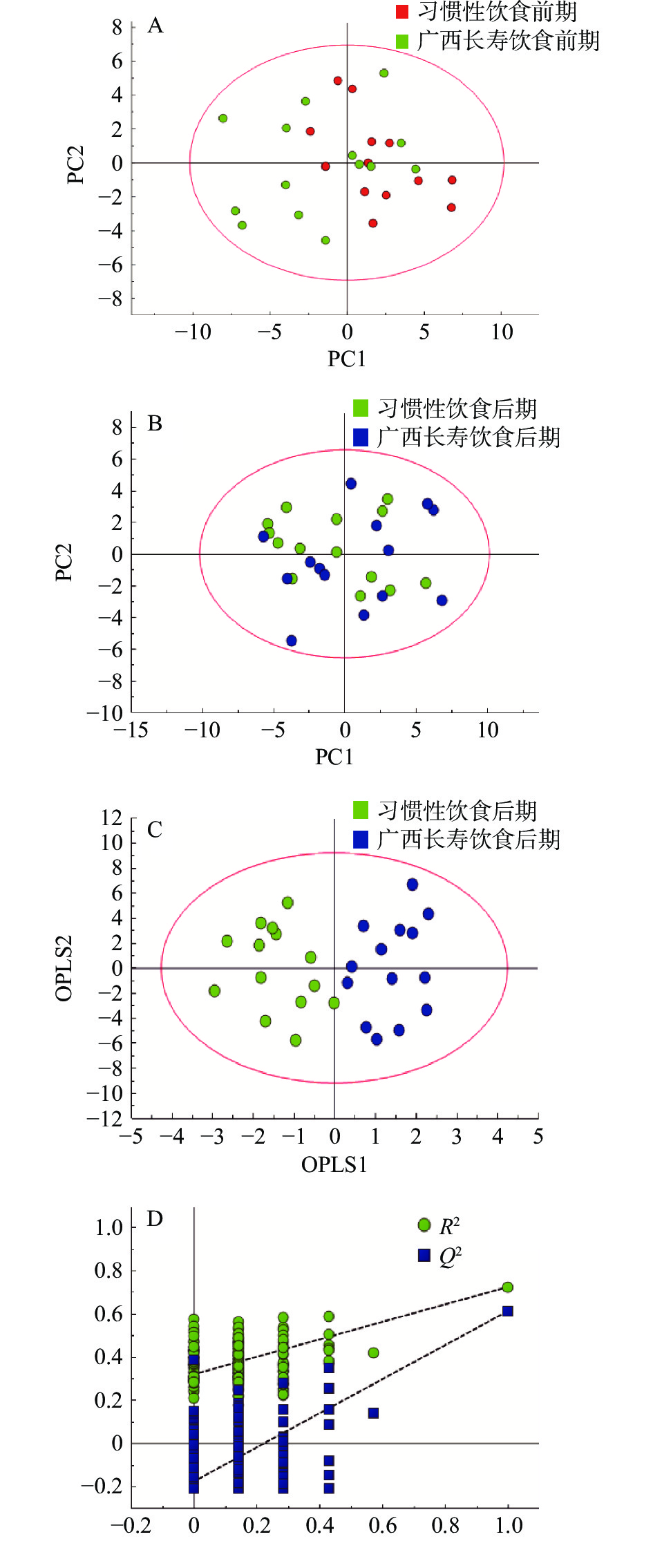
图 2 志愿者习惯性饮食阶段和广西长寿饮食阶段的代表性CPMG 1H NMR血清光谱注:与δ0.5~4.6相比,δ5.0~.4区域的光谱垂直扩大了6倍。1.脂质;2.异亮氨酸;3.亮氨酸;4.缬氨酸;5.乙醇;6.乳酸;7.丙氨酸;8.赖氨酸;9.乙酸;10.N-乙酰糖蛋白;11.谷氨酰胺;12.蛋氨酸;13.丙酮;14.乙酰乙酸盐;15.柠檬酸;16.三甲胺;17.肌酐;18. N-亚硝基二甲胺;19.胆碱;20.磷酸胆碱;21.三甲胺-N-氧化物;22.脯氨酸;23.鲨肌醇;24.甘氨酸;25.甘油;26.丝氨酸;27.苏氨酸;28. β-葡萄糖;29.α-葡萄糖;30.不饱和脂肪酸;31.组氨酸;32.酪氨酸;33.丙酮酸。Figure 2. Typical 500 MHz 1H NMR spectra of serum extracts for the volunteer with habitual diet and Guangxi longevity dietary为了辨析广西长寿饮食模式对血清代谢物的影响,对结果进行了PCA分析。图3A显示了志愿者习惯性饮食前和广西长寿饮食前的PC1与PC2得分图,经过PCA分析得到了4个主成分,R2X=0.596,血清代谢物的分布并未表现出显著差异。为了凸显志愿者习惯性饮食前和广西长寿饮食前血清代谢物的组间差异,使用OPLS-DA来可视化代谢物差异。经过OPLS-DA分析,R2Y=0.17,Q2=0.069,同时,模型CV-ANOVA测试得分为P=0.409,因Q2<0.4且P>0.05,故OPLS-DA模型无效,表明志愿者的习惯性饮食前期和广西长寿饮食前期的血清代谢物之间无显著差异。图3B显
示了志愿者习惯性饮食后和广西长寿饮食干预后的PC1与PC2得分图,经过PCA分析得到了5个主成分,R2X=0.662,进一步使用OPLS-DA分析来可视化代谢物差异(图3C)。所得参数为:R2Y=0.792,Q2=0.603,模型CV-ANOVA测试得分为P=0.002,因Q2>0.4且P<0.05,故表明该模型可靠,即该模型对志愿者的血清代谢物分离有很好的效果。对此进行置换检验(200次),以进一步评估模型的稳健性,因置换检验中的R2和Q2值均低于相应的原始值,Q2的回归线具有负截距(图3D),该结果表明构建的模型具有良好的拟合性和高可预测性,并可用于进一步筛选习惯性饮食后和广西长寿饮食干预后志愿者血清的差异性代谢物。 2.3 血清差异代谢物的筛选
根据OPLS-DA评分图中的VIP值(VIP>1),结合P<0.05,筛选出明显不同的代谢物谱,并将其选为潜在的代谢标志物,以确定与习惯性饮食相比,广西长寿饮食模式对于血清代谢物的本质影响。共有6种代谢物发生了显著变化,其中,组氨酸、甘油、α-葡萄糖、β-葡萄糖相对丰度显著增加,胆碱和乳酸的相对丰度显著降低(P<0.05)(见表2)。
表 2 血清中主要代谢物的统计分析结果Table 2. Statistical analysis results of the main metabolite in serum代谢物
(出峰位置)VIP 相对丰度 P值 习惯性饮食 广西长寿饮食 α-葡萄糖(5.23 ppm) 1.15 1.41±0.29 1.65±0.25↑ 0.005 β-葡萄糖(3.90 ppm) 1.65 2.53±0.50 3.00±0.45↑ 0.006 β-葡萄糖(3.43 ppm) 2.92 8.51±1.68 10.04±1.65↑ 0.005 α-葡萄糖/β-葡萄糖
(3.68~3.79 ppm)2.14 7.76±1.16 8.74±1.44↑ 0.008 组氨酸(3.25 ppm) 1.37 2.32±0.57 2.73±0.57↑ 0.017 胆碱(3.20 ppm) 2.60 5.54±1.59 4.23±1.57↓ 0.015 N-乙酰糖蛋白
(2.03 ppm)1.07 3.75±1.06 4.19±1.13↑ 0.053 脂质(1.28 ppm) 2.95 23.69±7.44 20.76±5.30↓ 0.086 乳酸(4.11 ppm) 1.16 1.85±0.55 1.54±0.38↓ 0.004 乳酸(1.33 ppm) 2.33 6.76±2.12 5.54±1.22↓ 0.017 甘油(3.65 ppm) 1.78 2.01±0.79 2.67±0.90↑ 0.020 注:↑表示与习惯性饮食相比,在广西长寿饮食干预后代谢物相对丰度显著升高(P<0.05);↓表示与习惯性饮食相比,在广西长寿饮食干预后代谢物相对丰度有所降低(P<0.05)。 2.4 粪便短链脂肪酸的变化
SCFAs主要通过肠道微生物发酵不可消化的碳水化合物产生。已有研究证明SCFAs的升高对健康有着诸多裨益,如改善血糖和血脂、降低机体炎症等[21]。研究表明,短期的饮食即可迅速改变肠道微生物群的组成和活性,从而影响SCFAs的产生[22-23]。因此,本研究同步检测了粪便SCFAs的变化,以探究广西长寿饮食模式对机体代谢的影响。结果表明,志愿者在习惯性饮食阶段的粪便SCFAs无显著变化(P˃0.05),而在广西长寿饮食干预后,乙酸盐和丁酸盐有了显著提高(P<0.05)。比较而言,丙酸盐、戊酸盐、异丁酸盐和异戊酸盐也有所升高,但是这种趋势并不显著(P˃0.05)(见表3)。
表 3 粪便SCFAs的统计分析结果Table 3. Statistical analysis results of the main SCFAs in fecesSCFAs 相对含量(mmol/L) P值 Day 0 Day 15 Day 29 Day 15 vs. Day 0 Day 15 vs. Day 29 乙酸 30.03±5.49 30.40±6.65 37.64±4.90↑ 0.826 0.005 丙酸 12.18±4.39 12.34±7.25 13.58±3.88 0.730 0.221 异丁酸 1.22±0.60 1.32±0.43 1.78±0.96 0.347 0.445 丁酸 15.63±6.62 15.43±5.13 24.51±7.02↑ 0.683 0.004 异戊酸 1.17±0.68 1.15±0.56 1.54±1.26 0.701 0.552 戊酸 0.98±0.46 1.05±0.57 1.55±1.08 0.382 0.101 注:↑表示与Day15(广西长寿饮食干预前)相比,Day29(广西长寿饮食干预后)SCFAs相对含量显著上升(P<0.05)。 2.5 关键代谢物的聚类分析和性能评估
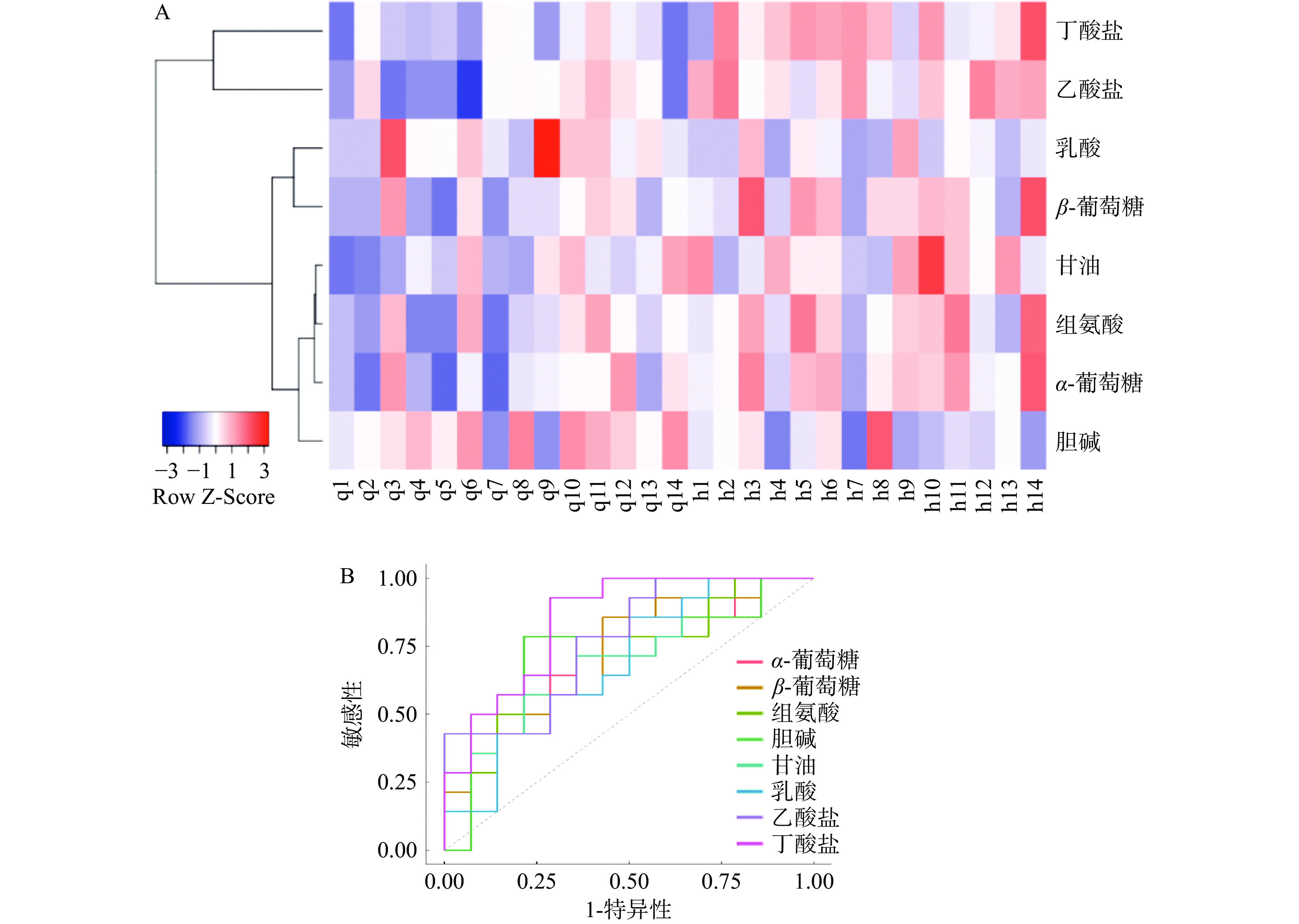
为了更好地可视化广西长寿饮食模式对所筛选血液代谢标志物和有关粪便SCFAs的影响,将Euclidean算法用于距离测量,结合Average Linkage算法进行了聚类分析(图4A)。图中纵坐标代表8种代谢标志物,横坐标代表习惯性饮食和广西长寿饮食干预的志愿者样本。颜色表示代谢物值,其中紫色最低,红色最高。可以看出,与习惯性饮食相比,在广西长寿饮食干预后,8种代谢标志物有着相对明显的表达差异。同时,采用蒙特卡罗交叉验证(Monte Carlo Cross Validation)和线性支持向量机(Support Vector Machine)的方法生成ROC曲线,以进一步评估所筛选的代谢标志物差异性(图4B)。结果表明,这8种代谢标志物曲线下的面积(area under curve,AUC)分别为:α-葡萄糖=0.7347;β-葡萄糖=0.7245;组氨酸=0.6939;胆碱=0.7500;甘油=0.7194;乳酸=0.6837;乙酸盐=0.7704;丁酸盐=0.8469。参考文献[24-25]的方法,认为AUC值大于0.6时,则模型预测有效,由图4B可知本研究中8种代谢标志物的AUC值均大于0.6[25-26],故认为上述8种成分均可用于后续分析(图4B)。
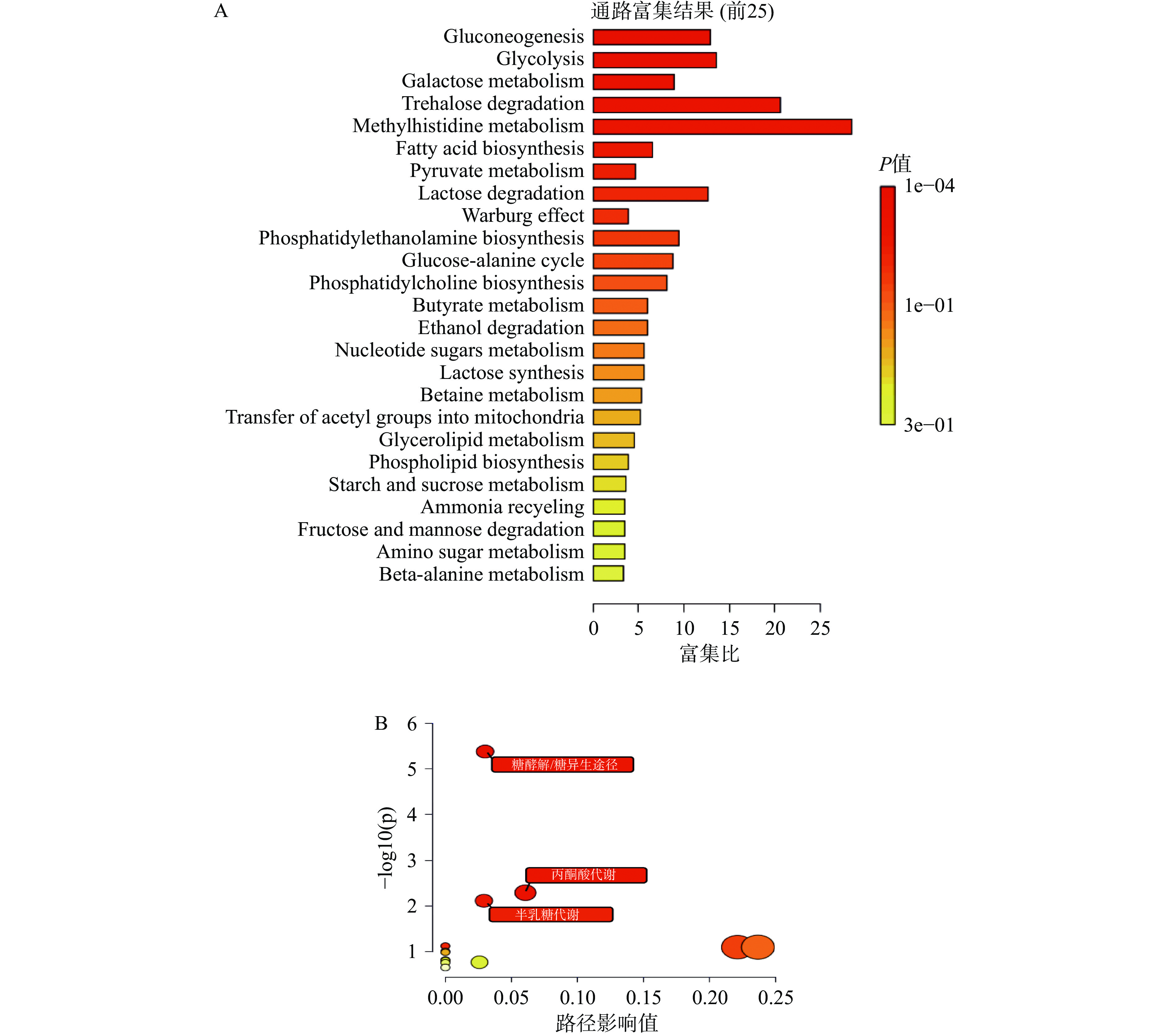
2.6 代谢途径分析
为了解志愿者的代谢物变化是否反映了其代谢途径的协同变化,使用MetaboAnalyst 5.0结合KEGG数据库将血液代谢标志物和有显著变化的粪便SCFAs分析结果用于代谢物组富集分析和途径分析(图5A和5B)。结果发现有3种潜在的代谢途径可能对改善机体健康状态有关键作用[24-25,27]。分别为:a.糖酵解/糖异生途径;b.丙酮酸代谢;c.半乳糖代谢。结果表明,本饮食模式对机体健康状态的影响与不同的代谢途径有关,且这些代谢途径可能在改善机体健康状态的过程中发挥重要作用。
3. 讨论
本团队前期研究发现所构建的广西长寿饮食模式对小鼠具有良好的抗衰老作用[14-15]。本研究则发现短期的广西长寿饮食模式干预后,志愿者血清代谢物中甘油、组氨酸、α-葡萄糖和β-葡萄糖相对丰度显著增加(P<0.05),胆碱和乳酸的相对丰度显著降低(P<0.05),同时,粪便中的乙酸盐和丁酸盐含量也显著上升(P<0.05)。还发现代谢物的变化与3条途径密切相关。
甘油作为甘油三酯的骨架成分,是连接糖代谢和脂肪酸代谢的关键。研究表明,甘油在体内可被转化为磷酸二羟基丙酮进入糖酵解过程,为机体提供能量[28]。本研究发现在两周高依从性的饮食干预之后,志愿者血清甘油的含量略有上升,这或许存在如下原因:广西长寿饮食模式中富含水果、蔬菜,而肉类含量较少,故总体能量摄入较志愿者习惯性饮食阶段相比较低,从而导致体内脂肪分解增加,引起甘油浓度增加,以参与糖酵解过程。亦有研究证明,甘油含量的升高对调节高脂血症有着积极作用[29]。故志愿者甘油水平的升高,可能对调节血脂水平发挥着一定的作用。
已有研究证明组氨酸作为人体必需氨基酸,其血清含量与机体健康衰老密切相关[30]。同时,血液组氨酸浓度已被证明与机体炎症状态和氧化应激水平相关。研究表明,组氨酸可通过与二价金属离子螯合,清除羟基自由基和单线态氧,从而改善机体的抗氧化水平,组氨酸的抗炎作用则可通过调控机体NF-
k B通路实现[31]。组氨酸在体内还可通过甲氨基谷氨酸在依赖四氢叶酸的途径中转化为谷氨酸,故研究表明,叶酸摄入不足会导致组氨酸的排泄增加,从而引起血液中组氨酸浓度降低[32]。Hefni等[33]通过对健康志愿者进行富含叶酸的饮食干预后,发现其血液中组氨酸丰度升高。广西长寿饮食模式中包含高水平的深色蔬菜类、水果类食物,且注重对豆类食物的摄入,故饮食中叶酸含量相对较高,饮食干预后组氨酸的丰度增高可能与此相关。此外,高水平的组氨酸还被证明可以有效改善胰岛素敏感性,对机体代谢紊乱起到良好的调节作用[34]。因此,本次研究结束后,志愿者血清代谢物中组氨酸水平的显著升高,可能对改善机体炎症和健康状态,提高机体抗氧化水平具有重要作用。志愿者血清中的乳酸水平在本次饮食干预后有了显著下降(P<0.05),这可能也是志愿者健康状态改善的标志。研究证明乳酸水平与胰岛素敏感性之间存在着显著的反比关系[35]。当胰岛素敏感性受损时,会降低机体内以糖原形式储存葡萄糖的能力,将摄入的碳水化合物更多的转化为乳酸,从而导致血液中乳酸水平升高[36]。故饮食干预后乳酸水平的降低和葡萄糖水平的升高可能反映了广西长寿饮食模式对胰岛素敏感性的调节作用。同时,Xu等[37]的研究表明高脂肪饮食会使血液乳酸水平升高,亦有研究表明低蛋白饮食可以有效降低乳酸水平[38]。在广西长寿饮食干预期间,志愿者摄入脂肪和蛋白质相比其习惯性饮食期间较少,这可能与乳酸水平降低有关。此外,乳酸水平的变化可能对丙酮酸代谢途径有着一定的影响。在体内,乳酸可通过乳酸脱氢酶生成丙酮酸,用于糖异生过程。且神经元代谢所需的能量是由乳酸作为代谢底物转化为丙酮酸进行氧化磷酸化产生的[39]。还有研究表明,机体衰老会影响丙酮酸代谢过程,并通过降低柠檬酸循环中的丙酮酸流量造成乳酸水平的增加[40]。结合这些报道分析本研究所得结果,认为饮食干预后志愿者乳酸水平的下降或许对调节胰岛素敏感性,维持机体健康状态,延缓衰老具有积极作用。
饮食干预后,志愿者血清中的胆碱丰度也有了显著降低。已有研究证明,胆碱与甘油三酯、血糖等心血管疾病风险指标显著正相关[41],还有报道高水平的血清胆碱浓度也被认为与结肠癌风险增加相关[42]。Heianza等[43]的研究表明低热量饮食干预会使志愿者血液中胆碱水平降低,这可能是饮食干预后志愿者胆碱丰度降低的原因。此外,在机体内,胆碱是生成氧化三甲胺的关键底物,氧化三甲胺被证明是与心血管疾病如冠心病、动脉粥样硬化等疾病风险相关的预测因子[44]。Abbasalizad等[45]的荟萃分析结果也表明,氧化三甲胺浓度与高血压风险之间呈显著的剂量效应关联,并与HDL-C等心血管代谢风险指标相关。故饮食干预后血清胆碱水平的显著降低,表明了广西长寿饮食模式对降低志愿者心血管疾病风险、改善机体健康状况密切相关。
乙酸盐和丁酸盐作为代表性的SCFAs,在本次饮食干预后有了显著升高(P<0.05)。研究表明,乙酸盐和丁酸盐因可以有效防止β细胞凋亡,使胰岛细胞具抗氧化作用,故在控制糖尿病方面具有积极影响[46]。同时,丁酸盐可有效改善机体血压状况,通过下调胆固醇生物合成关键基因的表达来改善机体血脂水平[47],且在维持肠道上皮细胞完整性方面也有积极作用[48]。在饮食干预后,志愿者粪便中乙酸盐和丁酸盐水平显著升高,潜在原因可能是饮食中高水平的谷物、水果和蔬菜有效增加了可降解纤维的细菌数量所致[49]。Quercia等[50]的研究也表明,富含高纤维的饮食模式可有效增加肠道菌群产生的SCFAs,这与本研究结果一致。因此,广西长寿饮食干预后志愿者粪便中乙酸盐和丁酸盐的显著升高可能对改善血糖,血压和血脂水平,预防机体罹患心血管疾病发挥重要作用。
Jee等[51]的研究表明了低水平葡萄糖浓度对机体健康的有益作用,本次试验的志愿者血清中的葡萄糖水平有所升高,这种现象或许可以这样理解:当机体处于炎症状态时,免疫细胞会优先使用糖酵解供能,从而加速机体糖酵解过程,致使机体葡萄糖水平降低[52]。适当范围的血清葡萄糖增加可能代表着机体炎症状况的改善。同时,半乳糖是葡萄糖产生的前体,在体内可通过转化为葡萄糖1-磷酸参与葡萄糖代谢过程。研究表明,过量的半乳糖积累会导致机体代谢紊乱[53]。因此,血液葡萄糖水平的升高可能与半乳糖代谢途径相关。此外,葡萄糖水平的升高也可能与糖酵解/糖异生途径相关。乳酸在体内参与糖异生途径可以产生内源性葡萄糖,糖异生途径可在机体血糖水平低时,通过非糖前体物质合成葡萄糖,为大脑等组织提供能量,保证机体需求,本研究发现的志愿者机体乳酸盐的显著降低也应该能够为这一判断提供支持,但要下结论则仍需要结合志愿者状态进行更多的研究。
4. 结论
本研究基于代谢组学技术探究了广西长寿饮食模式对志愿者代谢物的影响。结果表明:与习惯性饮食相比,广西长寿饮食模式对志愿者血清代谢物和粪便SCFAs有着明显的改变,经过分析共筛选出8种具有显著差异的代谢物,分别为组氨酸、甘油、α-葡萄糖、β-葡萄糖、胆碱、乳酸、乙酸盐和丁酸盐(P<0.05)。这些差异代谢物主要涉及糖酵解/糖异生途径、丙酮酸代谢和半乳糖代谢3条代谢途径,其含量变化趋势从代谢组学的角度说明了广西长寿饮食模式可能在一定程度上对降低炎症和罹患心血管疾病风险,提高机体抗氧化能力,延缓衰老进程具有积极作用。本研究为通过饮食干预改善机体代谢状况、维持机体健康状态提供了新的策略,也从代谢组学的角度对广西长寿饮食模式益生效果的作用机制进行了一定的阐释。
-
图 2 志愿者习惯性饮食阶段和广西长寿饮食阶段的代表性CPMG 1H NMR血清光谱
注:与δ0.5~4.6相比,δ5.0~.4区域的光谱垂直扩大了6倍。1.脂质;2.异亮氨酸;3.亮氨酸;4.缬氨酸;5.乙醇;6.乳酸;7.丙氨酸;8.赖氨酸;9.乙酸;10.N-乙酰糖蛋白;11.谷氨酰胺;12.蛋氨酸;13.丙酮;14.乙酰乙酸盐;15.柠檬酸;16.三甲胺;17.肌酐;18. N-亚硝基二甲胺;19.胆碱;20.磷酸胆碱;21.三甲胺-N-氧化物;22.脯氨酸;23.鲨肌醇;24.甘氨酸;25.甘油;26.丝氨酸;27.苏氨酸;28. β-葡萄糖;29.α-葡萄糖;30.不饱和脂肪酸;31.组氨酸;32.酪氨酸;33.丙酮酸。
Figure 2. Typical 500 MHz 1H NMR spectra of serum extracts for the volunteer with habitual diet and Guangxi longevity dietary
表 1 基线时志愿者临床和人口统计学特征
Table 1 Clinical and demographic characteristics of volunteers at baseline
基线特征 参数 年龄(岁) 62.93±9.36 性别(男/女) 7/7 BMI(kg/m2) 25.42±3.75 表 2 血清中主要代谢物的统计分析结果
Table 2 Statistical analysis results of the main metabolite in serum
代谢物
(出峰位置)VIP 相对丰度 P值 习惯性饮食 广西长寿饮食 α-葡萄糖(5.23 ppm) 1.15 1.41±0.29 1.65±0.25↑ 0.005 β-葡萄糖(3.90 ppm) 1.65 2.53±0.50 3.00±0.45↑ 0.006 β-葡萄糖(3.43 ppm) 2.92 8.51±1.68 10.04±1.65↑ 0.005 α-葡萄糖/β-葡萄糖
(3.68~3.79 ppm)2.14 7.76±1.16 8.74±1.44↑ 0.008 组氨酸(3.25 ppm) 1.37 2.32±0.57 2.73±0.57↑ 0.017 胆碱(3.20 ppm) 2.60 5.54±1.59 4.23±1.57↓ 0.015 N-乙酰糖蛋白
(2.03 ppm)1.07 3.75±1.06 4.19±1.13↑ 0.053 脂质(1.28 ppm) 2.95 23.69±7.44 20.76±5.30↓ 0.086 乳酸(4.11 ppm) 1.16 1.85±0.55 1.54±0.38↓ 0.004 乳酸(1.33 ppm) 2.33 6.76±2.12 5.54±1.22↓ 0.017 甘油(3.65 ppm) 1.78 2.01±0.79 2.67±0.90↑ 0.020 注:↑表示与习惯性饮食相比,在广西长寿饮食干预后代谢物相对丰度显著升高(P<0.05);↓表示与习惯性饮食相比,在广西长寿饮食干预后代谢物相对丰度有所降低(P<0.05)。 表 3 粪便SCFAs的统计分析结果
Table 3 Statistical analysis results of the main SCFAs in feces
SCFAs 相对含量(mmol/L) P值 Day 0 Day 15 Day 29 Day 15 vs. Day 0 Day 15 vs. Day 29 乙酸 30.03±5.49 30.40±6.65 37.64±4.90↑ 0.826 0.005 丙酸 12.18±4.39 12.34±7.25 13.58±3.88 0.730 0.221 异丁酸 1.22±0.60 1.32±0.43 1.78±0.96 0.347 0.445 丁酸 15.63±6.62 15.43±5.13 24.51±7.02↑ 0.683 0.004 异戊酸 1.17±0.68 1.15±0.56 1.54±1.26 0.701 0.552 戊酸 0.98±0.46 1.05±0.57 1.55±1.08 0.382 0.101 注:↑表示与Day15(广西长寿饮食干预前)相比,Day29(广西长寿饮食干预后)SCFAs相对含量显著上升(P<0.05)。 -
[1] KE C, XU H, CHEN Q, et al. Serum metabolic signatures of high myopia among older Chinese adults[J]. Eye,2021,35(3):817−824. doi: 10.1038/s41433-020-0968-z
[2] FLOEGEL A, STEFAN N, YU Z, et al. Identification of serum metabolites associated with risk of Type 2 diabetes using a targeted metabolomic approach[J]. Diabetes,2013,62(2):639−648. doi: 10.2337/db12-0495
[3] ZHANG Y, ZHANG H, CHANG D, et al. Metabolomics approach by 1 H NMR spectroscopy of serum reveals progression axes for asymptomatic hyperuricemia and gout[J]. Arthritis Res Ther,2018,20(1):111. doi: 10.1186/s13075-018-1600-5
[4] RAWAT A, MISRA G, SAXENA M, et al. (1)H NMR based serum metabolic profiling reveals differentiating biomarkers in patients with diabetes and diabetes-related complication[J]. Diabetes Metab Syndr,2019,13(1):290−298. doi: 10.1016/j.dsx.2018.09.009
[5] 朱莹莹, 李春保, 周光宏. 饮食、肠道微生物与健康的关系研究进展[J]. 食品科学,2015,36(15):234−239. [ZHU Y Y, LI C B, ZHOU G H. Advances in the associations of diet with gut microbiota and human health[J]. Food Science,2015,36(15):234−239. doi: 10.7506/spkx1002-6630-201515043 ZHU Y Y, LI C B, ZHOU G H. Advances in the associations of diet with gut microbiota and human health[J]. Food Science, 2015, 36(15): 234-239. doi: 10.7506/spkx1002-6630-201515043
[6] REEDY J, KREBS-SMITH S M, MILLER P E, et al. Higher diet quality is associated with decreased risk of all-cause, cardiovascular disease, and cancer mortality among older adults[J]. J Nutr,2014,144(6):881−889. doi: 10.3945/jn.113.189407
[7] ARCHUNDIA HERRERA M C, SUBHAN F B, CHAN C B. Dietary patterns and cardiovascular disease risk in people with Type 2 diabetes[J]. Current Obesity Reports,2017,6(4):405−413. doi: 10.1007/s13679-017-0284-5
[8] MATSUYAMA S, ZHANG S, TOMATA Y, et al. Association between improved adherence to the Japanese diet and incident functional disability in older people: The Ohsaki Cohort 2006 study[J]. Clinical Nutrition, 2019, 39(7).
[9] HU E A, CORESH J, ANDERSON C, et al. Adherence to healthy dietary patterns and risk of CKD progression and all-cause mortality: Findings from the CRIC (Chronic Renal Insufficiency Cohort) study[J]. American Journal of Kidney Diseases, 2020.
[10] MICHALCZYK M M, KLONEK G, MASZCZYK A, et al. The effects of a low calorie ketogenic diet on glycaemic control variables in hyperinsulinemic overweight/obese females[J]. Nutrients,2020,12(6):1854. doi: 10.3390/nu12061854
[11] PASANISI P, GARIBOLDI M, VERDERIO P, et al. A pilot low-inflammatory dietary intervention to reduce inflammation and improve quality of life in patients with familial adenomatous polyposis: Protocol description and preliminary results[J]. 2019, 18(11): 153473541984640.
[12] POLL B G, CHEEMA M U, PLUZNICK J L. Gut microbial metabolites and blood pressure regulation: Focus on SCFAs and TMAO[J]. Physiology (Bethesda),2020,35(4):275−284.
[13] 蔡达. 广西长寿之乡老人饮食与代谢特征及其相关性研究[D]. 南宁: 广西大学, 2017. CAI D. A correlation between diet and metabolic characteristics of healthy elderly people from longevous region in Guangxi province[D]. Nanning: Guangxi University, 2017.
[14] 宋奇, 艾连中, 鲁红岩, 等. 巴马长寿饮食模式在衰老小鼠模型中的抗氧化应激效果[J]. 食品科学,2018,39(19):147−153. [SONG Q, AI L Z, LU H Y, et al. Effect of Bama longevity dietary patterns on antioxidant stress in a mouse model of aging[J]. Food Science,2018,39(19):147−153. doi: 10.7506/spkx1002-6630-201819023 SONG Q, AI L Z, LU H Y, et al. Effect of Bama longevity dietary patterns on antioxidant stress in a mouse model of aging[J]. Food Science, 2018, 39(19): 147-153. doi: 10.7506/spkx1002-6630-201819023
[15] 黄燕婷, 梅丽华, 潘海博, 等. 巴马长寿特征饮食模式对自然衰老小鼠的抗衰老效果[J]. 食品科学,2021,42(5):137−144. [HUANG Y T, MEI L H, PAN H B, et al. Anti-aging effect of Bama longevity characteristic dietary patterns in naturally aging mice[J]. Food Science,2021,42(5):137−144. doi: 10.7506/spkx1002-6630-20200229-328 HUANG Y T, MEI L H, PAN H B, et al. Anti-aging effect of Bama longevity characteristic dietary patterns in naturally aging mice[J]. Food Science, 2021, 42(5): 137-144. doi: 10.7506/spkx1002-6630-20200229-328
[16] 祁波, 谢辉辉, 李国芳, 等. 金欣口服液对呼吸道合胞病毒诱发支气管哮喘模型小鼠血浆短链脂肪酸的影响[J]. 中医儿科杂志,2021,17(4):11−17. [QI B, XIE H H, LI G F, et al. Effects of Jinxin Koufuye on plasma short-chain fatty acids in respiratory syncytial virus-induced bronchial asthma in model mice[J]. Journal of Pediatrics of Traditional Chinese Medicine,2021,17(4):11−17. QI B, XIE H H, LI G F, et al. Effects of Jinxin Koufuye on plasma short-chain fatty acids in respiratory syncytial virus-induced bronchial asthma in model mice[J]. Journal of Pediatrics of Traditional Chinese Medicine, 2021, 17(4): 11-17.
[17] BRONS C, SPOHR C, STORGAARD H, et al. Effect of taurine treatment on insulin secretion and action, and on serum lipid levels in overweight men with a genetic predisposition for Type II diabetes mellitus[J]. Eur J Clin Nutr,2004,58(9):1239−1247. doi: 10.1038/sj.ejcn.1601955
[18] BROSKEY N T, ZOU K, DOHM G L, et al. Plasma lactate as a marker for metabolic health[J]. Exercise and Sport Sciences Reviews,2020,48(3):119−124.
[19] DU S, SUN S, LIU L, et al. Effects of histidine supplementation on global serum and urine (1)H NMR-based metabolomics and serum amino acid profiles in obese women from a randomized controlled study[J]. J Proteome Res,2017,16(6):2221−2230. doi: 10.1021/acs.jproteome.7b00030
[20] HTUN K T, PAN J, PASANTA D, et al. Identification of metabolic phenotypes in young adults with obesity by (1)H NMR metabolomics of blood serum[J]. Life (Basel), 2021, 11(6).
[21] CAMPOS-PEREZ W, MARTINEZ-LOPEZ E. Effects of short chain fatty acids on metabolic and inflammatory processes in human health[J]. Biochim Biophys Acta Mol Cell Biol Lipids,2021,1866(5):158900.
[22] DAVID L A, MAURICE C F, CARMODY R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature,2014,505(7484):559−563. doi: 10.1038/nature12820
[23] BRÜSSOW H, PARKINSON S J. You are what you eat[J]. Nature Biotechnology,2014,32(3):243−245. doi: 10.1038/nbt.2845
[24] PALVIAINEN M, LAUKKANEN K, TAVUKCUOGLU Z, et al. Cancer alters the metabolic fingerprint of extracellular vesicles[J]. Cancers (Basel), 2020, 12(11).
[25] WARE L J, RENNIE K L, KRUGER H S, et al. Evaluation of waist-to-height ratio to predict 5 year cardiometabolic risk in sub-Saharan African adults[J]. Nutr Metab Cardiovasc Dis,2014,24(8):900−907. doi: 10.1016/j.numecd.2014.02.005
[26] WHITE E S, XIA M, MURRAY S, et al. Plasma surfactant protein-D, matrix metalloproteinase-7, and osteopontin index distinguishes idiopathic pulmonary fibrosis from other idiopathic interstitial pneumonias[J]. Am J Respir Crit Care Med,2016,194(10):1242−1251. doi: 10.1164/rccm.201505-0862OC
[27] KOUIDHI S, ZIDI O, ALHUJAILY M, et al. Fecal metabolomics reveals distinct profiles of kidney transplant recipients and healthy controls[J]. Diagnostics (Basel), 2021, 11(5).
[28] BRISSON D, VOHL M C, PIERRE S T J, et al. Glycerol: A neglected variable in metabolic processes?[J]. BioEssays,2001,23(6):534−452. doi: 10.1002/bies.1073
[29] 周小理, 张欢, 周一鸣, 等. 基于代谢组学研究苦荞蛋白对高脂血症小鼠的干预作用[J]. 食品科学,2019,40(5):149−155. [ZHOU X L, ZHANG H, ZHOU Y M, et al. Metabonomic Study of the intervention effect of tartary buckwheat protein on hyperlipidemic mice[J]. Food Science,2019,40(5):149−155. doi: 10.7506/spkx1002-6630-20171030-354 ZHOU X L, ZHANG H, ZHOU Y M, et al. Metabonomic Study of the intervention effect of tartary buckwheat protein on hyperlipidemic mice[J]. Food Science, 2019, 40(5): 149-155. doi: 10.7506/spkx1002-6630-20171030-354
[30] KIM Y, KIM Y. L-histidine and L-carnosine exert anti-brain aging effects in D-galactose-induced aged neuronal cells[J]. Nutr Res Pract,2020,14(3):188−202. doi: 10.4162/nrp.2020.14.3.188
[31] FENG R N, NIU Y C, SUN X W, et al. Histidine supplementation improves insulin resistance through suppressed inflammation in obese women with the metabolic syndrome: A randomised controlled trial[J]. Diabetologia,2013,56(5):985−994. doi: 10.1007/s00125-013-2839-7
[32] COOPERMAN J M, LOPEZ R. The role of histidine in the anemia of folate deficiency[J]. Experimental biology and medicine (Maywood, N J),2002,227(11):998−1000. doi: 10.1177/153537020222701107
[33] HEFNI M E, WITTHÖFT C M, MOAZZAMI A A. Plasma metabolite profiles in healthy women differ after intervention with supplemental folic acid v. folate-rich foods[J]. Journal of Nutritional Science,2018,7:e32. doi: 10.1017/jns.2018.22
[34] NIU Y C, FENG R N, HOU Y, et al. Histidine and arginine are associated with inflammation and oxidative stress in obese women[J]. Br J Nutr,2012,108(1):57−61. doi: 10.1017/S0007114511005289
[35] ADEVA-ANDANY M, LÓPEZ-OJÉN M, FUNCASTA-CALDERÓN R, et al. Comprehensive review on lactate metabolism in human health[J]. Mitochondrion,2014,17:76−100. doi: 10.1016/j.mito.2014.05.007
[36] SCHMEDES M, BALDERAS C, AADLAND E K, et al. The effect of lean-seafood and non-seafood diets on fasting and postprandial serum metabolites and lipid species: Results from a randomized crossover intervention study in healthy adults[J]. Nutrients, 2018, 10(5): 598.
[37] XU J, LIU C, CAI S, et al. Metabolomic profilings of urine and serum from high fat-fed rats via 1h nmr spectroscopy and pattern recognition[J]. Applied Biochemistry and Biotechnology,2013,169(4):1250−1261. doi: 10.1007/s12010-012-0072-3
[38] CASTAGNARO S, PELLEGRINI C, PELLEGRINI M, et al. Autophagy activation in COL6 myopathic patients by a low-protein-diet pilot trial[J]. Autophagy,2016,12(12):2484−2495. doi: 10.1080/15548627.2016.1231279
[39] BOUZIER-SORE A K, VOISIN P, BOUCHAUD V, et al. Competition between glucose and lactate as oxidative energy substrates in both neurons and astrocytes: A comparative NMR study[J]. European Journal of Neuroscience,2006,24(6):1687−1694. doi: 10.1111/j.1460-9568.2006.05056.x
[40] GRAY L R, TOMPKINS S C, TAYLOR E B. Regulation of pyruvate metabolism and human disease[J]. Cellular and Molecular Life Sciences,2014,71(14):2577−2604. doi: 10.1007/s00018-013-1539-2
[41] KONSTANTINOVA S V, TELL G S, VOLLSET S E, et al. Divergent associations of plasma choline and betaine with components of metabolic syndrome in middle age and elderly men and women[J]. The Journal of Nutrition,2008,138(5):914−920. doi: 10.1093/jn/138.5.914
[42] GUERTIN K A, LI X S, GRAUBARD B I, et al. Serum trimethylamine N-oxide, carnitine, choline, and betaine in relation to colorectal cancer risk in the alpha tocopherol, beta carotene cancer prevention study[J]. Cancer Epidemiol Biomarkers Prev,2017,26(6):945−952. doi: 10.1158/1055-9965.EPI-16-0948
[43] HEIANZA Y, SUN D, SMITH S R, et al. Changes in gut microbiota–related metabolites and long-term successful weight loss in response to weight-loss diets: The pounds lost trial[J]. Diabetes Care,2018,41(3):413−419. doi: 10.2337/dc17-2108
[44] PENG J, XIAO X, HU M, et al. Interaction between gut microbiome and cardiovascular disease[J]. Life Sci,2018,214:153−157. doi: 10.1016/j.lfs.2018.10.063
[45] ABBASALIZAD FARHANGI M, VAJDI M. Gut microbiota-associated trimethylamine N-oxide and increased cardiometabolic risk in adults: A systematic review and dose-response meta-analysis[J]. Nutr Rev,2021,79(9):1022−1042. doi: 10.1093/nutrit/nuaa111
[46] 高中山, 任明, 刘杏利, 等. 短链脂肪酸在冠心病防治中的研究进展[J]. 临床心血管病杂志,2021,37(11):1062−1066. [GAO Z S, REN M, LIU X L, et al. Research progress on short chain fatty acids in prevention and treatment of coronary heart disease[J]. Journal of Clinical Cardiology,2021,37(11):1062−1066. GAO Z S, REN M, LIU X L, et al. Research progress on short chain fatty acids in prevention and treatment of coronary heart disease[J]. Journal of Clinical Cardiology, 2021, 37(11): 1062-1066.
[47] AGUILAR E C, LEONEL A J, TEIXEIRA L G, et al. Butyrate impairs atherogenesis by reducing plaque inflammation and vulnerability and decreasing NFκB activation[J]. Nutrition, Metabolism and Cardiovascular Diseases,2014,24(6):606−613. doi: 10.1016/j.numecd.2014.01.002
[48] ROSHANRAVAN N, MAHDAVI R, ALIZADEH E, et al. Effect of butyrate and inulin supplementation on glycemic status, lipid profile and glucagon-like peptide 1 level in patients with Type 2 diabetes: A randomized double-blind, placebo-controlled trial[J]. Horm Metab Res,2017,49(11):886−891. doi: 10.1055/s-0043-119089
[49] PAPARO L, CALIGNANO A, TOCCHETTI C G, et al. The influence of fiber on gut microbiota: Butyrate as molecular player involved in the beneficial interplay between dietary fiber and cardiovascular health[M]. Dietary Fiber for the Prevention of Cardiovascular Disease, 2017: 61−71.
[50] QUERCIA S, TURRONI S, FIORI J, et al. Gut microbiome response to short-term dietary interventions in reactive hypoglycemia subjects[J]. Diabetes/Metabolism Research and Reviews,2017,33(8):e2927.
[51] JEE S H, OHRR H, SULL J W, et al. Fasting serum glucose level and cancer risk in korean men and women[J]. JAMA,2005,293(2):194−202. doi: 10.1001/jama.293.2.194
[52] SOTO-HEREDERO G, GOMEZ DE LAS HERAS M M, GABANDE-RODRIGUEZ E, et al. Glycolysis-a key player in the inflammatory response[J]. Febs J,2020,287(16):3350−3369. doi: 10.1111/febs.15327
[53] FU Y, YIN R, LIU Z, et al. Hypoglycemic effect of prolamin from cooked foxtail millet (Setaria italic) on streptozotocin-induced diabetic mice[J]. Nutrients, 2020, 12(11): 3452.
-
期刊类型引用(2)
1. 彭婷,江丹,陈阳,王玉,赖富丽,陈志元,黄林恋. 响应面法优化桑叶提取液脱色工艺及其对α-葡萄糖苷酶抑制活性. 食品与发酵科技. 2024(06): 62-69 .  百度学术
百度学术
2. 郑霖华,吴启赐,陈巧玲,林佳燕,廖苑萍. 细梗香草皂苷活性炭脱色工艺及抑菌活性研究. 中国食品添加剂. 2021(11): 67-72 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:



