Screening of Infant-derived Lactobacillus rhamnosus and Its Promotion of Intestinal Organoid Growth
-
摘要: 本研究以分离得到的5株来源于一月龄婴儿的鼠李糖乳杆菌(Lactobacillus rhamnosus)与2株副干酪乳杆菌(Lactobacillus paracasei)作为实验菌,以鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)作为对照菌株,通过耐酸实验、耐胆盐实验、疏水性实验、自动聚集能力测定和细胞黏附等实验对这些菌株的消化道耐受性进行评价。进一步选择在耐受性实验中综合评价效果最好的鼠李糖乳杆菌SW-02与肠道类器官进行共培养,用倒置相差显微镜观察类器官形态、生长状况,计算出芽率,利用EdU染色评估类器官中细胞增殖情况,利用实时荧光定量PCR检测增殖标志基因Ki67、肠道干细胞标志物Lgr5和紧密连接蛋白Zo-1的mRNA水平,利用酶联免疫吸附试验测定粘蛋白MUC2含量。结果证实:与其他菌株相比,鼠李糖乳杆菌SW-02有较强的耐酸性;SW-02、SW-03和SW-X的耐胆盐能力相对较强;LGG、SW-01、SW-02、SW-04和TX-02对二甲苯的疏水性高;对于自动聚集能力,SW-01最强,SW-02次之;对HT-29细胞的黏附性实验显示,菌株SW-01、SW-02和SW-03具有较高的黏附能力;将SW-02与类器官共培养时,SW-02显著(P<0.05)提高了类器官的出芽率和出芽个数,促进类器官的生长;与对照组相比,SW-02组类器官的Ki67、Lgr5和Zo-1的mRNA水平均显著增加,MUC2分泌量显著增加(P<0.05)。综上,鼠李糖乳杆菌SW-02具有较好的消化道耐受性和促进肠道类器官生长的能力,可以作为今后开发具有益生性产品的潜在菌株。Abstract: In this study, five strains of Lactobacillus rhamnosus (L. rhamnosus) and two strains of Lactobacillus paracasei (L. paracasei) isolated from infants were used as experimental bacteria and Lactobacillus rhamnosus GG as control strain. The gastrointestinal tolerance of these strains were evaluated through acid resistance test, bile salt resistance test, hydrophobicity test, automatic aggregation ability test and cell adhesion test. L. rhamnosus SW-02, the best effective strain in tolerance evaluation, was co-cultured with intestinal organoids. The morphology and growth status of organoids were observed by inverted phase contrast microscope, and the budding rate was calculated. The proliferation status of organoids was evaluated by EdU staining. The mRNA levels of the proliferation marker Ki67, intestinal stem cell marker Lgr5 and tight junction protein Zo-1 were measured by real-time PCR. The level of MUC2 was detected by enzyme-linked immunosorbent assay. The results showed that compared with other strains, L. rhamnosus SW-02 had strong acid resistance. SW-02, SW-03 and SW-X had strong bile salt resistance. LGG, SW-01, SW-02, SW-04 and TX-02 had high hydrophobicity to xylene. For automatic aggregation capability, SW-01 was the strongest, followed by SW-02. The adhesion test of HT-29 cells showed that SW-01, SW-02 and SW-03 had high adhesion ability. When SW-02 was co-cultured with intestinal organoids, SW-02 significantly (P<0.05) increased the budding rate and number of organoids, and promoted the growth of organoids. Compared with the control group, the mRNA levels of Ki67, Lgr5 and Zo-1 in SW-02 group were significantly increased, and the secretion of MUC2 was significantly increased (P<0.05). In conclusion, L. rhamnosus SW-02 has good gastrointestinal tolerance and the ability to promote the growth of intestinal organs, and can be used as a potential strain for the development of probiotic products in the future.
-
婴儿期是肠道菌群定殖的关键时期,肠道菌群早期定殖模式可以影响肠道生理发育、免疫系统、神经系统等的成熟,影响远期肥胖、过敏性疾病等的发病几率。近年来,国内外大量研究显示肠道微生物参与调控肠道细胞增殖分化,其中,益生菌发挥了极重要的益生作用[1]。益生菌的干预对动物早期肠道形态发育、肠道上皮细胞增殖分化、肠道紧密连接及粘膜屏障形成等肠道发育过程有重要影响[2]。一方面,益生菌可以通过自身组分(如菌毛蛋白、细胞壁成分等)[3]、代谢产物(丁酸等)[4]、分泌蛋白(如鼠李糖乳杆菌LGG分泌的P40和P75)[5]等促进肠道上皮细胞的增殖分化、增强肠道粘膜屏障功能;另一方面,益生菌还可以通过调节肠道菌群结构来调节肠道功能,进而促进机体肠道粘膜免疫功能[6]。
鼠李糖乳杆菌(Lactobacillus rhamnosus)是一种存在于人体肠道中的革兰氏阳性菌。其中,鼠李糖乳杆菌LGG是目前全球研究最为广泛,应用最多的益生菌之一,主要通过平衡肠道菌群、维护肠道屏障结构完整、调节肠道免疫功能和增强肠道免疫力发挥对肠道的保护作用。LGG通过促进肠道紧密连接和黏蛋白表达维护肠道屏障结构完整[7]。LGG的早期定殖(出生后1~5 d)促进了小鼠肠道功能成熟和免疫球蛋白A的产生,同时降低了其成年后对结肠炎的易感性[8]。然而,目前可用于婴幼儿食品的益生菌菌株十分有限,且大多数为国外菌株,因此,筛选具有促进肠道生长发育潜能的鼠李糖乳杆菌,一方面对于研究益生菌调节肠道发育的功能机制具有重要科学价值;另一方面对于开发具有维护婴幼儿肠道健康以及临床肠道损伤修复作用的益生功能食品具有重要意义。
目前,大量用于研究益生菌在肠道发育和肠道疾病中作用的体外模型主要依赖于永生化的细胞系,但由于肠道不同部位的组织具有独特的结构和生理功能,使用单一的离体细胞模型,很难模拟人体肠道的结构、功能,导致研究结果具有局限性。最近的研究表明,离体的肠道干细胞和隐窝可以在基质胶中经由3D培养模式形成肠道类器官[9]。这一结构包含特定组织来源的所有终末分化细胞,在形态和细胞组成上与体内肠道极为相似。来自小肠的肠道类器官由于其隐窝丰富通常是体外研究肠道发育和损伤修复的良好工具[10]。目前已有利用小肠类器官研究益生菌对肠道发育影响的相关报道[11-13]。Wu等[11]研究证实了罗伊氏乳杆菌(Lactobacillus reuteri)D8既可以在生理条件下促进来自小肠的肠道类器官生长增殖,也可以改善TNF-α诱导的肠道类器官的损伤,促进肠道上皮的修复。Hou等[12]利用肠道类器官与固有层淋巴细胞的共培养体系,证明了罗伊氏乳杆菌D8可以通过刺激固有层淋巴细胞分泌IL-22来促进肠道干细胞及肠上皮细胞增殖,进而修复受损的肠道屏障。
本研究以从1月龄健康婴儿粪便中分离鉴定的5株鼠李糖乳杆菌作为实验菌株,比较其耐酸、耐胆盐、表面疏水性、自动聚集能力及黏附性能,筛选出具有优良抗性和黏附性能的鼠李糖乳杆菌SW-02,并进一步利用肠道类器官模型对鼠李糖乳杆菌SW-02的促进肠道细胞增殖、完善肠道紧密连接及粘膜屏障的作用进行评价。
1. 材料与方法
1.1 材料与仪器
实验所用菌株鼠李糖乳杆菌LGG菌株 中国工业微生物菌种保藏中心,菌种保藏号:ATCC 53103;5株鼠李糖乳杆菌SW-01、SW-02、SW-03、SW-04、SW-X和两株副干酪乳杆菌TX-01、TX-02分离自1月龄健康婴儿粪便,保藏于天津科技大学工业微生物菌种资源平台;雄性SPF级C57BL/6小鼠(4周龄) 中国军事医学科学院实验动物中心(北京),动物试验均按照天津科技大学试验动物福利伦理委员会(GB/T 35892-2018)批准的方案进行;人结肠癌细胞HT-29(ATCC HTB-38) 保藏于本实验室,用10%胎牛血清(Fetal bovine serum, FBS)的DMEM/F12培养基中,在37 ℃、5% CO2的条件下培养。
MRS培养基、琼脂粉、琼脂糖、盐酸、牛胆盐、青-链霉素、冰杜尔贝科磷酸盐缓冲液(Dulbecco Phosphate-Buffered Saline,DPBS)、M-MLV逆转录酶(20000~28880 U/mg)、Trizol试剂、4',6-二脒基-2-苯基吲哚(DAPI) 北京索莱宝科技有限公司;DMEM/F12培养基 美国Gibco公司;胎牛血清 新西兰Newzerum公司;温和细胞解离试剂(Gentle Cell Dissociation Reagent,GCDR)、类器官培养基(IntestiCult OGM Mouse Kit) 加拿大干细胞技术有限公司;基质胶(Matrigel Matrix) 美国BD公司;SYBRGreen qPCR Master mix 德国DBI Bioscience公司;EdU检测试剂盒 大连美仑生物技术有限公司;小鼠黏蛋白2(Mucin2,MUC2)检测试剂盒 武汉华美生物工程有限公司;多聚甲醛 天津市江天化工技术股份有限公司;TritonX-100、四甲基偶氮唑盐(MTT) 美国Sigma公司;胎牛血清(FBS) 澳洲Ausbian公司。
TUS-200P振荡型恒温金属浴 中国上海一恒科技有限公司;SW-CJ-1FD型单人单面净化工作台 中国上海沪净医疗器械有限公司;HE-120多功能水平电泳槽 中国上海天能科技有限公司;SKY-2102C生化培养箱 中国上海苏坤实业有限公司;311型CO2培养箱 美国赛默飞世尔科技有限公司;ECLIPSE TE2000U倒置显微镜 日本尼康公司;LDZX-75KBS立式压力蒸汽灭菌器 中国上海申安有限公司;Hybrid TechnologyTM多功能酶标仪 美国伯腾仪器有限公司;StepOnePlusTM实时荧光定量PCR仪 美国应用生物系统公司;JIDI-18D离心机 广州吉迪仪器有限公司;TY-80B脱色摇床 常州润华电器有限公司。
1.2 实验方法
1.2.1 菌株的活化和生长曲线测定
从−80 ℃冰箱取出冻存的菌液,在无菌超净台中划线于固体MRS培养基上,挑取单菌落于5 mL液体MRS培养基中活化两次,将活化的菌体以1%(v/v)的接种量接种于液体MRS培养基中,置于37 ℃恒温孵育器24 h,每隔2 h取样,并在600 nm波长处测定其光密度值,绘制菌株的生长曲线。
1.2.2 供试菌株耐受性实验
1.2.2.1 耐酸性能力测定
参照郝冉等[14]的方法,将离心洗涤后的菌体分别重悬于经溶解度为36%~37%的盐酸调节后pH为1、2、3的液体MRS培养基中,以正常pH的菌液作为对照(正常生长状态的乳酸菌),调整菌液浓度为5×108 CFU/mL。各组分别取100 μL接种于96孔培养板中,37 ℃培养4 h。每孔加入20 μL 5 mg/mL的MTT作用4 h,终止培养后每孔加入100 μL的二甲基亚砜,在室温于转速为100 r/min的摇床上振荡15 min以充分溶解结晶物。利用多功能酶标仪测量570 nm波长处的吸光度(OD)值,存活率按以下公式计算:
存活率(%)=OD实验组OD对照组×100 1.2.2.2 耐胆盐能力测定
参照Liu等[15]的方法,将活化的菌体以108 CFU/mL分别接种在空白对照MRS液体培养基、含有0.1%、0.2%、0.3%胆盐的MRS液体培养基中,以不含胆盐的菌液作为对照(正常生长状态的乳酸菌)。37 ℃培养4 h,采用同1.2.2.1的MTT方法进行检测和计算存活率。
1.2.2.3 菌株疏水率测定
参照杜兰兰等[16]的方法,将活化的菌体以2%(v/v)接种量接种于MRS液体培养基中,37 ℃培养箱中过夜培养。菌液以5000 r/min离心10 min收集菌体,用磷酸盐缓冲液(Phosphate Buffered Saline,PBS,pH7.2)洗涤2次后重悬。利用多功能酶标仪在600 nm处检测其吸光度即初始吸光度值OD0,之后将3 mL细菌悬浮液与600 μL的二甲苯(5:1)混合,漩涡振荡2 min。室温孵育1 h,弃去有机相,取水相于600 nm波长处测定其吸光度值OD1,表面疏水性按以下公式计算:
疏水性(%)=OD0−OD1OD0×100 1.2.2.4 菌株自动聚集率测定
参照杜兰兰等[16]的方法,将活化的菌体以2%(v/v)接种量接种于MRS液体培养基中,37 ℃培养箱中过夜培养。将菌悬液漩涡振荡10 min后在600 nm波长下测定其吸光值作为整个细菌悬液的吸光值(OD0),后放于37 ℃静置孵育。分别在30、60、90、120、150 min时取上层样品,测定其吸光度(OD1)。自动聚集率按以下公式计算:
自动聚集率(%)=OD0−OD1OD0×100 1.2.2.5 对肠道细胞的黏附能力评价
参照Li等[17]的方法评价细菌对结肠癌细胞HT-29的黏附能力。将HT-29细胞接种于96孔板中,待细胞长至单层贴壁状态,1×PBS清洗细胞两次后加入无抗生素和无血清的DMEM/F12培养基预孵育37 ℃培养30 min。将活化的菌体以108 CFU/mL悬浮于无抗生素和无血清的DMEM/F12培养基中以制备细菌悬液,弃去细胞培养板中培养基后每孔加入制备好的细菌悬液100 μL,37 ℃孵育2 h,PBS洗去未黏附的细菌后于波长570 nm处测定吸光值(黏附菌组),以未进行PBS清洗细菌的细胞作为总菌组,以不加细菌悬液的细胞组作为对照组,之后采用同1.2.2.1的MTT方法进行检测和计算黏附能力。计算公式如下:
黏附能力(%)=OD粘附菌组−OD对照组OD总菌组−OD对照组×100 1.2.3 供试菌株对肠道类器官生长的影响
1.2.3.1 类器官的提取与分离
参考Sato等[18]的方法略作修改,在幽门下5 cm处及距回盲部5 cm处分别离断小肠。将小肠放入DPBS中,去除残留的肠系膜及血管,然后用10 mL注射器吸取冰DPBS从靠近幽门端冲洗肠腔,使肠内容物排出。将洗净的小肠剪成5 mm左右的片段,转移至50 mL离心管,冰浴静置至肠片段沉底,弃掉上清,加入25 mL温和细胞解离试剂置于摇床上以20 r/min转速室温孵育15 min,用含有0.1% FBS的PBS终止消化,反复吹吸,自然静置5min吸取上清,以70 μm细胞过滤器过滤收集上清液,沉淀,重复上述吹吸步骤3次。过滤后的上清液于4 ℃以300 g的离心速率离心5 min,弃上清液,分别用预冷的添加1%青-链霉素的PBS和DMEM/F-12培养基重悬沉淀并离心进行清洗。最后加入适当体积类器官生长培养基重悬沉淀,以1:2比例与Matrigel混匀,按每孔50 µL的体积种植到37 ℃预温的24孔板中,放入培养箱中1 h,待基质胶固化后,加入500 µL类器官生长培养基进行培养,每2~3 d换一次培养基,每5~7 d传代一次。
1.2.3.2 类器官与菌株共培养及出芽率、出芽个数的计数
倒置显微镜下观察类器官的生长情况,将类器官以50个/孔的密度接种到24孔板,待1~2 d后生长到具有一定球形类器官结构时与菌株进行共培养。将菌体用类器官生长培养基进行重悬,以1×104 CFU/孔的密度加入到细胞培养板中。实验分为3组进行,对照组(Control)、LGG共培养组和SW-02共培养组。共培养3 d,在光学显微镜下观察类器官生长情况,并计算类器官的出芽率及出芽个数。
1.2.3.3 EdU染色评估类器官的增殖状态
类器官的增殖情况利用EdU细胞增殖检测试剂盒进行,实验步骤参考试剂盒说明书进行。首先对处理后的类器官进行EdU标记,每孔加入200 μL含有50 μmol/L EdU的培养基孵育2 h,弃去培养基。用4%多聚甲醛进行固定,然后利用Apollo®荧光染料进行染色,最后用Hoechst33342对细胞核进行染色以评估总细胞数,并在共聚焦显微镜下观察计数,计算EdU阳性细胞数的比例。
1.2.3.4 实时荧光定量PCR 测定基因mRNA的相对表达量
利用Trizol试剂提取总RNA,取2 μg RNA用M-MLV逆转录酶进行逆转录。PCR扩增体系20 μL:qPCR master mix 10 μL,50×ROX 0.4 μL,上、下游引物各0.5 μL,cDNA模板1 μL,无菌蒸馏水7.6 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火和延伸30 s,40个循环;95 ℃ l min,55 ℃ l min,95 ℃ 15 s绘制熔解曲线。以GAPDH作为参考基因,2−ΔΔCt法计算目标基因mRNA的相对表达量。目标基因的引物序列见表1。
表 1 荧光实时定量PCR引物Table 1. Primers for real-time PCR基因 引物序列(5’→3’) 产物长度(bp) Gapdh F-ATGGTGAAGGTCGGTGTGAA
R-TGGAAGATGGTGATGGGCTT227 Ki67 F-ACCGTGGAGTAGTTTATCTGGG
R-TGTTTCCAGTCCGCTTACTTCT126 Zo-1 F-GTTGGTACGGTGCCCTGAAAGA
R-GCTGACAGGTAGGACAGACGAT133 Lgr5 F-CCTACTCGAAGACTTACCCAGT
R-GCATTGGGGTGAATGATAGCA165 1.2.3.5 酶联免疫吸附试验(ELISA)法测定MUC2含量
类器官与菌体共培养后,离心收集培养基上清,采用酶联免疫吸附法检测培养基上清液中MUC2水平,试剂盒采用小鼠MUC2的ELISA检测试剂盒,检测方法参考说明书进行。最后在450 nm波长测定光密度值,同时根据标准品绘制标准曲线并计算样本中MUC2含量。
1.3 数据处理
数据采用平均值±标准差(mean±SD)表示,每组实验重复3次。运用SPSS 19.0软件,通过One-way ANOVA和Two-way ANOVA进行数据分析,试验数据使用GraphPad Prism 5.0软件进行绘图及拟合处理。P<0.05认为具有统计学显著差异。
2. 结果与分析
2.1 供试菌株的生长曲线测定
通过生长曲线的测定来评价所筛菌株的差异性,结果如图1所示:
由图1可以看出,所有的鼠李糖乳杆菌菌株在0~4 h为生长迟滞期,4~12 h进入对数生长期,OD600由0.1左右迅速提高至1.3左右,此时生长速度较快。12 h后进入稳定期,OD600 基本不变,与对照菌LGG无明显差异。而两株副干酪乳杆菌TX-01和TX-02生长较为缓慢,24 h时OD值分别为1.11和1.06。
2.2 供试菌株的耐受性
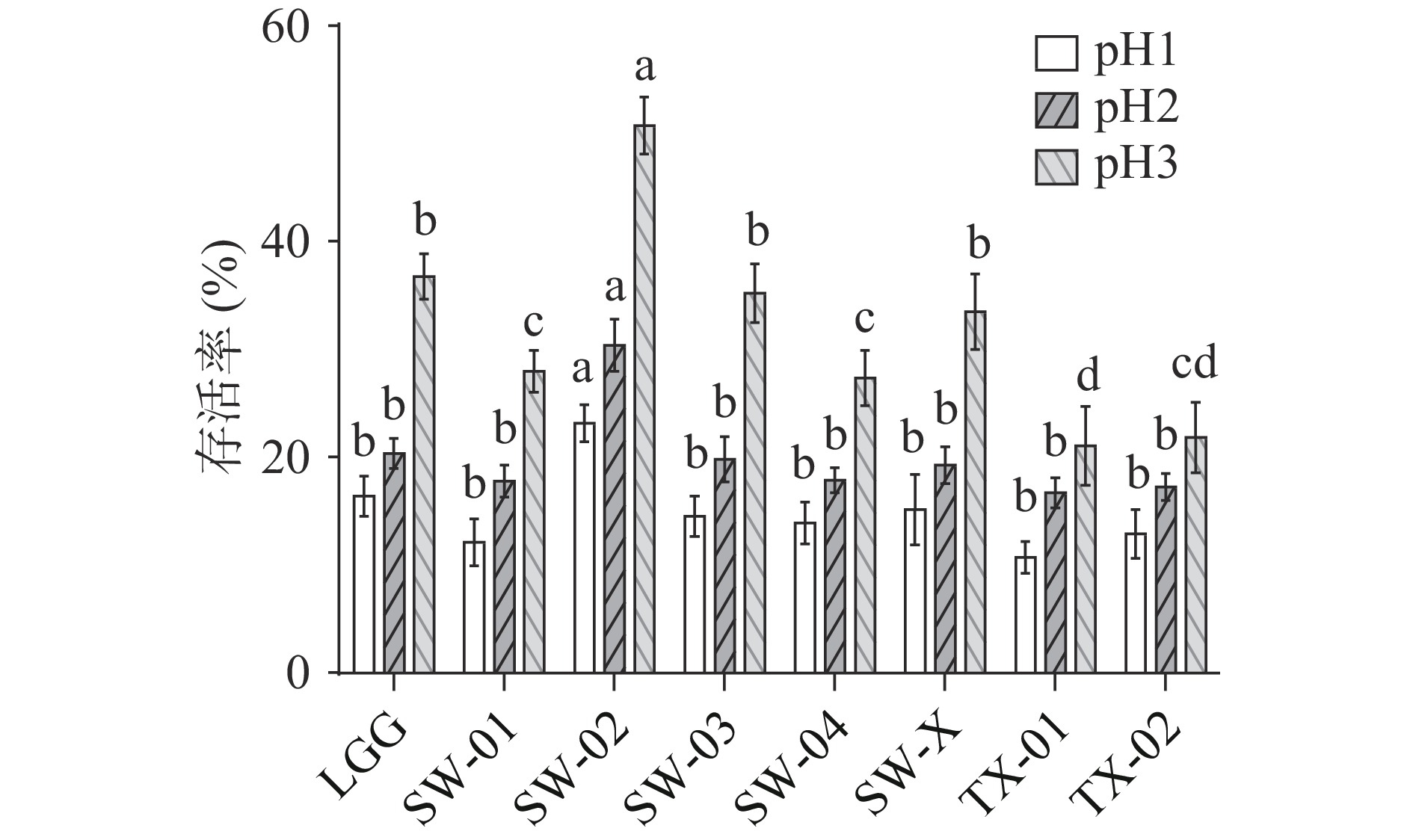
2.2.1 耐酸性能力测试
从图2可以看出:当pH为1、2和3时,鼠李糖乳杆菌SW-02的存活率显著高于商用菌株LGG(P<0.05),存活率分别达到了23.13%±1.75%、30.36%±2.54%和50.73%±2.77%。同时,在pH为3时,鼠李糖乳杆菌SW-03和鼠李糖乳杆菌SW-X的存活率显著高于除SW-02与LGG外的其他四组(P<0.05),存活率分别达到了35.17%±1.49%和33.51%±1.88%,也有较强的耐酸性。这表明SW-02、SW-03和SW-X具有更优的耐酸性,能在高浓度的胃液中存活并进入小肠。郭羽等[19]证实,LGG在pH1.5和2的条件下培养4 h其存活率分别为25.12%和27.96%。贺珊珊等[20]对5株益生菌进行耐酸性筛选,其中鼠李糖乳杆菌LR-D能够短时耐受低pH环境,在pH2.5的发酵液中培养2 h的存活率能够达到14.39%。对照本实验结果,SW-02的耐酸能力与上述菌相比更有优势。
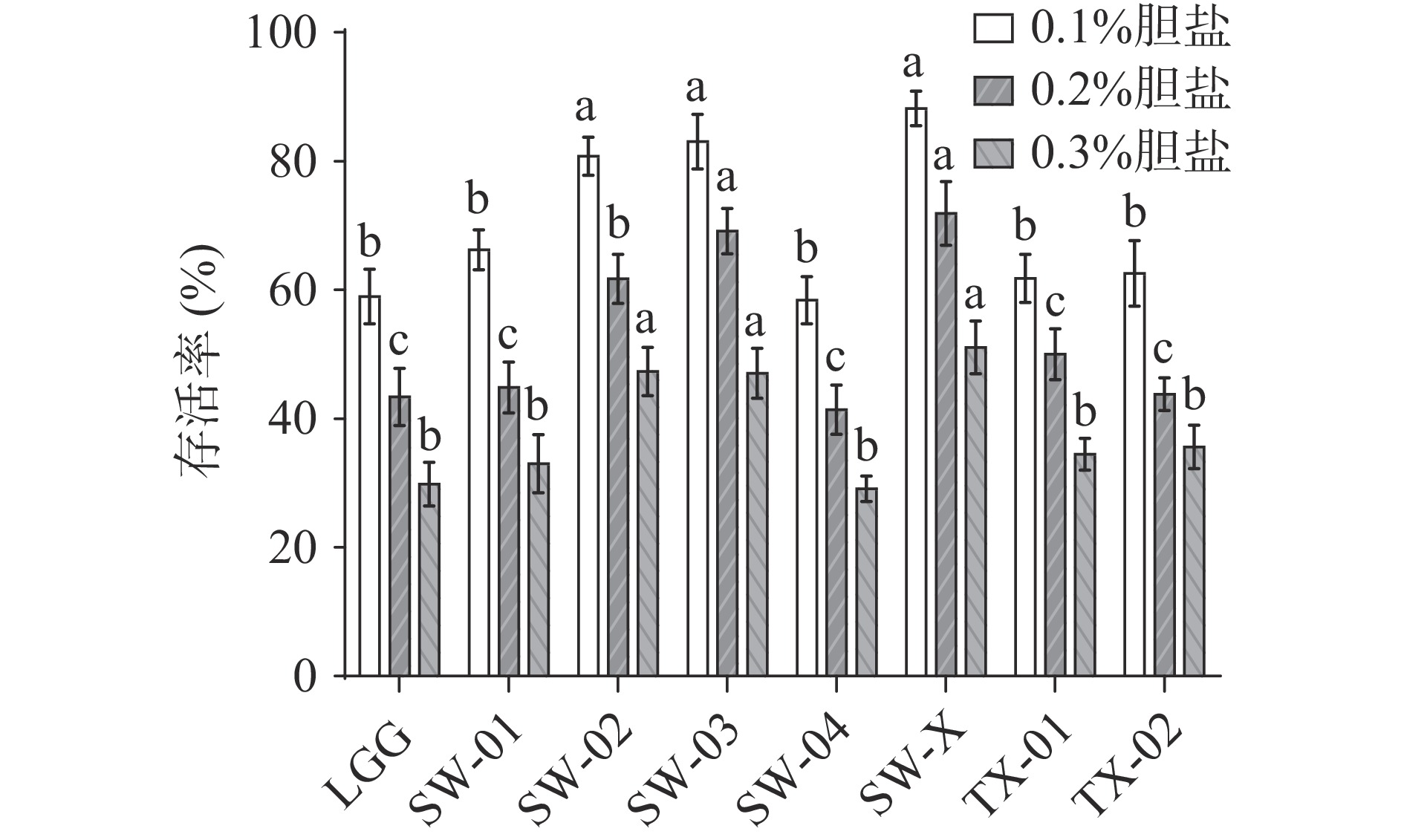
2.2.2 耐胆盐能力测试
从图3可以看出,鼠李糖乳杆菌SW-X、SW-03和SW-02的耐胆盐能力最为突出,显著高于对照菌株鼠李糖乳杆菌LGG和其余菌株(P<0.05),在胆盐浓度为0.3%时,存活率分别达到了51.04%±4.61%、47.02%±4.11%和47.35%±4.21%。而SW-01、SW-04、TX-01和TX-02的存活率与LGG相差不大。这表明,SW-X、SW-03和SW-02具有更优的耐胆盐性。与本文的研究结果相似,吕嘉枥等[21]发现在胆盐浓度为0.1%~0.3%时,LGG菌落存活率为37%~60%。薛梅等[22]发现鼠李糖乳杆菌LV108在胆盐浓度为0.3%时,培养2 h后存活率在45%左右,在胆盐浓度为0.1%时,培养2 h后存活率大于75%。对照本实验结果,SW-X、SW-03和SW-02在相同浓度胆盐处理4 h时,存活率与鼠李糖乳杆菌LV108处理2 h时结果相似,表明本实验筛选菌株SW-X、SW-03和SW-02具有更好的耐胆盐能力。
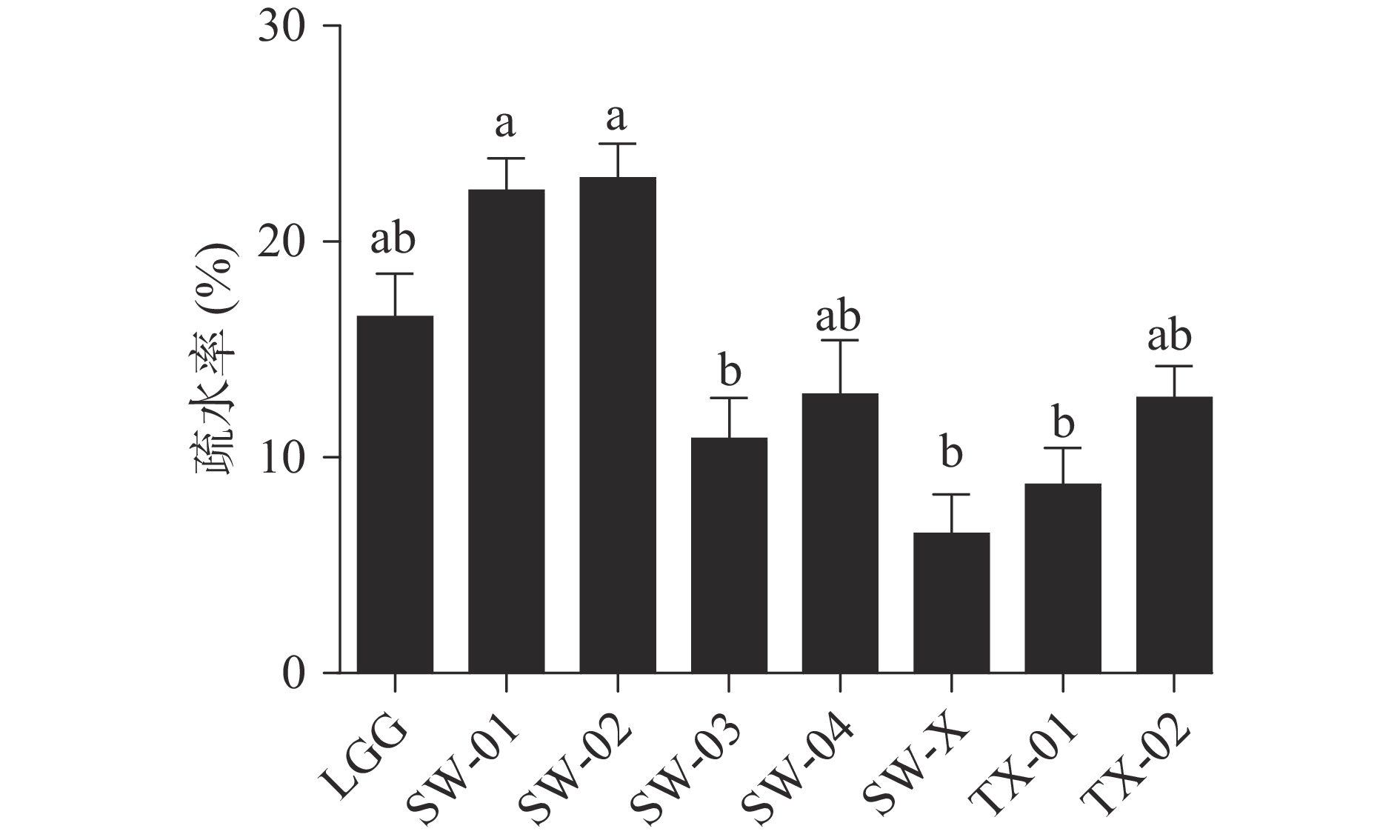
2.2.3 疏水率和自动聚集率测定
研究表明,细菌的疏水性能力、自动聚集能力和细菌的黏附性能存在一定的相关性,疏水性和自动聚集能力越高,其粘附性越好[23]。因此,通过疏水性实验和自动聚集实验,来测定菌株对HT-29细胞的粘附性,以评价菌株在肠上皮的粘附能力。结果如图4、图5所示:
从图4可以看出,细菌表面疏水性实验中,不同菌株的疏水性能力出现出明显的差异,SW-02、SW-01、LGG、SW-04和TX-02的疏水率相对较高,分别为22.94%±1.80%、22.36%±1.68%、16.52%±2.10%、12.90%±2.53%和12.76%±1.75%,而SW-03、SW-X和TX-01的疏水性能力相对较差,分别为10.87%±2.07%、6.46%±1.80%和8.74%±1.69%。杜兰兰等[16]的研究表明,LGG对二甲苯的疏水率为9.85%±1.25%。李珊珊等[24]的研究表明,鼠李糖乳杆菌ATCC7469对二甲苯的疏水率为15%左右,对照本实验结果,SW-02和SW-01的疏水性能力与上述菌相比更有优势。
从图5可以看出,自动聚集能力实验中,各菌株之间的自动聚集率表现出明显的差异。在2.5 h时,SW-01自动聚集率最高,为14.46%±1.20%,SW-02和SW-03次之,自动聚集率分别达到了11.55%±0.89%和10.57%±1.04%。龚虹等[23]认为自动聚集能力高的细菌,其表面疏水性也高。本研究中对比表面疏水性能力和自动聚集能力结果发现SW-01和SW-02的表面疏水性与自动聚集能力均较高。
2.2.4 供试菌株对结肠癌细胞HT-29黏附能力的测定
为了进一步验证菌株对肠道上皮细胞的黏附能力,利用HT-29细胞测定了各菌株对细胞的粘附能力。结果如图6所示:
从图6可以看出,与对照菌株LGG相比,菌株SW-02、SW-01和SW-03均表现出较高的黏附能力,黏附率分别为17.42%±1.22%、14.01%±1.82%和12.52%±1.43%。菌株TX-01和TX-02的黏附能力最差,黏附率均显著低于对照菌株LGG(P<0.05)。与本文的研究结果相似,唐雅茹等[25]测得植物乳杆菌KLDS1.0386对肠上皮细胞的黏附率为16.65%。在本研究中,通过对菌株生长曲线、耐酸耐胆盐实验、疏水性实验和自动聚集能力实验以及细胞黏附实验的测定,综合判断发现从健康婴儿中分离获得的菌株SW-02的耐受性较好,因此后续对鼠李糖乳杆菌SW-02的促肠道类器官生长作用进行评价。
2.3 鼠李糖乳杆菌SW-02对肠道类器官的影响
2.3.1 鼠李糖乳杆菌SW-02对肠道类器官生长的影响
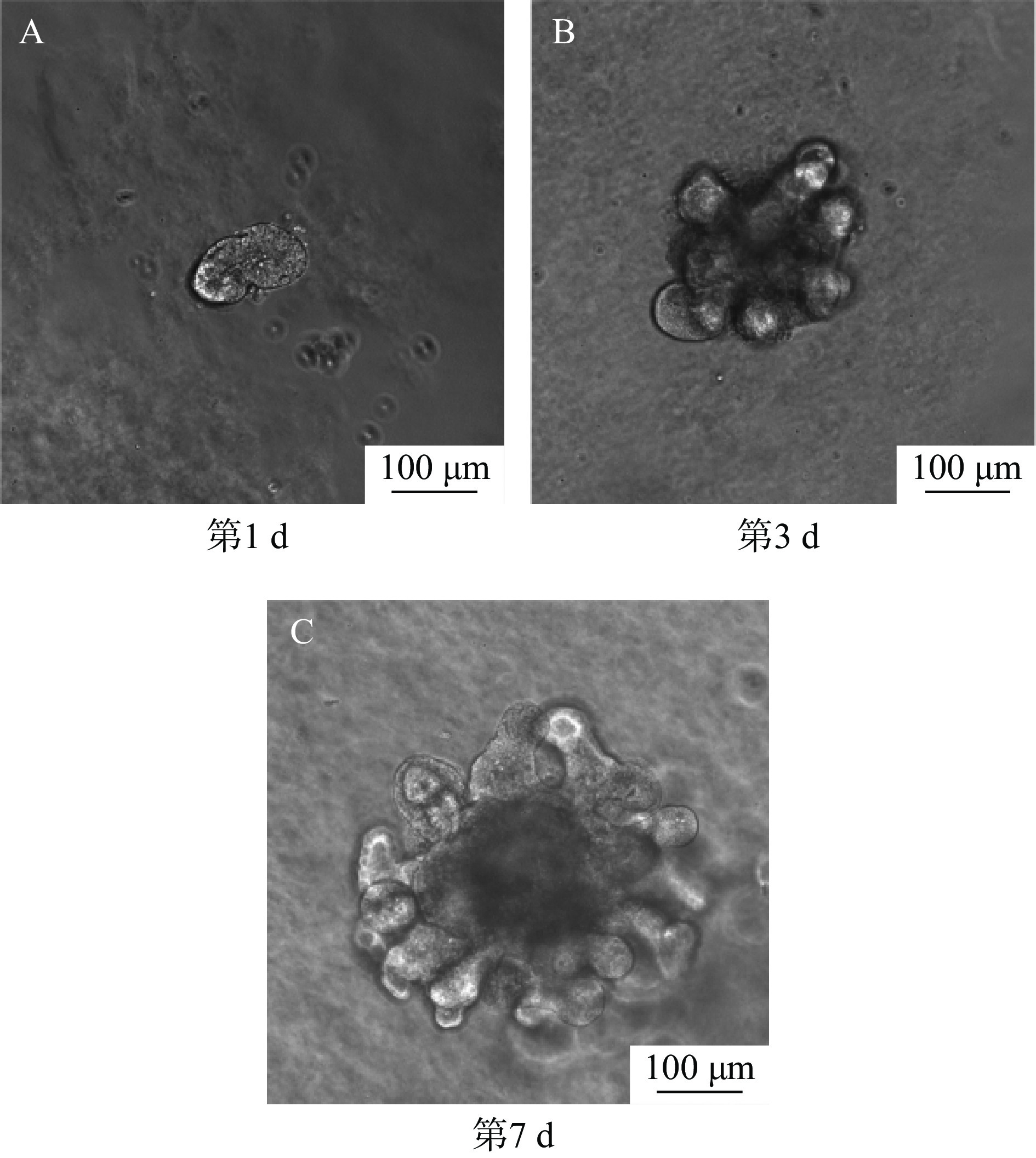
从小鼠小肠中分离隐窝,并进行长期传代培养形成肠道类器官,结果如图7所示。
分离的肠道隐窝数小时至1 d内闭合构成球形结构(图7A),其中心可见内腔,随着肠道干细胞的自我更新、不断增殖,2~3 d左右形成出芽结构并向外突出生长(图7B),经6~7 d培养后类器官最后可形成多个出芽结构,演化成为典型的肠道类器官(图7C)。后续视类器官的生长情况5~7 d可传代1次,冻存、复苏后均有活力。
为了进一步评价鼠李糖乳杆菌SW-02对肠道类器官生长的影响,以LGG作为对照菌株,将SW-02与肠道类器官进行共培养,结果如图8所示。
从图8可以看出,与对照组相比,与鼠李糖乳杆菌SW-02共培养的类器官体积明显增大,同时SW-02显著提高了类器官的出芽率和出芽个数(P<0.05)。这说明SW-02能促进干细胞的增殖和分化,促进了肠道类器官的生长。类器官具有某些与来源器官相似的结构特征和功能特性,而且能够在体外3D培养体系中稳定扩增,因此在生物学基础研究、构建疾病模型、肿瘤研究、组织再生修复、基因治疗以及药物筛选等方面显示出了广阔的应用前景[26]。Lukovac等[27]利用肠道类器官模型,研究了益生菌的代谢产物短链脂肪酸(Short Chain Fatty Acids,SCFA)及嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和普氏粪杆菌(Faecalibacterium prausnitzii)的代谢产物对肠道类器官中基因转录水平的影响。与本文的研究结果相似,罗伊氏乳杆菌D8可以促进小鼠肠道类器官生长增殖[11-12]。Sittipo等[13]证实热灭活的嗜酸乳杆菌可以使辐射所致损伤的肠道类器官恢复生长,提高出芽率。
2.3.2 EdU染色检测鼠李糖乳杆菌SW-02对肠道类器官中细胞增殖的影响
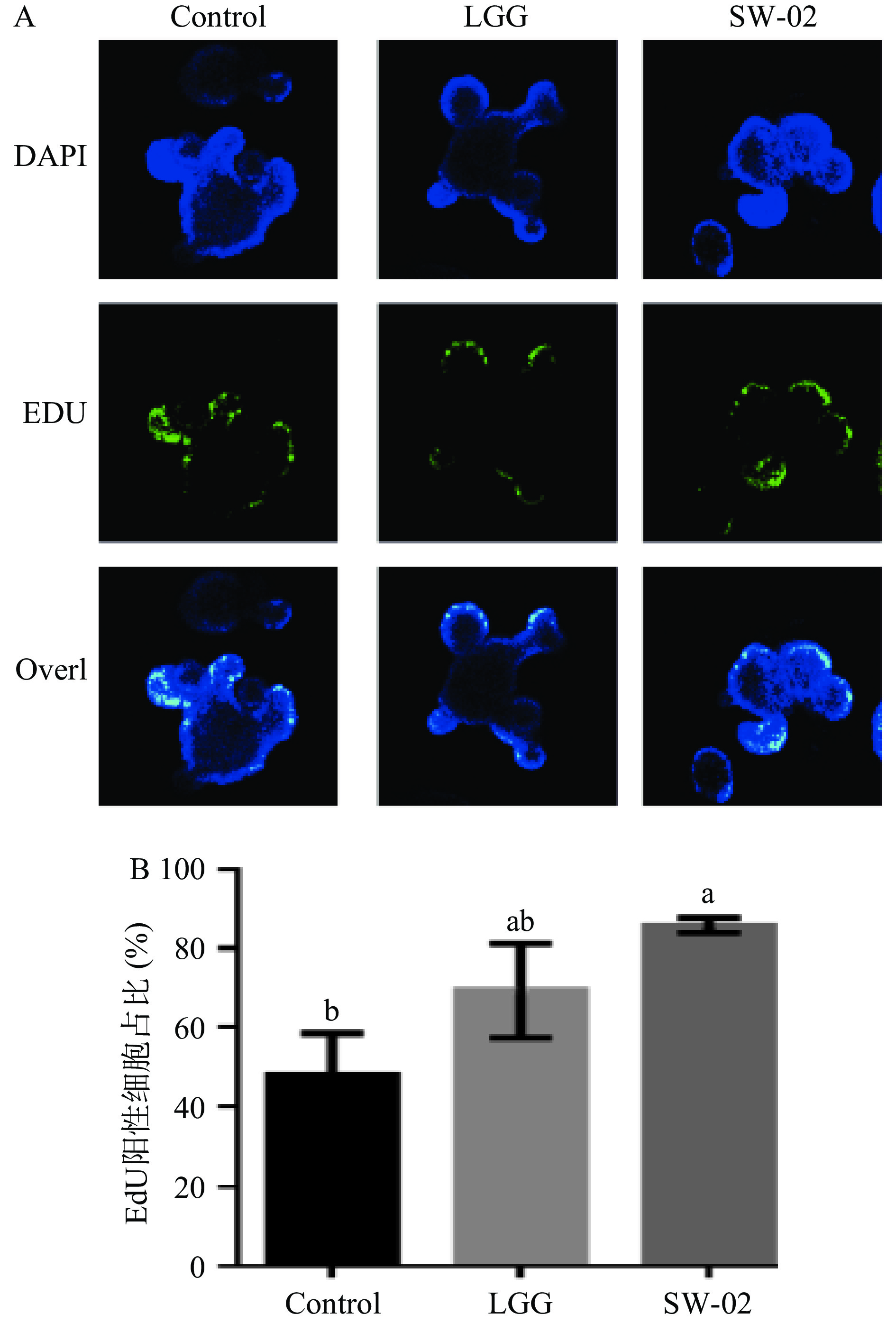
利用EdU染色评价了鼠李糖乳杆菌SW-02肠道类器官中细胞增殖的影响,结果如图9所示。
从图9可以看出,鼠李糖乳杆菌SW-02能促进类器官中细胞的增殖,EdU阳性细胞的百分比为85.2%±2.7%,显著高于对照组的45%±0.9%(P<0.05)。与LGG共培养的类器官中EdU阳性细胞的百分比为69.9%±5.5%。这说明SW-02的刺激,能够促进肠上皮细胞的增殖。相似地,Wu等[11]和Hou等[12]两个研究工作均证实罗伊氏乳杆菌D8可以上调肠道类器官中EdU阳性细胞数。
2.3.3 鼠李糖乳杆菌SW-02对肠道类器官中相关基因mRNA水平的影响
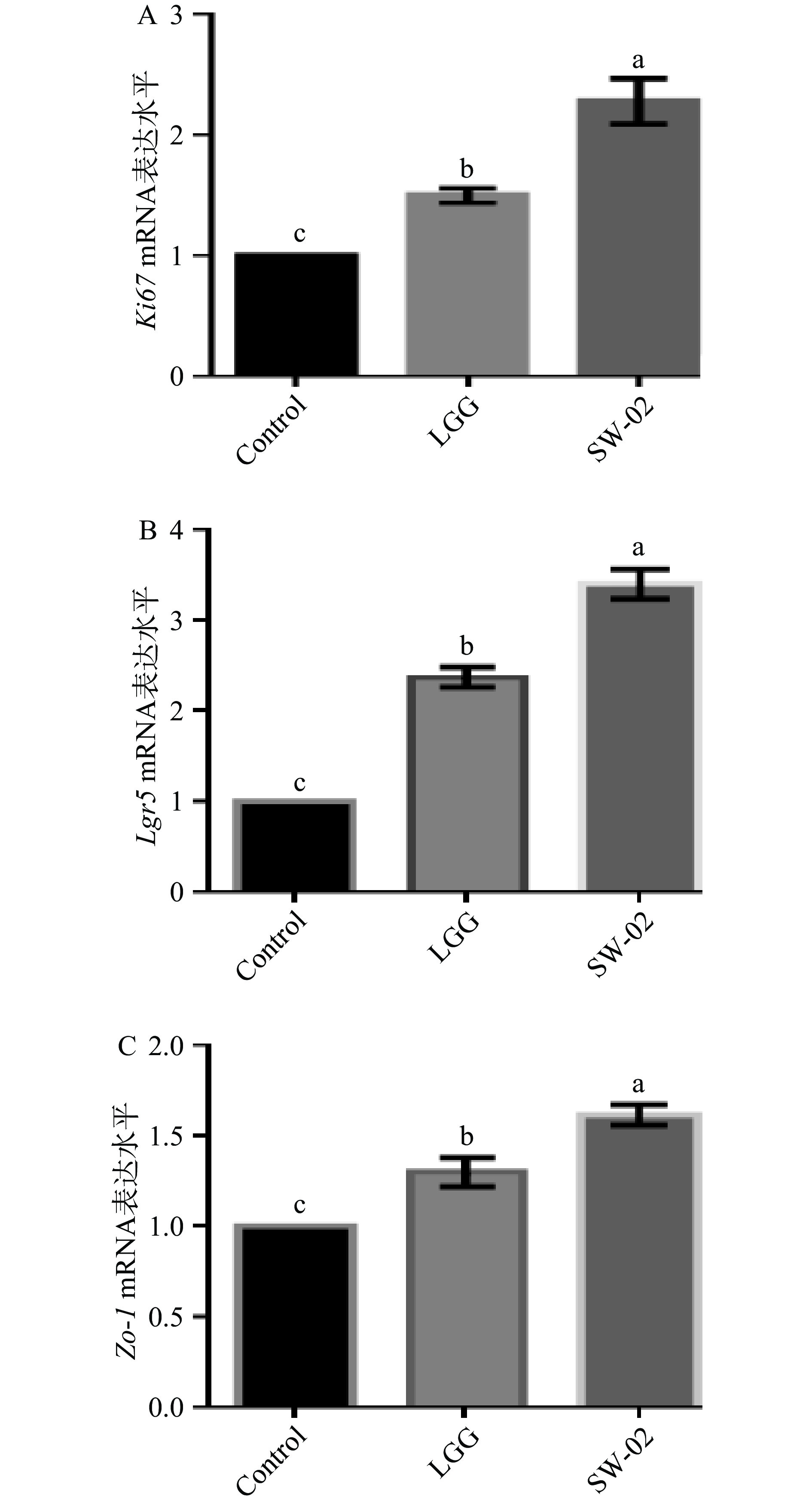
Lgr5是肠道干细胞的标记物,Lgr5阳性细胞能够分化为所有类型的肠道上皮细胞[28],Ki67是一种增殖细胞的相关抗原,其功能与有丝分裂密切相关[29]。紧密连接蛋白Zo-1对于上调上皮增殖和促进有丝分裂的完成具有至关重要的作用[30]。因此本研究利用Real-time PCR检测了肠道干细胞标志物Lgr5、细胞增殖相关基因Ki67和紧密连接蛋白Zo-1的mRNA水平,结果如图10所示。
从图10可以看出,SW-02的刺激显著促进了Lgr5的表达(P<0.05);同时,Ki67的表达出现了明显上调的趋势,这与肠道类器官EdU染色的结果一致;紧密连接蛋白Zo-1的mRNA水平也呈显著上调的趋势(P<0.05)。这些结果进一步说明鼠李糖乳杆菌SW-02可以促进肠道类器官的生长,促进肠道屏障的成熟。Sittipo等[13]证实热灭活的嗜酸乳杆菌可以上调辐射所致损伤的肠道类器官的Lgr5的mRNA水平。Ki67是肠道上皮细胞增殖能力和肠道发育程度的常用检测指标[9, 11, 31-32],已有多项关于益生菌及其蛋白对小肠类器官及乳鼠小肠组织中Ki67的影响的相关报道[9, 11, 31-32]。与本研究结果相似,Wu等[11]证实罗伊氏乳杆菌D8增加了小鼠小肠类器官中Ki67的mRNA水平。
2.3.4 鼠李糖乳杆菌SW-02对肠道类器官中黏蛋白MUC2表达的影响
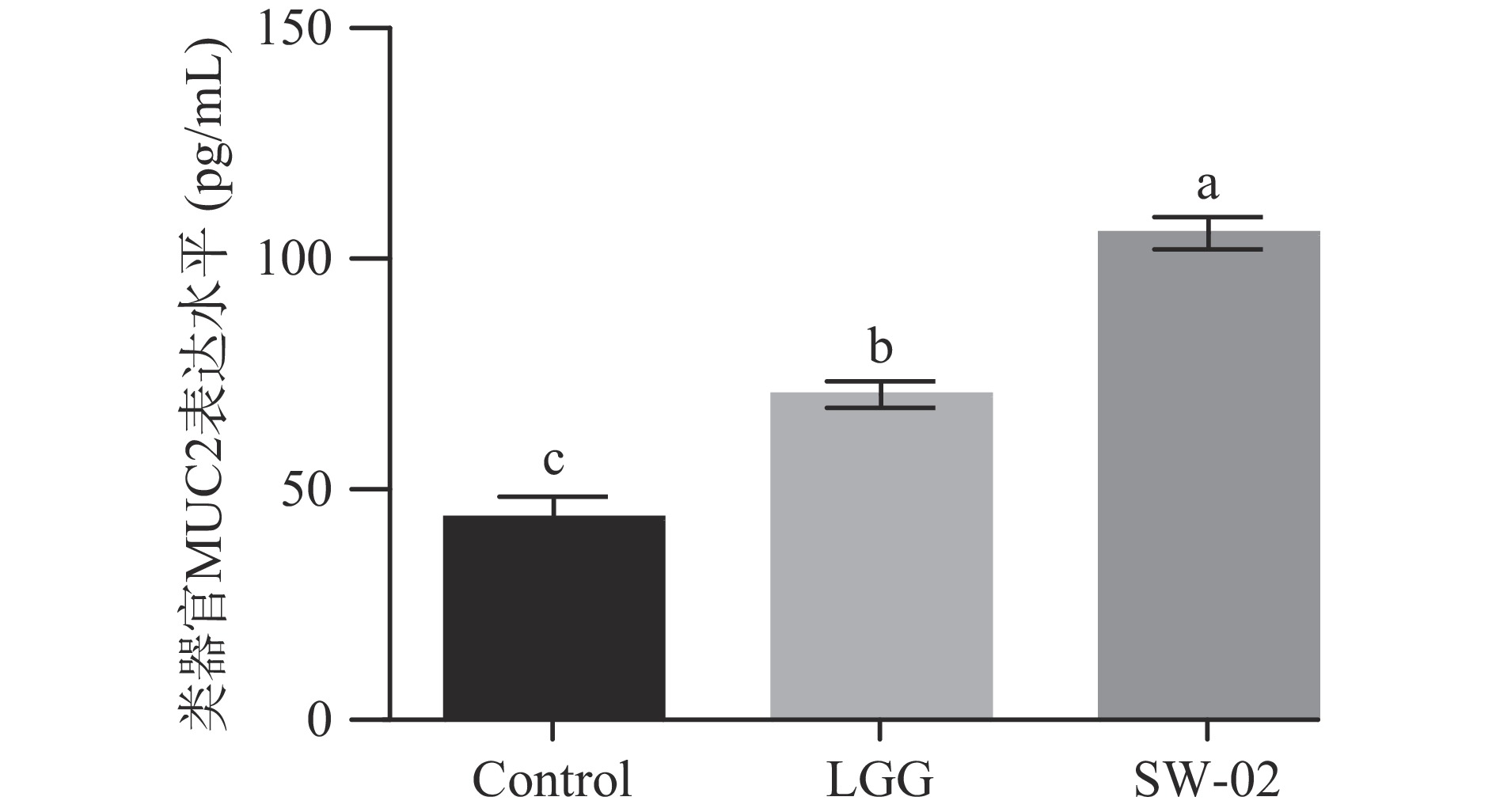
为了研究鼠李糖乳杆菌SW-02对肠道粘膜屏障的影响,利用ELISA的方法检测了鼠李糖乳杆菌SW-02对MUC2表达的影响,结果如图11所示。
从图11可以看出,与对照组相比,SW-02的处理明显促进了MUC2的分泌。这些结果说明鼠李糖乳杆菌SW-02有助于肠道粘膜屏障的完善。研究证实热灭活的嗜酸乳杆菌可以上调辐射所致损伤的肠道类器官中Muc-2的mRNA水平[13]。与这些研究相似,本研究中通过建立体外肠道类器官模型,发现鼠李糖乳杆菌SW-02在肠道类器官的出芽个数、出芽率、增殖情况等方面具有显著促进作用,同时可以上调Lgr5、Ki67、Zo-1的mRNA相对表达量和粘蛋白MUC2分泌。
3. 结论
综上所述,本研究以从一月龄健康婴儿粪便中分离的5株鼠李糖乳杆菌作为实验菌株,以LGG为对照菌株,通过耐酸、耐胆盐、疏水性、自动聚集和细胞粘附性实验,筛选出具有良好抗性的鼠李糖乳杆菌SW-02。进一步通过构建肠道类器官模型,发现鼠李糖乳杆菌SW-02能够促进肠道类器官的生长增殖、促进肠道紧密连接蛋白和粘蛋白MUC2的表达,有利于肠道屏障的完善。以上研究结果表明鼠李糖乳杆菌SW-02具有潜在的应用价值,有望成为商业开发的备选菌株。
-
表 1 荧光实时定量PCR引物
Table 1 Primers for real-time PCR
基因 引物序列(5’→3’) 产物长度(bp) Gapdh F-ATGGTGAAGGTCGGTGTGAA
R-TGGAAGATGGTGATGGGCTT227 Ki67 F-ACCGTGGAGTAGTTTATCTGGG
R-TGTTTCCAGTCCGCTTACTTCT126 Zo-1 F-GTTGGTACGGTGCCCTGAAAGA
R-GCTGACAGGTAGGACAGACGAT133 Lgr5 F-CCTACTCGAAGACTTACCCAGT
R-GCATTGGGGTGAATGATAGCA165 -
[1] 关嘉琦, 李柏良, 焦雯姝, 等. 益生菌对促进肠道发育作用的研究进展[J]. 食品科学,2020,41(21):278−285. [GUAN Jiaqi, LI Boliang, JIAO Wenshu, et al. Research progress of probiotics on promoting intestinal development[J]. Food Science,2020,41(21):278−285. doi: 10.7506/spkx1002-6630-20191015-132 GUAN Jiaqi, LI Boliang, JIAO Wenshu, et al. Research progress of probiotics on promoting intestinal development[J]. Food Science, 2020, 41(21): 278−285. doi: 10.7506/spkx1002-6630-20191015-132
[2] COLLADO M C, CERNADA M, BAÜERL C, et al. Microbial ecology and host-microbiota interactions during early life stages[J]. Gut Microbes,2012,3:352−365. doi: 10.4161/gmic.21215
[3] HIEMSTRA I H, BOUMA G, GEERTS D, et al. Nod2 improves barrier function of intestinal epithelial cells via enhancement of TLR responses[J]. Molecular Immunology,2012,52(3-4):264−272. doi: 10.1016/j.molimm.2012.06.007
[4] BANSAL T, ALANIZ R, JAYARAMAN A. Role for the bacterial signal indole in promoting epithelial cell barrier function[J]. Journal of Epithelial Biology and Pharmacology,2012,5(1):32−38. doi: 10.2174/1875044301205010032
[5] YAN F, CAO H W, COVER T L, et al. Colon-specific delivery of a probiotic-derived soluble protein ameliorates intestinal inflammation in mice through an EGFR-dependent mechanism[J]. Journal of Clinical Investigation,2011,121(6):2242−2253. doi: 10.1172/JCI44031
[6] YAN F, POLK D B. Probiotics and probiotic-derived functional factors-mechanistic insights into applications for intestinal homeostasis[J]. Frontiers in Immunology,2020,11:1428.
[7] HAN X, LEE A, HUANG S, et al. Lactobacillus rhamnosus GG prevents epithelial barrier dysfunction induced by interferon-gamma and fecal supernatants from irritable bowel syndrome patients in human intestinal enteroids and colonoids[J]. Gut Microbes,2019,10(1):59−76. doi: 10.1080/19490976.2018.1479625
[8] ALLAIRE J M, CROWLEY S M, LAW H T, et al. The intestinal epithelium: Central coordinator of mucosal immunity[J]. Trends in Immunology, 2018: S1471490618300681.
[9] YAN F, LIU L, CAO H, et al. Neonatal colonization of mice with LGG promotes intestinal development and decreases susceptibility to colitis in adulthood[J]. Mucosal Immunology,2017,10(1):117−127. doi: 10.1038/mi.2016.43
[10] LINDEMANS C A, CALAFIORE M, MERTELSMANN A M, et al. Interleukin-22 promotes intestinal-stem-cell-mediated epithelial regeneration[J]. Nature,2015,528(7583):560−564. doi: 10.1038/nature16460
[11] WU H, XIE S, MIAO J, et al. Lactobacillus reuteri maintains intestinal epithelial regeneration and repairs damaged intestinal mucosa[J]. Gut Microbes,2020,11(4):997−1014. doi: 10.1080/19490976.2020.1734423
[12] HOU Q, YE L, LIU H, et al. Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22[J]. Cell Death & Differentiation,2018,25(9):1657−1670.
[13] SITTIPO P, PHAM H Q, PARK C E, et al. Irradiation-induced intestinal damage is recovered by the indigenous gut bacteria Lactobacillus acidophilus[J]. Frontiers in Cellular and Infection Microbiology,2020,10:415. doi: 10.3389/fcimb.2020.00415
[14] 郝冉, 罗学刚, 贾玮, 等. 六株乳杆菌胃肠道定植能力分析[J]. 中国生化药物杂志, 2012, 33(5): 555-558 HAO Ran, LUO Xuegang, JIA Wei, et al. Analysis of the colonization ability of six strains of Lactobacillus in the gastrointestinal tract[J]. Chinese Journal of Biochemical Pharmaceutics, 2012, 33(5): 555−558.
[15] LIU M, ZHANG X, HAO Y, et al. Protective effects of a novel probiotic strain, Lactococcus lactis ML2018, in colitis: In vivo and in vitro evidence[J]. Food & Function, 2019, 10: 1132−1145.
[16] 杜兰兰, 王洋, 刘蕾, 等. 类植物乳杆菌L-ZS9黏附特性研究及胃肠道环境对其黏附力的影响[J]. 食品科技,2015,40(12):2−6, 14. [DU Lanlan, WANG Yang, LIU Lei, et al. Study on the adhesion characteristics of Lactobacillus plantarum L-ZS9 and the influence of gastrointestinal environment on its adhesion[J]. Food Science and Technology,2015,40(12):2−6, 14. DU Lanlan, WANG Yang, LIU Lei, et al. Study on the adhesion characteristics of Lactobacillus plantarum L-ZS9 and the influence of gastrointestinal environment on its adhesion[J]. Food Science and Technology, 2015, 40(12): 2−6, 14.
[17] LI Y, ZHANG T, GUO C, et al. Bacillus subtilis RZ001 improves intestinal integrity and alleviates colitis by inhibiting the Notch signalling pathway and activating ATOH-1[J]. Pathogens and Disease,2020,78(2):ftaa016. doi: 10.1093/femspd/ftaa016
[18] SATO T, VRIES R G, SNIPPERT H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature,2009,459(7244):262−265. doi: 10.1038/nature07935
[19] 郭羽, 王晓. 黄芪多糖对鼠李糖乳杆菌促生长作用初探[J]. 山西中医学院学报,2018,19(4):10−14. [GUO Yu, WANG Xiao. A preliminary study on the growth-promoting effect of astragalus polysaccharides on Lactobacillus rhamnosus[J]. Journal of Shanxi College of Traditional Chinese Medicine,2018,19(4):10−14. GUO Yu, WANG Xiao. A preliminary study on the growth-promoting effect of astragalus polysaccharides on Lactobacillus rhamnosus[J]. Journal of Shanxi College of Traditional Chinese Medicine, 2018, 19(4): 10−14.
[20] 贺珊珊, 鲍志宁, 林伟锋, 等. 降胆固醇和耐酸耐胆盐益生菌的筛选研究[J]. 现代食品科技,2019,35(8):198−206. [HE Shanshan, BAO Zhining, LIN Weifeng, et al. Study on the screening of cholesterol and acid-resistant salt probiotics[J]. Modern Food Science and Technology,2019,35(8):198−206. doi: 10.13982/j.mfst.1673-9078.2019.8.029 HE Shanshan, BAO Zhining, LIN Weifeng, et al. Study on the screening of cholesterol and acid-resistant salt probiotics[J]. Modern Food Science and Technology, 2019, 35 (8): 198-206. doi: 10.13982/j.mfst.1673-9078.2019.8.029
[21] 吕嘉枥, 闫亚梅, 王霄鹏, 等. 10株益生菌益生特性的比较研究[J]. 陕西科技大学学报(自然科学版),2016,34(1):118−122, 127. [LYU Jiali, YAN Yamei, WANG Xiaopeng, et al. Comparative study on the probiotic characteristics of 10 probiotics[J]. Journal of Shaanxi University of Science and Technology (Natural Science Edition),2016,34(1):118−122, 127. LYU Jiali, YAN Yamei, WANG Xiaopeng, et al. Comparative study on the probiotic characteristics of 10 probiotics[J]. Journal of Shaanxi University of Science and Technology (Natural Science Edition), 2016, 34(1): 118−122, 127.
[22] 薛梅, 刘东方, 桑建, 等. 鼠李糖乳杆菌LV108传代的稳定性[J]. 中国乳品工业,2016,44(7):15−19. [XUE Mei, LIU Dongfang, SANG Jian, et al. Stability of rats Lactobacillus LV108[J]. China Dairy Industry,2016,44(7):15−19. doi: 10.3969/j.issn.1001-2230.2016.07.004 XUE Mei, LIU Dongfang, SANG Jian, et al. Stability of Rats Lactobacillus LV108[J]. China Dairy Industry, 2016, 44 (7): 15-19. doi: 10.3969/j.issn.1001-2230.2016.07.004
[23] 龚虹, 王海霞, 马征途, 等. 乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J]. 中国微生态学杂志,2016,28(9):1026−1028. [GONG Hong, WANG Haixia, MA Zhengtu, et al. Study on the adhesion and biofilm, hydrophobicity and self-aggregation characteristics of lactic acid bacteria[J]. Chinese Journal of Microecology,2016,28(9):1026−1028. GONG Hong, WANG Haixia, MA Zhengtu, et al. Study on the adhesion and biofilm, hydrophobicity and self-aggregation characteristics of lactic acid bacteria[J]. Chinese Journal of Microecology 2016, 28(9): 1026−1028.
[24] 李姗姗, 张俊娟, 杨雪娟, 等. 益生乳杆菌的筛选研究[J]. 中国乳品工业,2012,40(5):4−8. [LI Shanshan, ZHANG Junjuan, YANG Xuejuan, et al. Study on the screening of probiotics[J]. China Dairy Industry,2012,40(5):4−8. doi: 10.3969/j.issn.1001-2230.2012.05.001 Li Shanshan, Zhang Junjuan, Yang Xuejuan, et al. Study on the screening of probiotics[J]. China Dairy Industry, 2012, 40 (5): 4-8. doi: 10.3969/j.issn.1001-2230.2012.05.001
[25] 唐雅茹, 于上富, 国立东, 等. 一株降胆固醇乳杆菌的筛选及其益生作用的研究[J]. 食品工业科技,2016,37(1):142−144. [TANG Yaru, YU Shangfu, GUO Lidong, et al. Screening of a cholesterol lowering Lactobacillus and its prebiotic effect[J]. Food Industry Science and Technology,2016,37(1):142−144. TANG Yaru, YU Shangfu, GUO Lidong, et al Screening of a cholesterol lowering Lactobacillus and its prebiotic effect[J]. Food Industry Science and Technology, 2016, 37 (1): 142-144.
[26] 杨桃, 孙宇, 陈佳佳, 等. 类器官的研究进展[J]. 中国细胞生物学学报,2019,41(3):494−500. [YANG Tao, SUN Yu, CHEN Jiajia, et al. Research progress in organoids[J]. Chinese Journal of Cell Biology,2019,41(3):494−500. YANG Tao, SUN Yu, CHEN Jiajia, et al. Research progress in organoids[J]. Chinese Journal of Cell Biology, 2019, 41(3): 494−500.
[27] LUKOVAC S, BELZER C, PELLIS L, et al. Differential Modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids[J]. MBio,2014,5(4):e01438−14.
[28] 沈颖, 郭红梅, 金玉. 肠道干细胞G蛋白耦联受体5的作用机制与影响因素[J]. 医学研究生学报,2018,31(9):101−104. [SHEN Ying, GUO Hongmei, JIN Yu. Mechanism and influencing factors of G protein-coupled receptor 5 in intestinal stem cells[J]. Journal of Medical Postgraduates,2018,31(9):101−104. doi: 10.16571/j.cnki.1008-8199.2018.09.019 SHEN Ying, GUO Hongmei, JIN Yu. Mechanism and influencing factors of G protein-coupled receptor 5 in intestinal stem cells[J]. Journal of Medical Postgraduates, 2018, 31(9): 101−104. doi: 10.16571/j.cnki.1008-8199.2018.09.019
[29] 刘伟, 余英豪, 欧阳学农, 等. P53和Ki67在胃癌中的表达及其临床意义[J]. 世界华人消化杂志,2011,19(4):367−373. [LIU Wei, YU Yinghao, OUYANG Xuenong, et al. Expression of P53 and Ki67 in gastric cancer and its clinical significance[J]. World Chinese Journal of Digestion,2011,19(4):367−373. LIU Wei, YU Yinghao, OUYANG Xuenong, et al. Expression of P53 and Ki67 in gastric cancer and its clinical significance[J]. World Chinese Journal of Digestion, 2011, 19(4): 367−373.
[30] KUO W T, ZUO L, ODENWALD M A, et al. The tight junction protein ZO-1 is dispensable for barrier function but critical for effective mucosal repair[J]. Gastroenterology,2021,161(6):1924−1939. doi: 10.1053/j.gastro.2021.08.047
[31] LEE Y S, KIM T Y, KIM Y, et al. Microbiota-derived lactate accelerates intestinal stem-cell-mediated epithelial development[J]. Cell Host & Microbe,2018,24(6):833−846.
[32] SHEN X, LIU L, PEEK R M, et al. Supplementation of p40, a Lactobacillus rhamnosus GG-derived protein, in early life promotes epidermal growth factor receptor-dependent intestinal development and long-term health outcomes[J]. Mucosal Immunology,2018,11(5):1316−1328. doi: 10.1038/s41385-018-0034-3
-
期刊类型引用(3)
1. 隋昕,孙绍春,孙猛,赵岩,孙佳彤,周晏起. 番石榴果实品质及其影响因素研究进展. 中国果树. 2024(07): 34-41 .  百度学术
百度学术
2. 彭丝兰,刘思思,易有金,刘汝宽,李昌珠,肖志红. 基于气相色谱-离子迁移谱技术分析不同预处理技术对压榨山茶油风味的影响. 中国油脂. 2024(08): 48-55 .  百度学术
百度学术
3. 姚力为,邓静,易宇文,刘阳,朱开宪,吴华昌. 烹饪熟度对牛排挥发性风味物质的影响研究. 中国调味品. 2024(09): 47-53 .  百度学术
百度学术
其他类型引用(0)









 下载:
下载:




 下载:
下载:



