Effects of Nitric Oxide on Storage Quality and Microstructure of Seedless White Grape Stem
-
摘要: 为研究NO处理对贮藏过程中无核白葡萄理化品质、色素物质积累和微观结构的影响,本实验以无核白葡萄为研究试材,分别采用500 μL/L NO和空气熏蒸葡萄2 h,在0±0.5 ℃下冷藏25 d后,并模拟货架条件下放置3 d,货架温度分别为8±0.5 ℃和20±0.5 ℃。结果表明,与对照组相比,NO熏蒸处理显著减缓了葡萄果梗失重和电导率的增加,抑制了叶绿素降解和花青素的积累;NO处理减少了果梗表面裂纹数量、开裂强度、木质部中无机物的消耗,从而减缓了局部组织的凹陷程度。组织染色分析发现,NO维持了果梗表皮细胞的体积,减缓了细胞壁增厚及其木栓化,抑制了表皮棕色物质的积累。综上所述,NO处理有利于保持葡萄果梗品质,通过抑制叶绿素降解和花青素积累来延迟果梗的褐变,保持葡萄果梗微观结构的完整性。Abstract: In order to study the effect of nitric oxide (NO) on the physicochemical quality, pigment accumulation and microstructure of thompson seedless grape during storage. The grapes were fumigated with 500 μL/L NO or air for 2 h and then stored at 0±0.5 ℃ for 25 days, afterwards the grapes were separately moved to simulated shelf conditions for 3 days at 8±0.5 ℃ and 20±0.5 ℃ at the same time. The results showed that NO significantly slowed down the weight loss of grape rachis and the increase of electrical conductivity, inhibited the degradation of chlorophyll and the accumulation of anthocyanin in grape rachis compared with the control group. NO reduced the quantity and strength of cracks on the surface of spine, but also helped to maintain the tightness of intercellular space arrangement, slowed down the depletion of inorganic matter in the xylem, thus reducing the degree of partial depressions in the tissues. Tissue staining analysis showed that NO maintained the volume of rachis epidermal cells, slowed down the cell wall thickening and corkification, in addition, inhibited the accumulation of brown matter in the epidermis. In conclusion, NO fumigation was conducive to maintaining the quality of grape rachis, delaying the browning by inhibiting chlorophyll degradation and anthocyanin accumulation, moreover, maintaining the integrity of the rachis microstructure.
-
Keywords:
- NO /
- rachis browning /
- thompson seedless grape /
- color and lustre /
- microstructure /
- storage quality
-
葡萄(Vitis vinifera L.)是一种世界性的水果,世界葡萄品种已达800多种[1]。葡萄是一种非呼吸跃变型果实,贮藏过程中呼吸速率较低,但果梗部位属于呼吸跃变型,呼吸作用远高于果粒,在4 ℃贮藏期间,果梗的平均呼吸作用是果粒的28倍;20 ℃放置3 d后,可高达12倍[2]。因此,葡萄果梗的品质劣变进程总是先于果粒,极易发生失水萎蔫、黄化、褐变,甚至干枯等。果梗褐变通常会引发果实软化、落粒和腐烂等问题。
果梗褐变是造成鲜食葡萄采后品质下降的第二大重要问题,也是鲜食葡萄贮藏新技术发展的主要障碍。近年来,控制葡萄果粒腐烂已得到广泛研究,而对果梗褐变的关注较少。果蔬采后贮藏过程易发生水分损失和细胞膜透性改变[3],常伴随色泽变化,主要表现为叶绿素降解[4]、有色物质如茄红素和花色素苷等合成[5]和木质素劣变等[6]。对消费者来说,绿色的果梗代表了新鲜度,因此,褐色果梗严重影响了葡萄的商品价值。
NO作为一种可自由扩散的膜透性信号分子[7],参与了果蔬的成熟衰老过程。已有研究表明,NO处理能显著抑制茄子[8]和番茄[9]色泽的转变,降低葡萄果实的失重率和褐变指数[10],延缓香蕉和哈密瓜电导率的上升[11],抑制了生菜叶片萎蔫、黄化和褐变[12]。项目组研究发现,适宜浓度的NO对无核白葡萄具有显著的保鲜作用,500 μL/L NO熏蒸浓度延缓葡萄果梗褐变的作用尤为明显[13],另有研究表明:NO熏蒸对木纳格葡萄的褐变有显著抑制作用,该现象与减轻氧化损伤有密切关系[10],但NO熏蒸对葡萄果梗细胞完整性、色素类物质、组织结构和细胞组分的理化品质等的影响作用目前尚不清楚。
为了进一步阐明NO对葡萄果梗的保鲜作用,本文以新疆主栽品种“Thompson Seedless”无核白葡萄为研究试材,从理化品质和微观结构角度分析500 μL/L NO熏蒸处理对采后葡萄果梗色泽品质和表皮、韧皮部、维管束、木质部、髓心、细胞壁等细胞物化形态的影响特点,旨在为NO在葡萄及其他果蔬保鲜领域中的应用提供实验数据和科学依据。
1. 材料与方法
1.1 材料与仪器
无核白葡萄 采收自新疆吐鲁番(可溶性固形物含量≥18%)。选择果串大小一致,果粒无病害、腐烂,果梗健康、绿色的葡萄作为试验样品,采收当天用冷链车运至新疆农业科学院农产品贮藏加工研究所冷库,在0±0.5 ℃,相对湿度(Relative Humidity, RH)90%±2%的冷库中预冷24 h。NO气体(≥99.9%) 广州世源气体有限公司;丙酮、石英砂、碳酸钙粉、1%盐酸–甲醇溶液、乙醇、冰醋酸、甲醛、二甲苯、石蜡、番红、固绿、磷酸二氢钠、磷酸氢二钠、戊二醛 乌鲁木齐国耀化玻仪器有限公司。
UV-2600紫外分光光度计 日本岛津有限公司;ddS-11A电导率仪 上海大普仪器有限公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;S-570型扫描电子显微镜 日本日立(HAITACHI)公司;LEICAASP200S全密封式组织脱水机、LEICAEG1160组织包埋机、LEICA2245石蜡切片机 德国莱卡仪器有限公司;PH100-3B41L-IPL石蜡样品显微镜 江西凤凰光学集团有限公司。
1.2 实验方法
1.2.1 样品处理
将预冷后的葡萄随机分成2组,放入多孔塑料盒,每盒装入2串,约1 kg。用500 μL/L标准NO气体熏蒸葡萄2 h,以未使用NO熏蒸的无核白葡萄作为对照组[13]。贮藏于0±0.5 ℃,RH 90%±2%的冷库中,冷藏25 d后,所有样品均分为三个样本,其中两个样品分别转移到两个模拟货架条件下贮藏3 d,货架温度分别为8±0.5 ℃(模拟商超水果冷藏柜温度)和20±0.5 ℃, RH 90%±2%,剩余样品继续冷藏至35 d,开展进一步的贮藏效果和货架期评价。贮藏过程中,对冷藏35 d葡萄果梗进行色差和微观结构分析,对货架期葡萄果梗的理化品质、色素物质积累进行定期监测和评价,冷藏期每隔5 d取样,货架期每天取样。
1.2.2 测定指标及方法
1.2.2.1 色差
参考池铭等[14]的方法进行测定。采用CR-400型便携式色差仪进行测定,背景为白色,测定果梗固定位置,读取a*、b*和h数值,a*正值表示红色,负值表示绿色;b*正值表示黄色,b*负值表示蓝色;h表示色相,重复测定三次。
1.2.2.2 失重率
参考Dilara等[15]的方法进行测定。去除葡萄果粒,用灭菌的剪刀将果梗剪成2±0.5 cm的小段。提前将烘箱温度升至100~105 ℃。将称过鲜重(FW)的果梗连同称量皿,放入烘箱内,于100~105 ℃杀青10 min,然后将烘箱的温度降到70~80 ℃左右,烘至恒重。取出装有果蔬材料的称量皿,放入干燥器中冷却至室温,称重。用称重后的重量减去称重皿重量即干重(dW)。重复三次,结果以%表示。
果梗失重率(%)=(FWn−dWnFWn−FWn+1−dWn+1FWn+1)×100 式中:n,n+1分别代表取样时间前后两个取样点的检测重量,g。
1.2.2.3 相对电导率
参考Zhang等[16]和王锋等[17]的方法进行测定。将称取的6.0 g葡萄果梗置于烧杯中,加入20 mL蒸馏水,在室温条件下放置12 h后,测定浸泡液的电导率。再将葡萄果梗煮沸5 min,待液体冷却后再次测定电导率,重复测定三次,结果以%表示。
相对电导率(%)=煮沸后电导率煮沸前电导率×100 1.2.2.4 叶绿素含量
参考Chen等[18]和曹健康等[19]的方法进行测定。准确称量1.0 g果梗冻样,加入适量的丙酮在冰上研磨成浆,最终定容至50.0 mL。在4 ℃,12000 r/min条件下离心10 min后,取上清液分别在663和645 nm处测定其吸光值,重复测定三次,结果以mg/kg表示。
叶绿素a含量(mg/kg)=(12.72A663−2.59A645)×50 叶绿素b含量(mg/kg)=(22.88A645−4.67A663)×50 总叶绿素含量(mg/kg)=叶绿素a含量+叶绿素b含量 1.2.2.5 花青素和类黄酮
参考Shahin等[20]的方法进行测定。称取2.0 g果梗组织,加入4 ℃ 1%的 HCl–甲醇溶液,在冰浴条件下研磨匀浆后,转入20 mL刻度试管中,定容至刻度,混匀,于4 ℃避光提取20 min。期间摇动数次,然后过滤,取滤液在波长325 nm处测定吸光值表示类黄酮含量,在波长530和600 nm处测定吸光值,吸光度值之差表示花青素含量,重复测定三次。用不同浓度的芦丁、花色苷,制作标准曲线,计算花青素和类黄酮准确含量。花色苷标准曲线方程为y=0.172x+0.002,R2=0.999;芦丁标准曲线方程为y=1.206x+0.017,R2=0.999。
1.2.2.6 超微结构观察
参考周江[21]和郑操等[22]的方法,采用电镜扫描观察。取果梗部位涉及主茎、次茎和果柄各5 mm的小段,将果梗样品脱水固定后,通过纵切观察表面气孔和裂纹变化,通过横切观察不同部位细胞形态变化。
1.2.2.7 组织学分析
参考Christian等[23]的方法进行测定,通过果梗石蜡横切面观察。采用番红-固绿染色法观察果梗组织不同部位纤维化和木质化水平。
1.3 数据处理
采用Excel 2013软件进行数据整理,Sigma Plot 14.0(Systat software Inc, San Jose, CA, USA)软件作图,所有统计分析均采用SPSS 19.0(SPSS Inc, Chicago, IL, USA)进行单因素方差分析(ANOVA)检验。所有数值均为三次数值的平均值,P<0.05表示差异显著,P<0.01表示差异极显著。
2. 结果与分析
2.1 果梗色差的变化
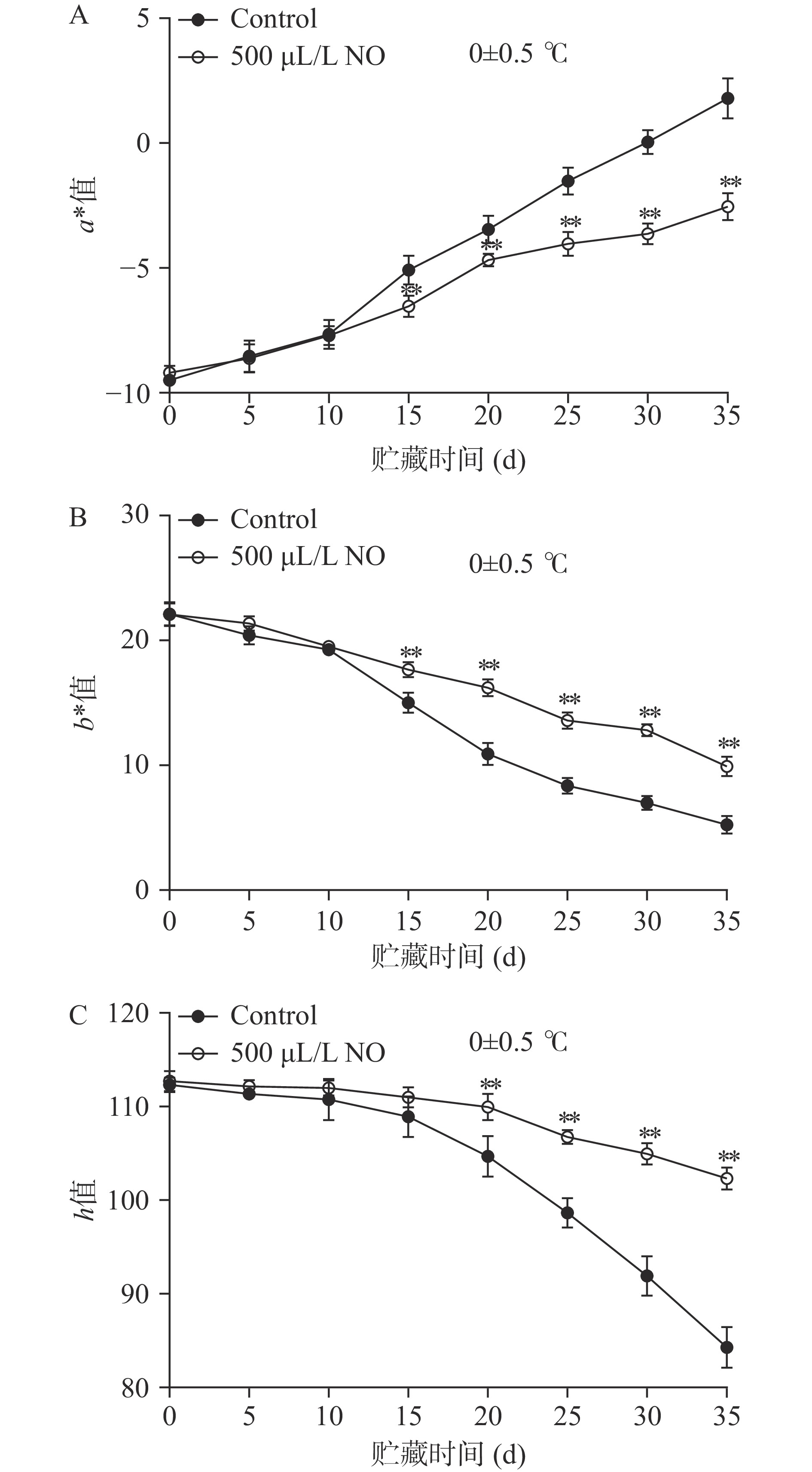
a*值的负值表示浅绿,a*值越小[14],说明葡萄果梗越绿,对0 ℃冷藏35 d的葡萄果梗进行色差分析表明(图1A),在整个贮藏期间,果梗的a*值呈上升趋势,NO处理组果梗的a*值均小于0,果梗的颜色呈现绿色,对照组果梗的a*值在30 d后均大于0,果梗失去绿色呈现橙色。冷藏25、30和35 d时,对照组中果梗a*值分别高于NO处理组1.66倍、3.67倍和2.41倍,差异极显著(P<0.01)。b*值越大,说明葡萄果梗褐变程度越小[14],与a*值变化趋势相反,葡萄果梗的b*值在整个贮藏期呈下降趋势(图1B),NO处理组和对照组在冷藏前期无明显差异,冷藏15 d后,NO处理组b*值极显著高于对照组(P<0.01),冷藏25、30和35 d时,NO处理组中果梗b*值分别高于对照组62.49%、83.38%和89.62%。贮藏过程中果梗褐变是引起果实品质和商品价值降低的主要因素[2],h值代表色相,能综合反映出样品的颜色[24],随着贮藏时间的延长,果梗的h值呈逐渐下降的趋势(图1C),先缓慢下降后快速下降,NO处理组抑制了果梗h值的下降,冷藏20 d后,NO处理组h值极显著高于对照组(P<0.01)。结果表明,NO熏蒸有效维持了果梗外观色泽,与百香果对NO熏蒸的响应一致[25]。
2.2 果梗失重率变化
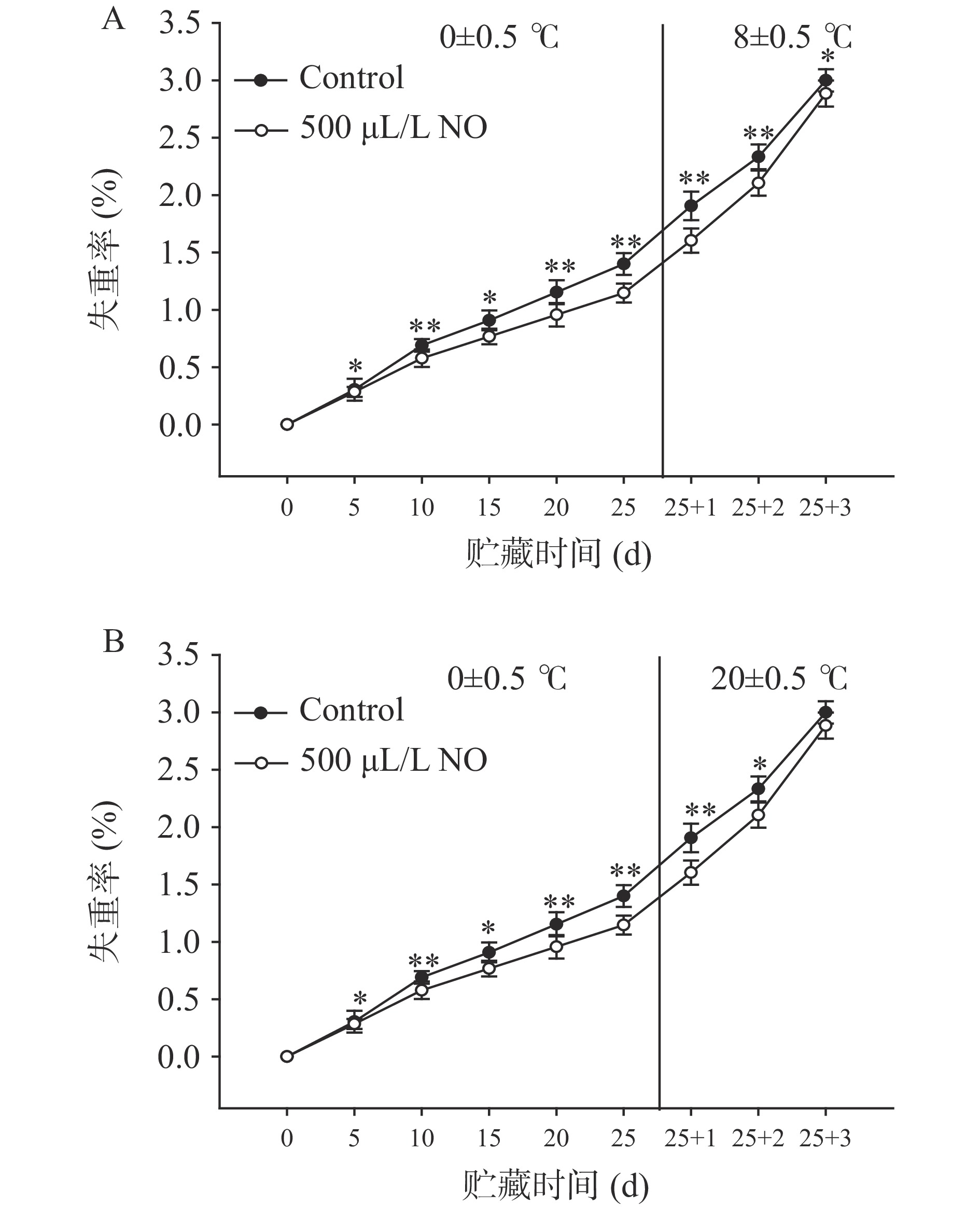
果蔬采后生理学研究表明,延缓果梗褐变的前提是减少水分流失[26]。由图2可知,随着贮藏时间的延长,处理组与对照组果梗失重率都在不断增加,且随着贮藏温度的变化而呈现不同的增加速度。在冷藏25 d期间,失重率缓慢增加,且NO处理组的增长趋势较为平缓,但货架期3 d后,NO处理组失重率迅速增加至2.89%~3.00%。总体来看,除20 ℃货架第3 d外,与对照组相比NO处理均显著抑制了失重率的增加(P<0.05),也有效维持了果梗的重量。本研究中,NO处理有效抑制了失重率的增加,该结果与Zhang等[10]的研究结果一致,NO延缓了贮藏期间果梗的失重,这可能与NO通过气孔介导调节水分散失的作用有关[27]。
2.3 果梗电导率变化
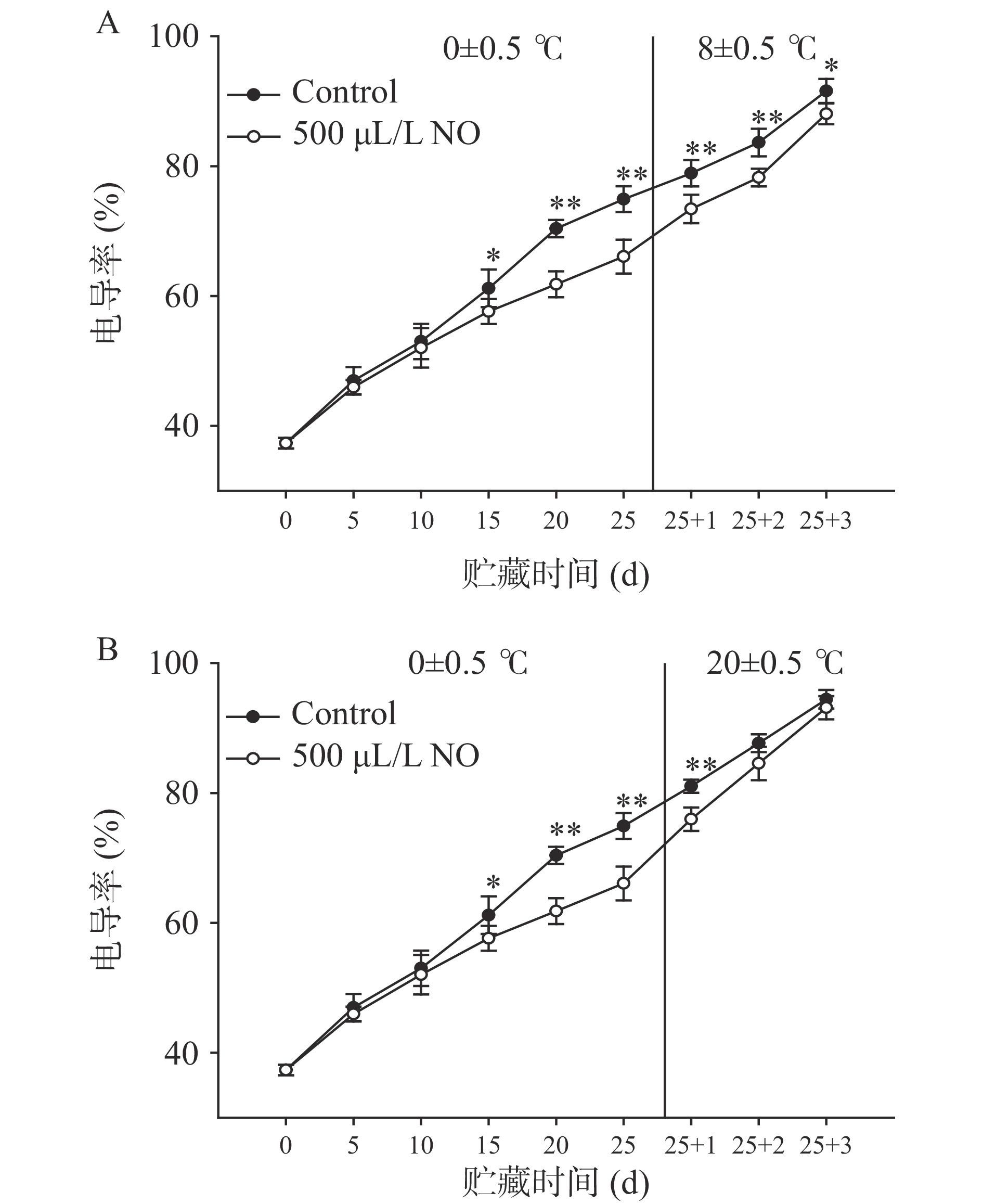
由图3可知,贮藏期间果梗电导率不断增加,冷藏到15 d后,与对照组相比NO处理组显著抑制了电导率的增加(P<0.05),且随着冷藏时间的延长,处理组与对照组之间的差异极显著(P<0.01)。因此,在冷藏20 d和25 d时,NO处理组的电导率分别比对照组降低了12.18%和11.80%。在8 ℃贮藏3 d的货架期内,NO均显著延缓了电导率的增加,且使电导率推迟1 d达到78%,与对照组差异显著(P<0.05)。与之不同的是,20 ℃贮藏3 d的货架期内,仅在货架第1 d时,NO具有极显著抑制电导率增加的作用(P<0.01)。这可能与NO有效维持了细胞壁完整性,延缓电导率的增加,延缓衰老进程有关[28]。一般随着贮藏时间的延长,细胞膜受伤害程度不断增大,细胞的完整性受到破坏,果实细胞膜的相对电导率相应增加,导致电解质大量渗透[29]。该结果与延缓枇杷木质化劣变过程中减少电导率的上升、延缓小白菜衰老过程中抑制电导率的增加现象一致[30]。
2.4 叶绿素含量变化
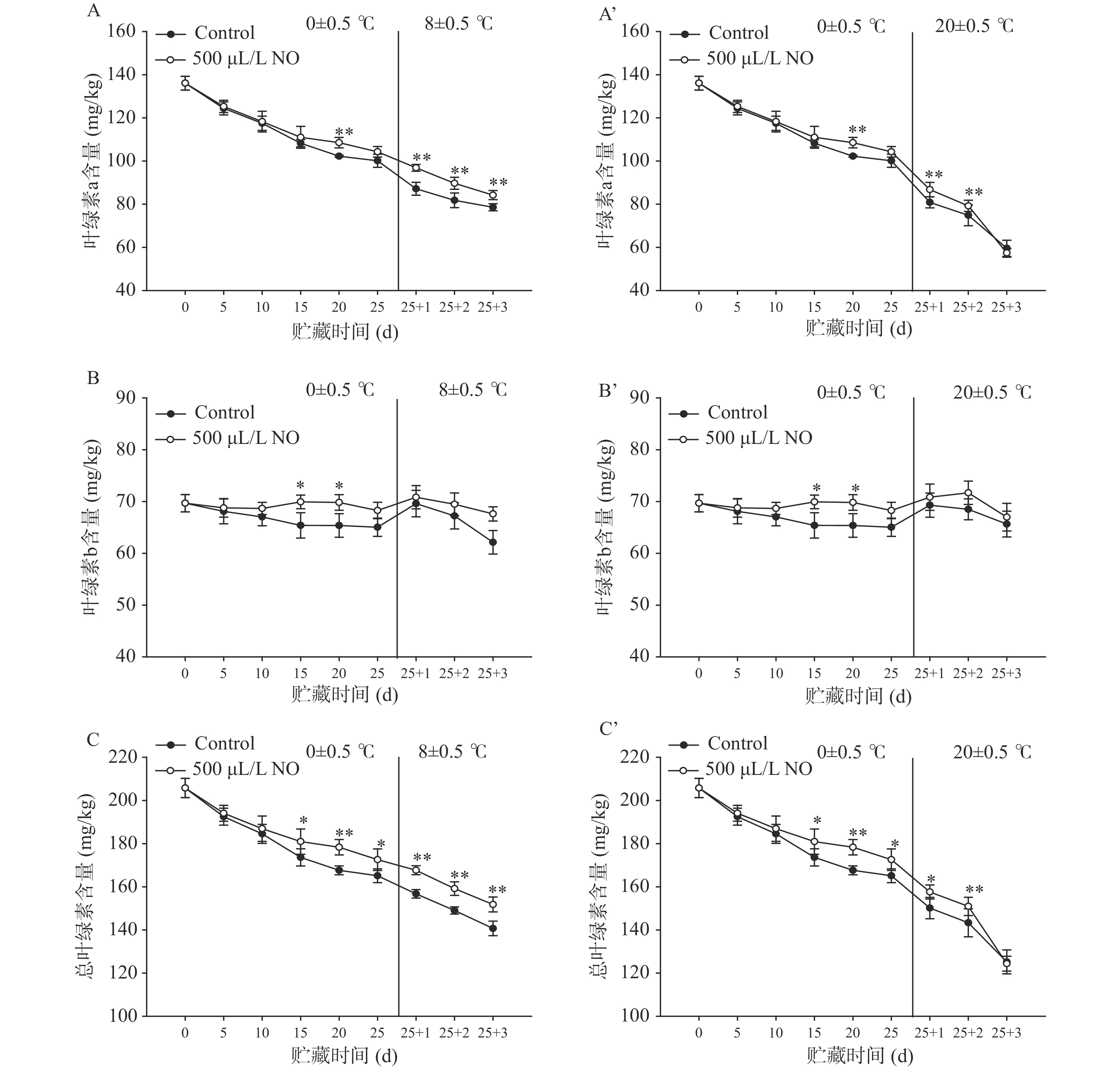
据研究显示,叶绿素降解或褐色物质生成都会影响果蔬的绿色外观[26]。由图4A、4A’可知,在贮藏期间,呈现蓝绿色的叶绿素a随着贮藏时间延长不断发生降解,冷藏25 d后,对照组含量降至采摘时的73.57%,且降解速度与贮藏温度高低有一定关系,8 ℃和20 ℃货架贮藏3 d后,NO处理组含量迅速降至采摘时的57.76%和43.77%,在货架期贮藏期间,除20 ℃货架期贮藏3 d外,处理组与对照组差异极显著(P<0.01)。由图4B、4B’可知,冷藏15 d以前,处理组呈现黄绿色的叶绿素b的含量缓慢减少,随后维持稳定,这与叶绿素a含量变化规律不同,可能由于在暗室中叶绿素b比叶绿素a稳定而不易降解,贮藏15、20 d时处理组显著高于对照组(P<0.05),且出现轻微增高现象,可能与NO抑制叶绿素b产生及其与叶绿素a降解产生叶绿素b的加和作用有关[31]。NO处理组8 ℃和20 ℃货架贮藏3 d后叶绿素b较采摘时分别降低了2.97%和3.87%。由图4C、4C’可知,葡萄采收后总叶绿素含量呈不断下降的趋势,对照组冷藏25 d后其含量降至采摘时的80.20%,继续在8 ℃和20 ℃货架贮藏3 d后其含量迅速降至采摘时的68.39%和60.85%。比较各叶绿素变化量发现,叶绿素a的降解是引起总叶绿素含量减少的主要原因,其次是叶绿素b。叶绿素a是叶绿素b降解速度的数倍甚至十几倍,其中在冷藏末期前者是后者的7.74倍,8 ℃和20 ℃货架贮藏3 d后前者是后者的为7.61倍和18.97倍。贮藏期内,NO对总叶绿素含量的降低有抑制作用,其中在8 ℃货架下,与对照组差异极显著(P<0.01)。本研究中,NO抑制了叶绿素降解的速度,有效维持了果梗外观色泽的现象与小白菜[30]和茄子[8]对NO熏蒸的响应一致。
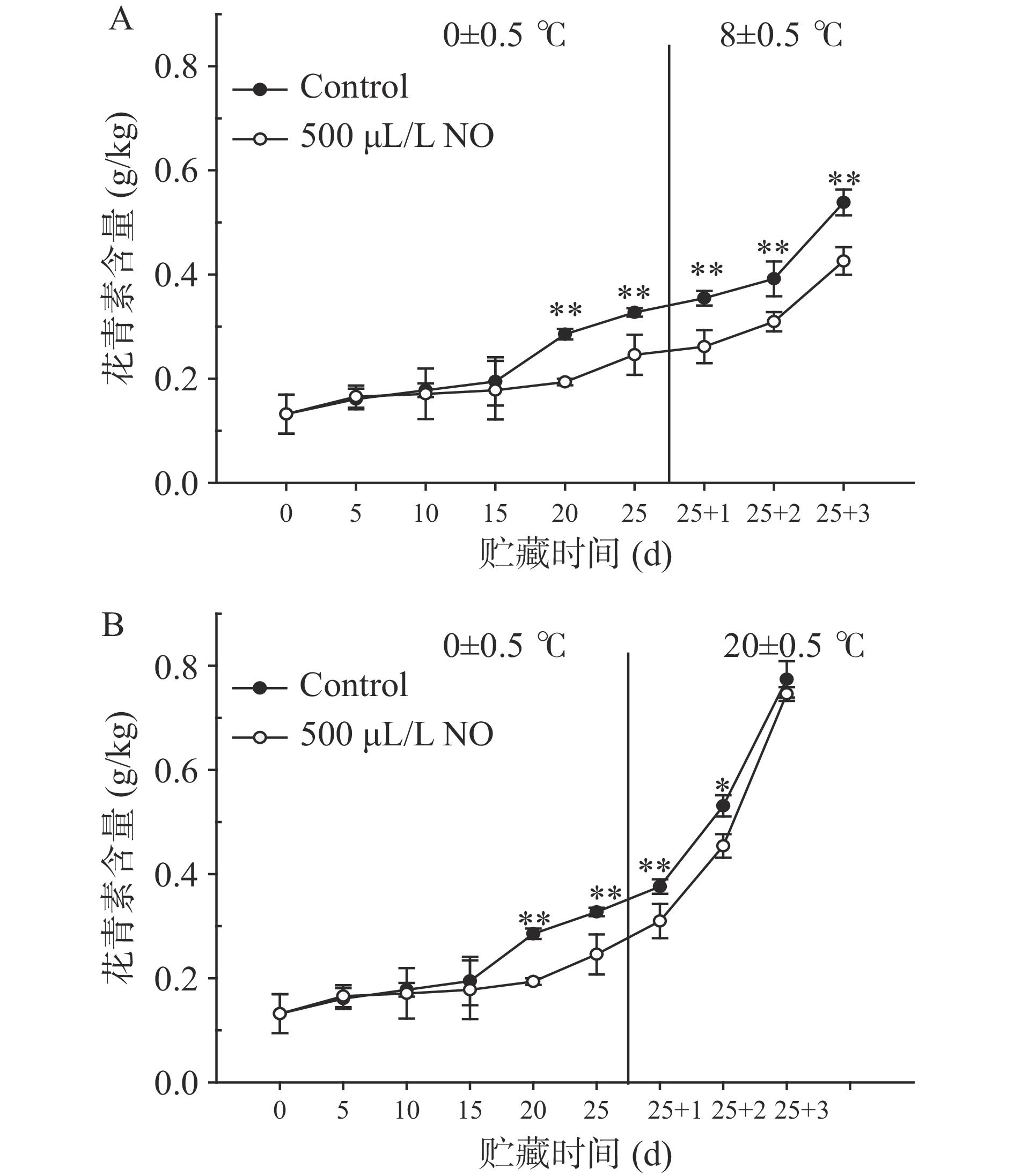
2.5 花青素含量变化
课题组前期研究发现果梗褐变与酚类物质氧化为醌类物质存在密切关系[13],但未对花青素含量开展分析。花青素是果蔬呈现红、橙、蓝、紫等深色的主要成分,与果蔬贮藏过程中的色泽的变化关系密切[32]。图5表明,在冷藏前15 d时,葡萄果梗的花青素含量在112.0~184.7 mg/kg之间,这与青提、红提、巨峰葡萄果梗中的花青素含量相近,但低于巨玫、夏黑、香悦等葡萄[33]。随着贮藏时间的延长和货架温度的不断增加,积累速度不断加快,而NO处理显著抑制了花青素的增加(P<0.05)。结果显示,冷藏期间NO处理组的果梗花青素出现显著增加的时间节点被推迟了5 d,故在20~25 d期间,花青素含量平均低于对照组的28.52%,差异极显著(P<0.01);与对照组的相应货架时间段相比,8 ℃货架期3 d内和20 ℃货架期2 d内,NO处理组中果梗花青素含量分别降低了22.71%和16.06%,差异极显著(P<0.01)。结果表明,NO抑制了花青素含量的增加,有效维持了果梗外观色泽,与西蓝花、生菜、青椒、葫芦瓜、青苹果和香梨对NO熏蒸的响应一致[29]。
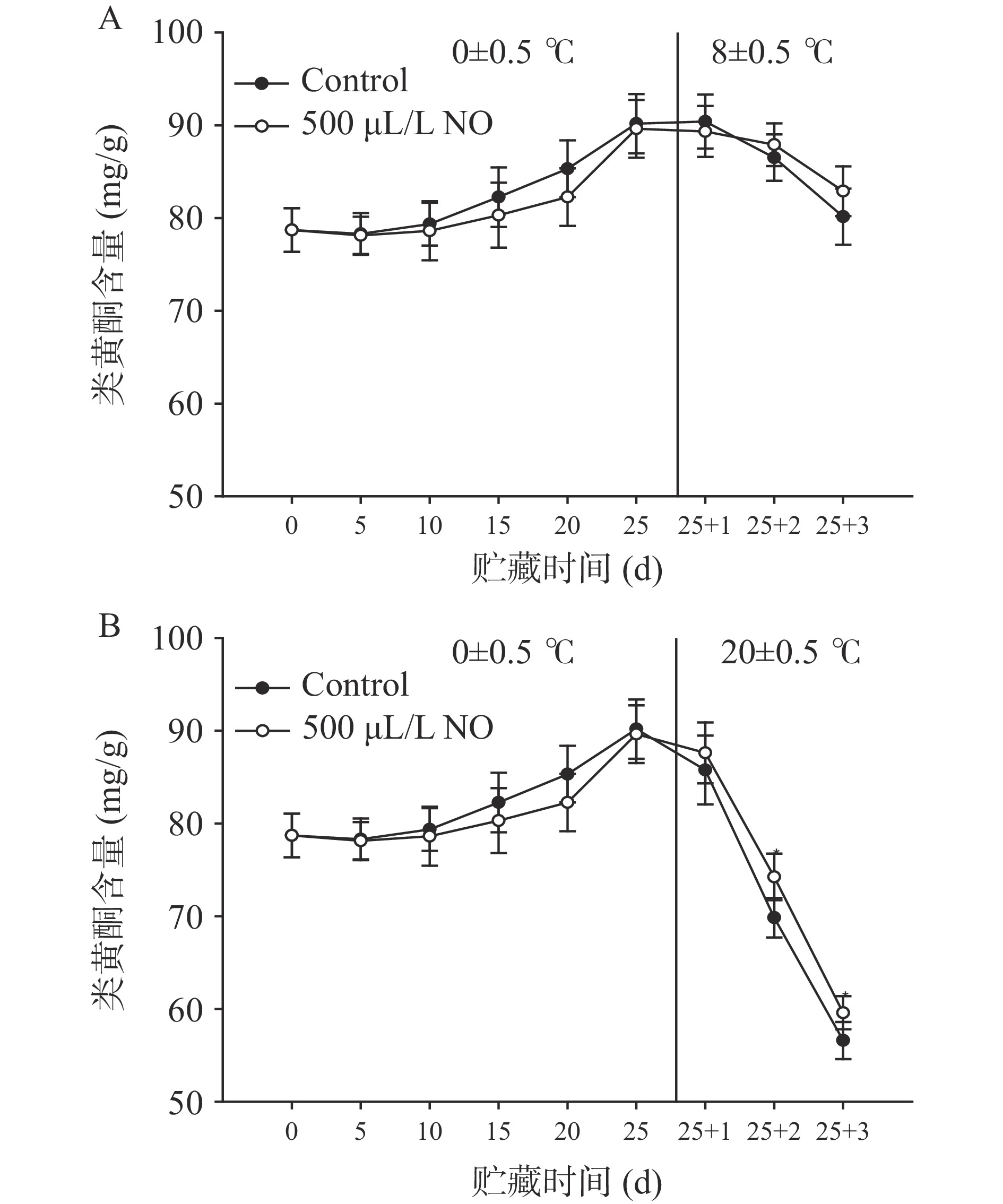
2.6 类黄酮含量变化
类黄酮物质大多为淡黄色,是抵御果蔬采后衰老的内源性抗氧化物质[13]。由图6可知,采后葡萄果梗中的类黄酮类含量缓慢增加,维持在较高水平,但随着货架温度的升高,氧化速度不断增加,剩余含量明显减少,尤其是20 ℃货架第2 d和第3 d,类黄酮含量比采摘时分别降低了11.26%和28.10%,而NO处理抑制了类黄酮含量的降低。但从采后冷藏期和8 ℃货架期贮藏来看,类黄酮含量变化不大,NO处理组有减缓变化强度的作用,但与对照组差异不显著(P>0.05),研究结果与开心果对NO熏蒸的响应不一致[20],与百香果对NO熏蒸的响应一致,这可能与不同种类的水果对NO的敏感程度不同有关[25]。
2.7 果梗表皮微观结构变化
葡萄果梗部位不仅起着向果粒输送水分、无机盐和有机物等营养物质的作用,而且发挥着使气体进出浆果的通道作用[34]。对葡萄果梗进行电镜扫描(SEM)(图7),结果表明采后果梗(图7a)表面并非光滑,但组织紧密,经过冷藏后,果梗表面变化明显,出现许多细小的皮孔和裂纹,且裂纹居多。随着贮藏时间的延长,裂纹的数量、宽度和深度不断增加。通过观察发现,冷藏前10 d(图7A’),果梗表皮薄层组织首先发生收缩,引起皮层褶皱开裂,NO处理组延缓了皮层褶皱开裂(图7D’);冷藏至20 d(图7B’)时,木栓层也出现了收缩,呈现网格结构,造成裂纹深度加大,NO处理组延缓了皮层褶皱开裂的面积(图7E’);冷藏至35 d(图7C’)时,收缩现象延伸至韧皮部,呈龟裂状,且多层细胞已出现孔洞化,裂纹深度和开度均有增强。本研究表明,NO熏蒸抑制了裂纹数量、宽度和深度增加,因此降低了裂纹密度,减少了开裂总面积,从而延缓了果梗衰老和劣变进程。与Elena等[12]的研究结果一致,NO通过抑制生菜叶片表面裂纹数量和开裂强度,延缓了叶片萎蔫、黄化和褐变进程,有效维持了生菜的品质。
2.8 果梗组织内部微观结构变化
葡萄果梗组织主要包括表皮、韧皮部和木质部。对葡萄果梗表皮进行电镜扫描(SEM)表明(图8),对照组的果梗表皮细胞紧密(图8A),韧皮部呈螺旋管状(图8D),随着贮藏时间的延长,表皮细胞膨压变小(图8B),细胞骨架变形,孔洞变大(图8B、E),骨架呈无规则,甚至发生凹陷(图8C、F),但从NO处理组中观察到,果梗表皮和韧皮部细胞的变化速度和程度均得到了减缓(图8A1~F1)。对照组的果梗木质部随着冷藏时间的延长,形态无明显变化(图8G、H、I),但细胞内的结晶物不断减少(图8G、H),甚至到贮藏末期,几乎无结晶物体(图8I),但NO处理组中的结晶物较多(图8G1~I1),尤其是冷藏早期(图8G1)数量和密度都明显多于对照组(图8G),冷藏后期仍有明显可见的物质(图8I1)。结果表明,NO处理组延缓了木质部细胞中无机盐和水分的消耗,有效维持了果梗中水分和无机盐的含量,减缓了果梗采后品质的劣变。与NO减少枇杷[35]和猕猴桃[36]]细胞内物质转运,延缓木质部中无机盐的消耗有类同之处。
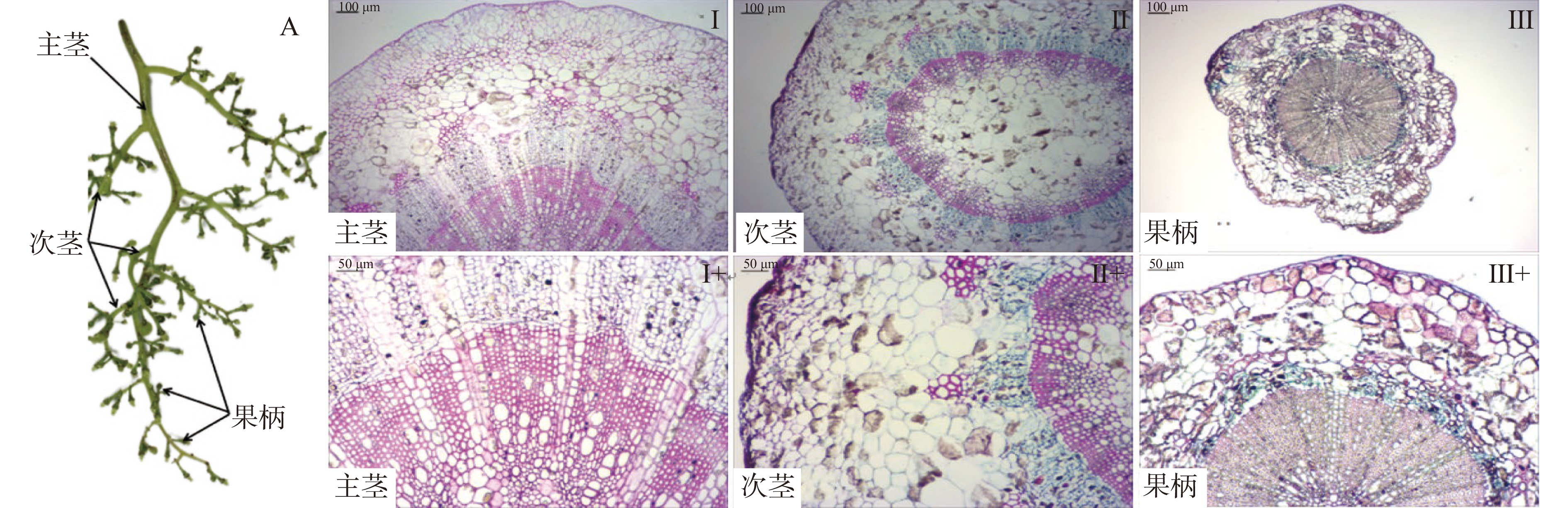
2.9 果梗细胞组织特性变化
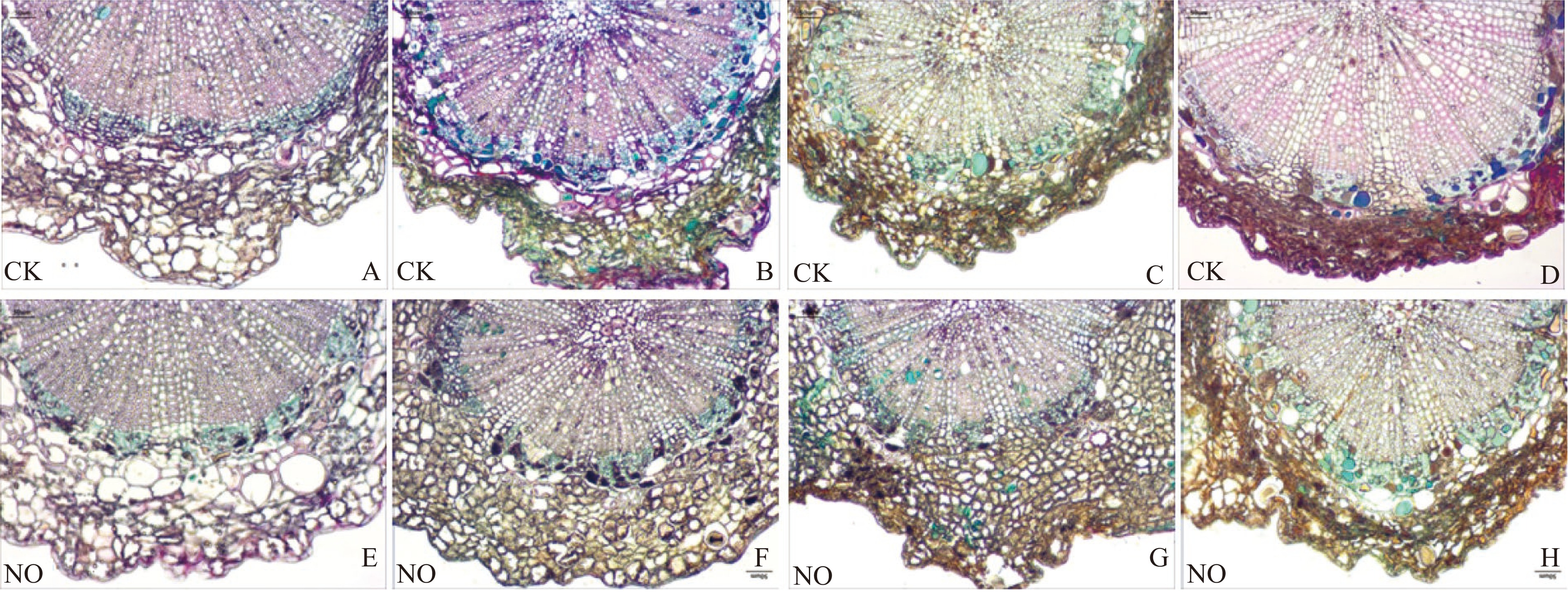
葡萄果梗横切面石蜡切片显示(图9),采后葡萄果梗部位从主茎(I、I+)、次茎(II、II+)到果柄(III、III+)各组织部位差异明显,比表面积逐渐增加(I-III)。其中表皮组织细胞层逐渐变薄,木栓化缓慢变厚(II、II+、III、III+);与主茎和次茎相比,果柄中的韧皮部呈束状分布的界限模糊,且细胞层较少(III、III+);相反,果柄中的木质部比例较高,髄芯细胞很少(III、III+),由此说明,与果粒直接相连的果柄在采后生理功能较弱,贮藏特性敏感。因此,为了评估果梗采后棕色化合物生成掩盖或隐藏绿色色素可能性、细胞骨架变化和木质化水平,对果柄进行了组织学分析(图10)。结果表明,随着贮藏时间的延长,对照组中(图10A~D),果柄表皮细胞体积不断变小,细胞壁逐渐增厚,细胞骨架缓慢塌陷,细胞壁木栓化程度不断增强;表皮绿色物质的占比不断减少,细胞形态结构不断崩溃,而且棕色物质积累快速增加,整体上褐变程度不断加强。结果与NO抑制生菜叶片萎蔫、黄化、褐变的结构现象类似[12],果蔬贮藏期会出现细胞完整性不断下降的现象[22],常与细胞骨架变形[25]、色素沉积[37]、酶促褐变[38]等生理生化反应密切相关。
3. 结论
本研究表明,无核白葡萄采后果梗褐变的部分原因是色素物质变化和微观结构的影响。NO有效延迟了葡萄果梗的褐变程度以及电导率的增加,抑制了叶绿素降解和花青素的积累。NO处理减少了果梗表面裂纹数量和开裂强度、局部组织的凹陷程度,减缓了木质部中无机物的消耗。另外,NO维持了果梗表皮细胞的体积,抑制了细胞壁增厚和木栓化,抑制了表皮棕色物质的积累,减缓了果梗韧皮部褐化、绿色物质被掩盖、细胞缩小和骨架变形,从而延缓了细胞结构的破坏。研究结果表明,NO从宏观和微观结构上维持了葡萄果梗贮藏品质,尤其能有效延缓葡萄果梗褐变进程,提高了无核白葡萄采后贮藏性能,是一种具有应用前景的保鲜方法。后期可以对NO影响果梗褐变的机理展开研究,为NO在葡萄采后贮藏保鲜领域中的应用提供更多有力的数据。
-
-
[1] 刘崇怀. 无核葡萄品种的无核性来源分析[J]. 植物遗传资源学报,2003,4(1):58−62. [LIU C H. Analysis on seedless source of seedless grape breeding[J]. Journal of Plant Genetic Resources,2003,4(1):58−62. doi: 10.3969/j.issn.1672-1810.2003.01.013 [2] LI A, ZUTAHY T, DAUS T, et al. The effects of 1-methylcyclopropane and ethylene on postharvest rachis browning in table grapes[J]. Postharvest Biology and Technology,2015,107:16−22. doi: 10.1016/j.postharvbio.2015.04.001
[3] LOAY A A, EI-BORYA M S. Improving fruit cluster quality attributes of ‘Flame Seedless’ grapes using preharvest application of ascorbic and salicylic acids[J]. Scientia Horticulturae,2018,233:339−348. doi: 10.1016/j.scienta.2018.02.010
[4] LESHEM Y Y, HARAMATY E, ILUZ D, et al. Effect of stress nitric oxide (NO): Interaction between chlorophyll fluorescence, galactolipid fluidity and lipoxygenase activitys[J]. Plant Physiology and Biochemistry,1997,35:573−579.
[5] 周慧娟. 水蜜桃发育和采后果皮的色素和芳香物质变化及相关蛋白组学研究[D]. 南京: 南京农业大学, 2018 ZHOU H J. Changes of coloured and aromatic compounds of honey peach peel and related proteomics studies during development and postharvest[D]. Nanjing: Nanjing Agricultural University, 2018.
[6] 程志华, 龚霄, 刘洋洋, 等. 不同贮藏温度对采后番荔枝品质的影响[J]. 食品工业科技,2019,40(9):264−268, 274. [CHENG Z H, GONG X, LIU Y Y, et al. Effects of different storage temperatures on quality of postharvest Annona squamosa L doi: 10.13386/j.issn1002-0306.2019.09.046 J]. Science and Technology of Food Industry,2019,40(9):264−268, 274. doi: 10.13386/j.issn1002-0306.2019.09.046
[7] MUKHERJEE S. Recent advancements in the mechanism of nitric oxide signaling associated with hydrogen sulfide and melatonin crosstalk during ethylene-induced fruit ripening in plants[J]. Nitric Oxide,2019(82):25−34.
[8] 范林林, 王清, 左进华, 等. 外源NO处理对茄子贮藏品质的影响[J]. 中国食品学报,2017,17(1):186−192. [FAN L L, WANG Q, ZUO J H, et al. The effect of exogenous NO treatment on eggplant quality during storag[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(1):186−192. doi: 10.16429/j.1009-7848.2017.01.024 [9] 杨杨. 一氧化氮参与调控番茄果实采后成熟衰老信号机制研究[D]. 北京: 中国农业大学, 2018 YANG Y. The signaling mechanism of nitric oxide on ripening and senescence of posthavest tomato fruit[D]. Beijing: China Agricultural University, 2018.
[10] ZHANG Z, XU J, CHEN Y, et al. Nitric oxide treatment maintains postharvest quality of table grapes by mitigation of oxidative damage[J]. Postharvest Biology and Technology,2019,152:9−18. doi: 10.1016/j.postharvbio.2019.01.015
[11] WANG Y S, LYO Z S, ZIA U K, et al. Effect of nitric oxide on energy metabolism in postharvest banana fruit in response to chilling stress[J]. Postharvest Biology & Technology,2015,108:21−27.
[12] ELENA T I, EMST J W. Nitric oxide prevents wound-induced browning and delays senescence through inhibition of hydrogen peroxide accumulation in fresh-cut lettuce[J]. Innovative Food Science and Emerging Technologies,2015,30:157−169. doi: 10.1016/j.ifset.2015.06.001
[13] WU Z H, DONG C H, WEI J, et al. A transcriptional study of the effects of nitric oxide on rachis browning in table grapes cv. Thompson Seedless[J]. Postharvest Biology and Technology,2021:175.
[14] 池铭, 孙丽娟, 马立杰, 等. 不同光质处理对采后桃果皮色泽及花色苷代谢的影响[J]. 食品科学,2022,14:1−12. [CHI M, SUN L J, MA L J, et al. Effects of different light quality treatments on color luster and anthocyanin metabolism of postharvest peach skin[J]. Food Science,2022,14:1−12. doi: 10.7506/spkx1002-6630-20210813-176 [15] DILARA K T, FIGEN K. Impact of preharvest and postharvest alginate treatments enriched with vanillin on postharvest decay, biochemical properties, quality and sensory attributes of table grapes[J]. Food Chemistry,2017,221:187−195. doi: 10.1016/j.foodchem.2016.09.195
[16] ZHANG T, CHE F B, ZHANG H, et al. Effect of nitric oxide treatment on chilling injury, antioxidant enzymes and expression of the CmCBF1 and CmCBF3 genes in cold-stored Hami melon (Cucumis melo L.) fruit[J]. Postharvest Biology and Technology,2017,127:88−98. doi: 10.1016/j.postharvbio.2017.01.005
[17] 王锋, 杨青珍, 赵旗峰, 等. 外源褪黑素对甜樱桃果实褐变和品质的影响[J]. 食品工业科技,2021,12(23):1−14. [WANG F, YANG Q Z, ZHAO Q F, et al. Effect of melatonin treatment on browning and quality of sweet cherry[J]. Science and Technology of Food Industry,2021,12(23):1−14. doi: 10.13386/j.issn1002-0306.2021060226 [18] CHEN Y X, WEI Q, KUAI B K, et al. Molecular cloning and characterization of a chlorophyll degradation regulatory gene from bamboo[J]. Biology Plantarum,2013,57(1):63−69. doi: 10.1007/s10535-012-0139-6
[19] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 38−40 CAO J K, JIANG W B, ZHAO Y M. Physiological and biochemical experiment guidance for fruits and vegetables after harvest[M]. China Light Industry Press, 2007: 38−40.
[20] SHAHIN G I, SEYED H J, MAHMOOD G, et al. The inhibitory effect of nitric oxide on enzymatic browning reactions of in-package fresh pistachios (Pistacia vera L.)[J]. Postharvest Biology and Technology,2020,159:110998. doi: 10.1016/j.postharvbio.2019.110998
[21] 周江. 二氧化硫(SO2)间歇熏蒸对红地球葡萄采后品质的影响[D]. 乌鲁木齐: 新疆农业大学, 2016 ZHOU J. Effects of sulfur dioxide intermittent fumigation on postharvest quality of red globe grapes during storage[D]. Urumqi: Xinjiang Agricultural University, 2016.
[22] 郑操, 喻书诚, 陈涛. 裂壶藻突变株S1的细胞生长及其油脂合成的超微结构[J]. 食品工业科技,2020,41(16):127−130, 149. [ZHENG C, YU S C, CHEN T. The microscopic performance of oil synthesis and its growth of Schizochytrium sp. mutant strain S1[J]. Science and Technology of Food Industry,2020,41(16):127−130, 149. doi: 10.13386/j.issn1002-0306.2020.16.021 [23] CHRISTIAN S, IVAN B, PABLO S, et al. Effect of modified atmosphere packaging (MAP) on rachis quality of ‘Red Globe’ table grape variety[J]. Postharvest Biology and Technology,2016,119:33−40. doi: 10.1016/j.postharvbio.2016.04.021
[24] 刘士伟, 于惠. 一种基于色相角算法的图像质量评价模型[J]. 包装工程,2012(17):94−97. [LIU S W, YU H. An image quality evaluation model based on hue angle algorithm[J]. Packaging Engineering,2012(17):94−97. doi: 10.19554/j.cnki.1001-3563.2012.17.023 [25] 王红林, 王宇, 赵晓珍, 等. 外源NO处理对百香果采后贮藏品质的影响[J]. 中国南方果树,2021,50(5):54−61. [WANG H Y, WANG Y, ZHAO X Z, et al. Effects of exogenous no treatment on postharvest storage quality of passion fruit[J]. Fruit Trees in Southern China,2021,50(5):54−61. doi: 10.13938/j.issn.1007-1431.20200727 [26] DUAN X, SU X, YOU Y, et al. Effect of nitric oxide on pericarp browning of harvested longan fruit in relation to phenolic metabolism[J]. Food Chemistry,2006,104(2):571−576.
[27] KOLLA, RAGHAVENDRA A S, RAGHAVENDRA. Nitric oxide is a signaling intermediate during bicarbonate‐induced stomatal closure in Pisum sativum[J]. Physiologia Plantarum,2007,130(1):91−98. doi: 10.1111/j.1399-3054.2007.00887.x
[28] LI L, TIAN S L, JIANG J, et al. Regulation of nitric oxide to Capsicum under lower light intensities[J]. South African Journal of Botany,2020,132:268−276. doi: 10.1016/j.sajb.2020.05.020
[29] WANG L, WANG Z X, LI J H, et al. Morphological and quality characterization of grape berry and rachis in response to postharvest 1-methylcyclopropene and elevated oxygen and carbon dioxide atmospheres[J]. Postharvest Biology and Technology,2019,153:107−117. doi: 10.1016/j.postharvbio.2019.04.001
[30] LIU Y B. Nitric oxide fumigation for control of western flower thrips and its safety to postharvest quality of fresh fruit and vegetables[J]. Journal of Asia-Pacific Entomology,2016,19(4):1191−1195. doi: 10.1016/j.aspen.2016.10.013
[31] 黄凯美, 颜韶兵, 刘霁虹, 等. NO对采后小白菜品质的影响[J]. 浙江农业科学,2016:523−525, 541. [HUANG K M, YAN S B, LIU Q H, et al. Effect of no on the quality of postharvest Chinese cabbage[J]. Journal of Zhejiang Agricultural Sciences,2016:523−525, 541. doi: 10.16178/j.issn.0528-9017.20160423 [32] JIANG Y. Role of anthocyanins, polyphenol oxidase and phenols in lychee pericarp browning[J]. Journal of the Science of Food and Agriculture,2000,80:305−310. doi: 10.1002/1097-0010(200002)80:3<305::AID-JSFA518>3.0.CO;2-H
[33] 李小娟, 聂钰洪, 刘琦琦, 等. 鲜食葡萄品种多酚类物质含量及抗氧化活性分析[J]. 北方园艺,2017(21):37−42. [LI X J, NIE Y H, LIU Q Q, et al. Analysis of polyphenol content and antioxidant activity of fresh grape varieties[J]. Northern Gardening,2017(21):37−42. [34] 谢兆森, 曹红梅, 李勃, 等. 巨峰葡萄果实不同发育期维管束水分运输变化[J]. 中国农业科学,2012,45(1):111−117. [XIE Z S, CAO H M, LI B, et al. Changes of water transportation in berry vascular bundle at different developmental phases of kyoho grape berry changes of water transportation in berry vascular bundle at different developmental phases of kyoho grape berry[J]. Agricultural Sciences in China,2012,45(1):111−117. doi: 10.3864/j.issn.0578-1752.2012.01.013 [35] 陈发河, 张美姿, 吴光斌. NO处理延缓采后枇杷果实木质化劣变及其与能量代谢的关系[J]. 中国农业科学,2014,47(12):2425−2434. [CHEN F H, ZHANG M Z, WU G B. Study of lignification’s delaying and its relationship with energy metabolism in loquat fruits after nitric oxide fumigation[J]. Agricultural Sciences in China,2014,47(12):2425−2434. doi: 10.3864/j.issn.0578-1752.2014.12.015 [36] 宋丽君. 一氧化氮处理对猕猴桃果实的保鲜效应及其生理机制研究[D]. 杭州: 浙江工商大学, 2016 SONG L J. Effect of nitric oxide treatment on preservation in kiwifruit and its involve physiological mechanism[D]. Hangzhou: Zhejiang Gongshang University, 2016.
[37] 王家保. 采后荔枝果皮衰老过程中生理变化与基因差异表达分析[D]. 海口: 华南热带农业大学, 2007 WANG J B. Analysis of physiological changes and differential gene expression during postharvest senescence of litchi pericarp[D]. Haikou: South China University of Tropical Agriculture, 2007.
[38] 姜丹. 水杨酸、硫化氢调控鲜切南瓜保鲜信号的机制[D]. 大连: 大连工业大学, 2016 JIANG D. Mechanism of controlling fresh-keeping pumpkin with salicylic acid and hydrogen sulfide[D]. Dalian: Dalian Polytechnic University, 2016.










 下载:
下载:


 下载:
下载:



