Optimization of High-pressure Enzymatic Hydrolysis for Extraction of Dermatan Sulfate and Analysis of Its Antioxidant Activity
-
摘要: 以猪肠粘膜提取肝素过程中透过液为原料,优化硫酸皮肤素提取工艺,探讨硫酸皮肤素的抗氧化能力。以硫酸皮肤素浓度为检测指标,筛选酶解最佳用酶,在单因素基础上通过Box-Behnken响应曲面试验优化高压酶解工艺,筛选最优大孔树脂,优化动态吸附洗脱条件纯化硫酸皮肤素,探究体外抗氧化活性。结果显示:在最佳酶解条件温度56 ℃,pH9.0,时间8.4 h,压力135 MPa下实测酶解硫酸皮肤素浓度为13.05 ng/mL,接近模型值;D312树脂以1.5 BV/h流速上样,4% NaOH 1.5 BV/h流速洗脱纯化效果最好,高效凝胶渗透色谱测定纯度达73.32%;硫酸皮肤素抗氧化能力与浓度呈正相关,DPPH自由基在2.4 mg/mL时清除率为36.29%,表现出一定清除能力,对于·OH 2.4 mg/mL时清除能力较强为68.2%,总还原力于2.4 mg/mL时为0.22。该研究为分离纯化硫酸皮肤素及其在抗氧化功能方面开发利用提供理论依据。Abstract: Taking permeate liquid in the process of extracting heparin from porcine intestinal mucosa as raw material, the extraction process of dermatan sulfate was optimized to explore the antioxidant capacity of dermatan sulfate. Taking the concentration of dermatan sulfate as the detection indicator, screening the best enzyme for enzymatic hydrolysis, on the basis of single factors, the high-pressure enzymatic hydrolysis process was optimized by Box-Behnken response surface test, the best macroporous resins were screened, the dynamic adsorption and elution conditions were optimized to purify dermatan sulfate, and investigating antioxidant activity in vitro. The results showed that: Under the optimal enzymatic hydrolysis conditions, temperature 56 ℃, pH9.0, time 8.4 h, and pressure 135 MPa, the measured concentration of dermatan sulfate was 13.05 ng/mL, which was close to the model value. D312 resin at 1.5 BV/h flow rate, 4% NaOH 1.5 BV/h flow rate elution and purification effect was the best, and high-performance gel permeation chromatography determination purity could reach 73.32%. The antioxidant capacity of dermatan sulfate was positively correlated with the concentration, the scavenging rate of DPPH free radical was 36.29% at 2.4 mg/mL, showing a certain scavenging ability. For ·OH, the scavenging ability was stronger at 2.4 mg/mL, which was 68.2%, and the total reducing power was 0.22 at 2.4 mg/mL. This study would provide a theoretical basis for the separation and purification of dermatan sulfate and its development and utilization in terms of antioxidant function.
-
硫酸皮肤素(Dermatan sulfate,DS),又称硫酸肤质、硫酸软骨素B,是一种线状阴离子多糖[1],具有抗凝血[2]、抗血栓[3]、抗氧化[4]、抗炎[5-6]和抗肿瘤[7]等生物活性,被广泛应用于医药行业中[8-11]。传统方法常以动物皮层,特别是水生生物(如鮟鱇鱼皮)为提取原料,目前工业上主要从猪皮和猪小肠中提取[12]。
DS以蛋白聚糖形式存在于哺乳动物细胞基质和结缔组织中[13-14],在生物体内通过共价键与蛋白质结合[15],因此需选取适当的酶切断共价键以达成提取DS目的。常使用木瓜蛋白酶、胰蛋白酶和Protamex复合蛋白酶等酶进行单酶或双酶复合水解,但均存在效率不高的问题,因此采用超高压技术通过施加一定压力使蛋白适当变性能够有效改善酶解效率[16-17]。朱文慧等[18]以鳕鱼骨为原料采用超高压耦合酶解工艺使酶解液氨基酸态氮含量提升1.68倍。原料酶解后仍含有较多杂质,离子交换树脂法能有效对DS分离纯化[19]。大孔树脂是一种兼具筛选和吸附能力的高分子材料,具备操作简便、不改变多糖原有结构和生物活性等优点,是理想DS吸附材料[20]。付莹[21]采用D208大孔吸附树脂以从鸡软骨中提取到纯度达72.03%的DS。
在猪肠粘膜提取肝素过程中,吸附透过液常作为废弃物被丢弃,经检测每毫升透过液中仍含有较高浓度DS(4.62 ng/mL),从中提取纯化DS既可以提高原料的利用率、降低污染,亦可增加产业价值[22]。本文以猪肠粘膜提取肝素透过弃液为原料,采用高压酶解结合树脂吸附技术,通过单因素和响应面试验优化酶解工艺和树脂吸附纯化条件,对DS与抗坏血酸(VC)进行抗氧化活性比较,为DS的提取及进一步研究应用提供实验基础。
1. 材料与方法
1.1 材料与仪器
猪肠粘膜肝素提取透过液 江西时通实业有限公司;醋酸纤维素薄膜(8 cm×12 cm) 腾辉化玻仪器;硫酸皮肤素标准品 北京普天同创生物科技公司;碱性蛋白酶(200 U/mg)、Protamex复合蛋白酶(100 U/mg)、木瓜蛋白酶(100 U/mg)、透析袋(1000 D) 北京索莱宝生物科技有限公司;D312树脂、D208树脂、D958树脂 新乡赛普瑞特有限公司;ELISA硫酸皮肤素酶联免疫试剂盒 上海梵态生物科技有限公司;无水乙醇、过氧化氢、1-二苯基-2-三硝基苯肼(DPPH自由基)、醋酸、抗坏血酸、甲苯胺蓝 分析纯,Sigma公司。
HL-300B恒流泵 兰格恒流泵有限公司;HZS-H水浴振荡器 哈尔滨东联电子技术开发有限公司;层析柱(直连通用B型,70 mL) 无锡天演生物;XQ-FD-10N冻干机 北京博医康实验仪器有限公司;TG-600酶标仪 Thermo Fisher科技公司;R-100旋转蒸发仪 瑞士Buchi有限公司;Power Pac HC电泳仪 Bio-rad生命医学有限公司;L-539超微分子压缩仪 沈阳人和机电工程设备有限公司。
1.2 实验方法
1.2.1 原料处理
猪肠粘膜肝素提取透过液经冻干、粉碎,过60目筛后得到冻干粉,−20 ℃保存。
1.2.2 蛋白酶的筛选
将碱性蛋白酶、Protamex复合蛋白酶、木瓜蛋白酶在最适pH和温度(表1)下向10 g样品中以18000 U/g酶底物比加酶水解8 h,结束后离心(8000 r/min,15 min)取上清以DS浓度为标准选择最适酶。DS浓度用试剂盒测定,DS抗体在经过标准品、样品、检测抗体温育洗涤后,使底物显蓝色,再经酸的作用转化黄色。颜色深浅与样品中DS浓度呈正相关,450 nm测定吸光度并计算浓度。根据标准曲线计算多糖浓度,标准曲线回归方程为y=0.1613x+0.0259,y代表吸光度值,x代表DS浓度(ng/mL),R2=0.9977。
表 1 不同蛋白酶最适pH和温度Table 1. Optimal pH and temperature for different proteases名称 最适pH 最适温度(℃) 碱性蛋白酶 9.0 45 Protamex复合蛋白酶 7.5 45 木瓜蛋白酶 7.0 55 1.2.3 高压酶解工艺的单因素实验
参考徐俊涛[23]的方法略作改动,进行温度、时间、pH和压力单因素实验。
1.2.3.1 酶解时间的选择
以酶解液DS浓度为指标,酶解温度45 ℃,pH9.0,酶添加量18000 U/g,压力100 MPa为基本条件,探究不同时间(1、2、3、4、5、6、7、8、9 h)条件下酶解效果。
1.2.3.2 酶解温度的选择
以酶解液DS浓度为指标,时间7 h,pH9.0,酶添加量18000 U/g,压力100 MPa为基本条件,设置不同温度(45、50、55、60 ℃)条件,探究酶解效果。
1.2.3.3 pH的选择
以酶解液DS浓度为指标,时间7 h,温度45 ℃,酶添加量18000 U/g,压力100 MPa为基本条件,探究不同pH(7.0、7.5、8.0、8.5、9.0、9.5)条件下酶解效果。
1.2.3.4 酶解压力的选择
以酶解液DS浓度为指标,时间7 h,温度45 ℃,pH9.0,酶添加量18000 U/g为基本条件,使用超微分子压缩仪设置不同压力(0、50、100、150、200 MPa)条件,探究酶解效果。
1.2.4 响应面试验
综合单因素的实验结果,选择软件Design-Expert利用Box-Behnken法设计四因素三水平实验,因素水平见表2。响应面结束后以所得最佳条件进行酶解,升温至85 ℃灭活后,过100目筛除杂后4000 r/min离心20 min,取上清即粗多糖溶液。
表 2 响应面设计因素及水平Table 2. Response surface design factors and levels水平 因素 A酶解温度(℃) B pH C酶解时间(h) D压力(MPa) −1 50 8.5 7 100 0 55 9.0 8 150 1 60 9.5 9 200 1.2.5 大孔树脂筛选
树脂预处理:以去离子水充分浸泡树脂,依次用4% HCl、4% NaOH溶液交替搅拌3 h,去离子水冲洗至中性后浸泡4 ℃保存备用[24]。
称取15 g经预处理的D208、D312、D958树脂,分别装入具塞三角瓶中,每瓶加入125 mL粗多糖溶液,置于55 ℃恒温振荡器中100 r/min振荡吸附过夜,以吸附量为标准选择最佳树脂。根据式(1)计算DS吸附量。
DS吸附量=(t0−t1)×V溶液 (1) 注:t0:吸附前溶液DS浓度(ng/mL);t1:吸附后溶液DS浓度(ng/mL);V溶液:溶液体积(mL)。
1.2.6 树脂吸附纯化工艺优化
1.2.6.1 吸附流速优化
称取30 g经预处理树脂以湿法装柱,去离子水平衡。粗多糖溶液在55 ℃条件下分别以1.0、1.5、2.0、2.5 BV/h上样,20 mL/管取样并测定DS浓度,吸附量达到饱和值时停止吸附,绘制吸附曲线并确定最优流速。
1.2.6.2 洗脱流速优化
树脂处理同1.2.6.1,粗多糖溶液以1.2.6.1所得最优流速上样至树脂饱和,用4% NaOH分别以1.0、1.5、2.0、2.5 BV/h进行洗脱,20 mL/管取样并测定DS浓度,当浓度稳定后停止洗脱,绘制洗脱曲线。
1.2.6.3 透析脱盐
参考薛发刚[25]的方法,洗脱液透析4 d,每隔6 h换一次水,透析后加入3倍体积的无水乙醇,4 ℃过夜后离心,将沉淀冻干后得到DS称重。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除能力测定
试验参考Nevin等[26]方法。将DS配制成浓度分别为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL的溶液,依次加入DPPH试剂,混匀后室温避光反应30 min,于517 nm处测得OD值为A2;以蒸馏水代替样品测得OD值为A1;无水乙醇代替DPPH测得OD值为A0。根据式(2)计算DPPH清除率。
DPPH自由基清除率(%)=[1−(A2−A0)A1]×100 (2) 1.2.7.2 羟基自由基清除率测定
参考李珊珊等[27]方法,将DS配制成浓度为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL的溶液,分别加入6 mmol/L FeSO4溶液、10%双氧水,摇匀后加入6 mmol/L水杨酸乙醇,37 ℃反应30 min,于510 nm测定OD值为A2;以蒸馏水代替双氧水OD值为A1;以蒸馏水代替样品OD值为A0。根据式(3)计算羟基自由基清除率。
羟基自由基清除率(%)=[1−A2−A1A0]×100 (3) 1.2.7.3 还原力测定
参考Oyaizu[28]方法,将DS配制成浓度分别为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL的溶液。取样品溶液0.5 mL加入磷酸缓冲液0.5 mL及K3Fe(CN)6 2.5 mL混匀,50 ℃水浴20 min,加入0.5 mL三氯乙酸,混匀后4000 r/min离心20 min取上清,加入蒸馏水和0.1% FeCl3溶液,静置10 min于700 nm测OD值为A2;以蒸馏水代替上清OD值为A1,根据式(4)计算还原力。
总还原能力=A2−A1 (4) 1.2.8 醋酸纤维素薄膜电泳分析
采用醋酸纤维薄膜电泳对得到DS进行分析,使用0.1 mol/L醋酸钡缓冲液,在100 V、4 mA的条件下电泳3 h后用0.1%甲苯胺蓝溶液染色0.5 h,2%醋酸溶液脱色 0.5 h[29]。
1.2.9 纯度测定
DS纯度测定采用高效凝胶渗透色谱法。以DS标品为对照,色谱柱为Ultrahydrogel Linear(7.8 mm×300 mm),流动相为超纯水,柱温30 ℃,流速1.2 mL/min,进样量20 μL[12]。
1.3 数据处理
实验均平行重复三次,数据统计采用Origin 2019进行数据处理拟合绘图,SPSS 20进行显著性分析,P<0.05和P<0.01分别指差异显著及极显著,响应曲面试验用Design-Expert软件进行设计和结果统计分析。
2. 结果与分析
2.1 蛋白酶的筛选
由表3可知,碱性蛋白酶酶解后溶液中的DS浓度显著高于Protamex复合蛋白酶和木瓜蛋白酶(P<0.05),效果最佳,后续实验采用碱性蛋白酶。蛋白酶具有专一性,不同酶的酶切位点不同,对酶解效果具有重要影响,选择合适作用位点的酶进行酶解至关重要。
表 3 三种酶酶解效果的影响Table 3. Effects of different enzymes on enzymatic hydrolysis酶的种类 酶解后溶液中DS浓度(ng/mL) 碱性蛋白酶 8.82±0.31a Protamex复合蛋白酶 6.21±0.09b 木瓜蛋白酶 4.58±0.14c 注:同列不同小写字母表示差异显著(P<0.05);表6同。 2.2 酶解条件实验
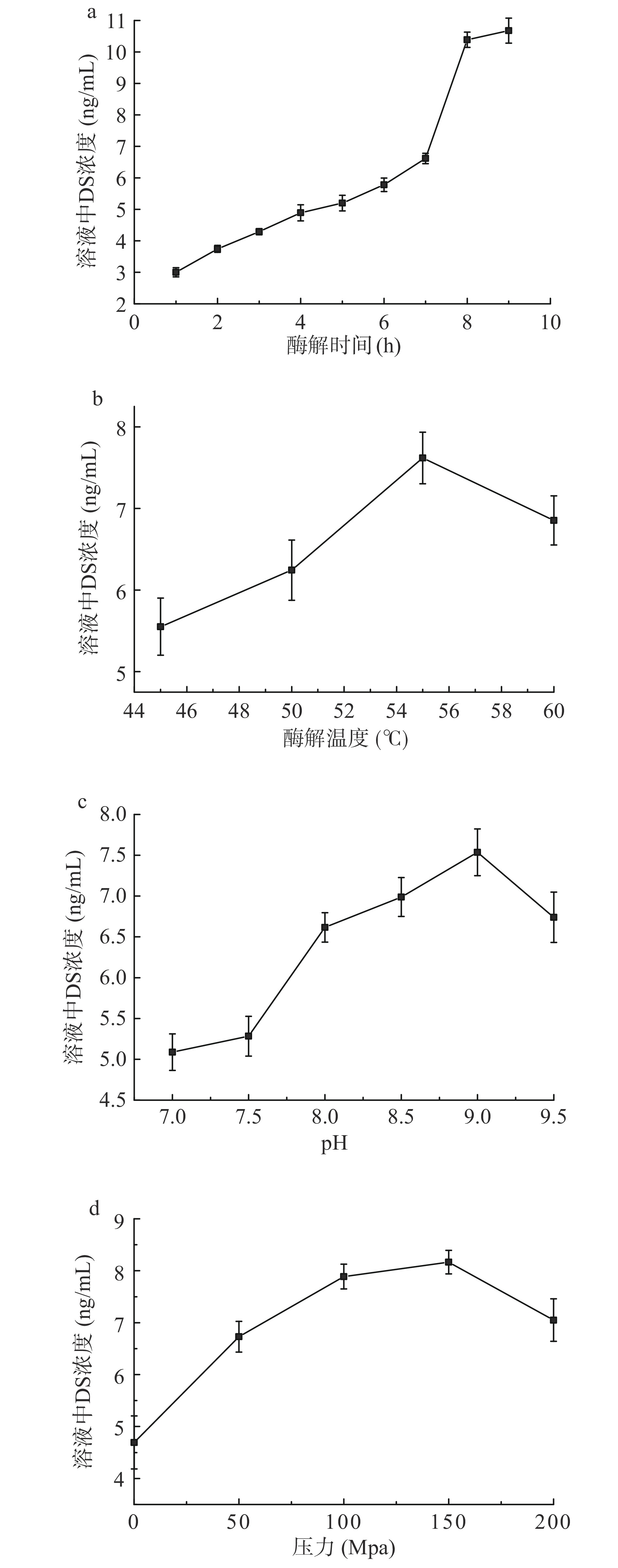
由图1a可知,溶液DS浓度在1~6 h时平缓上升,7~8 h之间显著(P<0.05)上升,8 h后浓度趋于稳定。可能是超高压酶解时,机器封闭,原料自然沉积底部接触面积较小导致前期酶解效率不高,故选择8 h为响应面0水平。
由图1b可知,溶液中DS浓度随温度升高先上升后下降,55 ℃时浓度达到最大值(7.61±0.31) ng/mL,当温度继续升高,可能影响了蛋白酶活性导致水解能力下降,DS浓度反而下降。故选择55 ℃为响应面0水平。
由图1c可知,溶液中DS浓度随pH升高逐渐增加,pH9.0时达到最大值,随后呈下降趋势,原因可能是过酸或过碱条件导致酶催化能力降低[30]。故选择pH9.0为响应面0水平。
由图1d可知,压力从0.1~200 MPa的过程中,DS浓度先增后减,在150 MPa时浓度最高,为(8.17±0.23) ng/mL,说明适度的压力可以激活酶活力中心。故选择150 MPa为响应面0水平。
2.3 响应面试验结果
2.3.1 试验设计与结果
响应面试验设计及结果如表4所示。对结果进行方差分析,对数据进行回归拟合,得到响应曲面回归方程如下:
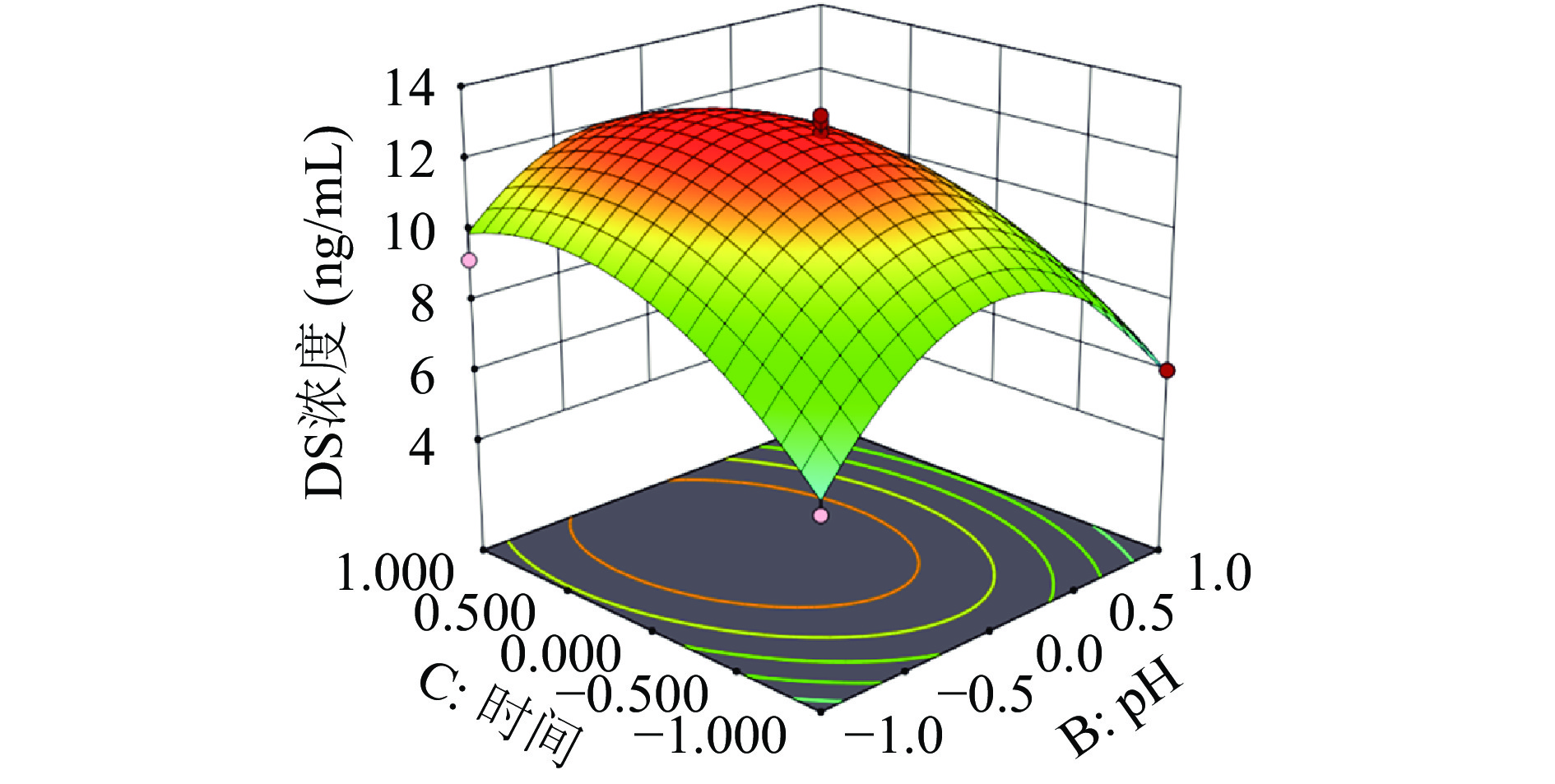
表 4 响应曲面试验设计及结果Table 4. Design and experimental results of response surface methodology实验号 A B C D Y:DS浓度(ng/mL) 1 0 0 0 0 11.95 2 0 1 0 −1 7.89 3 0 1 −1 0 6.03 4 0 0 0 0 12.63 5 −1 −1 0 0 7.38 6 0 0 0 0 13.02 7 1 0 0 −1 10.05 8 1 −1 0 0 9.12 9 0 0 0 0 12.73 10 1 0 −1 0 8.62 11 0 −1 0 1 8.96 12 −1 0 −1 0 7.67 13 0 −1 −1 0 5.94 14 −1 1 0 0 6.46 15 0 −1 1 0 9.19 16 1 0 1 0 11.24 17 0 0 0 0 13.21 18 1 1 0 0 7.80 19 0 1 1 0 6.10 20 −1 0 1 0 8.93 21 0 −1 0 −1 9.69 22 0 0 1 1 9.88 23 0 0 −1 1 8.08 24 −1 0 0 −1 9.57 25 −1 0 0 1 8.60 26 0 0 1 −1 12.38 27 1 0 0 1 9.26 28 0 1 0 1 4.13 29 0 0 −1 −1 9.22 Y=12.71+0.6233A−0.9892B+1.01C−0.8242D−0.1AB+0.34AC+0.045AD−0.795BC−0.7575BD−0.34CD−1.69A2−3.69B2−1.87C2−1.31D2
如表5可见:该模型整体(P<0.0001)极显著,失拟项(P=0.1589>0.05)不显著,说明模型可以真实反应试验,残差来源于随机误差。根据回归方程均方可知,各因素对响应值的影响力排序为:酶解时间(C)>pH(B)>压力(D)>酶解温度(A)。复相关系数R2=0.90,表明响应值(DS浓度)变化有90%来自于试验因素(温度、pH、时间、压力),可以较好解释各因素与响应值之间关系。因此,该模型拟合度良好,利用该回归方程可以对高压酶解效果进行分析预测。
表 5 方差分析结果Table 5. ANOVA results因素 平方和 自由度 均方 F值 P值 模型 145.52 14 10.39 19.01 < 0.0001** A 4.66 1 4.66 8.53 0.0112* B 11.74 1 11.74 21.47 0.0004** C 12.32 1 12.32 22.53 0.0003** D 8.15 1 8.15 14.9 0.0017** AB 0.04 1 0.04 0.0731 0.7908 AC 0.4624 1 0.4624 0.8455 0.3734 AD 0.0081 1 0.0081 0.0148 0.9049 BC 2.53 1 2.53 4.62 0.0495* BD 2.3 1 2.3 4.2 0.0597 CD 0.4624 1 0.4624 0.8455 0.3734 A2 18.55 1 18.55 33.92 < 0.0001** B2 88.43 1 88.43 161.71 < 0.0001** C2 22.65 1 22.65 41.41 < 0.0001** D2 11.21 1 11.21 20.51 0.0005** 残差 7.66 14 0.5469 失拟项 6.73 10 0.6726 2.89 0.1589 纯误差 0.9305 4 0.2326 总误差 153.18 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 图2可直观表示出当某因素被固定为中心点水平时,其他因素交互作用对响应值影响,曲面弯曲程度越大,因素交互作用越强,因素之间相关影响程度也就越大。
2.3.2 工艺优化与结果验证
结合响应面进行优化分析,以响应值最大为评价指标,得到最佳工艺条件为温度56.1℃,pH8.9,时间8.35 h,压力134.3 MPa,在此条件下DS浓度预测值为13.15 ng/mL。考虑实际可行性,调整工艺条件为温度56 ℃,pH9.0,时间8.4 h,压力135 MPa。经平行实验验证,DS浓度实际值为13.05 ng/mL,误差为0.1 ng/mL,与预测值接近,说明本模型具有可行性。
2.4 大孔树脂筛选
表6对比三种不同型号树脂吸附前后溶液中DS浓度变化,D312树脂吸附效果显著高于其余两种树脂(P<0.05)。树脂的吸附性能取决于树脂功能基与空间结构,一般非极性化合物易被非极性树脂吸附,极性树脂可以吸附极性物质[20]。DS作为具有一定极性的聚阴离子化合物,阴离子交换树脂D312是其纯化最佳树脂。本实验选用D312树脂进行后续实验。
表 6 树脂静态吸附结果Table 6. Result of resin static adsorption树脂型号 粒度范围(mm) 吸附前溶液中DS浓度(ng/mL) 吸附后溶液中DS浓度(ng/mL) D208 0.45~1.25 13.08±0.17a 10.94±0.13b D312 0.25~1.5 13.08±0.17a 8.31±0.21c D958 0.31~1.25 13.08±0.17a 11.58±0.12a 2.5 动态吸附实验
2.5.1 上样流速优化
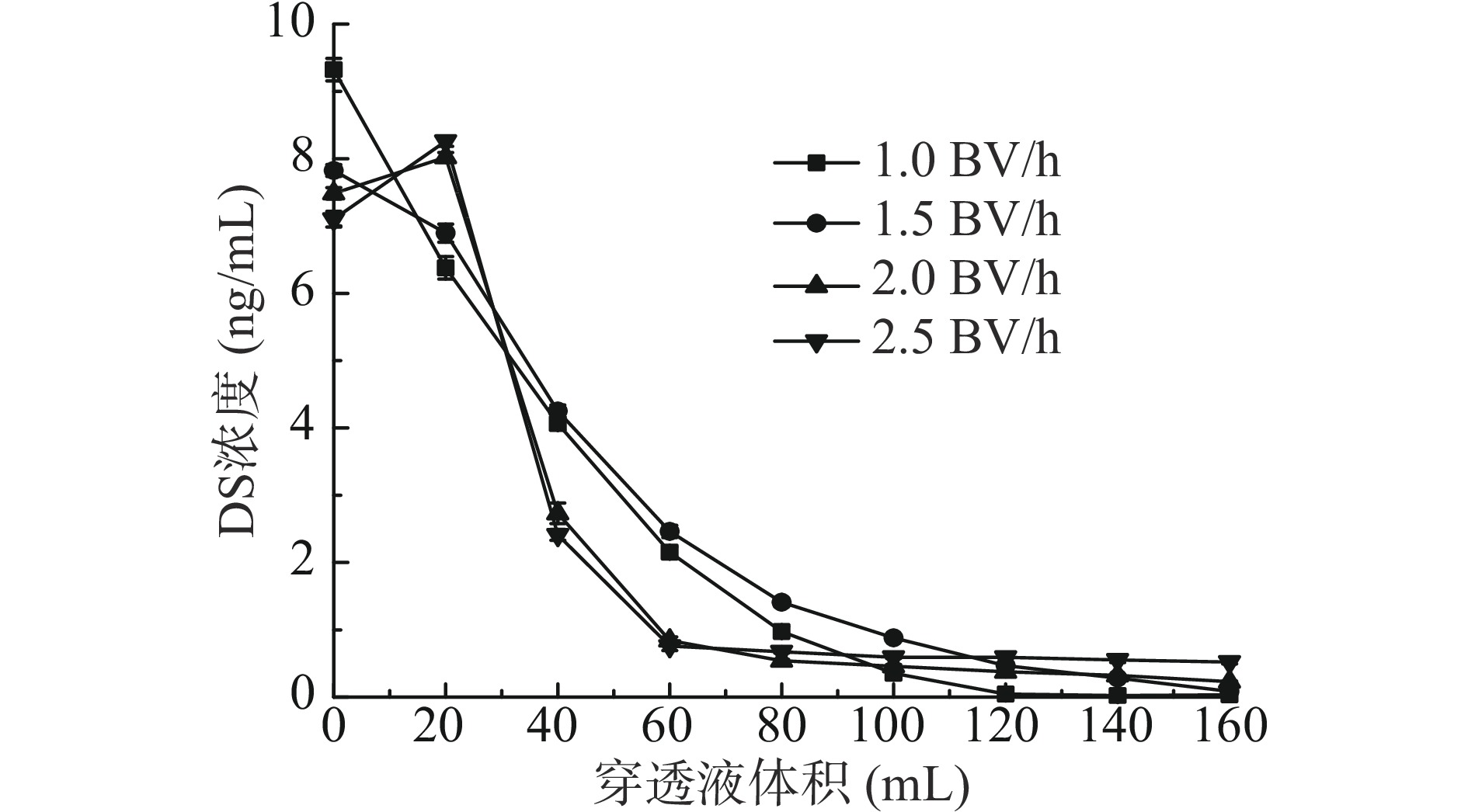
图3为D312树脂在不同上样流速下穿透液中DS浓度变化曲线。随着体积的增加,不同流速的DS浓度均升高,表明树脂的吸附能力下降。由图可见,2.5 BV/h相比于其他三种流速DS浓度上升最快,于120 mL最先到达平衡点,与横坐标所截面积最大,说明穿透溶液中DS浓度高;1.0 BV/h流速最晚到达稳定点,穿透溶液中DS浓度低。原因是流速快,导致DS与树脂接触不充分,吸附效果差;相反,流速越慢吸附效果越好,但时间成本高。考虑到吸附量与所需时间,1.5 BV/h与横坐标截面较2.0 BV/h更小,即吸附量较大,效果更优,故采用1.5 BV/h流速进行树脂吸附。
2.5.2 洗脱流速优化
图4为4% NaOH洗脱时不同流速穿透液中DS浓度变化曲线。解吸流速为2.0和2.5 BV/h时,于20 mL时出现峰值,而后洗脱液中DS浓度持续下降,100 mL后趋于稳定,但拖尾较长;解析流速为1.0和1.5 BV/h,峰值出现早,洗脱液中DS浓度随解析进行持续下降,于120和160 mL时趋于稳定,无拖尾。这是因为流速过快,树脂与洗脱液的接触不充分,DS还未被完全解吸下来,导致拖尾现象严重,造成材料的浪费;反之,流速过慢所需时间长,不利于生产。综合考虑时间成本,以1.5 BV/h洗脱流速最为合适。
2.6 抗氧化能力的测定
2.6.1 DPPH自由基清除能力
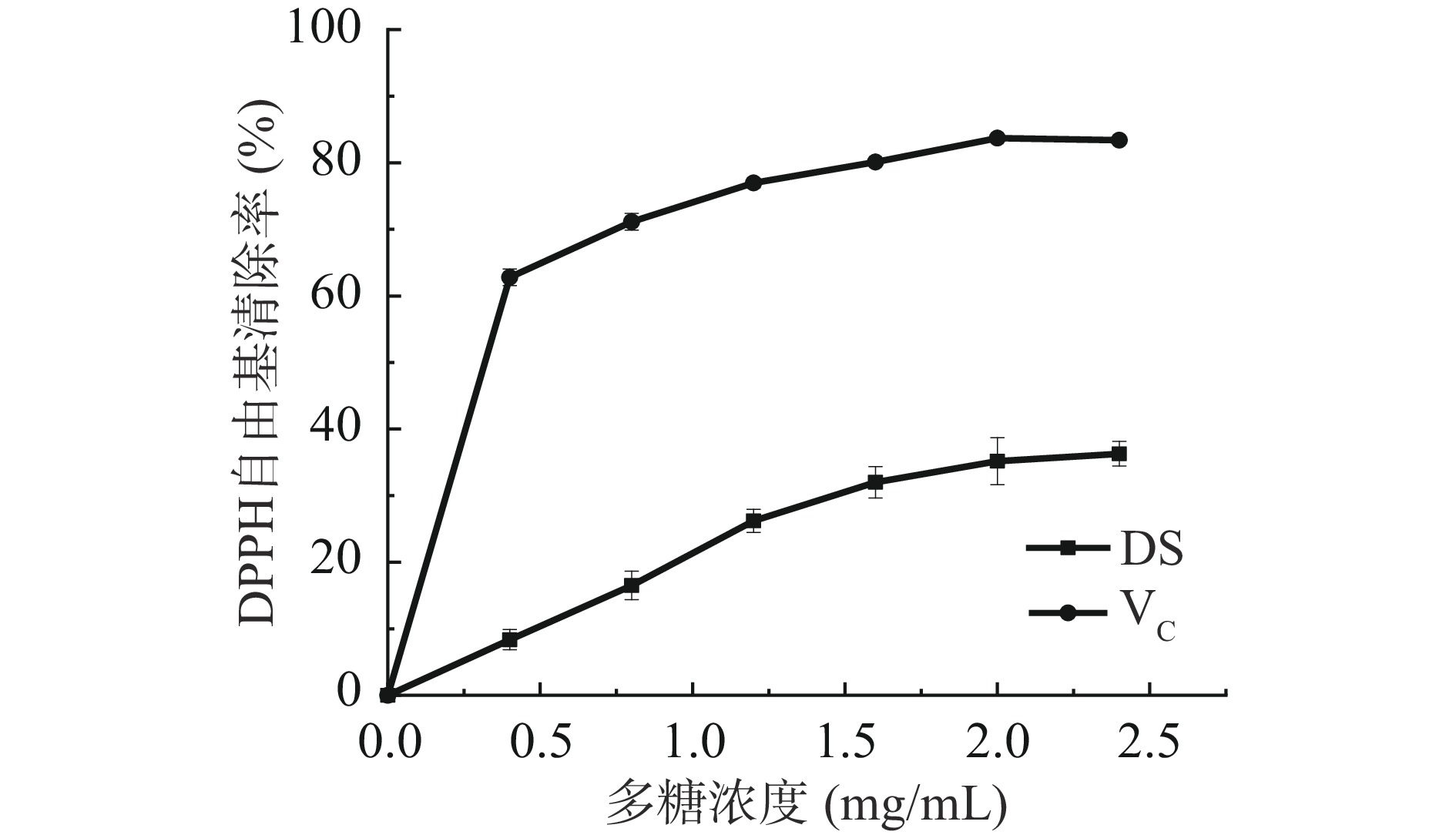
由图5可知,在测定浓度范围内,DS对DPPH自由基清除能力随浓度增长而加强,呈浓度依赖性。在2.0 mg/mL时DPPH自由基清除率为35.17%,当浓度达2.4 mg/mL时清除率为36.29%,DPPH自由基清除率增加趋势变缓,与阳性对照VC相比,清除能力可达VC的43.5%。可见DS具有一定的抑制DPPH自由基能力。
2.6.2 羟自由基清除能力
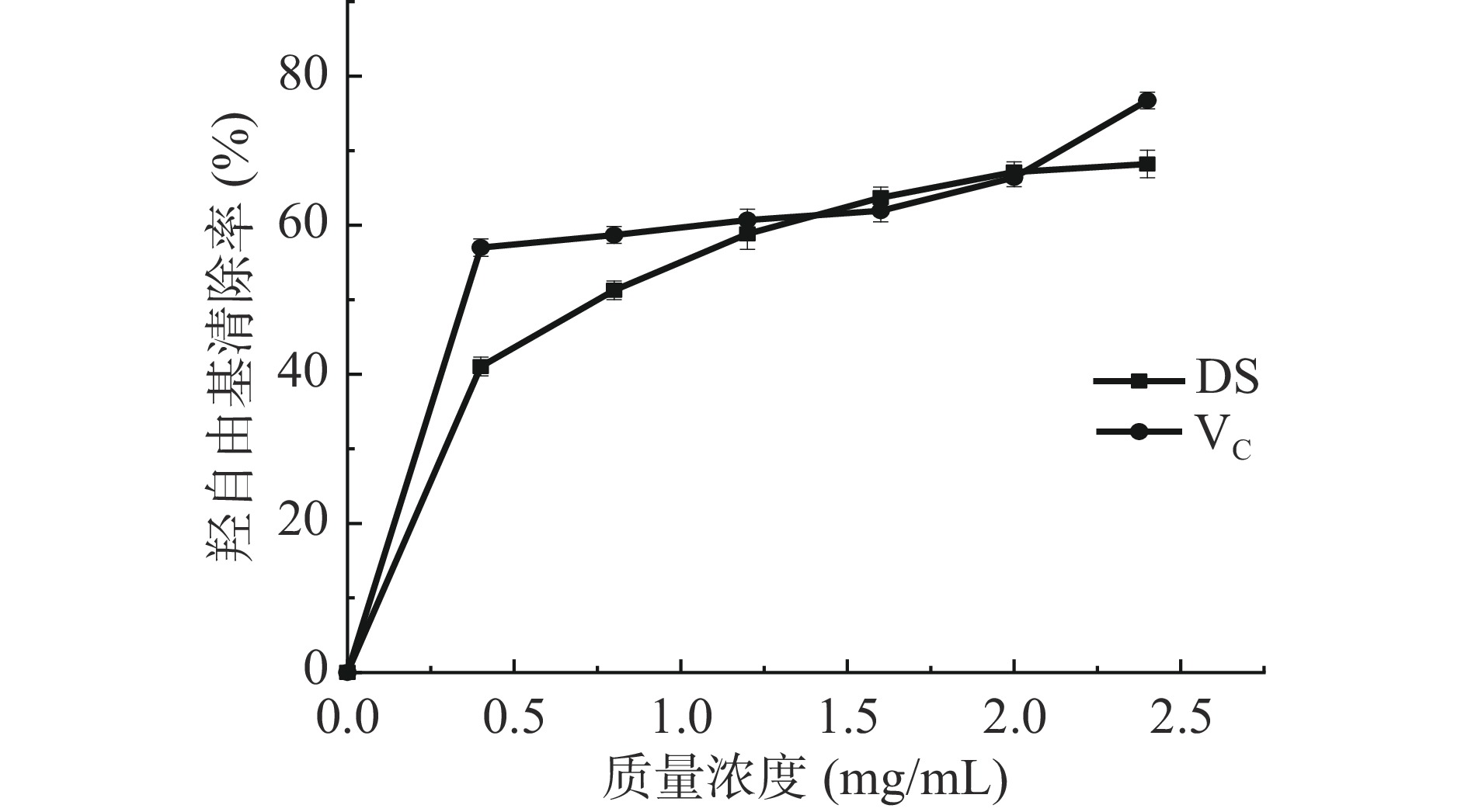
通过清除氧自由基中最活跃的·OH,从而减少有色物质的生成,以510 nm处OD值为评价标准定量样品对·OH的清除能力。图6表明,不同浓度DS与VC对羟自由基均具有较好抑制率,且随浓度增加而增大。当浓度在1.5、2.0 mg/mL时,DS的羟自由基清除率达63.7%、67.13%,均高于VC,可见DS具有抑制羟自由基的能力。
2.6.3 还原力测定
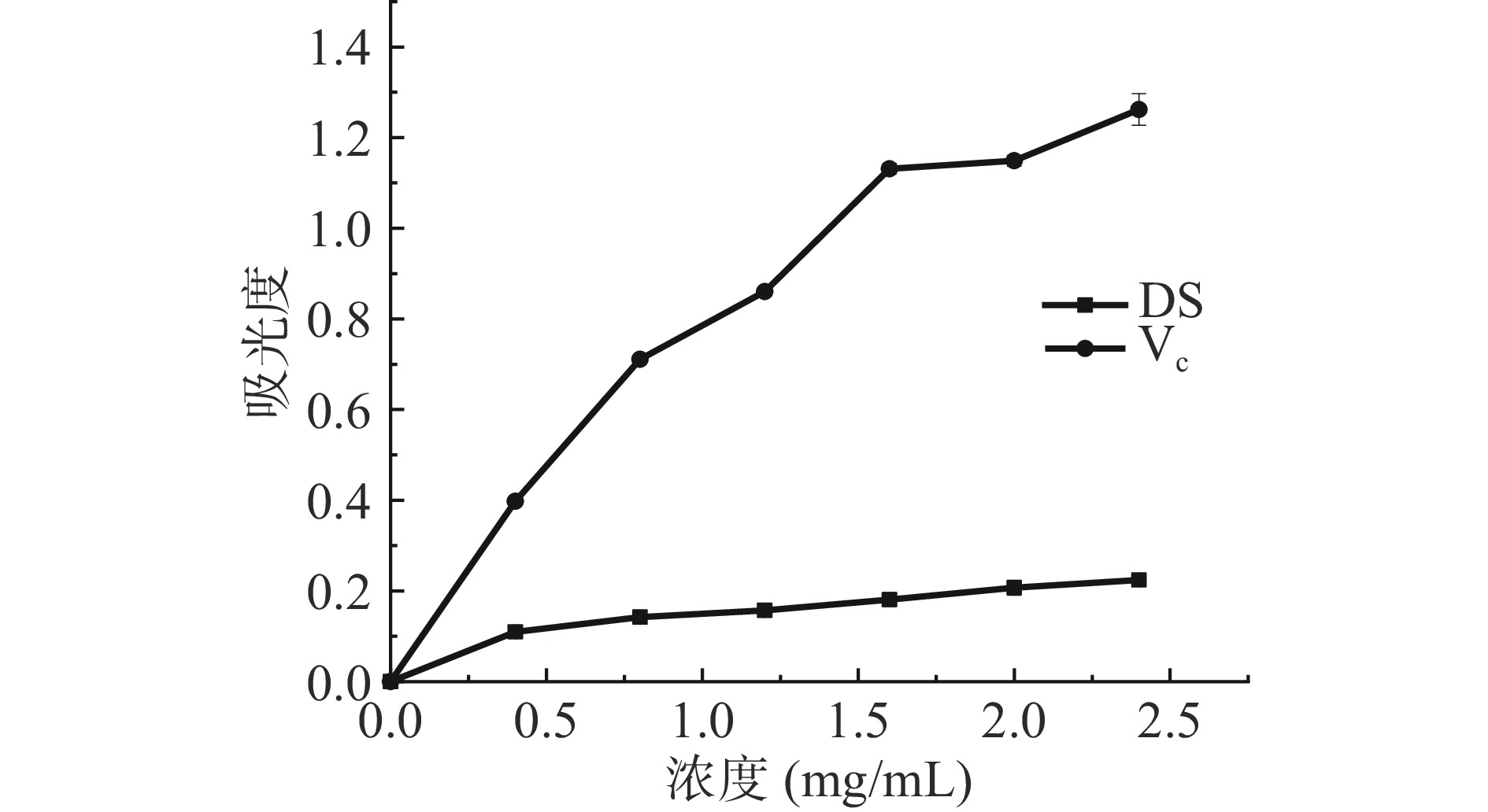
抗氧化剂的还原力是通过自身氧化给出电子清除自由基实现,DS还原力分析如图7所示,不同浓度DS还原力不同,随浓度升高还原力逐渐增加呈缓慢递增趋势,在DS浓度由0.4 mg/mL升至2.5 mg/mL时,还原力由0.11升至0.22,低浓度DS还原力较低,随浓度升高仍明显弱于阳性对照VC,说明其还原力较弱。
2.7 醋酸纤维薄膜电泳结果
纯化后得到DS多糖,进行醋酸纤维素薄膜电泳实验分析结果如图8所示,样品电泳后得到单一条带,且两者迁移距离和形状类似,说明纯化后DS多糖样品与标准品组分接近,达到了电泳纯,但无法测定具体纯度[31]。
2.8 色谱分析
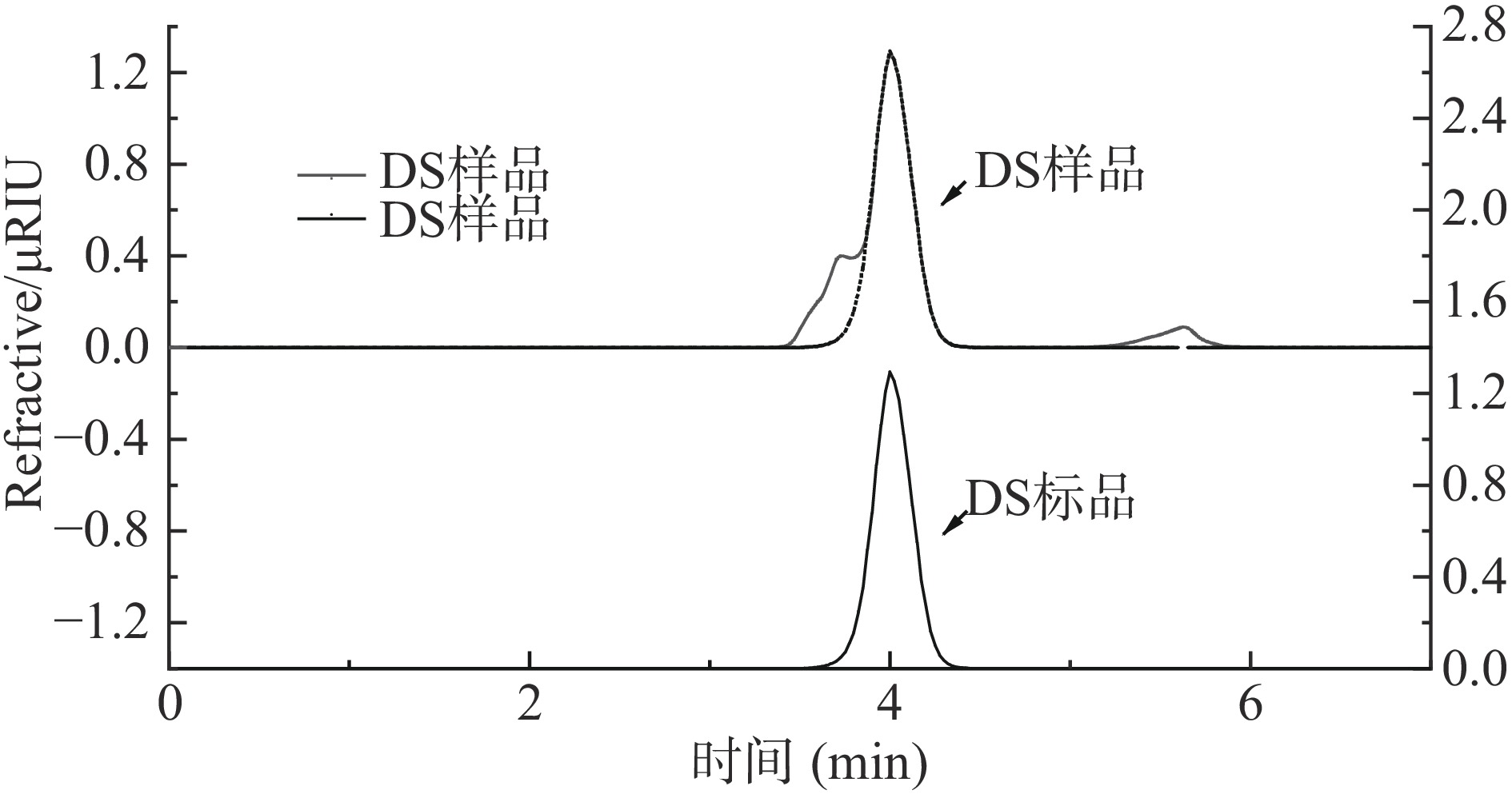
通过高效凝胶渗透色谱分析纯化后DS纯度为73.32%,相较付莹[21]采用D218树脂提取纯度提升1.29%。由图9可知,在时间为3.7和5.725 min时出现杂质峰,表明样品中含有其他分子量物质,这可能是硫酸软骨素和透明质酸钠。
3. 结论
本实验采用高压酶解结合树脂吸附技术提取DS,通过单因素和响应面试验优化最佳酶解工艺和树脂吸附条件,探讨了抗氧化活性。结果表明:在温度56 ℃,pH9.0,压力135 MPa处理8.4 h最优条件下,DS浓度达到13.05 ng/mL;使用D312树脂以1.5 BV/h流速上样,4% NaOH以1.5 BV/h流速洗脱条件下得到DS纯度可达73.32%;此外抗氧化试验表明,DS多糖还原力较弱,对DPPH自由基、羟基自由基具有清除能力,具备一定抗氧化活性。高压酶解结合树脂吸附工艺不仅提高了酶解效果,还提升了纯度。纯化后DS色谱存在杂质峰,电泳方法不能鉴定,后续需进一步探究高纯度DS纯化方法和其他成分结构鉴定方法,为DS产品开发利用提供理论参考与数据支撑。
-
表 1 不同蛋白酶最适pH和温度
Table 1 Optimal pH and temperature for different proteases
名称 最适pH 最适温度(℃) 碱性蛋白酶 9.0 45 Protamex复合蛋白酶 7.5 45 木瓜蛋白酶 7.0 55 表 2 响应面设计因素及水平
Table 2 Response surface design factors and levels
水平 因素 A酶解温度(℃) B pH C酶解时间(h) D压力(MPa) −1 50 8.5 7 100 0 55 9.0 8 150 1 60 9.5 9 200 表 3 三种酶酶解效果的影响
Table 3 Effects of different enzymes on enzymatic hydrolysis
酶的种类 酶解后溶液中DS浓度(ng/mL) 碱性蛋白酶 8.82±0.31a Protamex复合蛋白酶 6.21±0.09b 木瓜蛋白酶 4.58±0.14c 注:同列不同小写字母表示差异显著(P<0.05);表6同。 表 4 响应曲面试验设计及结果
Table 4 Design and experimental results of response surface methodology
实验号 A B C D Y:DS浓度(ng/mL) 1 0 0 0 0 11.95 2 0 1 0 −1 7.89 3 0 1 −1 0 6.03 4 0 0 0 0 12.63 5 −1 −1 0 0 7.38 6 0 0 0 0 13.02 7 1 0 0 −1 10.05 8 1 −1 0 0 9.12 9 0 0 0 0 12.73 10 1 0 −1 0 8.62 11 0 −1 0 1 8.96 12 −1 0 −1 0 7.67 13 0 −1 −1 0 5.94 14 −1 1 0 0 6.46 15 0 −1 1 0 9.19 16 1 0 1 0 11.24 17 0 0 0 0 13.21 18 1 1 0 0 7.80 19 0 1 1 0 6.10 20 −1 0 1 0 8.93 21 0 −1 0 −1 9.69 22 0 0 1 1 9.88 23 0 0 −1 1 8.08 24 −1 0 0 −1 9.57 25 −1 0 0 1 8.60 26 0 0 1 −1 12.38 27 1 0 0 1 9.26 28 0 1 0 1 4.13 29 0 0 −1 −1 9.22 表 5 方差分析结果
Table 5 ANOVA results
因素 平方和 自由度 均方 F值 P值 模型 145.52 14 10.39 19.01 < 0.0001** A 4.66 1 4.66 8.53 0.0112* B 11.74 1 11.74 21.47 0.0004** C 12.32 1 12.32 22.53 0.0003** D 8.15 1 8.15 14.9 0.0017** AB 0.04 1 0.04 0.0731 0.7908 AC 0.4624 1 0.4624 0.8455 0.3734 AD 0.0081 1 0.0081 0.0148 0.9049 BC 2.53 1 2.53 4.62 0.0495* BD 2.3 1 2.3 4.2 0.0597 CD 0.4624 1 0.4624 0.8455 0.3734 A2 18.55 1 18.55 33.92 < 0.0001** B2 88.43 1 88.43 161.71 < 0.0001** C2 22.65 1 22.65 41.41 < 0.0001** D2 11.21 1 11.21 20.51 0.0005** 残差 7.66 14 0.5469 失拟项 6.73 10 0.6726 2.89 0.1589 纯误差 0.9305 4 0.2326 总误差 153.18 28 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 6 树脂静态吸附结果
Table 6 Result of resin static adsorption
树脂型号 粒度范围(mm) 吸附前溶液中DS浓度(ng/mL) 吸附后溶液中DS浓度(ng/mL) D208 0.45~1.25 13.08±0.17a 10.94±0.13b D312 0.25~1.5 13.08±0.17a 8.31±0.21c D958 0.31~1.25 13.08±0.17a 11.58±0.12a -
[1] ZHANG B, CHI L. Chondroitin sulfate/Dermatan sulfate-protein interactions and their biological functions in human diseases: Implications and analytical tools[J]. Frontiers in Cell and Developmental Biology,2021,9:693563. doi: 10.3389/fcell.2021.693563
[2] BOUGATEF H, KRICHEN F, CAPITANI F, et al. Purification, compositional analysis, and anticoagulant capacity of chondroitin sulfate/dermatan sulfate from bone of corb (Sciaena umbra)[J]. International Journal of Biological Macromolecules,2019,134:405−412. doi: 10.1016/j.ijbiomac.2019.05.036
[3] BOUGATEF H, GHLISSI Z, KALLEL R, et al. Chondroitin/dermatan sulfate purified from corb (Sciaena umbra) skin and bone: In vivo assessment of anticoagulant activity[J]. International Journal of Biological Macromolecules,2020,164:131−139. doi: 10.1016/j.ijbiomac.2020.07.096
[4] SOUSA G, PALMERO C Y, SOUZA-MENEZES J D, et al. Dermatan sulfate obtained from the Phallusia nigra marine organism is responsible for antioxidant activity and neuroprotection in the neuroblastoma-2A cell lineage[J]. International Journal of Biological Macromolecules,2020,164:1099−1111. doi: 10.1016/j.ijbiomac.2020.06.285
[5] GRUBER S, ARNOLD M, CINI N, et al. Radioprotective effects of dermatan sulfate in a preclinical model of oral mucositis-targeting inflammation, hypoxia and junction proteins without stimulating proliferation[J]. International Journal of Molecular Sciences,2018,19(6):1684−1684. doi: 10.3390/ijms19061684
[6] SHANG C X, CAI C, ZHAO C X, et al. Synthesis and anti-inflammatory activity of gold-nanoparticle bearing a dermatan sulfate disaccharide analog[J]. Chinese Chemical Letters,2018,29(1):81−83. doi: 10.1016/j.cclet.2017.06.010
[7] USTYUZHANINA N E, BILAN M I, DMITRENOK A S, et al. Oversulfated dermatan sulfate and heparinoid in the starfish Lysastrosoma anthosticta: Structures and anticoagulant activity[J]. Carbohydrate Polymers,2021,261:117867. doi: 10.1016/j.carbpol.2021.117867
[8] CINI N, GRUBER S, ARICAN A Z, et al. Modulation of radiation-induced oral mucositis (mouse) by dermatan sulfate: Effects on differentiation processes[J]. Strahlentherapie und Onkologie,2020,196(1):85−94. doi: 10.1007/s00066-019-01532-8
[9] SYLVIA G, KATHARINA F, PETER K, et al. Protective effects of systemic dermatan sulfate treatment in a preclinical model of radiation-induced oral mucositis[J]. Strahlentherapie und Onkologie,2018,194(7):675−685. doi: 10.1007/s00066-018-1280-8
[10] PAN P, CHEN M, ZHANG Z L, et al. A novel LC-MS/MS assay to quantify dermatan sulfate in cerebrospinal fluid as a biomarker for mucopolysaccharidosis II[J]. Bioanalysis,2018,10(11):825−838. doi: 10.4155/bio-2018-0025
[11] 毛宝亮, 胡斌, 贾磊, 等. 胶原/硫酸软骨素/成纤维生长因子复合人工眼角膜的制备[J]. 中国组织工程研究,2018,22(14):2203−2208. [MAO B L, HU B, JIA J, et al. Artificial cornea preparation using collagen/chondroitin sulfate/fibroblast growth factor composite film[J]. Chinese Journal of Tissue Engineering Research,2018,22(14):2203−2208. doi: 10.3969/j.issn.2095-4344.0767 MAO B L, HU B, JIA J, et al. Artificial cornea preparation using collagen/chondroitin sulfate/fibroblast growth factor composite film[J]. Chinese Journal of Tissue Engineering Research, 2018, 22(14): 2203-2208. doi: 10.3969/j.issn.2095-4344.0767
[12] 廖文娟. 鮟鱇鱼皮硫酸皮肤素的提取、纯化、结构和活性研究[D]. 杭州: 浙江工商大学, 2008 LIAO W J. Studies on the extraction, purification structure and anticoagulant activity of dermatan sulfate from lophius litulon skin[D]. Hangzhou: Zhejiang Gongshang University, 2008.
[13] WANG W S, SHI L R, QIN Y, et al. Research and application of chondroitin sulfate/dermatan sulfate-degrading enzymes[J]. Frontiers in Cell and Developmental Biology,2020,9:237−241.
[14] 朱屋彪, 侯勇, 叶大彬, 等. 肝素中微量硫酸皮肤素的测定方法简介[J]. 山东化工,2014,43(3):37−38. [ZHU W B, HOU Y, YE D B, et al. Introduction of the detection method of trace dermatan sulfate in heparin[J]. Shandong Chemical Industry,2014,43(3):37−38. ZHU W B, HOU Y, YE D B, et al. Introduction of the detection method of trace dermatan sulfate in heparin[J]. Shandong Chemical Industry, 2014, 43(03): 37-38.
[15] NADEGE G, TANJA S, CHRISTIAN H, et al. Gene expression of the two developmentally regulated dermatan sulfate epimerases in the Xenopus embryo[J]. PLoS ONE,2018,13(1):175−181.
[16] 谢继青, 姬胜利, 王凤山, 等. 硫酸皮肤素的药理作用研究进展[J]. 药物生物技术,2001,8(4):234−238. [XIE J Q, JI S L, WANG F S, et al. Research progress in pharmacology of dermatan sulfate[J]. Pharmaceutical Biotechnology,2001,8(4):234−238. doi: 10.3969/j.issn.1005-8915.2001.04.017 XIE J Q, JI S L, WANG F S, et al. Research progress in pharmacology of dermatan sulfate[J]. Pharmaceutical Biotechnology, 2001, 8(4): 234-238. doi: 10.3969/j.issn.1005-8915.2001.04.017
[17] 孙萍, 杜德红, 曹润智, 等. 鳕鱼皮中硫酸皮肤素的提取工艺[J]. 食品研究与开发,2015,36(3):27−30. [SUN P, DU D J, CAO R Z, et al. Extraction of dermatan sulfate from cod skin[J]. Food Research and Development,2015,36(3):27−30. doi: 10.3969/j.issn.1005-6521.2015.03.007 SUN P, DU D J, CAO R Z, et al. Extraction of dermatan sulfate from cod skin[J]. Food Research and Development, 2015, 36(3): 27-30. doi: 10.3969/j.issn.1005-6521.2015.03.007
[18] 朱文慧, 杨琬琳, 步营, 等. 超高压耦合酶解鳕鱼骨的工艺优化及其对酶解液滋味的影响[J]. 食品工业科技,2019,40(4):214−219. [ZHU W H, YANG W L, BU Y, et al. Optimization of ultra high pressure coupled with enzymatic hydrolysis technology and its effect on the taste of hydrolysate of pollock bone[J]. Technology and Business University,2019,40(4):214−219. ZHU W H, YANG W L, BU Y, et al. Optimization of ultra high pressure coupled with enzymatic hydrolysis technology and its effect on the taste of hydrolysate of pollock bone[J]. Technology and Business University, 2019, 40(4): 214-219.
[19] 石滨, 郭学平, 苏涛. 硫酸皮肤素的研究概况[J]. 中国生化药物杂志,2001(2):105−106. [SHI B, GUO X P, SU T. Introduction to dermatan sulfate[J]. Chinese Journal of Biochemical Pharmaceutics,2001(2):105−106. doi: 10.3969/j.issn.1005-1678.2001.02.027 SHI B, GUO X P, SU T, et al. Introduction to dermatan sulfate[J]. Chinese Journal of Biochemical Pharmaceutics, 2001(02): 105-106. doi: 10.3969/j.issn.1005-1678.2001.02.027
[20] 信传鑫, 杨金涛, 戴晓婧, 等. 大孔树脂吸附桦褐孔菌多糖色素的机理及工艺优化[J]. 食品工业科技,2021,42(22):193−201. [XIN C X, YANG J T, DAI X Q, et al. Adsorption mechanism and process optimization of inonotus obliquus polysaccharide pigment by macroporous resin[J]. Science and Technology of Food Industry,2021,42(22):193−201. XIN C X, YANG J T, DAI X Q, et al. Adsorption mechanism and process optimization of inonotus obliquus polysaccharide pigment by macroporous resin[J]. Science and Technology of Food Industry, 2021, 42(22): 193-201.
[21] 付莹. 硫酸软骨素的制备及其降血脂作用的研究[D]. 哈尔滨: 哈尔滨商业大学, 2014 FU Y. Extraction and research of the chondroitin sulfate on the function in blood lipid reduction[D]. Harbin: Harbin University of Commerce, 2014.
[22] 郭睿, 曹雁平, 施宇, 等. 从肝素生产废弃物中分离纯化硫酸皮肤素[J]. 食品工业科技,2011(3):224−229. [GUO R, CAO Y P, SHI Y, et al. Purifying dermatan sulfate from the waste in heparin production[J]. Science and Technology of Food Industry,2011(3):224−229. GUO R, CAO Y P, SHI Y, ET. al. Purifying dermatan sulfate from the waste in heparin production[J]. Technology and Business University, 2011(3): 224-229.
[23] 徐俊涛. 酶解法制备肝素钠关键工艺技术研究[D]. 郑州: 河南农业大学, 2012 XU J T. Study on enzymatic preparation of heparin sodium critical technology[D]. Zhengzhou: Henan Agricultural University, 2012.
[24] 张仁强. 提取肝素钠离子交换树脂的优选与处理[J]. 广东化工, 2017(17); 99-100 ZHANG R Q. Ion exchange resin preparation in extraction of heparin sodium[J]. Guangdong Chemical Industry, 2017(17): 99-100.
[25] 薛发刚. 硫酸皮肤素和硫酸乙酰肝素的制备及其抗血栓相关活性协同作用研究[D]. 济南: 山东大学, 2011 XUE F G. Preparation of heparan sulfate and dermatan sulfate and their synergism on antithrombotic related bioactivities[D]. Jinan: Shandong University, 2011.
[26] NEVIN K G, RAJAMOHAN T. Beneficial effects of virgin coconut oil on lipid parameters and in vitro LDL oxidation[J]. Clinical Biochemistry,2004,37(90):830.
[27] 李珊珊, 祝贺, 祁玉丽, 等. 人参果多糖的分离纯化及体外抗氧化活性研究[J]. 食品工业科技, 2018, 39(4): 73-76, 99 LI S S, ZHU H, QI Y L, et al. Research on extraction, purification, and antioxidant activity in vitro polysaccharide from ginseng berry[J]. Science and Technology of Food Industry, 2018, 39(4): 73-76, 99.
[28] OYAIZU M. Studies on product of browning reaction prepared from glucose amine[J]. Japan Journal of Nutrition,1984,44:307−315.
[29] 马继华. 离子交换层析制备高纯度肝素和硫酸皮肤素[D]. 武汉: 华中科技大学, 2013 MA J H. Preparation of high-purity heparin and dertamn sulfate by anion-exchange chromatography[D]. Wuhan: Huazhong University of Science and Technology, 2013.
[30] 王尚豪. 酶法制备热反应虾味香精的研究[D]. 福州: 福建农林大学, 2012 WANG S H. Study on the thermal reaction shrimp flavoring with enzymolysis method[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012.
[31] 白明月, 王清池, 邓世明, 等. 平颏海蛇皮中新型硫酸皮肤素的分离纯化和结构表征[J]. 中国海洋药物,2018,37(1):7−14. [BAI M Y, WANG Q C, DENG S M, et al. Isolation, purification and structure characterization of a novel dermatan sulfate from lapemis curtus skin[J]. Chinese Journal of Marine Drugs,2018,37(1):7−14. doi: 10.13400/j.cnki.cjmd.2018.01.002 BAI M Y, WANG Q C, DENG S M, et al. Isolation, purification and structure characterization of a novel dermatan sulfate from lapemis curtus skin[J]. Chinese Journal of Marine Drugs, 2018, 37(1): 7-14. doi: 10.13400/j.cnki.cjmd.2018.01.002





 下载:
下载:






 下载:
下载:



