Optimization of Extraction Process, Isolation and Characterization of Mycosporine-Like Amino Acids from Four Species of Marine Red Macroalgaes
-
摘要: 类菌胞素氨基酸(Mycosporine-like amino acids,MAAs)广泛存在于大型红藻中,是一类具有良好应用前景的活性物质。本文采用单因素和正交试验,分析了提取温度、时间、次数和料液比对红毛苔、石花菜、菊花江蓠和江蓠中MAAs提取物得率的影响,优化提取MAAs工艺,并对提取物进行了分离鉴定。结果表明,毛苔、石花菜、菊花江蓠和江蓠中MAAs优化提取工艺分别为:45 ℃、3 h、4次、1:25 g/mL;45 ℃、1 h、4次、1:20 g/mL;45 ℃、2 h、3次、1:15 g/mL;40 ℃、1 h、3次、1:20 g/mL。应用上述提取工艺,制备得到4种大型红藻MAAs提取物,提取物得率依次为249.3、197.9、146.4和449.5 mg/g,其在紫外光谱和薄层层析板呈现MAAs紫外吸收特性和颜色反应。同时,采用硅胶柱层析,对红毛苔和江蓠MAAs提取物进行分离,共得到3个组分H1、J1和J2。通过紫外光谱扫描、高效液相色谱和质谱分析,并与已有文献比较,确定了其MAAs组成。H1包括shinorine、palythine和porphyra-334(3种MAA含量为组分H1含量的95.4%)、palythenic acid(4.6%);J1包括shinorine、palythine和porphyra-334(3种MAA 为组分J1含量的96.3%)、palythenic acid(3.7%);J2为palythine单体。Abstract: Marine macroalgae is one of the good sources of mycosporine-like amino acids (MAAs), especially red macroalgae. As a new type of active substances with commercial development prospect, extraction, isolation and characterization of MAAs are far from enough for the application. To obtain the extraction process of MAAs from four species of red macroalgae (Bangia fusco-purpurea, Gelidium amansii, Gracilaria confervoides, and Gracilaria sp.), a series of single-factor and orthogonal experiments were carried out to analyze the effects of extraction temperature, time, times and solid-liquid ratio on the yields of MAAs. The extraction process of MAAs was optimized, and the extracts were isolated and identified. The optimized extraction processes of MAAs were obtained as follows: 45 ℃, 3 h, 4 times, 1:25 g/mL. 45 ℃, 1 h, 4 times, 1:20 g/mL. 45 ℃, 2 h, 3 times, 1:15 g/mL. 40 ℃, 1 h, 3 times, 1:20 g/mL. Four MAAs extracts of red algae were prepared by using the above extraction process, and the yields were 249.3, 197.9, 146.4 and 449.5 mg/g, respectively. All of them showed UV absorption characteristics and color reaction of MAAs in UV spectrum and thin layer chromatography (TLC). Furthermore, MAAs extracts from Bangia fusco-purpurea (or Gracilaria sp.) were isolated by silica gel column chromatography to obtain one fraction H1 (or two fractions J1 and J2). MAAs composition and proportion of these fractions were determined by UV, HPLC and MS, and comparison with existing literatures. H1 included shinorine, palythine and porphyra-334 (the content of these three MAAs was 95.4% of the content of the fraction H1), and palythenic acid (4.6%). Shinorine, palythine, porphyra-334 (96.3% of the fraction J1), and palythenic acid (3.7%) were in J1. And J2 was palythine.
-
Keywords:
- mycosporine-like amino acids /
- red macroalgae /
- extraction process /
- isolation /
- characterization
-
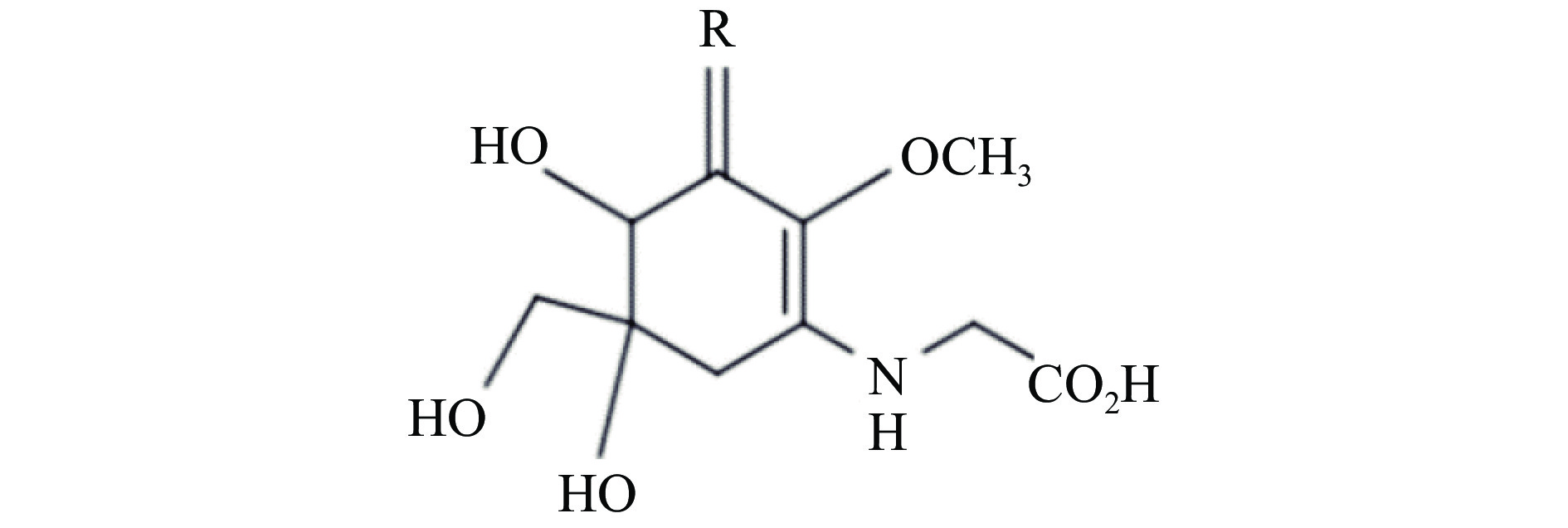
类菌胞素氨基酸(Mycosporine-like amino acids,MAAs)广泛分布于水生生物中,在大型红藻中含量丰富[1-2]。MAAs是一类小分子次级代谢产物,骨架为氨基环己烯酮或氨基环己烯胺的环状结构(图1),最大吸收波长在310~360 nm,是一种天然高效紫外线吸收剂[3]。目前,已鉴定结构的MAAs接近30种,主要包括asterina-330、mycosporine-glycine、porphyra-334和palythine等[1-2]。研究表明,MAAs具有明显的抗氧化作用,能抑制过氧化脂质生成、清除自由基、保护皮肤细胞不受氧自由基过度氧化的影响[3-4],还具有调节渗透等多种生理活性[3]。
大型海藻是MAAs的主要来源之一[5-7],usujirene、palythenic acid等MAAs仅存在于藻类[3,8]。大型红藻是MAAs的理想来源,不仅含量高,且种类丰富[2,7],已探明的MAAs种类超过22种[2],prasiolin[8]和bostrychines A~F[9]等MAAs仅在大型红藻中发现。此外,大型红藻还含有很多未知MAAs。目前,国内外对大型海藻MAAs研究尚处于初级阶段,多数集中在分布[10]、环境因子诱导[11]、活性等[3],大型红藻MAAs的提取和分离研究非常少[3,12]。近10年,仅见Bangia atropurpurea[13]、Bostrychia scorpioides[3]、麒麟菜(Eucheuma sp.)[4]、海萝藻(Gloiopeltis furcata)[14]、弓江蓠(Gracilaria arcuata)[15]、张氏江蓠(Gracilaria changii)[16]和条斑紫菜(Porphyra yezoensis)[17]等MAAs提取和分离的相关研究。我国大型红藻种类高达600多种[18],绝大多数的MAAs提取和分离为研究空白,有必要进行深入研究。
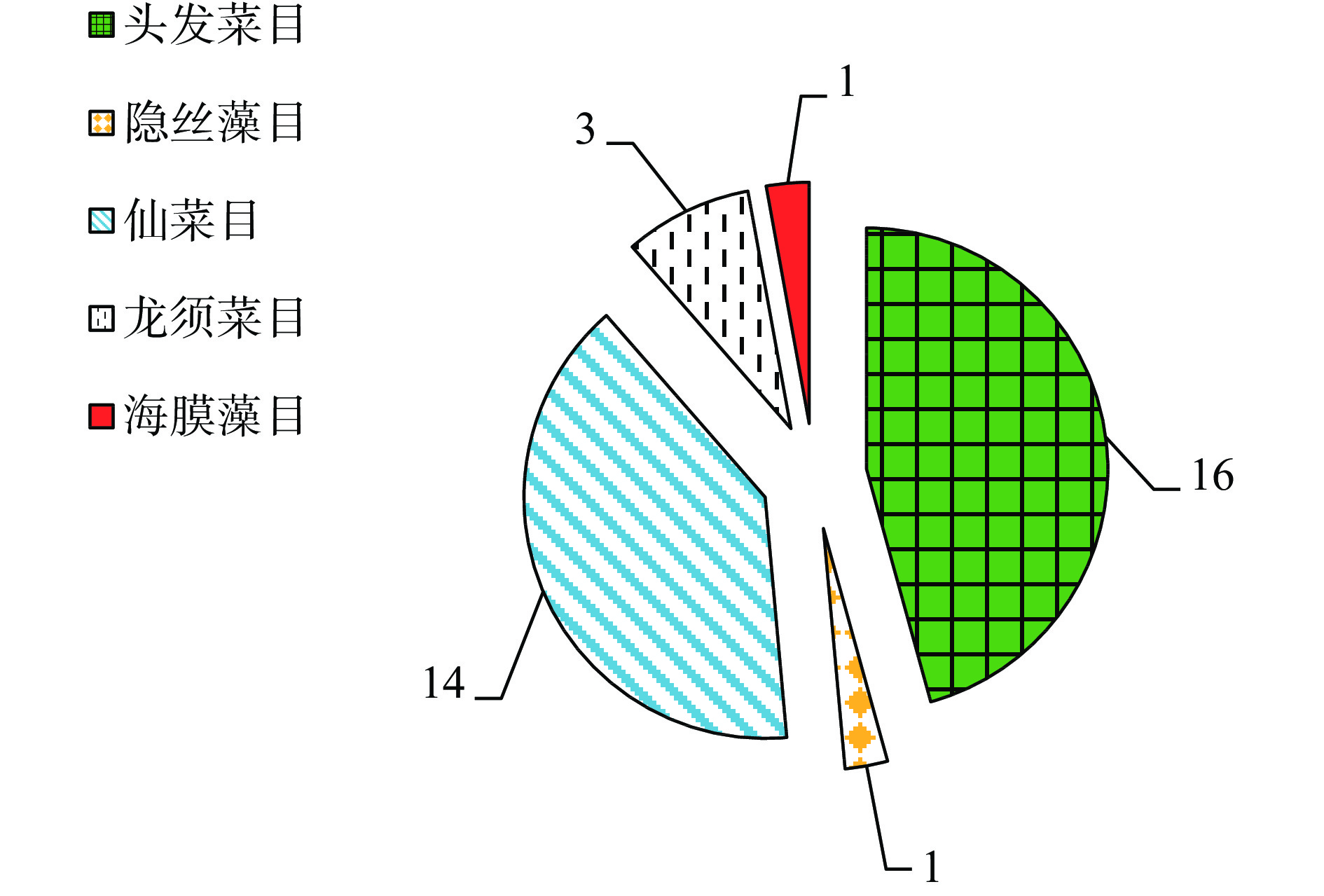
本文整理了2001~2021年期间发表在Web of Science、Springer、Google Scholar和CNKI数据库收录的有关大型海藻MAAs研究,发现MAAs含量高于3 mg/g的大型红藻主要集中在头发菜目(Bangiales)和仙菜目(Ceramiales),龙须菜目(Gracilariales)也有少数大型海藻MAAs含量较高(图2)。本文选定红毛苔(Bangiafusco purpurea)、石花菜(Gelidium amansii)、菊花江蓠(Gracilaria confervoides)和江蓠(Gracilaria sp.)4种大型红藻,它们分别归属于头发菜目、仙菜目和龙须菜目。目前,国内外尚未见此4种MAAs的提取和分离研究。基于此,本实验研究了提取温度、时间、次数和料液比对4种大型红藻MAAs提取物得率的影响,建立优化提取工艺。根据MAAs提取物得率和薄层层析检测结果,发现红毛苔和江蓠中MAAs含量较高;进一步,采用硅胶柱层析对此2种大型红藻MAAs提取物进行分离。最后,通过紫外光谱(Ultraviolet spectrum,UV)、高效液相色谱(High Performance Liquid Chromatography,HPLC)和质谱(Mass Spectrometry, MS)测定,并与已有文献比较,鉴定4种大型红藻MAAs组成;以期为大型海藻源MAAs的分离研究奠定实验基础和提供理论参考。
1. 材料与方法
1.1 材料与仪器
红毛苔(Bangia fusco purpurea)、石花菜(Gelidium amansii)、菊花江蓠(Gracilaria confervoides)、江蓠(Gracilaria sp.)、甲醇、乙醇 分析纯,江苏碧蓝海洋生物科技有限公司;甲醇、甲酸 色谱纯,DIKMA PURE色谱溶剂;硅胶粉200~300目 青岛海洋化工有限公司。
CPA224S电子天平德国 赛多利斯股份公司;DKZ-2电热恒温振荡槽 上海精宏实验设备有限公司;R-210真空旋转蒸发器 瑞士步琦;T9CS双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;QTUM0001X超纯水机 法国MILLIPORE;TSQ Quantum Access液质联用仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 原料处理
大型红藻干品经清洗、冷冻干燥、超微粉碎机粉碎后,过40目筛备用。
1.2.2 MAAs提取工艺
称取大型红藻干粉末10 g加入到一定体积的25%甲醇溶液中,搅拌后密封放入恒温水浴摇床中,在设定温度下振荡浸提一定时间。提取结束后,取出冷却至室温,倒出浸提液。重新加入相同体积的25%甲醇溶液,按照上述条件重复浸提设定提取次数。浸提液合并、过滤和减压蒸发后,加入无水乙醇(含量为80%),−20 ℃下沉淀6 h。4 ℃下,9000 r/min离心20 min,移出上清液,沉淀保留。用蒸馏水洗涤沉淀2~3次,洗涤液和先前的上清液合并,45 ℃下减压浓缩后(除去有机溶剂),冷冻干燥,制备到MAAs提取物。
1.2.3 单因素实验
1.2.3.1 提取温度对MAAs提取物得率的影响
提取温度设定为35、40、45、50和55 ℃,提取时间、次数和料液比分别为2 h、2次和1:20 g/mL。每个实验设定3个平行样,MAAs提取同1.2.2。
1.2.3.2 提取时间对MAAs提取物得率的影响
提取时间依次为1、2、3和4 h,提取温度、次数和料液比设定为45 ℃、2次和1:20 g/mL。每个实验设定 3 个平行样,MAAs 提取同 1.2.2。
1.2.3.3 提取次数对MAAs提取物得率的影响
设定提取次数为1、2、3和4次,提取温度、时间和料液比设定为45 ℃、2 h和1:20 g/mL。每个实验设定 3 个平行样,MAAs 提取同 1.2.2。
1.2.3.4 料液比对MAAs提取物得率的影响
料液比分别为1:10、1:15、1:20和1:25 g/mL,提取温度、时间和次数设定为45 ℃、2 h和2次。每个实验设定 3 个平行样,MAAs 提取同 1.2.2。
1.2.4 正交试验
在上述单因素实验基础上,选定L9(34)正交试验表,考察提取提取温度、提取时间、提取次数和料液比等4个因素对4种大型红藻MAAs提取物得率的影响(表1),实验中不设定平行样。
表 1 正交试验因素及水平设计Table 1. Factors and levels of orthogonal experiments水平 因素 A:提取温度(℃) B:提取时间(h) C:提取次数(次) D:料液比(g/mL) 1 40 1 2 1:15 2 45 2 3 1:20 3 50 3 4 1:25 1.2.5 MAAs提取物得率的计算
W=mM×1000 式中:W为MAAs粗提物得率,mg/g;m为粗提物质量,g;M为红藻粉末质量,g。
1.2.6 MAAs分离
参照文献[1,7],并对分离方法进行了主要改进。取1.0 g MAAs提取物加载在硅胶柱层析(3.0 cm×25 cm,200~300目)上,洗脱剂为甲醇/乙醇/蒸馏水(8:10:0.5),洗脱速度为1.0 BV/h,洗脱2.5倍柱体积(BV),每管50 mL洗脱馏分。馏分减压浓缩后,采用薄层层析和紫外光谱检测MAAs[15]。
1.2.7 MAAs检测
1.2.7.1 薄层层析定性检测
参照前期研究建立的薄层层析法[15],并稍加改进。待测样品溶解于蒸馏水中,配制浓度为1.6 g/L,点样在硅胶G板上,以甲醇/乙醇/蒸馏水(8:10:0.5,体积比)为展开剂。展开结束后,吹干G板,喷洒碘化秘钾试剂(7.3 g碘化铋钾,冰醋酸10 mL,蒸馏水60 mL),静置15~20 min,呈现黄或橙色斑点为含氮化合物的阳性反应,可初步确定为目标提取物或目标组分。
1.2.7.2 紫外光谱检测
取1 mL上述薄层层析检测确定的目标提取物或目标组分,进行200~400 nm波长扫描。在310~360 nm范围内有吸收的待测样品,可确定为含有MAAs。
1.2.7.3 高效液相色谱和质谱检测
MAAs提取物0.005 g溶于10 mL蒸馏水,微孔滤膜过滤后,进行高效液相色谱(HPLC)和质谱(ESI-MS)检测。HPLC分析:柱温为25 ℃,色谱柱为Waters HSS T3(4.6 mm×150 mm,3.5 μm)。流动相A为0.2%甲酸水溶液,流动相B为0.2%甲酸甲醇溶液。洗脱梯度:0~20 min,B%:0~70%;流速1.0 mL/min,波长330 nm;进样量100 μL。ESI-MS测定:喷雾气压45 psi,氮气流速10.0 L/min,干燥温度350 ℃,破碎电压100 V,毛细管电压4500 V,全扫描(Scan),参比离子质荷比:121.0509,922.0098,为参比离子对测定结果进行实时矫正,分辨率m/z在922.0098处全扫描响应为11300,质荷比(m/z)范围在120~1000。
1.2.8 大型红藻理化指标测定
采用GB 5009.3-2016[19]、GB 5009.4-2016[20]、GB 5009.5-2016[21]、GB 5009.6-2016标准方法[22],测定大型红藻中水分、蛋白质、脂肪、碳水化合物等成分。
1.3 数据处理
实验数据采用SPSS11.5软件包进行独立样本检验统计分析,P<0.05为显著性差异,P<0.01为极显著性差异。
2. 结果与分析
2.1 4种大型红藻MAAs提取工艺的优化
2.1.1 单因素实验结果
2.1.1.1 提取温度对4种大型红藻MAAs提取物得率的影响
由图3可知,4种大型红藻MAAs提取物得率随提取温度的升高而增大,在40~45 ℃时,MAAs提取物得率达到最大值。当提取温度继续增加时,4种大型红藻MAAs提取物得率开始下降,尤其红毛苔和江蓠MAAs提取物得率显著(P<0.05)降低。可能由于温度升高,多糖[23]等水溶性物质更易溶出,在去除这些物质的过程中造成了更多的MAAs损失;也可能是MAAs中某些MAA发生降解[24],具体原因还需要进一步研究。在MAAs提取过程中,提取温度是一个容易被忽视的影响因素,常见的提取温度在4~45 ℃[4]范围内。本文研究表明,提取温度是一个明显影响红毛苔等4种大型红藻MAAs提取物得率的因素,45 ℃是较适宜的提取温度。
2.1.1.2 提取时间对4种大型红藻MAAs提取物得率的影响
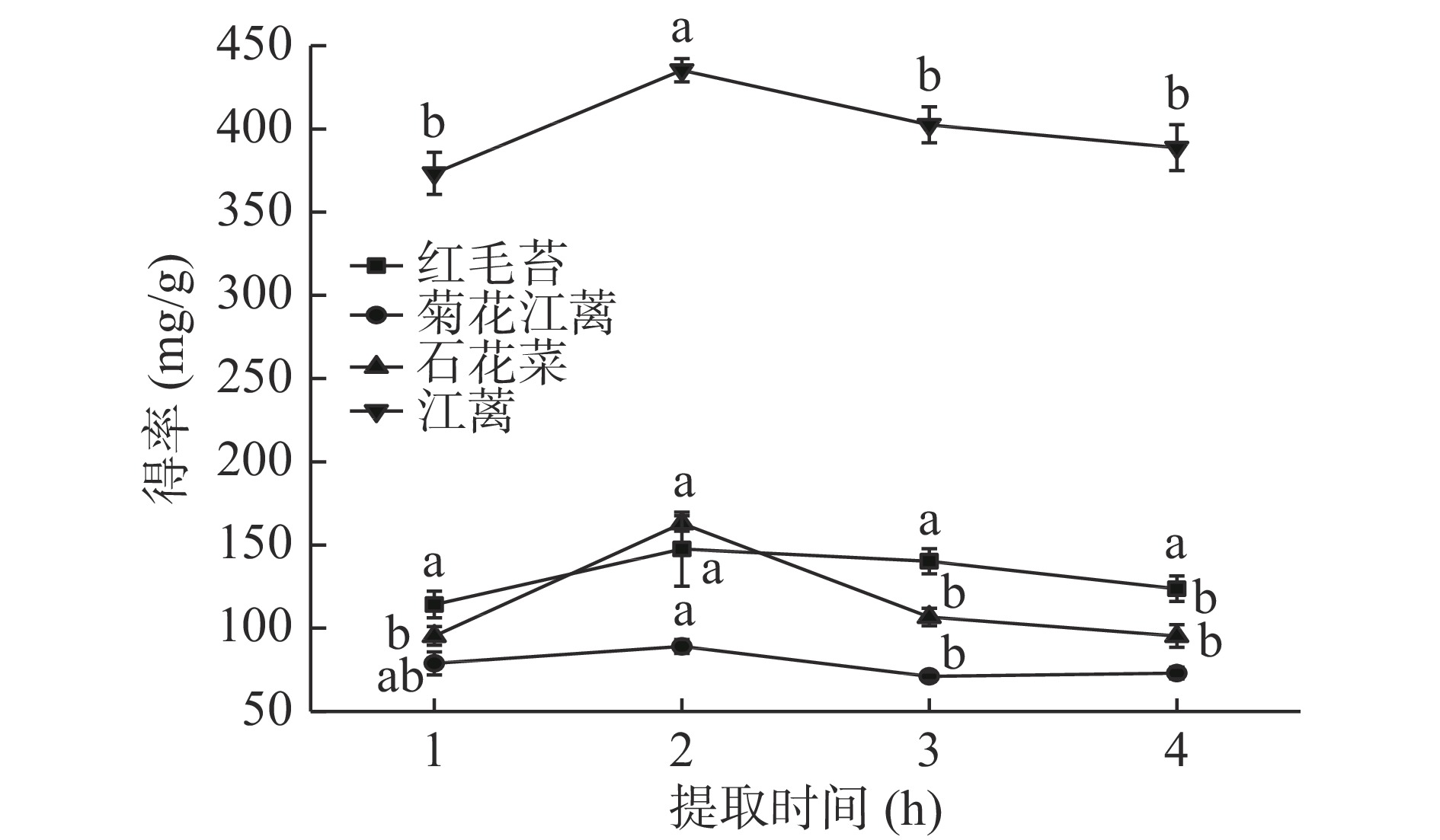
在图4中,随提取时间的增加,4种大型红藻MAAs提取物得率增大。提取时间为2 h时,MAAs提取物得率均达到最大值。当提取时间继续增加时,4种大型红藻MAAs提取物得率呈现下降趋势。这可能是提取时间过长,水溶性物质溶出更多,导致后续去除这些物质时MAAs损失量增大或者MAAs提取物出现热分解现象[25]。不同大型海藻MAAs提取时间从几分钟[7]到十几小时[23]不等,推测这可能与MAAs在藻体中位置有关,目前国内外尚未见大型海藻中MAAs位置研究。除红毛苔外,提取时间对其余3种大型红藻MAAs提取物得率有显著影响(P<0.05)。综上所述,2 h是4种红藻较适宜的提取时间。
2.1.1.3 提取次数对4种大型红藻MAAs提取物得率的影响
图5表明,提取次数不超过2次(或3次),菊花江蓠和石花菜(或红毛苔和江蓠)MAAs提取物得率随提取次数增加而增大。当提取次数继续增加时,除红毛苔外,其它3种大型红藻MAAs提取物得率显著(P<0.05)下降。提取次数过多会促使更多水溶性杂质被提取出来,导致在去除杂质过程中MAAs损失增加,从而导致提取次数增加而MAAs提取物得率下降的现象。在海萝和江蓠等大型海藻MAAs提取过程中[14,16],提取次数也是2次或3次。综上所述,本文选择的提取次数为3次。
2.1.1.4 料液比对4种大型红藻MAAs提取物得率的影响
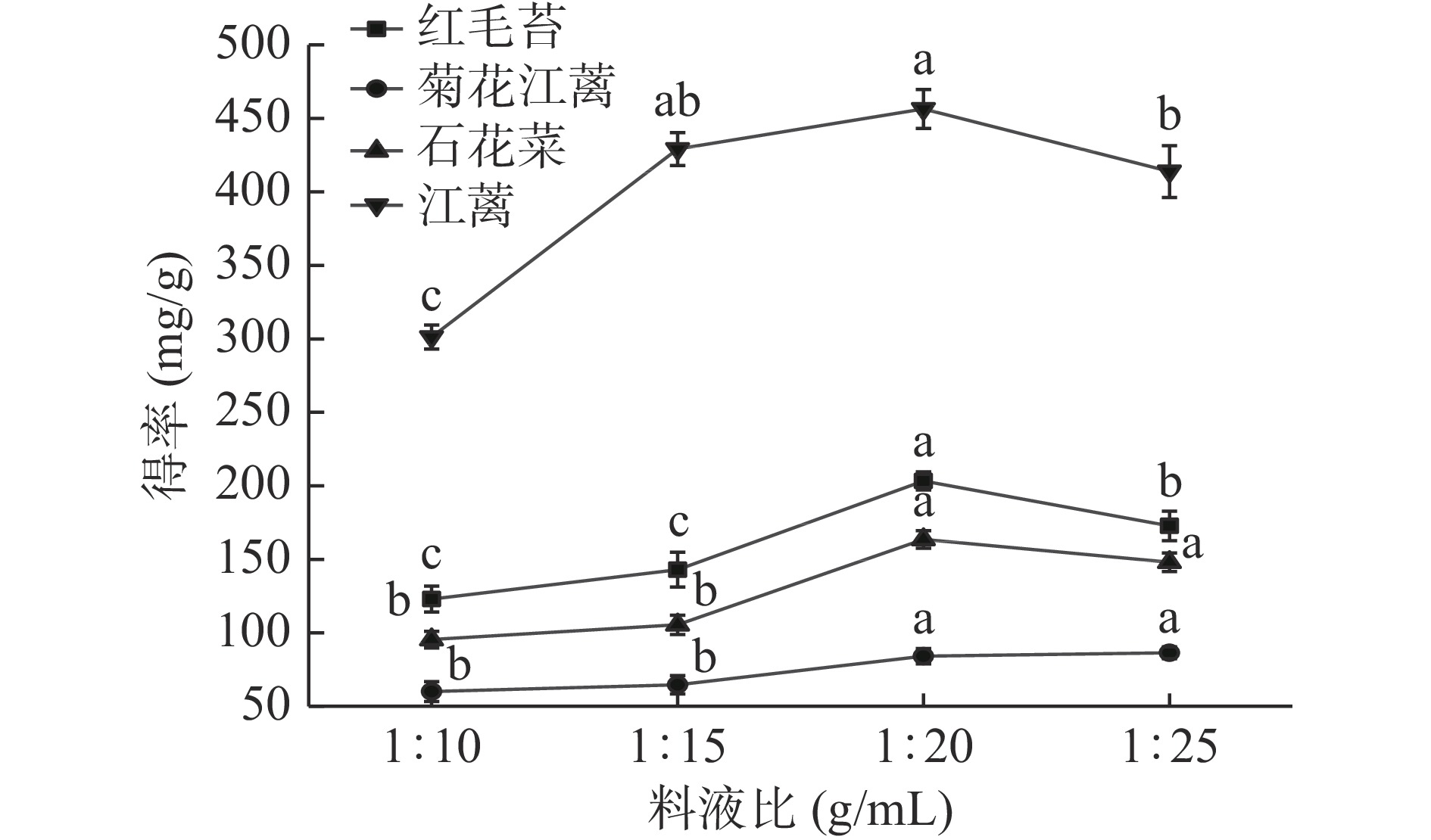
在1:10~1:20 g/mL范围内,随料液比增加,4种大型红藻MAAs提取物得率增大,在1:20 g/mL时,MAAs提取物得率达到最大值(图6)。料液比继续增加,MAAs提取物得率开始下降,特别是红毛苔和江蓠MAAs提取物得率下降显著(P<0.05),可能是越大的料液比溶出了越多水溶性杂质,在除去其过程中导致了更多的MAAs损失。不同大型海藻MAAs提取时,料液比相差甚远[23,25]。例如,紫菜Porphyra rosengurttii、角石花菜(Gelidium corneum)和Ahnfeltiopsis devoniensis等大型红藻MAAs提取时,料液比设定为1:100 g/mL;海萝MAAs提取料液比为1:67 g/mL;麒麟菜和张氏江蓠MAAs提取时的料液比与本文的研究结果接近,为1:30 g/mL[16,25]。综上所述,1:20 g/mL是4种红藻较适宜的提取料液比。
在前期研究基础上[15],本文选取25%甲醇为提取溶剂,从红毛苔等4种大型红藻中提取MAAs。在已有报道中,MAAs常用提取溶剂为15%~75%甲醇溶液[25],还有其它溶剂,例如,乙腈[12]、0.2%醋酸水溶液(加入0.5%甲醇)[26]和-辛基十二醇[27]等。通过上述单因素实验,发现适当增大提取温度、时间、次数和料液比有利于4种大型红藻MAAs的提取。
2.1.2 正交试验结果
在单因素实验基础上,采用正交试验,进一步分析提取温度、时间、次数和料液比对4种大型红藻MAAs提取物得率的影响,结果见表2。通过对正交试验结果进行直观分析(计算过程略),可得到红毛苔、石花菜、菊花江蓠和江蓠MAAs优化提取工艺,即分别为:45 ℃、3 h、4次、1:25 g/mL;45 ℃、1 h、4次、1:20 g/mL;45 ℃、2 h、3次、1:15 g/mL;40 ℃、1 h、3次、1:20 g/mL。
表 2 正交试验结果Table 2. Results of the orthogonal experiment实验号 因素 MAAs提取物得率(mg/g) A B C D 红毛苔 石花菜 菊花江蓠 江蓠 1 1 1 1 1 173.5 176.2 122.2 434.7 2 1 2 2 2 182.2 193.1 141.5 448.9 3 1 3 3 3 248.2 185.8 130.4 436.2 4 2 1 2 3 200.1 192.4 145.3 445.3 5 2 2 3 1 246.9 190.6 142.6 426.8 6 2 3 1 2 213.5 178.1 120.1 440.1 7 3 1 3 2 222.7 188.5 132.3 420.3 8 3 2 1 3 199.3 170.3 119.6 415.9 9 3 3 2 1 170.2 174.2 139.7 410.1 红毛苔 k1 201.30 198.77 195.43 196.87 适宜组合:A2B3C3D3 k2 220.17 209.47 184.17 206.13 k3 197.40 210.63 239.27 215.87 R 22.77 11.87 55.10 19.00 石花菜 k1 185.03 185.70 174.87 180.33 适宜组合:A2B1C3D2 k2 187.03 184.67 186.57 186.57 k3 177.67 179.37 188.30 182.83 R 9.37 6.33 13.43 6.23 菊花江蓠 k1 131.37 133.27 120.63 134.83 适宜组合:A2B2C2D1 k2 136.00 134.57 142.17 131.30 k3 130.53 130.07 135.10 131.77 R 5.47 4.50 21.53 3.53 江蓠 k1 439.93 433.43 430.23 423.87 适宜组合:A1B1C2D2 k2 437.40 430.53 434.77 436.43 k3 415.43 428.80 427.77 432.47 R 24.50 4.63 7.00 12.57 应用上述优化提取工艺,制备到红毛苔、石花菜、菊花江蓠和江蓠MAAs提取物,提取物得率依次为249.3、197.9、146.4和449.5 mg/g。Lee等[28]采用50%乙醇提取大型红藻海萝和马泽藻(Mazzaella sp.),提取物得率依次为10.32%和11.77%,本文中4种大型红藻提取物得率明显高于它们。在4种大型红藻MAAs提取过程中,还发现红毛苔MAAs提取液经过处理后,仍然非常混浊,而其它3种大型红藻MAAs提取液澄清透明,本文认为很可能是大型红藻成分含量不同所致。采用国标方法[19-22],测定了4种大型红藻营养成分(表3)。表3表明,红毛苔蛋白质含量明显高于其它大型红藻。在后续研究中,可对红毛苔MAAs提取液进行更有效的蛋白质去除。
表 3 4种大型红藻营养成分测定结果Table 3. Detection results of nutrient content from four red macroalgaes营养成分(g/100 g) 大型红藻种类 红毛苔 石花菜 菊花江蓠 江蓠 水分 7.37 9.54 8.93 4.36 蛋白 42.59 15.60 9.13 18.45 脂肪 3.50 2.47 2.25 3.48 灰分 14.20 29.74 25.92 54.38 碳水化合物 32.34 42.65 54.17 19.33 表 4 MAAs提取物硅胶柱层析分离组分的最大吸收波长、质谱、相对峰面积和MAAs组成Table 4. Maximum absorption wavelength, MS values, relative peak area and composition of the isolated fractions of MAA extracts by silica gel column chromatography组分 最大吸收波长λmax(nm) [M+H]+ Mass MAA种类 MAA或MAAs占相应组分总含量的比例(%) H1 333
319
334
337333.1
245.1
347.0
329.0332
244
346
328Shinorine
Palythine
Porphyra-334
Palythenic acid95.4
(3种MAA混合物)
4.6J1 333
319
334
337333.1
245.1
347.0
329.0332
244
346
328Shinorine
Palythine
Porphyra-334
Palythenic acid96.3
(3种MAA混合物)
3.7J2 319 245.1 244 Palythine 100 石花菜MAAs提取物 268
332
319
332
330
328205.0
333.1
245.1
347.0
303.1
222.7204
332
244
346
302
221Gadusol[32]
(MAAs前体)
Shinorine
Palythine
Porphyra-334
Palythinol
Unknown MAA
49.6
16.6
3.45
23.6
6.34菊花江蓠MAAs提取物 333
319
334
331
336
330333.1
245.1
347.0
303.1
329.0
-331
244
346
302
328
-Shinorine
Palythine
Porphyra-334
Palythinol
Palythenic acid
Unknown MAAs7.54
42.3
5.62
39.0
2.93
1.802.2 4种大型红藻MAAs的检测
将4种大型红藻MAAs提取物进行薄层层析检测(图7)、紫外波长扫描(未列出)和高效液相色谱-质谱分析(图8)。从图7可以看出,它们在硅胶板上均呈现了一个或几个黄色斑点(含氮化合物的阳性反应),这表明提取物中可能含有MAAs成分。紫外光谱扫描显示出此4种大型红藻MAAs提取物在310~360 nm范围内有吸收,符合MAAs特征吸收[3]。至此,在没有MAAs标准品作为参照情况下,仍能确定提取物中存在MAAs。由此可见,硅胶薄层层析检测和紫外波长扫描结合可用于大型海藻MAAs检测。此外,图7中斑点面积大小可反映待测样品中MAAs含量高低,这对于筛选高含量MAAs的大型海藻而言非常直观。
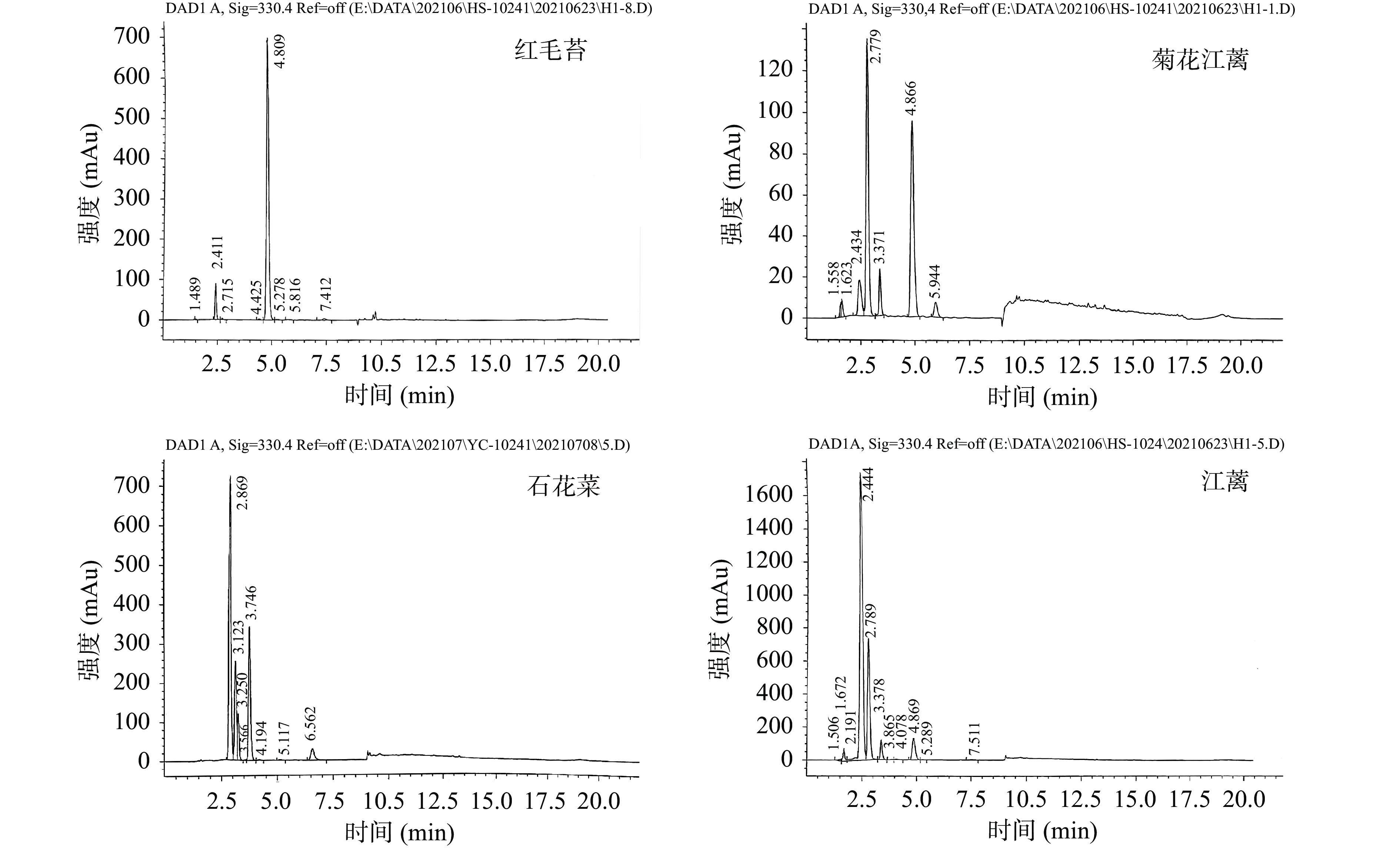
HPLC是MAAs常用分析和分离方法[4,23,25],本文也采用HPLC来分析4种大型红藻MAAs组成。从图8能够清晰地看出,红毛苔MAAs提取物出现了8个吸收峰,停留时间4.8 min处吸收峰最明显;菊花江蓠MAAs提取物在停留时间2.7和4.8 min处吸收峰较明显;石花菜MAAs提取物分别在停留时间2.8、3.1、3.7和6.5 min处出现了较明显的吸收峰;江蓠MAAs提取物则在停留时间2.4、2.7、3.3和4.8 min处有较明显的吸收峰。由此表明,4种大型红藻MAAs提取物中MAAs组成可能有所差异。
2.3 硅胶柱层析分离和质谱测定
上述实验表明,红毛苔和江蓠MAAs提取物得率较高,故将它们进行硅胶柱层析分离。红毛苔MAAs提取物经分离获得1个组分H1(第5管~第8管);江蓠MAAs提取物经分离获得2个组分J1(第5管)和J2(第9管~第11管)(图9)。随后,测定此3个组分的HPLC和MS。根据HPLC和MS信息,并参考文献[23-24],能鉴定出组分H1、J1和J2中MAAs组成(表4),即组分H1中有4种MAA,shinorine、palythine、porphyra-334和palythenic acid;组分J1中有4种MAA,shinorine、palythine、porphyra-334和palythenic acid;组分J2为palythine单体。硅胶柱层析[1,7]、离子交换柱层析[4,14,23]、高效液相色谱[4,23,29]、C18固相萃取小柱[14]和HILIC[30]等被用于大型海藻MAAs分离,其中,采用硅胶柱层析分离MAAs报道较少。上述结果表明,经硅胶柱层析分离,红毛苔和江蓠MAAs提取物能获得较好的初步分离。此外,也测定了石花菜和菊花江蓠MAAs提取物的高效液相色谱和质谱。同样地,也得到它们中可能的MAAs组成。
Shinorine、palythine和porphyra-334是大型红藻中常见MAA[3],palythenic acid目前仅在大型红藻Solieria chordalis中发现[31],该MAA在浮游植物和微藻中较为常见。石花菜和菊花江蓠中存在palythinol、gadusol和未知MAA(M-328和M-330),这些未知MAA需要后续继续进行研究。
3. 结论
本文优化了红毛苔、石花菜、菊花江蓠和江蓠MAAs的提取工艺,发现当提取温度、时间、次数和料液比依次为45 ℃、3 h、4次、1:25 g/mL;45 ℃、1 h、4次、1:20 g/mL;45 ℃、2 h、3次、1:15 g/mL;40 ℃、1 h、3次、1:20 g/mL时,能获得最大的MAAs提取物得率,提取物得率依次为249.3、197.9、146.4和449.5 mg/g。将紫外光谱和薄层层析检测结合,对4种大型红藻MAAs提取物进行定性检测的同时还能粗略比较提取物中MAAs含量高低,可作为大型海藻MAAs的快速筛选方法。硅胶柱层析可用于红毛苔和江蓠MAAs提取物的分离,能获得较好的初步分离效果。经紫外光谱扫描、高效液相色谱和质谱分析,并与已有文献比较,确定了红毛苔和江蓠中MAAs为shinorine、palythine、porphyra-334和palythenic acid;石花菜和菊花江蓠MAAs主要由shinorine、palythine、porphyra-334、palythenic acid和palythinol组成,还有少量未知MAAs。
本文建立了红毛苔、石花菜、菊花江蓠和江蓠的提取和初步分离工艺,并明确了其MAAs组成,为大型海藻源MAAs提取和分离鉴定提供了技术和理论支撑。然而,目前尚未获得较高纯度MAAs,并且对此4种大型红藻中特定MAA缺乏针对性分离纯化方法。在后续工作中,需要继续开展MAAs纯化制备研究。
-
表 1 正交试验因素及水平设计
Table 1 Factors and levels of orthogonal experiments
水平 因素 A:提取温度(℃) B:提取时间(h) C:提取次数(次) D:料液比(g/mL) 1 40 1 2 1:15 2 45 2 3 1:20 3 50 3 4 1:25 表 2 正交试验结果
Table 2 Results of the orthogonal experiment
实验号 因素 MAAs提取物得率(mg/g) A B C D 红毛苔 石花菜 菊花江蓠 江蓠 1 1 1 1 1 173.5 176.2 122.2 434.7 2 1 2 2 2 182.2 193.1 141.5 448.9 3 1 3 3 3 248.2 185.8 130.4 436.2 4 2 1 2 3 200.1 192.4 145.3 445.3 5 2 2 3 1 246.9 190.6 142.6 426.8 6 2 3 1 2 213.5 178.1 120.1 440.1 7 3 1 3 2 222.7 188.5 132.3 420.3 8 3 2 1 3 199.3 170.3 119.6 415.9 9 3 3 2 1 170.2 174.2 139.7 410.1 红毛苔 k1 201.30 198.77 195.43 196.87 适宜组合:A2B3C3D3 k2 220.17 209.47 184.17 206.13 k3 197.40 210.63 239.27 215.87 R 22.77 11.87 55.10 19.00 石花菜 k1 185.03 185.70 174.87 180.33 适宜组合:A2B1C3D2 k2 187.03 184.67 186.57 186.57 k3 177.67 179.37 188.30 182.83 R 9.37 6.33 13.43 6.23 菊花江蓠 k1 131.37 133.27 120.63 134.83 适宜组合:A2B2C2D1 k2 136.00 134.57 142.17 131.30 k3 130.53 130.07 135.10 131.77 R 5.47 4.50 21.53 3.53 江蓠 k1 439.93 433.43 430.23 423.87 适宜组合:A1B1C2D2 k2 437.40 430.53 434.77 436.43 k3 415.43 428.80 427.77 432.47 R 24.50 4.63 7.00 12.57 表 3 4种大型红藻营养成分测定结果
Table 3 Detection results of nutrient content from four red macroalgaes
营养成分(g/100 g) 大型红藻种类 红毛苔 石花菜 菊花江蓠 江蓠 水分 7.37 9.54 8.93 4.36 蛋白 42.59 15.60 9.13 18.45 脂肪 3.50 2.47 2.25 3.48 灰分 14.20 29.74 25.92 54.38 碳水化合物 32.34 42.65 54.17 19.33 表 4 MAAs提取物硅胶柱层析分离组分的最大吸收波长、质谱、相对峰面积和MAAs组成
Table 4 Maximum absorption wavelength, MS values, relative peak area and composition of the isolated fractions of MAA extracts by silica gel column chromatography
组分 最大吸收波长λmax(nm) [M+H]+ Mass MAA种类 MAA或MAAs占相应组分总含量的比例(%) H1 333
319
334
337333.1
245.1
347.0
329.0332
244
346
328Shinorine
Palythine
Porphyra-334
Palythenic acid95.4
(3种MAA混合物)
4.6J1 333
319
334
337333.1
245.1
347.0
329.0332
244
346
328Shinorine
Palythine
Porphyra-334
Palythenic acid96.3
(3种MAA混合物)
3.7J2 319 245.1 244 Palythine 100 石花菜MAAs提取物 268
332
319
332
330
328205.0
333.1
245.1
347.0
303.1
222.7204
332
244
346
302
221Gadusol[32]
(MAAs前体)
Shinorine
Palythine
Porphyra-334
Palythinol
Unknown MAA
49.6
16.6
3.45
23.6
6.34菊花江蓠MAAs提取物 333
319
334
331
336
330333.1
245.1
347.0
303.1
329.0
-331
244
346
302
328
-Shinorine
Palythine
Porphyra-334
Palythinol
Palythenic acid
Unknown MAAs7.54
42.3
5.62
39.0
2.93
1.80 -
[1] ORFANOUDAKI M, HARTMANN A, KARSTEN U, et al. Chemical profiling of mycosporine-like amino acids in twenty-three red algal species[J]. Journal of Phycology,2019,55(2):393−403. doi: 10.1111/jpy.12827
[2] SUN Y Y, ZHANG N S, ZHOU J, et al. Distribution, contents, and types of mycosporine-like amino acids (MAAs) in marine macroalgae and a database for MAAs based on these characteristics[J]. Marine Drugs,2020,18(1):43−66. doi: 10.3390/md18010043
[3] ATHUKORALA Y, TRANG S, KWOK C, et al. Antiproliferative and antioxidant activities and mycosporine-like amino acid profiles of wild-harvested and cultivated edible Canadian marine red macroalgae[J]. Molecules,2016,21(1):1−17.
[4] 牛美英. 麒麟菜中类菌孢素氨基酸(MAAs)的提取、纯化、鉴定及抗氧化活性研究[D]. 青岛: 中国海洋大学, 2014. NIU M Y. The study on the isolation, purification, identification andantioxidant activity of mycosporine-like amino acids (MAAs) in Eucheuma[D]. Qingdao: Ocean University of China, 2014.
[5] LAMARE M D, LESSER M P, BARKER M F, et al. Variation in sunscreen compounds (mycosporine-like amino acids) for marine species along a gradient of ultraviolet radiation transmission within doubtful sound, New Zealand[J]. New Zealand Journal of Marine and Freshwater Research,2004,38(5):775−793. doi: 10.1080/00288330.2004.9517277
[6] HOYER K, KARSTEN U, SAWALL T, et al. Photoprotective substances in Antarctic macroalgae and their variation with respect to depth distribution, different tissues and developmental stages[J]. Marine Ecology Progress Series,2001,211:117−129. doi: 10.3354/meps211117
[7] ORFANOUDAKI M, HARTMANN A, MILADINOVIC H, et al. Bostrychines A~F, six novel mycosporine-like amino-acids and a novel betaine from the red alga Bostrychia scorpioides[J]. Marine Drugs,2019,17(6):356−371. doi: 10.3390/md17060356
[8] AGUILERA J, BISCHOF K, KARSTEN U, et al. Seasonal variation in ecophysiological patterns in macroalgae from an Arctic fjord. II. pigment accumulation and biochemical aefence systems against high light stress[J]. Marine Biology,2002,140:1087−1095. doi: 10.1007/s00227-002-0792-y
[9] KORBEE N, HUOVINEN P, FIGUEROA F L, et al. Availability of ammonium influences photosynthesis and the accumulation of mycosporine-like amino acids in two Porphyra species (Bangiales, Rhodophyta)[J]. Marine Biology,2005,146:645−654. doi: 10.1007/s00227-004-1484-6
[10] GUIHENEUF F, GIETL A, STENGEL D B. Temporal and spatial variability of mycosporine-like amino acids and pigments in three edible red seaweeds from western Ireland[J]. Journal of Applied Phycology,2018,30:2573−2586. doi: 10.1007/s10811-018-1436-z
[11] BRIANI B, SISSINI M N, LUCENA L A, et al. The influence of environmental features in the content of mycosporine-like amino acids in red marine algae along the Brazilian coast[J]. Journal of Phycology,2018,54(3):380−390. doi: 10.1111/jpy.12640
[12] HARTMANN A, MURAUER A, GANZERA M. Quantitative analysis of mycosporine-like amino acids in marine algae by capillary electrophoresis with diode-array detection[J]. Journal of Pharmaceutical and Biomedical Analysis,2017,138:153−157. doi: 10.1016/j.jpba.2017.01.053
[13] CHUANG L F, CHOU H N, SUNG P J. Porphyra-334 isolated from the marine algae Bangia atropurpurea: Conformational performance for energy conversion[J]. Marine Drugs,2014,12(9):4732−4740. doi: 10.3390/md12094732
[14] 张婉. 海萝藻中类菌胞素氨基酸的提取与抗氧化保湿特性研究[D]. 上海: 上海海洋大学, 2016. ZHANG W. Study on extraction, antioxidation and moisturizing activities of MAAs from Gloiopeltis furcata[D]. Shanghai: Shanghai Ocean University, 2016.
[15] 孙颖颖, 杨子轩, 周静, 等. 大型海藻类菌孢素氨基酸提取工艺及定性检测研究[J]. 食品科技,2021,46(3):205−211. [SUN Y Y, YANG Z X, ZHOU J, et al. Extraction process and a qualitative detection method of mycosporine-like amino acids from six species of marine macroalgae[J]. Food Science and Technology,2021,46(3):205−211. doi: 10.13684/j.cnki.spkj.2021.03.034 SUN Y Y, YANG Z X, ZHOU J, et al. Extraction process and a qualitative detection method of Mycosporine-like amino acids from six species of marine macroalgae[J]. Food Science and Technology, 2021, 46(3): 205-211. doi: 10.13684/j.cnki.spkj.2021.03.034
[16] 金宁宁. 江蓠中类菌胞素氨基酸(MAAs)分离纯化及应用研究[D]. 青岛: 中国海洋大学, 2012. JIN N N. Study on the isolation, purification and application of mycosporine-like amino acids (MAAs) in Gracilaria changii[D]. Qingdao: Ocean University of China, 2012.
[17] 张苗苗. 紫菜中类菌孢素氨基酸(MAAs)制备工艺的研究[D]. 青岛: 中国海洋大学, 2015. ZHANG M M. The preparation techniques of mycosporine-like amino acid from Porphyra yezoensis[D]. Qingdao: Ocean University of China, 2015.
[18] 丁兰平, 黄冰心, 谢艳齐. 中国大型海藻的研究现状及其存在的问题[J]. 生物多样性,2011,19(6):798−804. [DING L P, HUANG B X, XIE Y Q. Advances and problems with the study of marine macroalgae of China seas[J]. Biodiversity Science,2011,19(6):798−804. DING L P, HUANG B X, XIE Y Q. Advances and problems with the study of marine macroalgae of China seas[J]. Biodiversity Science, 2011, 19(6): 798-804.
[19] 国家卫生和计划生育委员会. GB 5009.3-2016食品安全国家标准, 食品中水分的测定[S]. 北京: 中国标准出版社, 2016. China's National Health and Family Planning Commission. GB 5009.3-2016 National Food Safety Standard. Determination of moisture in foods[S]. Beijing: China Standards Press, 2016.
[20] 国家卫生和计划生育委员会. GB 5009.5-2016食品安全国家标准, 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2016. China's National Health and Family Planning Commission. GB 5009.5-2016 National Food Safety Standard. Determination of protein in foods[S]. Beijing: China Standards Press, 2016.
[21] 国家卫生和计划生育委员会. GB 5009.6-2016食品安全国家标准 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2016. China's National Health and Family Planning Commission. GB 5009.6-2016 National food safety standard. Determination of fat in foods[S]. Beijing: China Standards Press, 2016.
[22] 国家卫生和计划生育委员会. GB 5009.4-2016食品安全国家标准 食品中灰分的测定[S]. 北京: 中国标准出版社, 2016. China's National Health and Family Planning Commission. GB 5009.4-2016 National food safety standard. Determination of ash in foods[S]. Beijing: China Standards Press, 2016.
[23] 李峰. 大型海藻角叉菜活性成分的研究[D]. 大连: 大连海洋大学, 2019. LI F. Study on the active constituents of macroalgae Chondrus ocellatus Holemes[D]. Dalian: Dalian Ocean University, 2019.
[24] ZHANG Z, TASHIRO Y, MATSUKAWA S, et al. Influence of pH and temperature on the ultraviolet-absorbing properties of porphyra-334[J]. Fisheries Science,2005,71(6):1382−1384. doi: 10.1111/j.1444-2906.2005.01106.x
[25] ELIPE M V S. Advantages and disadvantages of nuclear magnetic resonance spectroscopy as a hyphenated technique[J]. Analytica Chimica Acata,2003,497(1):1−25.
[26] 应锐, 张朝辉, 段筱杉, 等. 紫菜中类菌孢素氨基酸纯化工艺的优化及其抗紫外辐射作用研究[J]. 海洋科学,2017,41(2):71−80. [YING R, ZHANG C H, DUAN X S, et al. Optimization of purification process of mycosporine-like amino acid from Porphyra haitanensis and study on its antiultraviolet activity[J]. Marine Science,2017,41(2):71−80. doi: 10.11759/hykx20160811002 YING R, ZHANG C H, DUAN X S, et al. Optimization of purification process of mycosporine-like amino acid from Porphyra haitanensis and study on its antiultraviolet activity[J]. Marine Science, 2017, 41(2): 71-80. doi: 10.11759/hykx20160811002
[27] 贺庆梅. 海藻中紫外线吸收物质的制备与特性的研究[D]. 青岛: 中国海洋大学, 2008. HE Q M. Study on preparation and character of UV-absorbing compound in seaweeds[D]. Qingdao: Ocean University of China, 2008.
[28] LEE M H, KIM Y K, YOON N Y, et al. Study on UV absorption materials derived from red algae Gloiopeltis fucatas and Mazzaella sp. in Russia[J]. Fish Aquat Sci,2012,15(4):361−363.
[29] CHAVES-PENA P, CODA F D L, FIGUEROA F L, et al. Quantitative and qualitative HPLC analysis of mycosporine-like amino acids extracted in distilled water for cosmetical uses in four Rhodophyta[J]. Marine Drugs,2019,18(1):27−40. doi: 10.3390/md18010027
[30] HARTMANN A, BECKER K, KARSTEN U, et al. Analysis of mycosporine-like amino acids in selected algae and cyanobacteria by hydrophilic interaction liquid chromatography and a novel MAA from the red alga Catenella repens[J]. Marine Drugs,2015,13(10):6291−6305. doi: 10.3390/md13106291
[31] BEDOUX G, HARDOUIN K, MARTY C, et al. Chemical characterization and photoprotective activity measurement of extracts from the red macroalga Solieria chordalis[J]. Botanica Marina,2014,57(4):291−301. doi: 10.1515/bot-2013-0118
[32] PLACK P A, FRASER N W, GRANT P T, et al. Gadusol, an enolic derivative of cyclohexane-1, 3-dione present in the roes of cod and other marine fish. Isolation, properties and occurrence compared with ascorbic acid[J]. Biochemical Journal,1981,199(3):741−747. doi: 10.1042/bj1990741
-
期刊类型引用(2)
1. 胡晓琪,徐沈晨,王思宇,浦孟宣,胥珍红,马骁,孙颖颖. 石莼类菌孢素氨基酸的提取工艺及对副溶血弧菌的抑菌机理. 食品工业科技. 2024(18): 175-183 .  本站查看
本站查看
2. 赵秀芳,易俪慧,何阳迪,马骁,浦孟宣,朱文轩,王建莉,孙颖颖. 大型褐藻类菌胞素氨基酸的活性分析和应用研究. 食品科技. 2023(06): 202-209 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:




 下载:
下载:



