Exploration and Performance Evaluation of Probiotic Microcapsule Technology for Longevity Elderly Based on RBF-GA
-
摘要: 益生菌产品由于在储存或在胃肠道中活性会产生一定程度的降低,导致它们潜在的益生特性不能很好地发挥,因此,本研究对源自广西巴马百岁老人的发酵乳杆菌LTP1332进行了微胶囊化研究。在海藻酸钠(Sodium alginate,SA)和氯化钙为主要壁材的基础上,引入明胶(Gelatin,GEL)和壳聚糖(Chitosan,CS)进行复合,通过单因素实验寻找影响包埋率的关键因素,利用响应面设计(Box-Behnken Design,BBD)构建径向人工神经网络模型(Radial Basis Function,RBF),并借助遗传算法(Genetic Algorithms,GA)对其包埋工艺进行寻优。利用SEM扫描电镜等方法对优化后的胶囊进行表征,并进行体外模拟消化试验。结果表明,微胶囊的最佳制备工艺参数为:2.210%海藻酸钠,4.451% CaCl2,0.1%明胶,13.529 min固化时间,在该条件下所制样品的平均包埋率为95.08%±0.25%。优化工艺条件下的CS-GEL-SA-微胶囊经模拟胃液处理120 min后,菌体存活率仍可达22.48%±0.78%;在模拟肠液消化90 min时,菌体释放率即可达到最大值,具有较好的肠溶性。综上,该工艺条件下制备的长寿老人源益生菌微胶囊具有较好的护菌效果和开发应用前景。Abstract: The activity of probiotic products would reduce to a certain extent during storage and in the gastrointestinal tract, resulting in weakened potential probiotic properties, in this study, Lactobacillus fermentum LTP1332 from the feces of centenarians in Bama, Guangxi was microencapsulated. In this experiment, gelatin (GEL) and chitosan (CS) were introduced for compounding based on sodium alginate (SA) and CaCl2 as the main wall materials. The key factors affecting the embedding rate were found by single-factor test, the radial basis function (RBF) was constructed by using Box-Behnken design (BBD), and the encapsulation process of Lactobacillus fermentum LTP1332 microcapsules was optimized by using genetic algorithms (GA). The optimized capsules were characterized using SEM scanning electron microscopy and other methods, and the in vitro simulated digestion tests was carried out. Results showed that, the optimum preparation parameters of the microcapsule were as follows: 2.210% sodium alginate, 4.451% CaCl2, 0.1% gelatin, 13.529 min curing time. Under such conditions, the measured average embedding rate was 95.08%±0.25%. The cell survival rate of CS-GEL-SA microcapsule under the optimized processing conditions could still reach 22.48%±0.78% after being treated with simulated gastric juice for 120 min. The maximum rate of probiotic release could be reached at 90 min of digestion with simulated intestinal juice, which had good intestinal solubility. Therefore, it is considered that the long-lived elderly source probiotic microcapsule prepared under this processing condition would have a good bacterial protection effect and good prospects in development and application.
-
联合国粮食及农业协会(FAO)以及世界卫生组织(WHO)将益生菌定义为在适量条件下可以对宿主健康有益的活体微生物[1]。它们可以通过改善肠道微生态系统间接参与代谢、免疫反应以及疾病,从而影响人体健康[2]。乳杆菌属作为一类益生菌在人体肠道中广泛分布[3],研究表明,乳杆菌属中的发酵乳杆菌具有降解胆固醇、抗氧化以及抑制病原体的功效[4-5]。同时,乳杆菌属作为长寿老人的优势菌群[6-7],也开始受到人们的广泛关注。长寿老人源乳杆菌已经被证明了具有延缓衰老[8]、抑制基因毒性[9]、调节炎症健康[10]以及改善免疫调节[11]等功效,说明长寿老人源乳杆菌具有良好的潜在开发价值。
发酵乳杆菌LTP1332是本课题组从广西巴马长寿老人粪便筛选分离得到的一株优良肠道益生菌,体外实验已经证明了其具有良好的益生性能[12]。兰海静等[13]和黄燕婷等[14]等将发酵乳杆菌LTP1332添加至小鼠优化饲料中喂养衰老小鼠,使小鼠的运动协调能力和学习记忆能力等得到明显改善。以上研究结果说明了发酵乳杆菌LTP1332有良好的益生特性,具有开发成益生菌产品的潜力。
由于益生菌在储存以及肠道运输过程中的活性明显降低,因此可能无法实现自身潜在的益生特性[15-16]。微胶囊化作为一种新型的保护技术,可以增强益生菌抵御不良环境的能力,保证益生菌顺利到达肠道定殖并更好地发挥自身益生特性[17-18]。选择合适的壁材是微胶囊包埋技术的关键,由于用海藻酸盐与Ca2+交联制备凝胶具有无毒、成本低、操作简单等特点[15],使得海藻酸盐也成为了目前最广泛使用的益生菌微胶囊凝胶壁材[19]。然而,单一的海藻酸盐凝胶体系通常具有较强的半透性,这使得当酸性过低或者Ca2+过量时,形成的凝胶会发生一定的降解甚至崩塌[20]。将海藻酸盐与其他材料复合可以有效克服这种困难,从而提高胶囊的护菌效果[21-23]。在食品工业中应用较多的益生菌微胶囊化方法有三种:挤压法[24-25]、乳化法[16,26]和喷雾干燥法[27-29]。挤压法相比于另外两种方法,它具有对设备材料要求不高、胶囊大小均匀成球以及菌体包埋率高的特点[30]。选择合适的工艺条件可以更好地增加微胶囊对益生菌的包埋率[31],但包埋率和微胶囊的工艺条件之间存在着一种非线性关系,所以使用传统的回归模型优化,可能效果不佳。人工神经网络对输入、输出样本进行反复训练学习后,可以有效逼近任意复杂的非线性函数,所以在针对非线性系统的建模、预测问题上受到了许多研究者的关注[32-34]。将径向基函数人工神经网络与遗传算法相结合可以通过自然选择和群体遗传机理,对复杂性形态的非线性函数进行全局优化,这也正适合用来解决益生菌微胶囊工艺条件探索的问题。
为此,本研究以广西巴马百岁老人粪便样品中分离筛选鉴定的发酵乳杆菌LTP1332为试验菌种。采用挤压法制备益生菌微胶囊,选择海藻酸钠、明胶作为复合壁材,并通过壳聚糖进行二次包埋。利用RBF-GA模型探究了发酵乳杆菌LTP1332微胶囊的最佳制备工艺。最后分析微胶囊的形态结构、胃液耐受性以及肠液释放性等特性,以此来测评微胶囊化对发酵乳杆菌LTP1332的护菌效果。以期能为发酵乳杆菌LTP1332在食品工业上的应用提供技术支撑,也为益生菌微胶囊产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
发酵乳杆菌LTP1332(Lactobacillus fermentum,LTP1332) 由本团队分离筛选自广西巴马瑶族自治县健康百岁老人的粪便,已保藏于中国典型培养物保藏中心(保藏号:CCTCC M 2019029);海藻酸钠、壳聚糖、蔗糖 上海源叶生物科技有限公司;海藻糖 河南万邦化工科技有限公司;胰蛋白酶(1:250)、胃蛋白酶(1:10000) 美国Sigma公司;明胶 成都金山化学试剂有限公司;无水氯化钙 国药集团化学试剂有限公司;乙二胺四乙酸二钠 天津市凯通化学试剂有限公司;其它试剂 均为国产分析纯试剂。
GR85DP立式自动压力蒸汽灭菌锅 致微(厦门)仪器有限公司;DHP-9272D电热恒温培养箱 上海齐欣科学仪器有限公司;ZWYR-240恒温培养振荡箱 上海智城分析仪器制造有限公司;AC2-4S1生物安全柜 新加坡艺思高;ME104/02分析天平 梅特勒-托利多仪器(上海)有限公司;日立S-3400N型扫描电镜 日本日立电子有限公司。
1.2 实验方法
1.2.1 菌种活化及菌悬液的制备
将发酵乳杆菌LTP1332接种于MRS液体培养基中,37 ℃恒温振荡培养24 h后,进行活化传代。将扩大培养的发酵乳杆菌LTP1332通过离心(4500 ×g,4 ℃,15 min)获取菌泥[35],弃去上清液后,将菌泥沉淀重悬于20 mL NaCl溶液(8.5 g/L)并在相同条件下再次离心。然后将洗涤的菌泥重新悬浮在NaCl溶液中以获得活菌数约为108 CFU/mL菌悬液。
1.2.2 微胶囊的制备
1.2.2.1 CS-SA-微胶囊
将配制好的海藻酸钠溶液,经过0.22 μm滤膜除菌后,与制备好的菌悬液按2:1比例混合。用无菌注射器将混合液滴入无菌CaCl2固化剂中,形成微囊。用磁力搅拌器充分搅拌,使微囊,均匀成球,以无菌纱布过滤,并用无菌水冲洗胶囊表面残留的Ca2+以及未被包埋的益生菌[36]。取10.0 g过滤后的颗粒添加到90 mL新鲜制备的壳聚糖溶液(0.1%,w/v)中[20]。磁力搅拌5 min,使颗粒均匀包裹一层壳聚糖,用无菌纱布过滤并经无菌水冲洗表面残留的Ca2+及过量壳聚糖等多余物质,即可得到湿胶囊。
1.2.2.2 CS-GEL-SA-微胶囊
将配制好已知的明胶溶液,使用磁力搅拌器搅拌悬浮1 h,经过0.22 μm孔径滤膜进行过滤后以备用[36]。将明胶、海藻酸钠、菌悬液按照1:1:1比例混合后按照1.2.2.1节中的方法制备湿胶囊。
1.2.3 湿胶囊真空冷冻干燥
将所得的湿胶囊平铺于培养皿中,加入适量冻干保护剂溶液(5%蔗糖、5%海藻糖),于−20 ℃预冻2 h,经真空干燥,干燥压力600 Pa,干燥时间约18 h,得到干胶囊。
1.2.4 包埋率的计算
冷冻干燥结束后,采用EDTA溶液(pH8.0)解囊,破坏胶囊结构使胶囊内包埋菌液得以释放,通过平板菌落计数法确定胶囊中包埋活菌数。微胶囊包埋率(Microencapsulation efficiency,ME,%)计算公式如下所示:
ME(%)=NlN0×100 式中:ME表示微胶囊包埋率,%;N1表示微胶囊中所含活菌数,CFU/g;N0表示未形成微胶囊前原始菌液活菌数,CFU/g。
微胶囊解囊:取0.1000±0.0020 g微胶囊颗粒,溶解于30 mL EDTA溶液中,于180 r/min振荡处理5 min,待胶囊充分解囊,吸取混合液梯度倍数稀释后涂布。
1.2.5 胶囊制备工艺参数单因素的筛选
以微胶囊包埋率为参数,固定条件为:固化剂浓度3.3%、固化剂时间15 min、明胶浓度0.2%、海藻酸钠浓度2%。测定固化剂浓度(2.1%、2.7%、3.3%、3.9%、4.5%)、固化时间(5、10、15、20、25 min)、明胶浓度(0%、0.1%、0.2%、0.3%、0.4%)、海藻酸钠浓度(1%、1.5%、2%、2.5%、3%)对发酵乳杆菌LTP1332微胶囊包埋率大小的影响,以确定单因素的最佳条件。
1.2.6 微胶囊制备工艺BBD模型设计
基于单因素实验所得到的结果,选取固化剂浓度(A)、固化时间(B)和海藻酸钠浓度(C)为自变量,并固定明胶添加量为0.1%,发酵乳杆菌LTP1332微胶囊的包埋率作为响应值进行BBD模型设计,响应面因素与水平编码设计见表1。
表 1 响应面因素与水平编码设计Table 1. Factors and levels used in Box-Behnken design因素 水平 −1 0 1 A固化剂浓度(%) 3.3 3.9 4.5 B固化时间(min) 10 15 20 C海藻酸钠浓度(%) 1.5 2 2.5 1.2.7 RBF径向基函数神经网络的构建
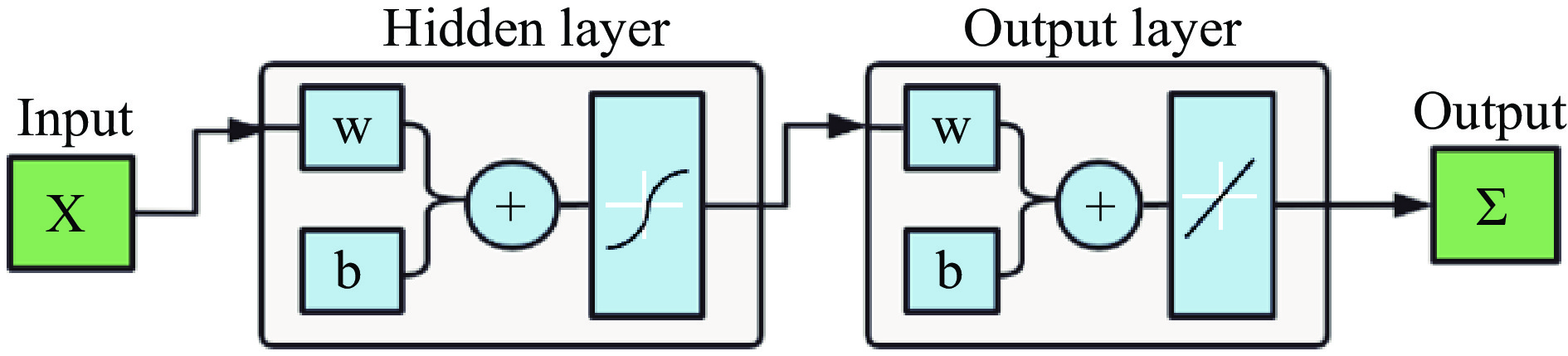
RBF径向基函数神经网络从输入到隐藏层的是非线性映射,从隐藏层到输出的是线性映射,可以很大程度上加快神经网络学习训练的速度并避免产生局部极小值[37],具体实现过程如图1所示。利用BBD模型设计中的3个因素(固化剂浓度、固化时间、海藻酸钠)作为输入层,最终包埋率设置为输出层。选取数据集中的70%为训练集,30%为测试集,最大训练次数为100次,学习精度为10−5,学习步长为0.05[38],以此来构建RBF人工网络模型。
1.2.8 RBF-GA模型寻优设计
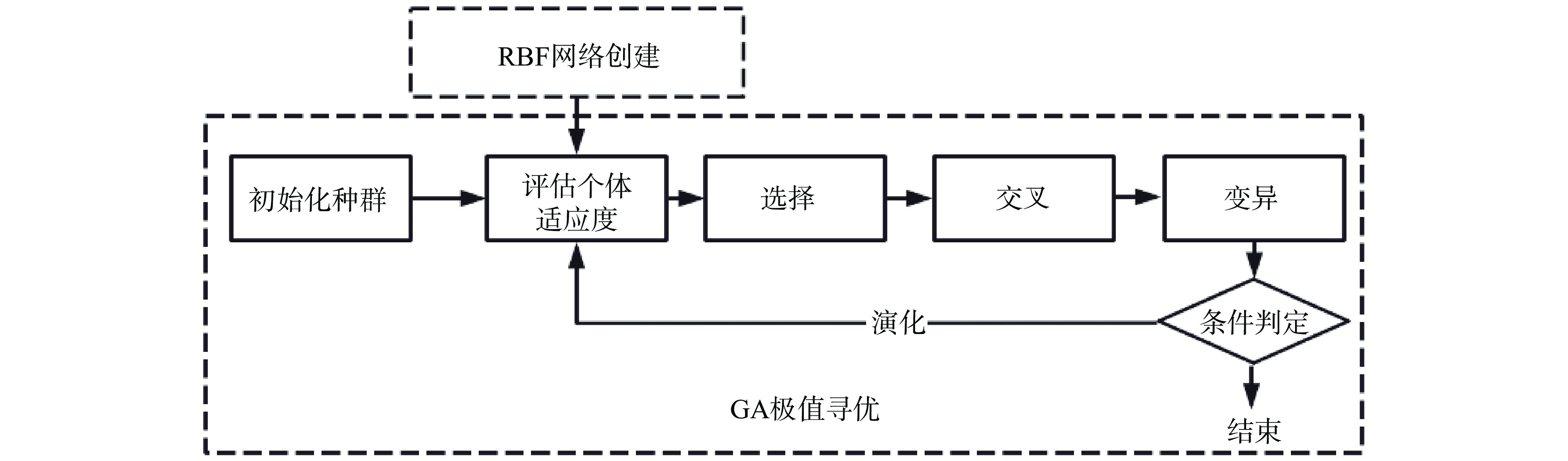
将RBF神经网络训练后的预测结果作为个体适应度值,变量的上下限对应BBD模型设计因素的最高及最低值,设置最大递代次数为60次、代沟为0.25、交叉概率0.8、变异概率0.01。以此来模拟生物的选择、交叉和变异等现象,寻找函数的全局最优值及对应输入值[38],RBF-GA模型寻优的基本流程图如图2所示。
1.2.9 BBD与RBF-GA模型比较
参考文献[39]中的方法,以均方根误差(Root mean square error,RMSE)、平均绝对偏差(Mean Absolute Error,MAE)和绝对系数(R2)大小作为评价预测微胶囊工艺优化模型的指标。其中RMSE和MAE的取值的越低,R2取值越高,则表示构建的模型越稳定,且具有一定的优势。
1.2.10 微胶囊扫描电镜(SEM)分析
用导电胶将制备好的干微胶囊平铺固定在样品台上,氧气吹去表面残留杂质后,15 mA离子化电流喷金2 min,通过扫描电镜观察发酵乳杆菌LTP1332微胶囊内部的结构特征。
1.2.11 微胶囊在模拟胃液中的耐受性试验
准确称取0.1000±0.0020 g冰箱储存的干微胶囊样品,加入3 mL人工模拟胃液(0.002 g/mL NaCl、0.0032 g/mL胃蛋白酶,用稀盐酸调整pH为2.0,过滤除菌后以备用)[12],混匀15 s,设置摇床转速为200 r/min,振荡处理,在0、30、60、90、120 min时,取处理液中的微胶囊,经EDTA解囊后,梯度取适量解囊液进行稀释涂布,测定菌落数。并取0.1 mL制备好的菌悬液,加入到3 mL人工模拟胃液中做对照试验。
1.2.12 微胶囊在模拟肠液中的释放性试验
参考周莉[21]、石月[40]的实验方法,并稍做改进。准确称取0.1000±0.0020 g冰箱储存的干微胶囊样品,加入3 mL人工模拟肠液(0.0068 g/mL KH2PO4、0.01 g/mL胰蛋白酶、0.003 g/mL胆盐,用0.4% NaOH调pH至8.0)[12],混匀15 s,设置转速为200 r/min,摇床振荡,在30、60、90、120、150 min时,取1 mL混合液于离心管中,经过500 r/min离心5 min,取上清液,稀释涂布,测定菌落数。
1.3 数据处理
试验均设置 3 次重复。利用Design-Expert V10.0.7软件进行响应面设计;Excel 2016软件、GraphPad Prism V8.0.2软件、Origin 2019软件进行数据分析及绘图;MATLAB R2019b软件构建人工神经网络模型及运行遗传算法寻优。
2. 结果与分析
2.1 微胶囊制备工艺单因素实验
2.1.1 固化剂浓度对微胶囊包埋率的影响
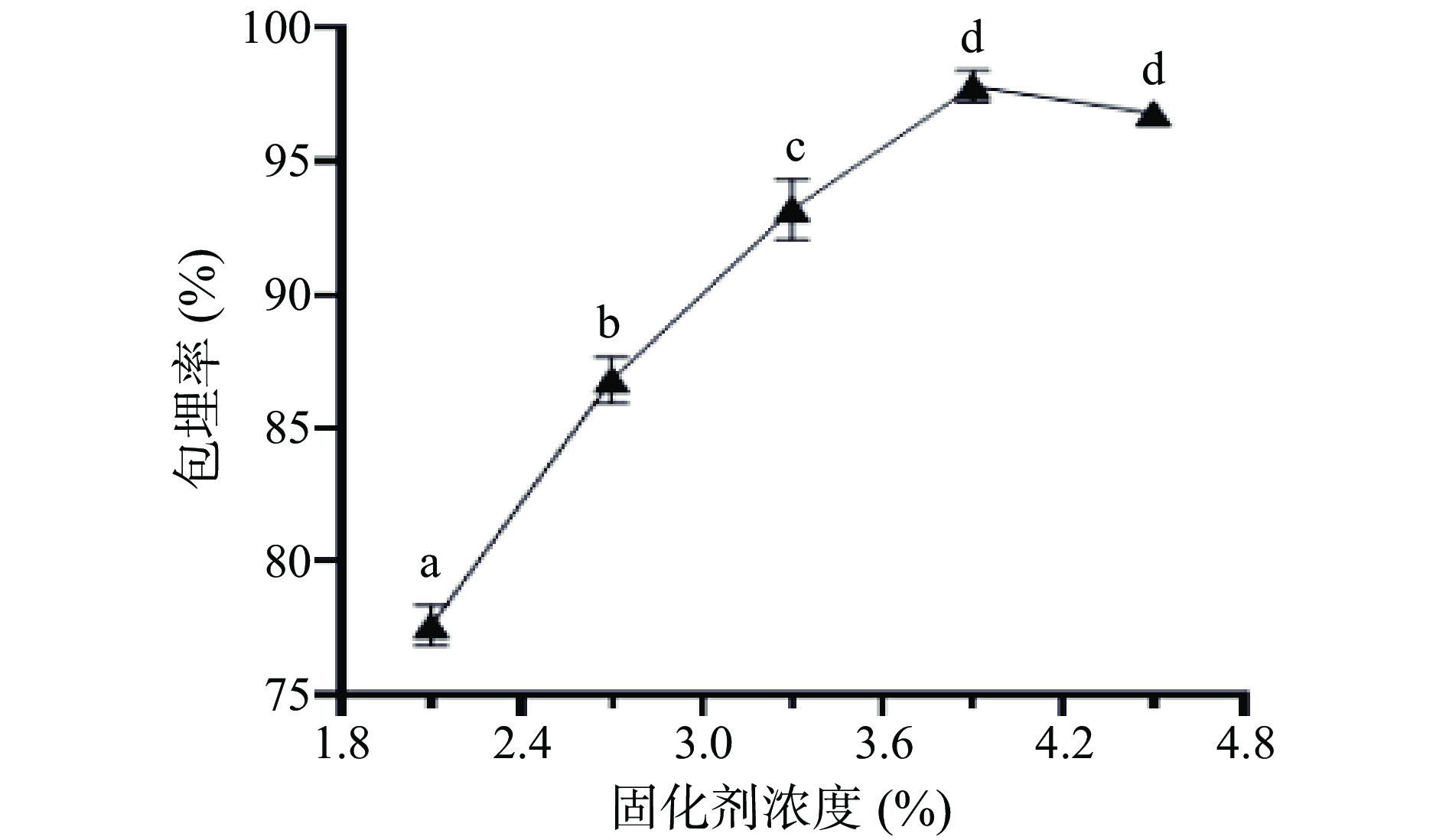
选择合适的工艺参数可以有效提高发酵乳杆菌LTP1332微胶囊的包埋率。按照1.2.2.2中的方法制备发酵乳杆菌LTP1332微胶囊,由图3可知,固化剂用量由2.2%增加到3.9%时,包埋率快速上升。随着Ca2+含量逐渐增多,整个体系能够与壁材发生交联反应的Ca2+相对减少,导致反应受到限制,无法包埋更多数量的发酵乳杆菌LTP1332,同时,局部钙离子的浓度过大,滴入的混合液很快被固化,从而导致制备的微胶囊壁材不稳定,不能更好得保护菌液,因此,在固化剂浓度3.9%时包埋率达到最大值,之后整体出现了下降的趋势。综上所述,选择固化剂浓度3.9%为最适单因素条件。
2.1.2 固化剂时间对微胶囊包埋率的影响
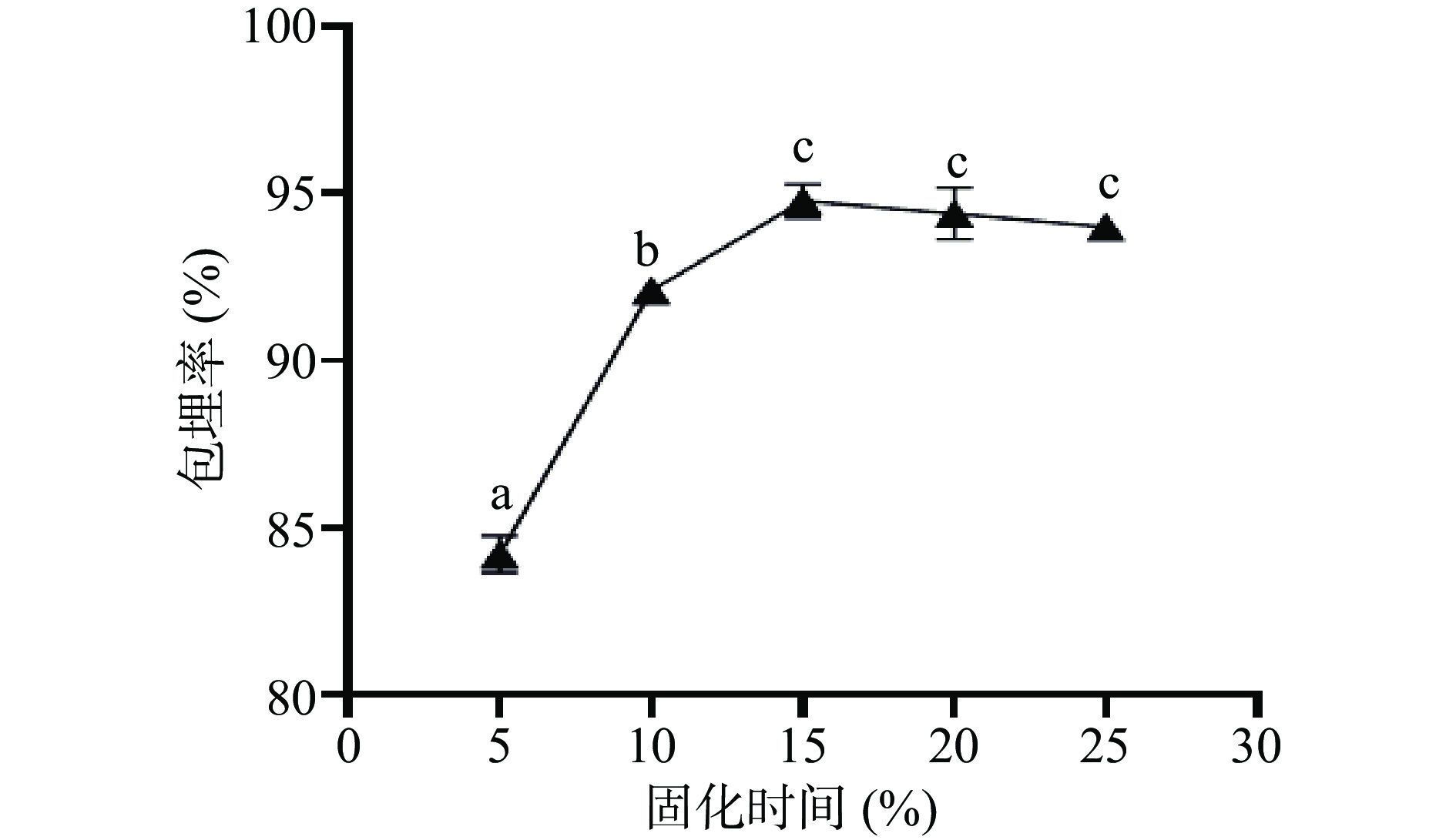
从图4可以看出,随着固化剂作用的时间增加,发酵乳杆菌LTP1332微胶囊的包埋率在逐渐上升,当固化时间超过15 min后整体呈下降趋势,此时包埋率最大可达94.8%±0.41%。壁材间交联反应达到饱和后,随着固化时间的延长会导致胶囊的脆性增加,从而导致包埋率降低[40]。因此,选择固化时间15 min作为发酵乳杆菌LTP1332微胶囊的最佳单因素制备条件。
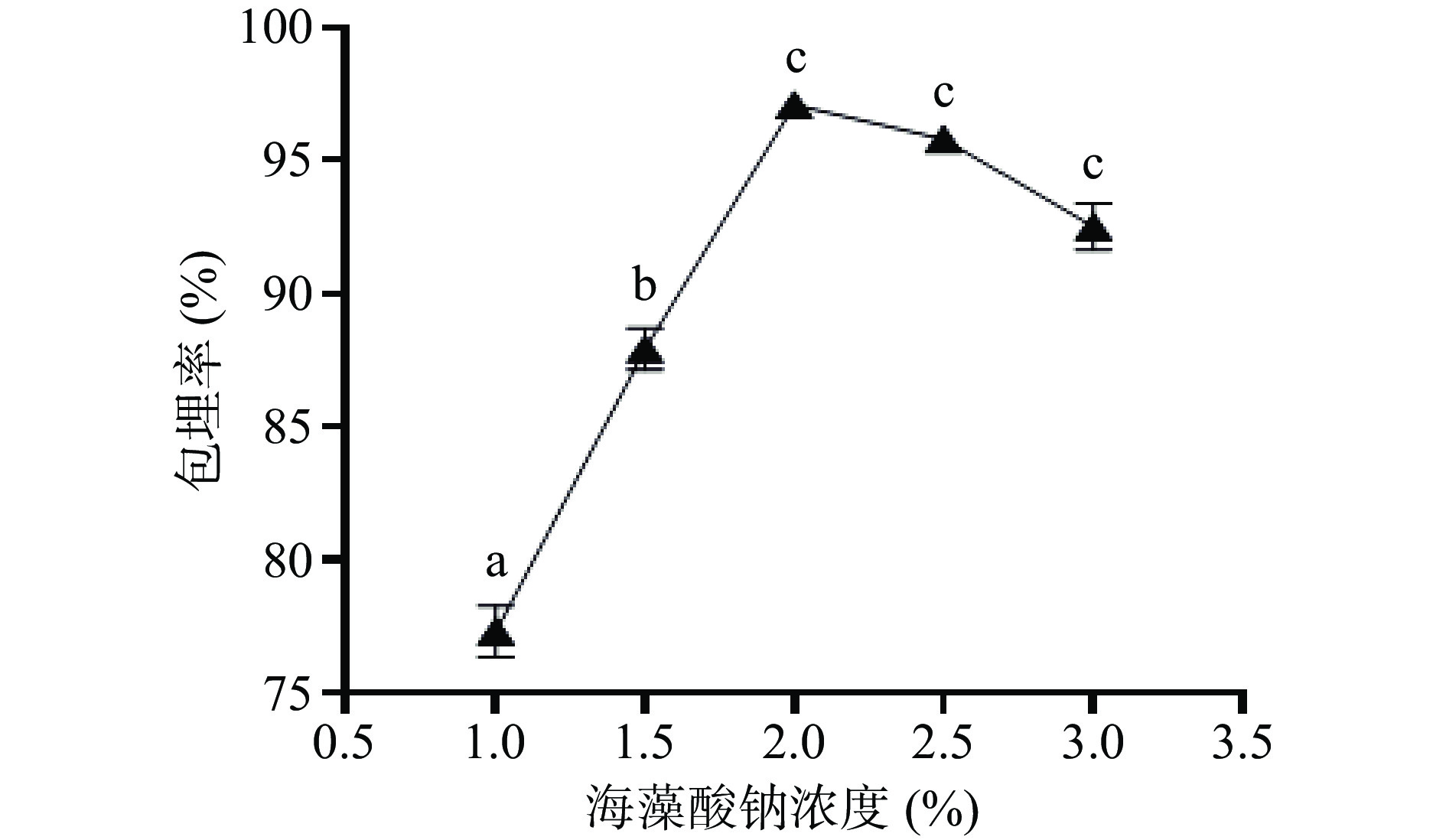
2.1.3 海藻酸钠浓度对微胶囊包埋率的影响
由图5可知,海藻酸钠过低时,形成的凝胶颗粒机械强度低,在搅拌时很容易被搅散,因此不能有效地包埋菌体,导致包埋率相对较低;在海藻酸钠浓度从1%提高到2%的过程中,随着海藻酸钠溶液浓度的增加,更多的Ca2+可以与海藻酸钠相结合,导致混合液粘度增大,菌液不容易分散,微胶囊的包埋率也在逐渐增加;当浓度超过2%后,海藻酸钠与Ca2+的结合位点增多,导致海藻酸钠中ɑ-L-古洛糖醛酸(ɑ-L-guluronic,G)单元上的Na+不能够完全与Ca2+发生离子交换反应,从而不能结合成密集的网状结构[23]。因此将2%海藻酸钠作为发酵乳杆菌LTP1332微胶囊的最佳单因素制备条件。
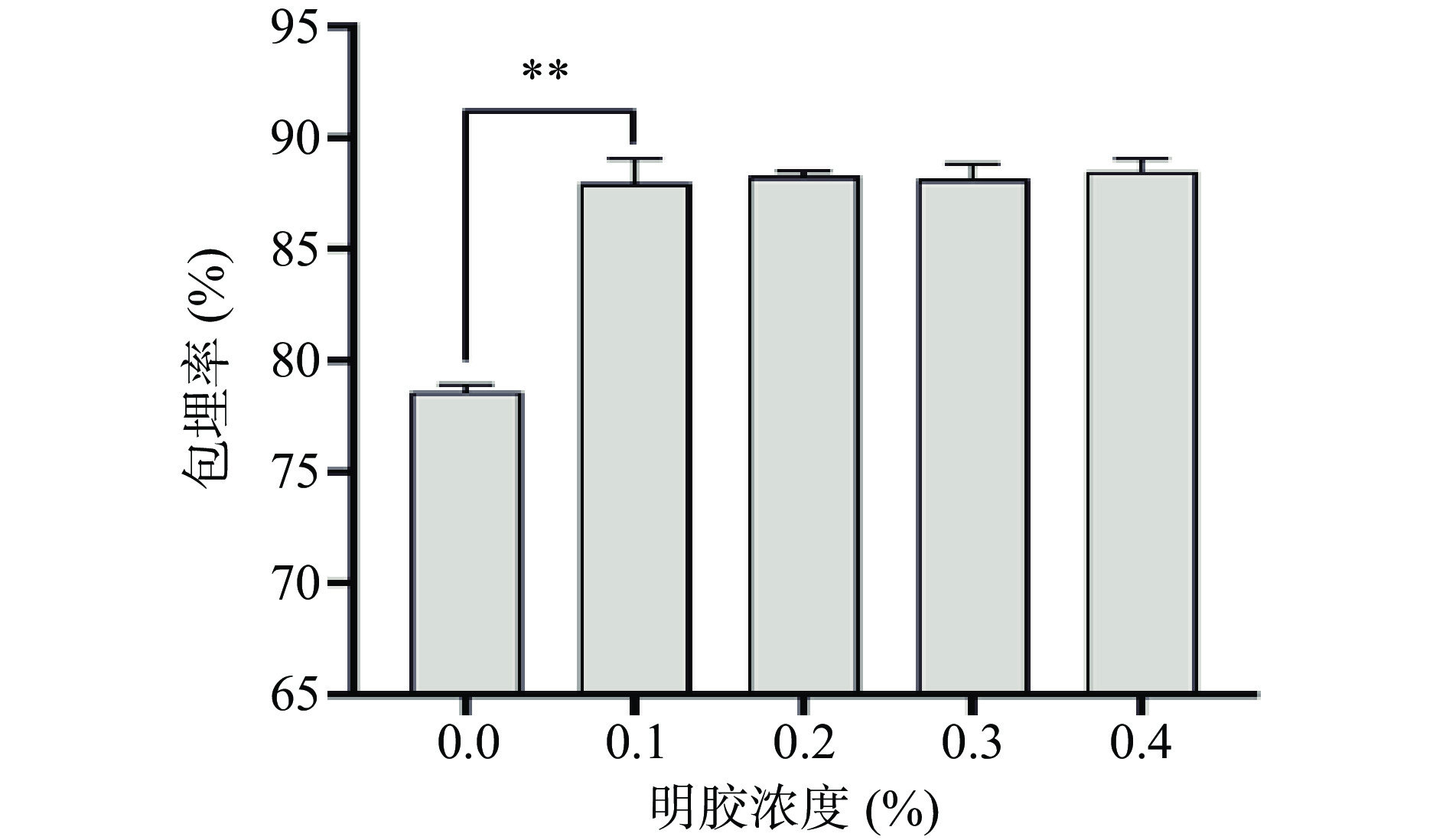
2.1.4 明胶浓度对微胶囊包埋率的影响
由图6可知,加入明胶后可以显著提高发酵乳杆菌LTP1332微胶囊的包埋率(P<0.01),但当明胶添加量超过0.1%后,微胶囊包埋率的变化不显著(P>0.05),因此不将其作为今后的优化条件,后续条件优化过程中固定添加0.1%的明胶。
2.2 微胶囊工艺BBD模型设计
2.2.1 Box-Behnken 响应面试验
以发酵乳杆菌LTP1332微胶囊的包埋率为响应值,按照表1中的因素水平进行响应面试验,试验结果如表2所示。根据表2的结果进行多元回归拟合得到二元多项方程为:
表 2 响应面试验设计方案及结果Table 2. Design scheme and results of response surface test实验号 A B C Y包埋率(%) 1 0 0 0 97.64 2 1 0 1 95.45 3 −1 −1 0 95.48 4 0 −1 −1 92.67 5 1 0 −1 94.33 6 −1 1 0 95.00 7 0 1 −1 93.01 8 0 0 0 98.36 9 0 0 0 97.13 10 −1 0 −1 91.94 11 0 0 0 98.09 12 0 −1 1 96.94 13 1 1 0 93.72 14 0 1 1 94.67 15 0 0 0 98.38 16 −1 0 1 97.07 17 1 −1 0 94.80 Y=97.92−0.15A−0.44B+1.52C−0.15AB−1.00AC−0.65BC−1.40A2−1.77B2−1.82C2
式中:Y表示益生菌微胶囊的包埋率,%;A表示固化剂浓度,%;B表示固化时间,min;C表示海藻酸钠浓度,%。
2.2.2 方差分析
根据表3可知,响应面模型极显著(P<0.01),失拟项不显著(P>0.05),表明了BBD模型的试验结果和数学模型拟合良好,没有产生失拟现象,模型可用。在二元多项式的方程决定系数R2为0.9690,校正决定系数R2adj为0.9292,说明了BBD模型与试验数据以及方程的拟合度良好,所得到的二元多项式方程可靠性高。同时,交互项AC、BC,二次项A2、B2、C2对发酵乳杆菌LTP1332微胶囊的包埋率影响显著(P<0.05),而交互项AB表现为不显著(P>0.05),这表明了各个影响因素与微胶囊的包埋率之间存在着一种非线性关系,图7更直观地反映了3个影响因子对微胶囊包埋率的影响。模型中的F值可以反映出各因素对所设参数影响程度的大小,一般F值越大,因素对参数的影响程度就越大[41]。根据F值可知,对发酵乳杆菌LTP1332微胶囊包埋率影响程度由大到小的排序为C>B>A,即海藻酸钠的浓度影响程度最大,固化剂时间其次,固化剂浓度影响程度最小。
表 3 以包埋率为响应值的回归模型及方差分析Table 3. Regression model and analysis of variance with embedding rate as response value方差来源 平方和 自由度 均方 F值 P值 显著性 模型 65.63 9 7.29 24.33 0.0002 ** A 0.18 1 0.18 0.59 0.4673 NS B 1.52 1 1.52 5.08 0.0589 NS C 18.54 1 18.54 61.87 0.0001 ** AB 0.09 1 0.09 0.30 0.6007 NS AC 4.02 1 4.02 13.41 0.0080 ** BC 1.70 1 1.70 5.68 0.0486 * A2 8.22 1 8.22 27.44 0.0012 ** B2 13.23 1 13.23 44.13 0.0003 ** C2 14.02 1 14.02 46.79 0.0002 ** 失拟项 0.96 3 0.32 1.13 0.4377 NS R2 0.9690 R2adj 0.9292 CV 0.57 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),NS表示差异不显著(P>0.05)。 2.3 RBF-GA模型预测
2.3.1 RBF神经网络建模
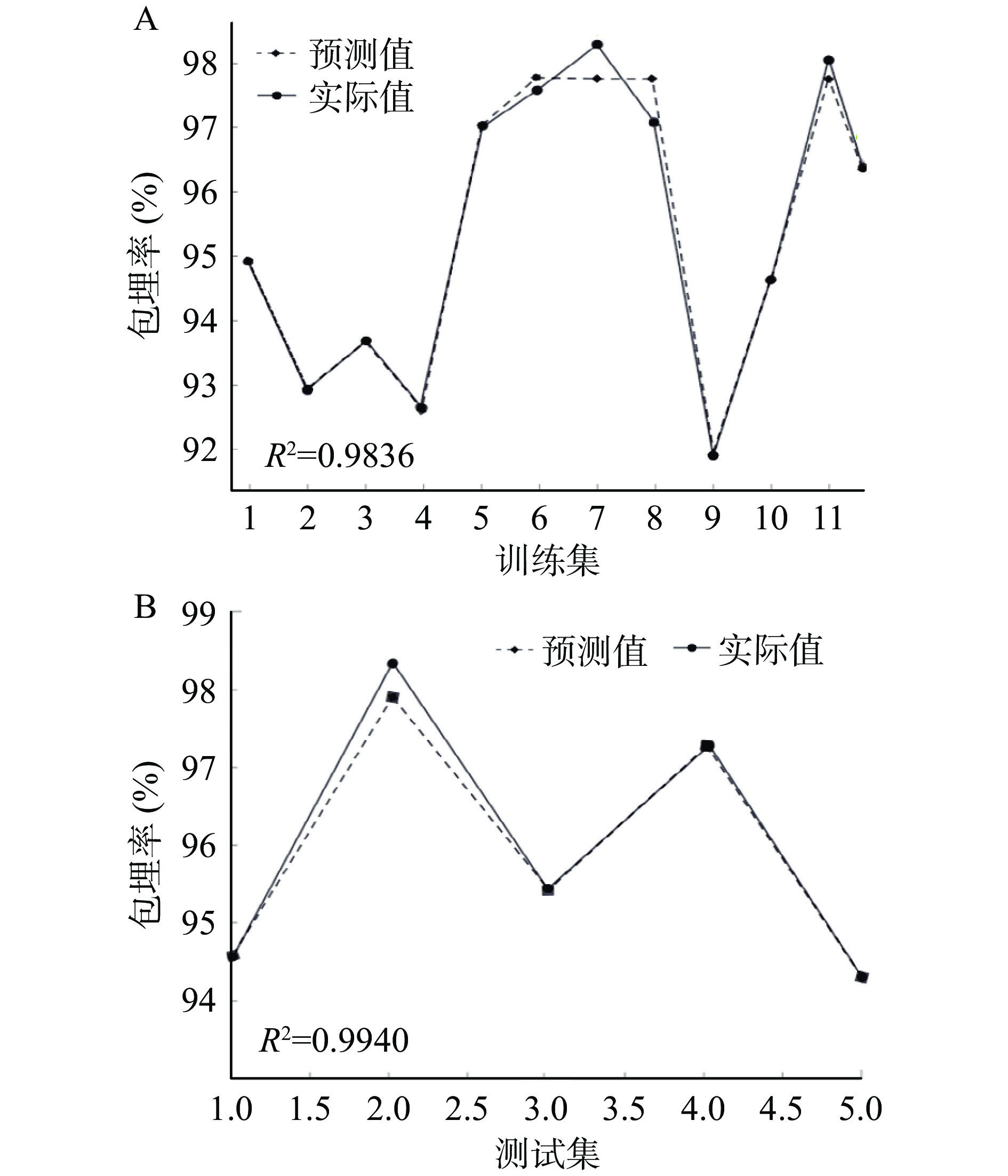
RBF神经网络具有最佳逼近和全局最优的性能,基本方式是用径向基函数构建隐藏层,将输入的低维矢量变换至高维空间内,从而可以使低维空间内线性不可分的问题在高维空间内线性可分[37]。将表2作为RBF人工神经网络模型的训练和测试样本数据集,该模型的训练及预测效果如图8所示。
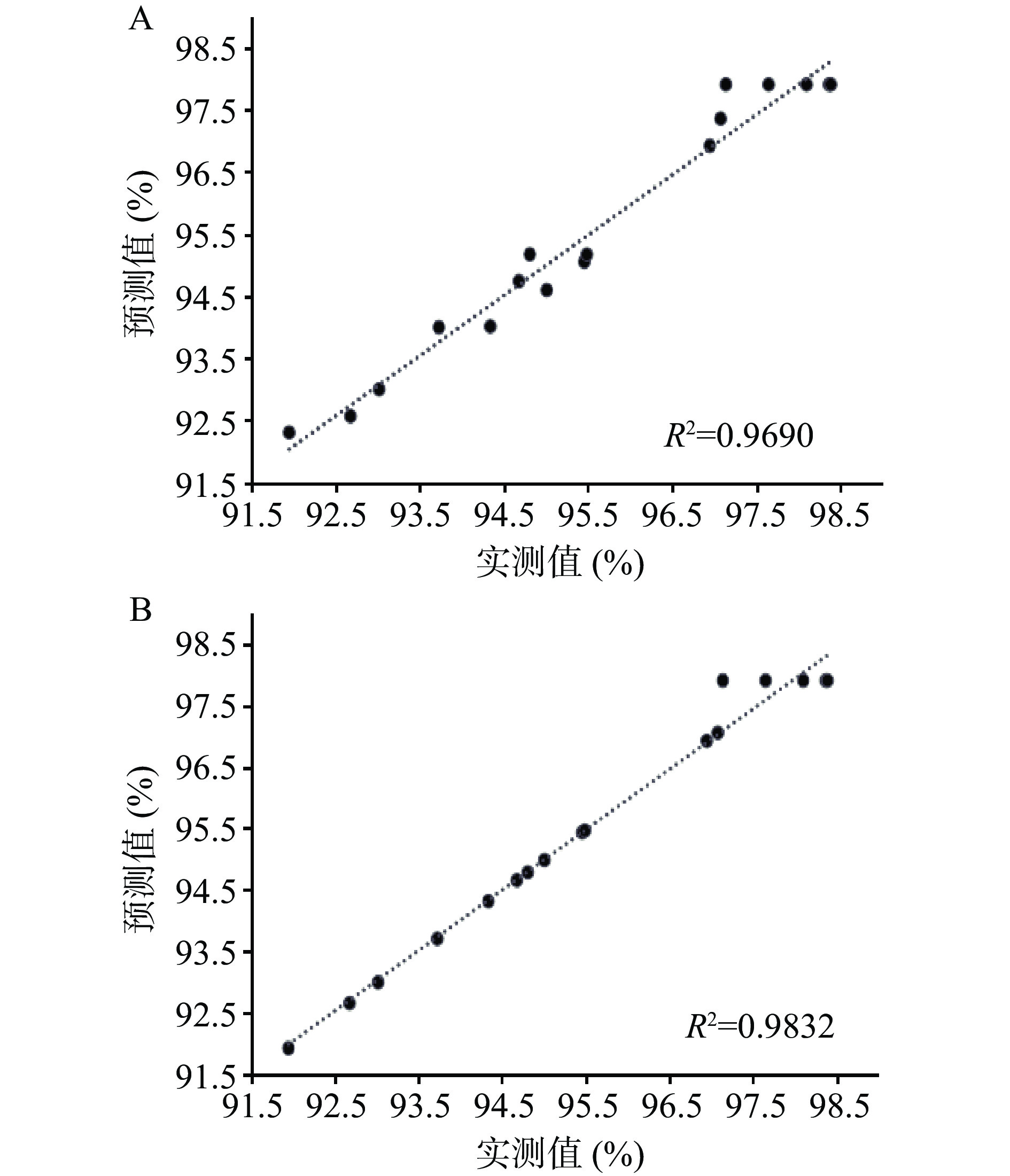
图8A反映对训练集的训练情况,预测值和实际值的重合程度越高说明训练效果越好,本研究的训练集经过100次以后,R2达到0.9836,说明经训练后神经网络模型的拟合度较高,可用于之后的测试。图8B反映了测试结束后程序自动将剩余的测试集带入模型进行测试的结果,除第二个样本略微出现偏离外,整体测试趋势良好,可以用来对发酵乳杆菌LTP1332微胶囊包埋率的后续模拟。
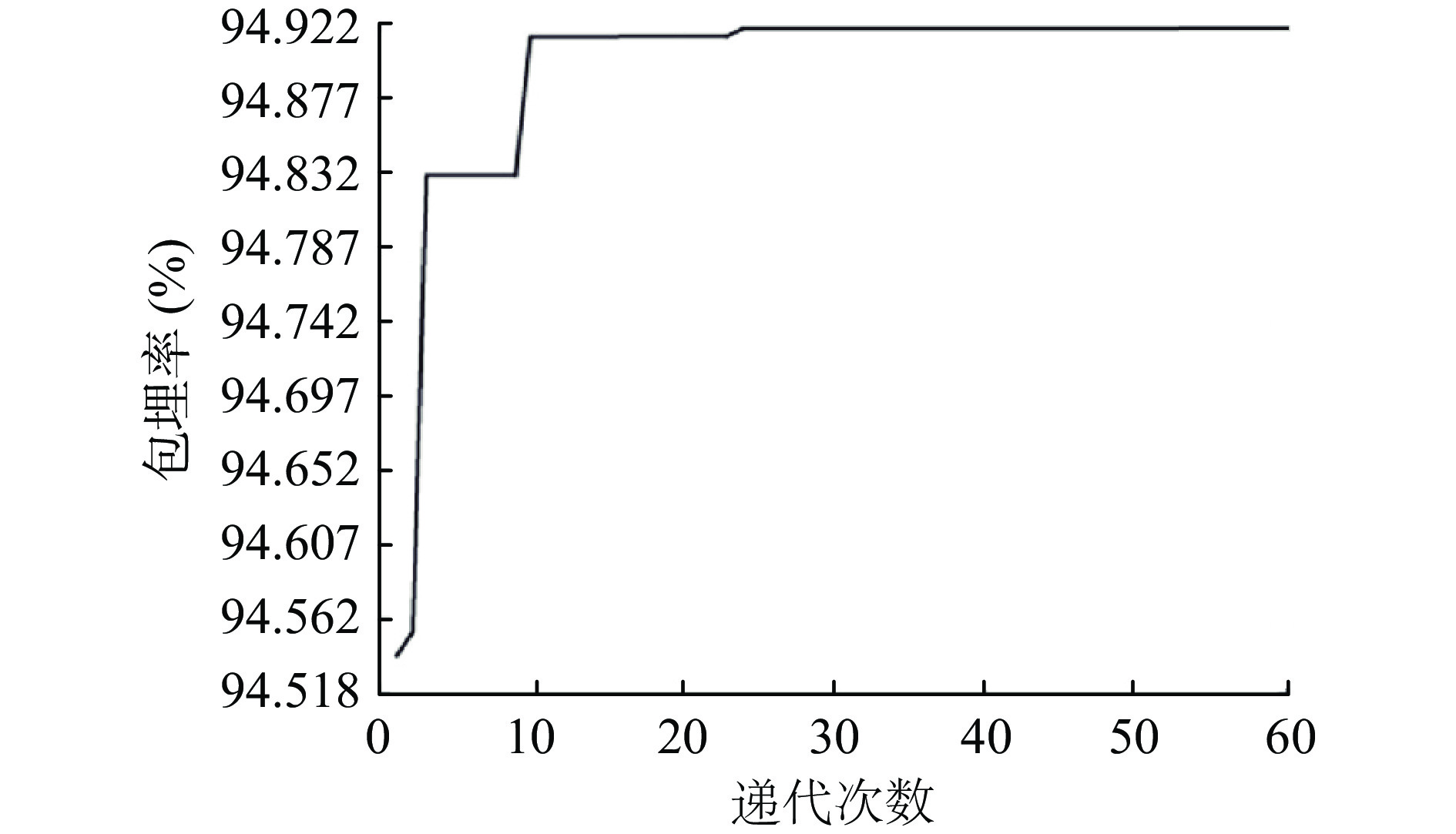
2.3.2 RBF-GA模型寻优结果
设定的最大遗传代数60,变量的二进制位数为8,利用GA对RBF径向基神经网络进行递代寻优。由图9可知,随着递代次数的不断增加,个体适应度所处的平稳期逐渐增长,这说明个体的适应能力会随着适应函数的减小而逐渐增大[37]。通过MATLAB R2019b软件运行GA算法程序,模拟生物进化过程中的选择、交叉、变异等自然选择情形,经过约24次的迭代,适应度曲线趋于平稳,寻找到最优值,迭代结束。由GA迭代程序运行结束的输出结果可得,包埋率的最大预测值为94.919%。对应的海藻酸钠浓度,固化剂浓度和固化时间的最优值分别为4.451%,2.210%和13.529 min。此时包埋率实测平均值为95.08%±0.25%,相对标准差(RSD)为3.28%,且预测值与实际值基本吻合,说明RBF-GA模型的寻优结果及各参数可靠。
2.4 两种优化模型比较
2.4.1 RBF-GA和BBD预测结果对比
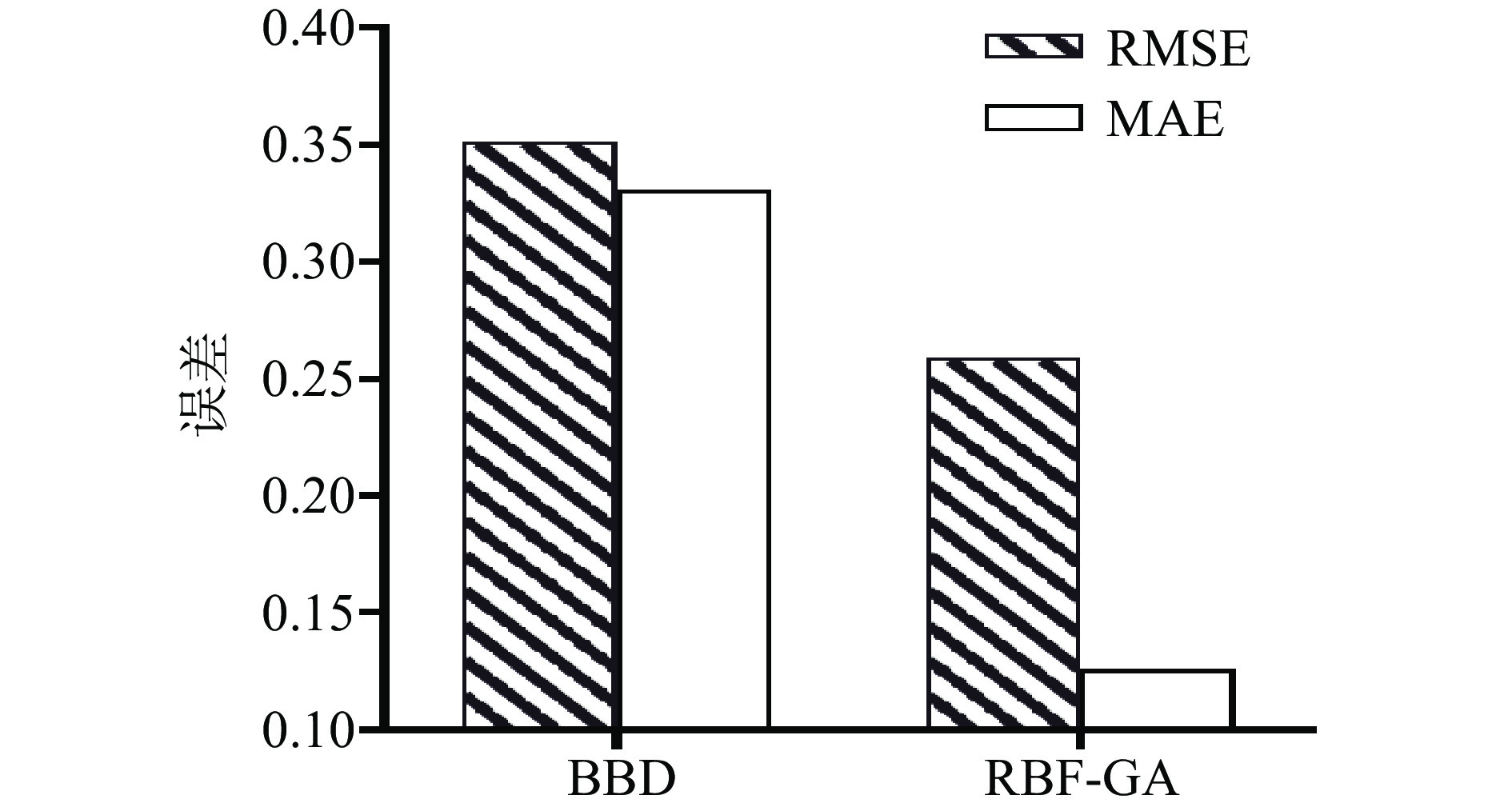
表4为BBD和RBF-GA模型所提供的发酵乳杆菌LTP1332微胶囊包埋率预测值。结合表4中两种优化模型的实测值及预测结果,分别计算出BBD和RBF-GA模型的RMSE、MAE以及R2值,分别为0.3513、0.3307、0.9690和0.2586、0.1259、0.9832。BBD和RBF-GA模型对发酵乳杆菌LTP1332微胶囊包埋率预测值的评估结果如图10所示。将二者的RMSE、MAE、R2进行对比,并结合图10可以发现RBF-GA模型比BBD模型具有更为准确的评估预测能力。由于微胶囊工艺参数与包埋率的非线性较强,RBF-GA与BBD模型相比具有更好的拟合效果,这与神经网络遗传算法模型在其它领域的应用效果类似[42-43]。
表 4 BBD和RBF-GA模型的预测值Table 4. Predicted values of BBD and RBF-GA models实验号 实测值(%) BBD预测值(%) RBF-GA预测值(%) 1 97.64 97.92 97.92 2 95.45 95.07 95.45 3 95.48 95.19 95.48 4 92.67 92.58 92.67 5 94.33 94.03 94.33 6 95.00 94.61 95.00 7 93.01 93.02 93.01 8 98.36 97.92 97.92 9 97.13 97.92 97.92 10 91.94 92.32 91.94 11 98.09 97.92 97.92 12 96.94 96.93 96.94 13 93.72 94.02 93.72 14 94.67 94.76 94.67 15 98.38 97.92 97.92 16 97.07 97.37 97.07 17 94.80 95.20 94.80 2.4.2 RBF-GA和BBD优化结果对比
RBF-GA和BBD模型优化各项参数、预测值以及实际值的对比如表5所示。就发酵乳杆菌LTP1332微胶囊包埋率的平均实测值与预测值而言,RBF-GA模型较BBD模型分别提高了0.76%和0.471%。由图11可知,RBF-GA模型的RMSE和MAE均小于BBD模型,说明RBF-GA模型具有更好的预测性能。单从包埋率的优化结果看,尽管本文优化结果显著性不高(P=0.0197<0.05),但依旧表明该法具有可行性。因为RBF-GA模型在优化的过程中并不需要其它额外的试验,方法较为简单,这也与许多研究者的方法相似,在BBD试验数据的基础上进行优化,使BBD作为人工神经网络遗传算法目标函数的二阶模型,最终在优化中均取得了更好的结果[44-45]。因此,可以认为RBF-GA模型在发酵乳杆菌LTP1332微胶囊制备工艺探究中已对BBD的二阶模型进一步优化。
表 5 RBF-GA模型与响应面优化模型下的预测值和实际值比较Table 5. Comparison of optimization results of RBF-GA and BBD for protectants优化模型 最优条件 预测包埋率(%) 实测平均包埋率(%) 固化剂浓度(%) 固化时间(min) 海藻酸钠浓度(%) RBF-GA 4.451 13.529 2.210 94.919 95.08±0.25 BBD 3.401 19.324 1.696 93.720 94.32±0.42 2.5 微胶囊质构分析结果
2.5.1 微胶囊外观
一般来说,通过挤压法制得的微胶囊,平均粒径在2~5 mm[46],且粒径在2~4 mm范围内的藻酸盐水凝胶颗粒对包裹在其中的益生菌具有更好的保护作用[47]。按照1.2.2.2方法,本研究制备的RBF-GA优化条件下的湿胶囊平均粒径为2.76±0.43 mm,干胶囊的平均粒径为1.25±0.26 mm,粒径大小在前人探索的优质范围之内,具体效果如图12所示。
2.5.2 扫描电镜(SEM)
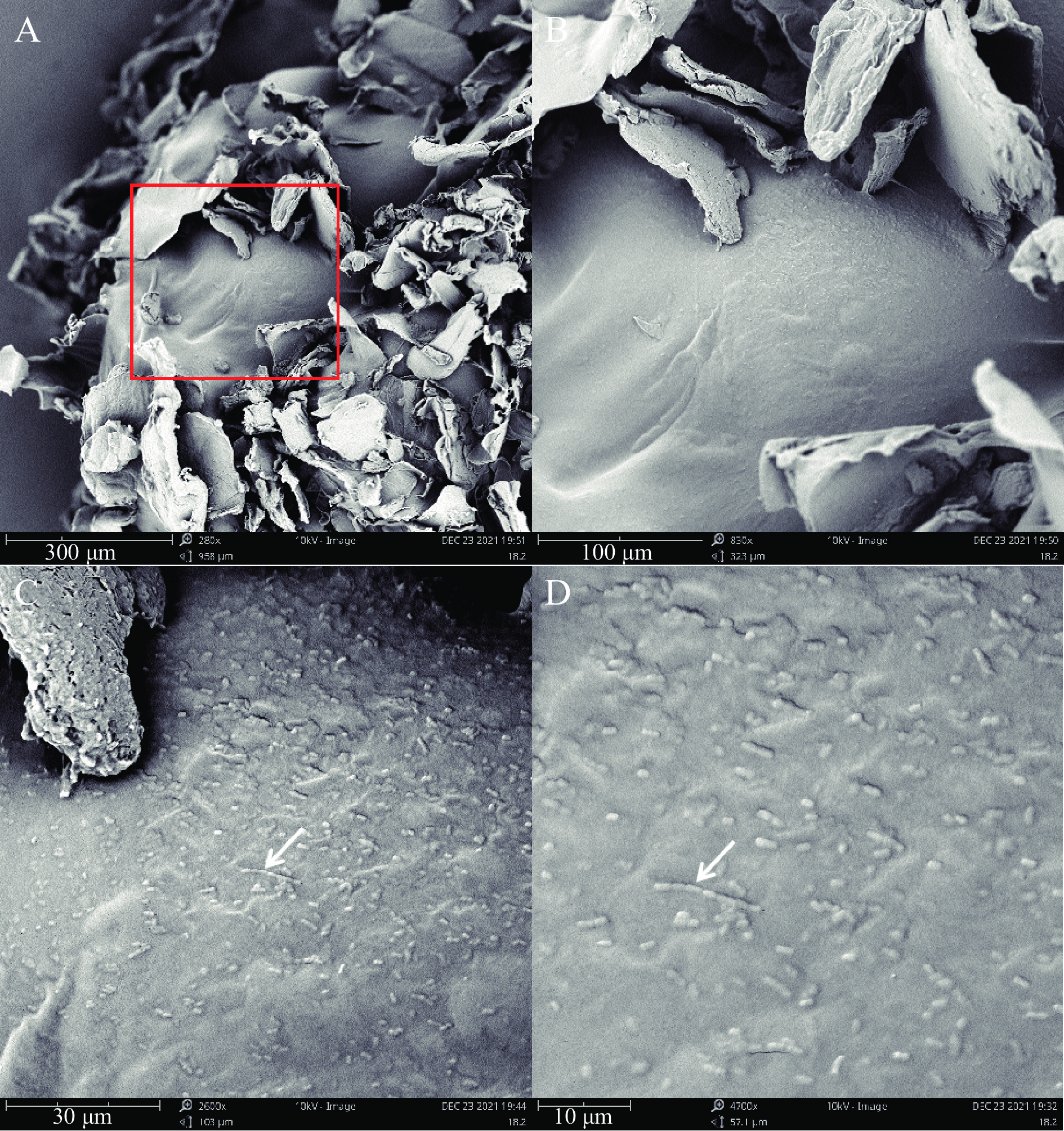
本研究通过SEM扫描电镜观察RBF-GA优化工艺条件下发酵乳杆菌LTP1332干微胶囊形态。经过冷冻干燥后,微胶囊的形态会发生变化[48],发酵乳杆菌LTP1332微胶囊形状由规范球体变为不规则球形。这可能是由于壳聚糖的沉积,在海藻酸盐表面形成聚电解质膜,从而导致胶囊壁材的外表面出现了一定的褶皱现象。图13A为发酵乳杆菌LTP1332胶囊的部分截面图,可以发现微胶囊的内部为多孔状,应该是海藻酸盐上的G单位与Ca2+形成离子桥导致的,这也证明了海藻酸钠和CaCl2之间很好地发生了离子性凝胶化[20]。图13B~D为图13A中红框部分的逐步放大图,从中可以发现,在微胶囊壁材上表面附着杆状的发酵乳杆菌LTP1332,这显示着微胶囊化可以对发酵乳杆菌LTP1332进行包埋和保护。
2.6 模拟胃肠道消化试验结果
2.6.1 模拟胃液耐受性试验结果
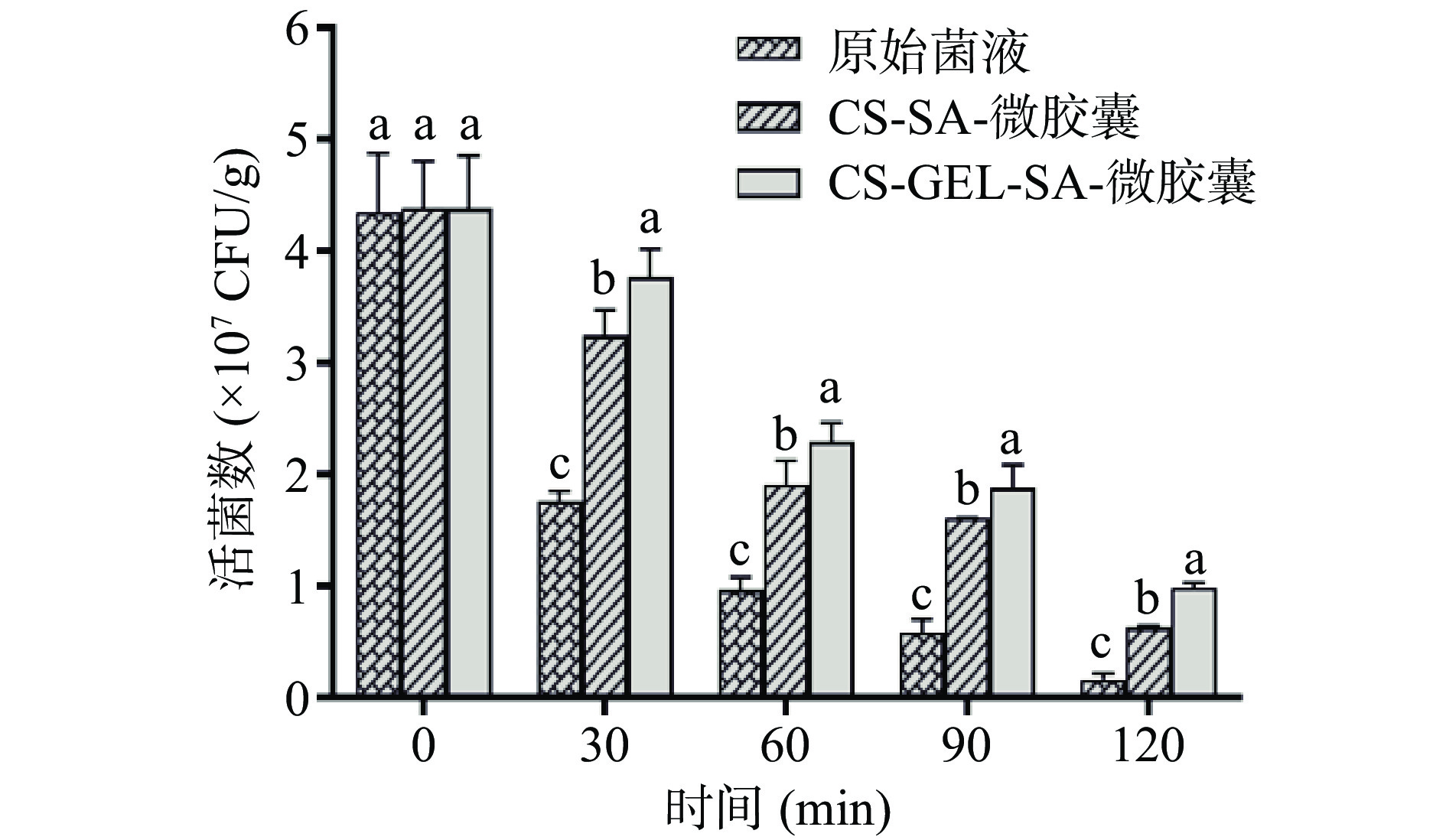
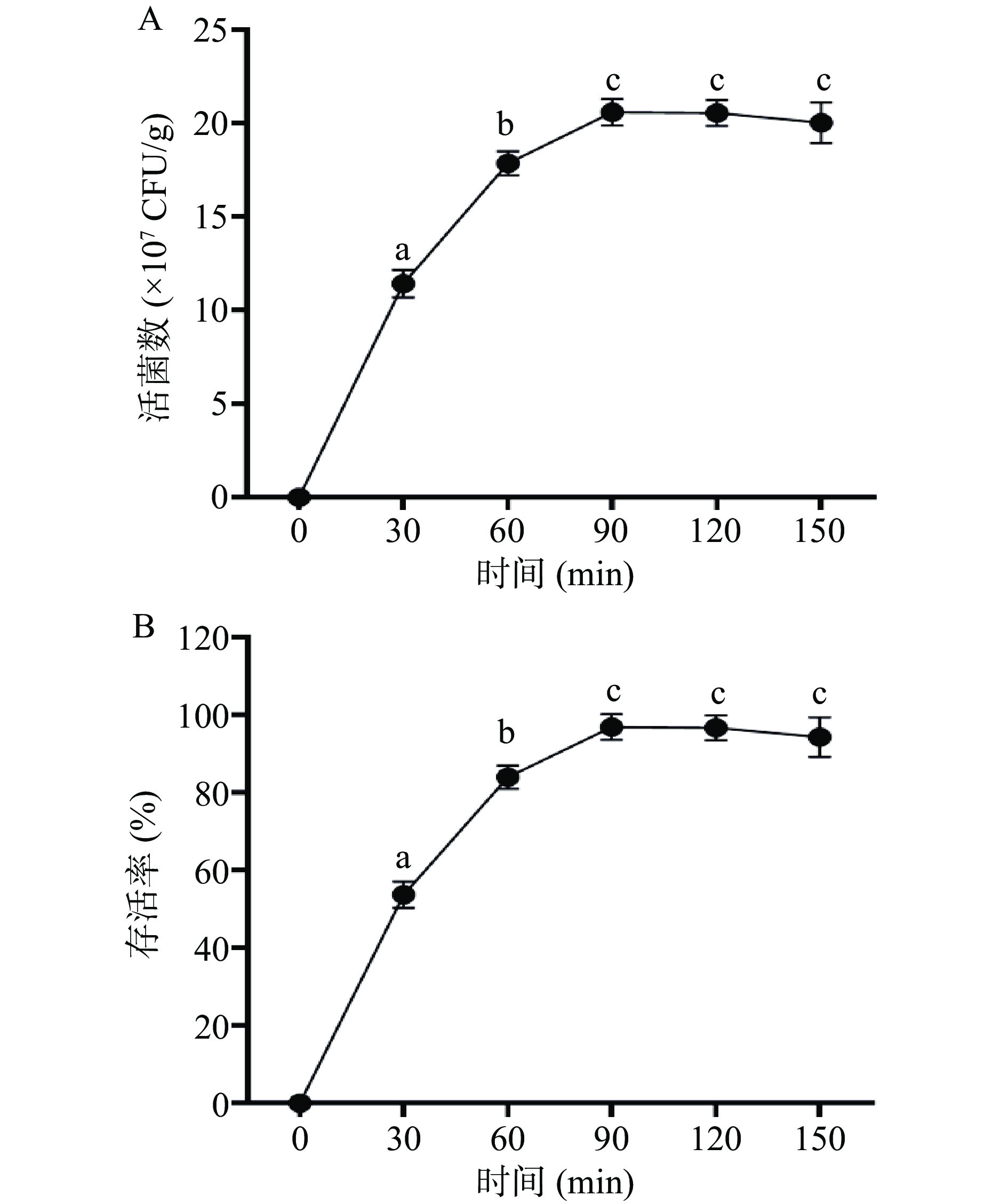
只有保证益生菌能够在胃肠道中大量健康存活,才能使其更好地发挥出自身益生特性。因此,研究了RBF-GA最优工艺下的发酵乳杆菌LTP1332微胶囊(CS-GEL-SA-微胶囊)在人工模拟胃液中的生存力,并与未添加明胶的CS-SA-微胶囊进行对比(如图14所示)。在食品中,每克或每毫升产品中活菌数要大于106~107才被认为是有效的[49],在刚开始进行模拟胃作用时,三组的活菌数都可达4×107 CFU/g以上,组间无显著差异(P>0.05),符合食品要求。在模拟胃液120 min时,两组微胶囊的活菌数都发生了明显下降,对此结果解释是,微胶囊颗粒表面存在一些相对较大的孔径,这有利于有机酸、氧气和消化酶等小分子扩散到微胶囊中,从而使包埋的发酵乳杆菌LTP1332失活[20]。此时CS-GEL-SA-微胶囊与CS-SA-微胶囊的益生菌存活率分别为22.48%±0.78%和14.33%±0.32%,相比之下CS-GEL-SA-微胶囊益生菌存活率更高,说明添加明胶复合后能有效改善微胶囊表面的孔径大小,增强菌体的存活率。CS-GEL-SA-微胶囊相比于未包埋的发酵乳杆菌LTP1332在模拟胃液中的存活率提高了18.71%±1.76%,说明了按照优化工艺制备的CS-GEL-SA-微胶囊,在胃液中可以表现出良好的护菌效果。在初始活菌数为4.377×107±0.388×107 CFU/g情况下,经人工模拟胃液处理后活菌数仍可达0.984×107±0.034×107 CFU/g,这与国内外的研究相比已经到达较高水平[31]。
2.6.2 模拟肠液释放性试验结果
在肠液中由于pH偏碱性,在阴离子的作用下,导致益生菌微胶囊的体积开始膨大,最终导致体系破裂,从而保证益生菌微胶囊可以更好地解囊,释放出益生菌[21]。从图15可知,随着微胶囊在人工模拟肠液中的处理时间延长,按照RBF-GA优化工艺条件下制备的CS-GEL-SA-微胶囊中的发酵乳杆菌LTP1332会连续释放,到90 min时释放率即可达到最高,90 min之后出现下降趋势,但不显著(P>0.05),此时测得菌体存活率为94.324%±2.034%,活菌数在108 CFU/g左右,这说明了该CS-GEL-SA-微胶囊具有较好的肠溶性。食品在肠道中一般3 h左右就能完成消化[50],CS-GEL-SA-微胶囊在人工肠模拟液中处理90 min时,菌体的释放率即可达到最大值,这也为其能更好的在人体中发挥益生作用提供了保障。
3. 结论
本研究采用RBF-GA模型等系列方法确定了发酵乳杆菌LTP1332微胶囊的最优制备工艺为2.210%海藻酸钠,4.451% CaCl2,0.1% 明胶,固化时间13.529 min。RBF-GA模型的RMSE、MAE、R2值分别为0.2586、0.1259、0.9832,经验证,RBF-GA模型的预测性能及包埋率优化结果均好于BBD模型,此时微胶囊平均包埋率为95.08%±0.25%。CS-GEL-SA-微胶囊显著提高了发酵乳杆菌LTP1332在模拟胃肠液中的存活率(P<0.05),在模拟胃液处理120 min后,包埋菌体的存活率仍可达22.48%±0.78%的较高水平,相比于未包埋的发酵乳杆菌LTP1332存活率提高了18.71%±1.76%,说明本研究开发的微胶囊具有较好的护菌效果。在肠液释放性试验中,CS-GEL-SA-微胶囊中在人工模拟肠液处理90 min时,菌体的释放率即可达到最高,具有较好的肠溶性。因此认为,本研究获得的发酵乳杆菌LTP1332 CS-GEL-SA-微胶囊工艺,为其在食品工业中走向实际应用提供了一定的理论基础,此外,RBF-GA模型的应用也为其它益生菌产品的工艺探究优化提供了新的手法。
-
表 1 响应面因素与水平编码设计
Table 1 Factors and levels used in Box-Behnken design
因素 水平 −1 0 1 A固化剂浓度(%) 3.3 3.9 4.5 B固化时间(min) 10 15 20 C海藻酸钠浓度(%) 1.5 2 2.5 表 2 响应面试验设计方案及结果
Table 2 Design scheme and results of response surface test
实验号 A B C Y包埋率(%) 1 0 0 0 97.64 2 1 0 1 95.45 3 −1 −1 0 95.48 4 0 −1 −1 92.67 5 1 0 −1 94.33 6 −1 1 0 95.00 7 0 1 −1 93.01 8 0 0 0 98.36 9 0 0 0 97.13 10 −1 0 −1 91.94 11 0 0 0 98.09 12 0 −1 1 96.94 13 1 1 0 93.72 14 0 1 1 94.67 15 0 0 0 98.38 16 −1 0 1 97.07 17 1 −1 0 94.80 表 3 以包埋率为响应值的回归模型及方差分析
Table 3 Regression model and analysis of variance with embedding rate as response value
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 65.63 9 7.29 24.33 0.0002 ** A 0.18 1 0.18 0.59 0.4673 NS B 1.52 1 1.52 5.08 0.0589 NS C 18.54 1 18.54 61.87 0.0001 ** AB 0.09 1 0.09 0.30 0.6007 NS AC 4.02 1 4.02 13.41 0.0080 ** BC 1.70 1 1.70 5.68 0.0486 * A2 8.22 1 8.22 27.44 0.0012 ** B2 13.23 1 13.23 44.13 0.0003 ** C2 14.02 1 14.02 46.79 0.0002 ** 失拟项 0.96 3 0.32 1.13 0.4377 NS R2 0.9690 R2adj 0.9292 CV 0.57 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),NS表示差异不显著(P>0.05)。 表 4 BBD和RBF-GA模型的预测值
Table 4 Predicted values of BBD and RBF-GA models
实验号 实测值(%) BBD预测值(%) RBF-GA预测值(%) 1 97.64 97.92 97.92 2 95.45 95.07 95.45 3 95.48 95.19 95.48 4 92.67 92.58 92.67 5 94.33 94.03 94.33 6 95.00 94.61 95.00 7 93.01 93.02 93.01 8 98.36 97.92 97.92 9 97.13 97.92 97.92 10 91.94 92.32 91.94 11 98.09 97.92 97.92 12 96.94 96.93 96.94 13 93.72 94.02 93.72 14 94.67 94.76 94.67 15 98.38 97.92 97.92 16 97.07 97.37 97.07 17 94.80 95.20 94.80 表 5 RBF-GA模型与响应面优化模型下的预测值和实际值比较
Table 5 Comparison of optimization results of RBF-GA and BBD for protectants
优化模型 最优条件 预测包埋率(%) 实测平均包埋率(%) 固化剂浓度(%) 固化时间(min) 海藻酸钠浓度(%) RBF-GA 4.451 13.529 2.210 94.919 95.08±0.25 BBD 3.401 19.324 1.696 93.720 94.32±0.42 -
[1] HILL C, GUARNER F, REID G, et al. The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nat Rev Gastroenterol Hepatol,2014,11(8):506−514. doi: 10.1038/nrgastro.2014.66
[2] 张彦位, 路江浩, 鄢梦洁, 等. 益生菌对微生态系统的改善作用及其应用研究进展[J]. 食品工业科技,2021,42(4):369−379. [ZHANG Y W, LU J H, YAN M J, et al. Research on probiotics to improve micro-ecosystem and its application[J]. Science and Technology of Food Industry,2021,42(4):369−379. ZHANG Y W, LU J H, YAN M J, et al. Research on probiotics to improve micro-ecosystem and its application[J]. Science and Technology of Food Industry, 2021, 42(4): 369-379.
[3] DUAR R M, LIN X B, ZHENG J, et al. Lifestyles in transition: Evolution and natural history of the genus Lactobacillus[J]. FEMS Microbiology Reviews,2017,41(1):27−48.
[4] YU Y, XIAO G, XU Y, et al. Changes of quality in the fruits of Prunus mume during deacidification by fermentation with Lactobacillus fermentium[J]. Journal of Food Science,2015,80(2):405−410. doi: 10.1111/1750-3841.12769
[5] 孙媛媛. 异型发酵乳杆菌高密度培养及提高其冻干存活率的方法[D]. 无锡: 江南大学, 2021 SUI Y Y. High-density cultivation of heterofermentive Lactobacillus and methods to improve the freeze-drying survival rate[D]. Wuxi: Jiangnan University, 2021.
[6] MA, YAO C Q, SHEN X, et al. The diversity and composition of the human gut lactic acid bacteria and bifidobacterial microbiota vary depending on age[J]. Applied Microbial and Cell Physiology,2021,105(21-22):8427−8440.
[7] PAN Y, WANG F, SUN D, et al. Intestinal Lactobacillus community structure and its correlation with diet of southern Chinese elderly subjects[J]. Journal of Microbiology,2016,54(9):594−601. doi: 10.1007/s12275-016-6131-7
[8] 蔚晓敏. 长寿老人源植物乳杆菌改善小鼠衰老的益生性评价及其机制探究[D]. 南昌: 南昌大学, 2020 WEI X M. Exploration of probiotic properties and mechanism of Lactobacillus plantarum form longevity elderly to improve senescence in mice[D]. Nanchang: Nanchang University, 2020.
[9] 王芳, 刘爱萍, 任发政, 等. 利用SOS显色反应评价长寿老人源乳酸菌对4-NQO基因毒性的抑制作用[J]. 食品科学,2007(10):425−429. [WANG F, LIU A P, REN F Z, et al. Lactic acid bacteria isolated from elderly people inhibit genotoxic effect of 4-nitroquinoline-1-oxide in SOS-chromotest[J]. Food Science,2007(10):425−429. doi: 10.3321/j.issn:1002-6630.2007.10.104 WANG F, LIU A P, REN F Z, et al. Lactic acid bacteria isolated from elderly people inhibit genotoxic effect of 4-nitroquinoline-1-oxide in SOS-chromotest[J]. Food Science, 2007(10): 425-429. doi: 10.3321/j.issn:1002-6630.2007.10.104
[10] MEI L H, ZHENG W X, ZHAO Z T, et al. A pilot study of the effect of Lactobacillus casei obtained from long-lived elderly on blood biochemical, oxidative, and inflammatory markers, and on gut microbiota in young volunteers[J]. Nutrients,2021,3(11):3891.
[11] ZHU J, ZHAO L, GUO H Y, et al. Immunomodulatory effects of novel bifidobacterium and lactobacillus strains on murine macrophage cells[J]. African Journal of Microbiology Research,2011,5(1):8−15.
[12] 喻婷, 黄国宏, 梁爱红, 等. 巴马长寿老人源乳酸杆菌的筛选及其益生特性[J]. 现代食品科技,2017,33(1):39−47. [YU T, HUANG G H, LIANG A H, et al. Screening of intestinal Lactobacillus from Bama centenarians and their probiotic characteristics[J]. Modern Food Science & Technology,2017,33(1):39−47. YU T, HUANG G H, LIANG A H, et al. Screening of intestinal Lactobacillus from Bama centenarians and their probiotic characteristics[J]. Modern Food Science & Technology, 2017, 33(1): 39-47.
[13] 兰海静, 杨伯宁, 黄联莉, 等. 巴马特色饮食模式对D-半乳糖致衰老小鼠运动能力和抗焦虑水平的影响[J]. 食品科学,2019,40(19):196−203. [LAN H J, YANG B N, HUANG L L, et al. Effect of Bama characteristic dietary patterns on exercise capacity and antianxiety level of D-galactose-induced aging mice[J]. Food Science,2019,40(19):196−203. doi: 10.7506/spkx1002-6630-20180727-338 LAN H J, YANG B N, HUANG L L, et al. Effect of Bama characteristic dietary patterns on exercise capacity and antianxiety level of D-galactose-induced aging mice[J]. Food Science, 2019, 40(19): 196-203. doi: 10.7506/spkx1002-6630-20180727-338
[14] 黄燕婷, 梅丽华, 潘海博, 等. 巴马长寿特征饮食模式对自然衰老小鼠的抗衰老效果[J]. 食品科学,2021,42(5):137−144. [HUANG Y T, MEI L H, PAN H B, et al. Anti-aging effect of Bama longevity characteristic dietary patterns in naturally aging mice[J]. Food Science,2021,42(5):137−144. doi: 10.7506/spkx1002-6630-20200229-328 HUANG Y T, MEI L H, PAN H B, et al. Anti-aging effect of Bama longevity characteristic dietary patterns in naturally aging mice[J]. Food Science, 2021, 42(5): 137-144. doi: 10.7506/spkx1002-6630-20200229-328
[15] YAO M, XIE J, DU H, et al. Progress in microencapsulation of probiotics: A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(2):857−874. doi: 10.1111/1541-4337.12532
[16] MARQUES D S T, SONZA P V, RAMIRES F S V, et al. Viability of microencapsulated Lactobacillus acidophilus by complex coacervation associated with enzymatic crosslinking under application in different fruit juices[J]. Food Research International,2021,141:110190. doi: 10.1016/j.foodres.2021.110190
[17] CHAMPAGNE C P, GARDNER N J, ROY D. Challenges in the addition of probiotic cultures to foods[J]. Critical Reviews in Food Science and Nutrition,2005,45(1):61−84. doi: 10.1080/10408690590900144
[18] ZAM W. Microencapsulation: A prospective to protect probiotics[J]. Current Nutrition & Food Science,2020,16(6):891−899.
[19] YEUNG T W, ARROYO-MAYA L J, MCCLEMENTS D J. Microencapsulation of probiotics in hydrogel particles: Enhancing Lactococcus lactis subsp
. Cremoris LM0230 viability using calcium alginate beads[J]. Food Funct,2016,7(6):1797−1804. [20] QI X X, SIMSEK S, OHM J B, et al. Viability of Lactobacillus rhamnosus GG microencapsulated in alginate/chitosan hydrogel particles during storage and simulated gastrointestinal digestion: Role of chitosan molecular weight[J]. Soft Matter,2020,16(7):1877−1887. doi: 10.1039/C9SM02387A
[21] 周莉, 王晓瑞, 平洋, 等. 保加利亚乳杆菌微胶囊的制备及特性研究[J]. 食品工业科技,2020,41(11):188−193. [ZHOU L, WANG X R, TAN J, et al. Preparation and characterization of microcapsule Lactobacillus bulgaricus[J]. Science and Technology of Food Industry,2020,41(11):188−193. ZHOU L, WANG X R, TAN J, et al. Preparation and characterization of microcapsule Lactobacillus bulgaricus[J]. Science and Technology of Food Industry, 2020, 41(11): 188-193.
[22] TA L P, BUJNA E, ANTAL O, et al. Effects of various polysaccharides (alginate, carrageenan, gums, chitosan) and their combination with prebiotic saccharides (resistant starch, lactosucrose, lactulose) on the encapsulation of probiotic bacteria Lactobacillus casei 01 strain[J]. International Journal of Biological Macromolecules,2021,183:1136−1144. doi: 10.1016/j.ijbiomac.2021.04.170
[23] 张汉辉, 程杏安, 李俊杰, 等. 荔枝多酚微胶囊的制备工艺优化及其特性分析[J]. 食品工业科技,2021,42(23):201−208. [ZHANG H H, CHENG X A, LI J J, et al. Optimization of preparation process of lichi polyphenols microcapsules and its characteristic analysis[J]. Science and Technology of Food Industry,2021,42(23):201−208. ZHANG H H, Cheng X A, Li J J, et al. Optimization of preparation process of lichi polyphenols microcapsules and its characteristic analysis[J]. Science and Technology of Food Industry, 2021, 42(23): 201-208.
[24] PATRIGNANI F, SIROLI L, SERRAZANETTI D I, et al. Microencapsulation of functional strains by high pressure homogenization for a potential use in fermented milk[J]. Food Research International,2017,97:250−257. doi: 10.1016/j.foodres.2017.04.020
[25] KUMAR A, KUMAR D. Development of antioxidant rich fruit supplemented probiotic yogurts using free and microencapsulated Lactobacillus rhamnosus culture[J]. Journal of Food Science and Technology,2016,53(1):667−675. doi: 10.1007/s13197-015-1997-7
[26] LOHRASBI V, ABDI M, ASADI A, et al. The effect of improved formulation of chitosan-alginate microcapsules of Bifidobacteria on serum lipid profiles in mice[J]. Microbial Pathogenesis,2020,149:104585. doi: 10.1016/j.micpath.2020.104585
[27] ZHAO C, ZHU Y, KONG B, et al. Dual-Core prebiotic microcapsule encapsulating probiotics for metabolic syndrome[J]. ACS Applied Materials & Interfaces,2020,12(38):42586−42594.
[28] RODRIGUES B M, OLIVO P M, OSMARI M P, et al. Microencapsulation of probiotic strains by lyophilization is efficient in maintaining the viability of microorganisms and modulation of fecal microbiota in cats[J]. International Journal of Microbiology,2020,2020:1293481.
[29] ZAEIM D, SARABI-JAMAB M, GHORANI B, et al. Microencapsulation of probiotics in multi-polysaccharide microcapsules by electro-hydrodynamic atomization and incorporation into ice-cream formulation[J]. Food Structure,2020,25:100147. doi: 10.1016/j.foostr.2020.100147
[30] BURGAIN J, GAIANI C, LINDER M, et al. Encapsulation of probiotic living cells: From laboratory scale to industrial applications[J]. Journal of Food Engineering,2011,104(4):467−483. doi: 10.1016/j.jfoodeng.2010.12.031
[31] 宋娇娇, 王俊国, 田文静, 等. 微胶囊制备工艺对益生菌活性的影响[J]. 中国乳品工业,2016,44(1):25−30. [SONG J J, WANG J G, TIAN W J, et al. Effects of the microencapsulation technology on the activity of probiotics[J]. China Dairy Industry,2016,44(1):25−30. doi: 10.3969/j.issn.1001-2230.2016.01.007 SONG J J, WANG J G, TIAN W J, et al. Effects of the microencapsulation technology on the activity of probiotics[J]. China Dairy Industry, 2016, 44(1): 25-30. doi: 10.3969/j.issn.1001-2230.2016.01.007
[32] VAMVOUDAKIS K G, LEWIS F L, HUDAS G R. Multi-agent differential graphical games: Online adaptive learning solution for synchronization with optimality[J]. Automatica,2012,48(8):1598−1611. doi: 10.1016/j.automatica.2012.05.074
[33] LU C, HE B, ZHANG R. Evaluation of English interpretation teaching quality based on GA optimized RBF neural network[J]. Journal of Intelligent & Fuzzy Systems,2021,40(2):3185−3192.
[34] XIE X, DU X, WANG B. Structural strength analysis of loess based on genetic algorithm and the prediction and optimization of coal mine gas emission[J]. Arabian Journal of Geosciences,2021,14(15):1539. doi: 10.1007/s12517-021-07923-5
[35] CHANG L, WANG P, SUN S, et al. A synbiotic marine oligosaccharide microcapsules for enhancing Bifidobacterium longum survivability and regulatory on intestinal probiotics[J]. International Journal of Food Science & Technology,2021,56(1):362−373.
[36] 刘耀东, 贾荣玲, 王国强. 益生菌微胶囊化对仔猪生长性能及免疫功能的影响[J]. 中国饲料,2021(3):55−59. [LIU Y D, JIA R L, WANG G Q. Effect of microencapsulation of probiotics on growth performance and immune function of piglets[J]. China Feed,2021(3):55−59. LIU Y D, JIA R L, WANG G Q. Effect of microencapsulation of probiotics on growth performance and immune function of piglets[J]. China Feed, 2021(3): 55-59.
[37] 潘海博, 覃璐琪, 黄燕婷, 等. 人工神经网络结合遗传算法优化保护剂提高罗伊氏乳杆菌抗冻性能[J]. 食品科学, 2021, 42(14): 70-77 PAN H B, QIN L Q, HUANG Y T, et al. Artifificial neural network-genetic algorithm-based optimization of the formulation of lyoprotectants to improve the freezing resistance of Lactobacillus reuteri[J]. Food Science, 2021, 42(14): 70-77.
[38] 潘海博, 覃璐琪, 梅丽华, 等. 罗伊氏乳杆菌LTR1318的培养工艺优化[J]. 现代食品科技,2020,36(10):59−67. [PAN H B, QIN L Q, MEI L H, et al. Optimization of culture process for Lactobacillus reuteri LTR1318[J]. Modern Food Science & Technology,2020,36(10):59−67. PAN H B, QIN L Q, MEI L H et al. Optimization of culture process for Lactobacillus reuteri LTR1318[J]. Modern Food Science & Technology, 2020, 36(10): 59-67.
[39] 温建东, 魏韶锋. 基于2种模型方法的板蓝根减压辅助提取工艺优化[J]. 中药材,2019,42(4):862−866. [WEN J D, WEI S F. Optimization of decompression-assisted extraction process of panax notoginseng based on 2 model methods[J]. Journal of Chinese Medicinal Materials,2019,42(4):862−866. WEN J D, WEI S F. Optimization of decompression-assisted extraction process of panax notoginseng based on 2 model methods[J]. Journal of Chinese Medicinal Materials, 2019, 42(4): 862-866.
[40] 石月. 复合乳杆菌微胶囊的研制及质量评价[D]. 哈尔滨: 黑龙江大学, 2015 SHI Y. Development and quality evaluation of Lactobacillus complex microcapsules[D]. Harbin: Heilongjiang University, 2015.
[41] 张良, 刘媛洁, 肖勇生, 等. 响应面法优化柑橘复合生物保鲜剂配方[J]. 食品工业科技,2016,37(16):340−345. [ZHANG L, LIU Y S, XIAO Y S, et al. Optimization of complex biopreservatives to improve quality preservation of citrus reticulata by response surface methodology[J]. Science and Technology of Food Industry,2016,37(16):340−345. ZHANG L, LIU Y S, XIAO Y S et al. Optimization of complex biopreservatives to improve quality preservation of citrus reticulata by response surface methodology[J]. Science and Technology of Food Industry, 2016, 37(16): 340-345.
[42] MIA M, DHAR N R. Prediction and optimization by using SVR, RSM and GA in hard turning of tempered AISI 1060 steel under effective cooling condition[J]. Neural Computing and Applications,2019,31(7):2349−2370. doi: 10.1007/s00521-017-3192-4
[43] JHA A K, SIT N. Comparison of response surface methodology (RSM) and artificial neural network (ANN) modelling for supercritical fluid extraction of phytochemicals from Terminalia chebula pulp and optimization using RSM coupled with desirability function (DF) and genetic algorithm (GA) and ANN with GA[J]. Industrial Crops and Products,2021,170:113769. doi: 10.1016/j.indcrop.2021.113769
[44] PRADHAN D, ABDULLAH S, PRADHAN R C. Chironji (buchanania lanzan) fruit juice extraction using cellulase enzyme: Modelling and optimization of process by artificial neural network and response surface methodology[J]. Journal of Food Science and Technology,2021,58(3):1051−1060. doi: 10.1007/s13197-020-04619-8
[45] MONDAL P, SADHUKHAN A K, GANGULY A, et al. Optimization of process parameters for bio-enzymatic and enzymatic saccharification of waste broken rice for ethanol production using response surface methodology and artificial neural network-genetic algorithm[J]. 3 Biotech,2021,11(1):28. doi: 10.1007/s13205-020-02553-2
[46] 田文静, 朱莹丹, 岳林芳, 等. 益生菌微胶囊化研究现状[J]. 中国食品学报,2016,16(8):186−194. [TIAN W J, ZHU Y D, YUE L F, et al. Research status on microcapsulation technology of probiotics[J]. Jounrnal of Chinese Institute of Food Science and Technology,2016,16(8):186−194. TIAN W J, ZHU Y D, YUE L F, et al. Research status on microcapsulation technology of probiotics[J]. Jounrnal of Chinese Institute of Food Science and Technology, 2016, 16(8): 186-194.
[47] RAMOS P E, SILVA P, ALARIO M M, et al. Effect of alginate molecular weight and M/G ratio in beads properties foreseeing the protection of probiotics[J]. Food Hydrocolloids,2018,77:8−16. doi: 10.1016/j.foodhyd.2017.08.031
[48] ANWAR S H, KUNZ B. The influence of drying methods on the stabilization of fish oil microcapsules: Comparison of spray granulation, spray drying, and freeze drying[J]. Journal of Food Engineering,2011,105(2):367−378. doi: 10.1016/j.jfoodeng.2011.02.047
[49] SHAH N P. Symposium: Probiotic bacteria: Selective enumeration and survival in dairy foods[J]. Journal of Dairy Science,2000,83(4):894−907. doi: 10.3168/jds.S0022-0302(00)74953-8
[50] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food & Function,2014,5(6):1113−1124.
-
期刊类型引用(0)
其他类型引用(2)






 下载:
下载:


 下载:
下载:



