Optimization of Oil Separation from Spanish Mackerel Viscera by Ultrasonic Field Coupled with Subcritical Water
-
摘要: 为研究鱼内脏高值化利用提供绿色环保、高效可行的新方法,本文对超声耦合亚临界水技术分离黄鲛鱼内脏油脂的效果和机理进行了研究,并与酶法、超声辅助溶剂法、超临界二氧化碳法的萃取效果进行了比较。利用气相色谱-质谱法(GC-MS)分析超声耦合亚临界水萃取鱼油的脂肪酸组成。通过测定黄鲛鱼内脏基质蛋白的水热液化反应的转化率揭示亚临界水高效分离鱼内脏油脂的化学机制。对鱼内脏冻干细颗粒物做扫描电镜,观察超声场物理效应联合亚临界水水热液化效应对鱼内脏基质蛋白网状结构的破坏性。试验结果显示:超声耦合亚临界水萃取鱼油的最佳工艺条件与黄鲛鱼内脏基质蛋白质发生水热液化反应的最佳条件一致,即在250 W/L,20 kHz的超声场耦合260 ℃、10 MPa的亚临界水媒介中萃取/反应60 min时,鱼油萃取率最高是59.87%±2.86%,反应转化率最高是92.37%±3.12%。与其他三种萃取方法相比,超声耦合亚临界水法的鱼油萃取率最高,不仅如此,鱼油中的二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的含量也最高,分别是(46.01±0.31)mg/g和(116.78±0.91)mg/g。超临界二氧化碳法萃取鱼油的酸价、过氧化值和羰基价最小,分别是(7.15±0.33)mg KOH/g、(1.83±0.13)mmol/kg和(2.01±0.21)mEq/kg。超声耦合亚临界水技术能够高效破坏鱼内脏基质蛋白的网状结构,充分释放网孔中包裹的鱼油,具有绿色环保、萃取时间短、鱼油萃取率高和鱼油中EPA、DHA含量高的优势。超临界二氧化碳萃取的鱼油氧化稳定性最佳,但萃取时间较长,萃取率较低。本研究阐明了超声耦合亚临界水萃取黄鲛鱼内脏油脂的作用机制,为精准利用该技术提供了试验和理论依据。Abstract: To explore an effective solution for high-value utilization of fish viscera, ultrasound coupled with subcritical water extraction (USCWE) was used to separate fish oil from Spanish mackerel viscera. The results were compared with those from enzymatic extraction (EE), ultrasonic-assisted organic solvent extraction (UOSE), and supercritical carbon dioxide extraction (SCE). Gas chromatography-mass spectrometry (GC-MS) was applied to analyze the fatty acid composition of the fish oil. The conversion rate of hydrothermal liquefaction (CRHL) of Spanish mackerel visceral stroma protein (SMVSP) was determined to explore the chemical mechanism of USCWE. Scanning electron microscope (SEM) was applied to observe the destructive action of ultrasonic physical effect coupled with subcritical water hydrothermal liquefaction on the network structure composed of stroma protein. The optimal conditions for USCWE of fish oil were consistent with that for the CRHL of SMVSP. The maximum extraction yield (EY, 59.87%±2.86%) of fish oil and CRHL of SMVSP (92.37%±3.12%) were obtained at 260 ℃ and 10 MPa with ultrasound enhancement (250 W/L, 20 kHz) for 60 min. Compared with the other three extraction methods, the EY of fish oil by USCWE was the highest. Moreover, the contents of eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) in fish oil were also the highest, which were (46.01±0.31) mg/g and (116.78±0.91) mg/g, respectively. The fish oil obtained by SCE showed the lowest acid value (AV, (7.15±0.33) mg KOH/g), peroxide value (POV, (1.83±0.13) mmol/kg), and carbonyl group value (CGV, (2.01±0.21) mEq/kg). USCWE could effectively destruct the network structure composed of stroma protein and fully released the fish oil wrapped in the mesh which had the advantages of environmental protection, short extraction time, high extraction yield and high content of EPA or DHA. The oxidation stability of fish oil by SCE was the highest, but the extraction time of SCE was longer and the EY was lower. This study elucidated the mechanism of USCWE of fish oil from Spanish mackerel viscera and provided experimental and theoretical basis for the precise use of this technology.
-
水产加工中会产生大量鱼内脏废弃物,存在生物资源浪费及环境污染问题。鱼内脏中富含二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等Ω-3系多不饱和脂肪酸,这些脂肪酸已被证实具有稳定血糖、血脂、血压[1-2],抗肿瘤[3],促进新生儿神经发育[4]等多种重要的生理活性,具有显著的营养价值。尽管微藻油因富含Ω-3系长链多不饱和脂肪酸,已被作为获得EPA和DHA的重要来源,但鱼油与之相比,仍具有各Ω-3系多不饱和脂肪酸种类及含量比更佳,生物效价更高的独特优势[5-7]。
目前,已报道的鱼油萃取方法主要有:稀碱水解法、酶解法、蒸煮法、溶剂萃取法和超临界CO2萃取法[8-9],这些方法都存在一些不足。其中,碱水解和溶剂萃取法因碱性化学品和有机溶剂的使用,存在着环境污染和化学品残留的问题;鱼内脏基质蛋白质是维持内脏特殊组织形态、发挥特定生物功能的主要物质载体,它通过形成致密的壁层包裹着油脂,是阻碍鱼油萃取效率的主要限制因素。利用蛋白酶水解肽键的化学特性,能够在一定程度上有效破坏基质蛋白质的网状结构,促进鱼油的释放与分离[10-12]。但蛋白酶作为一种生物催化剂,在水解过程中很难维持所需的活性和稳定性,水解效率有待提升[13-15],且不同批次的酶制剂在反应条件和酶活力上均存在差异,难以保障鱼油的稳定性;蒸煮法的热能消耗较大,且鱼油在高温下容易发生氧化酸败;超临界CO2萃取法仅适用于萃取原料外层组织的鱼油,难以彻底分离位于组织内部中心区域的鱼油,存在萃取率较低及溶剂成本较高的问题[16]。针对上述几种萃取方法的不足,探索一种环境友好、萃取效率高、低能耗和低成本的新型萃取技术势在必行。
200 ℃至374 ℃的亚临界水具有低粘度,对疏水化合物的高溶解性,活跃的反应性和催化性,这些特性被统称为亚临界水的水热液化效应[17-19]。利用亚临界水水热液化效应对生物质资源进行转化利用的研究报道主要集中在能源物质—“生物燃料”的精炼与制备方面[20-21],即利用亚临界水(250~374 ℃,4~22 MPa)的水热液化效应将废弃的生物质资源转化生成液态油状物质。尚未见利用其分离萃取生物活性物质的相关报道。包括蛋白质、脂肪在内的主要生物活性大分子在亚临界水中发生水热液化反应的反应条件、反应过程、反应产物有所不同。脂肪在330 ℃至340 ℃的亚临界水中迅速水解,生成甘油和游离脂肪酸,这些产物在374 ℃临界温度以下的亚临界水中性质稳定,不会发生裂解反应[22-25],这表明330 ℃以下的亚临界水能被用于分离萃取油脂。与油脂相比,蛋白质开始发生水热液化反应的温度更低,且反应底物和反应温度对反应产物有显著影响[25-29]。Rogalinski等[26,30]研究报道了牛血清白蛋白在温度高于230 ℃的亚临界水中水解产生肽和氨基酸,当温度高于250 ℃时,氨基酸裂解生成小分子碳氢化合物、胺、醛和酸等。这表明:要利用鱼内脏基质蛋白质在亚临界水中发生的水热液化反应高效分离萃取鱼油,关键问题是精准控制反应温度和时间,在快速彻底水解基质蛋白质的前提下降低反应温度,阻止氨基酸的裂解反应,以保证鱼油萃取物的质量和安全性。
超声耦合技术用于天然产物分离萃取已被广泛报道[31-34]。本文拟将超声耦合技术应用于亚临界水萃取系统,利用超声场物理效应耦合亚临界水水热液化效应,探究该技术对鱼内脏基质蛋白质的破坏效应及其对提升鱼油萃取效率的影响,并将该技术对鱼油的萃取效果与酶法、超声辅助溶剂法和超临界CO2法做对比,以期为超声耦合亚临界水萃取技术进行生物质资源高值化利用提供试验依据和新思路。
1. 材料与方法
1.1 材料与仪器
黄鲛鱼内脏 烟台海和食品有限公司提供,切成约(1.0×1.0)cm颗粒,冻干备用;EPA甲酯、DHA甲酯标准品、异辛烷(色谱纯)、甲醇(色谱纯) 德国Meker公司;硫酸钠、硫酸氢钠 北京通光精细化工公司;正己烷 南京化学试剂有限公司;氢氧化钾 天津凯美尔化学试剂有限公司;中性蛋白酶 50 U/mg,上海麦克林生化科技有限公司;所有分离用有机溶剂及药品均为国产分析纯。
HL-SF超声耦合亚临界水设备、HL-5L/50MPa-ⅡB型超临界CO2萃取设备 杭州华黎泵业有限公司;LGJ-18S冷冻干燥机 北京松源冻干;Avanti J-E落地冷冻高速离心机 美国Beckman Coulter公司;JY92-IIDN超声破碎仪 宁波新芝;SY-2000旋转蒸发仪 上海亚荣;气相色谱-质谱联用仪 配有LabSolutions色谱数据处理系统,日本Shimadzu公司;SU8010高分辨场发射扫描电镜 日本Hitachi公司。
1.2 实验方法
1.2.1 超声耦合亚临界水萃取黄鲛鱼内脏油脂工艺
准确量取100 g(m1)冻干的黄鲛鱼内脏颗粒放入容积为5 L的萃取釜中,萃取釜的进水口和出水口配有孔径为5 μm的过滤网。将蒸馏水泵入预热釜内加热至设定温度,当预热釜升温至100 ℃时,调节排气阀,将蒸馏水中的溶解氧排出。将预热釜内达到设定温度的蒸馏水泵入萃取釜中。当萃取釜内的温度、压强达到设定值时,开启超声发生装置,并调节超声输出功率250 W/L,频率20 kHz[33-34]。萃取结束后,萃取液在冷却釜内被冷却和收集。用高速冷冻离心机在转速20000 r/min,温度10 ℃条件下,离心分离30 min获得上层油相,用无水硫酸钠吸附油相中残留的水分,获得纯鱼油,精确称量其质量m2,鱼油萃取率采用质量分数表示,计算公式如下:
ω(%)=m2m1×100 (1) 式中:ω表示鱼油萃取率,%;m2表示萃取鱼油的质量,g;m1表示鱼内脏取样量,g。
1.2.2 鱼内脏基质蛋白质水热液化反应试验
鱼内脏基质蛋白质在亚临界水媒介发生水热液化反应导致肽键水解,使鱼内脏颗粒完整致密的网状结构被破坏,是鱼油得以释放,进而被亚临界水溶剂高效萃取分离的主要化学机制。因此,该部分试验提出了鱼内脏基质蛋白质水热液化反应转化率的涵义和测定方法,并探究了鱼内脏基质蛋白质水热液化反应转化率随反应温度和反应时间的变化规律,以期为阐明利用亚临界水水热液化效应高效萃取分离生物活性组分提供试验依据。
1.2.2.1 鱼内脏基质蛋白质水热液化反应转化率的测定
准确量取100 g黄鲛鱼内脏冻干颗粒,放入超声强化亚临界水萃取设备的反应釜中。当反应釜温度达到设定值时,开启超声波发生装置,调节输出功率是250 W/L,振动频率是20 kHz。黄鲛鱼内脏颗粒中总蛋白质质量(M1)的测定采用凯氏定氮法[35]。反应结束后,冷却、收集未反应的鱼内脏颗粒物残渣,用于测定未参加反应的总蛋白质量(M2)。黄鲛鱼内脏基质蛋白质的水热液化反应的转化率(R)计算公式如下:
R(%)=M1−M2M1×100 (2) 式中:R表示黄鲛鱼内脏基质蛋白质水热液化反应的转化率,%;M1表示反应前黄鲛鱼内脏颗粒中总蛋白的质量,g;M2表示反应结束后黄鲛鱼内脏颗粒残渣中总蛋白的质量,g。
1.2.2.2 温度对鱼内脏基质蛋白质水热液化反应转化率的影响
设定超声输出功率是250 W/L,超声振动频率是20 kHz,调节压力阀,保持亚临界水的压强是10 MPa,反应时间保持60 min,分别考察反应温度是200、210、220、230、240、250 ℃和260 ℃时,鱼内脏基质蛋白质发生水热液化反应的转化率,探究反应温度对水热液化反应转化率的影响规律。
1.2.2.3 反应时间对鱼内脏基质蛋白质水热液化反应转化率的影响
设定超声输出功率是250 W/L,超声振动频率是20 kHz,调节压力阀,保持亚临界水的压强是10 MPa,水热液化反应温度是260 ℃,分别考察反应时间是10、20、30、40、50 min和60 min时的鱼内脏基质蛋白质发生水热液化反应的转化率,探究反应时间对水热液化反应转化率的影响规律。
1.2.3 油脂萃取工艺的单因素实验
能显著影响超声耦合亚临界水萃取生物质原料中油性组分的关键因素主要是萃取温度和萃取时间[36-37]。为了探明并获得该法萃取鱼油的最佳萃取条件,本研究在保持超声场输出功率、超声场振动频率和亚临界水萃取压强不变的前提下,分别进行了亚临界水萃取温度和萃取时间对鱼油萃取率影响的单因素实验,实验方法如下。
1.2.3.1 温度对鱼油萃取率的影响
设定超声输出功率是250 W/L,超声振动频率是20 kHz,调节压力阀,保持亚临界水的压强是10 MPa,萃取时间保持60 min,分别考察亚临界水的萃取温度是200、210、220、230、240、250 ℃和260 ℃时的鱼油萃取率,探究萃取温度对鱼油萃取率的影响。
1.2.3.2 提取时间对鱼油萃取率的影响
设定超声输出功率是250 W/L,超声振动频率是20 kHz,调节压力阀,保持亚临界水的压强是10 MPa,亚临界水的萃取温度是260 ℃,分别考察亚临界水的萃取时间是10、20、30、40、50 min和60 min时的鱼油萃取率,探究萃取时间对鱼油萃取率的影响规律。
1.2.4 鱼油脂肪酸测定
利用GC-MS色谱分析法分析鱼油萃取物中的脂肪酸组成。GC条件是:DB-WAX型毛细管柱(30 m×0.25 mm×0.25 μm),进样器温度是240 ℃,检测器温度是240 ℃。升温程序:100 ℃保持13 min;以8 ℃/min升至180 ℃,保持6 min;以1 ℃/min升至200 ℃,保持20 min;以4 ℃/min升至230 ℃,保持10.5 min。载气氦气(He)流速0.9 mL/min,进样量是1 μL,分流比是10:1。MS条件是:电子轰击离子源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;激活电压1.5 V;质量扫描范围m/z 33~500。
准确量取EPA、DHA甲酯化标准品,溶解在异辛烷溶剂中,分别配制成0.025、0.050 、0.100、0.200 mg/mL和0.400 mg/mL的标准品溶液,根据峰面积与标准品浓度呈线性回归关系,获得EPA、DHA甲酯化标准品的标准曲线,标准曲线的公式见式(3)和式(4),分别用于计算不同萃取方法获得鱼油中EPA、DHA的含量。
CEPA=2×10−7×AEPA+6.02 (3) CDHA=2×10−7×ADHA+2.74 (4) 式中:CEPA、CDHA分别表示鱼油中EPA和DHA的质量浓度,mg/g;AEPA、ADHA表示样品中EPA和DHA对应色谱峰的峰面积。
1.2.5 不同提取方法对黄鲛鱼内脏油脂萃取效果的比较
1.2.5.1 酶法萃取实验
参考廖启元等[9]的实验,在预实验基础上进行优化,最终确定的最佳萃取条件是:准确量取200 g黄鲛鱼内脏冻干颗粒,8 g中性蛋白酶,600 mL蒸馏水放入容积1000 mL的锥形瓶中,充分混匀。将锥形瓶固定在40 ℃的恒温水浴中反应3 h。反应结束时,采用冰浴法终止反应。上层油相的分离、脱水方法及鱼油萃取率的计算方法与1.2.1中油相的分离与计算方法相同。
1.2.5.2 超临界CO2法萃取实验
参考Kuvendziev等[38]的实验,并在预实验基础上进行了优化,萃取条件是:准确量取1000 g黄鲛鱼内脏冻干颗粒置于容积5 L的萃取釜内,萃取压强30 MPa,萃取温度60 ℃,萃取时间4 h,CO2流量300 mL/min。鱼油萃取率的计算方法与1.2.1中的计算方法相同。
1.2.5.3 超声耦合有机溶剂萃取实验
预实验利用响应曲面优化设计方法确定的最佳萃取条件是:超声波输出功率800 W,频率20 kHz,萃取溶剂是正己烷,固液比1:10(w/w),萃取温度40 ℃,萃取时间2 h。萃取结束后,利用旋转蒸发器仪回收正己烷溶剂,获得纯鱼油。鱼油萃取率的计算方法与1.2.1中的计算方法相同。
1.2.5.4 测定指标
鱼油酸价(acid value,AV)、过氧化值(peroxide value,POV)和羰基价(carbonyl group value,CGV)的测定:不同萃取方法获得鱼油的AV、POV和CGV的测定方法分别采用国标GB 5009.229-2016、GB 5009.227-2016和GB 5009.230-2016,以评估不同萃取方法对鱼油氧化稳定性的影响。
1.2.6 内脏颗粒物生理结构分析
用打粉机将冻干备用的黄鲛鱼内脏大颗粒制成细粉状的样品,将样品用导电碳胶带固定后进行表面喷金,放入扫描电镜中观察微观结构,分析超声场物理效应耦合亚临界水水热液化效应及中性蛋白酶催化水解作用对黄鲛鱼内脏基质蛋白质网状结构的破坏性。
1.3 数据处理
利用IBM SPSS Statistics 21软件,采用单因素方差分析法,选择95%的置信度(P<0.05)对实验数据进行统计学分析。
2. 结果与分析
2.1 黄鲛鱼内脏基质蛋白质水热液化反应的转化率
基质蛋白质的水热液化反应过程依次经历蛋白质聚合,聚合蛋白质解聚,蛋白质水解产生水溶性肽和氨基酸的过程[39]。这表明,只要反应时间足够长,发生水热液化反应的基质蛋白质最终都会水解生成可溶性的寡肽和氨基酸,使鱼内脏基质蛋白质原有的网状结构被破坏,达到释放、分离鱼油的目的。因此,可以通过测定水热液化反应前后鱼内脏颗粒物中总蛋白的质量,依据总蛋白质量的减少量对黄鲛鱼内脏基质蛋白质发生水热液化反应的转化率进行表征。
2.1.1 温度对鱼内脏基质蛋白质水热液化反应转化率的影响
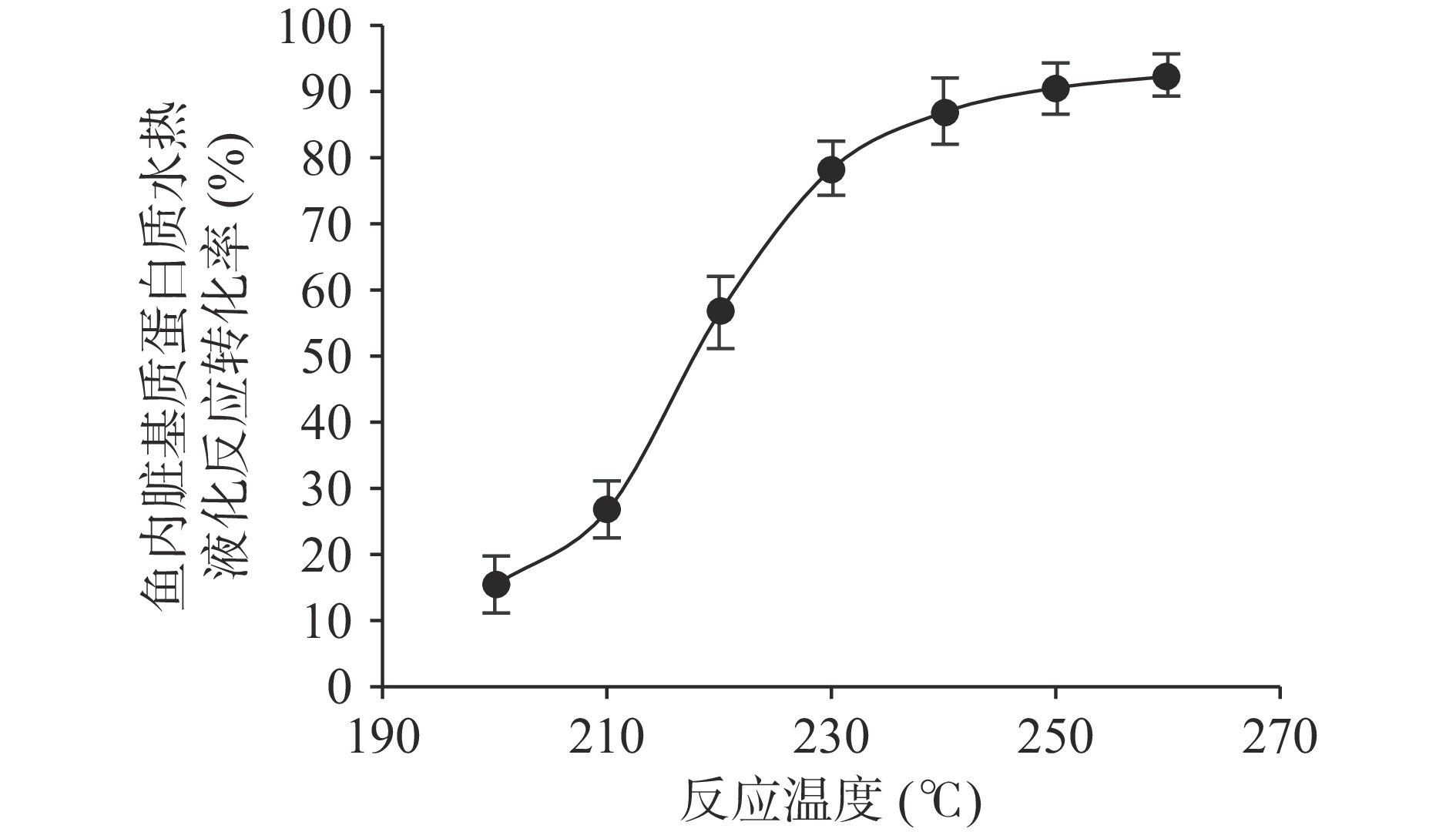
Karna等[40]报道了大豆蛋白在亚临界水中发生水热液化反应的现象和规律,并指出:反应温度和反应时间是影响反应过程和反应产物的两个主要因素。在150 ℃时,大豆蛋白主要发生热变性反应而生成分子量较大的热聚物,这些热聚物分子内部有少量肽键发生了水解。当温度升至190 ℃时,大豆蛋白热聚物发生解聚反应,分子内的肽键迅速水解生成寡肽,且寡肽的产率达到最大值。当温度超过210 ℃时,寡肽发生裂解反应,导致寡肽的得率下降。本试验在研究反应温度对鱼内脏基质蛋白质水热液化反应转化率的影响规律时也获得了相似的变化趋势。如图1所示,当温度低于210 ℃时,反应转化率较低,小于26.88%±4.30%,当温度超过210 ℃时,反应转化率开始迅速增加,温度从210 ℃升至230 ℃时,反应转化率从26.88%±4.30%迅速增至78.34%±4.00%,涨幅达到51.46%,这表明:当反应温度低于210 ℃时,基质蛋白质主要发生热变性和热聚合反应,仅有少量的肽键水解,210 ℃是鱼内脏基质蛋白质开始发生水解反应的起始温度,在210 ℃至230 ℃的温度区间内,肽键水解反应的转化率随温度升高而明显增加。当亚临界水温度超过230 ℃时,反应转化率增速明显放缓,当温度从240 ℃升至260 ℃,反应转化率从86.92%±5.02%增至92.37%±3.12%,仅增加了6.27%,表明继续升温对提升水热液化反应转化率的作用不显著,且会增加小分子肽、氨基酸等产物进一步裂解生成醛类、酮类等降低鱼油品质的物质的风险[27,40]。当亚临界水温度达到260 ℃时,鱼内脏基质蛋白质发生水热液化反应的转化率最大是92.37%±3.12%。
2.1.2 反应时间对鱼内脏基质蛋白质水热液化反应转化率的影响
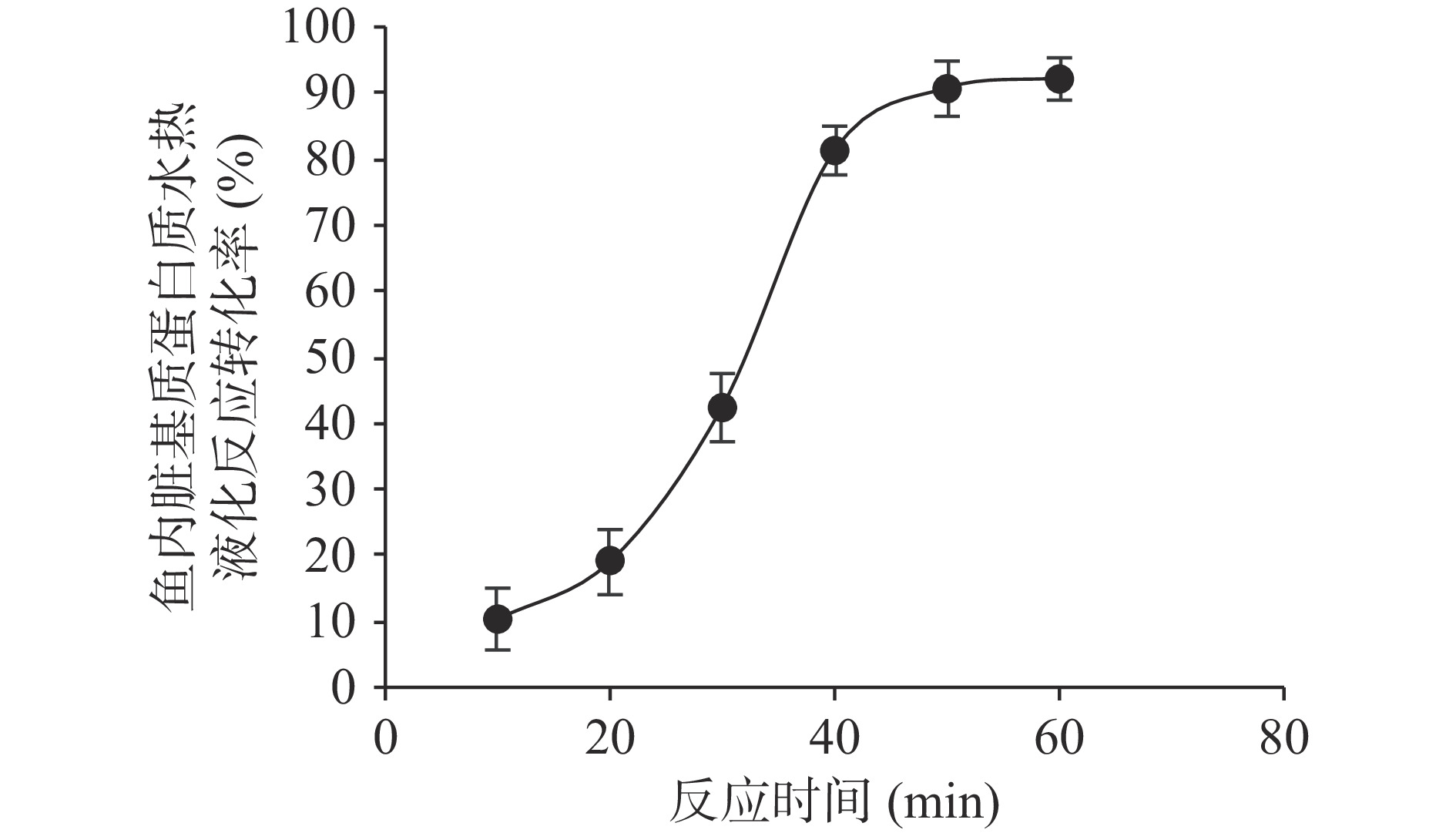
如图2所示:鱼内脏基质蛋白质发生水热液化反应的转化率在反应过程最初的20 min内较低,仅为18.98%±4.88%,根据Sunphorka等[39]提出的米糠蛋白的水热液化反应基本模型推测,鱼内脏基质蛋白质在反应起始阶段主要发生的是热聚合反应,生成结构致密的大分子聚合物,仅少部分可溶性小分子蛋白质水解,导致水热液化反应的转化率较低。随着反应时间的延长,起始阶段产生的大分子聚合物内的肽键开始水解生成可溶性的肽和氨基酸,水热液化反应转化率迅速增加,从20 min到40 min的反应过程,鱼内脏基质蛋白质发生水热液化反应的转化率从18.98%±4.88%迅速增加至81.22%±3.65%,该时间段内,转化率增长了62.24%,鱼内脏基质蛋白质形成的网状结构急剧瓦解,包裹在网眼内的鱼油得以充分释放。40 min后继续延长反应时间,水热液化反应的转化率增速明显下降,当反应时间为60 min时,转化率趋于稳定不再增加,且达到最大值是92.13%±3.28%。
2.2 超声耦合亚临界水萃取黄鲛鱼内脏油脂
2.2.1 温度对鱼油萃取率的影响
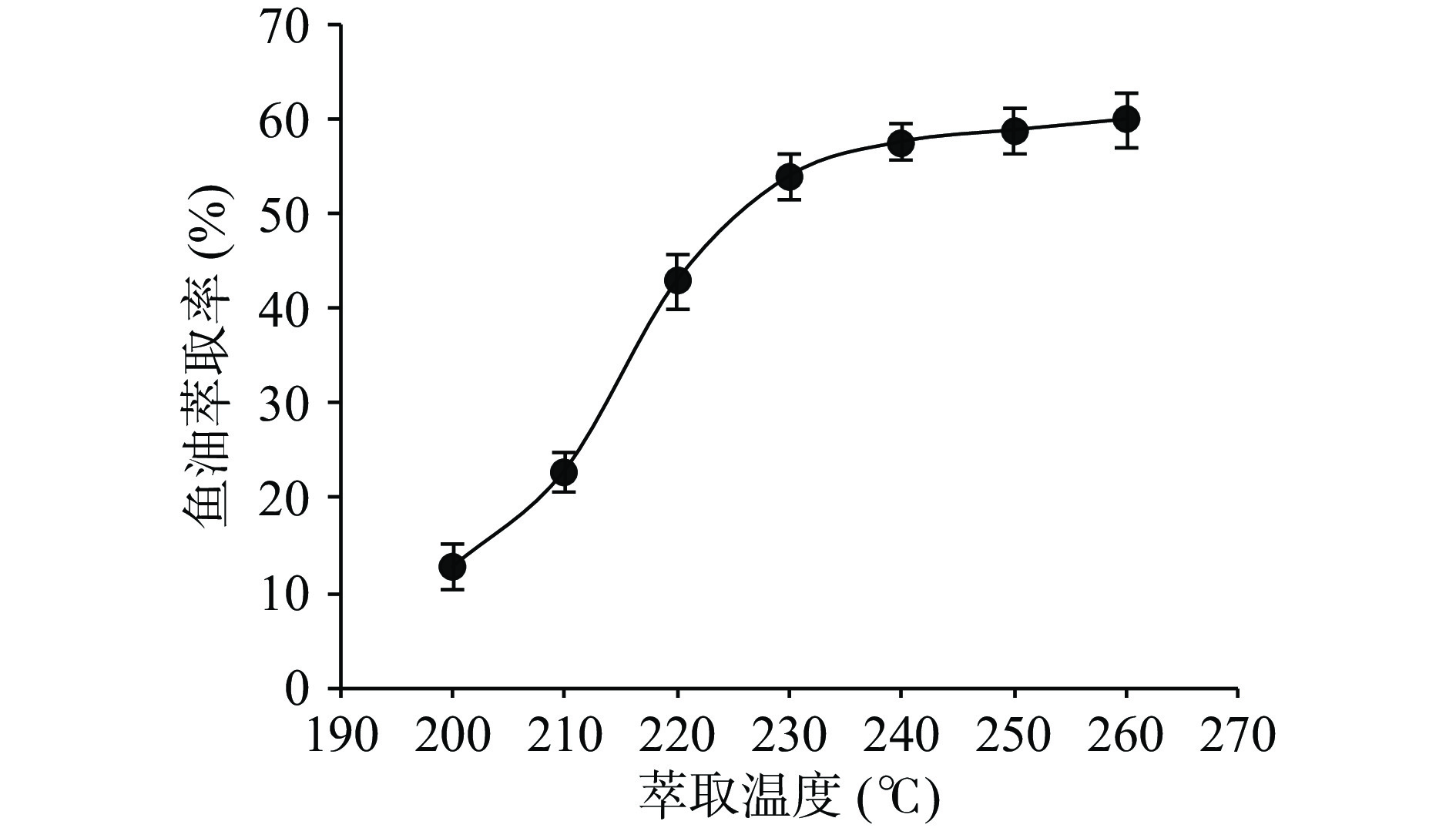
如图3所示,在200 ℃至230 ℃的温度区间内,鱼油萃取率随温度升高明显增加,温度超过230 ℃后,鱼油萃取率增加缓慢,趋于饱和。根据Noor等[37]的报道,水的介电常数、粘度、密度和表面张力随温度升高而显著降低,扩散性增加,亚临界水对生物原料基质的渗透性增加,使萃取体系的传质速率增加,因而目标物的萃取率在一定温度范围内随温度上升而显著增加。此外,超声空化强度[34]和亚临界水水热液化效应也会随亚临界水温度的升高而增加(见图1),意味着功率超声波和高温亚临界水对形成鱼内脏网状结构的基质蛋白质的联合破坏力增强,能明显减弱基质蛋白质对鱼油的包裹力和束缚力,提升鱼油的萃取率。亚临界水温度从210 ℃升至230 ℃时,鱼油萃取率从22.86%±2.1%增加至53.90%±2.55%,鱼内脏基质蛋白质的水热液化反应转化率从26.88%±4.30%增加至78.34%±4.00%,表明在210~230 ℃温度区间内,鱼油萃取率的增长趋势与基质蛋白质水热液化反应转化率的增长趋势一致,亚临界水的水热液化效应可能是该温度区间提高鱼油萃取率的主导因素,对鱼油萃取的强化作用甚至超过超声场的物理效应。亚临界水温度低于210 ℃时,基质蛋白质的水热液化反应转化率不足30%(见图1),表明在210 ℃以下的温度区间,超声场物理效应可能是强化鱼油萃取过程的主导因素。温度超过230 ℃时,鱼油萃取率的增速明显放缓,趋于饱和,当温度升至260 ℃时,萃取率达到最大值是59.87%±2.86%。
2.2.2 萃取时间对鱼油萃取率的影响
如图4所示,鱼油萃取率从整体上呈现出随萃取时间延长而增加的趋势。根据Noor等[37]的报道,萃取时间的长短决定了萃取体系中溶剂和目标萃取物的作用时间,当目标萃取物在萃取体系内达到溶解平衡状态时对应的最短萃取时间即为最佳萃取时间。在本研究中,从曲线的斜率变化可以判断:在萃取过程的前20 min鱼油萃取率的增速相对20 min至40 min的增速较慢,这可能与鱼内脏基质蛋白质在萃取过程开始阶段发生的热变性和热聚集反应有关[39],该反应导致基质蛋白质形成更致密的热聚物对鱼油产生的包裹阻力增加,使亚临界水媒介仅能在超声场物理作用下进行有限程度的渗透和溶解。鱼油萃取率在20 min至40 min的区间增速最快,从16.30%±1.66%增加至55.36%±2.33%,意味着65.47%的鱼油在这一时间段被萃取出来,这一变化趋势与鱼内脏基质蛋白质的水热液化反应转化率随反应时间的变化趋势基本一致(基质蛋白质的水热液化反应转化率从20 min时的18.98%±4.88%迅速增加至40 min时的81.22%±3.65%,见图2。这种一致性进一步表明:致密的基质蛋白质热聚物在这一时间段迅速水解,使包裹鱼油的阻力急剧下降,导致鱼油萃取率迅速增加,可以判断亚临界水的水热液化效应是这一时间段鱼油萃取率快速增加的主要因素。40 min后,鱼油萃取率趋于饱和,并在60 min时达到最大值是59.66%±1.95%。
此外,超声场物理效应能显著促进亚临界水媒介内的传质过程和反应进程,相同萃取条件下(260 ℃,10 MPa,60 min),超声作用前后(250 W/L, 20 kHz),鱼油的萃取率从51.52%±2.14%增加至59.87%±2.86%,鱼内脏基质蛋白质发生水热液化反应的转化率从84.15%±2.29%增加至92.37%±3.12%。
2.2.3 鱼油脂肪酸组成分析
表1列出了利用GC-MS对超声耦合亚临界水萃取的黄鲛鱼内脏油脂的脂肪酸组成进行定性定量分析的结果,每种组分的编号顺序对应着各色谱峰的保留时间,利用峰面积归一化法计算和表示每种组分的相对百分含量。GC-MS共检测出62种组分,其中,饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸分别占总油脂含量的26.17%,52.45%和20.27%,34种组分的百分含量超过0.1%(见表1),11种组分的百分含量超过1.00%,按照百分含量由高到低的顺序分别是9-十八烯酸甲酯(38.14%±1.09%)、十六烷酸甲酯(18.36%±0.54%)、4,7,10,13,16,19-二十二碳六烯酸甲酯(12.06%±0.43%)、9-十六烯酸甲酯(5.34%± 0.17%)、1,6-庚二烯酸(4.77%±0.13%)、5,8,11,14,17-二十碳五烯酸甲酯(3.54%±0.13%)、十四烷酸甲酯(2.60%±0.08%)、11-二十碳烯酸甲酯(2.25%±0.06%)、十五烷酸(2.15%±0.10%)、4,7,10,13,16-二十碳五烯酸甲酯(1.33%±0.03%)、7-甲基-6-十六烯酸甲酯(1.05%±0.04%)。鱼油组分中生理活性和经济价值最高的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的百分含量分别是4.87%±0.13%和12.06%±0.43%,总计占鱼油的16.93%,EPA与DHA的含量比约为2:5,且检出两种EPA的不饱和键取代位置,即5,8,11,14,17号碳位置的共轭双键排列和4,7,10,13,16号碳位置的共轭双键排列。与Zhang等[41]利用超高压联合酶法从金枪鱼头萃取的鱼油相比,本研究获得的鱼油中单不饱和脂肪酸含量更高(52.45%>32.70%),饱和脂肪酸(26.17%<28.29%)和多不饱和脂肪酸(20.27%<33.96%)的含量相对较低,且n-6:n-3=0.125更低(0.125<0.22),非常适合用于补充我国人口n-3型多不饱和脂肪酸的营养强化,在当前人类大脑和眼睛高强度运转的背景下,超声耦合亚临界水萃取获得的鱼油能够为满足人类护脑护眼的健康需求提供多一种膳食补充选择。
表 1 超声耦合亚临界水萃取的黄鲛鱼内脏油脂的脂肪酸组成Table 1. Fatty acid composition of fish oil extracted from Spanish mackerel viscera by USCWE编号 名称 百分含量(%) 1 十四烷酸甲酯 2.60±0.08 2 4,8,12-三甲基-十八烷酸甲酯 0.14±0.01 3 十五烷酸甲酯 0.60±0.02 4 十六烷酸甲酯 18.36±0.54 5 9-十六烯酸甲酯 5.34±0.17 6 11-十六烯酸甲酯 0.13±0.00 7 十四甲基-十六烷酸甲酯 0.25±0.01 8 18-甲基-异山梨酸甲酯 0.10±0.00 9 9,12-十六碳二烯酸甲酯 0.12±0.00 10 7-甲基-6-十六烯酸甲酯 1.05±0.04 11 庚酸甲酯 0.67±0.03 12 顺-10-十七烯酸甲酯 0.42±0.02 13 15-甲基-十七烷酸甲酯 0.11±0.00 14 9-十八烯酸甲酯 38.14±1.09 15 6,9-十八碳二烯酸甲酯 0.17±0.01 16 9,12-十八碳二烯酸甲酯 0.80±0.03 17 4-戊基-1-(4-丙基环己基)-环己烯 0.26±0.01 18 十九烷酸甲酯 0.15 ± 0.01 19 8,11,14-二十二碳三烯酸甲酯 0.37±0.01 20 6,9,12,15-十八碳四烯酸甲酯 0.38±0.02 21 18-甲基十九烷酸甲酯 0.35±0.02 22 11-二十碳烯酸甲酯 2.25±0.06 23 8,11-二十碳二烯酸甲酯 0.19±0.01 24 11,14-二十碳二烯酸甲酯 0.14±0.01 25 5,8,11,14-二十碳四烯酸甲酯 0.96±0.04 26 6,9,12,15-十八碳四烯酸甲酯 0.21±0.01 27 5,8,11,14,17-二十碳五烯酸甲酯 3.54±0.13 28 10-十九烯酸甲酯 0.13±0.01 29 十五烷酸 2.15±0.10 30 棕榈油酸 0.72±0.02 31 4,7,10,13,16-二十碳五烯酸甲酯 1.33±0.03 32 4,7,10,13,16,19-二十二碳六烯酸甲酯 12.06±0.43 33 硬脂酸 0.19±0.01 34 1,6-庚二烯酸 4.77±0.13 2.3 不同提取方法对黄鲛鱼内脏油脂萃取效果的影响
如表2所示:不同萃取方法对鱼油萃取率、鱼油中EPA和DHA的含量、鱼油的酸价、过氧化值和羰基价有显著影响(P<0.05)。根据Liu等[11]的报道,利用半纤维素酶和纤维素酶的水解特性联合微波辐射强化传质传热过程的特性,能够显著破坏肉桂叶的生物组织结构,达到提升精油萃取率和精油中含氧化合物含量的目的。这表明:不同萃取方法对萃取原料生物组织的破坏力及是否具有强化萃取体系传质传热过程的物理或化学效应是决定萃取率及萃取物中目标组分含量高低的显著影响因素。超声耦合亚临界水法、酶法、超声耦合溶剂法、超临界CO2法四种萃取方法获得的鱼油萃取率和鱼油中EPA、DHA的含量按顺序依次递减。破坏效应最大的是超声耦合亚临界水法。根据Huang等[33-34]的报道,利用超声场物理效应能够有效强化亚临界水的传热传质过程,能将紫草精油的萃取率从1.87%提升至2.39%。Karna等[40]则报道了大豆蛋白在150~200 ℃的亚临界水中发生水解反应生成小分子游离氨基化合物和肽,表明超声场是强化系统传热传质过程的有效手段,而蛋白质在一定温度的亚临界水中会发生水解反应。因此,超声耦合亚临界水萃取法很可能是在超声场物理效应与亚临界水水热液化效应的协同作用下,对鱼内脏颗粒的基质蛋白质产生了急剧的破坏力,使基质蛋白质迅速水解,同时促进亚临界水分子更彻底地渗入鱼内脏颗粒内核,溶解萃取被包裹在疏松网眼内的鱼油,并在最短的萃取时间(1 h)内获得最大的鱼油萃取率(59.87%±2.86%)和最高的EPA、DHA含量((46.01±0.31)mg/g、(116.78±0.91)mg/g)。比较四种不同萃取方法获得鱼油中的EPA和DHA含量,发现:对颗粒组织中基质蛋白质网状结构破坏性越大的萃取方法获得的鱼油中EPA、DHA的含量越高,这一现象可能与EPA、DHA等多不饱和脂肪酸在鱼内脏颗粒组织中的分布不均匀,且位于颗粒内核的含量高于颗粒外层组织中的含量有关。酶法和超声强化溶剂法的鱼油萃取率分别是52.30%±1.49%和47.63%±1.43%,在P<0.05的置信区间无显著性差异,这表明蛋白酶对鱼内脏基质蛋白质的水解破坏效应与超声场通过振动和空化效应促进有机溶剂渗入鱼内脏颗粒内部萃取鱼油的物理效应的强度差别不大。四种考察的萃取方法中,超临界CO2法的鱼油萃取率最低是41.81%±1.82%,萃取时间也最长是4 h,这表明:虽然超临界CO2是非极性溶剂,对鱼油表现出较好的溶解性,但其对鱼内脏颗粒内部结构的渗透性明显不及超声耦合亚临界水法和酶法,这一结果与Sneh等[16]报道的利用超临界CO2法萃取米糠油的主要问题是如何降低成本以及如何提升萃取率的结论一致。
表 2 不同萃取方法对鱼油萃取效果的影响Table 2. Effect of different extraction methods on extraction effect fish oil萃取方法 萃取条件 鱼油萃取率
(%)EPA含量
(mg/g)DHA含量
(mg/g)酸价
(mg KOH/g)过氧化值
(mmol/kg)羰基价
(mEq/kg)超声耦合亚
临界水法超声功率250 W/L,频率20 kHz,亚临界水
温度260 ℃,压强10 MPa,萃取时间1 h59.87±2.86a 46.01±0.31a 116.78±0.91a 11.78±0.41b 3.32±0.39b 3.76±0.23b 酶法 中性蛋白酶添加量1%(w/w),水解温度40 ℃,
振荡萃取3 h52.30±1.49b 41.63±0.52b 105.87±1.11b 13.29±0.34a 5.52±0.19a 4.96±0.13a 超声耦合溶剂法 超声功率800 W,频率40 kHz,萃取温度40 ℃,
正己烷萃取2 h47.63±1.43b 33.53±0.32c 86.98±1.29c 8.91±0.41c 2.06±0.15c 2.90±0.23c 超临界CO2法 萃取压强30 MPa,萃取温度60 ℃,
CO2流速3 mL/min,萃取时间4 h41.81±1.82c 30.30±0.26d 81.47±1.41d 7.15±0.33d 1.83±0.13c 2.01±0.21d 注:表中数据右上标的字母a、b、c、d表示同一列四种不同萃取方法获得的数据在P<0.05的显著性水平上是否存在显著性差异,当同一列两数据的右上标字母不同时,表示萃取方法对该数据结果影响显著,反之,表示无显著影响。 相较于其他三种萃取方法,酶法萃取的鱼油的酸价、过氧化值和羰基价最高,这一结果可能与该法萃取过程中鱼油与外界环境的暴露程度最大有关,在3 h的萃取过程中,质量密度较低的鱼油随着基质蛋白质的水解逐渐富集在反应液上层,在氧气、微生物、环境自由基等因素作用下,加速发生氧化酸败,产生更多的游离脂肪酸、氧化自由基和氧化产物,导致理化指标值最高。Zhang等[41]报道了利用酶法萃取获得的金枪鱼油的活化能值高达75 kJ/mol,并提出向鱼油中添加抗氧化剂或利用微胶囊技术以降低鱼油萃取及产品储藏期间的氧化酸败。超声耦合溶剂法和超临界CO2法萃取鱼油的理化指标值最低,这可能与它们的萃取条件较温和有关,且鱼油在正己烷和超临界CO2溶剂相内性质更稳定,不容易发生氧化酸败反应[8,16]。亚临界水的萃取温度较高,是260 ℃,为了减少亚临界水中氧气对鱼油的不利影响,本试验设计了专门的预热釜装置,通过调节排气阀,将亚临界水升温过程中的溶解氧充分排除在系统外,但即便如此,鱼油中的脂肪酸酯也会在高温亚临界水中发生部分水解[30],释放出更多的游离脂肪酸,导致酸价值偏高,少部分脂肪酸甚至会进一步降解,增加鱼油的过氧化值和羰基价。
2.4 黄鲛鱼内脏颗粒物微观结构分析
为了进一步观察和比较超声耦合亚临界水法和酶解法对鱼内脏基质蛋白质的水解破坏性,分别对黄鲛鱼内脏颗粒和上述两种萃取法萃取鱼油后的鱼内脏颗粒进行扫描电镜检测,以期更细致地观察两种萃取法的水解方式、水解特性和水解破坏程度。
如图5所示:黄鲛鱼内脏的冻干细颗粒(a)具有完整的微观结构,其内部分布着大小不等的孔洞,孔洞边缘的结缔组织坚固、致密、凹凸不平,想要释放和分离包裹在孔洞内的鱼油小液滴,必须破坏由基质蛋白质构成的结缔组织壁层,以便将鱼油小液滴释放并溶解在萃取溶剂相内。经过超声耦合亚临界水和中性蛋白酶作用后,颗粒的微观结构发生了显著改变。与(a)相比,(b)和(c)的扫描电镜图片的清晰度依次降低,这与鱼内脏基质蛋白质在超声场物理作用、亚临界水水热液化作用和中性蛋白质酶的生物催化作用下,分子结构发生改变有关,基质蛋白质生物大分子内的肽键水解、断裂,生成肽和氨基酸等更小的分子,这较小的分子带电量较少,喷金后吸附在颗粒物表层的金粉量较少,检样导电性下降使对应的扫描电镜图片清晰度下降。经超声耦合亚临界水萃取后,(b)颗粒的空间网状结构被彻底破坏,整体结构趋于平坦,凹凸程度低,形成的浅槽上方稀疏地连接着几条未完全断裂的基质组织,整体结构表面附着着一些性状不规则的小团块结构,它们是由致密的基质蛋白质热聚合物裂解形成的。经酶法萃取后,(c)颗粒的组织结构变得松弛而多孔,与(a)相比,原有的大孔洞数量明显减少,且形状不规则,基质组织在中性蛋白酶的水解作用下,呈现密集的凹凸状,并伴有一定数量的小洞,这与中性蛋白酶的水解方式有关,酶分子接触基质蛋白质表层,率先催化水解表层暴露的肽键,并以内切方式随机水解基质蛋白质分子内不同位置上的肽键,从而形成类似马蜂窝状的结构,但酶的催化活性会随着水解作用进程逐渐降低,导致酶法萃取对鱼内脏细颗粒组织的破坏效应有限,表现在与(b)相比,(c)仍保留着整体较完整的空间结构,因此酶法的鱼油萃取率及鱼油中EPA和DHA的含量都低于超声耦合亚临界水法。
3. 结论
本研究表明超声场物理效应协同亚临界水水热液化效应能显著提升鱼油的萃取效率,增加鱼油中EPA和DHA的含量。与酶法、超声耦合溶剂法和超临界CO2法相比,超声耦合亚临界水萃取鱼油具有高效、环保、EPA和DHA含量高的特点,是一种适用于萃取分离生物组织内部活性成分的萃取技术。但萃取时应控制好亚临界水的萃取温度和时间,以确保获得高萃取效率的同时,又能减少氨基酸和脂肪酸的降解反应,避免小分子醛类、酮类等副产物降低萃取物的品质。此外,控制反应条件,从基质蛋白质水热液化反应产物中筛选具有界面活性和抗氧化活性的小分子肽,并探究其与鱼油的协同效应是进一步拓展该技术用于萃取分离活性组分的一个关键研究方向。
-
表 1 超声耦合亚临界水萃取的黄鲛鱼内脏油脂的脂肪酸组成
Table 1 Fatty acid composition of fish oil extracted from Spanish mackerel viscera by USCWE
编号 名称 百分含量(%) 1 十四烷酸甲酯 2.60±0.08 2 4,8,12-三甲基-十八烷酸甲酯 0.14±0.01 3 十五烷酸甲酯 0.60±0.02 4 十六烷酸甲酯 18.36±0.54 5 9-十六烯酸甲酯 5.34±0.17 6 11-十六烯酸甲酯 0.13±0.00 7 十四甲基-十六烷酸甲酯 0.25±0.01 8 18-甲基-异山梨酸甲酯 0.10±0.00 9 9,12-十六碳二烯酸甲酯 0.12±0.00 10 7-甲基-6-十六烯酸甲酯 1.05±0.04 11 庚酸甲酯 0.67±0.03 12 顺-10-十七烯酸甲酯 0.42±0.02 13 15-甲基-十七烷酸甲酯 0.11±0.00 14 9-十八烯酸甲酯 38.14±1.09 15 6,9-十八碳二烯酸甲酯 0.17±0.01 16 9,12-十八碳二烯酸甲酯 0.80±0.03 17 4-戊基-1-(4-丙基环己基)-环己烯 0.26±0.01 18 十九烷酸甲酯 0.15 ± 0.01 19 8,11,14-二十二碳三烯酸甲酯 0.37±0.01 20 6,9,12,15-十八碳四烯酸甲酯 0.38±0.02 21 18-甲基十九烷酸甲酯 0.35±0.02 22 11-二十碳烯酸甲酯 2.25±0.06 23 8,11-二十碳二烯酸甲酯 0.19±0.01 24 11,14-二十碳二烯酸甲酯 0.14±0.01 25 5,8,11,14-二十碳四烯酸甲酯 0.96±0.04 26 6,9,12,15-十八碳四烯酸甲酯 0.21±0.01 27 5,8,11,14,17-二十碳五烯酸甲酯 3.54±0.13 28 10-十九烯酸甲酯 0.13±0.01 29 十五烷酸 2.15±0.10 30 棕榈油酸 0.72±0.02 31 4,7,10,13,16-二十碳五烯酸甲酯 1.33±0.03 32 4,7,10,13,16,19-二十二碳六烯酸甲酯 12.06±0.43 33 硬脂酸 0.19±0.01 34 1,6-庚二烯酸 4.77±0.13 表 2 不同萃取方法对鱼油萃取效果的影响
Table 2 Effect of different extraction methods on extraction effect fish oil
萃取方法 萃取条件 鱼油萃取率
(%)EPA含量
(mg/g)DHA含量
(mg/g)酸价
(mg KOH/g)过氧化值
(mmol/kg)羰基价
(mEq/kg)超声耦合亚
临界水法超声功率250 W/L,频率20 kHz,亚临界水
温度260 ℃,压强10 MPa,萃取时间1 h59.87±2.86a 46.01±0.31a 116.78±0.91a 11.78±0.41b 3.32±0.39b 3.76±0.23b 酶法 中性蛋白酶添加量1%(w/w),水解温度40 ℃,
振荡萃取3 h52.30±1.49b 41.63±0.52b 105.87±1.11b 13.29±0.34a 5.52±0.19a 4.96±0.13a 超声耦合溶剂法 超声功率800 W,频率40 kHz,萃取温度40 ℃,
正己烷萃取2 h47.63±1.43b 33.53±0.32c 86.98±1.29c 8.91±0.41c 2.06±0.15c 2.90±0.23c 超临界CO2法 萃取压强30 MPa,萃取温度60 ℃,
CO2流速3 mL/min,萃取时间4 h41.81±1.82c 30.30±0.26d 81.47±1.41d 7.15±0.33d 1.83±0.13c 2.01±0.21d 注:表中数据右上标的字母a、b、c、d表示同一列四种不同萃取方法获得的数据在P<0.05的显著性水平上是否存在显著性差异,当同一列两数据的右上标字母不同时,表示萃取方法对该数据结果影响显著,反之,表示无显著影响。 -
[1] 胡名媛, 王锋, 马永建, 等. 鱼油对KKAy糖尿病小鼠糖代谢及pI3K/Akt信号通路的影响[J]. 食品科学,2018,39(11):126−131. [HU M Y, WANG F, MA Y J, et al. Effect of fish oil on glucose metabolism and pI3K/Akt signaling pathway in diabetic KKAy mice[J]. Food Science,2018,39(11):126−131. doi: 10.7506/spkx1002-6630-201811020 HU M Y, WANG F, MA Y J, et al. Effect of fish oil on glucose metabolism and PI3K/Akt signaling pathway in diabetic KKAy mice[J]. Food Science, 2018, 39(11): 126-131. doi: 10.7506/spkx1002-6630-201811020
[2] MASON R P. New insights into mechanisms of action for omega-3 fatty acids in atherothrombotic cardiovascular disease[J]. Current Atherosclerosis Reports,2019,21(2):1−11.
[3] BIE N, HAN L, MENG M, et al. Anti-tumor mechanism of eicosapentaenoic acid (EPA) on ovarian tumor model by improving the immunomodulatory activity in F344 rats[J]. Journal of Functional Foods,2020,65:103739. doi: 10.1016/j.jff.2019.103739
[4] GHAZALE H, RAMADAN N, MANTASH S, et al. Docosahexaenoic acid (DHA) enhances the therapeutic potential of neonatal neural stem cell transplantation post—Traumatic brain injury[J]. Behavioural Brain Research,2018,340:1−13. doi: 10.1016/j.bbr.2017.11.007
[5] TIBBETTS S M, SCAIFE M A, ARMENTA R E. Apparent digestibility of proximate nutrients, energy and fatty acids in nutritionally-balanced diets with partial or complete replacement of dietary fish oil with microbial oil from a novel Schizochytrium sp. (T18) by juvenile Atlantic salmon (Salmo salar L.)[J]. Aquaculture,2020,520:735003. doi: 10.1016/j.aquaculture.2020.735003
[6] RYCKEBOSCH E, BRUNEEL C, TERMOTEVERHALLE R, et al. Nutritional evaluation of microalgae oils rich in omega-3 long chain polyunsaturated fatty acids as an alternative for fish oil[J]. Food Chemistry,2014,160:393−400. doi: 10.1016/j.foodchem.2014.03.087
[7] PEREZ-VELAZQUEZ M, GATLIN D M, GONZALEZ-FELIX M L, et al. Partial replacement of fishmeal and fish oil by algal meals in diets of red drum Sciaenops ocellatus[J]. Aquaculture,2018,487:41−50. doi: 10.1016/j.aquaculture.2018.01.001
[8] 陶宁萍, 鲍丹. 鱼油的营养和药用价值及其提取工艺的研究进展[J]. 上海水产大学学报,2005,2:197−201. [TAO N P, BAO D. Nutritive value and development of extraction technique on fish oil[J]. Journal of Shanghai Fisheries University,2005,2:197−201. TAO N P, BAO D. Nutritive value and development of extraction technique on fish oil[J]. Journal of Shang Hai Fisheries University, 2005, 2: 197-201.
[9] BUCIO S L, SANZ M T, BELTRAN S, et al. Study of the influence of process parameters on liquid and supercritical CO2 extraction of oil from rendered materials: Fish meal and oil characterization[J]. Journal of Supercritical Fluids,2016,107:270−277. doi: 10.1016/j.supflu.2015.09.019
[10] DE-SOUZA T S P, DIAS F F G, KOBLITZ M G B, et al. Effects of enzymatic extraction of oil and protein from almond cake on the physicochemical and functional properties of protein extracts[J]. Food and Bioproducts Processing,2020,122:280−290. doi: 10.1016/j.fbp.2020.06.002
[11] LIU Z Z, LI H L, CUI G Q, et al. Efficient extraction of essential oil from Cinnamomum burmannii leaves using enzymolysis pretreatment and followed by microwave-assisted method[J]. LWT-Food Science and Technology,2021,147(1):111497.
[12] LIU W, XIAO B, YANG G L, et al. Rapid salt-assisted microwave demulsification of oil-rich emulsion obtained by aqueous enzymatic extraction of peanut seeds[J]. European Journal of Lipid Science & Technology,2020,122(2):1−14.
[13] 李莹, 黄德春, 陈贵堂, 等. 昆布多糖不同提取工艺优化及其理化性质和抗肿瘤活性比较[J]. 食品科学,2019,40(6):289−295. [LI Y, HUANG D CH, CHEN G T, et al. Polysaccharides from Laminaria japonica: Optimization of different extraction processes and comparison of physicochemical properties and antitumor activity[J]. Food Science,2019,40(6):289−295. doi: 10.7506/spkx1002-6630-20180312-147 LI Y, HUANG D CH, CHEN G T, et al. Polysaccharides from Laminaria japonica: Optimization of different extraction processes and comparison of physicochemical properties and antitumor activity[J]. Food Science, 2019, 40(6): 289-295. doi: 10.7506/spkx1002-6630-20180312-147
[14] BASEGMEZ H I O, POVILAITIS D, KITRYTE V, et al. Biorefining of blackcurrant pomace into high value functional ingredients using supercritical CO2, pressurized liquid and enzyme assisted extractions[J]. The Journal of Supercritical Fluids,2017,124:10−19. doi: 10.1016/j.supflu.2017.01.003
[15] MACKELA I, ANDRIEKUS T, VENSKUTONIS P R. Biorefining of buckwheat (Fagopyrum esculentum) hulls by using supercritical fluid, Soxhlet, pressurized liquid and enzyme-assisted extraction methods[J]. Journal of Food Engineering,2017,213:38−46. doi: 10.1016/j.jfoodeng.2017.04.029
[16] PUNIA S, KUMAR M, SIROHA A K, et al. Rice bran oil: Emerging trends in extraction, health benefit, and its industrial application[J]. Rice Science,2021,28(3):217−232. doi: 10.1016/j.rsci.2021.04.002
[17] TEKIN K, KARAGOZ S, BEKTAS S. A review of hydrothermal biomass processing[J]. Renewable and Sustainable Energy Reviews,2014,40:673−687. doi: 10.1016/j.rser.2014.07.216
[18] HIRANO Y, MIYATA Y, TANIGUCHI M, et al. Fe-assisted hydrothermal liquefaction of cellulose: Effects of hydrogenation catalyst addition on properties of water-soluble fraction[J]. Journal of Analytical & Applied Pyrolysis,2020,145(1):1047191−1047197.
[19] CONTI F, TOOR S S, PEDERSEN T H, et al. Valorization of animal and human wastes through hydrothermal liquefaction for biocrude production and simultaneous recovery of nutrients[J]. Energy Conversion and Management,2020,216:112925. doi: 10.1016/j.enconman.2020.112925
[20] GOLLAKOTA A R K, KISHORE N, GU S. A review on hydrothermal liquefaction of biomass[J]. Renewable and Sustainable Energy Reviews,2018,81:1378−1392. doi: 10.1016/j.rser.2017.05.178
[21] DANDAMUDI K P R, MATHEW M, SELVARATNAM T, et al. Recycle of nitrogen and phosphorus in hydrothermal liquefaction biochar from Galdieria sulphuraria to cultivate microalgae[J]. Resources Conservation and Recycling,2021,171:105644. doi: 10.1016/j.resconrec.2021.105644
[22] EIKANI M H, KHANDAN N, FEYZI E, et al. A shrinking core model for Nannochloropsis salina oil extraction using subcritical water[J]. Renewable Energy,2019,131:660−666. doi: 10.1016/j.renene.2018.07.091
[23] SAMADI M, ABIDIN Z Z, YOSHIDA H, et al. Subcritical water extraction of essential oil from Aquilaria malaccensis leaves[J]. Separation Science & Technology,2019,55(15):2779−2798.
[24] WATANABE M, LIDA T, INOMATA H. Decomposition of a long chain saturated fatty acid with some additives in hot compressed water[J]. Energy Conversion and Management,2006,47:3344−3350. doi: 10.1016/j.enconman.2006.01.009
[25] TOOR S S, ROSENDAHL L, RUDOLF A. Hydrothermal liquefaction of biomass: A review of subcritical water technologies[J]. Energy,2011,36:2328−2342. doi: 10.1016/j.energy.2011.03.013
[26] ROGALINSKI T, HERRMANN S, BRUNNER G. Production of amino acids from bovine serum albumin by continuous sub-critical water hydrolysis[J]. Journal of Supercritical Fluids,2005,36:49−58. doi: 10.1016/j.supflu.2005.03.001
[27] CHOI J S, JANG D B, MOON H E, et al. Physiological properties of Engraulis japonicus muscle protein hydrolysates prepared by subcritical water hydrolysis[J]. Journal of Environmental Biology,2017,38(2):283−289. doi: 10.22438/jeb/38/2/MRN-973
[28] PHUSUNTI N, PHETWAROTAI W, TIRAPANAMPAI C, et al. Subcritical water hydrolysis of microalgal biomass for protein and pyrolytic bio-oil recovery[J]. Bioenergy Research,2017,10(4):1005−1017. doi: 10.1007/s12155-017-9859-y
[29] FAN X D, HU S F, WANG K, et al. Coupling of ultrasound and subcritical water for peptides production from Spirulina platensis[J]. Food and Bioproducts Processing,2020,121:105−112. doi: 10.1016/j.fbp.2020.01.012
[30] ROGALINSKI T, LIU K, ALBRECHT T, et al. Hydrolysis kinetics of biopolymers in subcritical water[J]. Journal of Supercritical Fluids,2008,46:335−341. doi: 10.1016/j.supflu.2007.09.037
[31] YAN J K, WU L X, CAI W D, et al. Subcritical water extraction-based methods affect the physicochemical and functional properties of soluble dietary fibers from wheat bran[J]. Food Chemistry,2019,298(15):124987.
[32] 朱严华, 杨波, 黄菊, 等. 超声提取-气相色谱-串联质谱法测定煎烤鱿鱼中16种多环芳烃[J]. 食品工业科技,2021,42(16):263−270. [ZHU Y H, YANG B, HUANG J, et al. Determination of 16 polycyclic aromatic hydrocarbons (PAHs) in fried squid by ultrasonic extraction-gas chromatography-mass spectrometry[J]. Science and Technology of Food Industry,2021,42(16):263−270. ZHU Y H, YANG B, HUANG J, et al. Determination of 16 polycyclic aromatic hydrocarbons (PAHs) in fried squid by ultrasonic extraction-gas chromatography-mass spectrometry[J]. Science and Technology of Food Industry, 2021, 42(16): 263-270.
[33] HUANG P P, YANG R F, QIU T Q, et al. Solubility of fatty acids in subcritical water[J]. The Journal of Supercritical Fluids,2013,81(5):221−225.
[34] HUANG P P, YANG R F, QIU T Q, et al. Ultrasound-enhanced subcritical water extraction of volatile oil from Lithospermum erythrorhizon[J]. Separation Science & Technology,2010,45(10):1433−1439.
[35] THOMPSON M, OWEN L, WILKINSON K, et al. A comparison of the Kjeldahl and Dumas methods for the determination of protein in foods, using data from a proficiency testing scheme[J]. Analyst,2002,127(12):1666−1668. doi: 10.1039/b208973b
[36] ZHANG J X, WEN C T, ZHANG H H, et al. Recent advances in the extraction of bioactive compounds with subcritical water: A review[J]. Trends in Food Science & Technology,2020,95:183−195.
[37] HALIM N A A, ABIDIN Z Z, SIAJAM S I, et al. Optimization studies and compositional analysis of subcritical water extraction of essential oil from Citrus hystrix DC. leaves[J]. The Journal of Supercritical Fluids,2021,178:105384−105399. doi: 10.1016/j.supflu.2021.105384
[38] KUVENDZIEV S, LISICHKOV K, ZEKOVIC Z, et al. Supercritical fluid extraction of fish oil from common carp (Cyprinus carpio L.) tissues[J]. The Journal of Supercritical Fluids,2018,133:528−534. doi: 10.1016/j.supflu.2017.11.027
[39] SUNPHORKA S, CHAVASIRI W, OSHIMA Y, et al. Kinetic studies on rice bran protein hydrolysis in subcritical water[J]. The Journal of Supercritical Fluids,2012,65:54−60. doi: 10.1016/j.supflu.2012.02.017
[40] RAMACHANDRAIAH K, KOH B B, DAVAATSEREN M, et al. Characterization of soy protein hydrolysates produced by varying subcritical water processing temperature[J]. Innovative Food Science and Emerging Technologies,2017,43:201−206. doi: 10.1016/j.ifset.2017.08.011
[41] ZHANG Y C, SUN Q X, LIU S C, et al. Extraction of fish oil from fish heads using ultra-high pressure pre-treatment prior to enzymatic hydrolysis[J]. Innovative Food Science & Emerging Technologies,2021,70:102670−102680.









 下载:
下载:


 下载:
下载:



