In Vitro Antioxidant Activity Analysis of the Bi-directional Solid Fermentation Plasm of Hericium erinaceus and Ginseng
-
摘要: 目的:为了更好地研究与利用猴头菌及人参的药用价值。方法:本文以猴头菌为发酵菌种,人参为药性基质(PGP组)进行双向固体发酵,得到猴头菌-人参双向固体发酵菌质(HEP组),通过苯酚-硫酸法、考马斯亮蓝法测定不同发酵时期的发酵菌质组及人参药性基质组的不同醇沉组分多糖及蛋白质的含量,并采用DPPH·法、·OH法、ABTS+·法测定不同醇沉组分的抗氧化能力。结果:总糖含量以40%醇沉组分最多,发酵至第9 d时,发酵菌质组40%醇沉组分HEP-40总糖含量达到0.98 mg/g,人参基质组40%醇沉组分PGP-40总糖含量达到1.03 mg/g,还原糖、蛋白质含量以90%醇沉组分的最多,发酵至第30 d时,发酵菌质组90%醇沉组分HEP-90还原糖含量达到0.18 mg/g,人参基质组90%醇沉组分PGP-90还原糖含量达到0.24 mg/g;发酵至第40 d时,HEP-90蛋白质含量达到0.54 mg/g,PGP-90蛋白质含量达到0.46 mg/g。菌质组各醇沉组分在发酵至第24 d时对DPPH自由基的清除能力均达到较好的效果,发酵菌质中不同醇沉组分多糖HEP-40、HEP-70、HEP-90的DPPH自由基清除率分别为37.66%、60.06%、73.58%;当发酵至第40 d时,HEP-40、HEP-70、HEP-90对羟自由基的清除率分别为33.71%、54.32%、94.90%;当发酵至第40 d时,HEP组的ABTS自由基清除能力达到峰值,HEP-40、HEP-70、HEP-90对ABTS自由基的清除率分别为44.83%、87.90%、98.90%。结论:猴头菌与人参进行双向固体发酵后,发酵产物(HEP组)中的药效活性成分与未经发酵处理的人参(PGP组)中的药效活性成分相较抗氧化能力显著提升。Abstract: : Objective: To better study and make use of the medicinal value of Hericium erinaceus and ginseng. Methods: In this paper, Hericium erinaceus was used as the fermentation strain and ginseng was used as the drug substrate (PGP) for two-way solid fermentation to obtain Hericium erinaceus ginseng two-way solid fermentation bacteria (HEP). The contents of polysaccharides and proteins of fermentation bacteria and different alcohol precipitation components of ginseng drug substrate group in different fermentation periods were determined by phenol sulfuric acid method and Coomassie brilliant blue method. And DPPH·, ·OH and ABTS+· methods were used to determine the antioxidant capacity of different alcohol precipitation components. Results: The total sugar content of 40% alcohol precipitation component was the most. At the 9th day of fermentation, the total sugar content of 40% alcohol precipitation component HEP-40 in fermentation substrate group reached 0.98 mg/g, and the total sugar content of 40% alcohol precipitation component PGP-40 in ginseng matrix group reached 1.03 mg/g. The content of reducing sugar and protein in 90% alcohol precipitation component was the most. At the 30th day of fermentation, the content of reducing sugar in 90% alcohol precipitation component HEP-90 of fermentation substrate group reached 0.18 mg/g, and the content of reducing sugar in 90% alcohol precipitation component PGP-90 of ginseng matrix group reached 0.24 mg/g; At the 40th day of fermentation, the protein content of HEP-90 and PGP-90 reached 0.54 and 0.46 mg/g respectively. The scavenging of DPPH radicals by all alcoholic fractions of the fermentation plasm up to the 24th day of fermentation was good, with DPPH scavenging rates of 37.66%, 60.06% and 73.58% for the polysaccharides HEP-40, HEP-70 and HEP-90 in the fermentation plasm, respectively; At the 40th day of fermentation, the clearance rates of HEP-40, HEP-70 and HEP-90 on OH radical were 33.71%, 54.32% and 94.90%, respectively; When the fermentation reached the 40th day, the clearance ability of the HEP group reached the peak, and the clearance rates of HEP-40, HEP-70 and HEP-90 on ABTS radical were 44.83%, 87.90% and 98.90%, respectively. Conclusion: After two-way solid fermentation of Hericium erinaceus and ginseng, the antioxidant capacity of the pharmacodynamic active components in the fermentation products (HEP) was higher than that of the pharmacodynamic active components in ginseng without fermentation treatment (PGP).
-
猴头菌(Hericium erinaceus)隶属担子门(Basidiomycota)伞菌纲(Agaricomycetes)红菇目(Russulales)猴头菌科(Hericiaceae)猴头菌属(Hericium)[1],具有一定的抗氧化、抗菌、抗衰老、抗肿瘤和神经保护、抗炎等作用[2-3]。作为我国传统的“药食同源”的大型真菌,因其具有重要的食用价值和药用功效而受到了消费者的广泛喜爱。人参(Panax ginseng C.A. Mey.)为多年生宿根阴性草本双子叶植物,是我国传统的名贵中药材,具有抗癌、抗肿瘤、抗焦虑和保肝护肝、保护心脑血管等活性作用,具有显著的药理活性和极高的药用价值[4-8]。
双向固体发酵是以中药材或中药材残渣为药性基质,利用药用真菌的生物活性分解代谢药性基质中的纤维、蛋白质、糖类等成分为自身提供生长所需的营养及能量,使药用真菌在药性基质的基础上通过次生代谢产物发酵对中药材的活性成分进行修饰改造,得到新的药效活性成分的一种新型发酵技术[9-10]。双向发酵过程中,真菌自身丰富的酶系统,可将药性基质中的纤维素类物质水解,从而为发酵基质的生长代谢提供能量,同时发酵基质中的营养成分也可为真菌的营养生长提供必要的养分[11-14]。朱蕴兰等[15]对蛹拟青霉与金针菇菇柄双向固体发酵后菌质的活性物质含量及抗氧化活性进行了探究,发现菌质中多糖比未经发酵的金针菇菇柄中的含量高,且经过发酵后的菌质的抗氧化活性也有所提升。
猴头菌作为自然界中一种珍贵的大型药食两用真菌,在固体发酵过程中,可通过多种次生代谢产物可对固体基质的物质基础进行改造,从而提高基质中活性物质含量。如,刘明明等[16]利用猴头菌与小麦固体培养基进行双向发酵,发现猴头菌发酵组明显提高了小麦基质中蛋白质的含量。另有研究表明,猴头菌与玉米蛋白粉的发酵产物的抗氧化活性明显增高[17]。人参经微生物固体发酵后的,其发酵产物更利于人体消化吸收。由原型人参皂苷转化得到的稀有人参皂苷Rg2、Rg3具有更高效的抗焦虑、抗炎、抗癌活性作用[18-20]。
人参已被发现含有多种活性成分,如皂苷、多糖、黄酮、挥发油等[21]。其中,人参多糖约占人参干重的10%,是人参中最丰富的活性物质,具有免疫调节、抗氧化、抗癌、消炎等作用[22]。李万丛等[23]的实验结果表明,人参经酿酒酵母发酵后,多糖的含量及活性均有一定提升。猴头菌多糖具有神经调节、抗炎、抗癌、维持胃肠道稳态以及抗氧化等多种生理活性[24]。秦培鹏等[25]优化提取方法后得到了8.87%的猴头菌多糖。YAN等[26]用不同溶剂萃取猴头菌中多糖,并对各组分多糖的抗氧化活性进行了比较研究,结果发现,提取溶剂对猴头菌多糖的结构、单糖组成、分子量等理化性质有显著的影响,其中柠檬酸提取的多糖组分具有更强的DPPH清除能力。多酚也是一类重要的抗氧化活性成分,但其在猴头菌中含量远低于猴头菌多糖[27],因此本研究主要针对发酵菌质中的多糖进行抗氧化活性分析。目前,应用猴头菌与人参进行的双向固体发酵,其发酵菌质多糖活性如何,尚未见报道。因此,本实验采取猴头菌与人参进行双向发酵,得到不同培养天数的发酵菌质。为进一步探究发酵菌质中所含营养成分,对发酵菌质及人参药性基质中的多糖及蛋白质含量进行动态跟踪,采用分级醇沉的方法进一步探究发酵菌质中活性多糖的动态变化,并对其抗氧化活性进行研究。希望通过本文的实验结果,为下一步研究发酵菌质多糖的药理作用提供理论背景,为深入开发猴头菌与人参的药用价值奠定基础。
1. 材料与方法
1.1 材料与仪器
人参 吉林省怡生对外贸易有限公司;猴头菌 吉林省生物研究所张金亭研究员赠予;葡萄糖、蛋白胨、磷酸二氢钾、硫酸镁、酵母粉、琼脂粉 国药集团化学试剂有限公司;2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)、过硫酸钾、2,4,6-三吡啶基三嗪(2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ) 上海源叶生物科技有限公司;水杨酸、无水乙醇 北京化工厂。
SLI-700型恒温培养箱 上海爱朗仪器有限公司;FDU-2110型冷冻干燥机 东京理化器械株式会社;YXQ-LS-50A型压力蒸汽灭菌器 上海博迅实业有限公司;SW-CJ-2F型洁净工作台 苏州安泰空气技术有限公司;ZQZY-85CNS 型振荡培养箱 上海知楚仪器有限公司;BT 25s型电子分析天平 赛多利斯科学仪器(北京)有限公司;M200 Pro型多功能酶标仪 瑞士TECAN集团公司;A11B S025型粉碎机 德国IKA仪器设备有限公司。
1.2 实验方法
1.2.1 菌种培养
将保存于4 ℃冰箱的猴头菌菌种在无菌条件下转接到PDA固体培养基(葡萄糖20 g、蛋白胨10 g、KH2PO4 2 g、MgSO4•7 H2O 1 g、琼脂粉18 g、蒸馏水1 L)中,于26 ℃恒温黑暗条件下培养,待猴头菌菌丝布满培养基表面,进行猴头菌液体菌种的培养。取固体培养物转接于液体培养基中(葡萄糖20 g、蛋白胨10 g、KH2PO4 2 g、MgSO4•7 H2O 1 g、蒸馏水1 L),接种量7%,在26 ℃、160 r/min的黑暗条件下培养10 d,至培养基中含有大量黄色菌球时,终止液体发酵。
1.2.2 双向固体发酵菌质的制备
参照文献[28],将人参药材粉碎,过16目筛后装至培养瓶,每瓶装入20 g,加适量水,混匀,121 ℃高压灭菌30 min,待人参基质冷却至室温后,接入猴头菌液体菌种,接种量10%,室温避光培养。培养至第30 d时,猴头菌菌丝布满整个药性基质且形成了明显的菌蕾结构,为发酵终点。取出发酵菌质,40 ℃烘干,密封保存。
1.2.3 不同醇沉组分多糖的制备
准确称取10 g菌质样品,料液比为1:20 g/mL,提取温度为95 ℃,每次1 h,提取2次,过滤,合并滤液,60 ℃水浴浓缩提取至原体积的1/4。在浓缩液中加入一定量的无水乙醇使得乙醇体积分数分别达到40%、70%、90%,4000 r/min离心30 min,收集沉淀,得到3个不同菌质多糖级分(HEP-40、HEP-70、HEP-90)。以粉碎后不接种猴头菌液体菌种的人参药材为对照组,按同种方法进行醇沉,得到3个人参对照组多糖(PGP-40、PGP-70、PGP-90)。分别对上述6组多糖进行真空冷冻干燥,密封保存,备用。
1.2.4 不同醇沉多糖组分中总糖含量测定
根据文献[29]稍作改动,采用苯酚-硫酸法测定总糖含量。标准曲线制作:将烘干至恒重的无水葡萄糖配制为0.1 mg/mL的标准液,精确移取0、0.2、0.4、0.6、0.8、1 mL,并用蒸馏水补足至1 mL,振荡混匀。依次加入5%苯酚1 mL,硫酸5 mL,混匀,沸水浴5 min,冷却至室温,取出。以蒸馏水为空白,于490 nm波长处测定吸光值。标准回归方程为:Y=3.4372X+0.0042,R2=0.9980。待测样品如上条件进行测定,根据标准曲线计算总糖含量。
1.2.5 不同醇沉多糖组分中还原糖含量测定
参考文献[30]稍作修改,采用3,5-二硝基水杨酸比色法测定总还原糖(DNS)。标准曲线制作:将烘干至恒重的无水葡萄糖配制为1 mg/mL的标准液,精确移取0、0.2、0.4、0.6、0.8、1 mL,以蒸馏水补足至1 mL,震荡混匀。加入DNS溶液2 mL,混匀后,沸水浴5 min,冷却至室温,加入蒸馏水9 mL,混匀。以蒸馏水为空白,于540 nm波长处测定吸光度。标准回归方程为:Y=0.4615X−0.0079,R2=0.9989。待测样品如上条件进行测定,并根据标准曲线计算还原糖含量。
1.2.6 不同醇沉多糖组分中蛋白质含量测定
利用考马斯亮蓝法[31]测定多糖样中蛋白质含量。依次吸取0.05 mg/mL蛋白质标准溶液0、0.2、0.4、0.6、0.8、1 mL,分别加蒸馏水补足至1.0 mL,相当于含有血清蛋白的质量依次为 0、10、20、30、40、50 μg。加入4 mL考马斯亮蓝溶液,充分振荡5 min,于波长595 nm处测定吸光值。以蛋白质的质量(μg)为横坐标,以吸光度值为纵坐标,绘制蛋白标准曲线得出回归方程。标准回归方程为:Y=0.945X−0.0044,R2=0.9977。待测样品中的蛋白质含量测定方法同上。
1.2.7 不同醇沉多糖组分抗氧化活性评价
1.2.7.1 DPPH自由基清除率测定
按文献[32-33]方法,取不同质量浓度的样品溶液与DPPH溶液各2 mL,振荡摇匀,室温条件下避光放置30 min,于波长517 nm处测定吸光值。按下式计算DPPH自由基清除率X。
X(%)=(1−AX−AX0A0)×100 (1) 式中:AX为样品吸光值;AX0为显色剂本底吸光值;A0为空白吸光值。
1.2.7.2 羟自由基清除率测定
参考文献[34]中的方法进行测定,取1.0 mL上述多糖样品与1.0 mL(9 mmol/L)FeSO4,1.0 mL 9 mmol/L水杨酸-乙醇溶液,再加入1.0 mL(9 mmol/L)H2O2混合,摇匀,37 ℃水浴30 min后,于510 nm波长处测定AX,用1.0 mL水代替样品测定A0,用1.0 mL水代替H2O2测定AX0。清除率按上述公式(1)计算。
1.2.7.3 ABTS自由基清除率测定
参考文献[35] 的方法进行ABTS自由基清除能力的测定。取上述多糖样品溶液0.2 mL与ABTS工作液2.0 mL(2.45 mmol/L的K2S2O8溶液2.5 mL与7 mmol/L的ABTS溶液2.5 mL混合均匀,测定A734 nm,为0.70±0.02,即得ABTS工作液)混合均匀,振荡30 s,室温避光放置6 min后测定其在734 nm波长处的吸光度。清除率按上述公式(1)计算。
1.3 数据处理
通过GraphPad Prism 9软件作图并进行数据分析。所有实验重复3次,数据均以平均值±标准差表示,P<0.05表示差异具有显著性,P<0.01表示差异极显著,P<0.001表示差异具有高度统计学意义。
2. 结果与分析
2.1 不同醇沉多糖组分中总糖、还原糖含量
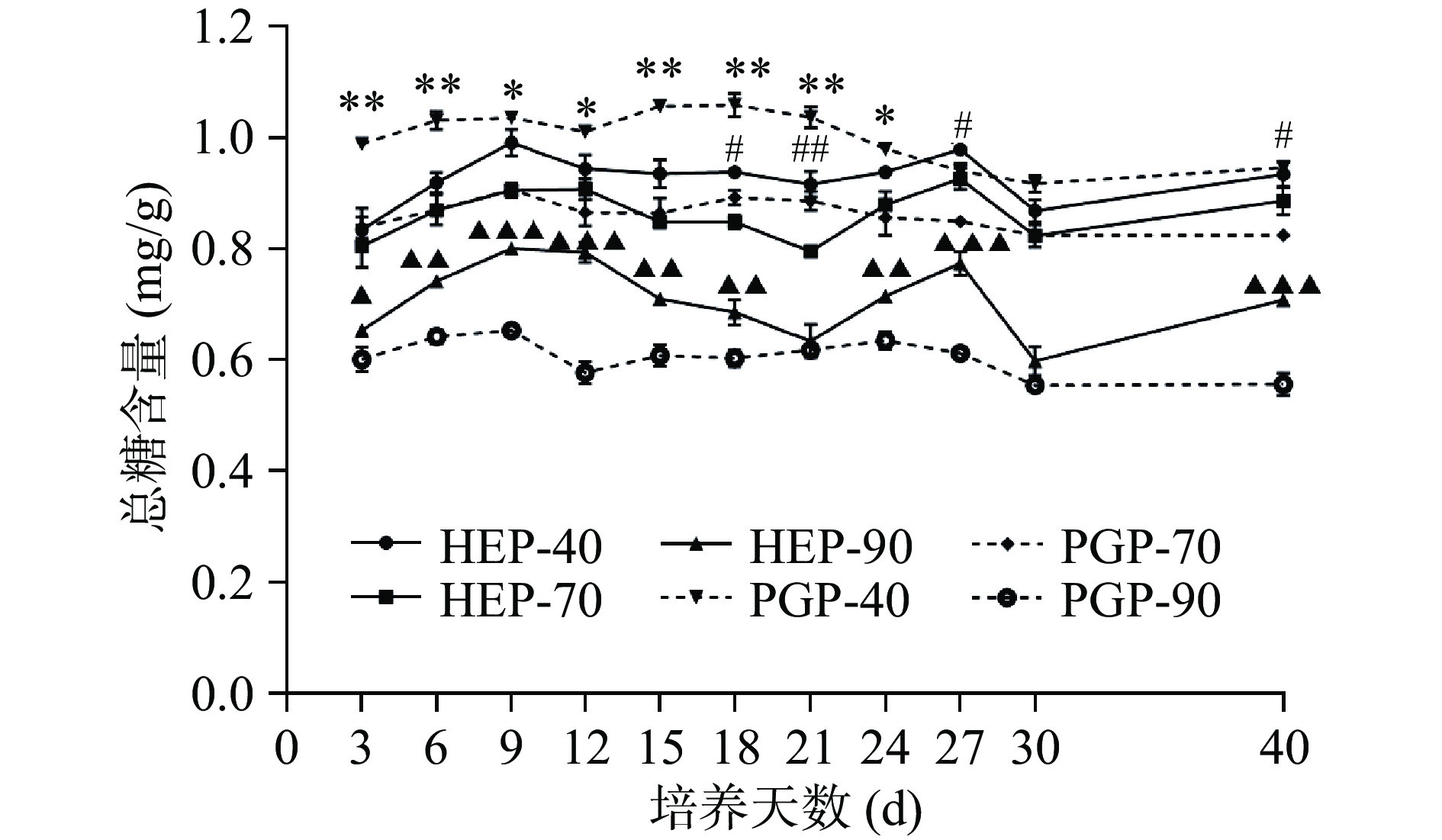
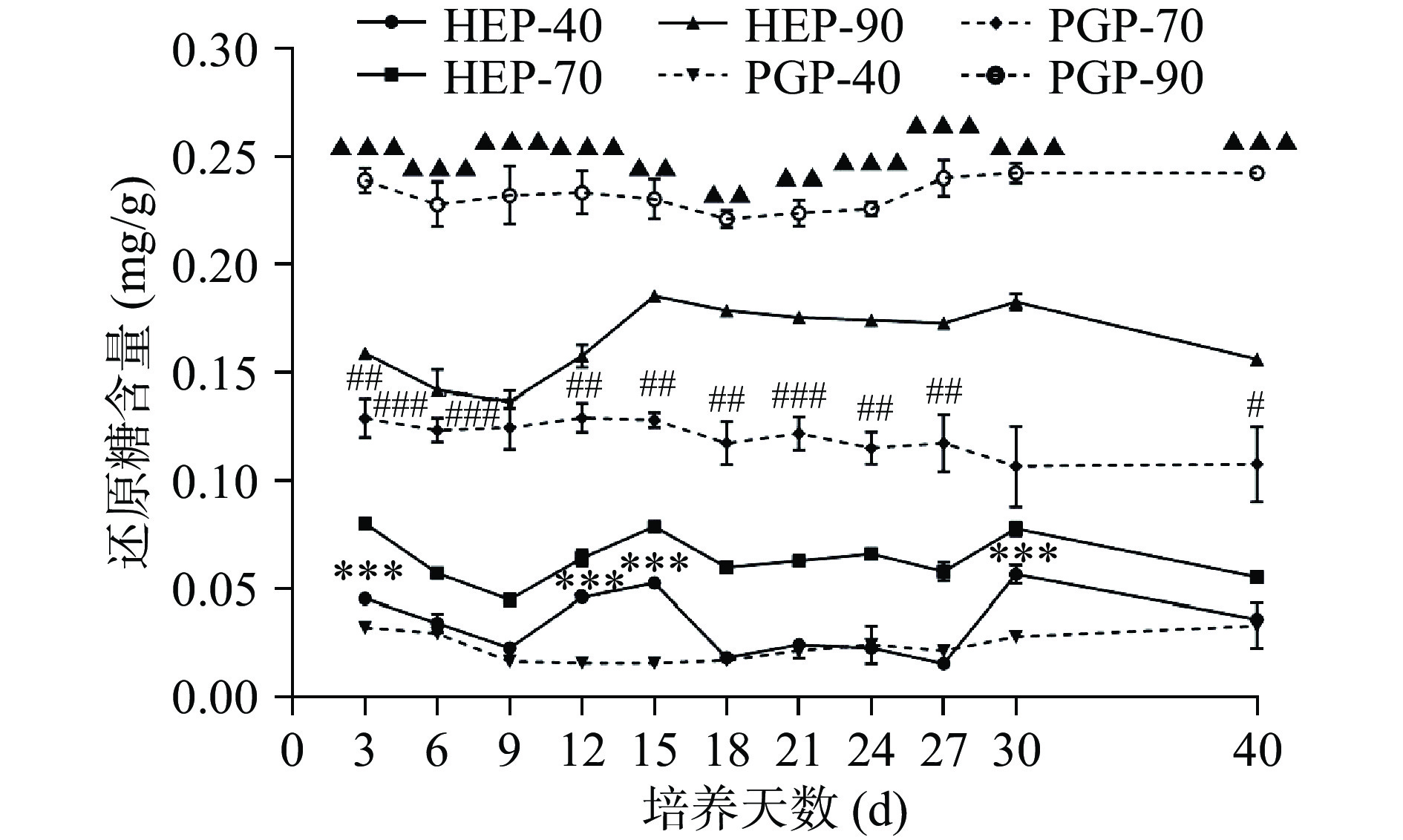
通过图1、图2可知,随乙醇浓度增加,总糖含量下降,还原糖含量上升。即HEP-40和PGP-40中总糖含量最高。还原糖含量变化趋势与总糖含量变化趋势相反,即HEP-90和PGP-90中还原糖含量最高。随发酵时间延长,菌质多糖组分中总糖含量呈现出缓慢上升下降、再上升再下降的过程。其中,总糖含量在第9 d峰值,HEP-40可达0.98 mg/g,HEP-70可达0.93 mg/g,HEP-90可达0.77 mg/g,PGP-40可达1.03 mg/g,PGP-70可达0.90 mg/g,PGP-90可达0.65 mg/g。由数据可知,与PGP-40、PGP-70、PGP-90的含量相比,HEP-40、HEP-70、HEP-90的含量分别下降了4.85%、上升了3.33%和18.46%。HEP-40与PGP-40组分中的总糖含量在发酵前期呈现了显著差异(P<0.05);HEP-70与PGP-70组分中的总糖含量在发酵第18、21、27、40 d时呈现了显著差异(P<0.05);在发酵第9、12、27、40 d时,HEP-90与PGP-90组分中的总糖含量具有高度显著差异(P<0.001)。
![]() 图 1 不同醇沉多糖组分中总糖含量测定注:*、**、***分别表示HEP-40组分与PGP-40组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);#、##、###分别表示HEP-70组分与PGP-70组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);▲、▲▲、▲▲▲分别表示HEP-90组分与PGP-90组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001),图2~图6同。Figure 1. Determination of total sugar content in different alcohol precipitation polysaccharide components
图 1 不同醇沉多糖组分中总糖含量测定注:*、**、***分别表示HEP-40组分与PGP-40组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);#、##、###分别表示HEP-70组分与PGP-70组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);▲、▲▲、▲▲▲分别表示HEP-90组分与PGP-90组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001),图2~图6同。Figure 1. Determination of total sugar content in different alcohol precipitation polysaccharide componentsHEP-40、HEP-70与HEP-90组分还原糖的含量在第 9~15 d,第 27~30 d 呈上升趋势,第 30~40 d呈下降趋势。HEP-40与PGP-40组分中的还原糖含量仅在发酵第3、12、15、30 d时呈现了高度显著性差异(P<0.001);HEP-70与PGP-70组分中的还原糖含量在发酵前期差异极显著(P<0.01);在整个发酵过程中,HEP-90与PGP-90组分中的还原糖含量均呈现了极显著差异(P<0.01)。当发酵至第30 d时,HEP-40可达0.06 mg/g,HEP-70可达0.08 mg/g,HEP-90可达0.18 mg/g,PGP-40可达0.03 mg/g,PGP-70可达0.11 mg/g,PGP-90可达0.24 mg/g。对比PGP-40、PGP-70、PGP-90的含量,HEP-40、HEP-70、HEP-90的还原糖含量分别上升了100%、下降了27.27%和25%。对比HEP与PGP组分总糖与还原糖含量变化可以发现,菌质发酵使得人参基质中的还原糖及总糖含量呈现动态变化,且40%醇沉组分表现为还原糖含量升高,而70%与90%醇沉组分表现为还原糖含量降低。而总糖变化趋势与之相反。
2.2 不同醇沉多糖组分中蛋白质含量
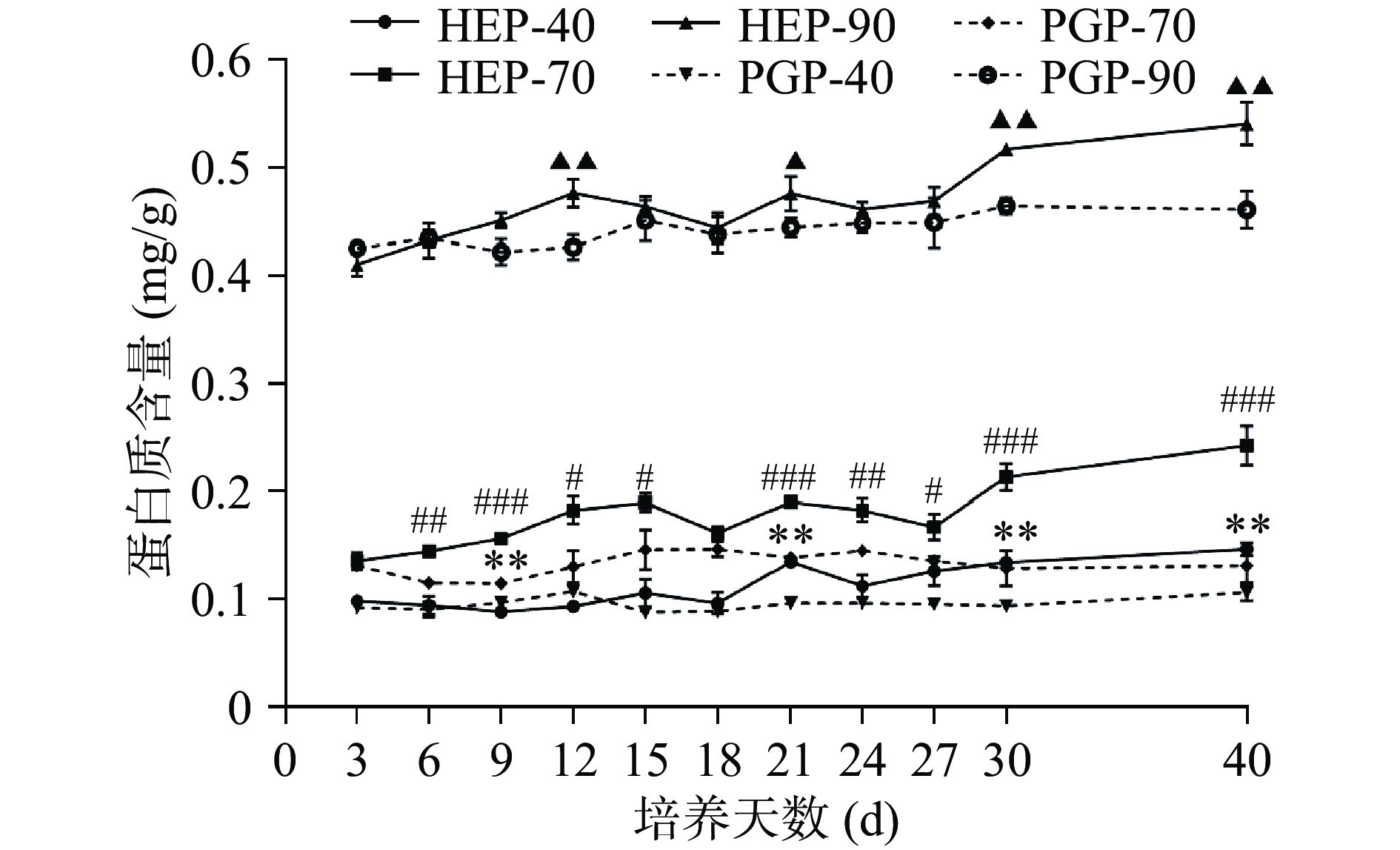
不同醇沉多糖组分中蛋白质含量测定结果如下图3所示,结果表明蛋白质主要集中在90%醇沉组分中,其次是70%醇沉组分和40%醇沉组分。HEP-40与PGP-40组分中的蛋白质含量在发酵第9、21、30、40 d时差异极显著(P<0.01);HEP-70与PGP-70组分中的蛋白质含量在发酵第9、21、30、40 d时差异高度显著(P<0.001);在发酵第12、30、40 d时,HEP-90与PGP-90组分中的蛋白质含量均呈现了极显著差异(P<0.01)。由蛋白质含量变化特征表明,当发酵至第12~15 d时,蛋白质含量均处于第一个上升期,发酵至第21 d左右时,各醇沉组分均达到第二个小幅度的上升期。当发酵至40 d时,菌质组蛋白质含量达到峰值,HEP-40、HEP-70、HEP-90分别可达0.15、0.24、0.54 mg/g,PGP-40、PGP-70、PGP-90分别可达0.11、0.13、0.46 mg/g。对比PGP-40、PGP-70、PGP-90的含量,HEP-40、HEP-70、HEP-90的含量分别上升了36.36%、84.62%、17.39%。通过以上数据可知,发酵后菌质组中的蛋白质含量明显提高,且与PGP-70相比,HEP-70中蛋白质的含量相对较高。
2.3 不同醇沉多糖组分的抗氧化活性测定结果
2.3.1 DPPH自由基清除率
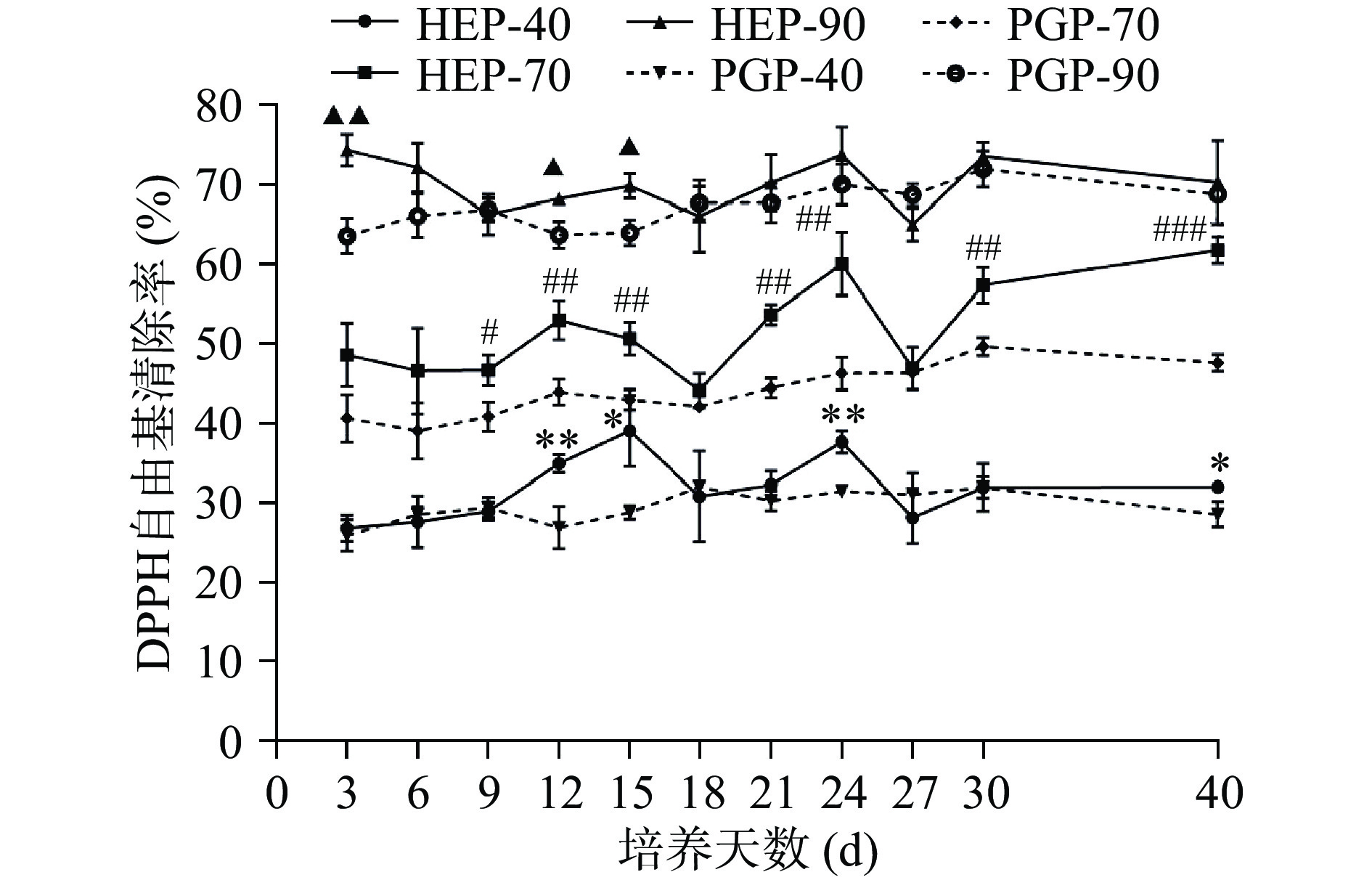
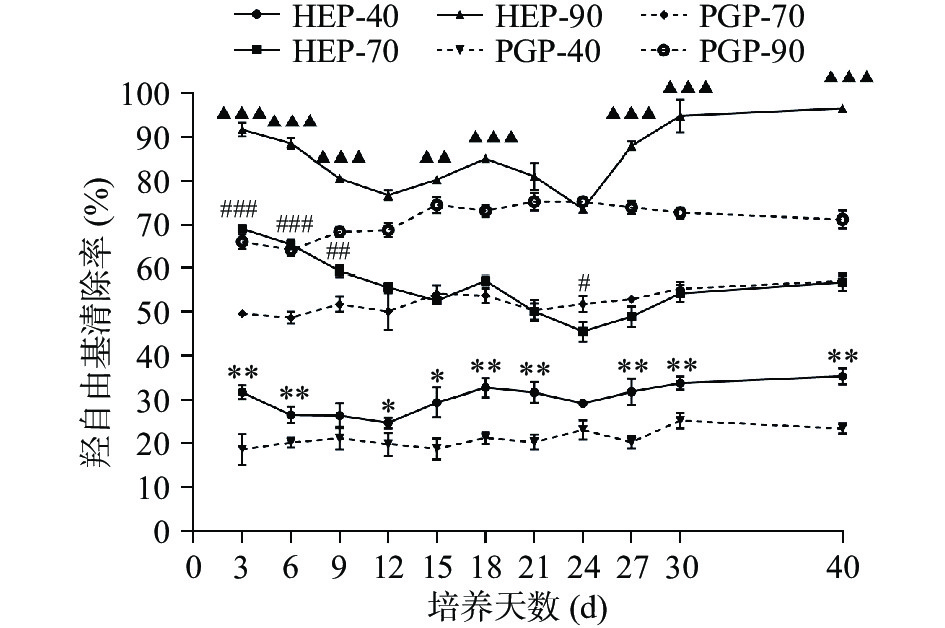
不同醇沉多糖组分对DPPH自由基的清除率测定结果如下图4所示,随醇沉浓度的增加,各醇沉组分的DPPH自由基的清除活性由高到低为90%醇沉组分>70%醇沉组分>40%醇沉组分。对比PGP组,HEP组对DPPH自由基的清除能力更强,HEP组各醇沉组分在发酵至第24 d时对DPPH自由基的清除能力均有较好的效果,HEP-40、HEP-70、HEP-90的清除率分别为37.66%、60.06%、73.58%,与PGP-40、PGP-70、PGP-90相比,分别增长了16.46%、23.08%、5.11%。HEP-40与PGP-40组分的DPPH自由基清除率在发酵第12、24 d时差异极显著(P<0.01);HEP-70与PGP-70组分的DPPH自由基清除率在发酵第40 d时差异高度显著(P<0.001);在发酵第3 d时,HEP-90与PGP-90组分的DPPH自由基清除率呈现了极显著差异(P<0.01)。
2.3.2 羟自由基清除率
HEP组及PGP组对羟自由基的清除率测定结果如下图5所示。由图可知,各不同醇沉组分的清除能力高低为90%醇沉组分>70%醇沉组分>40%醇沉组分。HEP-40与PGP-40组分的羟自由基清除率在发酵第3、6、18、21、27、30、40 d时差异极显著(P<0.01);HEP-70与PGP-70组分的羟自由基清除率在发酵第3 d及第6 d时差异高度显著(P<0.001);在发酵第3、6、9、18、27、30、40 d时,HEP-90与PGP-90组分的羟自由基清除率差异高度显著(P<0.001)。通过对比HEP组的羟自由基清除率发现,发酵至12~18 d、24~30 d时为HEP组清除能力的上升期。当发酵至第40 d时,HEP-40、HEP-70、HEP-90的清除率分别为33.71%、54.32%、94.90%,与PGP-40、PGP-70、PGP-90相比,各醇沉组分对羟自由基清除率分别增加了50.70%、1.05%、35.80%。
2.3.3 ABTS自由基清除率
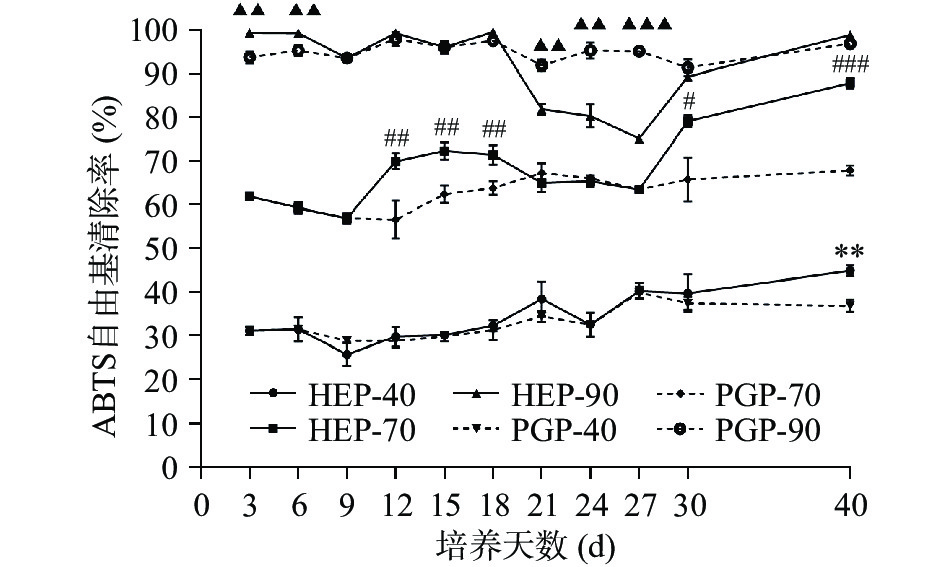
不同醇沉组分对ABTS自由基的清除率测定结果如下图6所示,各醇沉组分对ABTS自由基的清除能力为90%醇沉组分>70%醇沉组分>40%醇沉组分。对HEP组对ABTS自由基的清除率分析得知,当菌质发酵至第12~18 d、第27~30 d时,为HEP组清除能力的上升期。当发酵至第40 d时,HEP组的清除能力达到峰值,HEP-40、HEP-70、HEP-90的清除率分别为44.83%、87.90%、98.90%,与PGP-40、PGP-70、PGP-90相比,各醇沉组分对ABTS自由基的清除率分别增加了21.72%、29.46%、2.06%。HEP-40 与 PGP-40 组分的 ABTS 自由基清除率在发酵第40 d时差异极显著(P<0.01);HEP-70与PGP-70组分的ABTS自由基清除率在发酵第40 d时差异高度显著(P<0.001);在发酵第27 d时,HEP-90与PGP-90组分的ABTS自由基清除率差异高度显著(P<0.001)。
3. 讨论与结论
猴头菌与人参多糖均具有降血糖、保肝护胃、抗氧化、抗肿瘤等功能,本文初探了菌质不同醇沉组分的活性变化[36-38]。通过对PGP组和HEP 组进行分级醇沉,得到了不同发酵时期的PGP-40、PGP-70、PGP-90和HEP-40、HEP-70、HEP-90组分,测定了其总糖、还原糖、蛋白质的含量,以及ABTS自由基、羟自由基、DPPH自由基的清除率。
通过对比不同醇沉浓度下的多糖含量变化发现,40%醇沉组分中总糖含量最高,而还原糖、蛋白质则是90%醇沉组分中含量最高。除此以外,总糖及还原糖含量的周期变化趋势也有所差异。综合分析发现,经猴头菌发酵的90%醇沉组分与未经发酵的人参基质相较,总糖与蛋白质含量有所升高,而还原糖含量有所降低,这说明了猴头菌与人参双向固体发酵后,基质营养成分发生了改变,这种改变也使得其生物活性有所提升。对比各醇沉组分的自由基清除率发现,HEP组的抗氧化能力呈现先下降再上升、再下降再上升的变化趋势,且基本在发酵至40 d时,清除率达到峰值。对比HEP组与PGP组醇沉多糖,发现发酵后菌质抗氧化活性较对照组均有提高,说明猴头菌-人参双向发酵可提升人参活性成分的抗氧化活性,这可能是由于猴头菌在发酵过程中分泌出多种胞外酶及次生代谢产物,对人参基质中多糖侧链等产生了影响,使得抗氧化活性得以提升[39]。纵观整个发酵期,当菌质发酵至第12 d和第30 d左右时,其抗氧化能力均有一定幅度的上升趋势。对比各醇沉组分的清除率发现,同浓度下各醇沉组分对自由基的清除能力强弱为ABTS自由基>羟自由基>DPPH自由基。
通过本文的物质含量及抗氧化能力的数据表明,通过猴头菌与人参进行双向发酵后,菌质中的活性物质含量增高且活性增加。该结论与MRMA等[40]的研究结果一致,利用黑曲霉及和米曲霉对葡萄渣进行固态发酵,两种真菌都提高了提取物的活性物质含量及抗氧化活性。LIU等[41]选用灰树花真菌发酵脱脂米糠水提取物,并分析了发酵产物的抗氧化活性及其对NO产生的影响,发现发酵产物对羟基和DPPH自由基的清除率比未发酵产物显著提高,发酵至第9 d时NO的产生也显著提高。通过分析HEP组活性物质含量及抗氧化活性变化得知,猴头菌与人参进行双向发酵过程中,自身存在着生长发育的周期性。希望通过本文初步探索结果,总结不同发酵时期活性物质含量及活性的动态变化规律,为日后更好的开展相关实验工作提供理论背景,为充分挖掘猴头菌-人参固体双向发酵过程中更多药效物质的变化规律及药用价值奠定基础。同时,希望通过本文的实验结果,为同属药食同源的猴头菌与人参在保健食品的开发上提供良好的数据支撑。但本文仍存在不足,对菌质中药效活性物质的作用机理及药理活性研究的并不透彻,也希望通过未来的实验研究,加强对菌质中药效物质的探索,提高猴头菌与人参的商业价值。
-
图 1 不同醇沉多糖组分中总糖含量测定
注:*、**、***分别表示HEP-40组分与PGP-40组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);#、##、###分别表示HEP-70组分与PGP-70组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001);▲、▲▲、▲▲▲分别表示HEP-90组分与PGP-90组分含量或活性存在显著差异(P<0.05)、极显著差异(P<0.01)、高度显著差异(P<0.001),图2~图6同。
Figure 1. Determination of total sugar content in different alcohol precipitation polysaccharide components
-
[1] KIM K T, CHO D W, YANG M J, et al. Thirteen-week oral toxicity study of fermented ginseng, GBCK25, in sprague-dawley rats[J]. Regulatory Toxicology and Pharmacology,2020,118:104812. doi: 10.1016/j.yrtph.2020.104812
[2] GASECKA M, SIWULSKI M, MAGDZIAK Z, et al. The effect of drying temperature on bioactive compounds and antioxidant activity of Leccinum scabrum (Bull.) Gray and Hericium erinaceus (Bull.) Pers[J]. Journal of Food Science and Technology,2020,57(2):513−525. doi: 10.1007/s13197-019-04081-1
[3] LI Q Z, WU D, ZHOU S, et al. Structure elucidation of a bioactive polysaccharide from fruiting bodies of Hericium erinaceus in different maturation stages[J]. Carbohydrate Polymers,2016,144:196−204. doi: 10.1016/j.carbpol.2016.02.051
[4] LEE Y Y, KIM S D, PARKS C, et al. Panax ginseng: Inflammation, platelet aggregation, thrombus formation, and atherosclerosis crosstalk[J]. Journal of Ginseng Reasearch,2022,46(1):54−61. doi: 10.1016/j.jgr.2021.09.003
[5] IRFAN M, KWAK Y S, HAN C K, et al. Adaptogenic effects of Panax ginseng on modulation of cardiovascular functions[J]. Journal of Ginseng Reasearch,2020,44(4):538−543. doi: 10.1016/j.jgr.2020.03.001
[6] LIU S, LIU F B, WANG T T, et al. Polysaccharides extracted from Panax ginseng C. A. Mey enhance complement component 4 biosynthesis in human hepatocytes[J]. Frontiers in Pharmacology,2021,12:734394. doi: 10.3389/fphar.2021.734394
[7] PARK E K, SHIN Y W, LEE H U, et al. Inhibitory effect of ginsenoside Rb1 and compound K on NO and prostaglandin E2 biosyntheses of RAW 264.7 cells induced by lipopolysaccharide[J]. Biological and Pharmaceutical Bulletin,2005,28(4):652−656. doi: 10.1248/bpb.28.652
[8] 李相鹏, 王鹏, 李英霞. 原人参二醇型皂苷活性代谢物Compound K药理活性的研究进展[J]. 中国药理学与毒理学杂志,2011(1):97−101. [LI X P, WANG P, LI Y X. Progress in pharmacological actions of ginsenoside Compound K, an active metabolite of protopanaxadiol type saponins[J]. Chinese Journal of Pharmacology and Toxicology,2011(1):97−101. doi: 10.3867/j.issn.1000-3002.2011.01.019 [9] INDRASTUTI Y E, ESTIASIH T, CHRISTANTI R A, et al. Microbial and some chemical constituent changes of high cyanide cassava during simultant spontaneous submerged and solid state fermentation of "gadunganpohung"[J]. International Food Research Journal,2018,25(2):487−498.
[10] LIU Z, TANG Y, ZHOU R, et al. Bi-directional solid fermentation products of Trametes robiniophila Murr with Radix Isatidis inhibit proliferation and metastasis of breast cancer cells[J]. Journal of the Chinese Medical Association,2018,81(6):520−530. doi: 10.1016/j.jcma.2017.12.003
[11] HIROYUKI F, TARO U, NOBUYA M, et al. Pharmacokinetic study of compound K in Japanese subjects after ingestion of panax ginseng fermented by Lactobacillus paracasei A221 reveals significant increase of absorption into blood[J]. Journal of Medicinal Food,2018,22(3):257−263.
[12] 乔梦丹, 刘尚, 张琰, 等. 基于UPLC-Q-Orbitrap MS/MS研究人参皂苷在发酵过程中的生物转化[J]. 高等学校化学学报,2018,39(2):219−225. [QIAO M D, LIU S, ZHANG Y, et al. Biotransformation of ginsenosides in fermented ginseng using UPLC-Q-Orbitrap MS/MS[J]. Chemical Research in Chinese Universities,2018,39(2):219−225. doi: 10.7503/cjcu20170385 [13] AI Z Y, YOU Y, LI W C, et al. Enhanced uronic acid content, antioxidant, and anti-inflammatory activities of polysaccharides from ginseng fermented by Saccharomyces cerevisiae GIW-1[J]. Journal of Food Processing and Preservation,2020,44(11):14885−14893.
[14] KIM Y J, YAMABE N, CHOI P, et al. Efficient thermal deglycosylation of ginsenoside Rd and its contribution to the improved anticancer activity of ginseng[J]. Journal of Agricultural and Food Chemistry,2013,61(38):9185−9191. doi: 10.1021/jf402774d
[15] 朱蕴兰, 陈宏伟, 陈安徽, 等. 蛹拟青霉-金针菇菇柄双向固体发酵条件及抗氧化活性J]. 食品科技, 2019, 44(6): 30-38. [ZHU Y L, CHEN H W, CHEN A H, et al. Condition of bidirectional solid-state fermentation of Paecilomyces militaris and Flammulina velutipes of waste stalk and antioxidant activity[J]. Food Science and Technology,2019,44(6):30−38. [16] 刘明明, 雷志华, 黄苏静, 等. 香菇与猴头菇菌种对2种小麦基质固体发酵菌质营养的影响[J]. 贵州农业科学,2019,47(1):74−78. [LIU M M, LEI Z H, HUANG S J, et al. Effects of Lentinula edodes and Hericium erinaceus on nutritional in fungal substance of substrate solid fermentation of two wheat varieties[J]. Guizhou Agricultural Sciences,2019,47(1):74−78. doi: 10.3969/j.issn.1001-3601.2019.01.015 [17] 盛悦. 猴头菌生物转化玉米蛋白粉发酵产物中多糖的分离及活性研究[D]. 长春: 吉林农业大学, 2017 SHENG Y. Study on the separation and activity evaluation of polysaccharides from the fermentation products of Hericium erinaceus[D]. Changchun: Jilin Agricultural University, 2017.
[18] NAKHJAVANI M, SMITH E, TOWNSEND A R, et al. Anti-angiogenic properties of ginsenoside Rg3[J]. Molecules,2020,25(21):4905. doi: 10.3390/molecules25214905
[19] PARK J S, SHIN J A, JUNG J S, et al. Anti-inflammatory mechanism of compound K in activated microglia and its neuroprotective effect on experimental stroke in mice[J]. Journal of Pharmacology and Experimental Therapeutics,2012,341(1):59−67. doi: 10.1124/jpet.111.189035
[20] REN S M, LIU R Q, WANG Y J, et al. Synthesis and biological evaluation of ginsenoside compound K analogues as a novel class of anti-asthmatic agents[J]. Bioorganic & Medicinal Chemistry Letters,2019,29(1):51−55.
[21] DAI L H, LIU C, LI J, et al. One-pot synthesis of ginsenoside Rh2 and bioactive unnatural ginsenoside by coupling promiscuous glycosyltransferase from Bacillus subtilis 168 to sucrose synthase[J]. Journal of Agricultural and Food Chemistry,2018,66(11):2830−2837. doi: 10.1021/acs.jafc.8b00597
[22] HWANG S H, SHIN T J, CHOI S H, et al. Gintonin, newly identified compounds from ginseng, is novel lysophosphatidic acids-protein complexes and activates G protein-coupled lysophosphatidic acid receptors with high affinity[J]. Molecules & Cells,2012,33(2):151−162.
[23] 李万丛, 艾芷伊, 游颖, 等. 酿酒酵母CCTCC M2016373发酵对人参多糖组分及抗氧化能力的影响[J]. 食品科技,2019,44(8):1−5. [LI W C, AI Z Y, YOU Y, et al. Effects of Saccharomyces cerevisiae CCTCC M2016373 fermentation on the composition and antioxidant capacity of ginseng polysaccharides[J]. Food Science and Technology,2019,44(8):1−5. [24] WANG N, WANG X L, HE M J, et al. Ginseng polysaccharides: A potential neuroprotective agent[J]. Journal of Ginseng Research,2021,45(2):211−217. doi: 10.1016/j.jgr.2020.09.002
[25] 秦培鹏, 刘涛. 猴头菌多糖热水浸提工艺研究[J]. 安徽农业科学,2014,42(9):4784−4786. [QIN P P, LIU T. Study on hot water extraction technology of Hericium erinaceus polysaccharide[J]. Journal of Anhui Agricultural Sciences,2014,42(9):4784−4786. doi: 10.3969/j.issn.0517-6611.2014.15.083 [26] YAN J K, DING Z C, LI D X, et al. Comparative study of physicochemical properties and bioactivity of Hericium erinaceus polysaccharides at different solvent extractions[J]. Carbohydrate Polymers,2018,193(1):373−382.
[27] 张新超, 郭丽琼, 林俊芳, 等. 猴头菌固体发酵基质的抗氧化活性成分研究[J]. 食品与机械,2011,27(4):43−47. [ZHANG X C, GUO L Q, LIN J F, et al. Study on antioxidant components of Hericium erinaceus solid fermentation substrate[J]. Food & Machinery,2011,27(4):43−47. doi: 10.3969/j.issn.1003-5788.2011.04.011 [28] 张蕊多. 刺五加—灵芝双向发酵菌质的制备及其主要活性成分的液质联用分析[D]. 长春: 长春中医药大学, 2019 ZHANG R D. Preparation of Acanthopanax senticosus-Ganoderma lucidum bidirectional fermentation product and analysis on its mainactive components by LC-MS[D]. Changchun: Changchun University of Chinese Medicine, 2019.
[29] DU B M, GILLES KA, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[30] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技,2013,34(18):75−77. [LI H, LU J P, WANG D J, et al. Study on determination of reducing sugar from haw flakes with DNS colorimetry method[J]. Science and Technology of Food Industry,2013,34(18):75−77. doi: 10.13386/j.issn1002-0306.2013.18.043 [31] ATHERTON B A, CUNNINGHAM E L, SPLITTGERBER A G, et al. A mathematical model for the description of the Coomassie brilliant blue protein assay[J]. Analytical Biochemistry,1996,233(2):160−168. doi: 10.1006/abio.1996.0024
[32] MOHANAN A, NICKERSON M T, GHOSH S. Oxidative stability of flaxseed oil: Effect of hydrophilic, hydrophobic and intermediate polarity antioxidants[J]. Food Chemistry,2018,266:524−533. doi: 10.1016/j.foodchem.2018.05.117
[33] JING Y S, ZHU J H, LIU T, et al. Structural characterization and biological activities of a novel polysaccharide from cultured Cordyceps militaris and its sulfated derivative[J]. Journal of Agricultural and Food Chemistry,2015,63(13):3464−3471. doi: 10.1021/jf505915t
[34] CHEN B J, SHI M J, CUI S, et al. Improved antioxidant and anti-tyrosinase activity of polysaccharide from Sargassum fusiforme by degradation[J]. International Journal of Biological Macromolecules,2016,92:715−722. doi: 10.1016/j.ijbiomac.2016.07.082
[35] ZOU Y, HUANG Y X, ZHU L R, et al. Multi-wavelength spectrophotometric measurement of persulfates using 2, 2′-azino-bis (3-ethylbenzothiazoline-6-sulfonate) (ABTS) as indicator[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2019,216:214−220. doi: 10.1016/j.saa.2019.03.019
[36] HE X R, WANG X X, FANG J C, et al. Structures, biological activities, and industrial applications of the polysaccharides from Hericium erinaceus (Lion’s Mane) mushroom: A review[J]. International Journal of Biological Macromolecules Molecular Sciences,2017,97:228−237. doi: 10.1016/j.ijbiomac.2017.01.040
[37] 万宁威, 雷帮星, 何劲, 等. 猴头菌液体发酵产多糖、核苷、萜类工艺优化及其抗氧化活性[J]. 食品工业科技,2022,43(2):233−240. [WAN N W, LEI B X, HE J, et al. Optimization and antioxidant analysis of liquid fermentation production of polysaccharides, nucleosides and terpenes from Hericium erinaceus[J]. Science and Technology of Food Industry,2022,43(2):233−240. doi: 10.13386/j.issn1002-0306.2021050138 [38] 杨永刚, 王丹丹, 张艳秋, 等. 猴头菌多糖对溃疡性结肠炎模型大鼠肠道短链脂肪酸含量的影响[J]. 中国药房,2019,30(20):2763−2767. [YANG Y G, WANG D D, ZHANG Y Q, et al. Effects of Hericium erinaceus polysaccharide on the content of short-chain fatty acids in the intestine of ulcerative colitis model rats[J]. China Pharmacy,2019,30(20):2763−2767. [39] 米合热尼沙·阿木热江, 阿合买提江·吐尔逊, 杨飞, 等. 不同乙醇浓度醇沉对库尔勒香梨多糖含量及红外表征的影响[J]. 新疆医科大学学报,2022,45(8):886−889, 895. [MIHERENISHA A, AHEMAITIJIANG T, YANG F, et al. Effects of alcohol precipitation with different ethanol concentration on polysaccharide content of Pyrus sinkiangensis Yü and its infrared characterization[J]. Journal of Xinjiang Medical University,2022,45(8):886−889, 895. doi: 10.3969/j.issn.1009-5551.2022.08.014 [40] MRMA B, IC C, CSG A, et al. Production of grape pomace extracts with enhanced antioxidant and prebiotic activities through solid-state fermentation by Aspergillus niger and Aspergillus oryzae[J]. Food Bioscience,2021,42:101168. doi: 10.1016/j.fbio.2021.101168
[41] LIU Q, CAO X, ZHUANG X, et al. Rice bran polysaccharides and oligosaccharides modified by Grifola frondosa fermentation: Antioxidant activities and effects on the production of NO[J]. Food Chemistry,2017,223(15):49−53.
-
期刊类型引用(17)
1. 张根,陈宝锐,潘璐璐,王慧,杨波,卜钦鹏. 农产品抗生素残留现状及快速检测方法研究进展. 应用生态学报. 2024(05): 1408-1418 .  百度学术
百度学术
2. 张波,郭二菱,黄笑晨,郭爱静,王可. 豆粉中31种杀菌剂残留的UPLC-MS/MS测定法. 职业与健康. 2024(12): 1590-1595 .  百度学术
百度学术
3. 舒达,江敏,吴昊,王凌宇,李昊霖. 改良QuEChERs法联合超高效液相色谱-质谱法测定水产养殖池塘底泥中8种抗生素残留. 分析试验室. 2024(08): 1139-1145 .  百度学术
百度学术
4. 杨飘飘,张静雅,刘红,李丽霞. 高效液相色谱-串联质谱法测定化妆品中禁用磺胺和喹诺酮类化合物. 日用化学工业(中英文). 2024(08): 997-1007 .  百度学术
百度学术
5. 王宁,粟有志,阿斯喀·夏热甫汉,雷红琴,李艳美,李芳,王兴磊. QuEChERS净化-高效液相色谱-串联质谱法同时测定动物尿液中16种磺胺类和6种大环内酯类抗生素的残留量. 理化检验-化学分册. 2024(08): 802-809 .  百度学术
百度学术
6. 魏宁果,贾亦森,范芳芳,吴坤. 基于QuEChERS原则的样品处理技术在动物源性食品兽药残留分析中的应用. 化学分析计量. 2024(09): 124-132 .  百度学术
百度学术
7. 张晓艺,郑三燕,张秀尧,李瑞芬,杨舒然. 超高效液相色谱-三重四级杆质谱联用-内标法对豆芽中抗生素的测定. 上海预防医学. 2024(11): 1100-1105 .  百度学术
百度学术
8. 潘永波,万娜,王承业,邹冬梅. 快速滤过型净化结合液相色谱-质谱联用法测定海产品中19种磺胺类药物残留. 食品工业科技. 2023(07): 320-328 .  本站查看
本站查看
9. 孙德军. 畜产品中磺胺类药物残留危害及检测技术的研究进展. 饲料工业. 2023(09): 73-80 .  百度学术
百度学术
10. 邱启全,李美玲,孙悦. 微流控芯片联用高效液相色谱-荧光检测器同时测定肉类食品中4种磺胺类药物残留. 食品安全质量检测学报. 2023(09): 202-211 .  百度学术
百度学术
11. 谷悦,唐会鑫,李朔,马玲,王可,杨莉丽. QuEChERS-超高效液相色谱-三重四极杆串联质谱法测定水果制品和肉酱中10种四环素类抗生素. 食品工业科技. 2023(18): 313-320 .  本站查看
本站查看
12. 马思琪,张敏,张世卓,崔圣宇,邵杰,王洋,孙辑凯,张宏莲. 食用鱼中残留的2种磺胺类成分TLC-SERS检测方法的建立. 中国食品工业. 2023(19): 63-65 .  百度学术
百度学术
13. 邵丽,王晓,张伟,徐淑飞. QuEChERS方法应用研究进展. 安徽农业科学. 2023(24): 9-18 .  百度学术
百度学术
14. 苏敏,吴彦蕾,邓惠玲,董宪兵,陈欣,黄大亮,周纯洁. QuEChERS-LC-MS/MS法快速检测鱼肉中54种兽药残留. 食品与发酵科技. 2023(06): 135-141 .  百度学术
百度学术
15. 张慧芳,孙文. 高效液相色谱-串联质谱法测定牛奶中9种磺胺类药物残留不确定度的评定. 食品安全导刊. 2022(26): 92-94 .  百度学术
百度学术
16. 洪妍妍,陈海玲,王翠玲,余艳明,王敏杰,李宝珠,庄春红. 样品前处理QuEChERS法及新型吸附材料在水产品中抗生素残留分析中的应用进展. 食品安全质量检测学报. 2022(21): 6898-6906 .  百度学术
百度学术
17. 高云慨,陈小妹,陈春泉,肖璇,郑金明,尹青春. HPLC-MS/MS法测定罗非鱼中4种四环素类抗生素残留量及不确定度评定. 食品安全导刊. 2022(32): 97-101+105 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:
 下载:
下载:



