Optimization of Enzymatic Hydrolysis Process of Pueraria Protein by Response Surface Methodology and Its Antioxidant Properties in Vitro
-
摘要: 目的:优化葛根蛋白酶解工艺并研究其抗氧化特性。方法:以DPPH自由基清除能力、水解度(DH)为评价指标,结合SDS-PAGE电泳结果,筛选最佳水解蛋白酶;在单因素实验基础上,利用Box-Behnken响应面法优化葛根蛋白酶解工艺,并对最佳葛根蛋白酶解物进行抗氧化特性研究。结果:葛根蛋白酶解最佳工艺条件为:酶解温度55 ℃、pH9、酶底比2%,该条件下制备的葛根蛋白酶解物清除DPPH自由基、ABTS+自由基、OH自由基的IC50值分别为0.15、0.38、1.41 mg/mL,还原能力为0.553。结论:该条件下制备的葛根蛋白酶解物具有较好的抗氧化特性。
-
关键词:
- 葛根蛋白 /
- Box-Behnken响应面法 /
- 酶解工艺 /
- 抗氧化特性
Abstract: Objective: To optimize the enzymatic hydrolysis process of Pueraria protein and study its antioxidant properties. Methods: DPPH radical scavenging ability and DH were used as the index to screen the best hydrolytic protease. Base on the single factor experiments, the Box-Behnken response surface design was used to optimize the enzymatic hydrolysis process of Pueraria protein, and the antioxidant properties of the optimum hydrolysate in vitro was analyzed. Results: The optimal hydrolysis conditions for alkaline protease were as follows: Temperature 55 ℃, pH9 and enzyme substrate ratio 2%. Under these conditions, the IC50 of DPPH·, ABTS+·, and ·OH radicals were 0.15, 0.38, 1.41 mg/mL and a reduction capacity of 0.553. Conclusion: Under these conditions, Pueraria protein hydrolysate had remarkable antioxidant properties. -
葛根为多年生豆科植物野葛Pueraria lobata(Willd).Ohwi或甘葛藤的干燥块根,习称野葛,始载于《神农本草经》,列为中品[1]。目前报道的葛根化学成分主要有异黄酮类、三萜类、皂苷类、生物碱类、香豆素类和多糖类等成分[2-3],在保护心肌[4]、解酒保肝[5]、降血脂[6]、降血糖[7]和抗氧化等方面具有显著的药用价值。此外,葛根中还含有淀粉、膳食纤维、矿物元素等营养成分,以及多种人体必需氨基酸,尤其是人体不能合成的必需氨基酸含量更高[8]。
细胞的氧化代谢会产生自由基,过量的自由基会使细胞和组织发生损伤,还会引起多种疾病如心血管疾病、糖尿病、癌症等。因此,食源性抗氧化肽作为一类天然抗氧化活性物质受到国内外学者的广泛关注[9]。葛根蛋白作为一种食源性蛋白属于豆科植物蛋白,具有脂肪少、胆固醇低等优点[10]。现代营养学研究认为,由于蛋白质具有分子量大结构复杂的特点,当摄入人体后难以发挥其营养价值和生理功能[11]。因此对蛋白进行水解,降低蛋白分子量提高其活性成为了研究热点,蛋白酶解是目前生产蛋白质水解物的主要途径[12]。蛋白质通过酶解可以生成多种生物活性肽,能够很好地改善蛋白质的功能性质及生物活性[13]。通过查阅文献可知,目前对葛根的研究主要集中在黄酮类成分及葛根蛋白的研究,而未见其对葛根蛋白酶解物的研究。
因此,在本课题组前期对葛根蛋白研究的基础上,以葛根蛋白为原料,采用单因素实验,结合响应面分析方法对葛根蛋白酶解物的酶解条件进行优化,将最佳条件下所得酶解物进行抗氧化特性研究,为葛根蛋白的深入开发利用提供一定理论基础。
1. 材料与方法
1.1 材料与仪器
葛根药材 北京本草方源药业集团有限公司;碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、中性蛋白酶(100 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(300 U/mg) 上海源叶生物科技有限公司。
OSB-2100油浴锅 上海爱朗仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 上海豫康科教仪器设备有限公司;PB-10赛多利斯台式数显酸度计 上海诺萱科学仪器有限公司;5804R低温离心机 美国贝克曼库尔特有限公司;DRC-2L冷冻干燥机 北崎国际贸易有限公司;K9840自动凯氏定氮仪 济南海能仪器股份有限公司;Mini-PROTEAN Tetra Cell Bio-rad蛋白电泳仪 美国Bio-rad公司。
1.2 实验方法
1.2.1 葛根蛋白的制备
取适量葛根药材,按照料液比1:20(g/mL)的比例加入蒸馏水,搅拌均匀,用1.0 mol/L NaOH调节pH至10.0,于45 ℃水浴锅中反应2 h,冷却至室温,4000 r/min离心,取上清,用1.0 mol/L的HCl调pH至3.5,沉淀复融后透析48 h,冷冻干燥[14]。
1.2.2 最适蛋白酶筛选
称取5份质量相同的葛根蛋白用蒸馏水配制成底物浓度为2%的溶液,按照酶底比为1%的比例,分别加入不同蛋白酶,然后在各自最适温度和 pH条件下(详见表1),酶解3 h。酶解后立即于100 ℃水浴中灭酶10 min,冷却后调节pH至中性,于4 ℃下8000 r/min离心15 min,取上清液[15]。以DPPH自由基清除率为评价指标,同时结合水解度、SDS-PAGE电泳,筛选出最适合葛根蛋白酶解的蛋白酶。
表 1 5种蛋白酶的最适酶解条件Table 1. Optimum enzymatic hydrolysis conditions of five proteases蛋白酶种类 温度(℃) pH 碱性蛋白酶 55 8.5 中性蛋白酶 50 7 木瓜蛋白酶 65 6.5 胰蛋白酶 45 8.0 胃蛋白酶 37 1.5 1.2.3 葛根蛋白酶解工艺的单因素实验
以DPPH自由基清除率和水解度为评价指标,对筛选出的最适蛋白酶进行单因素实验,研究各因素对葛根蛋白酶解过程的影响,固定酶解温度55 ℃,酶解时间3 h,底物浓度2%,酶底比1%,酶解pH8.5进行实验。各变量因素水平分别设定为酶解温度(35、45、55、65、75、85 ℃)、酶底比(0.5%、1%、1.5%、2%、2.5%、3%)、pH(6.5、7.5、8.5、9.5、10.5)、酶解时间(1、2、3、4、5 h)、底物浓度(1%、2%、3%、4%、5%),各组试验均重复3次。
1.2.4 葛根蛋白酶解工艺的响应面法优化试验
在单因素实验结果的基础上,进行3因素3水平Box-Behnken响应面试验设计,因素水平表见表2,以DPPH自由基清除率为响应值,优化葛根蛋白最佳酶解工艺,并进行试验验证。
表 2 Box-Behnken响应面试验因素水平设计Table 2. Factors and levels of Box-Behnken response surface test水平 因素 A酶解温度(℃) B酶解pH C酶底比(%) 1 45 7.5 1.5 0 55 8.5 2 −1 65 9.5 2.5 1.2.5 指标测定
1.2.5.1 水解度测定
采用凯氏定氮法来测定葛根蛋白中总氮含量;采用酸度计法来测定酶解液中氨基态氮的含量,水解度计算公式如下:
式中:DH:水解度(%);m1:样品质量(g);m2:样品总氮质量(g);V1:样品稀释液加入甲醛后pH调至9.2时消耗NaOH的体积(mL);V2:空白试验加入甲醛后pH调至9.2时消耗NaOH的体积(mL);c:NaOH的浓度(mol/L);V3:样品稀释液的取用量(mL);V4:样品稀释液的定容体积(mL)。
1.2.5.2 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
根据文献[16]修改如下:分离胶与浓缩胶的浓度分别为12%、5%,Marker上样量为5 μL,葛根蛋白酶解物样品上样量为15 μL。电泳条件:浓缩胶电压70 mV,时间30 min;分离胶电压140 mV,时间50 min。电泳结束后,采用考马斯亮蓝R250染色40 min,脱色,Invitrogen iBright FL 1000扫描成像。
1.2.6 葛根蛋白酶解物的体外抗氧化特性试验
1.2.6.1 DPPH自由基清除能力测定
根据文献[17]修改如下:将配制好的葛根酶解物溶液2 mL加入到2 mL 0.004%的DPPH溶液中,涡旋后,放置暗室反应30 min,于517 nm处进行测定,得到吸光度值A1;以2 mL乙醇代替DPPH溶液作为样品对照,测定得吸光度值A2;以2 mL蒸馏水代替样品液作为空白对照,测定得吸光度值A0。以1 mL乙醇+1 mL水作为空白调零,VC作为阳性对照。按下列公式计算:
1.2.6.2 ABTS+自由基清除能力测定
根据文献[18]修改如下:用pH7.4 PBS缓冲溶液将0.2 mL ABTS+工作液进行稀释,调至734 nm处吸光度值为0.7±0.2;取10 μL不同浓度葛根蛋白酶解物样品溶液与0.2 mL ABTS+工作液进行混合,常温避光反应6 min,于734 nm波长测定吸光度,VC为阳性对照,按下列公式计算:
式中:A1为样品+ABTS+测得的吸光度值;A0为PBS+ABTS+测得的吸光度值。
1.2.6.3 羟基自由基清除能力测定
根据文献[19]修改如下:取0.75 mmol/L邻二氮菲溶液1 mL于试管中,加入0.2 mol/L pH7.4 PBS缓冲溶液2 mL,再分别加入不同浓度葛根蛋白酶解物样品溶液1 mL,混匀后加入0.75 mmol/L FeSO4溶液1 mL以及0.025% H2O2溶液1 mL,充分混匀。37 ℃下反应30 min,于536 nm处测定吸光度值A1,用蒸馏水调0。蒸馏水代替样品溶液,测定吸光度值A0;蒸馏水代替H2O2溶液,测定吸光度值A2,按下列公式计算:
1.2.6.4 总还原能力测定
根据文献[20]修改如下:分别取葛根蛋白酶解物溶液2.5 mL,依次加入2.5 mL 0.2 mol/L磷酸盐缓冲溶液和1% K3Fe(CN)6溶液,于50 ℃反应20 min后冷却,加入2.5 mL 10%三氯乙酸,离心,取上清液、蒸馏水、0.1%FeCl3溶液按1:1:5的比例混匀,静置,在700 nm处测定吸光度值A1;用蒸馏水代替1% K3Fe(CN)6溶液,测定吸光度值A2。以蒸馏水作为空白调零,VC作为阳性对照组。按下列公式计算:
1.3 数据处理
所有试验均重复3次,结果以
2. 结果与分析
2.1 最适水解蛋白酶的确定
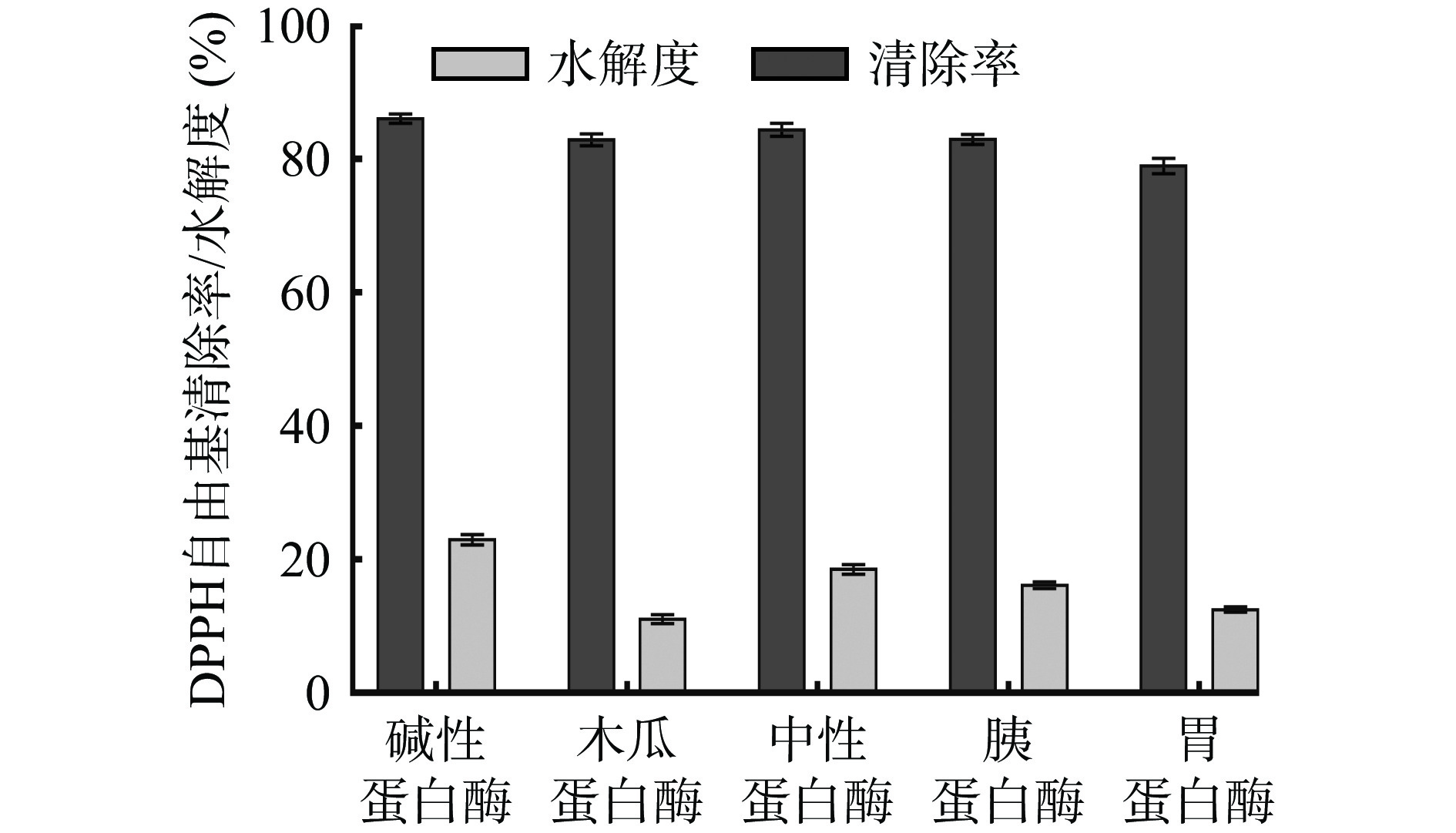
蛋白酶酶解是目前生产蛋白质水解物的主要途径。本试验以DPPH自由基清除率为评价指标,同时结合水解度、SDS-PAGE电泳,对4种酶进行筛选,结果见图1~图2。
由图1可知,碱性蛋白酶酶解产物DPPH自由基清除率较其他酶解产物而言较高,且水解度也高,原因可能是碱性蛋白酶酶解更易生成抗氧化活性高、分子量小的多肽[21];SDS-PAGE电泳图(图2)显示,葛根蛋白的亚基分子质量主要集中在70、40、35、25、10 kDa,经不同蛋白酶酶解后,高分子量亚基均不同程度的降低,其中碱性蛋白酶酶解物高分子量亚基最少,且低分子量亚基明显高于其它酶解物,说明碱性蛋白酶酶解效果好于其它几种蛋白酶。综合考虑水解度和DPPH自由基清除能力,葛根蛋白制备酶解物的最适宜蛋白酶为碱性蛋白酶,因此选用碱性蛋白酶对葛根蛋白进行后续试验的酶解研究。
2.2 单因素实验结果
2.2.1 酶解温度对葛根蛋白酶解物水解度及DPPH自由基清除率的影响
酶解温度的高低变化是影响酶促反应的重要因素之一,由图3可知,葛根蛋白酶解物的DPPH自由基清除能力和水解度随着温度的升高呈现出先升高后降低的趋势。这主要是因为温度过低,蛋白酶的活性未被完全激活[22],当温度达到55 ℃时,大部分酶的活性被激活,因此此时葛根蛋白酶解物的DPPH自由基清除能力和水解度达到最大值。但随着温度继续升高,活性反而下降,其原因可能是温度过高酶的结构发生了一定的变化,使酶活性降低,从而导致酶解物的DPPH自由基清除能力和水解度下降[23],所以选择酶解温度45、55、65 ℃进行响应面分析。
2.2.2 酶底比对葛根蛋白酶解物水解度及DPPH自由基清除率的影响
由图4可知,当酶底比在0.5%~2%范围内,随加酶量增加,葛根蛋白酶解物的DPPH自由基清除能力和水解度随着酶底比的增大呈现逐渐升高的趋势;当酶底比为2%时,DPPH自由基清除能力和水解度均达到最高值分别为86.1%和24.3%;之后继续增加酶底比,两个指标变化不明显。这可能是因为酶与底物的结合达到饱和,使得酶解物的DPPH自由基清除能力和水解度不再增加趋于平缓[24]。所以选择酶底比1.5%、2%、2.5%三个水平进行响应面分析。
2.2.3 酶解pH对葛根蛋白酶解物水解度及DPPH自由基清除率的影响
由图5可知,葛根蛋白酶解物的DPPH自由基清除能力和水解度随着pH的增高呈现先升高后降低的趋势,在pH8.5时两个指标达到最大。推测原因是酶解体系环境pH过高或过低会造成酶活力降低甚至是失活,导致酶与底物结合效率减弱,使得酶解效率降低[25]。所以选择酶解pH7.5、8.5、9.5进行响应面分析。
2.2.4 酶解时间对葛根蛋白酶解物水解度及DPPH自由基清除率的影响
由图6可知,随着时间的增长,葛根蛋白酶解物对DPPH自由基清除能力和水解度的影响,随着时间的增长而上升,最后达到一定值之后基本保持不变。其原因可能是当酶解反应刚开始的时候,酶的活性和底物浓度较高,反应速度较快,当时间到达3 h时基本达到最高值,可能是因为随着酶解时间的增加,底物浓度有所下降,导致水解度增幅减缓[26],所以选择3 h作为酶解时间。
2.2.5 底物浓度对葛根蛋白酶解物水解度及DPPH自由基清除率的影响
由图7可知,随着底物浓度的不断增加,葛根蛋白酶解物的DPPH自由基清除率和DH不断升高,当底物浓度超过2%时,两个指标均有所下降。这可能是因为底物浓度会影响蛋白酶与底物的结合,所以当底物浓度小于2%时,增加底物浓度对蛋白酶与底物的结合具有一定的促进作用,从而使得酶解物中的抗氧化活性物质随之增加;当底物浓度超过2%时,反应体系浓度过高,会对蛋白酶的分散性和活性物质的释放造成一定的影响[27]。所以选择底物浓度2%进行酶解。
2.3 Box-Behnken响应面法优化试验结果
2.3.1 回归模型的建立与数据分析
根据单因素实验结果,以DPPH自由基清除能力为评价指标,进行3因素3水平响应面优化设计,结果见表3。
表 3 Box-Behnken试验设计及结果Table 3. Design and results of Box-Behnken test实验号 酶解温度(A) 酶解pH(B) 酶底比(C) DPPH自由基
清除能力(%)1 0 0 0 86.826 2 −1 0 1 79.199 3 1 1 0 82.505 4 0 0 0 87.957 5 0 1 −1 71.050 6 0 −1 −1 65.453 7 0 −1 1 73.979 8 −1 1 0 77.082 9 0 0 0 85.637 10 1 0 1 81.113 11 1 −1 0 67.860 12 0 1 1 86.971 13 −1 0 −1 64.723 14 −1 −1 0 68.730 15 0 0 0 84.730 16 0 0 0 85.289 17 1 0 −1 70.637 通过Design-Expert 8.0软件对3因素进行回归拟合,根据表3得到的多元二次回归方程为Y=86.09+1.55A+5.20B+6.17C+1.57AB−1.00AC+1.85BC−6.24A2−5.80B2−5.93C2。
对葛根蛋白酶解工艺进行响应面分析,由方差分析结果可知(表4),该模型P<0.0001为极显著,失拟项P>0.05为不显著,说明方程具有良好的拟合性,可用该回归方程进行试验分析。该模型的决定系数R2>0.9,表明实测值与预测值之间具有较好的相关性;模型调整系数R2Adj为0.9778,能够说明97.78%的试验结果,对实际试验拟合良好。酶解温度、酶解pH及酶底比三个因素对响应值的影响显著性可用F值来评价[28],由表4可知,F(A)=12.74,F(B)=143.77,F(C)=202.87,即各因素对葛根蛋白酶解物的DPPH自由基清除能力影响顺序为酶底比>pH>酶解温度,三个因素对葛根蛋白酶解物的DPPH自由基清除能力影响均极显著(P<0.01)。
表 4 二次回归模型方差分析结果Table 4. Analysis of variance results of quadratic regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1074.84 9 119.43 79.43 <0.0001 ** A 19.16 1 19.16 12.74 0.0091 ** B 216.17 1 216.17 143.77 <0.0001 ** C 350.03 1 305.03 202.87 <0.0001 ** AB 9.9 1 9.9 6.58 0.0372 * AC 4 1 4 2.66 0.1469 BC 13.67 1 13.67 9.09 0.0195 * A2 164.18 1 164.18 109.19 <0.0001 ** B2 141.6 1 141.6 94.17 <0.0001 ** C2 147.83 1 147.83 98.32 <0.0001 ** 残差 10.53 7 1.50 失拟项 3.8 3 1.27 0.75 0.5750 纯误差 6.72 4 1.68 总误差 1085.37 16 注:*:显著,P<0.05;**:极显著,P<0.01。R2=0.9903,R2Adj=0.9778。 2.3.2 响应面各因素交互作用分析
运用 Design-Expert V8.0.6软件,分析响应面优化试验结果,得到的响应面曲面图,该图能反映各因素以及因素之间的交互作用对响应值的影响,试验结果见图8。三维图谱和等高线图能够更加直观地研究交互因素间的相互作用情况。由图8a、图8b可知,等高线的形状与椭圆形相近,响应面陡峭,表明AB(温度和pH)以及BC(酶底比和pH)的交互作用对DPPH自由基清除能力的影响较大[29]。图8c的等高线形状与圆形非常相近,响应面也较为平缓,说明AC两因素之间的交互作用对DPPH自由基的清除作用影响较小。
2.3.3 验证试验
运用 Design-Expert V8.0.6软件对模型进行解析,得到了一组碱性蛋白酶酶解葛根蛋白的最优条件为:酶解温度56.47 ℃、pH9.06、酶底比2.3%。在此条件下制备的葛根蛋白酶解物具有良好的DPPH自由基清除能力,其清除率为89.51%。根据实际操作条件,将葛根蛋白酶解的最佳条件修正为:酶解温度55 ℃、pH9、酶底比2%。在该条件下所得到的葛根蛋白酶解物对DPPH自由基清除率为88.14%±0.50%,此时水解度为23.6%,与模型预测值基本一致。
2.4 葛根蛋白酶解物体外抗氧化试验结果
身体代谢的过程中会产生自由基,而过多的自由基会引起氧化应激从而造成细胞和组织的氧化损伤,导致各种疾病的产生[30]。DPPH·、·OH等自由基是目前最常用的体外抗氧化评价指标[31-33],自由基清除率越大表明抗氧化能力越强。由图9可知,葛根蛋白经碱性蛋白酶酶解后能够提高DPPH自由基、ABTS+自由基、羟基自由基的清除能力及还原能力,且与蛋白相比酶解物清除DPPH自由基、ABTS+自由基、羟基自由基的半抑制浓度(half maximal inhibitory concentration,IC50)降低,分别为0.15、0.38、1.41 mg/mL。这是由于酶解过程中生物大分子蛋白被酶解成了一些抗氧化性更好的小分子肽[34-35]。
3. 结论
本文以葛根蛋白为原料,以DPPH自由基清除能力、水解度为指标,结合SDS-PAGE电泳结果筛选5种蛋白酶对葛根蛋白的酶解效果,最终得到碱性蛋白酶为酶解葛根蛋白的最佳酶。在单因素实验结果的基础上,以DPPH自由基清除能力为响应值,运用响应面分析法对葛根蛋白酶解工艺进行优化,确定最佳酶解条件:酶解温度55 ℃、酶解pH9、酶底比2%。在最优条件下葛根蛋白酶解物对DPPH自由基、ABTS+自由基、OH自由基的清除能力以及还原能力较蛋白均有所提高。
综上所述,葛根蛋白在碱性蛋白酶条件下得到的酶解产物,与葛根蛋白相比较,具良好的抗氧化活性,表明葛根蛋白酶解产物可作为一种有效的多肽来源添加到食品中去,发挥相应的营养价值,为日后葛根多肽的研究提供一定的参考。
-
表 1 5种蛋白酶的最适酶解条件
Table 1 Optimum enzymatic hydrolysis conditions of five proteases
蛋白酶种类 温度(℃) pH 碱性蛋白酶 55 8.5 中性蛋白酶 50 7 木瓜蛋白酶 65 6.5 胰蛋白酶 45 8.0 胃蛋白酶 37 1.5 表 2 Box-Behnken响应面试验因素水平设计
Table 2 Factors and levels of Box-Behnken response surface test
水平 因素 A酶解温度(℃) B酶解pH C酶底比(%) 1 45 7.5 1.5 0 55 8.5 2 −1 65 9.5 2.5 表 3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken test
实验号 酶解温度(A) 酶解pH(B) 酶底比(C) DPPH自由基
清除能力(%)1 0 0 0 86.826 2 −1 0 1 79.199 3 1 1 0 82.505 4 0 0 0 87.957 5 0 1 −1 71.050 6 0 −1 −1 65.453 7 0 −1 1 73.979 8 −1 1 0 77.082 9 0 0 0 85.637 10 1 0 1 81.113 11 1 −1 0 67.860 12 0 1 1 86.971 13 −1 0 −1 64.723 14 −1 −1 0 68.730 15 0 0 0 84.730 16 0 0 0 85.289 17 1 0 −1 70.637 表 4 二次回归模型方差分析结果
Table 4 Analysis of variance results of quadratic regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1074.84 9 119.43 79.43 <0.0001 ** A 19.16 1 19.16 12.74 0.0091 ** B 216.17 1 216.17 143.77 <0.0001 ** C 350.03 1 305.03 202.87 <0.0001 ** AB 9.9 1 9.9 6.58 0.0372 * AC 4 1 4 2.66 0.1469 BC 13.67 1 13.67 9.09 0.0195 * A2 164.18 1 164.18 109.19 <0.0001 ** B2 141.6 1 141.6 94.17 <0.0001 ** C2 147.83 1 147.83 98.32 <0.0001 ** 残差 10.53 7 1.50 失拟项 3.8 3 1.27 0.75 0.5750 纯误差 6.72 4 1.68 总误差 1085.37 16 注:*:显著,P<0.05;**:极显著,P<0.01。R2=0.9903,R2Adj=0.9778。 -
[1] 国家药典委员会. 中华人民共和国药典[M]. 一部. 北京: 化学工业出版社, 2020: 333−334. National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China[M]. Volume I. Beijing: Chemical Industry Press, 2020: 333−334.
[2] 刘亚美, 陈琼, 吴菲菲, 等. 葛根异黄酮的现代研究进展[J]. 福建茶叶,2020,42(1):18−19. [LIU Yamei, CHEN Qiong, WU Feifei, et al. Modern research progress of Pueraria isoflavones[J]. Fujian Tea,2020,42(1):18−19. doi: 10.3969/j.issn.1005-2291.2020.01.013 [3] ZHANG Y N, ZHU S J, LI N, et al. Screening and identification of the active components from puerariae radix by HUVECICMC-LC-MS 2[J]. Jourmal of Chromatography B,2019:1132.
[4] 魏述永. 葛根素心血管保护作用及其机制研究进展[J]. 中国中药杂志,2015,40(12):2278. [WEI Shuyong. Research progress on cardiovascular protective effect and mechanism of puerarin[J]. Chinese Journal of Traditional Chinese Medicine,2015,40(12):2278. [5] 王树深. 葛根提取物对酒精中毒小鼠的保护作用[D]. 大连: 大连理工大学, 2019. WANG Shushen. Protective effect of Pueraria lobata extract on alcoholism mice[D]. Dalian: Dalian University of Technology, 2019.
[6] 王萌萌, 梅振东, 张淼, 等. 葛根提取物对高脂血症大鼠血脂及抗氧化能力的影响[J]. 食品工业科技,2015,36(11):369−372. [WANG Mengmeng, MEI Zhendong, ZHANG Miao, et al. Effects of Pueraria extract on blood lipid and antioxidant capacity in hyperlipidemia rats[J]. Science and Technology of Food Industry,2015,36(11):369−372. doi: 10.13386/j.issn1002-0306.2015.11.067 [7] 袁媛, 侯雪峰, 封亮, 等. 葛根素对体内外晚期糖基化终末产物形成的抑制作用[J]. 中草药,2017,48(7):1386−1390. [YUAN Yuan, HOU Xuefeng, FEN Liang, et al. Inhibitory effect of puerarin on the formation of advanced glycation end products in vivo and in vitro[J]. Chinese Herbal Medicine,2017,48(7):1386−1390. [8] 陈艳, 文佳玉, 谢晓芳, 等. 葛根的化学成分及药理作用研究进展[J]. 中药与临床,2021,12(1):53−60. [CHEN Yan, WEN Jiayu, XIE Xiaofang, et al. Research progress on chemical constituents and pharmacological effects of Pueraria lobata[J]. Traditional Chinese Medicine and Clinic,2021,12(1):53−60. doi: 10.3969/j.issn.1674-926X.2021.01.013 [9] 李福荣, 赵爽, 张秋, 等. 食源性生物活性肽的功能及其在食品中的应用[J]. 食品研究与开发,2020,41(20):210−217. [LI Furong, ZHAO Shuang, ZHANG Qiu, et al. Functions of food derived bioactive peptides and their application in food[J]. Food Research and Development,2020,41(20):210−217. doi: 10.12161/j.issn.1005-6521.2020.20.035 [10] 刘虹, 易丽莎, 蒲乙琴, 等. 中国野生豆科植物资源及豆类蛋白研究概况[J]. 生物资源,2019,41(3):185−194. [LIU Hong, YI Lisha, PU Yiqin, et al. Overview of wild leguminous plant resources and bean protein research in China[J]. Biological Resources,2019,41(3):185−194. [11] 郭溆, 田硕, 程安玮, 等. 酶解黄秋葵籽蛋白制备抗氧化肽的工艺优化[J]. 食品研究与开发,2018,39(24):91−97. [GUO Xu, TIAN Shuo, CHEN Anwei, et al. Optimization of enzymatic hydrolysis of okra seed protein to prepare antioxidant peptides[J]. Food Research and Development,2018,39(24):91−97. doi: 10.3969/j.issn.1005-6521.2018.24.015 [12] 王春雨, 迟乃玉, 张庆芳, 等. 低温脂肪酶的分离纯化及酶学性质[J]. 食品与生物技术学报,2013,32(8):809−813. [WANG Chunyu, CHI Naiyu, ZHANG Qingfang, et al. Isolation, purification and enzymatic properties of low temperature lipase[J]. Journal of Food and Biotechnology,2013,32(8):809−813. [13] 庞广昌, 陈庆森, 胡志和, 等. 蛋白质的消化吸收及其功能评述[J]. 食品科学,2013,34(9):375−391. [PANG Guangchang, CHEN Qingsen, HU Zhihe, et al. Review on digestion, absorption and function of protein[J]. Food Science,2013,34(9):375−391. doi: 10.7506/spkx1002-6630-201309074 [14] 王苗, 张红印, 范琳, 等. 葛根蛋白提取工艺及其体外抗氧化性研究[J]. 食品研究与开发,2021,42(1):73−79. [WANG Miao, ZHANG Hongyin, FAN Lin, et al. Study on extraction technology of Pueraria protein and its antioxidant activity in vitro[J]. Food Research and Development,2021,42(1):73−79. doi: 10.12161/j.issn.1005-6521.2021.01.013 [15] 吴雷, 贡湘磊. 葡萄籽蛋白的提取及其酶解液抗氧化活性研究[J]. 美食研究,2021,38(2):93−98. [WU Lei, GONG Xianglei. Study on extraction of grape seed protein and antioxidant activity of its enzymatic hydrolysate[J]. Food Research,2021,38(2):93−98. doi: 10.3969/j.issn.1009-4717.2021.02.015 [16] 张京涛, 冯翠萍. 海鲜菇蛋白质功能特性及消化性的研究[J]. 食品科技,2020,45(3):49−56. [ZHANG Jingtao, FENG Cuiping. Study on functional characteristics and digestibility of protein from shiitake mushroom[J]. Food Science and Technology,2020,45(3):49−56. doi: 10.13684/j.cnki.spkj.2020.03.013 [17] ELZBIETA W, ALDONA K, RENATA Z W. Antioxidant activity and free radicals of roasted herbal materials[J]. Herba Polonica,2017,63(2):34−41. doi: 10.1515/hepo-2017-0011
[18] 夏雨, 卓倩婷, 徐雅囡, 等. 美藤果蛋白的分级提取、理化性质鉴定及抗氧化活性研究[J]. 食品科技,2021,46(1):193−198. [XIA Yu, ZHUO Qianting, XU Yanan, et al. Fractionated extraction, physicochemical properties identification and antioxidant activity of sinomenine fruit protein[J]. Food Science and Technology,2021,46(1):193−198. doi: 10.13684/j.cnki.spkj.2021.01.031 [19] HAFIZA N, NABIL S, MUHAMMAD F, et al. Measurement of total phenolic content and antioxidant activity of aerial parts of medicinal plant Coronopus didymus[J]. Asian Pacific Journal of Tropical Medicine,2017,10(8):855−862.
[20] 徐丹萍, 蒲彪, 叶萌, 等. 藤椒冷榨油饼粕中多酚的纯化及体外抗氧化活性[J]. 西北农业学报,2018,27(11):1690−1700. [XU Danping, PU Biao, YE Meng, et al. Purification and in vitro antioxidant activity of polyphenols from cold pressed oil cake of rattan pepper[J]. Northwest Agricultural Journal,2018,27(11):1690−1700. doi: 10.7606/j.issn.1004-1389.2018.11.018 [21] 阚旭辉, 郭红英, 谭兴和, 等. 可食性植物源抗氧化肽的研究进展[J]. 湖南农业科学,2016(9):111−114,120. [KAN Xuhui, GUO Hongying, TAN Xinghe, et al. Research progress of edible plant derived antioxidant peptides[J]. Hunan Agricultural Science,2016(9):111−114,120. doi: 10.16498/j.cnki.hnnykx.2016.09.030 [22] 麻成金, 黄伟, 黄群, 等. 复合酶法提取仿栗籽蛋白的工艺优化[J]. 食品科学,2012,33(20):27−32. [MA Chengjin, HUANG Wei, HUANG Qun, et al. Optimization of extraction process of chestnut like seed protein by complex enzyme method[J]. Food Science,2012,33(20):27−32. [23] 滕超, 王中月, 李秀婷, 等. 生产高纯度低聚木糖的酶筛选及其水解条件优化[J]. 中国食品学报,2018,18(6):104−111. [TENG Chao, WANG Zhongyue, LI Xiuting, et al. Screening of enzymes for producing high purity xylooligosaccharides and optimization of hydrolysis conditions[J]. Chinese Journal of Food Science,2018,18(6):104−111. doi: 10.16429/j.1009-7848.2018.06.014 [24] GOMEZ-RUIZ J, LOPEZ-EXPOSITO I, PIHLANTO A P, et al. Antioxidant activity of ovine casein hydrolysates: Identification of active peptides by HPLC-MS/MS[J]. European Food Research and Technology,2008,227(4):1061−1067. doi: 10.1007/s00217-008-0820-3
[25] 周徐慧, 钱平, 卢蓉蓉, 等. 酶法制备汉麻籽蛋白抗氧化肽[J]. 食品与发酵工业,2008(5):76−81. [ZHOU Xuhui, QIAN Ping, LU Rongrong, et al. Enzymatic preparation of antioxidant peptides from hemp seed protein[J]. Food and Fermentation Industry,2008(5):76−81. doi: 10.13995/j.cnki.11-1802/ts.2008.05.018 [26] DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp (Hypophthalmichthys molitrix)[J]. Food Chem,2008,107(4):1485−1493. doi: 10.1016/j.foodchem.2007.10.011
[27] 张杨, 胡磊, 汪少芸, 等. 响应面优化酶解法制备蒲公英籽蛋白抗氧化肽工艺[J]. 食品工业科技,2016,37(5):258−262. [ZHANG Yang, HU Lei, WANG Shaoyun, et al. Optimization of enzymatic hydrolysis process for preparation of dandelion seed protein antioxidant peptides by response surface methodology[J]. Science and Technology of Food Industry,2016,37(5):258−262. doi: 10.13386/j.issn1002-0306.2016.05.042 [28] 薛雨菲, 李芳, 程怡媚, 等. Box-Benhnken响应面优化巴旦杏抗氧化肽的制备工艺[J]. 现代食品科技,2019,35(12):208−215. [XUE Yufei, LI Fang, CHENG Yimei, et al. Box-benhnken response surface methodology to optimize the preparation process of antioxidant peptides from Badan apricot[J]. Modern Food Science and Technology,2019,35(12):208−215. doi: 10.13982/j.mfst.1673-9078.2019.12.027 [29] DOBLADO-MALDONADO A F, JANSSEN F, COMAND S V, et al. A response surface analysis of the aqueous leaching of amylase from maize starch[J]. Food Hydrocolloid,2017,63:265−272. doi: 10.1016/j.foodhyd.2016.09.006
[30] 刘媛, 王健, 杨立亭, 等. 响应面法优化杏仁粕蛋白酶解工艺及酶解液抗氧化活性研究[J]. 粮食与油脂,2019,32(10):13−17. [LIU Yuan, WANG Jian, YANG Liting, et al. Optimization of enzymatic hydrolysis process of almond meal and antioxidant activity of enzymatic hydrolysate by response surface methodology[J]. Grain and Oil,2019,32(10):13−17. doi: 10.3969/j.issn.1008-9578.2019.10.005 [31] ZHANG Z L, KONG F S, NI H, et al. Structural characterization, glucosidase inhibitory and DPPH· scavenging activities of polysaccharides from guava[J]. Carbohydrate Polymers,2016,144(25):106−114.
[32] 杨健, 李芳菲, 武淑影, 等. 大豆蛋白美拉德反应产物的抗氧化特性及其机理[J]. 中国食品学报,2017,17(2):44−51. [YANG Jian, LI Fangfei, WU Shuying, et al. Antioxidant properties and mechanism of Maillard reaction products of soybean protein[J]. Chinese Journal of Food Science,2017,17(2):44−51. doi: 10.16429/j.1009-7848.2017.02.007 [33] 胡玲玲, 李春阳, 曾晓雄, 等. 富硒发芽糙米蛋白的抗氧化活性[J]. 食品科学,2016,37(1):99−103. [HU Lingling, LI Chunyang, ZENG Xiaoxiong, et al. Antioxidant activity of selenium enriched germinated brown rice protein[J]. Food Science,2016,37(1):99−103. doi: 10.7506/spkx1002-6630-201601018 [34] LIN H M, DENG S G, HUANG S B. Antioxidant activities of ferrous-chelating peptides isolated from five types of low-value fish protein hydrolysates[J]. J Food Biochem,2014,38(6):627−633. doi: 10.1111/jfbc.12103
[35] CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Food Chem,2007,100(4):1537−1543. doi: 10.1016/j.foodchem.2005.12.019
-
期刊类型引用(7)
1. 杨敏,张密,叶贤胜,曾长立,马爱民,牛蒙亮,许丹云. 大球盖菇多肽的制备、抗氧化及抗肿瘤活性的研究. 山西农业大学学报(自然科学版). 2025(01): 123-132 .  百度学术
百度学术
2. 魏磊,景炳年,李宁洁,金饶,谢晓阳,刘雨晴,马艳妮,梁雅辉,王韬,王伟. 赤松茸乙醇提取物不同萃取相生物活性对比. 食品研究与开发. 2025(04): 39-45 .  百度学术
百度学术
3. 王小平,刘忠莹,钟洋,张定秋,陆阳,朱敏敏,郑红毅,何叶馨,王鑫,黄韬睿,江祖彬. 基于离子色谱-电感耦合等离子体质谱法分析木耳、香菇、松茸和茶树菇中砷形态分布. 食品工业科技. 2024(07): 254-260 .  本站查看
本站查看
4. 韦菡燕,蒋军文. 等离子体对松茸多糖抗疲劳作用的影响. 保鲜与加工. 2024(10): 128-133 .  百度学术
百度学术
5. 黄磊,何春梅,司灿,石鸿宇,段俊. 大球盖菇栽培研究进展. 中国食用菌. 2023(03): 8-14 .  百度学术
百度学术
6. 魏磊,王伟,谢晓阳,周雍,刘雨晴,马艳妮,宁二娟,王韬,李宁洁,景炳年. 响应面优化博爱赤松茸多糖提取工艺及其抑菌和抗氧化活性研究. 食品工业科技. 2023(15): 213-220 .  本站查看
本站查看
7. 曹燕妮,华蓉,邓雅元,王娟,游金坤. 食用菌中维生素测定方法研究. 中国食用菌. 2022(09): 44-47 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:














 下载:
下载:



