Influence of Heat Pre-treatment and Oxidative Pre-treatment on the Spray Dried Powder of Lactobacillus rhamnosus
-
摘要: 喷雾干燥法是低成本、高效率的益生菌菌粉生产方法,但是容易导致严重的活性损失。本研究通过热预处理和氧化预处理提高鼠李糖乳杆菌hsryfm 1301喷雾干燥菌粉的存活率、胃肠道耐受能力和耐贮藏能力。以未预处理菌体为对照,采用46 ℃ 1 h的热预处理条件或0.5 mmol/L H2O2 1 h的氧化预处理条件处理菌体后进行喷雾干燥。结果显示,对照组喷雾干燥存活率仅为29%,而热预处理组和氧化预处理组喷雾干燥的存活率为98%和76%,分别提高到3.38和2.62倍。对照组菌粉的人工胃液耐受存活率为0.8%,而热预处理组和氧化预处理组菌粉的人工胃液存活率达到了76%和72%,分别提高到了原来的95.0和92.5倍。此外,热预处理组菌粉在−20 ℃下贮藏4个月,菌体存活率仍大于80%,氧化预处理组菌粉贮藏4个月的存活率则保持高于40%。本研究表明,鼠李糖乳杆菌hsryfm 1301经过热预处理或氧化预处理后,菌体获得的热胁迫和氧化胁迫耐受能力,有助于其在喷雾干燥中存活。Abstract: Spray drying is a commonly used method in the food industry since it is cost-effective and highly flexible, but spray drying typically results in lower survival rate of starter cultures than freeze-drying. In this study, the influence of heat pre-treatment (46 ℃, 1 h) and oxidative pre-treatment (0.5 mmol/L H2O2, 1 h) on the spray dried powder of Lactobacillus rhamnosus hsryfm 1301 was investigated. The results showed that heat pre-treatment and oxidative pre-treatment could improve the survival rate. The survival rate of the untreated group was only 29%, while the survival rates of heat pre-treated and oxidative pre-treated cells were 98% and 76%, which increased by 3.38 and 2.62 folds, respectively. At the same time, the acid-resistant of the untreated bacterial powder was 0.8%, while the acid-resistant survival rates of heat pre-treated and oxidative pre-treated bacterial powder were 76% and 72%, which increased by 95.0 and 92.5 times, respectively. Moreover, the heat pre-treated and oxidative pre-treated bacterial powder had good storage ability in the environment of −20 ℃. The survival rate of heat pre-treated bacterial powder remained greater than 80% after stored at −20 ℃ for 4 months, and that of oxidative pre-treated bacterial powder was greater than 40%. It was suggested that the strengthened heat stress and oxidative stress tolerance of L. rhamnosus hsryfm 1301 by heat pre-treatment and oxidative pre-treatment were helpful to survive spray drying.
-
Keywords:
- Lactobacillus rhamnosus /
- heat pre-treatment /
- oxidative pre-treatment /
- spray drying /
- storage
-
乳酸菌及其发酵乳制品已成为目前受欢迎的益生菌功能食品之一[1]。乳酸菌的活性是其在食品中进行发酵和人体内发挥益生作用的必要基础。研究人员认为,乳酸菌的日摄入量达到109 菌落形成单位(colony forming unit,CFU)方能发挥较好的益生功能[2]。然而,乳酸菌在生产、贮藏、运输和消费过程中,会受到工艺流程、宿主、及自身代谢产物等多种胁迫,引起活性损失[3]。
低温和干燥是目前最有效的微生物活性维持条件。干燥菌粉活菌数高、活性稳定、货架期长,冷链、运输和贮藏成本低,便于后续加工,是发酵剂和益生菌制剂的主要产品形式。喷雾干燥法将乳酸菌培养物雾化后,置于高温的流动热空气中,达到快速干燥的目的,主要生产设备喷雾干燥塔是乳品工业的基础设施,工艺成熟、干燥快速且连续生产能力强。喷雾干燥法生产成本只有冷冻干燥法的20%左右,能耗为冷冻干燥的1/10~1/16[4]。乳酸菌培养物甚至可以直接随食品一同喷雾干燥,使产品具有更好的均一性,并进一步简化生产流程,降低生产成本。随着乳酸菌奶粉、乳酸菌米粉、乳酸菌豆粉、乳酸菌慕斯粉、乳酸菌冰激凌粉及含乳酸菌食品原料等产品的兴起,喷雾干燥法展现出很好的应用前景。然而,较低的存活率和稳定性仍限制喷雾干燥法的进一步应用。
在喷雾干燥过程中,乳酸菌直接暴露于高温的空气中,其活性损失主要来自于生产过程中的热胁迫和氧化胁迫,氧化胁迫同时是乳酸菌贮藏期间面临的最主要胁迫[1]。乳酸乳球菌和双歧杆菌的喷雾干燥存活率与其热胁迫和氧化胁迫耐受能力呈正相关[5-6]。鼠李糖乳杆菌(Lactobacillus rhamnosus)hsryfm 1301分离自中国巴马的长寿老人,具有明显的功能特性[7]。该菌株对热胁迫和氧化胁迫存在明显的交叉适应,热预处理或氧化预处理均能够同时提高菌株的热胁迫和氧化胁迫耐受能力[8],但是两种预处理方法是否能够提高鼠李糖乳杆菌hsryfm 1301的喷雾干燥存活率及其提高水平仍不清晰。本文探究热预处理或氧化预处理对鼠李糖乳杆菌hsryfm 1301喷雾干燥存活率及后续耐贮藏能力的影响,以期为喷雾干燥在鼠李糖乳杆菌菌粉生产中的应用提供新的思路。
1. 材料与方法
1.1 材料与仪器
鼠李糖乳杆菌hsryfm 1301 于2013年分离自广西省巴马瑶族自治县的长寿老人,具有显著的降血脂功能[7],现保藏于中国普通微生物菌种保藏管理中心(CGMCC No. 8545);胃蛋白酶(1:10000)、牛胆盐 北京索莱宝科技有限公司;30% H2O2 国药集团化学试剂有限公司;de Man Rogosa Sharpe (MRS)培养基 蛋白胨 10.0 g/L,牛肉浸粉 8.0 g/L,酵母浸粉 4.0 g/L,葡萄糖 20.0 g/L,磷酸氢二钾 2.0 g/L,柠檬酸氢二铵 2.0 g/L,乙酸钠 5.0 g/L,硫酸镁 0.2 g/L,硫酸锰 0.04 g/L,吐温80 1.0 g/L,pH6.5±0.2。
GL-10MD大容量高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;MOBILE MINOR喷雾干燥机 德国GEA Grop集团;HH-8水浴锅 上海力辰邦西仪器科技有限公司;JF-SX-500全自动灭菌锅 日本TOMY公司;SW-CJ-1F超净工作台 苏州净化设备有限公司;SPX-150BSH生化培养箱 上海新苗医疗器械制造有限公司。
1.2 实验方法
1.2.1 菌株的培养
从冻存管中取鼠李糖乳杆菌hsryfm 1301的冻干菌粉(约0.5 g),置于5 mL MRS液体培养基,37 ℃培养24 h;将菌液在MRS固体培养基上划线纯化;挑取单菌落,在MRS液体培养基37 ℃培养24 h;4 ℃保藏备用。
1.2.2 热预处理
热预处理条件参照前期实验结果进行[8-9],将活化的鼠李糖乳杆菌 hsryfm 1301按2%(v/v)的接种量转接到600 mL MRS液体培养基中,混匀,37 ℃培养至OD600 nm为1.8,然后将培养好的菌液放置46 ℃水浴锅中热处理1 h。对照组不进行热预处理。
1.2.3 氧化预处理
氧化预处理条件参照前期实验结果进行[8-9],将活化的鼠李糖乳杆菌 hsryfm 1301按2%(v/v)的接种量转接到600 mL MRS液体培养基中,混匀,37 ℃培养至OD600 nm为2.0左右。然后将培养好的菌液离心,PBS重悬后,添加终浓度为0.5 mmol/L的H2O2,37℃下预处理1 h。对照组不进行氧化预处理。
1.2.4 喷雾干燥条件
使用大容量高速冷冻离心机将对照、热预处理和氧化预处理后的菌液以4000 ×g的转速离心20 min,倒掉上清液,得到鼠李糖乳杆菌 hsryfm 1301菌泥。将菌泥重悬于0.6 L保护剂,充分混匀。将混悬液进行喷雾干燥(喷雾前MRS平板计数;喷雾干燥参数:进风120 ℃,出风60 ℃,流速8.5 mL/min)[10-11]。对喷雾干燥获得的菌粉进行MRS平板计数[12],喷雾干燥存活率通过公式(1)计算。喷雾干燥保护剂:脱脂乳150.0 g/L,海藻糖90.0 g/L,甘油8.0 ml/L,加水定容至1 L[11,13]。
(1) 1.2.5 喷雾干燥菌粉对人工胃液的耐受能力
分别称取对照组、热预处理组和氧化预处理组喷雾干燥菌粉1.0 g,用9.0 mL PBS悬浮菌体,混匀。取1.0 mL的菌悬浮液转接至9.0 mL的pH 2.5人工胃液,37 ℃培养3 h,分别在0和3 h利用平板计数法测定活菌数[12],通过公式(2)计算其存活率(%)。
(2) 0.01 mol/L磷酸盐缓冲液:准确称取8.0 g NaCl,0.2 g KCl,1.44 g Na2HPO4,0.24 g KH2PO4溶于700 mL蒸馏水中,用1.0 mol/L HCl调pH为7.2~7.4,最后定容至1 L。高压灭菌后(121 ℃,15 min),低温保藏(4 ℃),备用。
模拟胃液配制方法:准确称取0.5 g NaCl,0.3 g胃蛋白酶溶于50 mL蒸馏水中,用1.0 mol/L HCl调节pH为2.5,最后定容至100 mL,过滤除菌(0.22 μm滤膜),4 ℃低温保藏[14]。
1.2.6 喷雾干燥菌粉对胆盐的耐受能力
胆盐是益生菌在人体肠道中面临的主要胁迫,大量益生菌筛选研究用胆盐培养基模拟肠道胁迫[14]。分别称取对照组、热预处理组和氧化预处理组喷雾干燥菌粉1.0 g,用9.0 mL PBS悬浮菌体,混匀。取1.0 mL的菌悬浮液转接至9.0 mL的含0.1%胆盐的MRS液体培养基中,37 ℃培养3 h,分别在0和3 h利用平板计数法测定活菌数[12],通过公式(2)计算其存活率(%)。
胆盐培养基配制方法:准确称取一定量的胆盐溶于MRS液体培养基中,使其胆盐浓度(w/v)为0.1%,用0.1 mol/L HCl调节pH为6.5±0.2,高压灭菌后(121 ℃,15 min),冷却备用[14]。
1.2.7 喷雾干燥菌粉在贮藏期内活菌数的变化
将对照喷雾干燥菌粉、热预处理喷雾干燥菌粉和氧化预处理喷雾干燥菌粉分别放置−20 ℃、4 ℃和室温(25 ℃)下密封避光贮藏[15]。用MRS固体培养基对菌粉进行平板计数(前5个周每周1次,后续每月1次)[12]。存活率通过公式(1)计算。
1.3 数据处理
所有实验均设置3次平行;采用Excel进行数据处理;采用SPSS 19.0软件对实验数据进行显著性分析,P<0.05 为差异显著;使用Origin和Visio进行绘图。
2. 结果与分析
2.1 热预处理和氧化预处理对菌株喷雾干燥存活率的影响
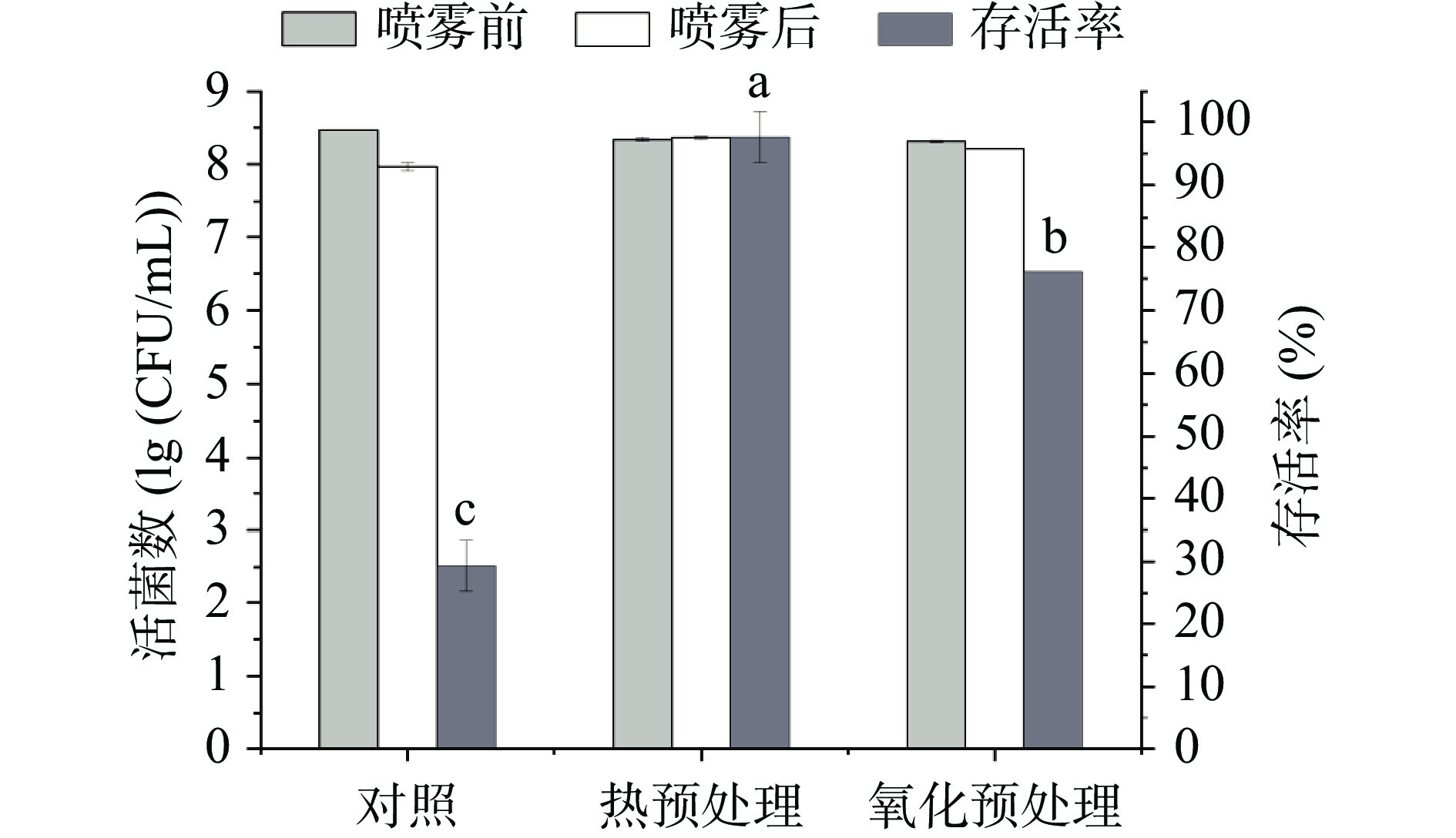
热预处理和氧化预处理未对菌株的生长产生大的影响,同等生长时间活菌数均可以达到1×108 CFU/mL以上。未经热预处理的鼠李糖乳杆菌 hsryfm 1301菌液经喷雾干燥后存活率仅为29%,而经过热胁迫处理菌液经喷雾干燥后存活率达到了98%,存活率提高到原来的3.38倍(图1)。氧化预处理同样可以提高鼠李糖乳杆菌 hsryfm 1301在喷雾干燥中的存活率。氧化预处理后菌液经喷雾干燥存活率约为76%,相较于未经氧化胁迫处理的菌株的喷雾干燥存活率提高了约1.62倍(图1)。这说明菌株经过46 ℃热胁迫或0.5 mmol/L H2O2氧化胁迫后,菌体获得的热胁迫和氧化胁迫耐受能力,有助于其在喷雾干燥中存活。
![]() 图 1 热预处理和氧化预处理后菌株的喷雾干燥存活率注:不同小写字母表示差异显著,P<0.05;图2同。Figure 1. Survival rates of heat pre-treated or oxidative pre-treated L. rhamnosus hsryfm 1301 cells during spray drying
图 1 热预处理和氧化预处理后菌株的喷雾干燥存活率注:不同小写字母表示差异显著,P<0.05;图2同。Figure 1. Survival rates of heat pre-treated or oxidative pre-treated L. rhamnosus hsryfm 1301 cells during spray drying已有研究表明,热预处理能够提高一些乳杆菌的喷雾干燥存活率。对植物乳杆菌299V和嗜酸假单胞菌HA-61112分别进行49.5和50 ℃胁迫处理后,这两株菌在喷雾干燥过程中细胞活性没有显著降低[16]。同样较温和的热处理条件(52 ℃, 15 min)不会影响植物乳杆菌8329喷雾干燥前的细胞活性,却能显著提高其喷雾干燥的存活率[17]。除热预处理能够赋予乳酸菌较高的热和喷雾干燥的耐受性外,酸、胆盐、渗透压、氧化胁迫也能达到类似效果。Desmond等发现将副干酪乳杆菌NFBC 338暴露于亚致死浓度H2O2(3 mmol/L)、盐溶液(0.3 mol/L NaCl)中,可以显著提高喷雾干燥的存活率[18]。
本文的实验结果发现,热预处理或氧化预处理同样能够提高鼠李糖乳杆菌的喷雾干燥存活率,但是与文献报道的其它乳杆菌所需要的预处理条件强度有所不同,表明不同菌种对胁迫的预适应能力存在差异。作者的前期研究表明,热预处理或氧化预处理除了能够提高菌株对同种胁迫的耐受之外,还存在交叉保护作用。经温和热预处理后,菌株的氧化胁迫耐受能力提高13倍;经温和氧化预处理后,菌株的热胁迫耐受能力提高150倍[8]。因此,预处理手段对喷雾干燥过程中菌体的保护可能存在多种机制。热预处理的效果好于氧化预处理,可能是由于热胁迫是喷雾干燥中的最主要胁迫[19]。这种预处理赋予的保护作用可能是由于特定胁迫蛋白的合成所致。已有研究证明喷雾干燥前热胁迫蛋白(尤其是负责预防或修复错误折叠多肽的蛋白或分子伴侣)的过量产生是保护菌体免受干燥损伤的有效手段,Prasad等[20]利用二维凝胶电泳和N端测序分析了鼠李糖乳杆菌在热胁迫条件下的蛋白质合成,发现蛋白质GroEL和DnaK,糖酵解酶甘油醛-3-磷酸脱氢酶和ABC运输相关蛋白质上调。
2.2 热预处理和氧化预处理对喷雾干燥菌粉胃肠道环境耐受能力的影响
胃肠道中的酸胁迫和胆盐胁迫是益生菌在肠道中定殖所面临的主要胁迫。对照组菌粉在模拟人工胃液和0.1%胆盐中的存活率为0.8%和72%。热胁迫处理后喷雾干燥的菌粉对模拟人工胃液和0.1%胆盐的耐受能力分别为76%、74%,与对照组菌粉相比,热预处理菌株喷雾干燥菌粉的酸胁迫存活率提高了94.0倍(P<0.05),耐胆盐能力未受不良影响(P>0.05)(图2)。这表明热胁迫处理不仅提高了菌株的喷雾干燥存活率,同时大幅提高了菌粉的胃酸耐受能力。氧化预处理菌粉对模拟人工胃液和0.1%胆盐的存活率分别为72%和89%(图2),耐酸、耐胆盐能力分别提高了91.5倍和24%。因此,氧化胁迫处理不仅提高了菌株的喷雾干燥存活率,同时显著提高了菌粉对胃肠道环境的耐受能力(P<0.05)。
鼠李糖乳杆菌 hsryfm 1301喷雾干燥菌粉的耐胆盐能力较强,对照组喷雾干燥菌粉的耐胆盐(0.1%)存活率为72%,热预处理对菌粉的耐胆盐能力没有负面影响,氧化预处理则进一步提高了其耐胆盐能力。鼠李糖乳杆菌 hsryfm 1301喷雾干燥菌粉的耐胃酸能力较弱,远低于未喷雾培养液中菌体的胃酸耐受能力[21],可能是由于与耐酸相关的酶类或膜系统受到了损伤;但是经热预处理或氧化预处理后,其胃酸耐受能力均大幅提升,表明预处理手段减轻了喷雾过程中耐酸相关的酶类或膜系统受到的损伤。上述结果表明预处理重建了喷雾干燥菌粉的胃酸耐受能力,使其能够更好地通过胃肠道,有利于其发挥益生菌制剂应有的功能。热预处理和氧化预处理对菌体酸胁迫和胆盐胁迫耐受能力的强化作用可能缘于菌体对胁迫的交叉适应,但是具体机制仍有待研究[22]。
2.3 喷雾干燥菌粉活的耐贮藏能力
相较于冷冻干燥菌粉,喷雾干燥菌粉的耐贮藏能力较弱,本文分3种贮藏条件研究了不同预处理菌粉的耐贮藏能力。对照菌粉在常温贮藏下活性仅能维持3周,随后迅速损失,在一个月内存活率即降至0(图3c);在4 ℃和−20 ℃条件下,耐贮藏能力较好且相似,在4个月内一直维持在20%以上(初始为29%),且后期趋于平稳,无下降趋势(图3a, 3b)。热预处理组菌粉在−20 ℃的贮藏环境中存活率较为稳定,贮藏120 d后,其存活率仍然大于80%,而且在贮藏后期存活率几乎保持不变(图3a);在4 ℃环境下的耐贮藏能力稍弱,120 d储藏后热预处理组菌粉存活率下降到65%,但仍大幅高于对照菌株(图3b);在常温下耐贮藏能力极弱,甚至弱于对照菌粉,存活率在3周内即下降至0(图3c)。氧化预处理组同样在−20 ℃的贮藏条件下贮藏能力最好,菌粉贮藏120 d后存活率仍然可以维持在40%以上;4 ℃的贮藏能力稍弱,菌粉贮藏120 d后存活率下降到35%;氧化预处理组菌粉在这两种条件下的表现均优于对照组而劣于热预处理组。氧化预处理组菌粉在常温条件下活性下降同样很快,贮藏3周内即下降至0。
室温条件不适于鼠李糖乳杆菌 hsryfm 1301喷雾干燥菌粉的贮藏,3种菌粉在室温下存活率均大幅下降,1个月内存活率均降至检测限以下。贮藏温度越低,贮藏效果越好,这与文献报导的其它乳杆菌喷雾干燥菌粉和冷冻干燥菌粉的贮藏规律相符[23]。低温条件下,热预处理菌粉表现最好的耐贮藏能力,能够在−20 ℃或者4 ℃下长期保持较高活菌数。这表明喷雾干燥菌粉中的菌体仍维持一定的生理代谢活动,在常温下会导致菌体内平衡失调或能源耗尽,导致菌体死亡。有研究表明较低的水分活度有利于菌粉的贮藏,但是需要较高的出风温度,进而导致较低的存活率[15]。因此,通过比较热预处理、氧化预处理及对照菌粉中菌体的转录组或代谢组数据,将有利于分析菌体耐贮藏的内在机制,为提高耐菌粉贮藏能力提供理论支持。
3. 结论
鼠李糖乳杆菌 hsryfm 1301经喷雾干燥后能够保持一定的活菌数量,热预处理和氧化预处理可以有效提高菌株在喷雾干燥中的存活率、菌粉的胃肠道环境耐受能力和低温下的耐贮藏能力。热预处理比氧化预处理有更好的处理效果,不同预处理手段的不同效果,也为喷雾干燥中热胁迫和氧化胁迫的耐受研究提供了新的切入点。本研究获得的喷雾干燥菌粉存活率和胃肠道耐受能力较好,但是贮存条件较为苛刻,未来通过综合不同预处理手段及培养条件,改进喷雾干燥参数,将使喷雾干燥在菌粉生产中的应用更进一步。
-
图 1 热预处理和氧化预处理后菌株的喷雾干燥存活率
注:不同小写字母表示差异显著,P<0.05;图2同。
Figure 1. Survival rates of heat pre-treated or oxidative pre-treated L. rhamnosus hsryfm 1301 cells during spray drying
-
[1] TRIPATHI M K, GIRI S K. Probiotic functional foods: Survival of probiotics during processing and storage[J]. Journal of Functional Foods,2014,9(9):225−241.
[2] KARIMI R, MORTAZAVIAN A M, DA CRUZ A G. Viability of probiotic microorganisms in cheese during production and storage: A review[J]. Dairy Science and Technology,2011,91(3):283−308. doi: 10.1007/s13594-011-0005-x
[3] PAPADIMITRIOU K, ALEGRÍA Á, BRON P A, et al. Stress physiology of lactic acid bacteria[J]. Microbiology and Molecular Biology Reviews,2016,80(3):837−890. doi: 10.1128/MMBR.00076-15
[4] DIMITRELLOU D, KANDYLIS P, PETROVIĆ T, et al. Survival of spray dried microencapsulated Lactobacillus casei ATCC 393 in simulated gastrointestinal conditions and fermented milk[J]. LWT - Food Science and Technology,2016,71:169−174. doi: 10.1016/j.lwt.2016.03.007
[5] SIMPSON P J, STANTON C, FITZGERALD G F, et al. Intrinsic tolerance of Bifidobacterium species to heat and oxygen and survival following spray drying and storage[J]. Journal of Applied Microbiology,2005,99(3):493−501. doi: 10.1111/j.1365-2672.2005.02648.x
[6] DIJKSTRA A R, SETYAWATI M C, BAYJANOV J R, et al. Diversity in robustness of Lactococcus lactis strains during heat stress, oxidative stress, and spray drying stress[J]. Applied and Environmental Microbiology,2014,80(2):603−611. doi: 10.1128/AEM.03434-13
[7] CHEN D, YANG Z, CHEN X, et al. Effect of Lactobacillus rhamnosus hsryfm 1301 on the gut microbiota and lipid metabolism in rats fed a high-fat diet[J]. Journal of Microbiology and Biotechnology,2015,25(5):687−695. doi: 10.4014/jmb.1409.09085
[8] ZHANG C, LU J, YANG D, et al. Stress influenced the aerotolerance of Lactobacillus rhamnosus hsryfm 1301[J]. Biotechnology Letters,2018,40(4):729−735. doi: 10.1007/s10529-018-2523-6
[9] ZHANG C, GUI Y, CHEN X, et al. Transcriptional homogenization of Lactobacillus rhamnosus hsryfm 1301 under heat stress and oxidative stress[J]. Applied Microbiology and Biotechnology,2020,104(6):2611−2621. doi: 10.1007/s00253-020-10407-3
[10] SOLMAZ B, CHRISTOS S, LINA Y, et al. Optimization of spray-drying process conditions for the production of maximally viable microencapsulated L. acidophilus NCIMB 701748[J]. Drying Technology,2013,31(11):1274−1283. doi: 10.1080/07373937.2013.788509
[11] JIMMY P, MARTIJN B F, CHEN S, et al. Interactions between formulation and spray drying conditions related to survival of Lactobacillus plantarum WCFS1[J]. Food Research International,2014,56:9−17. doi: 10.1016/j.foodres.2013.12.007
[12] ZHANG C, YANG L, DING Z, et al. New selective media for isolation and enumeration of Lactobacillus rhamnosus and Streptococcus thermophilus[J]. Journal of Food Measurement and Characterization,2019,13:1431−1439. doi: 10.1007/s11694-019-00059-x
[13] TYMCZYSZYN E E, GÓMEZ-ZAVAGLIA A, DISALVO E A. Effect of sugars and growth media on the dehydration of Lactobacillus delbrueckii ssp. bulgaricus[J]. Journal of Applied Microbiology,2007,102(3):845−851. doi: 10.1111/j.1365-2672.2006.03108.x
[14] WU Q, ZHANG C, WA Y, et al. Correlation between exopolysaccharide biosynthesis and gastrointestinal tolerance of Lactiplantibacillus plantarum[J]. Journal of Applied Microbiology, 2021,doi: 10.1111/JAM.15213.
[15] SATU V, KARI S, SEPPO S. Water activity in dry foods containing live probiotic bacteria should be carefully considered: A case study with Lactobacillus rhamnosus GG in flaxseed[J]. International Journal of Food Microbiology,2012,157(2):319−321. doi: 10.1016/j.ijfoodmicro.2012.05.016
[16] BARBOSA J, BORGES S, TEIXEIRA P. Influence of sub-lethal stresses on the survival of lactic acid bacteria after spray-drying in orange juice[J]. Food Microbiology,2015,52:77−83. doi: 10.1016/j.fm.2015.06.010
[17] PAÉZ R, LAVARI L, VINDEROLA G, et al. Effect of heat treatment and spray drying on Lactobacilli viability and resistance to simulated gastrointestinal digestion[J]. Food Research International,2012,48(2):748−754. doi: 10.1016/j.foodres.2012.06.018
[18] DESMOND C, STANTON C, FITZGERALD G F, et al. Environmental adaptation of probiotic Lactobacilli towards improvement of performance during spray drying[J]. International Dairy Journal,2001,11(10):801−808. doi: 10.1016/S0958-6946(01)00121-2
[19] GÉRALDINE B, DIETER V, INGMAR J J, et al. Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J]. International Journal of Pharmaceutics,2016,505(1−2):303−318. doi: 10.1016/j.ijpharm.2016.04.002
[20] PRASAD J, MCJARROW P, GOPAL P K. Heat and osmotic stress responses of probiotic Lactobacillus rhamnosus HN001 (DR20) in relation to viability after drying[J]. Applied and Environmental Microbiology,2003,69(2):917−925. doi: 10.1128/AEM.69.2.917-925.2003
[21] 陈大卫. 辅助降血脂益生乳酸菌的筛选及其对高血脂大鼠肠道菌群的影响[D]. 扬州: 扬州大学, 2015 CHEN D W. Screening of auxiliary hypolipidemic properties of probiotic and its impact on the intestinal microbiota of hyperlipidemia rat model [D]. Yangzhou: Yangzhou University, 2015.
[22] YANG H, HE M, WU C. Cross protection of lactic acid bacteria during environmental stresses: Stress responses and underlying mechanisms[J]. LWT-Food Science and Technology,2021,144:111203. doi: 10.1016/j.lwt.2021.111203
[23] SUN H, HUA X, ZHANG M, et al. Whey protein concentrate, pullulan, and trehalose as thermal protective agents for increasing viability of Lactobacillus plantarum starter by spray drying[J]. Food Science of Animal Resources,2020,40(1):118−131. doi: 10.5851/kosfa.2019.e94
-
期刊类型引用(10)
1. 尉洁,张玲芳,胡顺安,秦孟春,马琳,李丹,段翠翠. 长白山区发酵酱菜中高产胞外多糖乳酸菌的筛选及多糖抗氧化性分析. 食品工业科技. 2024(02): 110-117 .  本站查看
本站查看
2. 赵丹,赵守祺,王烁,陈曦,杜仁鹏. 融合魏斯氏菌P2胞外多糖对巨噬细胞RAW264.7增殖及免疫调节活性的影响. 黑龙江大学自然科学学报. 2024(02): 200-206 .  百度学术
百度学术
3. 虞宁馨,于连升,齐心彤,葛菁萍,杜仁鹏. 肠膜明串珠菌葡聚糖蔗糖酶的生物信息学分析. 黑龙江大学自然科学学报. 2024(05): 544-552 .  百度学术
百度学术
4. 于连升,葛菁萍,平文祥,杜仁鹏. 环二鸟苷酸调控细菌胞外多糖生物合成的研究进展. 食品工业科技. 2023(09): 422-430 .  本站查看
本站查看
5. 张孟雨,李尧,彭嘉屹,陈禹豪,曾凤婷,钟青萍. 高产EPS乳酸片球菌的航天育种及其EPS性能研究. 食品工业科技. 2023(17): 158-167 .  本站查看
本站查看
6. 李旭阳,郭润晴,路江浩,鄢梦洁,张鹏,刘明月,杨玲. 嗜热链球菌S131对巨噬细胞的免疫调节作用研究. 食品与发酵工业. 2023(16): 247-252 .  百度学术
百度学术
7. 罗伟,杨立军,崔晨旭,王玉娇,陈琼,王锐丽,叶润. 内生菌协同发酵对半夏多糖及其生物活性的影响. 中南农业科技. 2023(08): 52-56+61 .  百度学术
百度学术
8. 杨立军,花娇娇,崔晨旭,贾艳娇,陈琼,赫丁轩. 一株高产胞外多糖半夏内生真菌的鉴定、发酵条件优化及生物活性测定. 中国酿造. 2023(11): 109-114 .  百度学术
百度学术
9. 唐华英,罗欣锦,张云野,杨睿睿,叶广彬,王长丽. 假肠膜明串珠菌GX-3产胞外多糖条件优化及其理化性质研究. 中国乳品工业. 2022(08): 15-19+26 .  百度学术
百度学术
10. 兰冬雪,瞿茜楠,黄天,姚国强,扎木苏,彭传涛,李兆杰. 益生菌活性代谢产物的研究及应用进展. 食品工业科技. 2022(24): 11-20 .  本站查看
本站查看
其他类型引用(0)







 下载:
下载:


 下载:
下载:



