Effect of in Vitro Simulated Digestion on Flavonoid and Reducing Ability of Fresh-cut Apple Residue
-
摘要: 通过体外模拟胃肠消化的方法对鲜切苹果皮渣黄酮进行体外模拟试验,测定模拟消化过程中黄酮含量和其还原能力,分析其变化规律,以期为鲜切苹果皮渣的进一步开发利用提供参考价值。结果表明,在模拟胃消化过程中,和未消化组相比,鲜切苹果皮渣黄酮含量和还原力在2 h内显著提高(P<0.05),胃蛋白酶和酸性环境对黄酮的释放和黄酮抗氧化能力均有促进作用;在肠消化模拟过程中,和未消化组相比,鲜切苹果皮渣黄酮含量在2~3 h内显著提高(P<0.05),还原力也随之明显增强。肠液消化组(有胰酶)的黄酮含量和还原能力均高于空白组(无胰酶),胰酶对黄酮的释放及其还原能力起到增强作用。Abstract: The in vitro simulation of gastrointestinal digestion was performed on the flavonoid of fresh-cut apple pomace residue to determine the changes of flavonoids content and their reducing ability during the simulated digestion process, in order to provide reference values for the further development and utilization of flavonoids in fresh-cut apple peels and pomace. The results showed that flavonoids content and reducing ability during the gastric digestion simulation increased significantly in 2 h compared with the undigested group(P<0.05). Pepsin and sour chemical environment had a facilitating effect on both the release and reduction ability of flavonoids. During the intestinal digestion simulation, the flavonoids obviously increased during 2~3 h of digestion compared with the undigested group(P<0.05), and the reducing ability also significantly increased. The flavonoid content and reducing ability of intestinal juice digestion group (with pancreatic enzyme) were higher than that of blank group (without pancreatic enzyme), the pancreatic enzyme also played a positive enhancing effect on both the release of flavonoids and their reducing ability.
-
Keywords:
- fresh-cut apple /
- residue /
- flavonoids /
- reducing ability /
- in vitro simulation of digestion
-
苹果因其口感爽脆多汁,酸甜可口,且具有美容养颜安神、增强记忆、提升智力等作用,所以又被称为“智慧果”,深受各个年龄段人群的喜欢;我国苹果的产量和消费水平均位居世界前列[1-2]。随着消费水平的提高,鲜切苹果迅速发展起来,鲜切苹果方便、快捷、新颖,并富含多种抗氧化活性物质,受到了消费者的青睐,在家庭消费及餐饮行业特别是快餐和配餐行业中广受欢迎。目前在欧美等发达国家和地区已经实现鲜切苹果的规范化和系统化生产,在鲜切产品消费中占有重要地位[3-5],在我国的发展前景也极为可观。
鲜切苹果是供消费者或餐饮行业即食的轻度加工产品,因此对原料的成熟度、含糖量及营养成分含量等要求高,宜选择不容易软化、粉质化品种如富士等[6],苹果皮渣产量约占苹果总量的20%~30%[7],大量皮渣被废弃或填埋,造成资源浪费。皮渣中含有甚至超过果肉的营养成分,除了丰富的膳食纤维外,还有酚类物质、黄酮类物质和二十八烷醇等物质,苹果中将近一半的VC也在紧贴果皮的部位[8]。黄酮类成分是苹果皮渣的最主要成分,主要包括黄烷醇类、黄酮醇类、二氢查耳酮类等,其总含量为834.2~2300.3 mg/kg,远高于果肉中15~605.6 mg/kg的含量[9],且具有很高的药用价值,对于预防心血管疾病、冠心病等慢性疾病有一定的治疗效果[10-11]。因此鲜切苹果皮渣具有极强的利用价值。
近几年,生物活性物质和营养成分的体外模拟消化研究受到国内外的广泛关注[12-14]。相对于体内消化,体外模拟胃、肠等的消化更为简单、易行、有效,可以在一定程度上反映食品、药品等在体内的变化规律,易于控制,省时省力[15-18],常用来分析食品、药品及活性物质消化前后结构变化、生物利用度及消化率等[19-21]。目前关于富含黄酮类物质的鲜切苹果皮渣这一加工副产物的消化过程变化报道较少。本文尝试通过体外模拟胃肠消化方法,评价鲜切苹果皮渣黄酮粗提物在消化过程中含量及还原力的变化规律,以期对鲜切苹果皮渣黄酮进行更加全面科学的判断和评价,为鲜切苹果加工副产物在医药、食品以及保健品等行业中的应用提供参考。
1. 材料与方法
1.1 材料与仪器
红富士苹果 产地为新疆,市售;胃蛋白酶(30000 U/g)、胰酶(4000 U/g)、α-淀粉酶(4000 U/g) 生化试剂,上海源叶生物技术有限公司;氢氧化钠、氯化钙、氯化钠、硝酸铝、氯化钾、三氯乙酸、碳酸氢钠、盐酸、磷酸氢二钠、亚硝酸钠、三氯化铁、无水乙醇等 均为国产分析纯。
SpectraMax iD3多功能酶标仪 美国分子仪器公司;HZC-250型恒温振荡培养箱 上海巴玖实业有限公司;JA5002 电子天平 上海浦春计量仪器有限公司;LGJ-10F 真空冷冻干燥机 北京松源华兴科技发展有限公司;CP225D分析天平 SARTORIUS公司;MDF-382E(N)型超低温冰箱 日本三洋公司;DR04型冷柜 青岛海尔特种电冰柜有限公司;苹果自动去皮切瓣机 北京燕诚集团;SY-1000E多用途恒温超声波提取机 北京弘祥隆生物技术开发有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 黄酮提取方法
苹果经过鲜切生产线上的自动去皮切瓣机后收集皮渣。将皮渣速冻后,进行真空冷冻干燥处理,干燥后的皮渣打粉,过100目筛备用。根据前期预实验结果,取苹果皮渣粉末与85%乙醇,料液比为1:15(w/v),置于恒温超声波提取机中,超声功率600 W,40 ℃超声60 min,冷却后抽滤,再将滤渣按上述条件重复提取1次,合并滤液。将滤液真空浓缩,浓缩比例为30:1(体积比),然后−80 ℃保存备用。
1.2.2 体外模拟消化
体外模拟消化包括口腔、胃消化和肠道消化三部分。先进行口腔和胃消化,然后进行肠消化。
1.2.2.1 消化液的配制
模拟唾液:配制α-淀粉酶/CaCl2溶液,将0.00918 g α-淀粉酶和0.015 g无水氯化钙加水定容至100 mL。
体外模拟胃液:在500 mL胃电解质溶液中加入0.0135 g胃蛋白酶,混合均匀后用1 mol/L HCl调pH至2。称取氯化钠3.1 g、氯化钾1.1 g、氯化钙0.15 g、碳酸氢钠0.6 g,溶解后定容至1 L,配制成胃电解质溶液[13,22]。
体外模拟肠液:向100 mL肠电解质溶液中加入同体积的胰酶溶液,摇匀,调节pH至7(用1 mol/L NaHCO3调节)。称取5.4 g氯化钠、0.65 g氯化钾、0.33 g氯化钙,溶解后定容至1 L,配制成肠电解质溶液。胰酶溶液:7 g胰酶溶于100 mL去离子水,6000 r/min离心10 min,取上清待用[13,22]。
1.2.2.2 模拟口腔和胃消化
参照文献[22-23]的方法并稍做改进。将黄酮提取液分别稀释1、2、4倍,配成高、中、低浓度,分别取1 mL,加入α-淀粉酶/CaCl2溶液(模拟唾液),混匀后在37 ℃恒温培养箱中振荡10 min(模拟口腔消化),然后加入体外模拟胃液10 mL(酸对照组为黄酮中浓度稀释液,不添加胃蛋白酶的胃电解质溶液,调节pH为2;空白对照组为黄酮中浓度稀释液,不调节pH的胃电解质溶液),调节样品组pH为2,然后于37 ℃恒温摇床150 r/min进行胃消化,分别于消化0、0.5、1、2 h后取样,6000 r/min离心10 min,取上清液于−80 ℃保存备用。
1.2.2.3 模拟肠消化
参照文献[13,23]的方法并稍做改进。将上述不同稀释倍数黄酮提取液经过模拟口腔和胃消化后,在消化液中加入体外模拟肠液10 mL(空白对照组为黄酮中浓度稀释液,加入肠电解质溶液,不添加胰酶),开始模拟肠道消化阶段。调节样品组和空白对照组的pH至7.2(用1 mol/L NaHCO3调节),然后置于恒温摇床中150 r/min、37 ℃进行消化培养,分别于0、0.5、1、2、3、4 h取样,6000 r/min离心10 min,取上清液于−80 ℃保存备用。
1.2.3 黄酮含量的测定
采用硝酸铝-亚硝酸钠比色法[24]取0.5 mL样品液,加入5%亚硝酸钠溶液0.15 mL,静置6 min后加入0.15 mL 10%硝酸铝溶液,静置6 min,加入4% NaOH溶液2 mL,加蒸馏水定容至5 mL,振荡混匀,静置3 min,在508 nm处测定吸光值。以芦丁为标准品,测定黄酮总含量。
1.2.4 还原能力的测定
采用普鲁士蓝法[25],移取0.5 mL模拟胃、肠消化液,依次加入0.2 mol/L磷酸盐缓冲液(pH=6.6)1.25 mL和1%的六氰合铁酸钾溶液1.25 mL,50 ℃水浴20 min,快速冷却,再加入10%三氯乙酸1.25 mL,3000 r/min离心10 min,移取上清液1.25 mL,依次加入1.25 mL蒸馏水,0.1%三氯化铁溶液0.25 mL,振荡摇匀,静置10 min,在波长为700 nm处测定其吸光值。
1.3 数据处理
数据用三次平均值±SD表示。采用 SPSS22.0 对数据进行单因素方差统计分析(ANOVA),LSD检验,以P<0.05作为差异显著性判断标准。
2. 结果与分析
2.1 模拟消化对鲜切苹果皮渣黄酮释放量的影响
2.1.1 体外模拟胃消化
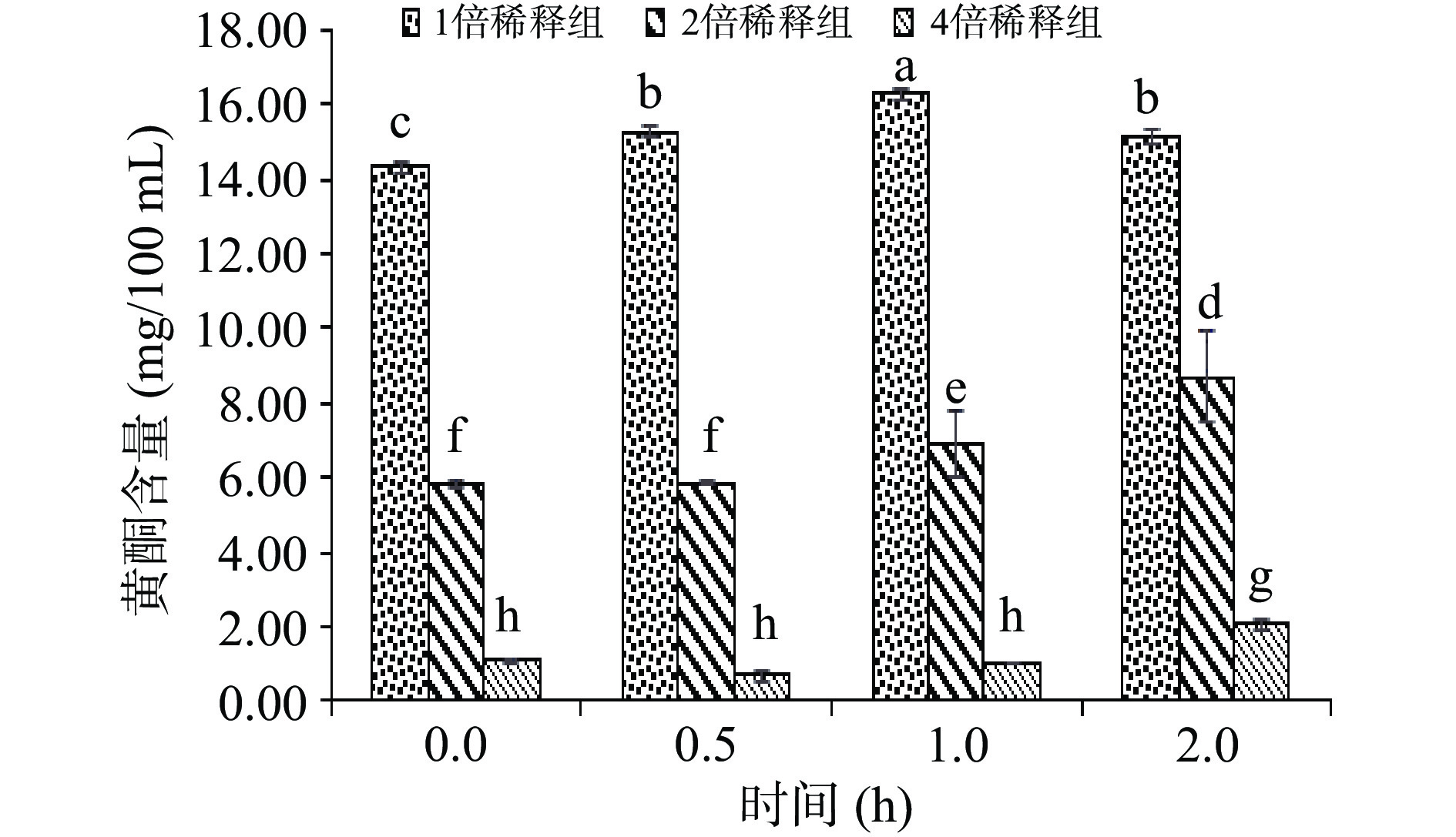
体外模拟胃消化过程中鲜切苹果皮渣黄酮释放量的变化情况如图1、图2所示。
由图1可见,三种不同浓度的黄酮提取液在相同模拟胃消化环境中发生的整体变化趋势均表现为含量上升。胃消化过程中,不同浓度间黄酮含量差异显著(P<0.05)。1倍稀释组在消化0.5 h以后释放量开始显著上升(P<0.05),1 h达到最大值,而后释放量略有下降;2倍稀释组和4倍稀释组黄酮含量在1 h后显著上升(P<0.05),证明随着胃消化时间延长,黄酮是一个持续缓慢释放的过程。
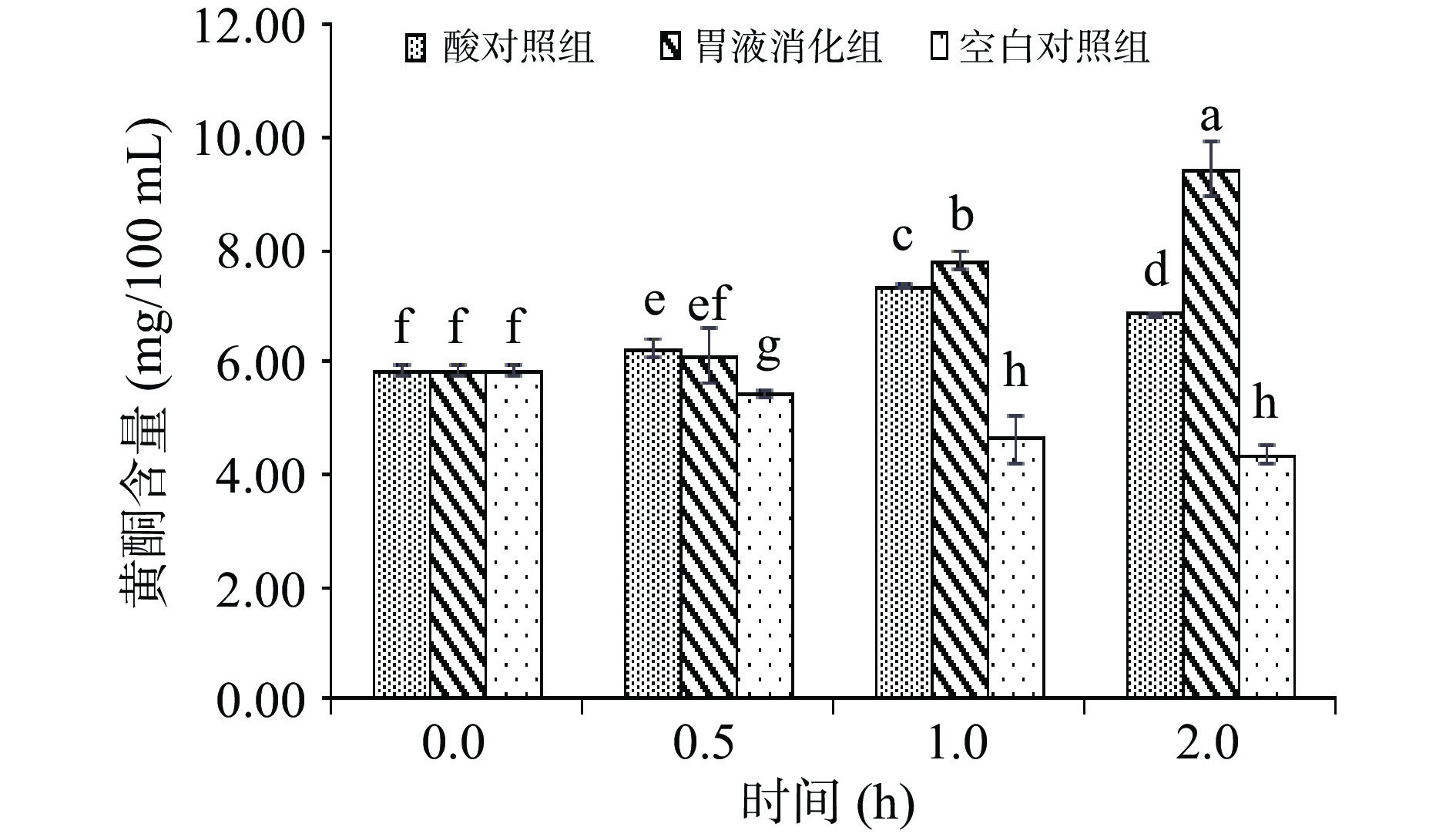
图2所示,胃消化阶段,胃液消化组、酸对照组和空白组三组的变化趋势。有胃蛋白酶的胃液消化组和无胃蛋白酶的酸对照组,采用中浓度黄酮提取液(即2倍稀释)黄酮含量在模拟胃消化过程中显著增加(P<0.05),逐渐趋于稳定,空白组在消化过程中黄酮含量下降后趋于稳定,这表明胃蛋白酶和胃酸对黄酮的释放均具有一定的促进作用,且加有胃蛋白酶的胃消化模拟体系中皮渣黄酮含量高于无胃蛋白酶的酸消化模拟体系,说明胃蛋白酶对黄酮释放的促进作用高于酸对照组。
胃消化过程中,黄酮释放量的显著升高可能是由于部分蛋白质在胃蛋白酶的作用下水解,使得被大分子蛋白质包埋的黄酮类物质被释放出来;也可能是胃蛋白酶的作用使多酚-蛋白质结构遭到破坏,多酚脱离蛋白质分子的束缚[23];黄酮类物质属于多酚中具有高抗氧化活性的一类物质,含量增加还可能是胃蛋白酶减弱了部分酚酸与细胞壁间的酯键,使酚酸从细胞壁中脱离。而酸性环境同样有此类效果,例如野樱莓、黑果枸杞中多酚的体外消化试验也发现酶解和pH变化更易于使多酚类物质由结合态变为自由态[26-27]。
2.1.2 体外模拟肠消化
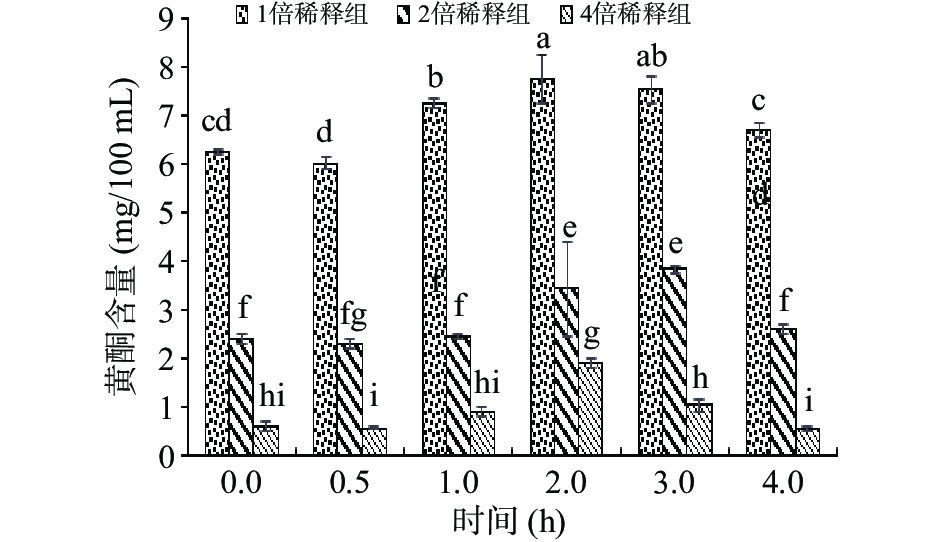
体外模拟肠消化过程中鲜切苹果皮渣黄酮释放量的变化情况如图3和图4所示。
经模拟胃环境消化后,进入模拟肠消化阶段。由图3可知,鲜切苹果皮渣黄酮在肠道消化过程中,呈现先缓慢增加后下降的趋势。不同浓度间,肠消化过程中黄酮含量差异显著(P<0.05)。高、中、低浓度的苹果皮渣黄酮粗提物的含量在肠消化2 h后显著上升(P<0.05),2~3 h黄酮含量达最大值,分别是肠消化开始时(0 h,即胃消化反应后但未进行肠消化时)的1.24、1.59、3.15倍。
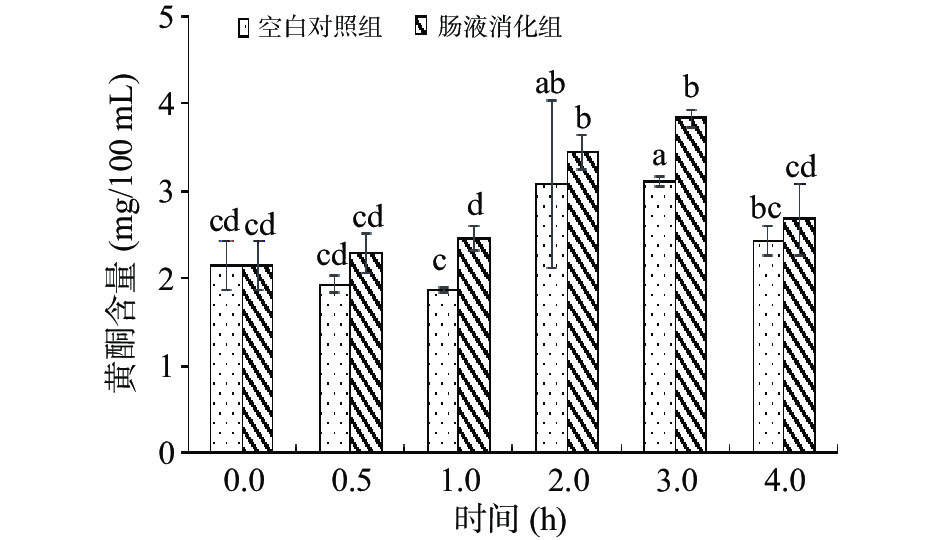
如图4,对比发现相同浓度的黄酮粗提液经过相同的胃消化模拟环境,空白组(即无胰酶环境)的粗提液黄酮含量与肠消化液组(有胰酶环境),均呈现先上升再下降的趋势,肠液消化组的黄酮含量高于空白组。肠消化过程中,3 h之前肠消化组黄酮含量高于空白对照组,且在0、0.5、2.0 h时黄酮含量没有显著性差异(P>0.05),3 h时肠液消化组显著高于空白组(P<0.05)。在消化的第3 h左右达到峰值,后缓慢降低。对比得出,有胰酶的肠模拟溶液一定程度可以促进黄酮释放。随着消化时间的延长,酯键可能被水解或部分黄酮降解,因而使黄酮含量在肠消化后端降低。
肠消化过程中,黄酮释放量的显著升高可能是由于部分蛋白质在胰酶的作用下水解,使得被大分子蛋白质包埋的黄酮类物质被释放出来;肠液消化组的酶可能作用于结合态的黄酮类物质,中性或偏碱性黄酮(如槲皮素等)可以在肠液介质中释放,并稳定存在。而肠消化后期随着酸性黄酮(如黄烷-3-醇等[18])大量降解或发生异构,释放的黄酮低于降解的黄酮,从而使黄酮总量降低[28]。
2.2 体外模拟消化过程中鲜切苹果皮渣黄酮粗提液还原能力的变化
2.2.1 体外模拟胃消化
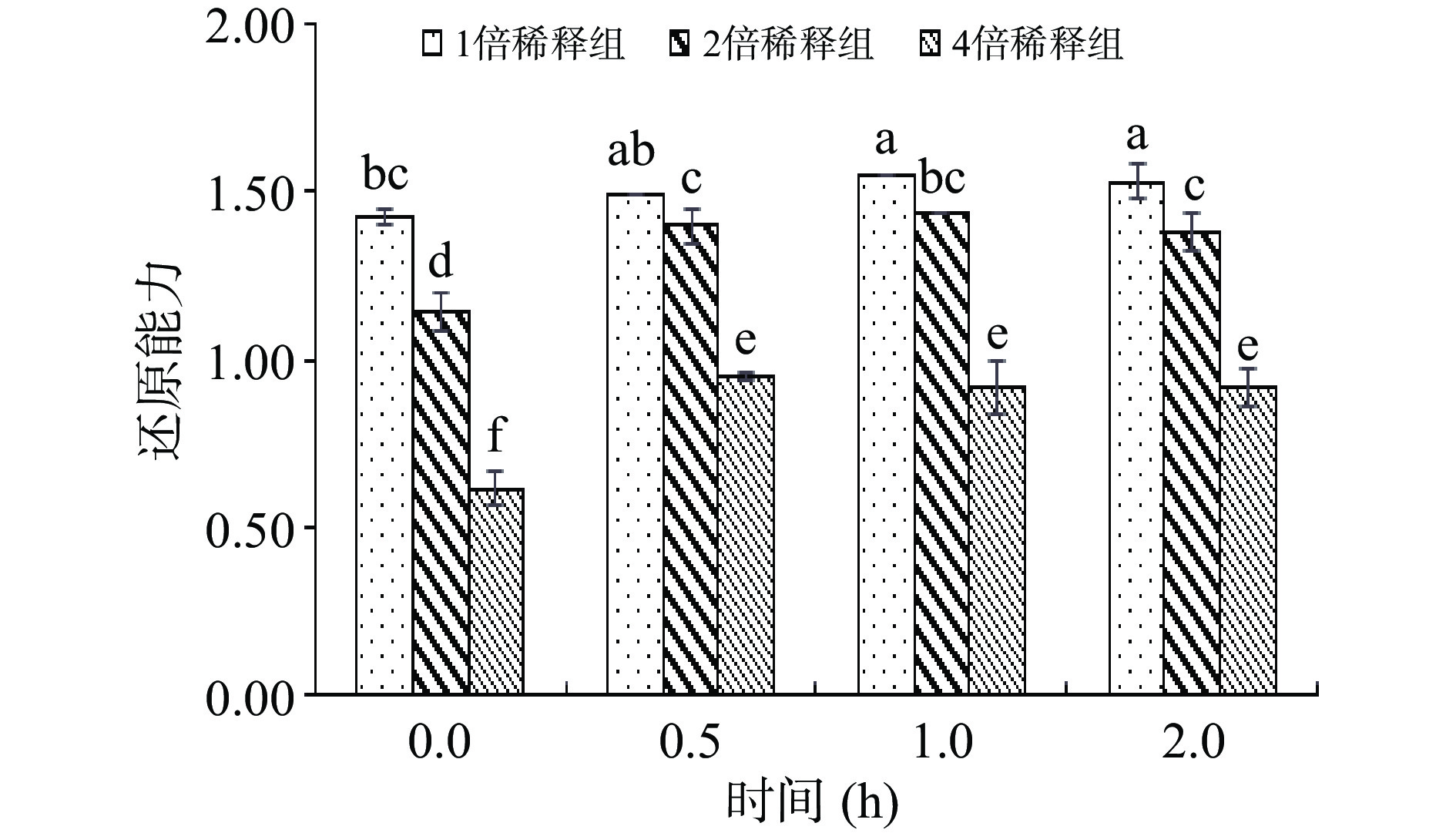
体外模拟胃消化对鲜切苹果皮渣粗提物还原能力的影响见图5和图6。
从图5可以看出,在模拟胃消化过程中,其还原能力逐渐升高,并趋于稳定,这与黄酮释放量的变化规律基本一致。不同浓度间,胃消化过程中还原力差异显著(P<0.05),浓度越高,总还原力越强。2倍稀释组和4倍稀释组在0.5 h的还原能力就显著高于0 h(P<0.05),1倍稀释组在消化1 h的还原能力显著高于0 h(P<0.05)。
由图6可知,模拟胃液消化和酸消化后鲜切苹果皮渣黄酮的总还原力均提高。胃液消化组(pH=2,有胃蛋白酶)和酸对照组(pH=2,无胃蛋白酶)的还原能力显著高于空白对照组(P<0.05)。胃消化1 h时胃液消化组和酸对照组的总还原力分别是空白对照组的1.39倍和1.29倍。而胃液消化组的还原力在1 h以后又高于酸对照组,说明酸性条件和胃蛋白酶均有利于鲜切苹果皮渣黄酮抗氧化活性的发挥,胃液消化对还原力的增强能力大于酸消化。可能是由于结合型黄酮类物质在体外经酸水解、酶水解等方式破坏酯键、醚键等得以释放[29],使其表现出较强的生物活性(还原性),因此消化后具有较高的保健价值。
2.2.2 体外模拟肠消化
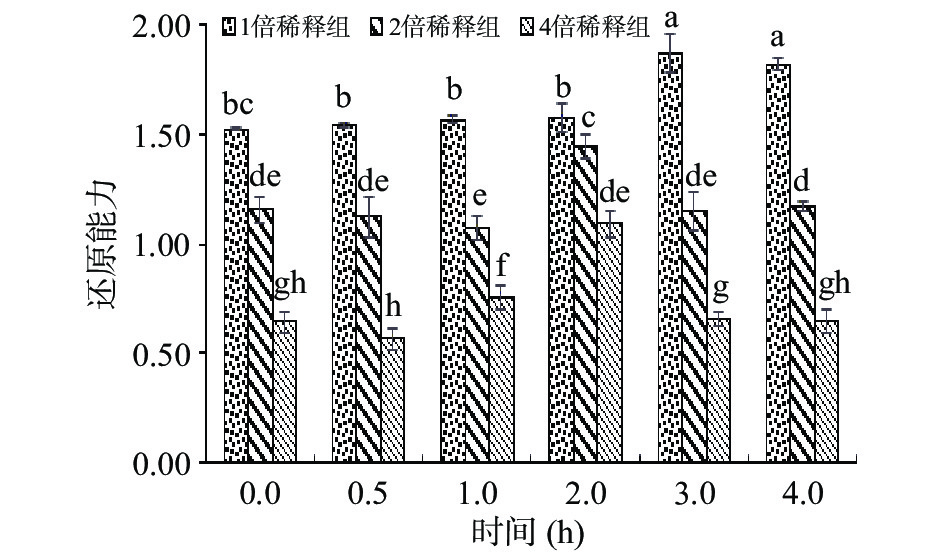
体外模拟肠消化对鲜切苹果皮渣黄酮粗提物还原能力的影响见图7和图8。
图7所示,模拟肠道消化环境中,随着消化时间的延长,各组还原能力呈先增加再降低的趋势。肠消化1 h以内,三组浓度的总还原力均无显著变化,各浓度之间还原力差异显著(P<0.05),在消化2~3 h时,各组样品均呈现还原能力增强的趋势;鲜切苹果皮渣黄酮粗提液浓度越大,其还原能力也随之增大。
由图8中可以看出,整个肠消化过程中,肠液消化组(有胰酶)的还原能力一直高于空白组(无胰酶),且消化1 h后该趋势更为显著(P<0.05)。肠液消化组还原力呈现先升高后降低并趋于平稳,而空白组的还原能力1 h后略有升高,3 h后显著下降(P<0.05),说明胰酶对鲜切苹果皮渣黄酮的还原能力有一定的增强作用。
黄酮类化合物以黄烷为母核,羟基的数量和位置都极大地影响了其抗氧化能力[30]。苹果果实类黄酮达34种,分属黄烷醇、黄酮醇、花青苷、二氢查耳酮和二氢黄酮醇5类[31],总还原力的变化可能与黄酮物质的结构及含量的变化有关,胃肠环境的变化也影响黄酮类物质的结构和抗氧化活性的发挥。另外,抗氧化活性也是体系中所有抗氧化物质发挥协同和拮抗作用的结果。
3. 结论
在模拟胃、肠消化过程中,鲜切苹果皮渣黄酮释放量均有显著升高(P<0.05),还原能力增强。在模拟胃消化中,胃蛋白酶和酸性环境对黄酮的释放和黄酮还原力均有促进作用,鲜切苹果皮渣黄酮粗提液浓度越大,还原力也越大;在模拟肠消化中,胰酶可以在一定程度上促进黄酮的释放,同时对还原能力也有增强作用,且鲜切苹果皮渣黄酮粗提液浓度越大,肠道中黄酮的还原力也越大。
任何一种生物活性物质在发挥其作用之前,都要经过人体的胃肠道消化,而消化也会对黄酮类化合物的生物活性产生影响。通过体外模拟肠胃消化法可以评价鲜切苹果皮渣在胃肠消化模拟过程中黄酮含量和其粗提液还原能力的变化规律。但体内环境相当复杂多变,还受到原料品种、取样位置等的影响,因此可通过进一步的动物实验、人体实验等进行验证探究。
-
-
[1] VRHOVSEK U, RIGO A, TONON D, MATTIVI F. Quantitation of polyphenols in different apple varieties[J]. Journal of Agricultural and Food Chemistry,2004,52(21):6532−6538. doi: 10.1021/jf049317z
[2] 唐先谱, 李喜宏, 张彪, 等. 复合保鲜剂对鲜切苹果贮藏品质影响的研究[J]. 中国食品添加剂,2018(2):138−143. [TANG X P, LI X H, ZHANG B, et al. Research on the effect of compound preservatives on the storage quality of fresh cut apple[J]. China Food Additives,2018(2):138−143. doi: 10.3969/j.issn.1006-2513.2018.02.015 [3] 陈晨, 胡文忠, 姜爱丽, 等. 半胱氨酸控制鲜切苹果褐变的生理机制[J]. 食品科学,2018,39(3):282−288. [CHEN C, HU W Z, JIANG A L, et al. Physiological mechanism for browning inhibition in fresh-cut apple by cysteine[J]. Food Science,2018,39(3):282−288. doi: 10.7506/spkx1002-6630-201803042 [4] CORTELLINO G, GOBBI S, BIANCHI G, RIZZOLO A. Modified atmosphere packaging for shelf life extension of fresh-cut apples[J]. Trends in Food Science and Technology,2015,46(2):320−330. doi: 10.1016/j.jpgs.2015.06.002
[5] 管磬馨, 胡文忠, 李婉莹, 等. 毛茶茶多酚提取工艺优化及其对鲜切苹果品质的影响[J]. 食品工业科技,2019,40(23):124−129. [GUAN Q X, HU W Z, LI W Y, et al. Optimization of extraction process of tea polyphenols from Maocha tea and its effect on quality of fresh-cut apples[J]. Science and Technology of Food Industry,2019,40(23):124−129. [6] 王宝刚. 鲜切水果加工技术与质量评价[M]. 北京: 中国轻工业出版社, 2021 WANG B G. Fresh-cut fruit processing technology and quality evaluation[M]. Beijing: China Light Industry Press, 2021.
[7] 韦婷, 何靖柳, 冯林, 等. 苹果皮渣的利用现状及展望[J]. 广东蚕业,2020,54(6):28−29. [WEI T. Utilization status and prospect of apple peel[J]. Guangdong Sericulture,2020,54(6):28−29. doi: 10.3969/j.issn.2095-1205.2020.06.11 [8] 冯涛, 杨容, 李越敏, 等. 苹果多酚提取物抗氧化活性研究[J]. 食品研究与开发,2008,29(12):189−192. [FENG T, YANG R, LI Y M, et al. Study on antioxidant activity of apple polyphenol extracts[J]. Food Research and Development,2008,29(12):189−192. doi: 10.3969/j.issn.1005-6521.2008.12.055 [9] 麻剑南, 何倩倩, 王雅丽, 等. 苹果皮有效成分及药理作用研究进展[J]. 食品与药品,2013,15(3):219−223. [MA J N, HE Q Q, WANG Y L, et al. Research progress on chemical constituents and pharmacological effects of apple peels[J]. Food and Drug,2013,15(3):219−223. doi: 10.3969/j.issn.1672-979X.2013.03.026 [10] LIN T E, LESCH A, LI C L, GIRAULT H H. Mapping the antioxidant activity of apple peels with soft probe scanning electrochemical microscopy[J]. Journal of Electroanalytical Chemistry,2017,786:120−128. doi: 10.1016/j.jelechem.2017.01.015
[11] 王玉, 刘琦, 耿杰. 沙棘黄酮的分离纯化及其抗运动性疲劳作用[J]. 食品工业科技,2020,41(23):169−174. [WANG Y, LIU Q, GENG J. Purification and resisting movement fatigue activity of flavonoids from Hippophae rhamnoides L[J]. Science and Technology of Food Industry,2020,41(23):169−174. doi: 10.13386/j.issn1002-0306.2020020153 [12] HUANG H Z, SUN Y J, LOU S T, et al. In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (Myrica rubra Sieb. et Zucc.) fruits: A comparison with traditional methods[J]. Food Chemistry,2014,146:363−370. doi: 10.1016/j.foodchem.2013.09.071
[13] GUMIENNA M, LASIK M, CZARNECKI Z. Bioconversion of grape and chokeberry wine polyphenols during simulated gastrointestinal in vitro digestion[J]. International Journal of Food Science and Nutrition,2011,62(3):226−233. doi: 10.3109/09637486.2010.532115
[14] MR A, TMC A, HCDSH A, et al. Encapsulation of broccoli extract by electrospraying: Influence of in vitro simulated digestion on phenolic and glucosinolate contents, and on antioxidant and antihyperglycemic activities-ScienceDirect[J]. Food Chemistry,2020:339.
[15] IORE R, BARILLARI J, ROLLIN P. Comment on in vitro gastrointestinal digestion study of broccoli inflorescence phenolic compounds, glucosinolates, and vitamin C[J]. Journal of Agricultural & Food Chemistry,2004,52(24):7432−7433.
[16] GULLON B, PINTADO M E, FERNÁNDEZ-LÓPEZ J, et al. In vitro gastrointestinal digestion of pomegranate peel (Punica granatum) flour obtained from co-products: Changes in the antioxidant potential and bioactive compounds stability[J]. Journal of Functional Foods,2015,19:617−628. doi: 10.1016/j.jff.2015.09.056
[17] 曹卓阳, 林晓娟, 张宏婧, 等. 超高静压和体外消化对芝麻酚类物质、抗氧化活性及结构的影响[J]. 食品工业科技,2022,43(3):33−39. [CAO Zhuoyang, LIN Xiaojuan, ZHANG Hongjing, et al. Effects of ultra-high static pressure and in vitro digestion on phenolics, antioxidant activity and structure from sesame[J]. Science and Technology of Food Industry,2022,43(3):33−39. doi: 10.13386/j.issn1002-0306.2021040138 [18] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al. In vitro bioaccessibility and antioxidant activity of grape polyphenols[J]. Food Chemistry,2010,120(2):599−606. doi: 10.1016/j.foodchem.2009.10.030
[19] TARKO T, DUDA-CHODAK A, ZAJAC N. Digestion and absorption of phenolic compounds assessed by in vitro simulation methods. A review[J]. Roczniki Państwowego Zakadu Higieny,2013,64(2):79−84.
[20] CHEN Y, LIN H, LIN M, et al. Effect of roasting and in vitro digestion on phenolic profiles and antioxidant activity of water-soluble extracts from sesame[J]. Food and Chemical Toxicology,2020:111239.
[21] 闵芳芳, 聂少平, 万宇俊, 等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学,2013,34(21):24−29. [MIN F F, NIE S P, WAN Y J, et al. In vitro digestion and absorption of polysaccharide from Cyclocarya paliurus leaves[J]. Food Science,2013,34(21):24−29. [22] BLANQUET S, EVELIJIN Z, BEYSSAC E, et al. A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J]. Pharmaceutical Research,2004,21(4):585−591. doi: 10.1023/B:PHAM.0000022404.70478.4b
[23] 周笑犁, 吴珊珊, 林栋, 等. 体外模拟消化对蓝莓皮渣粗提物抗氧化成分及其活性的影响[J]. 食品研究与开发,2018,39(4):26−32. [ZHOU X L, WU S S, LIN D, et al. Changes in antioxidant substances and activity in crude extract of blueberry pomace during in vitro simulated digestion[J]. Food Research and Development,2018,39(4):26−32. doi: 10.3969/j.issn.1005-6521.2018.04.005 [24] LI X C, CHEN D F, MAI Y, WEN B, WANG X Z. Concordance between antioxidant activities in vitro and chemical components of Radix Astragali (Huangqi)[J]. Natural Product Research,2012,26(11):1050−1053. doi: 10.1080/14786419.2010.551771
[25] 齐美娜. 紫色马铃薯中花色苷的提取、产品研制及其抗氧化活性的研究[D]. 哈尔滨: 东北农业大学, 2013 QI M N. Studies on extraction, the development of products and antioxidant activity of anthocyanins in purple potato[D]. Harbin: Northeast Agricultural University, 2013.
[26] 楼舒婷, 林雯雯, 孙玉敬, 等. 黑果枸杞中多酚的体外消化及其抗氧化性研究[J]. 食品工业科技,2015,36(11):66−70. [LOU S T, LIN W W, SUN Y X, et al. Research of bioavailability and antioxidant activity of polyphenol in Lycium ruthenicum Murr[J]. Science and Technology of Food Industry,2015,36(11):66−70. [27] 饶雪甜, 曾新安, 林松毅, 等. 黑果腺肋花楸在体外模拟消化过程中酚类物质及抗氧化性的变化规律[J]. 现代食品科技, 2020, 36(12): 77−83 RAO X T, ZENG X A, LIN S Y, et al. Changing trends in the phenolic substances and antioxidant activities of chokeberry (Aronia melanocarpa) subjected to in vitro simulated digestion[J]. Modern Food Science and Technology, 2020, 36(12): 77−83.
[28] 彭梦雪, 从彦丽, 刘冬. 模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性的相关性[J]. 现代食品科技,2016,32(1):122−128. [PENG M X, CONG Y L, LIU D. Determination of antioxidant activity and the contents of polyphenols and flavonoids of apples by simulated gastrointestinal digestion[J]. Modern Food Science and Technology,2016,32(1):122−128. doi: 10.13982/j.mfst.1673-9078.2016.1.020 [29] 颜才植, 叶发银, 赵国华. 食品中多酚形态的研究进展[J]. 食品科学,2015,36(15):275−280. [YAN C Z, YE F Y, ZHAO G H. Review of studies on free and bound polyphenols in foods[J]. Food Science,2015,36(15):275−280. [30] OU B X, HUANG D J, HAMPSCH-WOODILL M, et al. Analysis of antioxidant activities of common vegetables employing oxygen radical absorbance capacity(ORAC) and ferric reducing antioxidant power(FRAP) assays: A comparative study[J]. Journal of Agricultural and Food Chemistry,2002,50(11):3122−3128. doi: 10.1021/jf0116606
[31] 聂继云, 吕德国, 李静, 等. 苹果果实中类黄酮化合物的研究进展[J]. 园艺学报,2009,36(9):1390−1397. [NIE J Y, LU D G, LI J, et al. Advances in studies on flavonoids in apple fruit[J]. Acta Horticulturae Sinica,2009,36(9):1390−1397. doi: 10.3321/j.issn:0513-353X.2009.09.023 -
期刊类型引用(8)
1. 邢建华,孙鹿璐,李哲贤. 儿茶素抑制p38 MAPK磷酸化减轻脂多糖诱导的大鼠心肌细胞凋亡、炎症及氧化损伤. 激光生物学报. 2024(03): 259-266 .  百度学术
百度学术
2. 李瑞雪,于江傲,冉军舰,段旭,赵瑞香,焦凌霞,杜晗笑,庞帅. 发酵果蔬汁功能特性及生物转化研究进展. 中国酿造. 2023(02): 22-26 .  百度学术
百度学术
3. 陶柏楠,金铮钰,张钰,万星. 长时程采血法及儿茶素药代动力学参数研究. 湖北民族大学学报(医学版). 2022(02): 1-4+9 .  百度学术
百度学术
4. 韦熹苑,邓琦,卢小玲,舒柯,卓燊,范家文,潘思杏. 广西不同产地金樱根及炮制品中没食子酸和儿茶素的含量差异分析. 广西植物. 2022(05): 833-844 .  百度学术
百度学术
5. 刘彦霞,秦菲. 儿茶素类物质按聚合度分离分析方法研究进展. 食品工业. 2021(05): 377-382 .  百度学术
百度学术
6. 刘海燕,曹藩荣. 茶叶中黄酮类化合物对肠道的保护作用的研究概况. 广东茶业. 2021(03): 2-7 .  百度学术
百度学术
7. 薛静秀,李涛,马哲,任建,马思雨,刘娜. EGCG-绿原酸混合液对变异链球菌抑制作用的体外研究. 现代口腔医学杂志. 2021(05): 294-297 .  百度学术
百度学术
8. 于艳华,岳显文,鲍慧玮,候新野,徐阳. HPLC法同时测定爬山虎茎中7个成分的含量. 中药材. 2021(06): 1447-1450 .  百度学术
百度学术
其他类型引用(7)





 下载:
下载:


 下载:
下载:



