Study on Structure Characterization and Anti Digestion Properties of Mung Bean Resistant Dextrin
-
摘要: 为探究绿豆抗性糊精的结构表征及抗消化特性,本实验以绿豆淀粉为原料,采用酸热法制备绿豆抗性糊精,对其颗粒形态、晶型、偏振光、官能团、分子量、糖苷键等结构变化进行表征,并通过模拟体外消化探究其抗消化特性。结果表明:与绿豆淀粉相比,绿豆抗性糊精的结构为大小不一、形状不规则的碎片状,偏振光十字消失,化学基团相似,各官能团的峰位保持不变且没有新峰产生,晶型为非晶态结构,分子发生降解其重均分子量MW为5.24×103 g/mol,糖苷键发生断裂且生成新的耐消化糖苷键;通过模拟体外消化实验表明:绿豆抗性糊精具有极强的抗消化能力,抗消化淀粉含量为92.28%。本实验旨在为功能性膳食纤维的开发提供理论与数据支持。Abstract: In order to explore the structural characterization and anti-digestion characteristics of mung bean resistant dextrin, mung bean starch was used as raw material to prepare mung bean resistant dextrin by acid heat method. Its surface morphology, crystal form, polarized light, functional groups and glycosidic bonds were characterized, and its anti-digestion characteristics were explored by simulating in vitro digestion. The results showed that compared with mung bean starch, the structure of mung bean resistant dextrin was fragmented with different sizes and irregular shapes. The polarized light cross disappeared, and the chemical groups were similar. The peak positions of each functional group remained unchanged and no new peaks were generated. The crystal structure was amorphous, and the molecular weight MW of molecular degradation was 5.24×103 g/mol. The glycosidic bond was broken and a new digestion-resistant glycosidic bond was generated. The simulated in vitro digestion experiment showed that mung bean resistant dextrin had strong anti-digestion ability, and the anti-digestion content was 92.28%. This experiment aims to provide theoretical and data support for the development of functional dietary fiber.
-
绿豆(Vigna radiata),又名青小豆,是中国主要豆科作物之一,年产量近100万t,约占世界总产量的30%[1]。绿豆具有较高的营养与保健价值,富含淀粉、蛋白质、膳食纤维、维生素、钙、硒等营养素,其中淀粉是豆类种子中最为丰富的碳水化合物,含量约为51.9%~53.7%[2-3]。相比于资源利用较充足的玉米淀粉和马铃薯淀粉,由于绿豆淀粉本身具有凝胶性强、易老化回生的特性,对于绿豆淀粉深层次的开发和利用不够,因此以绿豆淀粉为原料进行综合利用是今后重点研究方向。
随着生活水平的日益提高,由于不合理的能量摄入,导致高血糖、高血脂等慢性代谢疾病发病率逐年增加,有研究表明这与人们日常饮食中的膳食纤维摄入量不足有关[4]。抗性糊精(Resistant Dextrin,RD),又称难消化糊精,是以淀粉为原料制备的一种低GI(升糖指数)水溶性膳食纤维,属绿色农业深加工产品[5]。抗性糊精具有高溶解度、耐酸热、低粘度的优良的加工特性,通常被用于饮料、肉制品、面制品等加工食品中[6]。此外,研究表明抗性糊精不被人体消化酶利用,大部分在结肠中被肠道微生物发酵利用发挥多种生理功能[7],如降低血浆甘油三酯,减轻肥胖[8],调控餐后血糖及胰岛素抵抗水平,防治糖尿病等代谢疾病[9]。目前,国内外对抗性糊精的研究大多数集中在制备方法[10]、理化特性[11]、生理功能[12]等方面,但对抗性糊精的分子结构表征及抗消化特性研究鲜有报道。因此,本研究以绿豆淀粉为原料,采用酸热法制备绿豆抗性糊精,对其结构进行表征并通过模拟体外消化探究抗消化特性,为开发具有低血糖生成指数的功能性膳食纤维提供理论基础与数据支持。
1. 材料与方法
1.1 材料与仪器
绿豆淀粉(纯度为89.5%) 实验室自制;耐高温α-淀粉酶(4×104 U/g)、碱性蛋白酶(6×104 U/g) 上海金穗生物科技有限公司;糖化酶(1×105 U/mL) 北京生化试剂有限公司;猪胰α-淀粉酶(50 U/mg)、黑曲霉淀粉葡萄糖苷酶(1×104 U/mL) Sigma公司;葡萄糖检测试剂盒(GOPOD) 购于爱尔兰Megazy-me公司;溴化钾 光谱级,天津市大茂化学试剂厂;其余等试剂均为国产分析纯。
HD9920高速空气循环加热器 美的科技有限公司;RE-52AA旋转蒸发器 上海亚荣仪器厂;GPhenomG2 扫描电子显微镜 Phenom World公司;D8ADVANCE X-射线粉末衍射仪 德国布鲁克公司;NP-800PRF偏光显微镜 日本奥林巴斯公司;Nicolet 6700傅里叶变换红外光谱仪 美国Thermo Fisher公司;GPC-20A凝胶渗透色谱仪 日本津岛TOSOH公司;Bruker AVANCE 600核磁共振仪 德国布鲁克公司;Ald-2LD plus真空冷冻干燥机 德国Christ公司。
1.2 实验方法
1.2.1 粗糊精的制备
参照陈磊[13]的方法进行制备,称取绿豆淀粉,添加1%的盐酸,使酸浓度达到淀粉干基0.10%,再添加1%的柠檬酸占干淀粉0.10%,在鼓风干燥箱中预烘干,使其水分含量低于5%。将预烘干的酸解淀粉,放入高速循环气流加热器中,设定温度170 ℃,加热时间60 min,进行酸热糊精化反应,迅速冷却至室温,得到粗糊精。
1.2.2 抗性糊精的制备
参照张颖等[14]方法略作修改,将粗糊精用0.05 mol/L的磷酸盐缓冲溶液(pH=6)配成50%的溶液,加入0.5%的耐高温α-淀粉酶水浴酶解2 h,0.2%的碱性蛋白酶酶解1 h,0.2%的糖化酶酶解36 h,进行离心分离(5000 r/min、10 min),将酶解液添加活性炭充分搅拌脱色,采用纳滤膜脱盐处理,旋转蒸发浓缩至原体积的1/3,加入4倍体积的95%乙醇沉淀,于4 ℃冰箱中醇沉过夜,冷冻干燥得到抗性糊精。
1.2.3 绿豆抗性糊精的结构表征
1.2.3.1 扫描电子显微镜
将待测样品均匀分散在导电的样品台上,贴在圆形存根上进行涂金,保持在3.0 kV加速电压下,用导电胶将样品进行固定,利用离子溅射镀膜仪喷金,放大500和10倍观察样品颗粒的照片。
1.2.3.2 X-射线衍射
将干燥样品放置玻璃板上,射线衍射在40 kV和3 mA的条件下工作,采用广角衍射仪衍射,扫描区域为5~60°(2θ),辐射线为Cu Kα,以2°/min的速度,扫描步长间隔为0.02,DS-SS-RS设置分别为1~0.1 mm,并用JADE 6.0软件计算相对结晶度,并导出相应曲线。
1.2.3.3 偏光显微镜分析
将样品配成1%的悬液,混匀使样品颗粒充分分散,滴1滴于洁净的载玻片上,然后将盖玻片缓慢放置以避免形成气泡。在目镜和物镜10/50倍的放大倍数下,捕获图像并进行分析。
1.2.3.4 傅里叶红外光谱
称取一定量样品与干燥的KBr粉末以1:100的质量比(样品:溴化钾)于玛瑙研钵研磨混匀,压片厚度为0.4 mm,放入傅立叶红外光谱仪光束中进行全波段的扫描,在室温(22±1 ℃)条件下,空气为背景,分辨率为4 cm−1,扫描范围为4000~400 cm−1,扫描32次,进行归一化处理,得到红外光谱图并进行分析。
1.2.3.5 凝胶色谱分析
参照张婷等[15]测定方法略作修改测定。20 mg样品溶解于1 mL的DMSO溶液,用注射器吸取上清液分子膜过滤,微量注射器吸取100 μL滤液,注入GPC色谱组。采用相对校正法,色谱柱:TSKGELGMPWXL 300 mm×7.8 mm凝胶色谱柱,控制流速:0.6 mL/min。
1.2.3.6 核磁共振氢谱
将样品溶解在1 mL的D2O(10 mg/mL)中,使用500 MHz核磁共振波谱仪,在25 ℃下,每秒进行32次单独扫描,扫描宽度为16 ppm,在相位循环探测模式下记录。
1.2.4 模拟体外消化特性
参照Englyst[16]和戚明明等[17]体外模拟消化模型,并略作修改。精确取0.20 g样品置于20 mL的醋酸钠缓冲液(pH=5.2,0.5 mol/L)的三角锥形瓶中,然后在沸水糊化30 min,冷却室温后加5 mL混合酶液(含有290 U/mL猪胰α-淀粉酶和20 U/mL黑曲霉淀粉葡萄糖苷酶),置于37 ℃恒温摇床中,以190 r/min充分振荡培养,测定水解20、60、90、120、180 min内产生葡萄糖含量,分别取0.1 mL水解液加入1 mL无水乙醇进行灭酶处理,采用GOPOD试剂盒在50 ℃恒温水浴锅显色20 min测定还原糖含量,计算水解率和抗消化特性。
HR(%)=Gt−G0M×0.9×100 RDS(%)=G20−G0Ts×0.9×100 SDS(%)=G120−G20Ts×0.9×100 RS(%)=1−SDS−RDS 式中:HR为水解率,%;Gt不同时间还原糖含量,mg;G0初始还原糖含量,mg;M样品的质量,mg;0.9葡萄糖换算系数;RDS表示易消化淀粉含量、SDS表示慢消化淀粉含量、RS表示抗消化淀粉含量,%;G20表示酶解20 min时葡萄糖质量,mg;G120表示酶解120 min时葡萄糖质量,mg;Ts为底总糖含量,mg。
1.3 数据处理
采用SPSS22.0软件进行ANOVA法分析差异显著性(P<0.05),各数据重复测定三次,取用平均值±标准差来表示,采用Origin 2019、MestReNova4软件进行绘图处理。
2. 结果与分析
2.1 绿豆抗性糊精的结构表征
2.1.1 扫描电镜分析
通过扫描电子显微镜对绿豆淀粉与绿豆抗性糊精的颗粒表面形态结构进行比较。由图1可知,天然绿豆淀粉颗形态呈椭圆形,少量颗粒呈球形状结构,表面光滑且无裂痕;相反,绿豆抗性糊精的颗粒呈大小不一的不规则碎片结构,表面局部隆起呈现片层状,有明显凹坑且发生聚集现象,这表明在酸热条件作用下,淀粉颗粒的无定形区域的晶体片层被破坏,不能再形成周期性的片层结构,此研究结果与Zhen等[18]研究抗性糊精的颗粒形态结构相符合。由于发生酸热糊精化反应,淀粉颗粒发生破裂,内部结构遭到一定程度的破坏,使淀粉分子发生一定程度的降解,而降解后的小分子物质,进一步发生糖基转移和聚合反应,重新聚合成大小不一,表面粗糙的致密颗粒[19]。研究表明致密、结构不规则的颗粒具有较强的抗酶解特性,颗粒形态的变化与其消化性密切相关[20],由此推断粗糙表面且有致密结构的绿豆抗性糊精具有更强的耐酶解特性。
2.1.2 X-ray衍射分析
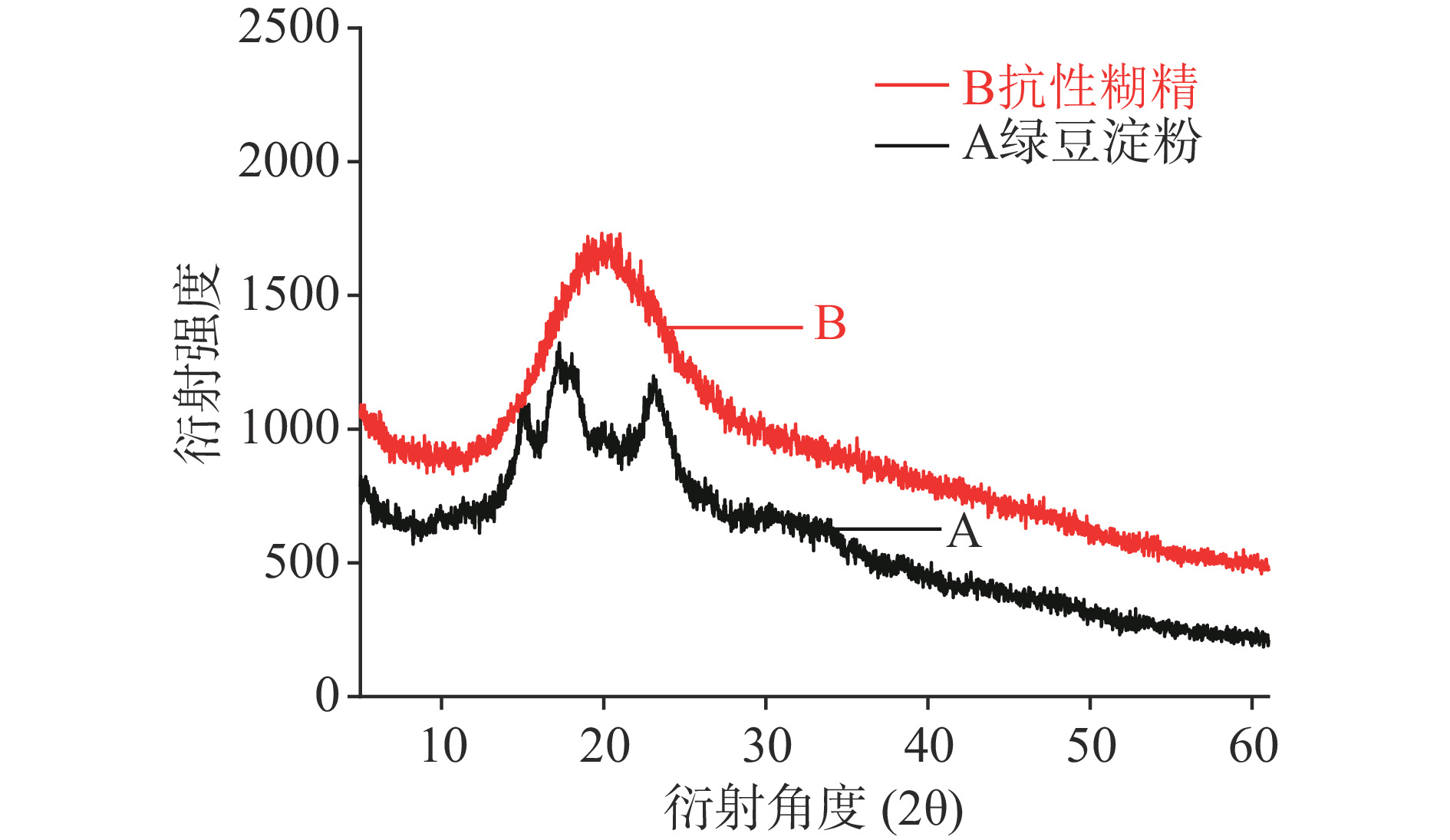
通过X-衍射表征可以直观判断颗粒结晶区和无定形区的变化,观察衍射峰角度和特征峰的强弱,可以确定晶体结构类型。由图2所示:A为绿豆淀粉衍射曲线,其衍射峰对应的衍射角度在15.07°、17.25°、和23.10°处附近出现,经拟合分析相对结晶度为34.37%,为典型的C型半结晶的高聚物[21];与绿豆淀粉相比,B绿豆抗性糊精的衍射结构发生明显变化,有序的结晶结构被破坏导致结晶峰完全消失,仅在2θ=20°附近出现峰型较宽、弥散的非晶型衍射峰,表明抗性糊精的结构是以葡萄糖为主体的葡聚糖[22]。由于高温酸热转化过程中,H+加速了淀粉晶体结构的破坏,淀粉分子由有序晶体向无序晶体转化,促进了小分子的重新聚合和分子间的糖基转移反应,该峰的形成主要归因于小分子物质发生聚合反应的重结晶,形成的非淀粉的糖苷键且具有高度分支结构,形成的空间位阻不能被消化酶破坏,具有抗酶解特性[23],从而使绿豆抗性糊精具有耐酶解的抗消化特性。
2.1.3 偏光十字分析
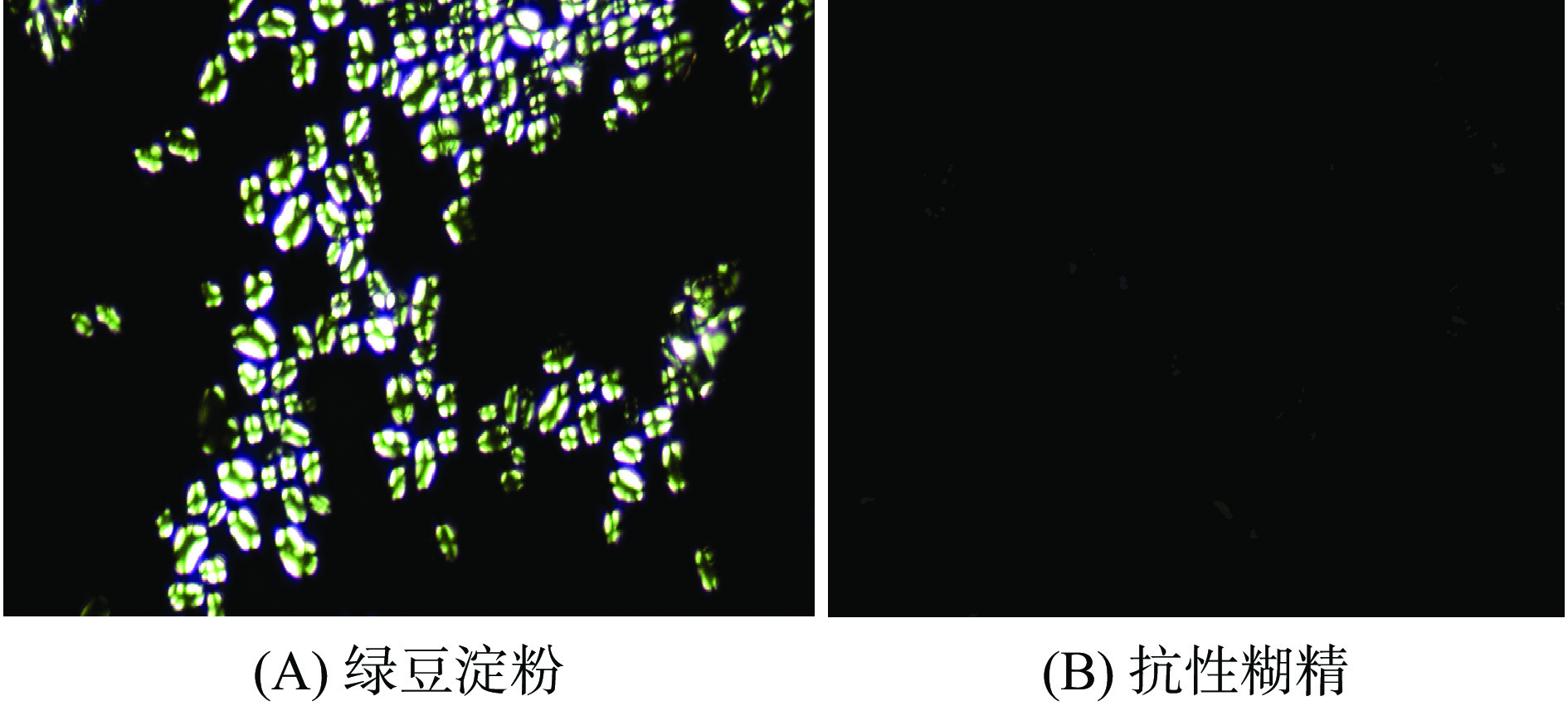
淀粉颗粒偏光十字的变化可反映其结晶结构与分子链的排列变化,淀粉颗粒存在结晶区和非结晶区,由于分子的排列有序程度和折射率不同,产生各向异性,使淀粉颗粒呈现偏光十字现象[24]。由图3可知,绿豆淀粉具有双折射特性,产生偏振光,呈现明显的偏光十字现象,而本实验所制备绿豆抗性糊精双折射特性和偏光十字完全消失。由于淀粉在制备抗性糊精过程中受酸热高温条件的影响,超过玻璃化转变温度,淀粉颗粒外壳中的无定形区域变得柔韧,淀粉通过空隙间产生压力膨胀发生裂解,从而导致颗粒内部分子链径向有序排列的结晶结构受到破坏,但由于聚合反应发生,颗粒内部的分子链依旧存在一定有序排列的结构,促进了抗性糊精的形成[25-26],此研究结果与上述X-衍射探究结果相符合。
2.1.4 红外光谱分析
通过FT-IR探究抗性糊精分子结构中的相关化学键和官能团变化。如图4所示,在3405 cm−1处有较宽的-OH伸缩振动峰,表明抗性糊精具有较强的亲水性基团,在2924 cm−1处是由C-H伸缩振动形成的吸收峰,1151和1024 cm−1处分别为C-O-C的非伸缩振动峰和C-O的对称振动吸收峰,858 和922 cm−1处的特征吸收带与α和β-糖苷键特殊吸收峰相关,发生一定强度伸缩振动[27]。由于发生糊精化反应导致连接淀粉分子主要的α-1,4糖苷键显著遭到破坏,在降解的淀粉分子发生诱导解聚,攻击周围分子的羟基和短链交联聚合,诱导分子内新的耐消化糖苷键的形成[28]。绿豆抗性糊精形成过程未产生新官能团,与绿豆淀粉结构相似,但发生一定条件的糖苷键断裂和聚合反应。由于在高温酸热条件下,发生糊精化反应,其转化过程中发生转葡萄糖苷化和再聚合反应[29],导致新的耐消化糖苷键生成使抗性糊精具有极强抗消化特性。
2.1.5 分子量测定结果
根据GPC色谱分析可得到样品的重均分子质量MW、数均分子质量Mn、分散度PDI情况。如表1所示,绿豆抗性糊精的分子量Mn为2.24×103 g/mol,MW为5.24×103 g/mol,且PDI为2.33;绿豆淀粉的分子量Mn为7.49×104 g/mol,MW为3.12×105 g/mol,且PDI为4.17,分散度PDI均小于10,样品纯度均较高,由此表明绿豆抗性糊精的分子量远小于绿豆淀粉的分子量,将其归类为低分子量的聚合物。由于前期较强酸热水解作用,淀粉颗粒的无定形区和结晶区都遭到破坏,分子链被切断造成严重的主链结构解聚,导致分子发生降解,但糊精化过程中具有复杂的结构重排,结构发生了变化,链状结构被破环,产生分子量较小的高度支化短链聚合物,这些重排的分子发生聚合反应,导致抗消化糊精部分含量增加,从而导致在体内的消化率降低[30],此结果与徐佩琳[31]制备山药抗性糊精研究结果相符。
表 1 绿豆淀粉与绿豆抗性糊精的分子量测定结果Table 1. Molecular weight determination results of mung bean starch and mung bean resistant dextrin种类 Mn(g/mol) MW(g/mol) PDI 绿豆抗性糊精 2.24×103 5.24×103 2.33 绿豆淀粉 7.49×104 3.12×105 4.17 注:MW为重均分子质量;Mn为数均分子质量;PDI为分散度。 2.1.6 核磁共振氢谱
由于大部分葡萄糖单元上的质子(如甲基和亚甲基质子)在3.0~4.0 ppm高场光谱区上发生化学位移,存共振拥挤区,但糖环上异头氢质子在4.5~5.5 ppm的低场光谱区发生化学位移,不在共振拥挤区,从而被分离和分辨,因此利用1H-NMR分析抗性糊精的分子结构及糖苷键变化[32]。本研究采用1H-NMR结合1H1HOCSY分析,其结果如图5所示:在1H-NMR谱δ4.0~5.5×10−6区域内有5.27、4.84、4.74、4.53~4.52、4.39、4.06 ppm处出现异头氢信号,其中4.74 ppm为D2O质子峰,α-型吡喃糖H-1质子的化学位移大于4.95 ppm,β型吡喃糖H-1质子的化学位移小于4.95 ppm[33],由此表明抗性糊精同时含有α和β两种端基差向异构构型,存在吡喃环非对称伸缩振动峰和呋喃环CH变角振动峰,进一步证实了绿豆抗性糊精在傅里叶中发生糖苷键断裂和转苷反应导致糖环发生振动。抗性糊精在1H-NMR中5.27、4.53、4.52 ppm处的共振结合1H1HOCSY光谱中二倍体图可知,发生质子化学位移,糖残基连接方式复杂,随着氧碳离子或自由基的形成而攻击了相邻的羟基,与相邻糖环的羟基发生转苷反应生成α(β)-1,2糖苷键和α(β)-1,6糖苷键[34],Weil等[35]研究结果显示,在高温糊精化下,更容易使α-1,4糖苷键断裂,且抗性糊精的抗性含量与含有的α-1,4-糖苷键的量成反比。因此,通过核磁共振光谱进一步表明,大量易消化α-1,4糖苷键的断裂以及新的难消化糖苷键的生成,导致抗性糊精具有抗酶解消化特性。
2.2 模拟体外消化特性
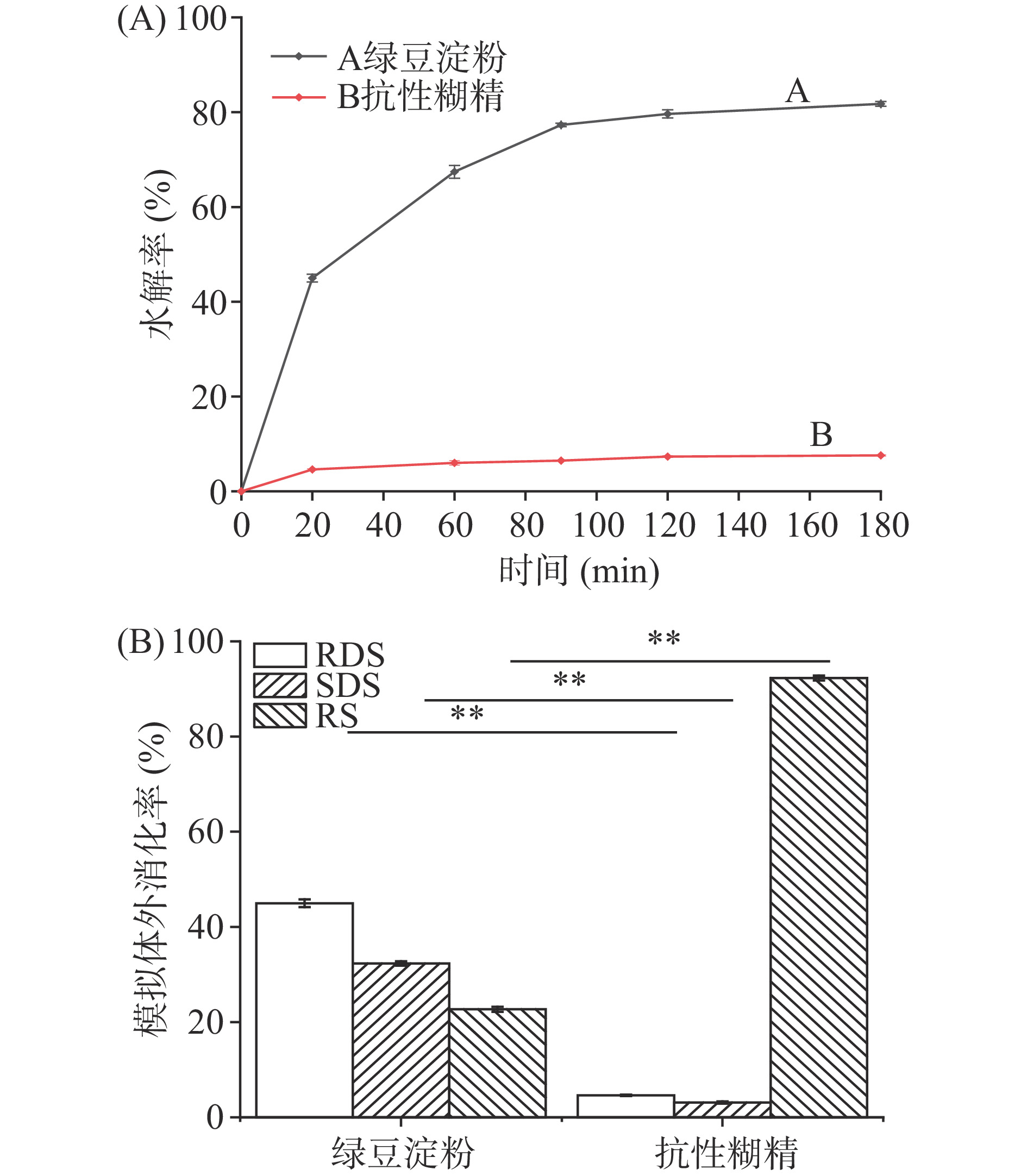
为更好阐明抗性糊精的抗消化机理,通过模拟体外消化探究其消化特性,如图6所示,在模拟消化20~180 min中,随着时间延长绿豆淀粉的水解率明显增加,而绿豆抗性糊精的水解率呈平缓增加,表明抗性糊精比淀粉具有明显的抗酶解消化能力。通过模拟体外消化进一步得出绿豆淀粉的RDS为44.98%、SDS为32.32%、RS为22.7%,相比绿豆抗性糊精RDS为4.61%,SDS为3.11%,RS为92.28%,此结果与郭峰等[36]研究抗性糊精的RS含量为90.81%相似。进一步表明绿豆抗性糊精具有极低的体外消化率和抗消化特性,有利于降低餐后血糖和维持胰岛素水平,符合膳食纤维的功能特性[37]。根据上述对抗性糊精结构表征的变化可进一步解释抗性糊精抗消化特性机理,由于在抗性糊精制备过程,淀粉颗粒结构在酸热处理过程中消失,裂解后的小分子糊精聚合后形成较为致密的颗粒且高度分支结构,因而降低了消化酶对淀粉的敏感。此外,抗性糊精的抗消化能力很大程度上归因于在糊精化过程中,α-1,4和α-1,6糖苷键断裂,重新聚合生成耐消化糖苷键,抵抗消化酶的作用,从而减少单位时间对葡萄糖的吸收[4]。
3. 结论
本研究对绿豆抗性糊精的颗粒形态、晶形结构、偏光十字、官能团、分子量、糖苷键的变化规律进行表征,探究绿豆抗性糊精的抗消化机理。结果表明,在高温酸热条件下,发生复杂的糊精化反应,导致抗性糊精呈现形状不规则、大小不一的碎片结构,偏光十字消失,结晶结构显著被破坏,分子发生降解和糖苷键发生断裂,降解小分子物质重新聚合,形成高度支化以葡萄糖为主体的葡聚糖,此外,通过转苷作用形成α(β)-1,2和α(β)-1,6的耐消化糖苷键,导致空间位阻不能被消化酶酶解破坏,通过模拟体外消化进一步验证抗性糊精具有极强抗消化特性。因此,通过对绿豆抗性糊精结构和抗消化性的研究,为功能性膳食纤维的开发提供理论与数据支持。
-
表 1 绿豆淀粉与绿豆抗性糊精的分子量测定结果
Table 1 Molecular weight determination results of mung bean starch and mung bean resistant dextrin
种类 Mn(g/mol) MW(g/mol) PDI 绿豆抗性糊精 2.24×103 5.24×103 2.33 绿豆淀粉 7.49×104 3.12×105 4.17 注:MW为重均分子质量;Mn为数均分子质量;PDI为分散度。 -
[1] 刘婷婷, 吴玉莹, 秦宇婷, 等. 绿豆淀粉工艺废水中蛋白质的功能性质[J]. 食品科学,2017,38(5):104−110. [LIU T T, WU Y Y, QIN Y T, et al. Functional properties of proteins in mung bean starch process wastewater[J]. Food Science,2017,38(5):104−110. doi: 10.7506/spkx1002-6630-201705017 [2] 刘紫薇, 李欣, 高菲, 等. 煮制时间对绿豆中淀粉性质的影响及相关性分析[J]. 包装工程,2021,42(13):93−99. [LIU Z W, LI X, GAO F, et al. Effect of cooking time on starch properties in mung beans and correlation analysis[J]. Packaging Engineering,2021,42(13):93−99. [3] 张海均, 贾冬英, 姚开. 绿豆的营养与保健功能研究进展[J]. 食品与发酵科技,2011,48(1):7−10. [ZHANG H J, JIA D Y, YAO K. Research progress of mung bean nutrition and health care function[J]. Food and Fermentation Technology,2011,48(1):7−10. [4] TORAYA A R, SEGURA C M, CHEL G L, et al. Some nutritional characteristics of enzymatically resistant maltodextrin from cassava (Manihot esculenta Crantz) starch[J]. Plant Foods for Human Nutrition,2017,72(2):145−149.
[5] 黄政, 孙江文, 徐勇, 等. 抗性糊精的研究与应用进展[J]. 海南师范大学学报(自然科学版),2018,31(4):418−427. [HUANG Z, SUN J W, XU Y, et al. Research and application progress of resistant dextrin[J]. Journal of Hainan Normal University (Natural Science Edition),2018,31(4):418−427. [6] 徐仰丽, 刘亚伟, 任伟豪. 抗性糊精的研究进展[J]. 河南工业大学学报(自然科学版),2008,29(4):67−71. [XU Y L, LIU Y W, REN W H. Research progress of resistant dextrin[J]. Journal of Henan University of Technology (Natural Science Edition),2008,29(4):67−71. [7] LAETITIA G D, LI S G, POCHAT M, et al. Effects of NUTRIOSE dietary fiber supplementation on body weight, body composition, energy intake, and hunger in overweight men[J]. International Journal of Food Sciences amd Nutrition,2011,62(6):628−635. doi: 10.3109/09637486.2011.569492
[8] HU Q, LU Y, HU F, et al. Resistant dextrin reduces obesity and attenuates adipose tissue inflammation in high-fat diet-fed mice[J]. International Journal of Medical Sciences,2020,17(17):2611−2621. doi: 10.7150/ijms.45723
[9] ASTINA J, SAPWAROBOL S. Attenuation of glycaemic and insulin responses following tapioca resistant maltodextrin consumption in healthy subjects: A randomised cross-over controlled trial[J]. Journal of Nutritional Science,2020(9):e29.
[10] 顾品品, 张燕萍. 不同处理方式对红香母芋抗性糊精性质的影响[J]. 食品研究与开发,2020,41(15):30−35. [GU P P, ZHANG Y P. Effects of different treatment methods on the properties of resistant dextrin in hongxiangmu taro[J]. Food Research and Development,2020,41(15):30−35. [11] JOCHYM K K, NEBESNY E. Enzyme-resistant dextrins from potato starch for potential application in the beverage industry[J]. Carbohydrate Polymers,2017(172):152−158.
[12] RENATA B, KAMILA J, KATARZYN S, et al. The effect of citric acid-modified enzyme-resistant dextrin on growth and metabolism of selected strains of probiotic and other intestinal bacteria[J]. Journal of Functional Foods,2010,2(2):126−133. doi: 10.1016/j.jff.2010.03.002
[13] 陈磊. 功能淀粉糊精的制备及其应用研究[D]. 广州: 华南理工大学, 2014. CHEN L. Preparation and application of functional starch dextrin[D]. Guangzhou: South China University of Technology, 2014.
[14] 张颖, 朱晓雯, 钱和, 等. 高纯度难消化糊精的制备工艺及其特性研究[J]. 食品工业科技,2015,36(10):293−296. [ZHANG Y, ZHU X W, QIAN H, et al. Study on preparation process and characteristics of high purity indigestible dextrin[J]. Food Industry Science and Technology,2015,36(10):293−296. [15] 张婷, 李佳瑶, 安双双, 等. 高粱抗性糊精的制备工艺优化及结构表征[J]. 食品科技,2020,342(4):238−243. [ZHANG T, LI J Y, AN S S, et al. Preparation process optimization and structure characterization of sorghum resistant dextrin[J]. Food Science and Technology,2020,342(4):238−243. [16] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition,1992,46(2):33−50.
[17] 戚明明, 彭慧慧, 宋佳琳, 等. 挤压和酶解对豌豆粉淀粉体外消化率、蛋白质结构和流变特性的影响[J/OL]. 食品科学: 1−11 [2021-07-12]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210205.1756.085.html. QI M M, PENG H H, SONG J L, et al. Effects of extrusion and enzymatic hydrolysis on in vitro digestibility, protein structure and rheological properties of pea powder starch[J/OL]. Food Science: 1−11 [2021-07-12]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210205.1756.085.html.
[18] ZHEN Y H, ZHANG T, JIANG B, et al. Purification and characterization of resistant dextrin[J]. Foods,2021,10(1):185. doi: 10.3390/foods10010185
[19] 苏会波, 林海龙. 难消化糊精的研究进展[J]. 食品与生物技术学报,2014,33(1):1−7. [SU H B, LIN H L. Research progress of indigestible dextrin[J]. Journal of Food and Biotechnology,2014,33(1):1−7. [20] ZENG F, ZHU S, CHEN F, et al. Effect of different drying methods on the structure and digestibility of short chain amylose crystals[J]. Food Hydrocolloids,2016,52:721−731. doi: 10.1016/j.foodhyd.2015.08.012
[21] FANG K, HE W, JIANG Y, et al. Preparation, characterization and physicochemical properties of cassava starch-ferulic acid complexes by mechanical activation[J]. International Journal of Biological Macromolecules,2020,160:482−488. doi: 10.1016/j.ijbiomac.2020.05.213
[22] 李良玉, 刘晚霞, 李朝阳, 等. 绿豆抗性糊精的高效纯化技术及分子特性研究[J]. 中国食品学报,2020,20(10):134−141. [LI L Y, LIU W X, LI C Y, et al. High efficiency purification technology and molecular characteristics of mung bean resist-ant dextrin[J]. Chinese Journal of Food,2020,20(10):134−141. [23] MAO H J, CHEN Z J, LI J, et al. Structural comparisons of pyrodextrins during thermal degradation process: The role of hydrochloric acid[J]. Food Chemistry,2021(349):129174.
[24] ATROUS H, BENBETTAIEB N, HOSNI F, et al. Effect of γ-radiation on free radicals formation, structural changes and functional properties of wheat starch[J]. International Journal of Biological Macromolecules,2015,80:64−76. doi: 10.1016/j.ijbiomac.2015.06.014
[25] 杨亚鸽, 刘洁, 刘亚伟. 木薯淀粉制备热转化糊精及特性研究[J/OL]. 河南工业大学学报(自然科学版): 1−12 [2021-07-12]. http://kns.cnki.net/kcms/detail/41.1378.N.20210611.1501.002.html. YANG Y G, LIU J, LIU Y W. Preparation and characteristics of thermal conversion dextrin from cassava starch[J/OL]. Journal of Henan University of Technology (Natural Science Edition): 1−12 [2021-07-12]. http://kns.cnki.net/kcms/detail/41.1378.N.20210611.1501.002.html.
[26] WANPHEN W, ROBERT C W, SUTTIPUN K, et al. Pyrodextrin from waxy and normal tapioca starches: Physicochemical properties[J]. Food Hydrocolloids,2019,104(C):105745.
[27] WANG H S, ZAINABU M, ZHENG R N. Characterization of microwave-synthesized polydextrose and its radical-scavenging activity[J]. Taylor and Francis,2018,37(1):44−56.
[28] JOANNA T B, WIOLETTA B, ARTUR S, et al. Molecular and supermolecular structure of co-mmercial pyrodextrins[J]. Journal of Food Science,2016,81(7-9):C2135.
[29] 大隈一裕, 西端豊秀. 水溶性膳食纤维Fibersol-2[J]. 食品科学,2004(4):218−220. [OKUMA Y Y, XIDUAN C X. Water soluble dietary fiber fibersol-2[J]. Food Science,2004(4):218−220. [30] BAI Y, CAI L, DOUTCH J, et al. Structural changes from native waxy maize starch granules to cold-water-soluble pyrodextrin during thermal treatment[J]. Journal of Agricultural and Food Chemistry,2014,62(18):4186−4194. doi: 10.1021/jf5000858
[31] 徐佩琳. 酸热法和微波预处理—酶法制备山药抗性糊精及其特性研究[D]. 合肥: 合肥工业大学, 2018. XU P L. Preparation and characterization of yam resistant dextrin by acid thermal method and microwave pretreatment enzyme method[D]. Hefei: Hefei University of Technology, 2018.
[32] 张晶. 酯化麦芽糊精的制备及其特性研究[D]. 郑州: 河南工业大学, 2010. ZHANG J. Preparation and characterization of esterified maltodextrin[D]. Zhengzhou: Henan University of Technology, 2010.
[33] 武小辉. 麦芽糊精的交联聚合技术及其特性研究[D]. 郑州: 河南工业大学, 2016. WU X H. Study on cross-linking polymerization technology and characteristics of maltodextrin[D]. Zhengzhou: Henan University of Technology, 2016.
[34] BAI Y J, SHI Y C. Chemical structures in pyrodextrin determined by nuclear magnetic resonance spectroscopy[J]. Carbohydrate Polymers,2016,151:426−433. doi: 10.1016/j.carbpol.2016.05.058
[35] WEIL W, WEIL R C, KEAWSOMPONG S, et al. Pyrodextrins from waxy and normal tapioca starches: Molecular structure and in vitro digestibility[J]. Carbohydrate Polymers,2021,252(11):117140.
[36] 郭峰, 陈磊, 叶晓蕾, 等. 不同酶水解对抗性糊精消化性的影响研究[J]. 食品工程,2016(1):28−30, 45. [GUO F, CHEN L, YE X L, et al. Study on the effect of different enzymatic hydrolysis on the digestibility of anti dextrin[J]. Food Engineering,2016(1):28−30, 45. doi: 10.3969/j.issn.1673-6044.2016.01.009 [37] HUANG Z, WANG J J, CHEN Y, et al. Effect of water-soluble dietary fiber resistant dextrin on flour and bread qualities[J]. Food Chemistry,2020,317(C):126542.
-
期刊类型引用(6)
1. 徐美琪,李思漫,刘欣,欧月灵,罗舒雯,李琳,陈旭,朱杰. 脱支和重结晶法制备抗性糊精的结构和功能特性分析. 食品工业科技. 2024(05): 37-43 .  本站查看
本站查看
2. 曾佳,林江涛,岳清华,李淑月,李心灵,郑雁. 超声协同微波法制备抗性糊精及其结构和体外消化特性. 食品研究与开发. 2024(12): 85-94 .  百度学术
百度学术
3. 王昂,韩四海,岳崇慧,刘建学,罗登林,李佩艳,王萍,郭金英. 小麦抗性糊精的酸热法制备、表征及消化特性分析. 食品安全质量检测学报. 2023(08): 222-229 .  百度学术
百度学术
4. 李泽润,田延军,黄艳红,聂玉朋,孙萍,王珊珊,干邵波,徐慧. 不同制备工艺对抗性糊精构效的影响. 食品科学. 2023(11): 79-85 .  百度学术
百度学术
5. 陈新阳,赵朋辉,刘莹莹,王静静,薛迎春,侯银臣,廖爱美,潘龙,黄继红. 小麦抗性糊精制备工艺优化、结构表征及其体外消化. 食品研究与开发. 2023(17): 110-117 .  百度学术
百度学术
6. 宋丽冉,严洪冬,李良玉,刘伟,曹龙奎,曹荣安,潘旭琳. 高粱抗性糊精制备工艺的优化及其结构和体外消化特性研究. 食品工业科技. 2023(19): 262-271 .  本站查看
本站查看
其他类型引用(5)










 下载:
下载:


 下载:
下载:



