Inhibitory Effect of Seven Phenolic Compounds in Fruit Peel of Pingguoli Pear on Alternaria alternata in Vitro
-
摘要: 为揭示苹果梨果皮的主要酚类物质对果实采后黑斑病菌链格孢(Alternaria alternata)生长的影响,在前期对发育及贮藏期梨果皮酚类物质含量分析的基础上,本文研究了苹果梨果皮的7种酚类物质处理对A. alternata孢子萌发、菌丝生长、菌丝干重及黑色素形成的影响。结果表明,除熊果苷外,酚酸和黄酮类物质均对A. alternata孢子萌发、菌丝生物量增加具有一定的抑制作用,且存在浓度依赖性,抑制效果依次为酚酸类>黄酮类>简单酚,其中阿魏酸的抑制作用较强,3 mg/mL的阿魏酸处理后A. alternata的孢子萌发、菌丝生长和菌丝干重分别较对照(0 mg/mL)组降低了98.5%、29.4%和22.2%。同时7种酚类物质处理后均不同程度的增加了A. alternata黑色素的含量。可见苹果梨果皮的酚类物质对A. alternata的生长和致病性具有重要的调控作用。Abstract: In order to reveal the effect of main phenolic substances on the growth of black spot Alternaria alternata after fruit harvesting, and on the basis of the analysis of the content of Pingguoli pear peel phenolic substances during the development and storage period, this paper studied the effects of seven phenolic substances in the Pingguoli pear peel on the spore germination, mycelium growth, mycelium dry weight and melanin formation. The results showed that, in addition to arbutin, phenolic acids and flavonoids had a certain inhibitory effect on the germination of A. alternata, and there was a concentration dependence, and the inhibitory effect was phenolic acids> flavonoids> simple phenols, in turn. The inhibitory effect of ferulic acid was strong, and the spore germination, mycelial growth and dry weight of mycelium treated with 3 mg/mL ferulic acid were reduced by 98.5%, 29.4% and 22.2% respectively compared with the control (0 mg/mL). At the same time, the content of A. alternata melanin was increased in varying degrees after the treatment of seven phenolic substances. It can be seen that phenolic substances in Pingguoli pear peel have an important regulatory effect on the growth and pathogenicity of A. alternata.
-
Keywords:
- Alternaria alternata /
- phenolic compounds /
- antifungal activity /
- spore germination /
- mycelium growth /
- melanin
-
链格孢(Alternaria alternata)是一种可以引起多数水果发生采后病害的真菌病原物,可对枣[1]、苹果[2]、柑橘[3]、蓝莓[4]以及苹果梨[5]等造成严重的病害。由该病原菌引起的黑斑病是苹果梨主要的采后病害。黑斑病不仅造成苹果梨的品质劣变,而且在果实体内产生的链格孢毒素对人体健康造成严重威胁,制约着苹果梨产业的健康发展。目前,合成杀真菌剂被广泛应用于控制果实采后病害的发生[6],其效果虽然较好,但由于广泛应用导致了病原菌耐药性显著增加,且对人类及环境造成危害[7]。因此研究开发控制果蔬采后病害的天然防腐剂已势在必行。
酚类物质作为植物天然次级代谢产物具有抗氧化、清除自由基、抵御生物和非生物胁迫作用。已有研究表明酚类物质可通过限制病原体生长、增加植物抗性的化学屏障等抵御病原物的侵染[8]。近期研究发现苹果、柑橘、山楂和樱桃中提取的酚类物质可以有效清除果实体内的自由基[9]。同时果皮中的酚类物质对病原菌的侵染也具有一定的影响,如在未成熟苹果中的绿原酸,桃果皮和晚熟甜樱桃中的酚酸能有效抑制盘长孢(Gloeosporium perennans),桃褐腐病菌(Monilinia fructicola)和A. alternata侵入寄主[10-11]。进一步研究发现,果实中的酚类物质还可以通过损伤病原物的细胞膜进而延缓其致病性,如对香豆酸甲酯(乙酯)和水杨酸可以对A. alternata[12-13]和扩展青霉(Penicillium expansum)[14]的质膜造成损伤从而促进内溶物的泄露,降低其对果实的致病性。另外酚类物质影响A. alternata色素和毒素的产生[10]。但由于果皮酚类物质种类、含量及存在状态具有较大差异,因此其调控机理也呈现复杂性[15]。虽然已有部分研究报道了酚类物质对病原真菌的调控作用,但苹果梨果皮中的酚类物质对A. alternata生长以及致病性的调控机制鲜有报道,因此在我们前期发现的苹果梨果皮中主要7种酚类物质的基础上[16],本文进一步研究评价了苹果梨果皮的7种酚类物质对A. alternata的生长以及黑色素产生的影响,以期为揭示酚类物质调控该病原物的致病机理提供有效的理论依据。
1. 材料与方法
1.1 材料与仪器
链格孢(Alternaria alternata) 分离于贮藏中自然发病的苹果梨果实,纯化后PDA培养基保存待用;酚类物质标准品(绿原酸、咖啡酸、阿魏酸、对香豆酸、儿茶素、表儿茶素、熊果苷) 上海源叶生物科技有限公司;黑色素标准品 Sigma公司;琼脂、Tween-80 柯意哲(上海)机电工程有限公司;75%酒精 山东利尔康医疗科技股份有限公司。
SW-CJ-2FD型超净工作台 苏州安泰空气技术有限公司;CX21FS1C型生物显微镜 奥林巴斯工业有限公司;DHP-9272B型恒温培养箱 上海一恒科技有限公司;TGL-20MC 台式高速冷冻离心机 长沙平凡仪器仪表有限公司;UV-2450紫外分光光度计 日本岛津;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;AWL-1002-M艾科普超纯水仪 上海鼎国际贸易有限公司。
1.2 实验方法
1.2.1 病原物分离、纯化与孢子悬浮液的配制
将有黑斑病的苹果梨果实,以75%酒精进行果实表面消毒,再用无菌水冲洗后切取病健交界处的组织,在无菌操作条件下移至马铃薯葡萄糖(PDA)培养基上,然后于28 ℃恒温培养,待其长出分生孢子之后再进行分离、纯化,并通过回接试验确定其致病性。分离纯化的病原物在马铃薯葡萄糖(PDA)培养基上保存备用[16]。
取PDA上培养5 d的A. alternata菌种,加入含有0.05%的Tween-80的适量无菌水,用无菌涂布器轻轻刮涂平板上的病原菌孢子,然后用4层已灭菌的纱布进行过滤,将过滤后的孢子悬浮液转移到无菌三角瓶中,并立即封口。随后将配制好的孢子悬浮液在漩涡振荡器上振荡20 s使孢子分散均匀,并用血球计数板在光学显微镜下进行计数,添加无菌水进行稀释,使其达到实验所需不同浓度。最后将配制好的A. alternata孢子悬浮液在6000 ×g条件下离心10 min,并弃去上清液,沉淀用于后续试验。
1.2.2 苹果梨果皮的酚类物质处理对A. alternata生长的影响
1.2.2.1 外源酚类物质对A. alternata孢子萌发的影响
无菌条件下,用打孔器取直径为9 mm的2%的水琼脂培养基,然后将其置于已灭菌的载玻片上,在1.2.1中得到的孢子悬浮液(1×106个/mL)的沉淀中分别加入等量的绿原酸(1、2、4 mg/mL)、咖啡酸(0.2、0.4、0.6 mg/mL)、阿魏酸(0.5、1、2 mg/mL )、对香豆酸(0.3、0.6、1.2 mg/mL)、儿茶素(0.5、1、2 mg/mL)、表儿茶素(0.2、0.4、0.8 mg/mL)以及熊果苷(7.5、15、30 mg/mL)溶液,混合均匀后,分别在水琼脂培养基上用移液枪滴加20 µL的混合溶液,此浓度来源于前期实验研究得到的基于苹果梨果皮的7种酚类物质含量[16]。置于28 ℃下培养,分别在萌发2、4、6、8 h时镜检观察A. alternata萌发率,直至对照完全萌发。以无菌水处理作为对照。每次镜检100个孢子,重复3次。
1.2.2.2 外源酚类物质对A. alternata菌丝生长的影响
分别将不同浓度的上述酚类物质溶液加入无菌的PDA培养基中,混合均匀,倒入无菌的培养皿中,分别接种28 ℃培养7 d的直径为8 mm的A. alternata菌饼,然后于28 ℃条件下恒温培养5 d,每天测量菌落直径。以无菌水作为对照。每个处理3个平行,重复3次。
1.2.2.3 外源酚类物质对A. alternata菌丝生物量的影响
上述酚类物质溶液加入无菌的PDA培养基中,混合均匀,倒入无菌的培养皿中,待凝固后在培养基表面铺上无菌的玻璃纸,分别接种28 ℃培养7 d的直径为8 mm的A. alternata菌饼,然后于28 ℃条件下恒温培养5 d后取下玻璃纸,称重。以无菌水作为对照。每个处理3个平行,重复3次。
1.2.3 外源酚类物质对A. alternata黑色素的影响
1.2.3.1 黑色素标准曲线的制作
分别配制浓度为0、10、20、30、40、50 mg/L的黑色素标准溶液,在400 nm处测定吸光值,制作标准曲线。
1.2.3.2 黑色素的提取
按照1.2.2.3中的方法,将培养5 d的A. alternata菌丝取下后,称取0.25 g置于研钵中,加入液氮,研磨,置于30 mL 1 mol/L NaOH的锥形瓶中,进行沸水浴5 h提取,每30 min左右晃荡一次,注意补充NaOH。−20 ℃冷却20 min,双层滤纸过滤,滤液用7 mol/L HCl调节pH2.0,10000 ×g离心15 min,得到沉淀为黑色素粗提物。
1.2.3.3 黑色素的纯化与测定
向1.2.3.2中得到的黑色素粗提物加入5 mL 7 mol/L HCl,充分混匀,沸水浴2 h,10000 ×g离心15 min,沉淀用1 mol/L NaOH溶解,再用7 mol/L HCl调pH至2.0,10000 ×g离心15 min,重复3次。沉淀用1 mol/L NaOH溶液定容。以1 mol/L NaOH为空白,用紫外分光光度计于400 nm处测定溶液的吸光值。A. alternata菌丝中黑色素含量(y,mg/g),x为吸光值,计算公式为:
$$ \mathrm{y}=\left(\mathrm{x}+0.111\right)/0.791 $$ 1.3 数据处理
所有试验数据采用Microsoft Excel 2019计算标准偏差,Origin 2021作图,用SPSS 23.0软件对得到的数据进行方差分析,采用Duncan’s多重差异显著分析。图中竖线代表标准误,相同字母表示差异不显著(P<0.05)。
2. 结果与分析
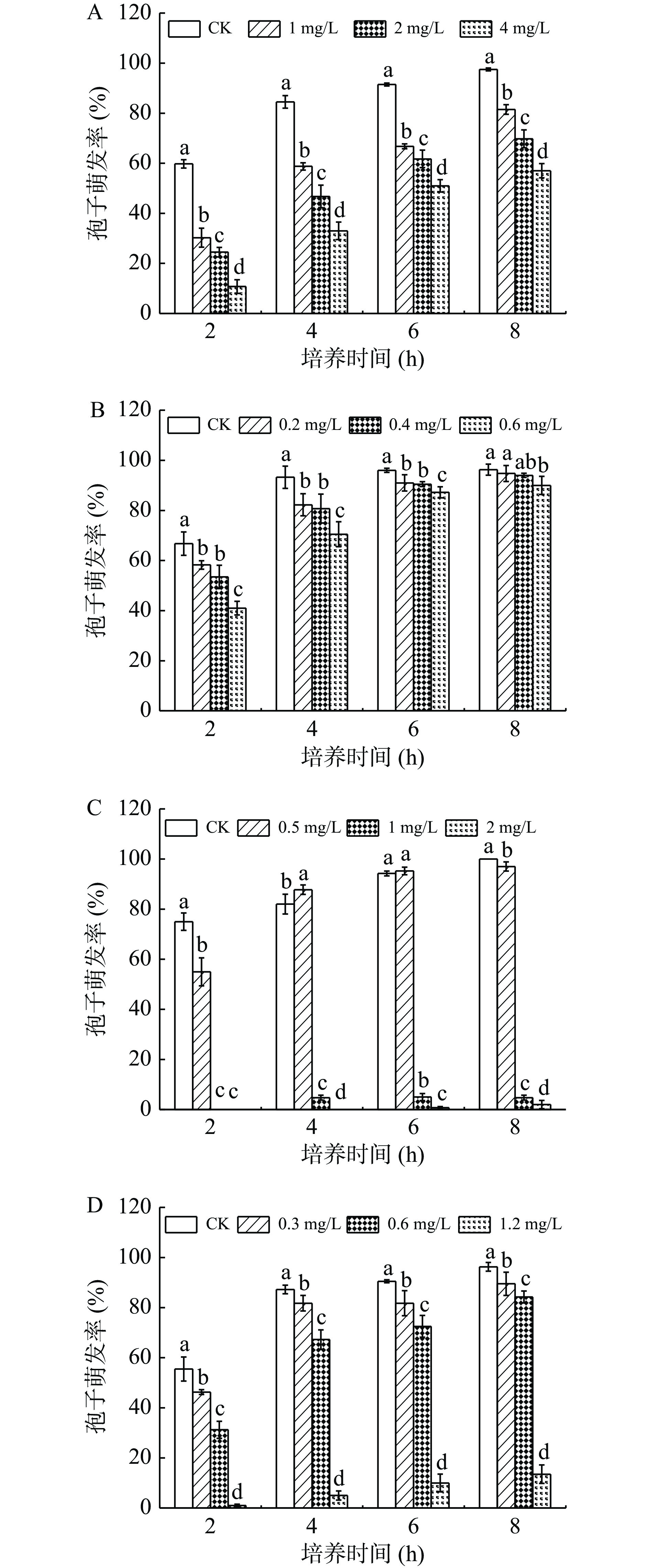
2.1 苹果梨果皮酚类物质对A. alternata孢子萌发的影响
2.1.1 酚酸类物质处理对A. alternata孢子萌发的影响
A. alternata孢子萌发率随培养时间的延长而增加,不同浓度的酚酸类物质处理后A. alternata萌发率均显著低于对照(P<0.05),且存在浓度依赖性(图1),对照组和处理组的孢子萌发率随着培养时间的增加逐渐增加,且对照组与处理组之间存在显著性差异(P<0.05)。在培养8 h后,四个酚酸类物质对A. alternata的孢子萌发均有一定的抑制作用(图1),其中2 mg/mL阿魏酸、1.2 mg/mL对香豆酸、4 mg/mL绿原酸和0.6 mg/mL咖啡酸处理组的孢子萌发率分别较对照降低了98.5%、86.0%,41.5%和6.5%。
2.1.2 黄酮类物质处理对A. alternata孢子萌发的影响
由图2可知,在整个培养时间内,孢子萌发率随着培养时间的延长逐渐增加,不同浓度的表儿茶素和儿茶素处理对A. alternata孢子萌发率均有一定的抑制作用,且浓度越大抑制作用越强。在培养2~6 h时,抑制作用明显,培养8 h时,抑制作用减弱,0.8 mg/mL表儿茶素和2 mg/mL儿茶素处理组与对照之间存在显著性差异(P<0.05),孢子萌发率分为对照的11.9%和6.7%。
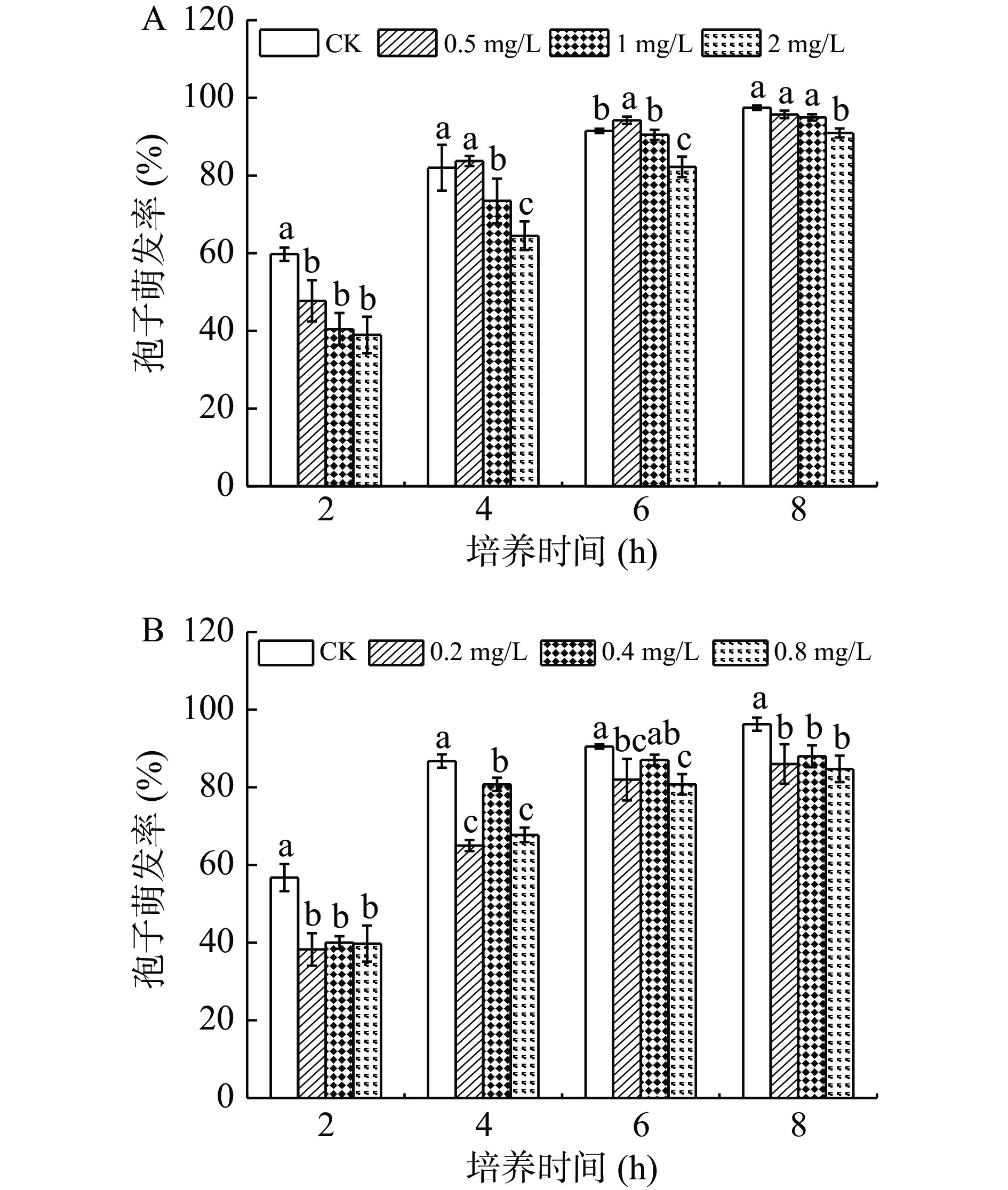
2.1.3 熊果苷处理对A. alternata孢子萌发的影响
熊果苷是苹果梨果皮中含量最丰富的一种酚类物质。由图3可知,在整个培养时间内,不同浓度熊果苷处理A. alternata后,对其孢子的萌发无抑制作用,与对照相比无明显差异。
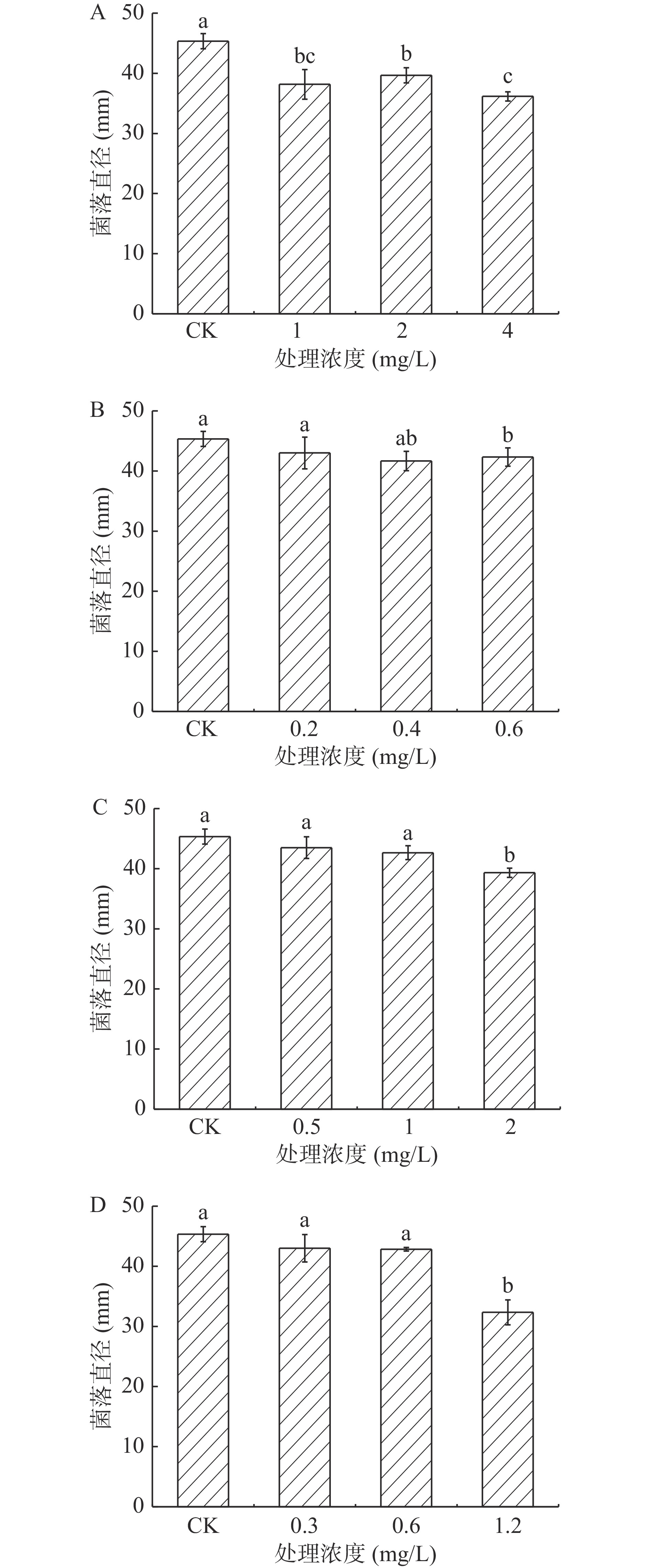
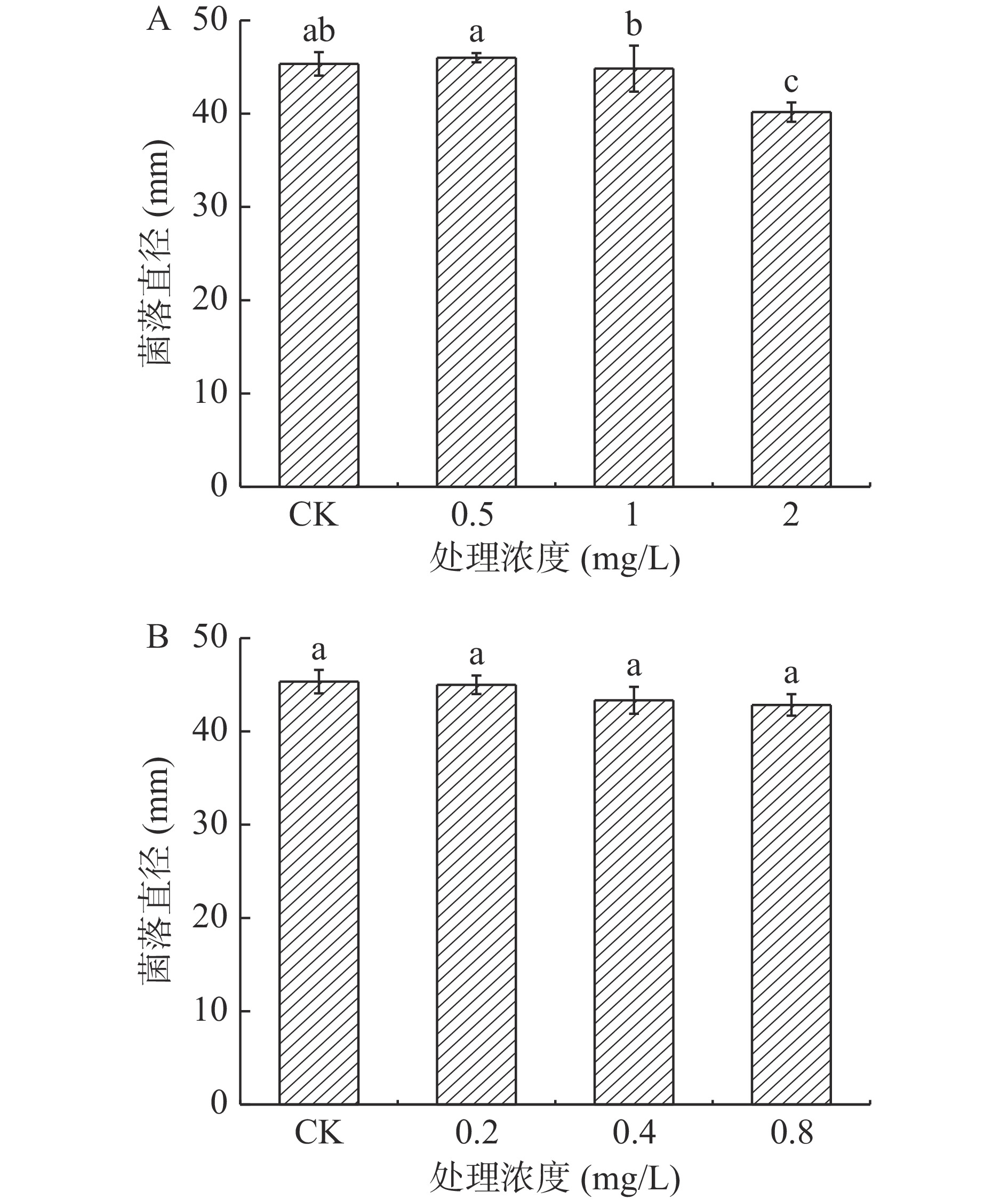
2.1.4 酚酸类物质处理对A. alternata菌丝生长的影响
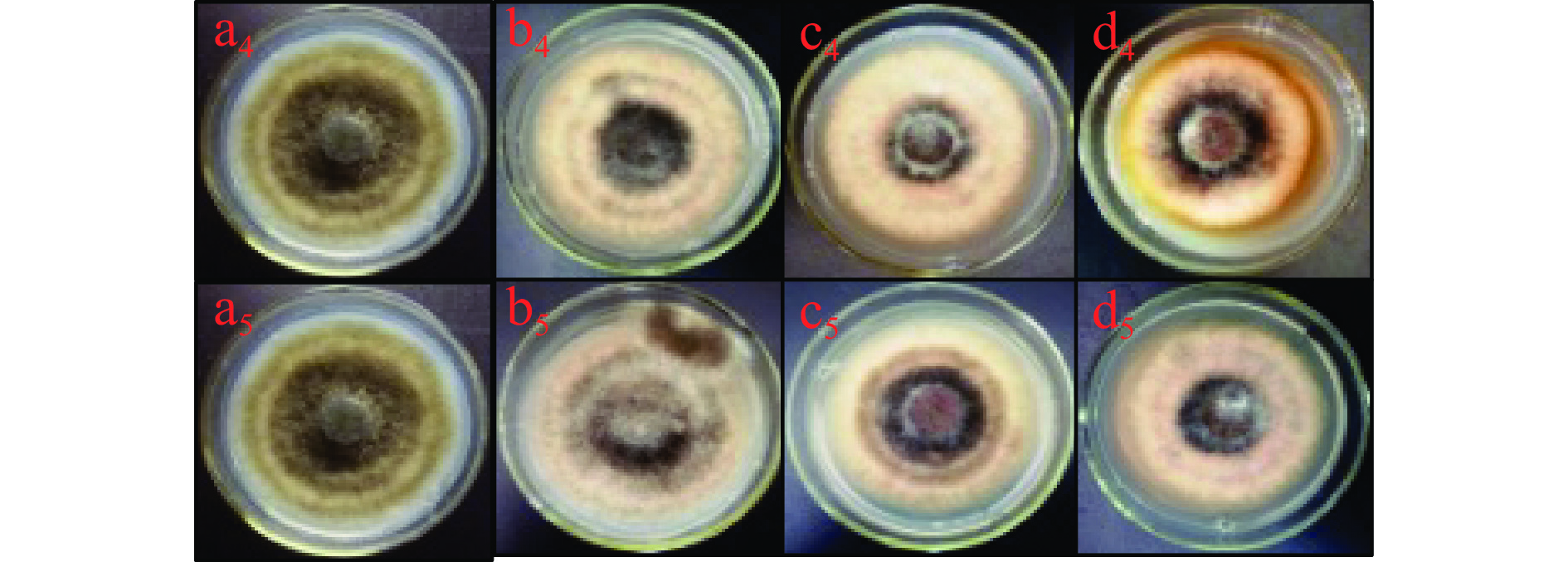
由图4可知,在整个培养期间,A. alternata的菌丝生长受到酚酸类物质的显著抑制,且随着处理浓度的增加,抑制作用越强,在培养4 d后,高浓度酚酸类物质处理A. alternata后,其菌丝生长状况与对照组相比,均有显著地抑制作用,其中阿魏酸处理抑制作用最强,以4 mg/mL绿原酸、0.6 mg/mL咖啡酸、2 mg/mL阿魏酸和1.2 mg/mL对香豆酸处理组分别较对照降低了24.8%、6.5%、8.2%和29.4%。图5表示A. alternata由4种酚酸类物质处理之后的菌落颜色为墨绿色,边缘白色为菌丝,且图片显示4种酚酸类物质均不同程度得抑制了A. alternata的菌落生长,且统计结果为图4所示。
2.1.5 黄酮类物质处理对A. alternata菌丝生长的影响
黄酮类物质表儿茶素处理A. alternata后,培养4 d后,由图6可知,其菌丝生长状况与对照相比无明显差异,而儿茶素处理后高浓度具有显著地抑制作用,2 mg/mL处理后较对照降低了8.2%(P<0.05)。图7则分别为儿茶素和表儿茶素处理之后A. alternata的菌落生长4 d的形态,通过图片结果显示,2种黄酮类物质处理之后,其中2 mg/mL的儿茶素处理抑制了A. alternata的菌落生长,表儿茶素处理之后对其抑制作用不明显,但2种黄酮类物质处理之后,A. alternata的孢子产生均被抑制其中儿茶素抑制性较表儿茶素强,且具有浓度效应。
2.1.6 熊果苷处理对A. alternata菌丝生长的影响
由图8可知,不同浓度外源熊果苷处理A. alternata后,培养4 d时,其菌丝生长状况与对照相比无显著性差异(P>0.05)。表明外源熊果苷处理后对A. alternata的菌丝生长无抑制作用。由图9可以看出,熊果苷处理A. alternata后,菌落直径与对照相比无明显差异,但菌落颜色对照为墨绿色,处理组为褐色。
2.2 苹果梨果皮酚类物质对A. alternata生长的影响
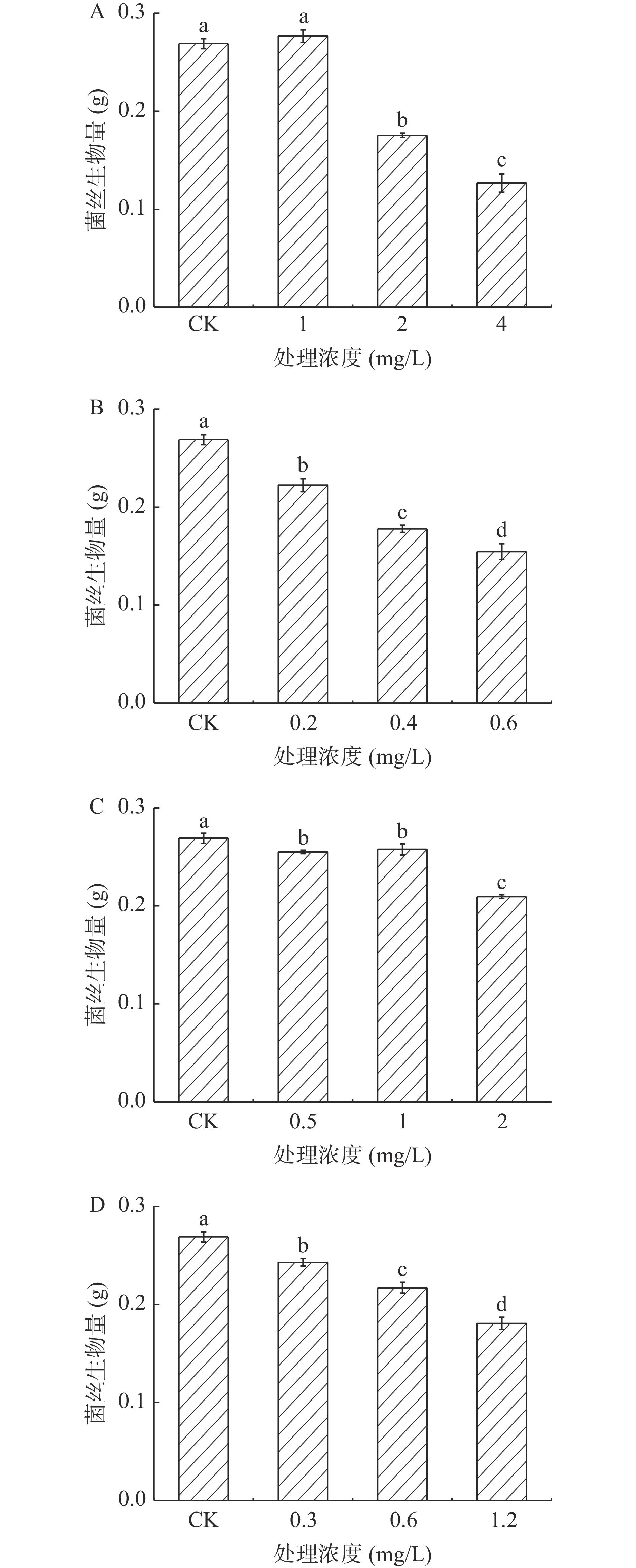
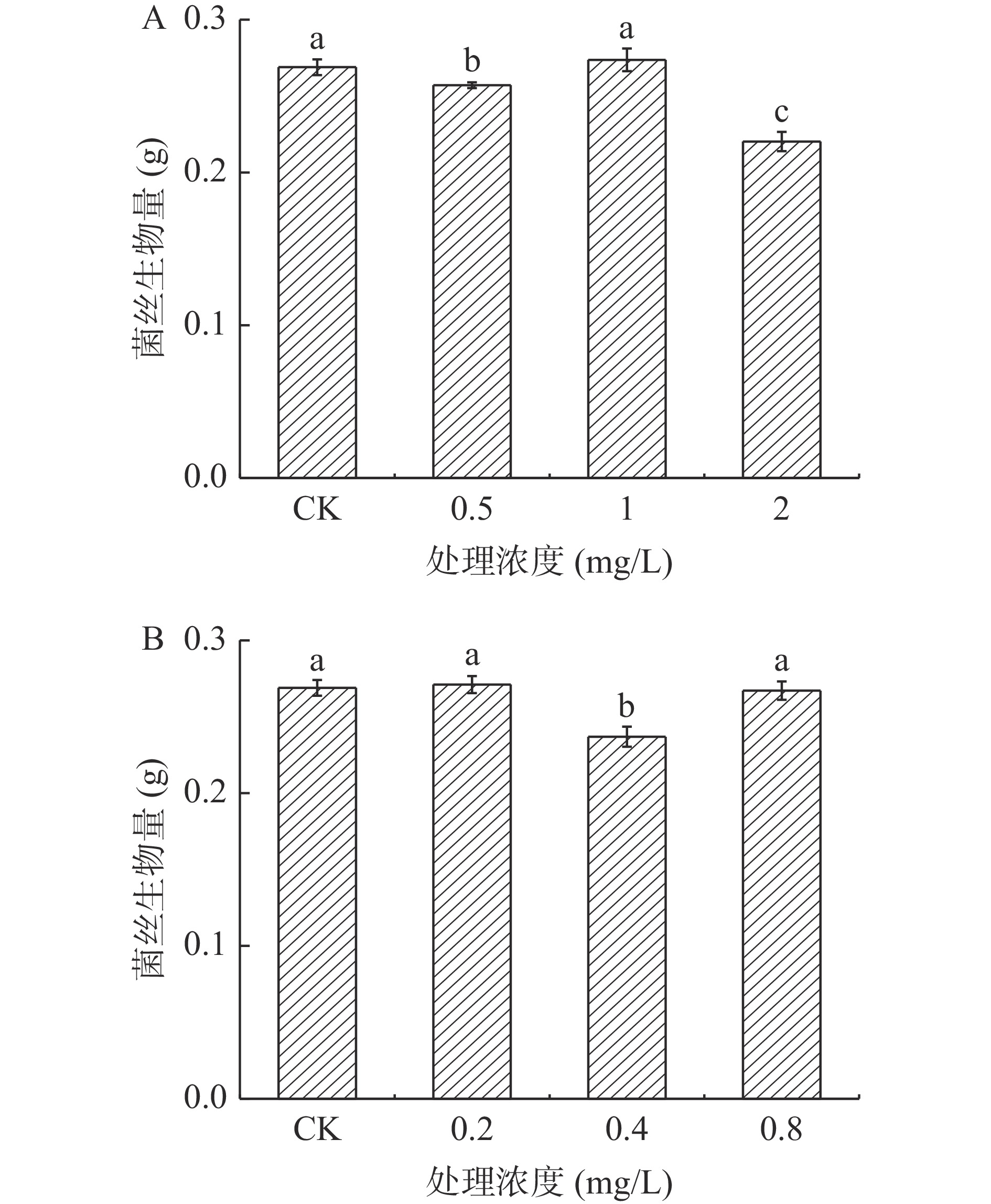
2.2.1 酚酸类物质对A. alternata菌丝生物量的影响
不同浓度的外源酚酸类物质处理A. alternata后,均一定程度的降低了A. alternata的菌丝干重,且随着浓度的增加菌丝生物量被降低的程度越强。在培养4 d后(图10),以4 mg/mL绿原酸,0.6 mg/mL咖啡酸,2 mg/mL阿魏酸和1.2 mg/mL对香豆酸处理组较对照分别降低了52.9%、42.5%、22.2%和32.8%。
2.2.2 外源黄酮类物质对A.alternata菌丝生物量的影响
由图11可知,不同浓度儿茶素处理A. alternata后(图11A),对其菌丝干重的影响程度不同,其中2 mg/mL处理后与对照相比菌丝生物量降低了18.1%。然而,不同浓度表儿茶素处理A. alternata后(图11B),与对照相比菌丝生物量无明显差异。
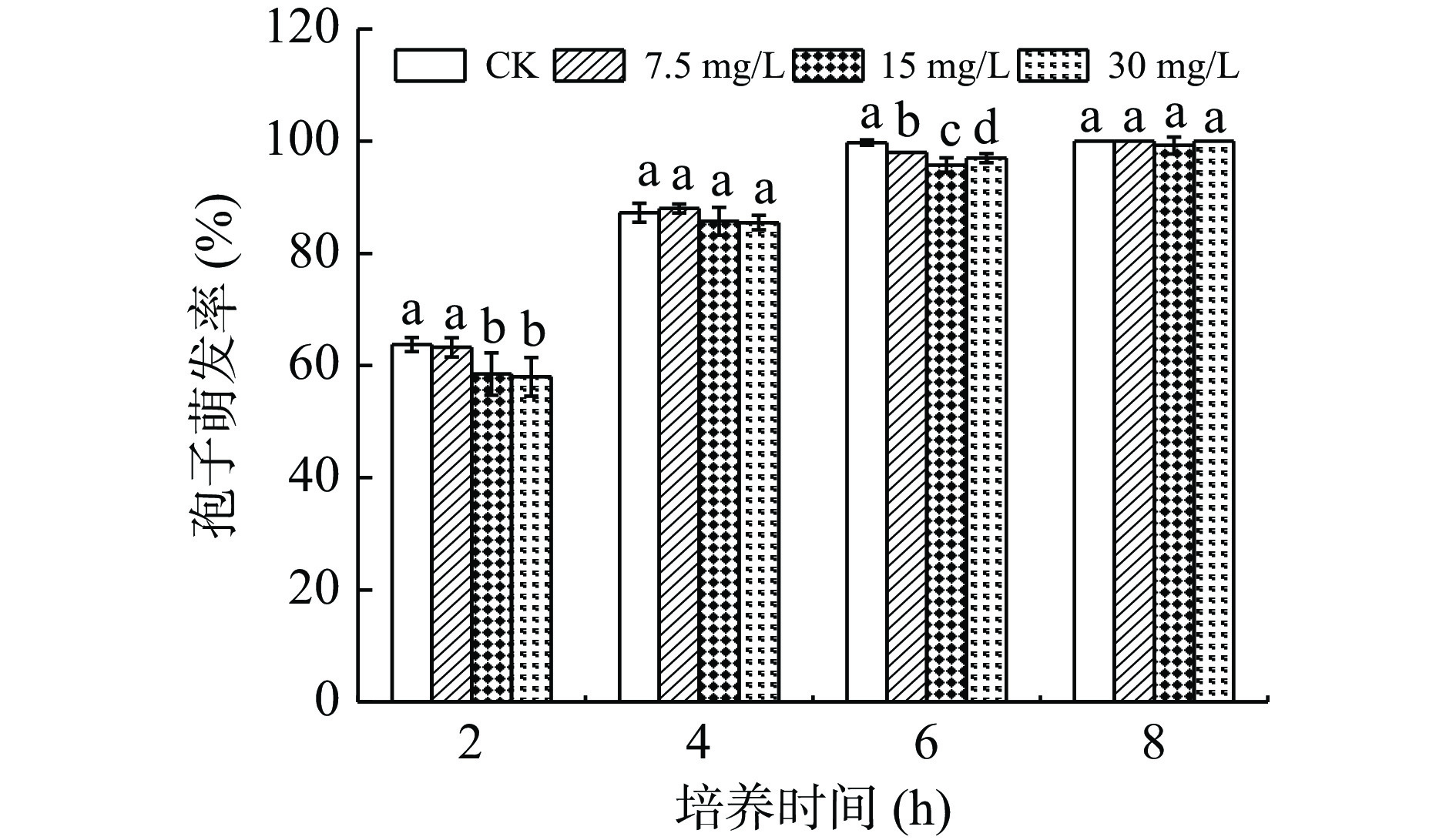
2.2.3 外源熊果苷处理质对A. alternata菌丝生物量的影响
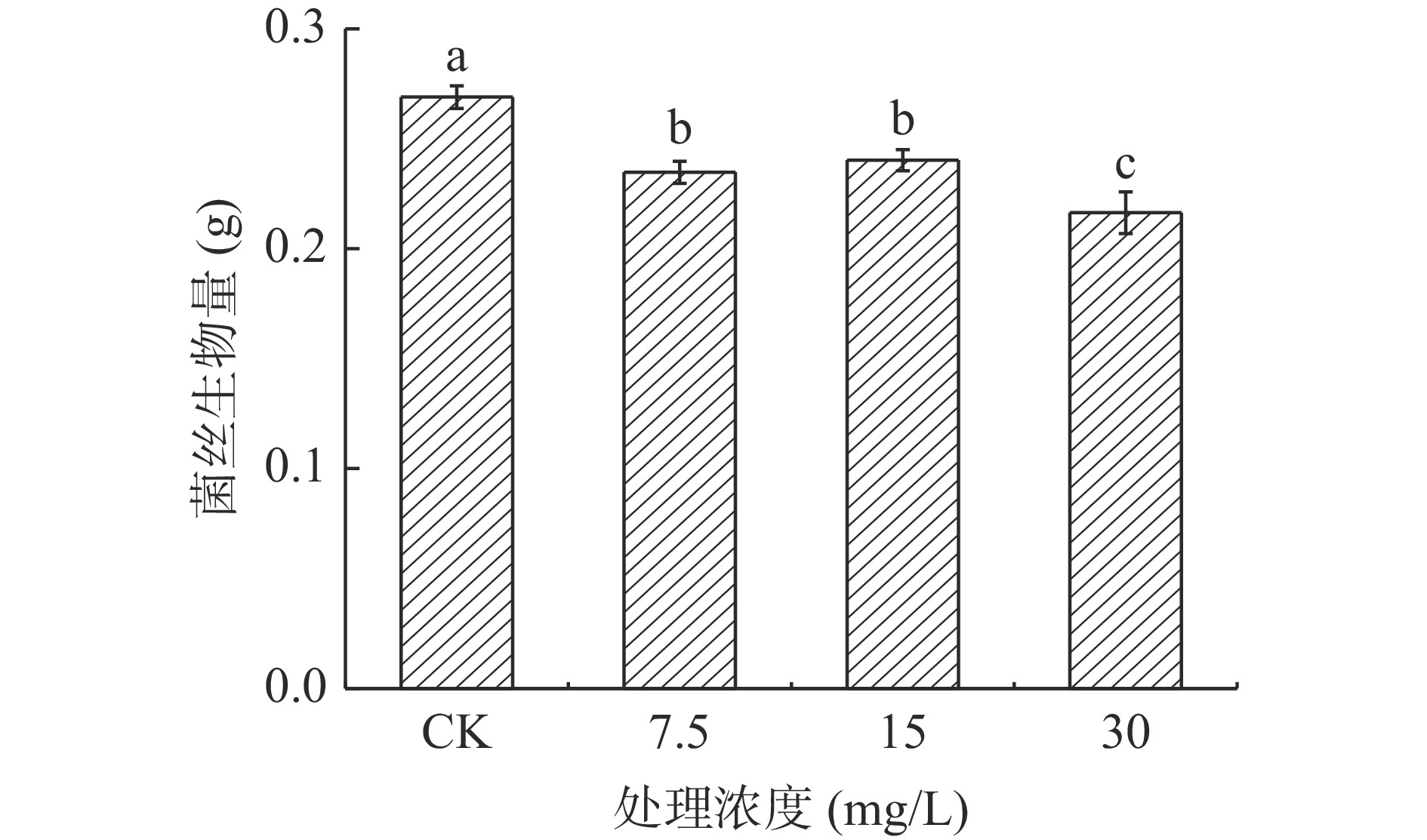
在苹果梨果皮酚类物质中,熊果苷含量最高。由图12可知,培养4 d时,以不同浓度外源熊果苷处理A. alternata后,随着熊果苷浓度增加,菌丝生物量含量逐渐下降。其中30 mg/mL熊果苷处理后较对照降低了19.6%。
2.3 苹果梨果皮酚类物质对A. alternata黑色素含量的影响
由表1可知,培养4 d时,不同浓度外源酚类物质处理A. alternata后,其黑色素含量均不同程度的增加,且总体上随着酚类物质浓度的增加黑色素含量呈现增加的趋势。其中儿茶素、表儿茶素和熊果苷对黑色素形成的促进作用最强,0.4 mg/mL 咖啡酸、2 mg/mL儿茶素、0.6 mg/mL表儿茶素和30 mg/mL熊果苷处理后,A. alternata黑色素含量分别是对照的2.53倍、3.00倍、2.05倍和1.53倍。但绿原酸、阿魏酸和对香豆酸处理A. alternata后,黑色素的含量略有增加。
表 1 不同酚类物质对A. alternata黑色素含量的影响Table 1. Effect of different phenolic compounds on the content of melanin in A. alternata酚类物质种类 浓度(mg/L) 黑色素(mg/g) 酚类物质种类 浓度
(mg/L)黑色素(mg/g) 绿原酸 CK 0.230±0.007b 儿茶素 CK 0.230±0.007d 1 0.257±0.018a 0.5 0.332±0.007c 2 0.276±0.119a 1 0.376±0.005b 4 0.260±0.006a 2 0.691±0.008a 咖啡酸 CK 0.230±0.007d 表儿茶素 CK 0.230±0.007d 0.2 0.382±0.008b 0.2 0.310±0.007c 0.4 0.581±0.009a 0.4 0.426±0.010b 0.6 0.276±0.012c 0.8 0.472±0.023a 阿魏酸 CK 0.230±0.007b 熊果苷 CK 0.230±0.007d 0.5 0.210±0.005c 7.5 0.426±0.015a 1 0.233±0.005ab 15 0.256±0.002c 2 0.241±0.001a 30 0.352±0.006b 对香豆酸 CK 0.230±0.007b 0.3 0.283±0.005a 0.6 0.228±0.001b 1.2 0.234±0.002b 注:不同字母表示不同处理浓度间差异显著(P<0.05)。 3. 讨论
本研究发现苹果梨果皮的酚酸类物质显著地抑制了A. alternata的孢子萌发、菌丝生长及生物量,这与Lee等[11]发现在未成熟的桃果实皮中的绿原酸对M. fructicola作用结果相一致。类似的如Sanzani等 [3]和白雪娜等[17]研究发现伞形花内酯能有效抑制苹果P. expansum、Botrytis cinerea和M. fructicola的生长。Li等发现800 μg/mL的对香豆酸甲酯(乙酯)显著地延缓了A. alternata孢子萌发以及菌丝生长,进而延缓枣果实病害的发生[12-13]。本文研究结果显示,阿魏酸和对香豆酸对A. alternata生长的抑制效果最佳,在处理8 h后发现,2 mg/mL阿魏酸和1.2 mg/mL对香豆酸处理的A. alternata孢子萌发率分别较对照降低了98.5%以及86.0%;培养4 d时,这两个酚类物质处理组的A. alternata菌落直径与对照相比分别降低了29.4%和8.2%,相类似的研究发现阿魏酸处理可有效控制西瓜采后病原真菌Fusarium oxysporum引起的枯萎病[18]。此外,本研究发现,2 mg/mL的儿茶素对A. alternata的生长同样具有抑制作用,Pane等[19]在辣椒中也有类似发现。根据本研究的具体结果,分析可能的原因与酚类物质处理病原菌后破坏了其细胞膜完整性有一定的关联,由于植物酚类物质的化学结构式上存在的羟基(-OH)连接在苯环或其复杂的芳香环上[20],因此其更具有亲脂性,而羟基可作用于细胞膜通过氧化磷酸化解偶联进而优先进入膜内[21]。由此酚类物质的抗真菌机制在于其影响病原物细胞脂蛋白膜的功能,损伤细胞膜完整性,细胞离子稳态以及液泡,胞质pH的变化[22- 23],类似的研究发现水杨酸处理后损伤P. expansum细胞膜完整性,导致质膜蛋白质,糖以及核酸的渗透泄露[24]。
黑色素是病原真菌致病过程中重要的毒力因子,具有抗氧化、抗溶菌酶、吸收紫外线、抵御宿主免疫攻击等生物学功能[25],虽然对真菌生长和繁殖的影响较弱,但能够降低病原菌对寄主所分泌的代谢产物的敏感性,从而提高其在寄主中的生存能力[26],如Bacillus anthraci、Magnaporthe grisea、Acanthosporium cucurbitum、Acanthopanax senticosus和Acanthopanax graminearum等入侵寄主时产生的黑色素能激发附着胞产生膨压,有利于病原菌在寄主体内定殖[27],同时,Pihet等[28]和Chai等[29]研究发现Cryptococcus neoformans黑色素缺失突变菌株丧失了致病性,在M. grisea [30]和A. alternata[31]中也发现了类似结果。而黑色素增强病原真菌的生命力主要是由于其具有菌体胞外氧化还原缓冲剂的作用,可以中和病原物侵入寄主时造成的由于环境压力产生的氧化剂,并且研究观察到,黑色的C. neoformans细胞在氮和氧衍生的氧化剂作用下比非黑化的细胞存活率高出约10倍,这表明黑色素通过保护病原体免受免疫产生的自由基而有助于其致病,同时在对Wangiella dermatidis以及A. alternata的氧化损伤研究时发现,黑色素在这两种病原菌中的氧化还原性质与C. neoformans中发现的结果一致[32]。然而,酚类物质对病原菌黑色素的研究鲜有报道,我们研究发现,梨果皮的7种酚类物质处理A. alternata后,不同程度的刺激了该病原菌黑色素的产生,有趣的是,酚酸类物质处理后显著地延缓A. alternata的生长,然而其对黑色素的产生无明显影响,相反的是儿茶素、表儿茶素和熊果苷处理后使A. alternata生长过程中黑色素明显增加,其高浓度处理后黑色素含量分别是对照的3.00倍、2.05倍和1.53倍。其具体调控机理尚需进一步研究。
4. 结论
除熊果苷外,苹果梨果的酚类物质处理对A. alternata的生长均具有不同程度的抑制作用,其中酚酸类物质的抑制效果较明显,阿魏酸的抑制作用最强。此外,酚类物质处理后,均显著地激发了A. alternata致病过程中黑色素的产生量,儿茶素、表儿茶素和熊果苷对A. alternata产生黑色素的促进作用较强。表明苹果梨果皮酚类物质对A. alternata的生长以及致病性具有重要的调控作用。
-
表 1 不同酚类物质对A. alternata黑色素含量的影响
Table 1 Effect of different phenolic compounds on the content of melanin in A. alternata
酚类物质种类 浓度(mg/L) 黑色素(mg/g) 酚类物质种类 浓度
(mg/L)黑色素(mg/g) 绿原酸 CK 0.230±0.007b 儿茶素 CK 0.230±0.007d 1 0.257±0.018a 0.5 0.332±0.007c 2 0.276±0.119a 1 0.376±0.005b 4 0.260±0.006a 2 0.691±0.008a 咖啡酸 CK 0.230±0.007d 表儿茶素 CK 0.230±0.007d 0.2 0.382±0.008b 0.2 0.310±0.007c 0.4 0.581±0.009a 0.4 0.426±0.010b 0.6 0.276±0.012c 0.8 0.472±0.023a 阿魏酸 CK 0.230±0.007b 熊果苷 CK 0.230±0.007d 0.5 0.210±0.005c 7.5 0.426±0.015a 1 0.233±0.005ab 15 0.256±0.002c 2 0.241±0.001a 30 0.352±0.006b 对香豆酸 CK 0.230±0.007b 0.3 0.283±0.005a 0.6 0.228±0.001b 1.2 0.234±0.002b 注:不同字母表示不同处理浓度间差异显著(P<0.05)。 -
[1] YAN J, YUAN S, WANG C, et al. Enhanced resistance of jujube (Zizphus jujube Mill. cv. Dongzao) fruit against postharvest Alternaria rot by β-aminobutyric acid dipping[J]. Scientia Horticulturae,2015,186:108−114. doi: 10.1016/j.scienta.2015.02.018
[2] HARTEVELD D O C, AKINSANMI O A, DULLAHIDE S, et al. Sources and seasonal dynamics of Alternaria inoculums associated with leaf blotch and fruit spot of apples[J]. Crop Protection,2014,59:35−42. doi: 10.1016/j.cropro.2014.01.011
[3] SANZANI S M, REVERBERI M, GEISEN R. Mycotoxins in harvested fruits and vegetables: Insights in producing fungi, biological role, conducive conditions, and tools to manage postharvest contamination[J]. Postharvest Biology and Technology,2016,122:95−105. doi: 10.1016/j.postharvbio.2016.07.003
[4] GRECO M, PATRIARCA A, TERMINIELLO L, et al. Toxigenic Alternaria species from Argentinean blueberries[J]. Food Microbiology,2012,154:187−191. doi: 10.1016/j.ijfoodmicro.2012.01.004
[5] LI Y C, BI Y, AN L Z. Occurrence and latent infection of Alternaria rot of Pingguoli pear (Pyrus bretschneideri Rehd. cv. Pingguoli) fruits in Gansu, China[J]. Journal of Phytopathology,2007,155(1):56−60. doi: 10.1111/j.1439-0434.2006.01202.x
[6] ESTIARTE N, CRESPO-SEMPERE A, MARIN S, et al. Exploring polyamine metabolism of Alternaria alternata to target new substances to control the fungal infection[J]. Food Microbiology,2017,65:193−204. doi: 10.1016/j.fm.2017.02.001
[7] WANG Y, YU T, LI Y C, et al. Postharvest biocontrol of Alternaria alternata in Chinese winter jujube by Rhodosporidi paludigenum[J]. Applied Microbiology,2009,107:1492−1498. doi: 10.1111/j.1365-2672.2009.04330.x
[8] PIZZOLITTO R P, BARBERIS C L, DAMBOLENA J S, et al. Inhibitory effect of natural phenolic compounds on Aspergillus parasitic growth[J]. Journal of Chemistry, 2016, 2015: 1-7.
[9] İREM D, EKSI A. Antioxidant capacity and anthocyanin profile of sour cherry (Prunus cerasus L.) juice[J]. Food Chemistry,2012,135(4):2910−2914. doi: 10.1016/j.foodchem.2012.07.032
[10] WANG M, JIANG N, WANG Y, et al. Characterization of phenolic compounds from early and late ripening sweet cherries and their antioxidant and antifungal activities[J]. Food Chemistry,2017,65:5413−5420. doi: 10.1021/acs.jafc.7b01409
[11] LEE M H, BOSTOCK R M. Induction, regulation and role in pathogenesis of appressoria in Monilinia fructicola[J]. Phytopathology,2006,96(10):1072−1080. doi: 10.1094/PHYTO-96-1072
[12] LI W S, YUAN S Z, SUN J. Ethyl p-coumarate exerts antifungal activity in vitro and in vivo against fruit Alternaria alternata via membrane-targeted mechanism[J]. International Journal of Food Microbiology,2018,278:26−25. doi: 10.1016/j.ijfoodmicro.2018.04.024
[13] LI W S, YUAN S Z, LI Q Q. Methyl p-coumarate inhibits black spot rot on jujube fruit through membrane damage and oxidative stress against Alternaria alternata[J]. Postharvest Biology and Technology, 2018, 145: 230–238.
[14] DA ROCHA NETOA C, MARASCHIN M, PIERO R M D. Antifungal activity of salicylic acid against Penicillium expansum and its possible mechanisms of action[J]. International Journal of Food Microbiology, 2015, 215: 64–70.
[15] PRUSKY D, ALKAN N, MENGISTE T, et al. Quiescent and necrotrophic lifestyle choice during postharvest disease development[C]. Annual Review of Phytopathology, 2013, 51: 155–176.
[16] 刘筱. 基于苹果梨果皮含量水平的酚类物质对Alternaria alternata侵染及胞外降解酶的调控[D]. 兰州: 甘肃农业大学, 2017. LIU X. Regulation of phenolic compounds based on concentration level in fruit peel of Pingguoli pear on pre-penetration process and extracellular degrading enzymes of Alternaria alternata[D]. Lanzhou: Gansu Agricultural University, 2017.
[17] 白雪娜, 卜亚春, 谷继成, 等. 伞形花内醋对植物病原真菌的抑制作用[J]. 植物保护,2012,38(2):42−45. [BAI X N, BU Y C, GU J C, et al. Antifungal activity of umbelliferone to plant pathogenic fungi[J]. Plant Protection,2012,38(2):42−45. doi: 10.3969/j.issn.0529-1542.2012.02.008 BAI X N, BU Y C, GU J C, et al. Antifungal activity of umbelliferone to plant pathogenic fungi[J]. Plant Protection, 2012, 38(2): 42-45. doi: 10.3969/j.issn.0529-1542.2012.02.008
[18] ANI V, VARADARAJ M, NAIDU K. Antioxidant and antibacterial activities of polyphenolic compounds from bitter cumin (Cuminum nigrum L.)[J]. European Food Review Technology,2006,224:109−115. doi: 10.1007/s00217-006-0295-z
[19] PANE C, FRATIANNI F, PARISI M, et al. Control of Alternaria post-harvest infections on cherry tomato fruits by wild pepper phenolic-rich extracts[J]. Crop Protection,2016,84:81−87. doi: 10.1016/j.cropro.2016.02.015
[20] BRUNETON J. Pharmacognosy, phytochemistry, medicinal plants intercept[M]. London Paris: New York, 1992.
[21] MIGUEL ÁNGEL P, AGUSTÍN L, CRUZ S D L, et al. PCR-based assay for the detection of Alternaria species and correlation with HPLC determination of altenuene, alternariol and alternariol monomethyl ether production in tomato products[J]. Food Control,2012,25(1):1−52.
[22] XU J, ZHOU F, JI B P, et al. The antibacterial mechanism of carvacrol and thymol against Escherichia coli[J]. Letters in Applied Microbiology,2008,47(3):174−179. doi: 10.1111/j.1472-765X.2008.02407.x
[23] RAO A, ZHANG Y Q, MUEND S, et al. Mechanism of antifungal activity of terpenoid phenols resembles calcium stress and inhibition of the TOR pathway[J]. Antimicrobial Agents and Chemotherapy,2010,54(12):5062−5069. doi: 10.1128/AAC.01050-10
[24] CEZAR D R N A, MARASCHIN M, DI PIERO R M. Antifungal activity of salicylic acid against Penicillium expansum and its possible mechanisms of action[J]. Food Microbiology,2015,215:64−70. doi: 10.1016/j.ijfoodmicro.2015.08.018
[25] LANOUE A, BURLAT V, HENKES G J, et al. De novo biosynthesis of defense root exudates in response to Fusarium attack in barley[J]. New Phytologist,2010,185:577−588. doi: 10.1111/j.1469-8137.2009.03066.x
[26] 周真, 杜妍娴, 李希清. 黑色素与常见病原真菌致病性的关系[J]. 中国真菌学杂志,2011,6(6):373−376. [ZHOU Z, DU Y X, LI X Q. The relationship between melanin and common pathogenicity[J]. Chinese Journal of Mycology,2011,6(6):373−376. doi: 10.3969/j.issn.1673-3827.2011.06.016 ZHOU Z, DU Y X, LI X Q. The relationship between melanin and common pathogenicity[J]. Chinese Journal of Mycology, 2011, 6(6): 373-376. doi: 10.3969/j.issn.1673-3827.2011.06.016
[27] 吴尧, 马爱民, 侣国涵, 等. 香灰菌黑色素的分离及抗氧化活性研究[J]. 天然药物研究与开发,2007,19(7):43−44. [WU Y, MA A M, LÜ G H, et al. Isolation and antioxidant activity of melanin pigment from Hypoxylon sp J]. Natural Product Research and Development,2007,19(7):43−44.
[28] PIHET M, VANDEPUTTE P, TRONCHIN G, et al. Melanin is an essential component for the integrity of the cell wall of Aspergillus fumigatus conidia[J]. BMC Microbiology,2009,9:177. doi: 10.1186/1471-2180-9-177
[29] CHAI L Y, NETEA M G, SUGUI J, et al. Aspergillus fumigatus conidial melanin modulates host cytokine response[J]. Immunobiology,2010,215(11):915−920. doi: 10.1016/j.imbio.2009.10.002
[30] BUTLER M J, DAY A W, HENSON J M, et al. Pathogenic properties of fungal melanins[J]. Mycologia,2001,93:1−8. doi: 10.2307/3761599
[31] YAGO J I, LIN C H, CHUNG K R. The SLT2 mitogen-activated protein kinase-mediated signalling pathway governs conidiation, morphogenesis, fungal virulence and production of toxin and melanin in the tangerine pathotype of Alternaria alternata[J]. Molecular Plant Pathology,2011,12(7):653−665. doi: 10.1111/j.1364-3703.2010.00701.x
[32] RITA DE CÁSSIA R G, POMBEIRO-SPONCHIADO S R. Antioxidant activity of the melanin pigment extracted from Aspergillus nidulans[J]. Biological and Pharmaceutical Bulletin,2005,28(6):1129−1131. doi: 10.1248/bpb.28.1129
-
期刊类型引用(0)
其他类型引用(4)






 下载:
下载:



 下载:
下载:



