Study on Aqueous Two-phase Extraction Process of Volatile Oil from Cinnamon and Its Flavor Composition
-
摘要: 目的:优化双水相法萃取肉桂挥发油工艺并研究其对风味物质的影响。方法:以肉桂挥发油得率为指标,通过正交试验设计优化双水相萃取肉桂挥发油工艺;采用气相色谱与质谱联用并运用主成分分析法对比探究肉桂挥发油风味物质变化。结果:最佳萃取工艺为乙醇质量分数25%,磷酸二氢钠质量分数34%,固液比1:15 g/mL,萃取时间60 min,萃取温度35 ℃,此条件下肉桂挥发油和肉桂醛得率为2.82%和0.037%,与常规水蒸气蒸馏法相比分别提高了1.07和1.31倍。双水相萃取法和水蒸气蒸馏法制得挥发油中分别鉴定出14和15种物质,均以萜烯类和醛类为主。双水相萃取法制得挥发油中含有更多的α-蒎烯(59.93%)、杜松萜-1(10),4-二烯(10.20%)、α-衣兰油烯(7.35%)、环苜蓿烯(2.44%)和衣兰烯(1.50%)等萜烯类成分。结论:双水相萃取用于肉桂挥发油提取具有条件温和、得率高及溶剂易回收等优势,可作为香辛料挥发油萃取分离的有效方法。Abstract: Objective: This study aimed to optimize the extraction process of essential oil from Cinnamomum cassia Presl. and reveal its effect on flavor compounds. Methods: The aqueous two-phase extraction of essential oil was optimized by orthogonal design, and the yield of the essential oil from Cinnamomum cassia Presl. was employed as the index to evaluate the outcome. The flavor compounds of cinnamon volatile oil were analyzed by Gas Chromatography-Mass Spectrometry (GC-MS) combined with principal component analysis. Results: The optimal extraction conditions were as follows: The mass fraction of ethanol 25%, the mass fraction of sodium dihydrogen phosphate 34%, the solid-liquid ratio 1:15 g/mL, the extraction time 60 min, and the temperature of extraction 35 ℃. Under these conditions, the yields of cinnamon volatile oil and cinnamaldehyde were 2.82% and 0.037%, which were 1.07 times and 1.31 times higher than those of the conventional steam distillation method. Furthermore, a total of 14 and 15 chemical compounds were identified in the essential oil of Cinnamomum cassia Presl. by two-phase extraction and steam distillation method, respectively. The results demonstrated that most of these compounds were terpenes and aldehydes. Compared with the conventional steam distillation method, the main components of the volatile oil prepared by aqueous two-phase extraction were distinct, and the latter contained more terpene components such as α-pinene (59.93%), cadina-1(10),4-diene (10.20%), α-muurolene (7.35%), cycloalfalfa (2.44%) and yilanene (1.50%). Conclusion: The aqueous two-phase extraction has several advantages of mild conditions, high yield and easy recovery of solvent for the extraction of cinnamon volatile oil. It can be used as an effective method for the extraction and separation of volatile oil from spices.
-
Keywords:
- cinnamon /
- aqueous two-phase extraction /
- volatile oil /
- cinnamic aldehyde /
- flavor composition
-
肉桂为樟科樟属植物肉桂(Cinnamomum cassia Presl.)的干燥树皮,是具有暖甜、辛辣风味的浓香型香料,在食品调味、保鲜、抑菌消炎等方面有重要作用[1-2]。肉桂中含有1.2%~4.6%的挥发油,为淡黄色油状液体,具有药草、辛香-药草香风味及甜味,应用范围广泛,包括烘焙食物、酒精饮料、牙膏和口香糖等[3-4]。其挥发油中风味成分复杂,产量和组成比例受品种、预处理及提取手段等影响[5]。
目前,提取肉桂挥发油的方法包括水蒸气蒸馏、超声、微波辅助提取[6-7]及超临界流体萃取[8]等。其中,传统的水蒸气蒸馏法操作简便,但具有挥发油提取得率低、耗时长和操作温度高等不足[9];对于新型的超声、微波辅助提取法,在挥发油提取得率上有所提升,但其对设备有一定要求[9-10];超临界流体萃取法具有过程高效、产品杂质成分少等优势,但其操作略复杂且生产成本高[11]。双水相萃取(Aqueous two-phase extraction,ATPE)是一种条件温和、传质速度快、分相时间较短且溶剂易回收的新型萃取分离技术[12]。根据待萃取物在互不相溶两水相间的选择性分配,原料进入体系后,在疏水作用、电荷作用以及各种力(如氢键)的共同作用下,其有效成分在两相中以不同速度分配而达到快速分离。因此,双水相体系作为萃取介质,对目标物的萃取目的性和高效性强。研究表明,基于乙醇-盐、聚乙二醇-盐及丙酮-盐等体系,在黄酮、皂苷和生物碱等天然产物的分离提取中效果明显[13-16]。另外,有研究采用β-环糊精-硫酸钠体系应用于罗汉松枝叶挥发油的提取,其得率较水蒸气蒸馏法提高了20.55%[17]。但双水相萃取肉桂挥发油的相关研究还未见文献报道。
因此,为解决挥发性成分损失、溶剂难以回收、能耗和设备造价高等问题,本文采用双水相萃取法制备肉桂挥发油,在对其萃取体系和工艺进行优化的基础上,采用气相色谱与质谱联用对比分析双水相萃取法和常规水蒸气蒸馏法制得肉桂挥发油、肉桂醛得率及其风味物质差异,为香辛料精油的高效制备和应用提供理论和技术指导。
1. 材料与方法
1.1 材料与仪器
肉桂 北京仟草中药饮片有限公司;肉桂醛标准品(Lot.No.924E021)、肉桂挥发油标准品(YZ-111550) 北京索莱宝科技有限公司;甲醇、乙腈 色谱纯;硫酸铵、硫酸钠、磷酸二氢钠、磷酸氢二钾、聚乙二醇4000、无水乙醇等其他试剂 均为分析纯。
ZORBAX SB-C18色谱柱、65 μm PDMS/DVB萃取头 艾杰科(天津)生物科技有限公司;DHC-250深冷粉碎机 江阴市弘川机械设备有限公司;ISQ 7000单四极杆GC-MS联用仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 样品制备
将肉桂剪为约5 mm大小片状,每组进料量约为500 g,采用DHC-250深冷粉碎机分别在室温和−35 ℃温度环境下,以30 Hz主机频率和15 Hz风机频率粉碎至完全出料,做3次平行实验并取全部肉桂粉进行后续工艺优化和提取实验。
1.2.2 双水相萃取肉桂挥发油
1.2.2.1 双水相萃取工艺
采用浊点滴定法[12]绘制乙醇-盐和聚乙二醇-盐相图,分别准确称重3.00 g硫酸钠/硫酸铵/磷酸二氢钠/磷酸氢二钾(ms)并溶于10.00 g的蒸馏水(mw)中,在溶液中加入乙醇直到观察混浊,记录乙醇的量(me)和混合物的总质量(mi);继续加入蒸馏水(mwj)至溶液清澈,记录总质量(mj)。重复上述步骤,记录足够的数据,依据公式(1)和(2)共得到对应10组数据来建立相图。聚乙二醇-盐体系相图同上。
醇浓度(w/w)=∑memi×100(i=1,2,3,⋯,n) (1) 盐浓度(w/w)=∑msmj×100(j=1,2,3,⋯,n) (2) 萃取过程参考Gharat等[13-14,18-19]方法并作部分修改。第一步成相:在15 mL离心管中,分别加入定量的盐溶液、醇溶液(w/w)至体系总重为10.00 g;第二步萃取:按一定固液比加入肉桂粉混匀并搅拌一段时间;第三步分相:将混匀液在4000 r/min条件下离心15 min,在室温下量取和记录上、下相体积并在287 nm下测定吸光值,代入挥发油标准曲线得出挥发油浓度;第四步回收:将上相萃取液旋蒸回收乙醇,得到的挥发油在4 ℃保存用于后续风味物质的分析。每组做3次平行实验。
相比(R)和分配系数(K)计算如下:
R=VTVB (3) K=CTCB (4) 式中:VT、VB和CT、CB为体系中上、下相的体积(mL)和挥发油浓度(10−5 g/mL)。
萃取得率(ET和EB)和回收率(Y)计算如下:
ET(%)=CTVTDW×100 (5) EB(%)=CBVBDW×100 (6) Y(%) = RK1+RK×100 (7) 式中:ET和EB分别为上相萃取率和下相萃取率;D为稀释倍数;W为肉桂粉绝对干燥下重量,g。
1.2.2.2 标准曲线的建立
取0.10 mL浓度为1.00×10−5 g/mL的肉桂挥发油标准溶液于10 mL棕色容量瓶中并用无水乙醇定容,作为储备液。分别取0.10、0.15、0.20、0.25和0.30 mL于10 mL棕色容量瓶中,用无水乙醇定容制得标准溶液,在287 nm下测定吸光值。经测定,得出肉桂挥发油的标准曲线为y=1.966x+0.162 (R2=0.9943)(y为吸光值,x为挥发油浓度,10−5 g/mL)。
1.2.3 双水相萃取肉桂挥发油的工艺优化
1.2.3.1 单因素实验
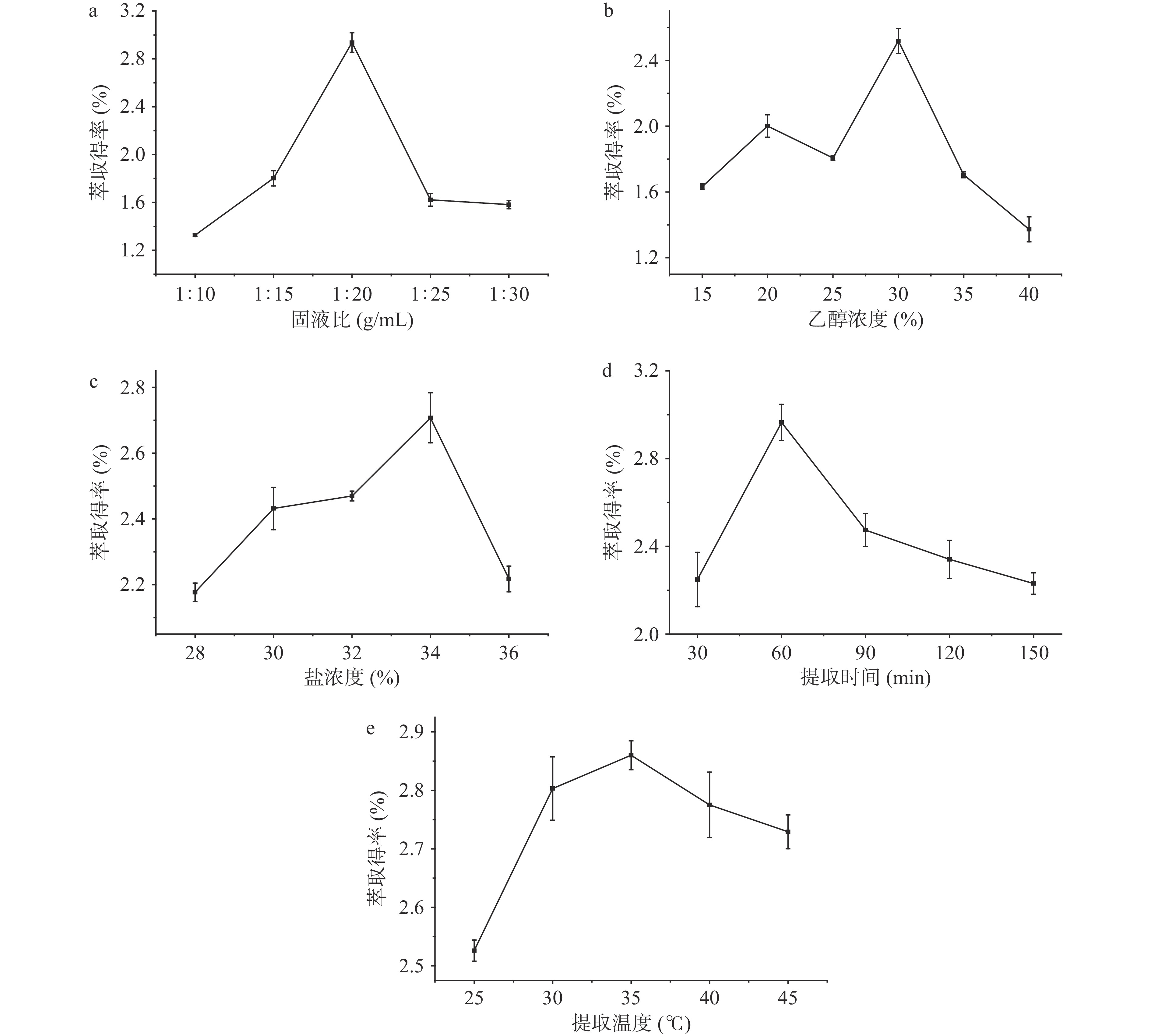
选用乙醇-磷酸二氢钠体系萃取肉桂挥发油,固定条件为:固液比1:20 g/mL、乙醇浓度25%、磷酸二氢钠浓度32%、提取时间60 min和提取温度35 ℃,分别考查固液比(1:10、1:15、1:20、1:25和1:30 g/mL)、醇浓度(15%、20%、25%、30%和35%)、盐浓度(28%、30%、32%、34%和36%)、提取时间(30、60、90、120和150 min)及提取温度(25、30、35、40和45 ℃)对肉桂挥发油萃取得率的影响。
1.2.3.2 正交试验
在单因素实验的基础上,因提取温度对肉桂挥发油萃取得率的影响不大而选取固液比、乙醇浓度、磷酸二氢钠浓度和提取时间为正交试验因素进行设计优化,如表1所示。
表 1 正交试验因素水平Table 1. Factors and levels of orthogonal experiment水平 因素 A乙醇浓度(%) B磷酸二氢钠浓度(%) C固液比(g/mL) D萃取时间(min) 1 25 32 1:15 30 2 30 34 1:20 60 3 35 36 1:25 90 1.2.4 肉桂挥发油含量测定
挥发油的含量测定参考中国药典2020版[20],先取约300 mL蒸馏水与沸石置于圆底烧瓶中,连接挥发油测定器并从上端加水至溢流入烧瓶为止,再快速加二甲苯1 mL后连接冷凝管,加热至沸腾30 min后,停止加热并放置约15 min,读取二甲苯体积;再精密称取肉桂粉40.00 g置于圆底烧瓶中,同理连接挥发油测定器并加水溢流入烧瓶为止,加热微沸约5 h,放置1 h后读取油层量,自油层量中减去二甲苯量即为挥发油量,重复操作3次。按以下公式计算肉桂粉中挥发油含量;
肉桂挥发油含量(%)=VW×100 (8) 式中:V为挥发油体积,mL;W为肉桂粉绝对干燥下的重量,g。
1.2.5 肉桂醛含量测定
肉桂醛含量测定同上参考[20-21],精密称取肉桂粉0.50 g加入甲醇25 mL并称重,功率350 W,频率35 kHz条件下超声处理10 min,放置过夜,同法超声处理一次,称重并用甲醇补足减失重量。量取续滤液1 mL,置25 mL容量瓶中,加甲醇定容,用于测定肉桂醛含量。
肉桂醛测定HPLC条件:采用二元高压梯度模式,检测波长:290 nm;流动相为乙腈:水为35:65;柱温:35 ℃;流速:0.8 mL/min;进样量20 μL。
肉桂醛得率公式如下:
肉桂醛得率(%)=CDVW×100 (9) 式中:C为样品浓度,g/mL;D为稀释倍数;V为样品体积,mL;W为肉桂粉绝对干燥下的重量,g。
1.2.6 肉桂挥发油风味物质分析
参考López等[22-23]顶空固相微萃取挥发性物质:先将萃取头老化25 min,然后量取肉桂挥发油于25 mL顶空瓶,加盖密封并在50 ℃、250 r/min条件下搅拌平衡15 min,再用已老化的萃取头吸附25 min后在进样口解吸15 min。GC-MS程序条件[24-25]:采用GC-MS联用仪(离子源200 ℃,70 eV);TG-5MS毛细管柱(30 m×0.25 mm×0.25 μm);炉火温度在40 ℃保持3 min,然后以4 ℃/min的速率从40 ℃提高到150 ℃,并保持1 min;再以8 ℃/min的速率从150 ℃提高到250 ℃维持6 min;分流比为1:10;载气:氦气;流速:0.9 mL/min;通过使用Wiley/NBS质谱库注册表和NIST MS搜索并和文献比对确定成分名称及分类整理各风味物质相对含量。
1.3 数据处理
实验数据均采用IBM SPSS Statistics 25和OriginPro 8.5整理分析和绘制,主成分分析采用SIMCA 14.1版软件得到结果。
2. 结果与分析
2.1 双水相萃取体系的选择
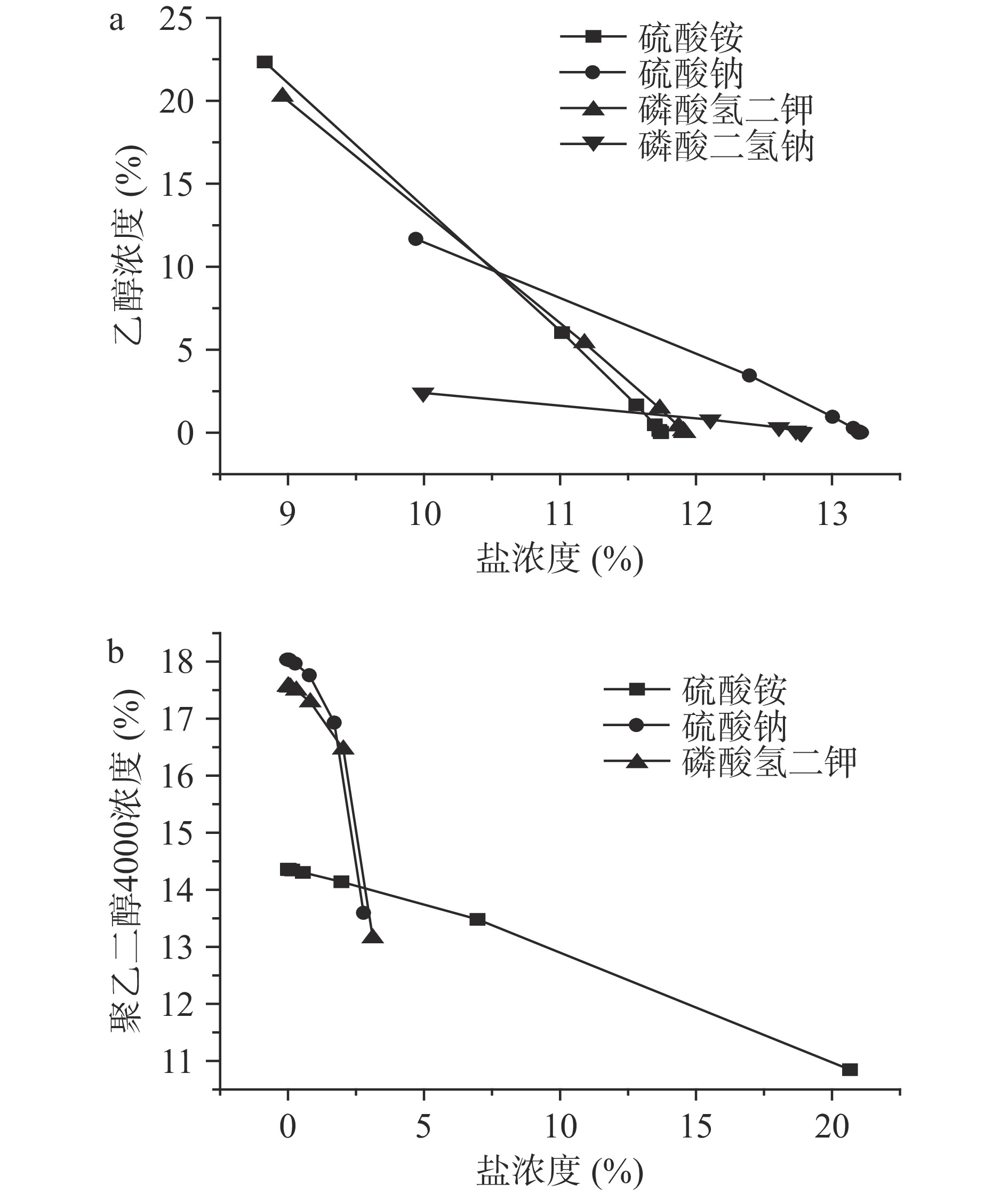
初步选择有机溶剂-盐作为萃取肉桂挥发油的双水相萃取体系。乙醇作为绿色有机溶剂且易于萃取酚类等天然化合物,聚乙二醇4000也是药物萃取常用的萃取介质[16]。采用浊点法绘制乙醇-硫酸钠/硫酸铵/磷酸二氢钠/磷酸氢二钾和聚乙二醇4000-硫酸铵/硫酸钠/磷酸氢二钾体系的双节点相图,如图1所示。结果表明,在低浓度范围内,对于乙醇-盐双水相体系,随盐浓度增大,其成相能力为硫酸铵>磷酸氢二钾>磷酸二氢钠>硫酸钠;对于聚乙二醇4000-盐体系,随盐浓度增大,其成相能力为磷酸氢二钾>硫酸钠>硫酸铵。由于盐析作用或高聚物的不相溶性,两种介质在水中达到一定浓度而成相,而成相能力的差异取决于两相的浓度配比。当醇在水中的质量分数降低,其极性降低,疏水性增加,导致与水缔合能力减弱,与盐溶液的差异变大从而推动两相的形成;当盐在水中的质量分数提高,双水相体系极性增大,出现的盐析作用促使醇与盐在水中达到配比平衡而成相[13]。为了选取最佳萃取体系,基于以上萃取体系的成相效果还需研究其对肉桂挥发油萃取的影响。
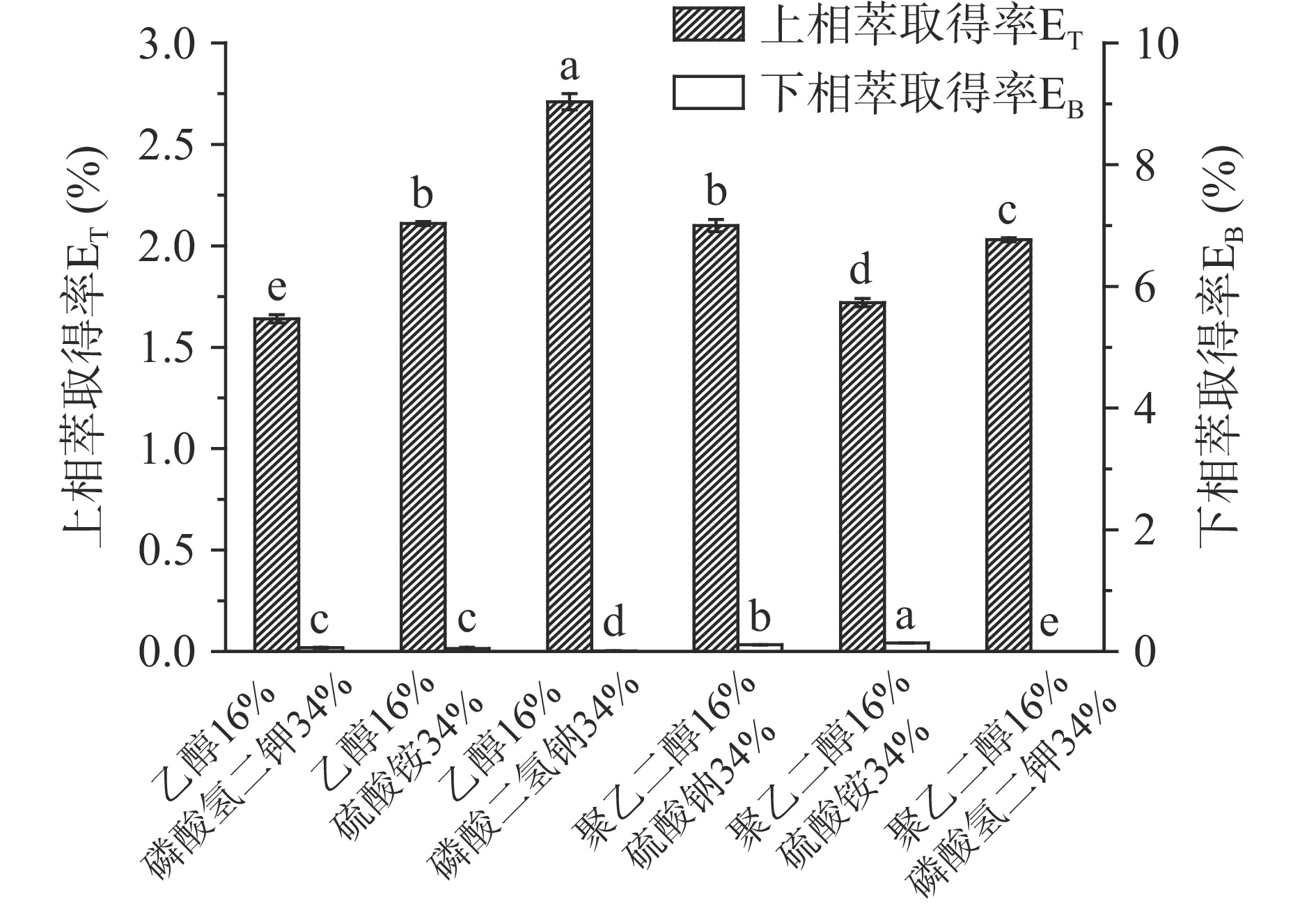
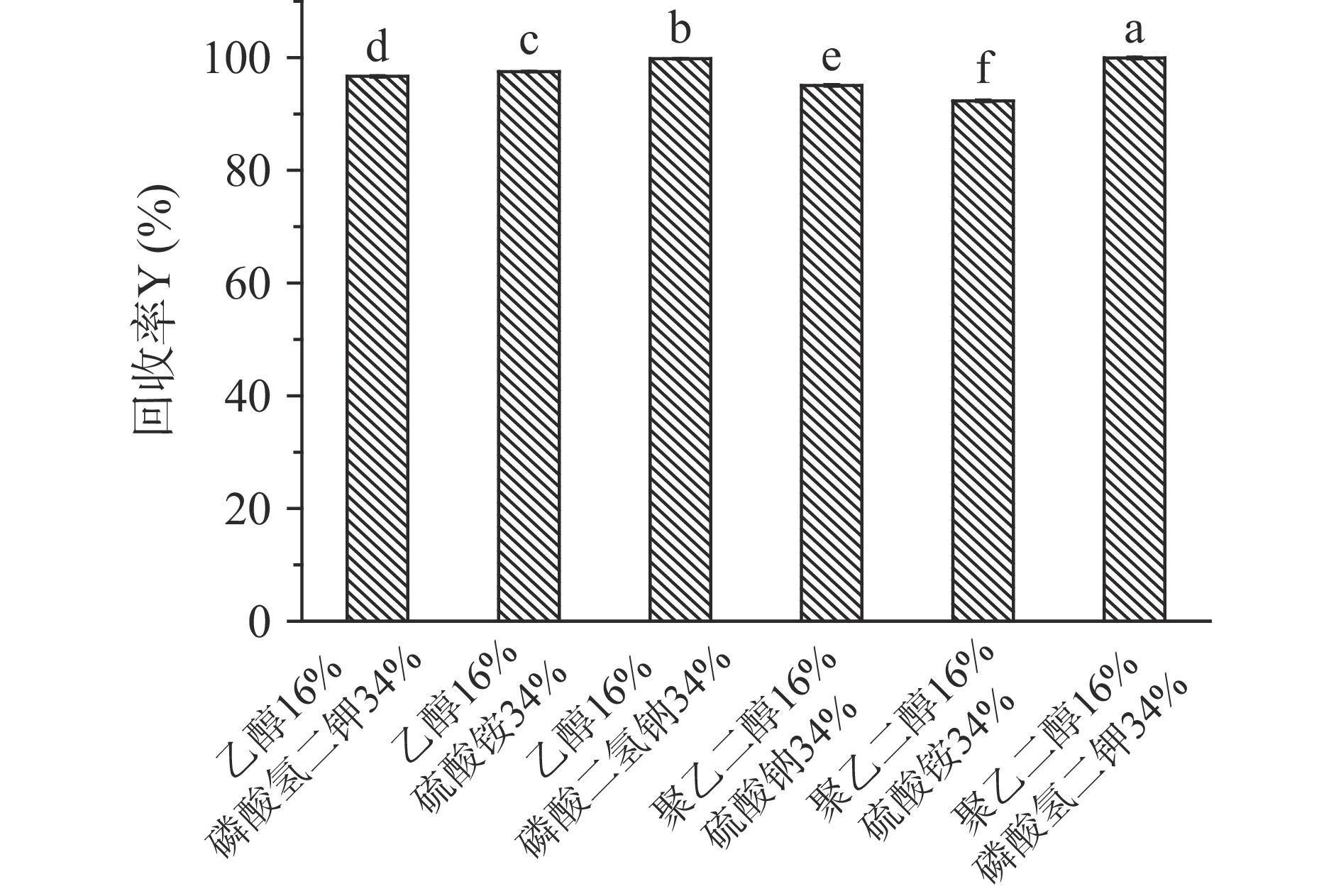
通过相图选择各体系曲线上方不同的质量浓度,考察其对肉桂挥发油的萃取效果。其中乙醇-硫酸钠、聚乙二醇-磷酸二氢钠体系均无分层现象,因此不能作为肉桂挥发油萃取介质。相比R和分配系数K是衡量目标物在体系中分离效果的重要指标[26]。R值和K值越大,表示目标物迁移到上相中的浓度越高,萃取效果越好。萃取体系中形成两种不相混溶的水相间的低界面张力使得两相之间的质量传播增强[12],从而不同水相间对于目标物的迁移速率具有一定的差异。如图2所示,相比与聚乙二醇-盐体系,乙醇-盐体系下萃取肉桂挥发油的相比和分离系数较高,尤其乙醇-磷酸二氢钠体系的萃取效果较好(P<0.05)。由图3不同双水相体系的上、下相肉桂挥发油萃取率之比可知,乙醇-磷酸二氢钠体系最适宜作为肉桂挥发油的萃取体系,其二者质量分数为16%/34%时的上相萃取率为2.71%(P<0.05)。如图4所示,乙醇-盐体系下萃取肉桂挥发油的回收率显著高于聚乙二醇-盐体系,对应乙醇-磷酸二氢钠体系的回收率高达99.79%(P<0.05)。因此,通过优化确定乙醇-磷酸二氢钠体系为实验范围内最佳双水相萃取体系,用于后续肉桂挥发油的提取制备实验。
2.2 双水相萃取肉桂挥发油的工艺优化
2.2.1 单因素实验优化结果
固液比对肉桂挥发油萃取得率的影响结果如图5a所示。随固液比增加,肉桂挥发油在体系中传质空间逐渐扩大,其萃取得率逐渐增大,在固液比1:20 g/mL时达到最高值2.94%。然而随固液比继续增加,萃取基质的比率下降,使肉桂挥发油的表面疏水性相对降低[19]而逐渐向下相迁移,向上相的传质速率相对减慢,从而使肉桂挥发油萃取得率呈下降趋势。
不同乙醇浓度对肉桂挥发油的提取能力有明显差异,结果如图5b所示。随乙醇浓度增加,挥发油萃取得率呈先升高后降低的趋势,可能由于乙醇浓度的提高导致体系的粘度相对增大而处于界面电势不稳定的流动状态[13],导致挥发油的上相迁移效果不理想而影响了萃取率。当乙醇浓度为30%时,挥发油萃取得率最高达到2.52%。随后,由于上、下相中主要物质的浓度差使得挥发油向下相分布,同时可能还提取了更多的黄酮类化合物使其萃取得率降低[16,27],从而导致萃取得率呈下降趋势。
图5c为双水相萃取体系中磷酸二氢钠浓度对肉桂挥发油萃取得率影响的结果。随着盐浓度提高,肉桂挥发油萃取得率明显提高并在盐浓度34%时最高。此后继续提高盐浓度,萃取得率呈现下降趋势,说明体系中醇和盐的浓度比例变化而导致目标物向下相部分迁移[28]。
由图5d可知,萃取时间对肉桂挥发油萃取得率的影响显著。随着萃取时间延长,挥发油萃取得率先上升后下降,当提取时间为60 min时,萃取得率达到最大值。提取时间的适当延长有助于形成双水相体系的动态平衡[18],但是过长时间的萃取可能打破体系的平衡状态,使上相中目标物质浓度过高而向下相中转移从而导致萃取得率降低。
萃取温度对肉桂挥发油萃取得率的影响结果如图5e所示。在常温25 ℃下萃取效果最差。随温度升高,加快了萃取体系中醛类、烯类等大分子及其他小分子的迁移速率,促使目标物更多地迁移到上相中。当萃取温度在35 ℃时,挥发油萃取得率达到最高。由于30~45 ℃萃取温度下萃取得率变化不大,故下述正交实验未考虑纳入萃取温度。
2.2.2 正交试验优化结果
由表2可知,双水相提取工艺因素对肉桂挥发油萃取得率影响程度:B(磷酸二氢钠浓度)>A(乙醇浓度)>D(萃取时间)>C(固液比),优化提取工艺为A1B2C1D2,即乙醇浓度为25%,磷酸二氢钠浓度为34%,固液比为1:15 g/mL;提取时间为60 min。方差分析结果显示,优化因素中双水相萃取体系组成浓度和提取时间对肉桂挥发油的萃取得率影响显著。经验证得到挥发油平均萃取得率为2.71%±0.10%,与正交试验结果基本一致。
表 2 正交试验结果及方差分析Table 2. Orthogonal experiment results and variance analysis序号 A(%) B(%) C(g/mL) D(min) 萃取得率(%) 1 25 32 1:15 30 2.09±0.03 2 25 34 1:20 60 2.50±0.09 3 25 36 1:25 90 2.08±0.01 4 30 32 1:20 90 2.12±0.05 5 30 34 1:25 30 2.79±0.01 6 30 36 1:15 60 2.12±0.09 7 35 32 1:25 60 2.02±0.07 8 35 34 1:15 90 2.35±0.04 9 35 36 1:20 30 1.68±0.06 K1 6.67 6.56 6.56 6.17 − K2 6.64 7.25 6.30 6.64 − K3 6.05 5.88 6.50 6.55 − R 0.62 1.37 0.26 0.47 − 自由度 2 2 2 2 − 方差 0.081 0.298 0.010 0.072 − F值 12.937 47.480 1.621 11.493 − 显著性 0.002 0.000 0.251 0.003 − 注:P<0.05表示影响显著;P<0.01表示影响极显著。 2.3 双水相萃取对肉桂挥发油和肉桂醛得率的影响
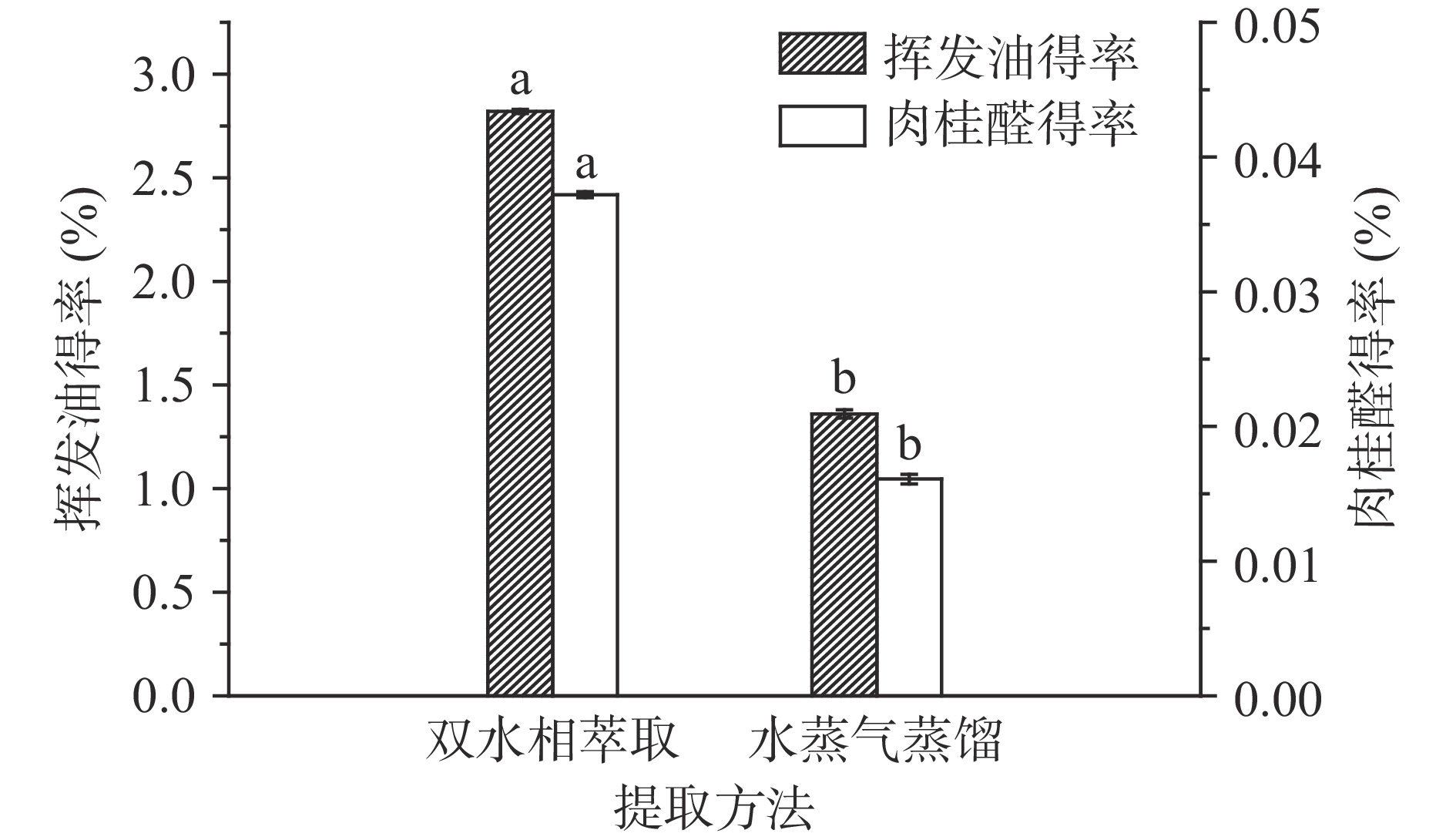
采用乙醇-磷酸二氢钠双水相体系在最佳工艺下提取肉桂挥发油和肉桂醛得率如图6所示。与传统水蒸气蒸馏法相比,采用双水相萃取肉桂挥发油和肉桂醛得率分别提高了1.07和1.31倍。其中,挥发油得率略高于Pistelli等[29]、孙凤蕊[30]文献报道采用超声辅助蒸馏提取肉桂挥发油得率(2.63%~4.64%)。基于乙醇-磷酸二氢钠体系的双水相萃取法比超声辅助方式耗能低并有效节省提取时间,且两相界面张力引起分子快速迁移的萃取环境更易分离和保留热敏性物质,因而在肉桂挥发油提取和分离上具有一定优势。
2.4 双水相萃取对肉桂挥发油风味的影响
双水相萃取与水蒸气蒸馏提取肉桂挥发油风味物质的相对含量如表3所示。采用GC-MS检测到两种提取方法获得肉桂挥发油主要风味物质分别有14和15种,以萜烯类和醛类为主。与文献报道[16,25]相比,所测得烯类含量较高,这可能与肉桂原料品种和采收批次等有关。结果表明,与水蒸气蒸馏法相比,双水相萃取得到肉桂挥发油中含有较高的(−)-α-蒎烯、衣兰烯、(+)-环苜蓿烯、杜松萜-1(10),4-二烯、α-衣兰油烯等单萜、倍半萜类物质。这可能由于这类烯萜物质是肉桂挥发油中主要的挥发性物质,易溶于醇及亲脂性溶剂,使其在乙醇-磷酸二氢钠体系中的分配系数增大而利于向上相聚集[16]。其中,双水相萃取获得肉桂挥发油中(−)-α-蒎烯的相对含量占59.93%,与传统方法相比提高了1.03倍,其用途十分广泛,主要用于制取香水、合成香料、润滑剂、增塑剂等的起始原料[31]。尽管双水相萃取肉桂中肉桂醛提取得率高于水蒸气蒸馏,但是其在挥发油中的相对含量与传统方法相比略有降低。因此,采用乙醇-磷酸二氢钠双水相体系萃取肉桂挥发油在风味组成上有利于萜烯类挥发性物质的提取。
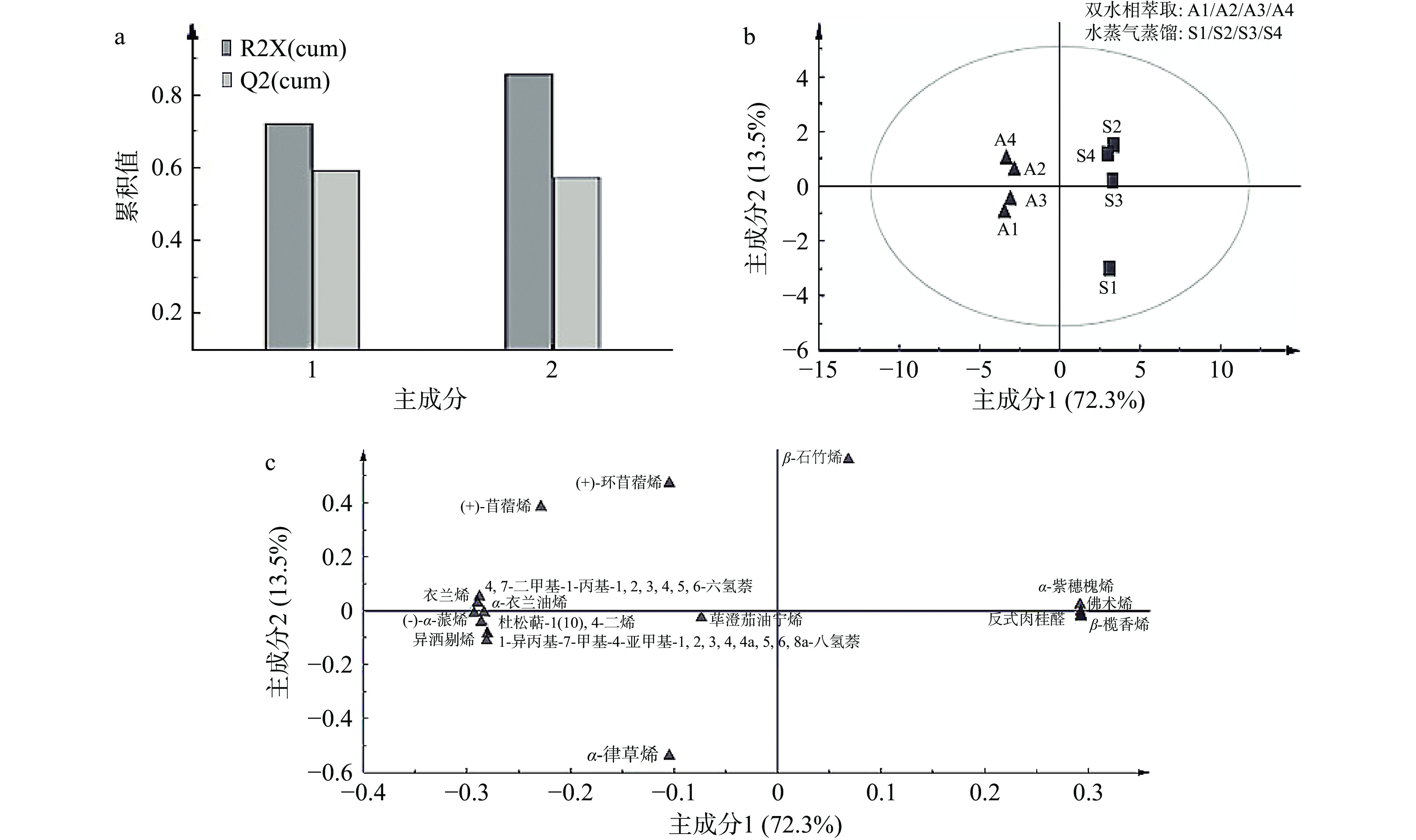
表 3 不同萃取方式肉桂挥发油风味物质相对含量Table 3. Content of flavor compounds in volatile oil of cinnamon by different extraction methods序号 保留时间(min) CAS号 化合物名称 相对含量(%) 双水相萃取 水蒸气蒸馏 1 25.05 57194-69-1 反式肉桂醛 14.92±0.02 36.65±0.01 2 27.85 22469-52-9 (+)-环苜蓿烯 2.44±0.01 2.02±0.02 3 28.02 14912-44-8 衣兰烯 1.50±0.01 0.54±0.01 4 28.32 3856-25-5 (−)-α-蒎烯 59.93±0.02 29.53±0.03 5 28.67 515-13-9 β-榄香烯 − 1.01±0.04 6 28.88 3650-28-0 (+)-苜蓿烯 2.00±0.02 1.72±0.02 7 29.33 24959-83-9 异洒剔烯 1.02±0.02 0.57±0.01 8 29.61 87-44-5 β-石竹烯 1.36±0.01 1.32±0.02 9 30.67 6753-98-6 α-律草烯 0.83±0.02 0.79±0.02 10 31.23 16729-00-3 4,7-二甲基-1-丙基-1,2,3,4,5,6-六氢萘 0.60±0.01 − 11 31.39 30021-74-0 1-异丙基-7-甲基-4-亚甲基-1,2,3,4,4a,5,6,8a-八氢萘 3.68±0.01 3.24±0.02 12 31.49 20085-19-2 α-紫穗槐烯 0.68±0.02 1.24±0.02 13 32.02 10219-75-7 佛术烯 − 0.95±0.01 14 32.18 10208-80-7 α-衣兰油烯 7.35±0.02 6.45±0.02 15 32.9 16729-01-4 杜松萜-1(10),4-二烯 10.20±0.01 8.66±0.01 16 33.14 29837-12-5 荜澄茄油宁烯 1.95±0.02 1.76±0.01 双水相萃取和水蒸气蒸馏提取肉桂挥发油风味物质的主成分分析对比结果如图7所示。主成分分析中R2X(cum)代表在当前主成分数量时解释方差的累积值,而Q2(cum)指的是随着主成分数量增加时该模型的预测能力。如图7a~图7b所示,通过主成分分析共提取到了两个主成分,共占到总物质的85.8%(R2X(cum))且Q2(cum)均大于0.5,说明该模型可以较好地分析肉桂挥发油的整体风味。如图7b所示,双水相萃取和水蒸气蒸馏样本组之间呈现明显分离,表明两种提取方法对肉桂挥发油风味物质组成有明显差异。由图7c可知,对第一主成分贡献较大的是反式肉桂醛、β-榄香烯、α-紫穗槐烯和佛术烯,具有辛辣、辛香风味[32-33]。这些物质与水蒸气蒸馏样本组呈正相关,即为水蒸气蒸馏法得到肉桂挥发油中的主要特征风味。对第二主成分贡献较大的是(+)-环苜蓿烯、(+)-苜蓿烯、β-石竹烯和4,7-二甲基-1-丙基-1,2,3,4,5,6-六氢萘,具有丁香、松脂气味[32-33]。双水相萃取法得到的肉桂挥发油中以(+)-环苜蓿烯、(−)-α-蒎烯、4,7-二甲基-1-丙基-1,2,3,4,5,6-六氢萘、衣兰烯、杜松萜-1(10),4-二烯及α-衣兰油烯等为主要特征成分。这进一步表明了双水相萃取制得肉桂挥发油与水蒸气蒸馏法相比具有多种萜烯类的风味特征。
3. 结论
通过单因素和正交实验优化得出双水相萃取肉桂挥发油最佳工艺为:乙醇质量分数25%,磷酸二氢钠质量分数34%,固液比1:15 g/mL,萃取时间60 min,萃取温度35 ℃,此条件下肉桂挥发油和肉桂醛得率为2.82%和0.037%,与常规水蒸气蒸馏法相比分别提高了1.07和1.31倍。采用GC-MS检测分析出肉桂挥发油风味物质以萜烯类和醛类为主。通过主成分分析法对双水相萃取法和水蒸气蒸馏法制得挥发油组成进行差异分析,二者主要特征成分存在显著差异,双水相萃取法制得肉桂挥发油含有更多的α-蒎烯、衣兰烯和环苜蓿烯等萜烯类成分。结果表明,双水相萃取肉桂挥发油具有条件温和、得率高、萜烯类成分丰富的优势,为肉桂挥发油的高效制取和利用提供理论支撑,但对于双水相体系的微观界面特性等相关挥发油萃取机理有待深入探究。
-
表 1 正交试验因素水平
Table 1 Factors and levels of orthogonal experiment
水平 因素 A乙醇浓度(%) B磷酸二氢钠浓度(%) C固液比(g/mL) D萃取时间(min) 1 25 32 1:15 30 2 30 34 1:20 60 3 35 36 1:25 90 表 2 正交试验结果及方差分析
Table 2 Orthogonal experiment results and variance analysis
序号 A(%) B(%) C(g/mL) D(min) 萃取得率(%) 1 25 32 1:15 30 2.09±0.03 2 25 34 1:20 60 2.50±0.09 3 25 36 1:25 90 2.08±0.01 4 30 32 1:20 90 2.12±0.05 5 30 34 1:25 30 2.79±0.01 6 30 36 1:15 60 2.12±0.09 7 35 32 1:25 60 2.02±0.07 8 35 34 1:15 90 2.35±0.04 9 35 36 1:20 30 1.68±0.06 K1 6.67 6.56 6.56 6.17 − K2 6.64 7.25 6.30 6.64 − K3 6.05 5.88 6.50 6.55 − R 0.62 1.37 0.26 0.47 − 自由度 2 2 2 2 − 方差 0.081 0.298 0.010 0.072 − F值 12.937 47.480 1.621 11.493 − 显著性 0.002 0.000 0.251 0.003 − 注:P<0.05表示影响显著;P<0.01表示影响极显著。 表 3 不同萃取方式肉桂挥发油风味物质相对含量
Table 3 Content of flavor compounds in volatile oil of cinnamon by different extraction methods
序号 保留时间(min) CAS号 化合物名称 相对含量(%) 双水相萃取 水蒸气蒸馏 1 25.05 57194-69-1 反式肉桂醛 14.92±0.02 36.65±0.01 2 27.85 22469-52-9 (+)-环苜蓿烯 2.44±0.01 2.02±0.02 3 28.02 14912-44-8 衣兰烯 1.50±0.01 0.54±0.01 4 28.32 3856-25-5 (−)-α-蒎烯 59.93±0.02 29.53±0.03 5 28.67 515-13-9 β-榄香烯 − 1.01±0.04 6 28.88 3650-28-0 (+)-苜蓿烯 2.00±0.02 1.72±0.02 7 29.33 24959-83-9 异洒剔烯 1.02±0.02 0.57±0.01 8 29.61 87-44-5 β-石竹烯 1.36±0.01 1.32±0.02 9 30.67 6753-98-6 α-律草烯 0.83±0.02 0.79±0.02 10 31.23 16729-00-3 4,7-二甲基-1-丙基-1,2,3,4,5,6-六氢萘 0.60±0.01 − 11 31.39 30021-74-0 1-异丙基-7-甲基-4-亚甲基-1,2,3,4,4a,5,6,8a-八氢萘 3.68±0.01 3.24±0.02 12 31.49 20085-19-2 α-紫穗槐烯 0.68±0.02 1.24±0.02 13 32.02 10219-75-7 佛术烯 − 0.95±0.01 14 32.18 10208-80-7 α-衣兰油烯 7.35±0.02 6.45±0.02 15 32.9 16729-01-4 杜松萜-1(10),4-二烯 10.20±0.01 8.66±0.01 16 33.14 29837-12-5 荜澄茄油宁烯 1.95±0.02 1.76±0.01 -
[1] RIBEIRO-SANTOS R, ANDRADE M, MADELLA D, et al. Revisiting an ancient spice with medicinal purposes: Cinnamon[J]. Trends in Food Science & Technology,2017,62(4):154−169.
[2] 王芳, 曹锦轩, 潘道东, 等. 肉桂精油对成团泛菌和腐生葡萄球菌的抑菌活性及其机理[J]. 食品工业科技,2016,37(19):75−80. [WANG F, CAO J X, PAN D D, et al. Bacteriostatic activity and mechanism of cinnamon essential oil against Pantoea agglomerans and Staphylococcus saprophyticus[J]. Science and Technology of Food Industry,2016,37(19):75−80. WANG F, CAO J X, PAN D D, et al. Bacteriostatic activity and mechanism of cinnamon essential oil against Pantoea agglomerans and Staphylococcus saprophyticus[J]. Science and Technology of Food Industry, 2016, 37(19): 75-80.
[3] SHREAZ S, WANI W A, BEHBEHANI J M, et al. Cinnamaldehyde and its derivatives, a novel class of antifungal agents[J]. Fitoterapia,2016,112:116−131. doi: 10.1016/j.fitote.2016.05.016
[4] ZHOU Y, WU X H, CHEN J H, et al. Effects of cinnamon essential oil on the physical, mechanical, structural and thermal properties of cassava starch-based edible films[J]. International Journal of Biological Macromolecules,2021,184(6):574−583.
[5] WANG R, WANG R, YANG B. Extraction of essential oils from five cinnamon leaves and identification of their volatile compound compositions[J]. Innovative Food Science & Emerging Technologies,2009,10(2):289−292.
[6] MODI P I, PARIKH J K, DESAI M A. Sonohydrodistillation: Innovative approach for isolation of essential oil from the bark of cinnamon[J]. Industrial Crops and Products,2019,142(16):111838−111845.
[7] 程强. 基于新型溶剂的微波辅助技术在植物精油提取上的应用研究[D]. 杭州: 浙江工业大学, 2017. CHENG Q. Application of microwave assisted technology in extraction of plant essential oil based on novel solvents[D]. Hangzhou: Zhejing University of Technology, 2017.
[8] GYŐRI E, VARGA A, FÁBIÁN I, et al. Supercritical CO2 extraction and selective adsorption of aroma materials of selected spice plants in functionalized silica aerogels[J]. The Journal of Supercritical Fluids,2019,148(2):16−23.
[9] ANTICONA M, BLESA J, FRIGOLA A, et al. High biological value compounds extraction from citrus waste with non-conventional methods[J]. Foods,2020,9(6):811−835. doi: 10.3390/foods9060811
[10] 彭颖. 肉桂精油的提取及其微胶囊化的研究[D]. 天津: 天津商业大学, 2012. PENG Y. Study on extraction and microencapsulation of cinnamon essential oil[D]. Tianjin: Tianjin University of Commerce, 2012.
[11] XIONG K, CHEN Y, SHEN S. Experimental optimization and mathematical modeling of supercritical carbon dioxide extraction of essential oil from Pogostemon cablin[J]. Chinese Journal of Chemical Engineering,2019,27(10):2407−2417. doi: 10.1016/j.cjche.2019.03.004
[12] PEREIRA J F B, FREIRE M G, COUTINHO J A P. Aqueous two-phase systems: Towards novel and more disruptive applications[J]. Fluid Phase Equilibria,2020,505(1):112341−112353.
[13] GHARAT N N, RATHOD V K. Response surface methodology for the extraction of wedelolactone from Eclipta alba using aqueous two-phase extraction[J]. Prep Biochem Biotechnol,2020,50(8):827−833. doi: 10.1080/10826068.2020.1753071
[14] YANG S X, LIU B, TANG M, et al. Extraction of flavonoids from Cyclocarya paliurus (Juglandaceae) leaves using ethanol/salt aqueous two-phase system coupled with ultrasonic[J]. Journal of Food Processing and Preservation,2020,44(6):e14469.
[15] CHONG K Y, STEFANOVA R, ZHANG J, et al. Aqueous two-phase extraction of bioactive compounds from haskap leaves (Lonicera caerulea): Comparison of salt/ethanol and sugar/propanol systems[J]. Separation and Purification Technology,2020,252(12):117399−117411.
[16] 高晓燕. 几种天然产物的双水相体系萃取研究[D]. 徐州: 中国矿业大学, 2019. GAO X Y. Study on extraction of several natural products by aqueous two-phase system[D]. Xuzhou: China University of Mining, 2019.
[17] 王全泽. 罗汉松枝叶挥发油提取工艺、成分分析及提取残渣的利用[D]. 吉首: 吉首大学, 2018. WANG Q Z. Extraction technology, composition analysis and residue utilization of the volatile oil from arhat pine[D]. Jishou: Jishou University, 2018.
[18] HAN X, LI W, MA X, et al. Enzymatic hydrolysis and extraction of ginsenoside recovered from deep eutectic solvent-salt aqueous two-phase system[J]. Journal of Bioscience and Bioengneering,2020,130(4):390−396. doi: 10.1016/j.jbiosc.2020.05.008
[19] TAN T W, HUO Q, LING Q. Purification of glycyrrhizin from Glycyrrhiza uralensis Fisch with ethanol/phosphate aqueous two phase system[J]. Biotechnology Letters,2002,24(17):1417−1420. doi: 10.1023/A:1019850531640
[20] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical and Technology Press, 2020.
[21] LEE H G, JO Y, AMEER K, et al. Optimization of green extraction methods for cinnamic acid and cinnamaldehyde from cinnamon (Cinnamomum cassia ) by response surface methodology[J]. Food Science and Biotechnology,2018,27(6):1607−1617. doi: 10.1007/s10068-018-0441-y
[22] LÓPEZ P, HUERGA M A, BATLLE R, et al. Use of solid phase microextraction in diffusive sampling of the atmosphere generated by different essential oils[J]. Analytica Chimica Acta,2006,559(1):97−104. doi: 10.1016/j.aca.2005.11.056
[23] 熊梅, 张正方, 唐军, 等. HS-SPME-GC-MS法分析肉桂子挥发性化学成分[J]. 中国调味品,2013,38(1):88−91. [XIONG M, ZHANG Z F, TANG J, et al. Analysis of volatile chemical constituents in Fructus Cinnamomi by HS-SPME-GC-MS method[J]. China Condiment,2013,38(1):88−91. doi: 10.3969/j.issn.1000-9973.2013.01.025 XIONG M, ZHANG Z F, TANG J, et al. Analysis of volatile chemical constituents in Fructus Cinnamomi by HS-SPME-GC-MS method[J]. China Condiment, 2013, 38(1): 88-91. doi: 10.3969/j.issn.1000-9973.2013.01.025
[24] CHEN Z F, HE B, ZHOU J, et al. Chemical compositions and antibacterial activities of essential oils extracted from Alpinia guilinensis against selected foodborne pathogens[J]. Industrial Crops and Products,2016,83:607−613. doi: 10.1016/j.indcrop.2015.12.063
[25] UQUICHE E, HUERTA E, SANDOVAL A, et al. Effect of boldo (Peumus boldus M.) pretreatment on kinetics of supercritical CO2 extraction of essential oil[J]. Journal of Food Engineering,2012,109(2):230−237. doi: 10.1016/j.jfoodeng.2011.10.013
[26] 侯宝娟. 荷叶黄酮新型双水相萃取耦合技术及其微囊化与应用研究[D]. 济南: 齐鲁工业大学, 2017. HOU B J. Study on aqueous two-phase extraction coupling technique of flavonoids of lotus leaf and its microencapsulation and applicaton[D]. Jinan: Qilu University of Technology, 2017.
[27] 邵圣娟, 卫静莉. 聚乙二醇-硫酸铵双水相体系萃取松花粉中总黄酮的工艺研究[J]. 食品工业科技,2017,38(11):266−269,275. [SHAO S J, WEI J L. Study on the extraction of total flavonoids from Pine Pollen in PEG400-(NH4)2SO4 aqueous two-phase system[J]. Science and Technology of Food Industry,2017,38(11):266−269,275. SHAO S J, WEI J L. Study on the extraction of total flavonoids from Pine Pollen in PEG400-(NH4)2SO4 aqueous two-phase system[J]. Science and Technology of Food Industry, 2017, 38(11): 266-269, 275.
[28] 范晓伟, 冉露, 郭箐, 等. 离子液体结合超声辅助和双水相萃取提取分离柑橘果皮中黄酮类化合物[J]. 食品科学,2020,41(10):265−271. [FAN X W, RAN L, GUO J, et al. Extraction and separation of flavonoids from citrus peel by successive ultrasound assisted with ionic liquids and aqueous two-phase extraction[J]. Food Science,2020,41(10):265−271. doi: 10.7506/spkx1002-6630-20190403-048 FAN X W, RAN L, GUO J, et al. Extraction and separation of flavonoids from citrus peel by successive ultrasound assisted with ionic liquids and aqueous two-phase extraction[J]. Food Science, 2020, 41(10): 265-271. doi: 10.7506/spkx1002-6630-20190403-048
[29] PISTELLI L, GIOVANELLI S, MARGARI P, et al. Considerable effect of dimethylimidazolium dimethylphosphate in cinnamon essential oil extraction by hydrodistillation[J]. RSC Advances,2016,6(57):52421−52426. doi: 10.1039/C6RA11487C
[30] 孙凤蕊. 肉桂油提取工艺的研究及优化[D]. 青岛: 青岛科技大学, 2019. SUN F R. Study and optimization of extraction of cinnamon oil[D]. Qingdao: Qingdao University of Science and Technology, 2019.
[31] RAO P V, GAN S H. Cinnamon: A multifaceted medicinal plant[J]. Evidence-Based Complementary and Alternative Medicine,2014,2014(1):642942−642954.
[32] KALLEL I, HADRICH B, GARGOURI B, et al. Optimization of cinnamon (Cinnamomum zeylanicum Blume) essential oil extraction: Evaluation of antioxidant and antiproliferative effects[J]. Evidence-Based Complementary and Alternative Medicine,2019,2019(1):6498347−6498358.
[33] 余拓. 肉桂精油的提取、副产物利用及工程化设计[D]. 广州: 华南理工大学, 2019. YU T. Extraction, comprehensive utilization engneering design of cinnamon essential oil[D]. Guangzhou: South China University of Technology, 2019.
-
期刊类型引用(5)
1. 潘冠均,段淋渊,赵嘉科,帅平,戴国礼,田维素,王金源,黄佳鹏,闭晓彤,林恩照,秦垦,郝志龙,张波. 摊放程度对枸杞芽叶茶风味品质的影响. 食品工业科技. 2025(04): 117-126 .  本站查看
本站查看
2. 吴宗杰,欧晓西,林宏政,余欣茹,程守悦,吴晴阳,李鑫磊,孙云. 武夷肉桂加工中挥发性成分糖苷结合物和香气品质形成研究. 茶叶科学. 2024(01): 84-100 .  百度学术
百度学术
3. 潘冠均,封娇,段淋渊,张炫鹂,戴国礼,帅平,秦垦,郝志龙,张波. 不同单株枸杞芽叶茶风味品质分析. 食品工业科技. 2024(15): 264-273 .  本站查看
本站查看
4. 徐晓俞,李程勋,李爱萍,郑开斌,潘键,侯明香. 肉桂茶纯露挥发性成分分析. 福建农业科技. 2024(06): 49-55 .  百度学术
百度学术
5. 占鑫怡,杨云,陈彬,黄慧清,赵梦莹,李鑫磊,孙云. 不同摇青程度春闺闽北乌龙茶品质差异分析. 食品工业科技. 2023(11): 271-279 .  本站查看
本站查看
其他类型引用(2)












 下载:
下载:


 下载:
下载:



