Dynamic Changes of Physicochemical Properties and Fungal Community Structure during Solid-state Fermentation of Sichuan Sun Vinegar
-
摘要: 为了探究四川晒醋发酵过程中真菌群落的演替及关键理化因子的变化规律,本文利用国标法和高通量测序技术对醋醅的理化指标和真菌群落进行了解析,同时结合真菌群落和理化因子进行冗余分析,找出影响真菌群落变化的关键理化因子。结果表明,随着发酵的进行,醋醅的pH降低,水分、温度基本保持稳定,总酸、氨态氮含量先持续增加后保持稳定,还原糖含量先增加后减少。通过高通量测序结果表明,四川晒醋固态发酵过程中共有9个门、299个属水平的真菌参与演替变化。毕赤酵母属(Pichia)和横梗霉属(Lichtheimia)为主要优势真菌。经过聚类分析,可将固态发酵过程分为3个阶段(第1发酵阶段,第1~8 d;第2发酵阶段,第9~12 d;第3发酵阶段,第14~16 d)。由冗余分析结果可知,氨态氮、总酸是影响真菌群落结构的主要因素,氨态氮、总酸与发酵第1~8 d的真菌群落呈负相关,与发酵第9~16 d的真菌群落呈正相关。该研究揭示了晒醋固态发酵过程中的真菌群落的多样性和演替规律及其影响因素,为掌握固态发酵过程中真菌的变化规律以及后续与风味物质的关联奠定基础。Abstract: In order to explore the succession of fungal community and key physicochemical properties in the fermentation process of Sichuan sun vinegar, the physicochemical properties and fungal communities of vinegar fermented grains were analyzed by national standard method and high-throughput sequencing technology. At the same time, the redundancy analysis was carried out combined with fungal community and physicochemical properties to find out the key physicochemical properties affecting the change of fungal community. The results showed that with the fermentation, the pH of vinegar fermented grains decreased, the moisture and temperature remained stable, the total acid and ammonia nitrogen content increased first and then remained stable, and the reducing sugar content increased first and then decreased. The results of high-throughput sequencing showed that there were 9 phyla and 299 genera involved in the succession of fungi during the solid-state fermentation of Sichuan sun vinegar. Pichia and Lichtheimia were the dominant fungi. Through cluster analysis, the solid-state fermentation process could be divided into three stages (the first fermentation stage, days 1~8, the second fermentation stage, days 9~12, the third fermentation stage, days 14~16). The results of redundancy analysis showed that ammonia nitrogen and total acid were the main factors affecting the fungal community. Ammonia nitrogen and total acid were negatively correlated with fermentation days 1~8, and positively correlated with the fungal community at days 9~16 of fermentation. This study revealed the diversity, succession and influencing factors of fungal communities in the solid-state fermentation process of sun vinegar, which laid the foundation for mastering the variation law of fungi in the solid-state fermentation process and the subsequent association with flavor substances.
-
四川晒醋是麸醋的一类,多产于川南地区。四川晒醋是以麸皮为主料,辅以多种中草药制曲为发酵剂,经过固态发酵、晒醅、晒醋液、灭菌等多道工序酿造而成的具有色泽棕褐、醇香回甜、酸味柔和、浓稠等独特风格的食醋[1-2]。晒醋采用传统的生料固态发酵工艺,发酵过程中糖化、酒化、醋化在一个发酵池内同时进行(即三边同池发酵),多种微生物交相演替,共同构成晒醋的独特风味。因此,研究晒醋发酵过程中的微生物群落,对于晒醋风味形成、工艺改进、产品开发等具有重要意义。
随着二代测序技术的发展,高通量测序技术因其通量高、速度快、准确度高、无需建库、简便高效等特点[3-4]广泛应用于食醋发酵过程的微生物群落研究中,王宗敏[5]利用高通量测序技术对镇江香醋的微生物群落进行研究,发现乳杆菌、醋酸杆菌、曲霉属、链格孢霉属在醋酸发酵过程占优势地位;刘廷锐[6]的研究表明:四川麸醋中的优势细菌也是乳杆菌属、醋杆菌属,并结合理化因子进行CCA分析发现酒度、酸度与发酵过程具有一定相关性。ZHU等[7]利用高通量测序技术对山西老陈醋醋酸发酵过程的细菌群落的演替进行分析,发现发酵第0 d至第4 d以泛菌属(Pantoea)、片球菌属(Pediococcus)、乳球菌属(Lactococcus)、根瘤菌属(Rhizobium)为主,发酵第5~21 d以乳杆菌属(Lactobacillus)为主,发酵第22~26 d以醋酸菌属(Acetobacter)、Komagataeibacter 和 Kroppenstedtia 为主。崔宁波[8]利用高通量测序技术发现生料酿醋发酵过程中以酿酒酵母和黑曲霉为优势真菌。目前,对于四川晒醋的细菌群落已有研究[9],而对于四川晒醋的真菌群落研究较少。从以往研究来看,真菌是食醋发酵过程中一类重要的微生物,包括酵母菌、曲霉、青霉等,在发酵过程中不仅起着糖化、液化等作用,还与食醋风味、品质等紧密相关。比如:酵母菌不仅能产生醇类、酯类等挥发性风味物质,还能产生四甲基吡嗪的前体物质—乙偶姻[10]。王宗敏[5]通过O2PLS相关性分析发现镇江香醋醋酸发酵过程中真菌与一部分氨基酸和风味物质相关;浙江玫瑰醋发酵过程中红曲霉属、假丝酵母属对醇类、醛类、酯类等风味物质有重要作用[11]。可见真菌在食醋发酵过程中起重要作用。
本文采用ITS高通量测序研究了四川晒醋在固态发酵过程中的真菌群落变化规律,并探究了理化因子的变化规律及不同发酵阶段的差异微生物。通过冗余分析探究真菌群落动态演替与理化因子的关系,掌握真菌变化与代谢产物以及产品质量之间的关联,为晒醋的人工调控提供理论依据。
1. 材料与方法
1.1 材料及仪器
样品 采集于四川某晒醋厂。从翻醅车间的固态发酵过程取样,从发酵第1 d开始每天定时取样,样品包括第1 d (F1)、第2 d (F2)、第3 d (F3)、第4 d (F4)、第5 d (F5)、第6 d (F6)、第7 d (F7)、第8 d (F8)、第9 d (F9)、第10 d (F10)、第11 d (F11)、第12 d (F12)、第13 d (F13)、第14 d (F14)、第15 d (F15)和第16 d (F16)的醋醅,共计16个样品。固定10个取样点,从醋醅表面向下10~30 cm处取样,将样品混合均匀,保存于−20 ℃冰箱中,采集结束后,运送回实验室,保存于−70 ℃冰箱中,待检测;土壤DNA提取试剂盒(Omega E.Z.N.A.® Soil DNA Kit) OMEGA;Agarose、TAE Invitrogen ;Marker Takara;甲醛溶液、3,5-二硝基水杨酸、苯酚、亚硫酸钠、酒石酸钾钠、氢氧化钠、甲醛溶液、3,5-二硝基水杨酸、苯酚 均为分析纯,天津市致远化学试剂有限公司;亚硫酸钠、四水酒石酸钾钠 均为分析纯,成都科隆化学品有限公司。
AT-710 pH计 京都电子KEM;MB25水分测定仪 OHAUS;T6分光光度计 新世纪,普析通用;NC2000 Nanodrop Thermo Scientific;DYY-6C电泳仪 北京六一;BG-gdsAUTO(130) 凝胶成像系统 北京百晶;Illumina MiSeq 测序平台 美国 Illumina 公司。
1.2 实验方法
1.2.1 理化因子检测方法
1.2.1.1 pH的测定
取10 g醋醅,加入90 mL去离子水,搅拌均匀,浸泡30 min后,过滤,使用pH计测定滤液的pH。
1.2.1.2 温度的测定
使用温度计插入醋醅表层以下10 cm处,测定温度。
1.2.1.3 总酸的测定
称取10 g醋醅,用100 mL容量瓶定容,浸泡3 h,过滤醋醅,取20 mL的滤液,参照GB 12456-2021 《食品安全国家标准 食品中总酸的测定》中pH计电位滴定法测定总酸含量。
1.2.1.4 氨基态氮的测定
参照GB 5009.235-2016 《食品中氨基酸态氮的测定》中酸度计法测定醋醅的氨基态氮含量。
1.2.1.5 水分的测定
取2 g左右的醋醅放入水分测定仪中测定醋醅的水分含量。
1.2.1.6 还原糖的测定
称量5 g 样品,加蒸馏水50 mL,45 ℃水浴2 h,冷却后定容于100 mL容量瓶中,过滤后取滤液,用DNS法[12]测定还原糖含量。
1.2.2 醋醅微生物基因组DNA的提取及高通量测序
醋醅总DNA采用土壤DNA提取试剂盒提取,1%琼脂糖凝胶电泳检测后,用NanoDrop 2000 测定DNA纯度和含量。通过PCR扩增真菌ITS1(a)序列,引物为ITS5F(5’-GGAAGTAAAAGTCGTAACAAGG-3’)、ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’),PCR产物经电泳、回收、定量后进行Illumina MiSeq 测序,测序公司为上海派森诺生物医药科技有限公司(上海,中国)。
1.2.3 高通量测序分析
主要使用QIIME2软件对测序数据进行分析。按照QIIME2 dada2分析流程进行序列去引物,质量过滤,去噪(denoise),拼接和去嵌合体等步骤,以100%相似度聚类划分为ASV,并利用Unite数据库(Release 8.0,https://unite.ut.ee/)对ASV进行分类注释,删除不能注释到门水平的序列,同时结合NCBI数据库进行比对注释,并计算香农指数(Shannon Index)、Simpson指数、Chao 1指数及文库覆盖率(Coverage),计算Bray-Curtis相异性指数,并对不同样本进行聚类分析。
1.3 数据处理
采用Excel软件处理数据,采用Origin2018软件绘制折线图、柱状图,并进行真菌样本的聚类分析,采用SPSS2018软件进行斯皮尔曼(Spearman)相关性分析。采用派森诺云平台(https://www.genescloud.cn/login)进行主成分分析(PCA)、Lefse分析(Linear discriminant analysis Effect Size,线性判别分析),利用Canon5.0进行冗余分析。
2. 结果与分析
2.1 四川晒醋发酵过程中理化因子结果分析
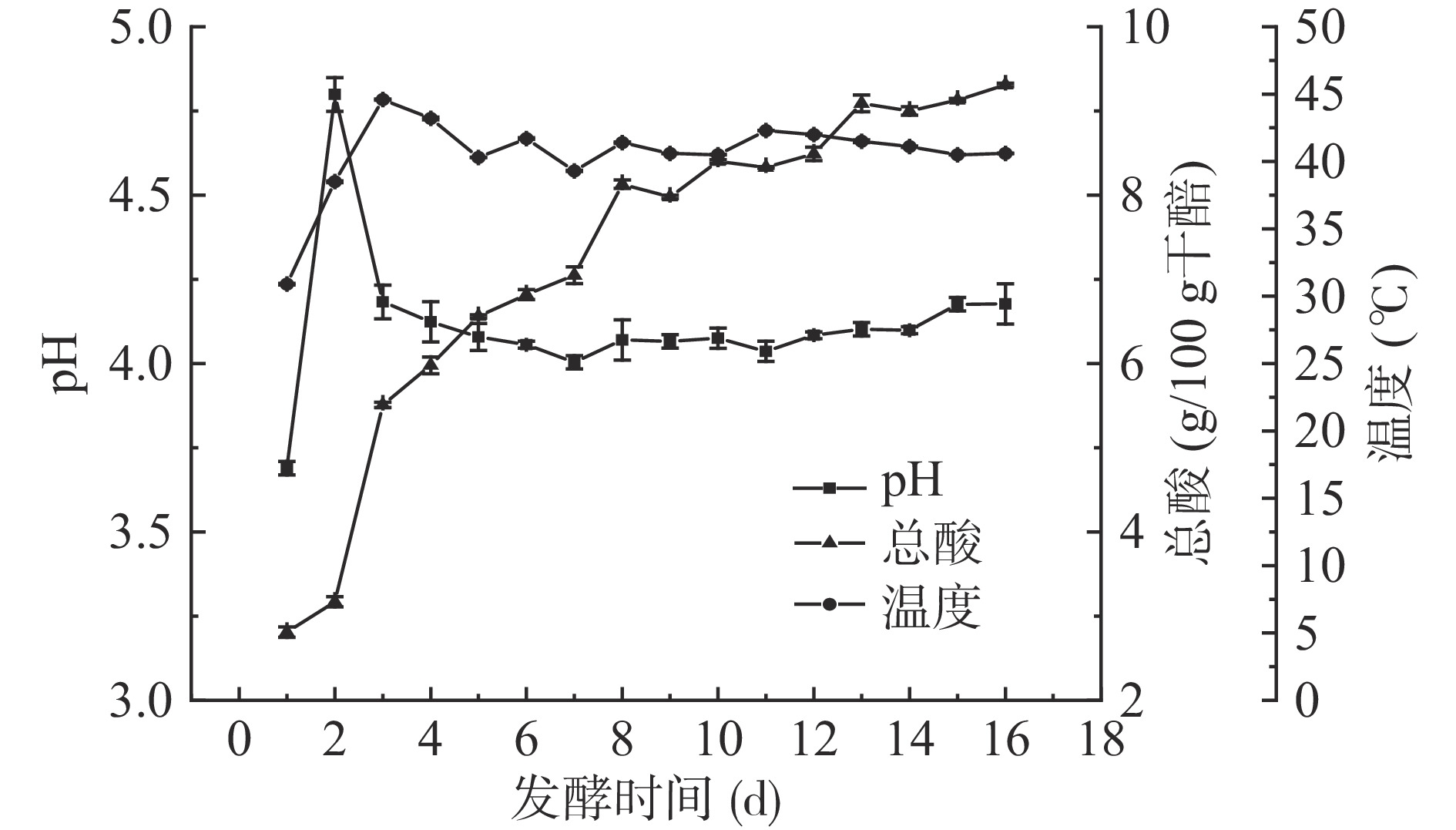
四川晒醋在固态发酵过程中的理化因子变化规律见图1与图2,在晒醋固态发酵过程中,pH呈先增加后降低再保持稳定的变化趋势,其pH先增加的原因是第1 d将醋母液倒入装有麸皮的发酵池后,等待醋母液自然下沉,导致局部pH较低(注:取样采用多点取样,由于发酵池较大,较深(发酵池规格:20 m×1.4 m×1 m),倒入醋母液后,发酵第1 d醋母液自然下沉,分布不均匀,所以第1 d的pH较低),第2 d翻醅后,醋母液与麸皮翻拌均匀使pH上升,随着发酵的进行,pH逐渐降低,第8 d之后,pH基本保持在4.2左右。总酸的含量是检验醋醅是否成熟的一个重要指标[13],随着发酵的进行,总酸的含量先增加后保持稳定。温度是固态发酵中的重要因素,温度过高,不利于低温微生物生长;温度过低,微生物生长缓慢,生产效率低。在发酵过程中,第2~3 d温度迅速上升,同时pH迅速降低,总酸含量迅速上升,说明微生物迅速生长,使醋醅温度升高,由于每天的翻醅操作,发酵后期的醋醅温度维持在40 ℃左右。
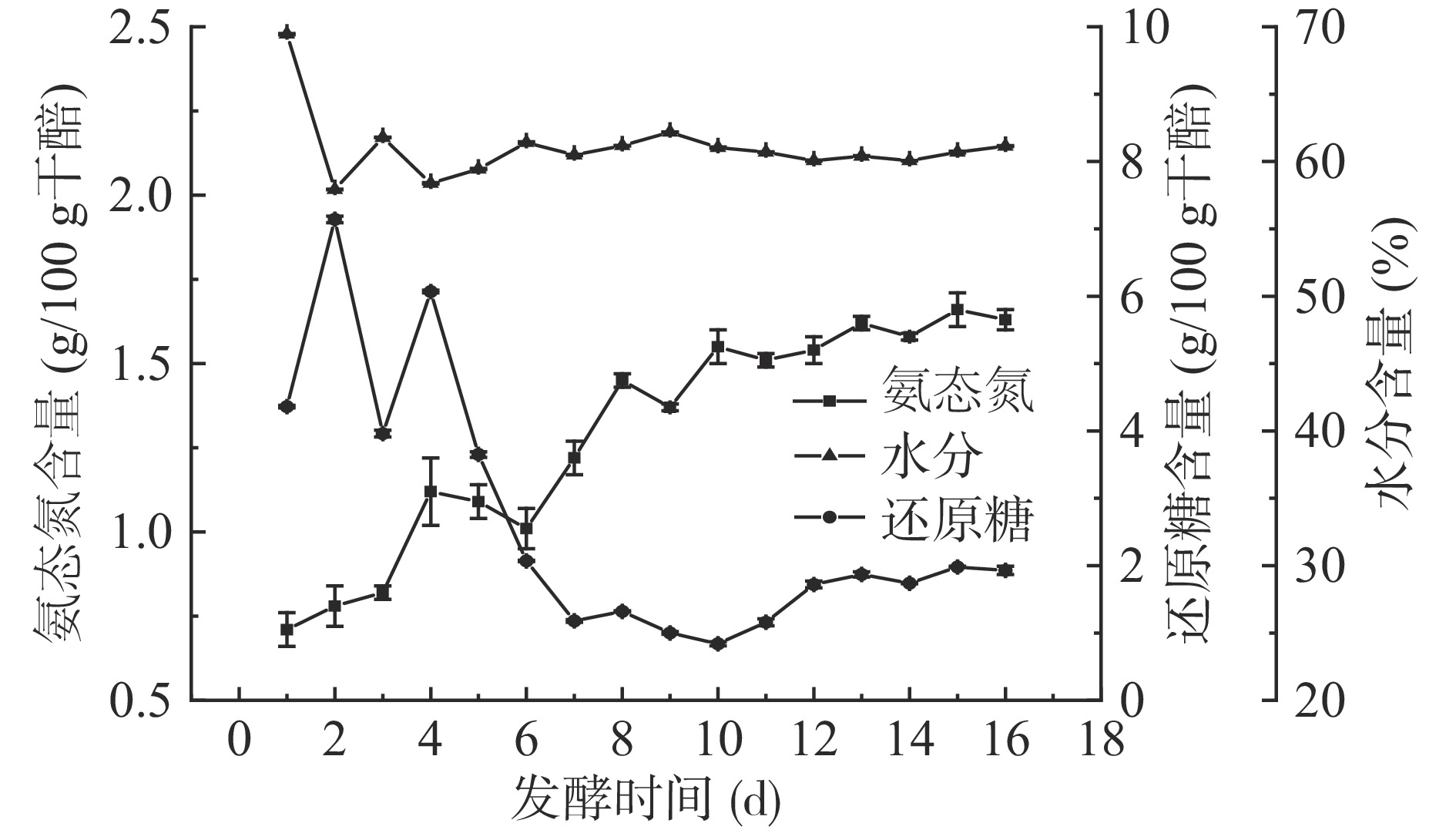
如图2所示,经翻醅操作后,醋醅中麸皮与醋母液混合均匀,醋醅的水分含量基本保持在60%左右。还原糖含量呈先增加后减少的趋势,说明发酵前期的霉菌等微生物分解淀粉、糊精等大分子物质,产生了大量的还原糖,在发酵后期,还原糖被微生物利用,其含量逐渐降低。氨态氮含量随着发酵时间的延长,呈逐渐上升的趋势,发酵第1~10 d增加迅速,发酵第11~16 d增加缓慢。在发酵前期,氨态氮含量增长较快,可能与产蛋白酶的微生物生长活跃有关;发酵后期,微生物数量减少,酶活下降以及各种氨基酸参与风味物质的合成,使氨基态氮含量增长缓慢。
2.2 样品的测序结果
醋醅中真菌群落测序深度>10000条序列,16个样本共获得62101条序列,因为ITS区域在不同物种间的变异度较大,测序所得reads长度位于120~400 bp。序列经过过滤和质量控制后,每个醋醅样本可用的测序序列均在10000条以上均达到要求的测序深度。为得到醋醅样本测序结果中的菌群结构和多样性等信息,本文采用100%相似度水平对优化过的ITS1序列进行归类,发现醋醅中的真菌群落可以划分为1271个扩增子序列变异(ASVs, amplicon sequence variants)。
2.3 样品间α多样性分析
由表1可知,各醋醅样本序列覆盖率均在0.9999左右,表明样本覆盖率高,测序深度合适;Chao1指数可以表示群落的丰富度,其值在15.90~485.26之间波动,说明真菌群落物种较丰富;Shannon指数和Simpson指数值越大,说明群落物种多样性越高;Shannon指数/Simpson指数值越高,表明群落的多样性越高。Shannon指数/Simpson指数在2.93~6.38之间变化,说明醋醅的真菌群落不断发生变化。在发酵第1 d至发酵第12 d,真菌多样性变化较小;发酵第13 d,其真菌多样性最高,说明第13 d的真菌种类丰富,随后,发酵第14 d至发酵16 d多样性略有降低。
表 1 每个醋醅样本的真菌群落测序情况及α多样性统计Table 1. Statistics of fungal community sequencing and α diversity in each cupei sample样品
名称序列数
(条)扩增子序列
变异(ASVs)Chao1
指数Shannon
指数Simpson
指数Shannon指数/
Simpson指数覆盖率 F1 62101 16 15.90 0.50 0.15 3.32 0.9999 F2 63152 24 23.65 1.28 0.37 3.49 0.9998 F3 75687 24 24.78 2.09 0.71 2.93 0.9998 F4 65658 35 35.72 1.67 0.50 3.36 0.9999 F5 73841 89 91.63 1.71 0.41 4.16 0.9996 F6 70722 40 42.93 1.91 0.59 3.26 0.9997 F7 63446 38 37.89 1.70 0.46 3.68 0.9998 F8 63979 58 60.26 1.95 0.53 3.71 0.9996 F9 63465 57 58.36 3.09 0.81 3.80 0.9998 F10 65146 71 72.86 3.15 0.82 3.86 0.9998 F11 64585 58 59.31 3.10 0.84 3.68 0.9998 F12 135298 72 79.13 2.82 0.78 3.61 0.9993 F13 76064 479 485.26 5.72 0.90 6.38 0.9988 F14 68013 93 92.79 3.54 0.84 4.19 0.9999 F15 75476 58 59.83 3.68 0.86 4.25 0.9998 F16 73403 59 60.13 4.27 0.90 4.74 0.9999 2.4 四川晒醋醋醅的门水平的真菌群落分析
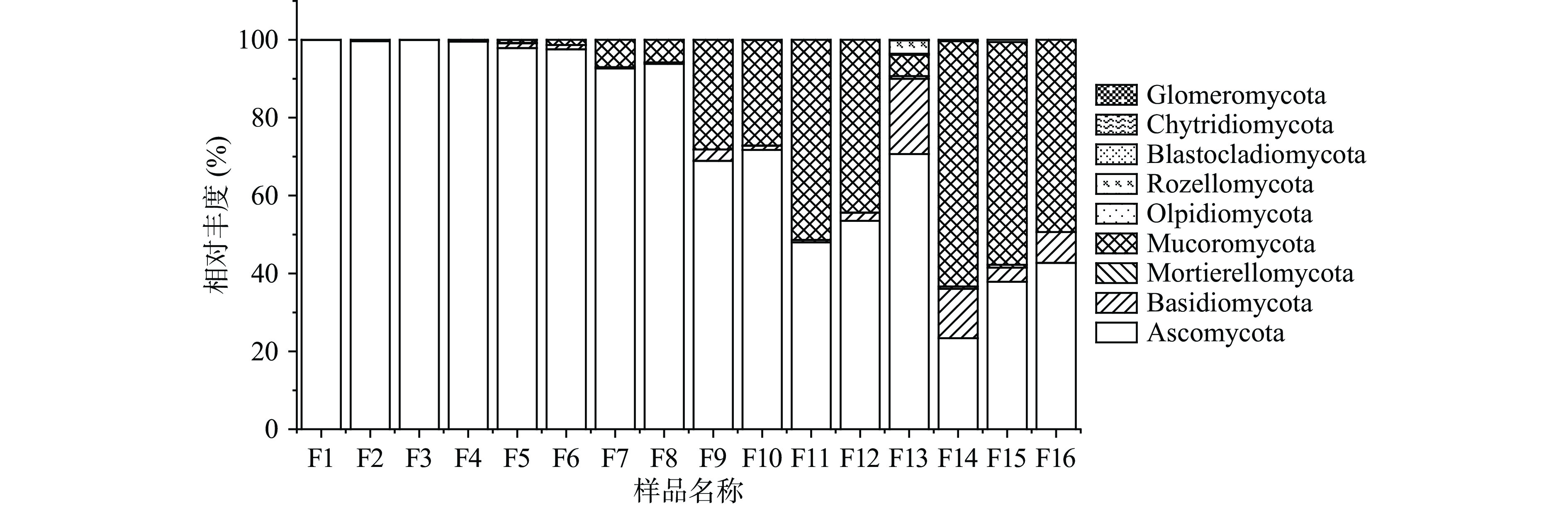
经过与Unite数据库比对分析,从图3中可以发现在分类学上,翻醅车间的醋醅中的真菌菌群归属于9个门,在固态发酵过程第1~8 d,子囊菌门(Ascomycota)占主导地位,发酵第9~16 d,毛霉门(Mucoromycota)丰度增加,与子囊菌门(Ascomycota)共同作为优势门。子囊菌门(Ascomycota)的相对丰度在发酵过程中整体呈下降趋势,发酵第1~8 d其相对丰度由99.9%下降至93.8%,发酵第9 d其相对丰度迅速下降至68.9%,发酵9~16 d其相对丰度在68.9%~23.4%范围内波动变化。毛霉门(Mucoromycota)在发酵1~8 d相对丰度很低(小于10%),发酵至9 d其相对丰度增加至28.1%,随后呈增加趋势,其相对丰度保持在50%左右。担子菌门(Basidiomycota)在发酵第1~12 d相对丰度较低,小于2%,在发酵第13、14 d其相对丰度最高达12%~19%,发酵第15~16 d降低至2%~7%。被孢霉门(Mortierellomycota)的相对丰度较低,保持在0%~0.6%左右;其余门类含量低(<0.1%)。
2.5 四川晒醋醋醅的属水平的真菌群落分析
经过与Unite 数据库比对分析,醋醅样品的真菌群落共299个属。将样品中相对丰度位于前25位的菌群绘制成微生物群落分布柱形图。从图4可以看出,毕赤酵母属(Pichia)和横梗霉属(Lichtheimia)的两个属的微生物在固态发酵过程中相对丰度较大。毕赤酵母属(Pichia)归属于子囊菌门酵母目,在整个发酵过程中,发酵第1~8 d相对丰度保持在90%以上;发酵第9~16 d,其相对丰度呈波动趋势下降,在18%~66%范围内波动。毕赤酵母属(Pichia)可能是由于酸性环境的压力使相对丰度逐渐降低。横梗霉属(Lichtheimia)归属于毛霉门,在发酵前3 d相对丰度低,从第4 d到第8 d其相对丰度逐渐增加至7%左右,第9~12 d,其相对丰度保持在27%~50%范围内,第13 d降低至5%,后期又保持在48%~62%范围内。说明横梗霉属(Lichtheimia)在发酵过程中,生长较缓慢,翻醅操作使好氧的霉菌丰度呈波动变化。
毕赤酵母属在种水平上主要检测到了克鲁维毕赤酵母(Pichia kluyveri)、毛榛毕赤酵母(Pichia mandshurica)、膜醭毕赤酵母(Pichia membranifaciens)和挪威毕赤酵母(Pichia norvegensis),其中,克鲁维毕赤酵母具有产酒精、产酯、耐酸(pH2~4)、耐高温(44 ℃)等优点[14],毕赤酵母多存在于酒曲和醋曲中[15-16],在醋醅中比较少见。有研究表明横梗霉菌具有产α-淀粉酶[17]、葡聚糖酶[18]、木聚糖酶[19]、纤维素酶[20]、蛋白酶[21]和糖化酶的能力。横梗霉菌能产生各种风味物质,如乙酸、乙醇、苯乙醇和乙酸乙酯等[22]。横梗霉菌属在醋醅中也比较少见,常存在于大曲中[23-24]。酿酒酵母相对丰度很低,可能是因为发酵过程中温度高于酿酒酵母的耐受温度。四川麸醋中的主要真菌是酿酒酵母、覆膜孢酵母、伊萨酵母、黑曲霉等,镇江香醋的主要真菌是曲霉属和链格孢霉属;永春老醋发酵过程中的主要真菌来自于酵母纲[25];赤水晒醋醋酸发酵阶段优势真菌为曲霉菌属(Aspergillus)和丝孢酵母菌属(Trichosporon)[26];可见不同食醋醋酸发酵过程中起主要作用的真菌各有不同,原因可能是曲、原料、环境中存在的微生物差异较大。
在发酵过程中,除了毕赤酵母属(Pichia)和横梗霉属(Lichtheimia)这两种相对丰度较高的属外,还存在许多相对丰度较低的物种,比如丝孢酵母属(Trichosporon)、链格孢霉属(Alternaria)、曲霉菌属(Aspergillus)和德克酵母属(Dekkera),其相对丰度保持在0.1%~4.0%之间,且存在于整个发酵过程中,其余属相对丰度小于0.1%(个别属在发酵某天丰度较高)。
2.6 四川晒醋的真菌群落演替的聚类分析
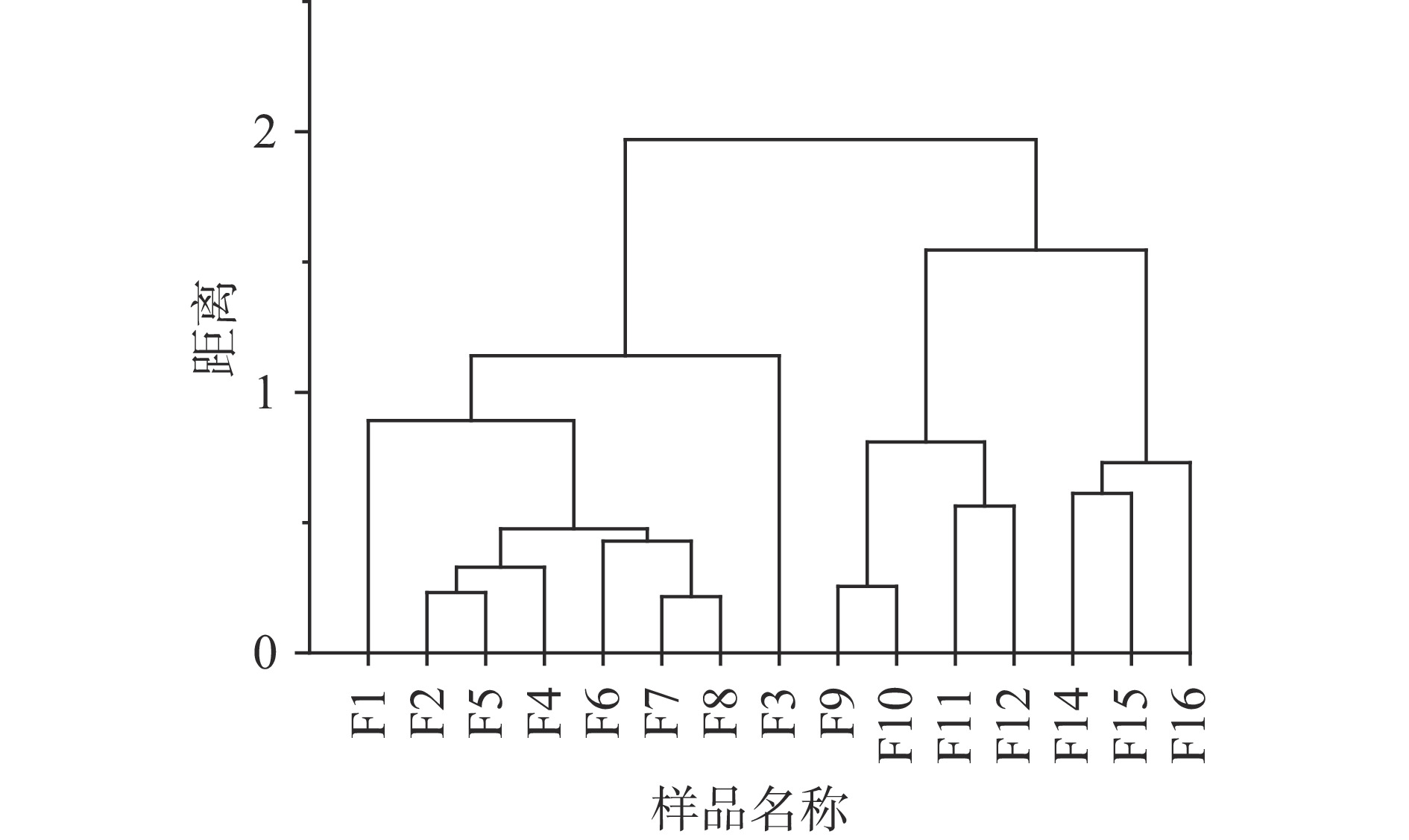
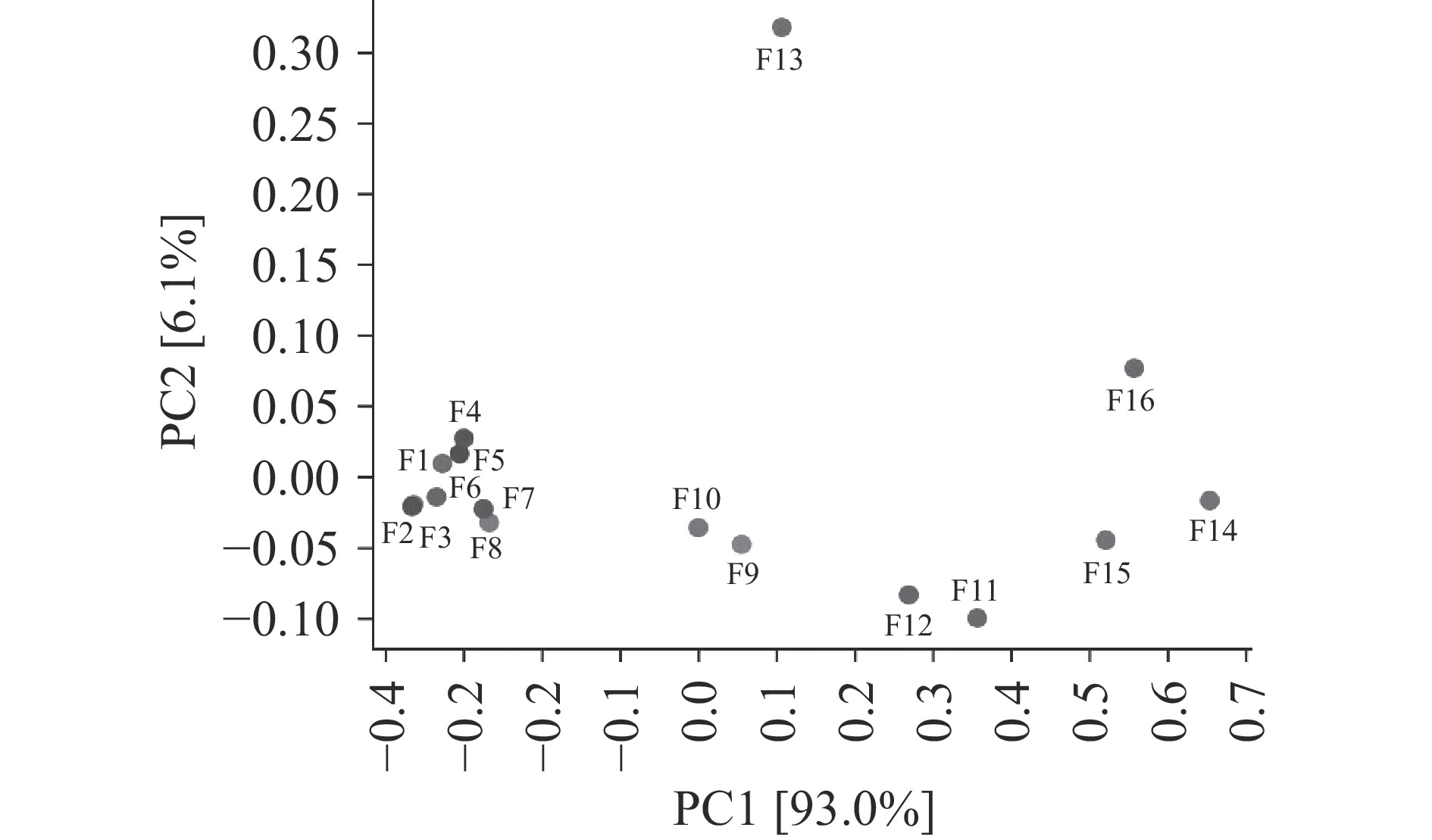
如图5所示,从对样品的聚类结果,可以看出真菌群落的演替呈现一定规律,发酵第1~8 d与其他时期有较大差异,并且发酵第9~12 d与发酵第13~16 d也位于两个不同分支。PCA分析发现(图6),前个两主成分可以代表99.1%的变量信息,真菌的群落变化主要发生PCA1轴。第13 d的样品与其他样品的距离较远,从第13 d的群落信息来看,检测到许多低丰度的属,与其他样品有较大差别。可能是开放的发酵环境导致样品受到了污染,所以后续分析将第13 d样品去除。为了研究四川晒醋固态发酵的不同发酵阶段,根据层次聚类结果,可将四川晒醋固态发酵阶段分为三个阶段,发酵第1~8 d为第1阶段,发酵第9~12 d为第2阶段,发酵第14~16 d为第3阶段。
2.7 不同发酵阶段标志性真菌分析
线性判别分析效应大小(LEfSe)分析是一种用于发现和解释高维度数据生物标识的分析工具,用于发现不同生物条件或环境下的多组样本中最能解释组间差异的物种特征,以及这些特征对组间差异的影响程度。因此,可以使用LEfSe分析鉴定出不同发酵阶段的标志性微生物[27]。由图7可知,醋醅发酵第1阶段(A)的差异性真菌来自于毕赤酵母科(Pichiaceae)的毕赤酵母属(Pichia)和德克酵母属(Dekkera)以及格孢菌科(Pleosporaceae)的链格孢属(Alternaria);发酵第2阶段(B)的差异性真菌有毛霉菌科(Mucoraceae)、毛霉属(Mucor)、卷枝毛霉菌(Mucor circinelloides);发酵第3阶段(C)的差异性真菌有21种,来自于毛霉目(Mucorales)、马拉色菌目(Malasseziales)、散囊菌目(Eurotiales)、被孢霉目 (Mortierellales),有伞枝横梗霉(Lichtheimia corymbifera)、Lichtheimia ornata、总状横梗霉(Lichtheimia ramosa)、Malassezia restricta、微小根毛霉(Rhizomucor pusillus)、细曲霉(Aspergillus gracilis)、紫红曲霉(Monascus purpureus)和 Mortierella elongata等属。
2.8 真菌群落与理化指标之间的相关性分析
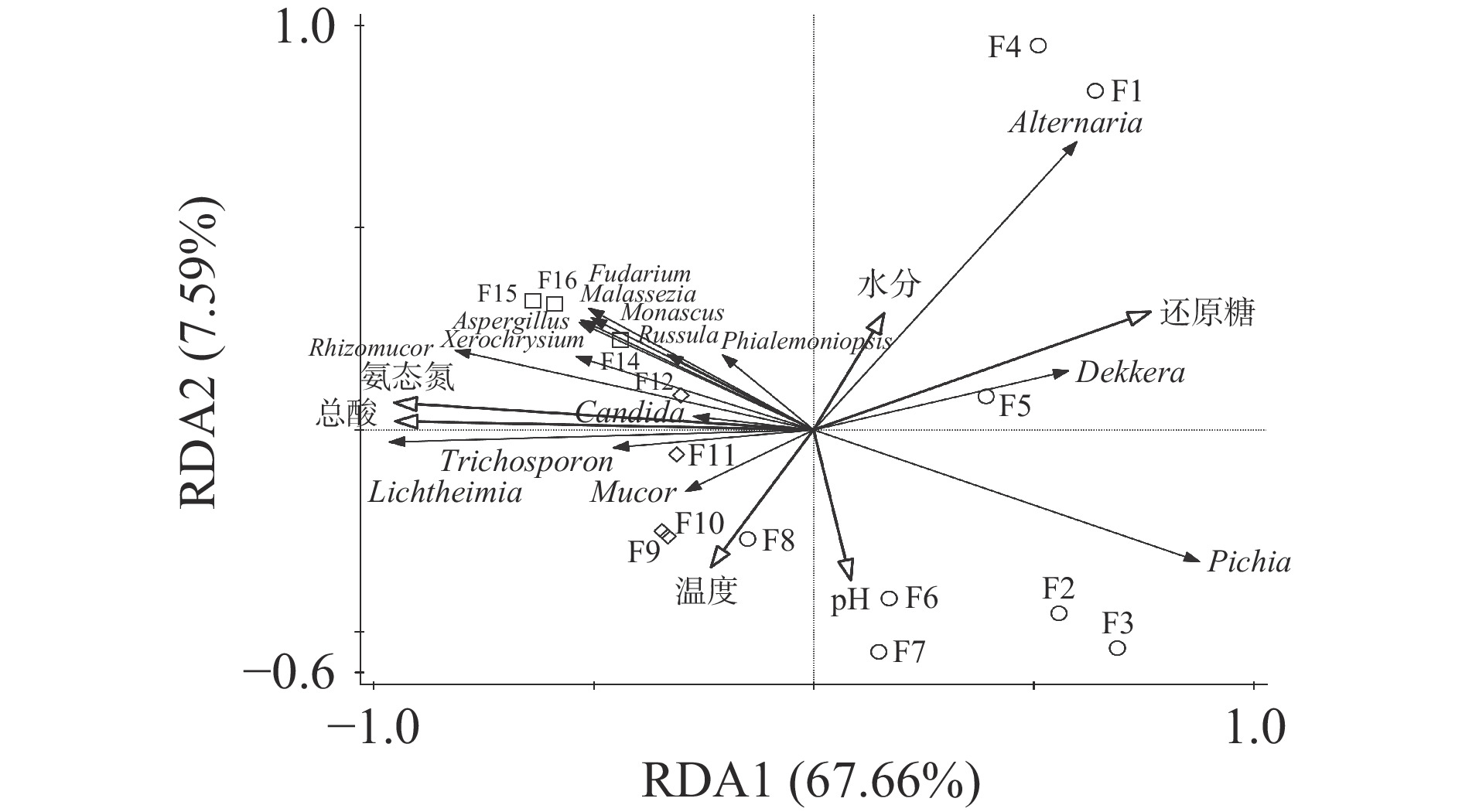
对翻醅车间的醋醅样本真菌群落进行去趋势对应分析(DCA),得到最大梯度长度为1.30,具有线性特征。因此,醋醅环境因子与微生物群落结构间的相关性分析适用线性模型冗余分析(RDA)。从RDA分析结果表明(图8),第一轴和第二轴分别解释微生物群落结构变化的67.66%和7.59%,总解释度为75.25%,说明真菌群落在属水平上的分布与理化因子关系密切。氨态氮、总酸和还原糖对群落的贡献度较大,氨态氮对真菌群落的解释率为61.7%(P<0.01),总酸对真菌群落的解释率为61.4%(P<0.01),还原糖对真菌群落的解释率为40.9%(P<0.01),温度、水分、pH的解释率依次减小,且不显著(P>0.05)。
氨态氮与发酵第1~7 d的群落呈负相关,其相关性逐渐减小;发酵第8~16 d的群落主要集中在氨态氮向量的正方向且逐渐远离原点,说明氨态氮与发酵第8~16 d的群落呈正相关,其相关性随着发酵时间延长逐渐增强,说明氨态氮对真菌群落的影响越来越大。
总酸对群落的影响与氨态氮相似。发酵前期产蛋白酶的真菌丰度不高,可能主要由芽孢杆菌等细菌产蛋白酶分解蛋白质,此时氨态氮的含量增长迅速,随着产酸菌的生长,醋醅中总酸含量上升,使不耐酸性的芽孢杆菌相对丰度减少,所以发酵后期主要由产蛋白酶的真菌来分解蛋白质。
还原糖与发酵前7 d的真菌群落呈正相关,且相关性呈减小趋势,发酵第8 d至第16 d的群落主要在向量的负方向且逐渐远离原点,说明发酵前期产淀粉酶、糖化酶等的真菌丰度较高,使还原糖含量增加,后期由于醋醅酸性环境的压力使部分真菌难以生存,相对丰度减小,同时使还原糖与真菌群落的相关性减小。有学者对麸醋的细菌群落、理化指标进行了冗余分析,得到的结果表明,温度是影响细菌群落变化的主要因素[28],说明真菌和细菌群落的影响因素有差异。有研究表明翻醅操作通过影响温度、氧气含量等发酵条件来影响微生物群落的结构[29]。
根据Spearman 相关系数可知理化指标与各个真菌的相关性,选择了丰度前15的真菌进行分析,结果表明(表2),这15种真菌大部分与总酸、氨态氮、还原糖三个指标具有显著相关性(P<0.05),此结果与RDA结果相似。与总酸呈显著正相关的真菌有横梗霉菌(Lichtheimia)、丝孢酵母属(Trichosporon)、曲霉属(Aspergillus)、镰刀霉(Fusarium)、毛霉属(Mucor)、Xerochrysium、根毛霉属(Rhizomucor)、红曲霉属(Monascus)、马拉色霉菌属(Malassezia),呈显著负相关的真菌有毕赤酵母属(Pichia)和链格孢属(Alternaria);与氨态氮呈显著正相关的真菌包括横梗霉菌(Lichtheimia)、曲霉属(Aspergillus)、镰刀霉(Fusarium)、毛霉属(Mucor)、Xerochrysium、根毛霉属(Rhizomucor)、红曲霉属(Monascus)、马拉色霉菌属(Malassezia),呈显著负相关的真菌包括毕赤酵母属(Pichia);与还原糖呈显著负相关的真菌包括横梗霉菌(Lichtheimia)、毛霉属(Mucor)、Xerochrysium、根毛霉属(Rhizomucor)。德克酵母属(Dekkera)、Phialemoniopsis、Russula、假丝酵母属(Candida)与总酸等理化因子相关性均不显著(P>0.05)。不同真菌与理化因子的相关性有较大差异,多种真菌共同作用,理化因子与真菌相互影响,通过控制发酵环境,可以影响真菌群落组成,从而改善食醋风味。
表 2 醋醅样品中理化指标与真菌的Spearman 相关性Table 2. Spearman correlation coefficients between physicochemical indicators and fungi in cupei samples真菌 pH 水分 温度 总酸 氨态氮 还原糖 Pichia −0.093 0.070 −0.125 −0.907** −0.893** 0.471 Lichtheimia −0.032 0.020 0.142 0.971** 0.918** −0.649** Alternaria −0.414 0.032 −0.132 −0.579* −0.479 0.293 Trichosporon −0.100 −0.148 0.127 0.546* 0.411 −0.468 Aspergillus 0.214 0.015 0.231 0.675** 0.686** −0.314 Fusarium 0.057 0.153 −0.343 0.530* 0.602* −0.28 Dekkera 0.025 −0.111 0.433 −0.507 −0.425 0.154 Phialemoniopsis 0.079 −0.105 −0.083 0.457 0.434 −0.276 Mucor −0.124 0.022 0.379 0.538* 0.553* −0.696** Russula 0.398 −0.225 −0.311 0.245 0.247 0.225 Xerochrysium −0.068 0.031 0.245 0.734** 0.575* −0.551* Rhizomucor 0.098 0.178 0.106 0.927** 0.891** −0.564* Monascus 0.304 0.214 −0.151 0.734** 0.748** −0.325 Malassezia 0.317 −0.03 0.141 0.823** 0.789** −0.164 Candida −0.094 −0.353 −0.025 0.368 0.232 −0.265 注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 3. 结论
本研究利用高通量测序技术对四川晒醋固态发酵过程中真菌的组成和演替规律进行了研究,并分析了发酵过程中理化因子的变化。随着发酵的进行,醋醅的pH降低,水分、温度基本保持稳定,总酸、氨态氮含量先持续增加后保持稳定,还原糖含量先增加后减少。真菌群落的多样性和均匀性呈现先稳定后逐渐增加再降低的趋势。根据聚类分析结果,可将发酵过程分为3个阶段,且3个阶段的标志性真菌不同。毕赤酵母和横梗霉菌是发酵过程中的主要真菌,毕赤酵母属的相对丰度在18.3%~99.6%范围内波动,横梗霉菌属的相对丰度在0.2%~62.5%范围内变化。此外,冗余分析结果表明,氨态氮、总酸是影响真菌群落的主要因素,氨态氮、总酸与发酵第1~8 d的真菌群落呈负相关,与发酵第9~16 d的真菌群落呈正相关。本研究发现理化因子对晒醋真菌群落的演替有一定的影响,后续还可以引入更多与真菌生长相关的理化因子,如氧气浓度、酶活等,可能有助于晒醋真菌群落变化的进一步探究。
-
表 1 每个醋醅样本的真菌群落测序情况及α多样性统计
Table 1 Statistics of fungal community sequencing and α diversity in each cupei sample
样品
名称序列数
(条)扩增子序列
变异(ASVs)Chao1
指数Shannon
指数Simpson
指数Shannon指数/
Simpson指数覆盖率 F1 62101 16 15.90 0.50 0.15 3.32 0.9999 F2 63152 24 23.65 1.28 0.37 3.49 0.9998 F3 75687 24 24.78 2.09 0.71 2.93 0.9998 F4 65658 35 35.72 1.67 0.50 3.36 0.9999 F5 73841 89 91.63 1.71 0.41 4.16 0.9996 F6 70722 40 42.93 1.91 0.59 3.26 0.9997 F7 63446 38 37.89 1.70 0.46 3.68 0.9998 F8 63979 58 60.26 1.95 0.53 3.71 0.9996 F9 63465 57 58.36 3.09 0.81 3.80 0.9998 F10 65146 71 72.86 3.15 0.82 3.86 0.9998 F11 64585 58 59.31 3.10 0.84 3.68 0.9998 F12 135298 72 79.13 2.82 0.78 3.61 0.9993 F13 76064 479 485.26 5.72 0.90 6.38 0.9988 F14 68013 93 92.79 3.54 0.84 4.19 0.9999 F15 75476 58 59.83 3.68 0.86 4.25 0.9998 F16 73403 59 60.13 4.27 0.90 4.74 0.9999 表 2 醋醅样品中理化指标与真菌的Spearman 相关性
Table 2 Spearman correlation coefficients between physicochemical indicators and fungi in cupei samples
真菌 pH 水分 温度 总酸 氨态氮 还原糖 Pichia −0.093 0.070 −0.125 −0.907** −0.893** 0.471 Lichtheimia −0.032 0.020 0.142 0.971** 0.918** −0.649** Alternaria −0.414 0.032 −0.132 −0.579* −0.479 0.293 Trichosporon −0.100 −0.148 0.127 0.546* 0.411 −0.468 Aspergillus 0.214 0.015 0.231 0.675** 0.686** −0.314 Fusarium 0.057 0.153 −0.343 0.530* 0.602* −0.28 Dekkera 0.025 −0.111 0.433 −0.507 −0.425 0.154 Phialemoniopsis 0.079 −0.105 −0.083 0.457 0.434 −0.276 Mucor −0.124 0.022 0.379 0.538* 0.553* −0.696** Russula 0.398 −0.225 −0.311 0.245 0.247 0.225 Xerochrysium −0.068 0.031 0.245 0.734** 0.575* −0.551* Rhizomucor 0.098 0.178 0.106 0.927** 0.891** −0.564* Monascus 0.304 0.214 −0.151 0.734** 0.748** −0.325 Malassezia 0.317 −0.03 0.141 0.823** 0.789** −0.164 Candida −0.094 −0.353 −0.025 0.368 0.232 −0.265 注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。 -
[1] 朱文优, 张超, 魏琴, 等. 四川晒醋烘醅工艺的改良研究[J]. 中国调味品,2012,37(4):82−84. [ZHU W Y, ZHANG C, WEI Q, et al. Technical innovation in the baking fermented grains processing of Sichuan sun vinegar[J]. China Condiment,2012,37(4):82−84. doi: 10.3969/j.issn.1000-9973.2012.04.022 [2] 周荣清. 四川麸醋生产工艺的特点及发展趋势[J]. 四川食品与发酵,2000(3):24−28. [ZHOU R Q. Characteristics and development trend of Sichuan bran vinegar production process[J]. Sichuan Food and Fermentation,2000(3):24−28. [3] ZHOU J, HE Z, YANG Y, et al. High-throughput metagenomic technologies for complex microbial community analysis: Open and closed formats[J]. m Bio,2015,6(1):e02288−02214.
[4] HE G Q, LIU T J, SADIQ F A, et al. Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J]. Journal of Zhejiang University Science B,2017,18(4):289−302. doi: 10.1631/jzus.B1600148
[5] 王宗敏. 镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D]. 无锡: 江南大学, 2016. WANG Z M. Correlation between structural shifts of microbiota and compositions of flavors during the stage of acetic acid fermentation of Zhenjiang aromatic vinegar[D]. Wuxi: Jiangnan University, 2016.
[6] 刘廷锐. 四川麸醋关键风味物质及其与酿造微生物的相关性研究[D]. 成都: 西华大学, 2020. LIU T R. Study on key flavor substances of Sichuan bran vinegar and their correlation with brewing microorganisms[D]. Chengdu: Xihua University, 2020.
[7] ZHU Y P, ZHANG F F, ZHANG C N, et al. Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation[J]. Scientific Reports,2018,8(1):407−424. doi: 10.1038/s41598-017-18689-w
[8] 崔宁波. 利用DNA高通量测序技术分析生料酿醋过程中的真菌多样性[D]. 太原: 山西大学, 2019. CUI N Y. Analysis of fungal diversity in vinegar brewing with raw materials by DNA high-throughput sequencing[D]. Taiyuan: Shanxi University, 2019.
[9] 冯洁雅, 张桂容, 蔡吉, 等. 基于高通量测序解析四川晒醋固态发酵过程中细菌群落变化[J]. 食品工业科技,2021,42(19):135−143. [FENG J Y, ZHANG G R, CAI J, et al. Analysis of bacterial community changes in Sichuan sun vinegar solid-state fermentation process based on high-throughput sequencing[J]. Food Industry Technology,2021,42(19):135−143. [10] 赵风琴. 凉州熏醋传统酿造过程主要功能微生物群落演替对四甲基吡嗪的影响[D]. 兰州: 甘肃农业大学, 2016. ZHAO F Q. The effects of major functional microbial succession on tetramethylpyrazine during the traditional brewing process of Liangzhou fumigated vinegar[D]. Lanzhou: Gansu Agricultural University, 2016.
[11] 方冠宇. 浙江玫瑰醋搅拌工艺及发酵过程中微生物与风味物质相关性研究[D]. 杭州: 浙江工商大学, 2018. FANG G Y. Research on the stirring technology and the correlation between microorganism and flavor substance in Zhejiang rosy vinegar fermentation process[D]. Hangzhou: Zhejiang University of Technology and Commerce, 2018.
[12] 赵东, 牛广杰, 赵旭东, 等. 糟醅中还原糖分析方法的探讨[J]. 酿酒,2013,40(2):88−90. [ZHAO D, NIU G J, ZHAO X D, et al. The research on measuring reducing sugar of grains[J]. Liquor Making,2013,40(2):88−90. doi: 10.3969/j.issn.1002-8110.2013.02.025 [13] 杜宏福. 山西老陈醋发酵过程中有机酸产生规律研究[D]. 天津: 天津科技大学, 2015. DU H F. The dynamic production of organic acids during Shanxi aged vinegar fermentation process[D]. Tianjin: University of Science and Technology, 2015.
[14] 冯莉, 陈雪, 李丽, 等. 5株克鲁维毕赤酵母的酿造学特性[J]. 中国食品学报,2018,18(12):72−79. [FENG L, CHEN X, LI L, et al. The enology characteristics of five strains of Pichia kluyveri[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(12):72−79. [15] 王晓丹, 陈美竹, 班世栋, 等. 茅台大曲中酵母的分离、鉴定及其功能初探[J]. 食品科学,2017,38(4):51−57. [WANG X D, CHEN M Z, BAN S D, et al. Separation, identification and functional characterization of yeast strains from Moutai-flavor Daqu, a traditional Chinese liquor fermentation starter[J]. Food Science,2017,38(4):51−57. doi: 10.7506/spkx1002-6630-201704009 [16] LI P, LI S, CHENG L L, et al. Analyzing the relation between the microbial diversity of Daqu and the turbidity spoilage of traditional Chinese vinegar[J]. Applied Microbiology and Biotechnology,2014,98(13):6073−6084. doi: 10.1007/s00253-014-5697-4
[17] AGUERO D, ALICE S M, LISBOA G, et al. Production and catalytic properties of amylases from Lichtheimia ramosa and Thermoascus aurantiacus by solid-state fermentation[J]. The Scientific World Journal,2016(1):1−10.
[18] NAYARA F L G, FLAVIAL R D S S, FABIANO A G, et al. Roduction of β-glucosidase on solid-state fermentation by Lichtheimia ramosa in agroindustrial residues: Characterization and catalytic properties of the enzymatic extract[J]. Electronic Journal of Biotechnology,2015,18(4):314−319. doi: 10.1016/j.ejbt.2015.05.007
[19] MARIA T A Z, ALEJANDRO S H, JOHAN R M, et al. Taxonomic identification of the thermotolerant and fast-growing fungus Lichtheimia ramosa H71D and biochemical characterization of the thermophilic xylanase LrXynA[J]. Amb Express,2017,7(1):194. doi: 10.1186/s13568-017-0494-y
[20] 苑广伟, 周洁嫦, 王欣宇, 等. 一株来源于土壤的横梗霉菌及其产羧甲基纤维素酶性质[J]. 工业微生物,2021,51(1):23−29. [YUAN G W, ZHOU J C, WANG X Y, et al. A Sporidiobolus pararoseus XWNRI from siol and its properties of carboxymethy cellulase[J]. Industrial Microbiology,2021,51(1):23−29. doi: 10.3969/j.issn.1001-6678.2021.01.004 [21] 李子健, 黄丹, 张曼, 等. 中高温大曲中两株耐热霉菌的分离鉴定及产酶特性比较[J]. 食品与发酵科技,2020,56(3):1−7. [LI Z J, HUANG D, ZHANG M, et al. Isolation and identification of two heat-resistant molds in Daqu at medium-high temperature and comparison of their enzyme production characteristics[J]. Food and Fermentation Sciences & Technology,2020,56(3):1−7. [22] CHUNG H, LEE N K, SEO J A, et al. Comparative analysis of nonvolatile and volatile metabolites in Lichtheimia ramosa cultivated in different growth media[J]. Journal of the Agricultural Chemical Society of Japan,2016,81(3):565−572.
[23] ZHENG X W, YAN Z, NOUT M J. Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J]. World J Microbiol Biotechnol,2015,31(1):199−208. doi: 10.1007/s11274-014-1776-z
[24] 李荣源, 卢红梅, 秦兴, 等. 高通量测序分析赤水晒醋各生产阶段微生物群落结构变化[J]. 食品科学,2020,41(24):78−86. [LI R Y, LU H M, QIN X, et al. High-throughput sequencing analysis of microbial community structure changes in various production stages of red water sun vinegar[J]. Food Science,2020,41(24):78−86. doi: 10.7506/spkx1002-6630-20191022-228 [25] 王俊奇, 黄卫红, 李双彤, 等. 永春老醋不同生产阶段细菌和真菌多样性动态变化特征分析[J]. 食品与发酵工业,2021,47(2):38−44. [WANG J Q, HUANG W H, LI S T, et al. Dynamic changes of bacterial and fungal diversities in Yongchun aged vinegar during production and storage[J]. Food and Fermentation Industries,2021,47(2):38−44. [26] 施思, 彭智辅, 乔宗伟, 等. 浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J]. 食品与发酵工业,2017(5):81−84. [SHI S, PENG Z F, QIAO Z W, et al. Analysis of the change of saccharifying power and fermenting power for Luzhou-flavor Daqu and their fungal diversity during storage[J]. Food and Fermentation Industries,2017(5):81−84. [27] 吴晓红, 高生平, 蒋彩云, 等. 榨菜发酵过程中原核微生物群落结构及其理化因子的动态演替[J]. 食品与发酵工业,2021,47(1):27−34. [WU X H, GAO S P, JIANG C Y, et al. Dynamic succession of prokaryotic microbial communities and physicochemical properties during the fermentation of Zhacai[J]. Food and Fermentation Industries,2021,47(1):27−34. [28] ZHU M, CHEN Z, LUO H B, et al. Study of the phase characteristics of Sichuan bran vinegar fermentation based on flavor compounds and core bacteria[J]. Journal of the American Society of Brewing Chemists,2020,79(2):1−11.
[29] ZHANG Q, FU C, ZHAO C, et al. Monitoring microbial succession and metabolic activity during manual and mechanical solid-state fermentation of Chinese cereal vinegar[J]. LWT-Food Science and Technology,2020,133:109868. doi: 10.1016/j.lwt.2020.109868
-
期刊类型引用(3)
1. 黄翠欣,张桂容,刘军,舒林,曹荣,温雪瓶,李丽. 一株产纤维素酶菌株的分离纯化及其产酶性质研究. 食品与发酵工业. 2023(17): 37-43 .  百度学术
百度学术
2. 袁治浩,卢红梅,李荣源,陈莉,徐融融. 陈酿方式对赤水晒醋醋醅的影响研究. 中国酿造. 2022(11): 78-83 .  百度学术
百度学术
3. 范三红,薛虎贵,白宝清,薛腾达,蔺佳钰,张锦华. 山西陈醋发酵过程微生物群落动态分析及差异菌属筛选. 食品工业科技. 2022(24): 171-179 .  本站查看
本站查看
其他类型引用(3)





 下载:
下载:


 下载:
下载:



