Identification and Antioxidant Activity Analysis of Polyphenols in Different Mango Kernels Cultivars
-
摘要: 研究不同品种芒果核内所含的多酚类物质及其抗氧活性。对4种市售芒果(象牙芒、玉芒、紫花芒和三年芒)核中多酚类物质进行提取、测定以及统计学分析。结果表明:芒果核中含有较为丰富的多酚类物质且具有良好的抗氧化活性,其中紫玉芒核中多酚含量最高,其抗氧化活性最强,其次是象牙芒核和三年芒核,玉芒核最差;4个品种的芒果核提取物存在较大差异,易于区分,且测定指标之间均呈现正相关,其中总酚和水解单宁与体外抗氧化指标均呈现显著的相关性(P<0.05);通过UPLC-Tripe TOF-MS/MS对芒果核中的多酚类化合物进行鉴定,共鉴定出28种多酚及其衍生物,包括2种酚酸、8种酚酸酯、10种酚酸糖苷、7种黄酮糖苷和1种黄酮。研究结果可为合理选择芒果品种提取芒果核中多酚类化合物提供科学依据。Abstract: The polyphenols and antioxidant activities of different mango cultivars were studied. Polyphenols from four commercial mango (Ivory, Yu, Zihua and Sannian) mango kernels were extracted, determined and analyzed statistically. The results showed that mango kernel contained abundant polyphenolic compounds and had good antioxidant activity. Among them, the content of polyphenol in Zihua mango kernel was the highest and its antioxidant activity was the strongest, followed by Ivory mango kernel and Sannian mango kernel, and that in Yu mango kernel was the worst. There were great differences in the extracts of mango kernels among the four cultivars, which were easy to distinguish, and there was a positive correlation between the determination indexes. Among them, total phenols and hydrolyzed tannins were significantly correlated with in vitro antioxidant activities (P<0.05). Compounds in mango kernel were identified by UPLC-Tripe TOF-MS/MS, and 28 polyphenols and their derivatives were identified, including 2 phenolic acids, 8 phenolic esters, 10 phenolic glycosides, 7 flavonoid glycosides and 1 flavonoid. The results can provide scientific basis for reasonable selection of mango cultivars to extract polyphenols from mango kernel.
-
Keywords:
- mango kernels /
- polyphenols content /
- antioxidant activities /
- correlation analysis
-
芒果(Mangifera indica L.)是著名的热带水果,其果肉肉质滑嫩、含糖量高、富有特殊气味,深受广大消费者的喜爱,被誉为“热带水果之王”,是热带、亚热带的主要经济作物[1]。近年来,世界芒果种植面积和产量都在不断上升,已成为世界五大热带农作物之一[2]。我国的芒果种植主要集中在海南、广东、广西、云南等地区,每年产量约160万吨,其果肉大部分用于鲜食、制作果汁、罐头等,而剩余的果皮[3]和果核基本上被当作废弃物,不仅造成环境污染,还会造成资源浪费[4]。此外,芒果核还有较高含量的优质蛋白[5]、脂肪酸[6]、淀粉[7]等具有极高的药用价值,据中国药典理论记载,芒果核具有补肾、祛肾寒的功能[2],这多与所含的多酚类物质有关。
多酚是植物体内天然存在的化合物,具有单个或多个苯环并结合单个或多个羟基的化学结构,参与抵御紫外线或病原体的侵袭,属于植物次级代谢产物[8]。基于提取的多酚类物质普遍存在抗氧化特性,可有效清除氧自由基、保护机体组织免受损伤[9],植物多酚可作为天然抗氧化剂广泛的应用到食品、畜牧和水产等方面[10];也可作为潜在的治疗疾病的药物[11],所表现的抗氧化活性、抗病毒[12]、抗菌[13]等多种生物活性使其成为近年来研究热点[14]。目前,从芒果核中提取多酚并测定其生物活性的研究报道较多,普遍采用的提取方法为乙醇作为有机溶剂以超声[15]、微波[16]等方法辅助提取,并对提取的多酚做了抗氧化活性[17]、抑菌性[18]以及抗癌[11]等生物活性评估。前人所做的研究大部分集中于多酚的提取、抗氧化和生物活性,鲜有探究多酚类物质的具体成分鉴定及多酚与抗氧化之间相关性和主成分的分析。
为了鉴定不同品种芒果核内所含的多酚类物质、抗氧化性以及之间的相关性,本文选取市场上常见的象牙芒(海南)、玉芒(海南)、紫花芒(广西)和三年芒(云南)4个品种,用超声波辅助乙醇提取多酚并测定4种芒果核中的总酚、总黄酮、水解单宁、缩合单宁和体外抗氧化,并通过UPLC-TripeTOF-MS/MS鉴定其中的多酚类化合物,用SPSS25和Origin2019b对所测指标进行主成分分析和相关性分析。其结果可为后续芒果核内多酚类物质进一步加工研究提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
本试验所使用的芒果 选自市售的象牙芒(产自海南)、玉芒(产自海南)、紫花芒(产自广西)和三年芒(产自云南)4种芒果,分离表皮、果肉得到其芒果核,芒果核冻干后备用;无水碳酸钠、无水氯化铝、六水合三氯化铁、甲醇、乙醇、氢氧化钠 分析纯,西陇科学股份有限公司;盐酸 广东广试试剂科技有限公司;七水合硫酸亚铁、六氰合铁酸钾、硝酸钠 广州市金华大化试剂有限公司;三氟乙酸 上海麦克林生化科技有限公司;没食子酸、儿茶素、芦丁 上海阿拉丁生化科技股份有限公司;Folin-Ciocalteu(FC)试剂、香草醛 美国Sigma公司;1,1-二苯基-2-苦肼基(DPPH)、2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)、TPTZ 北京索莱宝有限公司。
SK2210LHC型超声波清洗器 上海科导超声仪器有限公司;U-T6A型紫外可见光分光光度计 屹谱仪器制造(上海)有限公司;Christ/Alpha 2-4 LDplus型冻干机 德国Martin Christ公司;H1-16KR台式高速冷冻离心机 湖南可成仪器设备有限公司;LABOROTA 400型旋转蒸发仪 德国Heidolph公司;CPA225D精密分析电子天平 赛多利斯科学仪器(北京)有限公司;AB ekspertTM ultraLC 110超高效液相色谱仪、AB Sciex Triple TOF 5600+混合四级杆飞行时间质谱仪 美国AB SCIEX公司。
1.2 实验方法
1.2.1 多酚类物质提取
用乙醇提取方法[19]提取多酚类物质。芒果核冷冻干燥粉碎,后过60目筛得样品。称取1.0 g样品加入20 mL 80%乙醇,混匀后在25 ℃、超声频率53 kHz、功率100 W条件下超声30 min,静置过夜后,离心(8000 r/min,30 min)取上清液,获得芒果核提取物。
1.2.2 总酚含量测定
福林-酚法[20]测定总酚含量。0.1 mL样品与2.9 mL蒸馏水、0.25 mL Folin-Ciocalteu试剂混合5 min后加入0.75 mL 20% Na2CO3溶液,25 ℃避光反应30 min,于765 nm处测其吸光值,用80%乙醇溶解没食酸子的50~400 µg/mL溶液作为参考标准绘制标准曲线(y=0.0019x+0.0193, R2=0.9996),没食子酸当量表示总酚含量。
1.2.3 总黄酮含量测定
AlCl3-NaOH-NaNO3方法[21]测定总黄酮含量。取0.5 mL样品与0.2 mL 5% NaNO2,25 ℃反应6 min后,加0.2 mL 10% AlCl3混匀,25 ℃反应6 min,然后加0.5 mL 4% NaOH和5 mL蒸馏水充分混匀,25 ℃反应15 min,于510 nm测定吸光值。用80%乙醇溶解芦丁的100~500 µg/mL溶液作为参考标准绘制标准曲线(y=0.0011x+0.0026,R2=0.9923),芦丁当量表示总黄酮含量。
1.2.4 水解单宁含量测定
采用饱和KIO3法测定水解单宁的含量。取2 mL样品与3 mL饱和KIO3溶液混合反应15 min,离心(10000 r/min,2 min),取上清液于550 nm处测定吸光值。用80%乙醇溶解没食子酸的50~600 µg/mL溶液作为参考标准绘制标准曲线 (y=0.0011x+0.0342,R2=0.9994),没食子酸当量表示水解单宁含量。
1.2.5 缩合单宁含量测定
香草醛-盐酸方法[22]测定缩合单宁含量。取0.6 mL样品与3.0 mL香草醛试剂(1%香草醛甲醇溶液和8%盐酸甲醇溶液等体积混合,现配现用),25 ℃反应20 min后于500 nm处测定吸光值。用甲醇溶解儿茶素的50~600 µg/mL溶液作为参考标准绘制标准曲线(y=0.0011x+0.0378,R2=0.9993),儿茶素当量表示缩合单宁含量。
1.2.6 DPPH·清除能力
DPPH·清除能力的测定参照Chang等[23]的方法并加以修改。样品溶液与DPPH甲醇溶液(0.1 mmol/L)混合(1:1, v/v),25 ℃避光反应30 min,在517 nm处测定吸光值A。空白组用超纯水代替样品,吸光值为A0。以维生素C标准品绘制浓度为0.5~5 µg/mL的标准曲线(y=12.875x+4.2096,R2=0.9998)计算样品的DPPH·清除能力。
DPPH⋅清除率(%)=A0−AA0×100 按样品质量计算:
DPPH⋅清除能力(mgVC/gd.w.)=[(清除率−4.2096)/12.875]×V×DW×1000 式中:V为加入提取液体积,mL;W为样品质量,g;D为稀释倍数。
1.2.7 ABTS+·清除能力
ABTS+·清除能力的测定参照杨希娟等[24]的方法并加以修改。将1.92 g ABTS和0.33 g过硫酸钾溶于纯水中,黑暗放置12~16 h。取0.6 mL样品与3.4 mL ABTS溶液混匀反应6 min,在734 nm处测定其吸光值A。空白组用超纯水代替样品,吸光值为A0。以维生素C标准品绘制浓度为5~50 µg/mL标准曲线(y=1.4303x+1.5861,R2=0.9989)计算样品的ABTS+·清除能力,公式参照DPPH·清除能力。
1.2.8 Fe3+还原力测定
Fe3+还原力的测定参照刘瑞等[25]的方法并加以修改。0.5 mL样品、1.5 mL PBS(pH=6.6)和1.5 mL K3[Fe(CN)6]混匀,50 ℃水浴20 min。后加入1.5 mL 10% 三氯乙酸,离心,取上清液2.5 mL,并向其中加入1.5 mL纯水和0.3 mL 0.1% FeCl3溶液混匀,在700 nm处测定其吸光值Ai。空白组用超纯水代替,吸光值为Aj。以维生素C标准品绘制浓度为25~400 µg/mL标准曲线(y=0.0069x+0.049,R2=0.9977,其中y=ΔA=Ai−Aj)计算样品的Fe3+还原力。
1.2.9 总抗氧化能力
总抗氧化能力的测定依据FRAP法[23]。乙醇稀释的样品与FRAP试剂(包括A液:0.3 mol/mL pH=3.6醋酸缓冲液;B液:40 mmol/mL盐酸配置的10 mmol/mL的TPTZ溶液;C液:超纯水配置的20 mmol/L的FeCl3溶液,上述三种溶液按照A:B:C=10:1:1体积比混合,现配现用)混合后,37 ℃水浴反应5 min,在593 nm处测定其吸光值,以FeSO4标品绘制浓度为0.003125~0.1 µmol/mL标准曲线(y=9.1101x+0.0313,R2=0.9993)计算总抗氧化能力,结果表示为mmol Fe2+/g d.w.。
1.2.10 多酚类化合物鉴定
色谱柱:Waters HSS T3 C18色谱柱(100 mm×2.1 mm, 1.8 μm),柱温:35 ℃,流动相A:0.05%甲酸水,流动相B:乙腈,流速:0.3 mL/min。采用梯度洗脱程序(0~4 min,1%~5% B;4~20 min,5%~15% B;20~30 min,15%~35% B;30~35 min,35%~95% B;35~36 min,95%~1% B;36~40 min,1% B),进样量:3 μL,检测器波长:280 nm。
质谱条件:电喷雾离子源(ESI),并在负离子模式下进行,其主要操作参数如下:以空气为载气,氮气为雾化气和辅助气,相应的载气、雾化气和辅助气压分别为30、50、50 psi;离子源温度为550 ℃;雾化电压5 kV;去簇电压80 V;碰撞能35±15 eV。质谱仪的扫描范围为m/z 50~1500,并采用信息关联数据采集模式(IDA)对质谱数据进行采集。
1.3 数据处理
所有试验数据采用 SPSS25.0 进行显著性和相关性分析,Origin2019b进行主成分分析并绘图。
2. 结果与分析
2.1 不同品种芒果核中总酚、总黄酮、水解单宁和缩合单宁的含量
多酚类物质作为芒果核中重要的生物活性成分,其含量及组成对于芒果核的精深加工及功能性产品的创制具有重要意义[2]。由表1可以看出,4种芒果核提取物中总酚含量在118.55~193.77 mg GAE/g d.w.之间;总黄酮的含量8.23~25.58 mg RT/g d.w.;而水解单宁含量差异不大,在22.68~27.63 mg GAE/g d.w.之间;缩合单宁的含量2.34~23.17 mg CE/g d.w.。总酚和总黄酮含量较文献值[26]测定的均较高,可能是所选取的芒果品种或测定方法存在差异所导致的。在4种芒果核提取物中,紫花芒核的总酚、总黄酮、水解单宁和缩合单宁含量均为最高,而玉芒核含量都为最低,其余2种芒果,象牙芒核和三年芒核在总酚、总黄酮和水解单宁含量差异不大,而缩合单宁含量相差较大。不同品种之间含量的差异,可能是由于芒果在种植过程土壤酸碱度、水分、气候等条件的不同影响芒果核多酚类物质的积累[27],具体的机理还需进一步探究。
表 1 不同品种芒果核中总酚、总黄酮、水解单宁和缩合单宁的含量Table 1. The contents of total phenols, total flavonoids, hydrolyzed tannins and condensed tannins in mango kernels from different cultivars种类 总酚(mg GAE/g d.w.) 总黄酮(mg RT/g d.w.) 水解单宁(mg GAE/g d.w.) 缩合单宁(mg CE/g d.w.) 象牙芒核 176.70±4.48b 15.24±0.98b 26.72±0.52ab 5.61±0.27c 玉芒核 118.55±5.59c 8.23±0.75c 22.68±0.59c 2.34±0.16d 紫花芒核 193.77±3.65a 25.58±1.91a 27.63±1.32ab 23.17±0.55a 三年芒核 175.02±2.49b 22.69±1.37a 25.23±1.46b 18.40±0.72b 注:GAE为没食子酸,RT为芦丁,CE为儿茶素。同一列不同小写字母表示具有显著差异(P<0.05),表2同。 2.2 芒果核提取物抗氧化活性分析
比较4种芒果核中提取物的抗氧化活性的差异,结果如表2所示,在4种芒果核在DPPH·清除能力和总抗氧化能力上,象牙芒核和紫花芒核基本上无明显差异,其次是三年芒核和玉芒核。在ABTS+·清除能力上,紫花芒核提取物的ABTS+·清除能力最强,约是其他三种的2倍。在Fe3+还原能力上差异较大,以象牙芒核最高。总体来说,紫花芒核和象牙芒核提取物的抗氧化能力都较强,其次是三年芒核,玉芒核提取物的抗氧化能力在四种芒果核中是最差的。这也基本上与表1所测定的多酚类物质含量相吻合,可能抗氧化能力的大小,是由总酚含量高低所决定的。
表 2 不同芒果核提取物体外抗氧化活性分析Table 2. Analysis of antioxidant activity of different mango kernel extracts in vitro种类 DPPH·清除能力
(mg VC/g d.w.)ABTS+·清除能力
(mg VC/g d.w.)Fe3+还原能力
(mg VC/g d.w.)总抗氧化能力
(mmol Fe2+/g d.w.)象牙芒核 108.17±2.69a 387.07±21.88b 352.62±2.93a 52.55±2.50a 玉芒核 50.15±1.12c 309.69±7.07c 178.41 ±1.44d 35.99±3.31c 紫花芒核 108.66±3.19a 618.17±27.03a 300.65±7.71b 50.29±1.51a 三年芒核 89.64±2.78b 277.98±9.82d 222.54±5.44c 45.35±2.25b 2.3 相关性分析与主成分分析
多酚类物质可通过酚羟基作为氢供体直接与自由基反应、抑制产生自由基所需的酶活性、螯合诱导自由基产生的金属离子以及与其他物质产生协同抗氧化作用等方式表现抗氧化活性[28],因此植物提取物中的多酚类物质与其生物活性(如抗氧化活性)间存在一定的相关性[29]。
由表3可知,所测总酚、总黄酮、水解单宁、缩合单宁与抗氧化活性指标之间均呈现正相关,说明各指标之间存在或强或弱的相关性。其中,缩合单宁只与DPPH·清除能力呈现显著相关性(P<0.05),总黄酮与DPPH·清除能力和总抗氧化能力分别呈现极显著相关性(P<0.01)和显著相关性(P<0.05),总酚与ABTS+·清除能力呈现和显著相关性(P<0.05),与其他3种抗氧化活性指标均呈现极显著相关性(P<0.01),水解单宁与4种抗氧化活性指标均均呈现极显著相关性(P<0.01),以上结果表明总酚和水解单宁的含量对芒果核提取物的抗氧化活性影响较大。
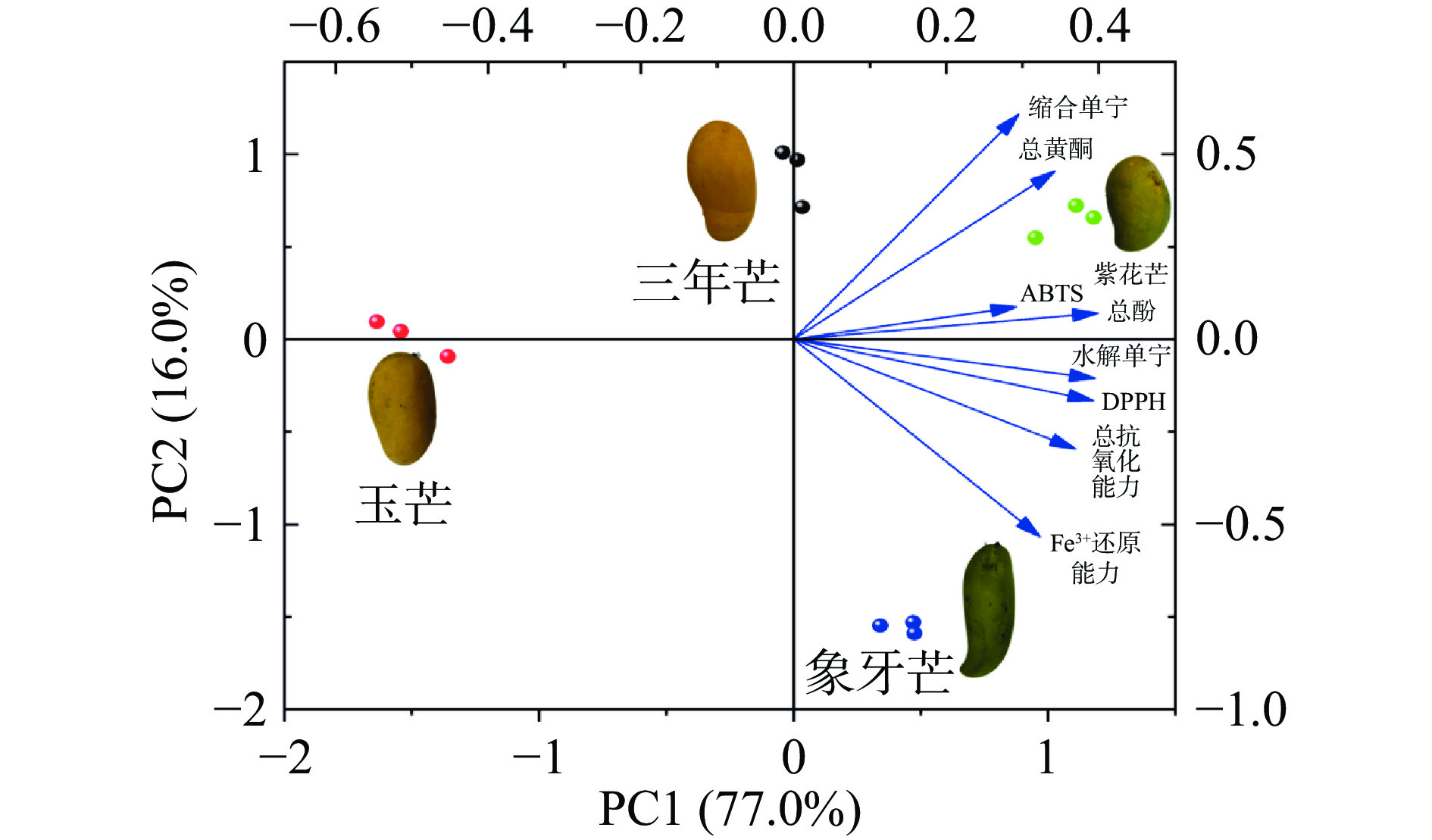
表 3 芒果核提取物中总酚、总黄酮、水解单宁、缩合单宁与体外抗氧化活性的相关性分析Table 3. Correlation analysis of total phenols, total flavonoids, hydrolyzed tannins, condensed tannins and antioxidant activities in vitro of mango kernel extracts总酚 总黄酮 水解单宁 缩合单宁 DPPH· ABTS+· Fe3+还原力 总抗氧化能力 总酚 1 0.886** 0.927** 0.767** 0.952** 0.596* 0.723** 0.898** 总黄酮 1 0.748** 0.959** 0.733** 0.540 0.357 0.619* 水解单宁 1 0.630* 0.951** 0.722** 0.844** 0.940** 缩合单宁 1 0.582* 0.561 0.169 0.448 DPPH· 1 0.589* 0.879** 0.978** ABTS·+ 1 0.533 0.532 Fe3+还原力 1 0.937** 总抗氧化能力 1 注:**表示极显著,P<0.01;*表示显著,P<0.05。 主成分分析见表4,由表4可知前两个主成分的特征值均大于1,其中主成分1贡献最大,达到76.987%,当主成分个数达到2时,累积方差贡献率92.957%,说明这两个主成分能够反映和解释所测的8个指标大部分信息[30]。主特征向量可以反映各个指标对主成分的贡献率[31],也可从图1中可以更明显地观察到各个指标的贡献率。在第一主成分方差贡献率77%,所测定8个指标均有较大的载荷,分布成正相关;第二主分方差贡献率16%,Fe3+还原力、缩合单宁、总黄酮在第二主成分上有较大的载荷,其中缩合单宁和总黄酮呈现正相关,而Fe3+还原力呈现负相关。从图1中可以看出四个样品得分分布图上彼此之间相距较远,所选品种之间的差异性还是较为明显的。
表 4 芒果核多酚类物质各评价指标主成分分析Table 4. Principal component analysis of each evaluation index of mango kernels polyphenols评价指标 主成分 1 2 总酚 0.39606 0.0716 总黄酮 0.34011 0.45525 水解单宁 0.39988 −0.09835 缩合单宁 0.2914 0.61036 DPPH· 0.39206 −0.16605 ABTS+· 0.29045 0.08844 Fe3+还原力 0.32194 −0.5311 总抗氧化能力 0.3754 −0.29656 特征值 6.159 1.278 方差贡献率(%) 76.987 15.97 累计贡献率(%) 76.987 92.957 2.4 UPLC-Tripe TOF-MS/MS鉴定芒果核中多酚类化合物
利用UPLC-Tripe TOF-MS/MS进行芒果核多酚类化合物物质的分析,并将实验数据与文献中已报道的研究结果及质谱数据库(Massbank和Metlin)进行比对,对比一级和二级质谱信息得出鉴定结果。4种芒果核中均含有的多酚类物质鉴定结果如表5所示。芒果核多酚中总共鉴定出28种多酚及其衍生物,包括2种酚酸、8种酚酸酯、10种酚酸糖苷、7种黄酮糖苷和1种黄酮。
表 5 芒果核提取物中多酚的鉴定结果Table 5. Identification of phenolic compounds of mango kernel extracts编号 保留时间 [M-H]−(m/z) 误差
(ppm)分子式 ESI 二级质谱主要的碎片离子
(m/z)鉴定组分 类别 测定值 理论值 1 4.512 169.0149 169.0142 −3.8 C7H6O5 125*, 79 没食子酸 酚酸 2 4.656 331.0689 331.0671 −5.4 C13H16O10 271*, 169*, 125* 没食子酰葡萄糖 酚酸糖苷 3 5.502 343.0672 343.0671 −0.3 C14H16O10 191*, 169*, 125* 没食子酰奎宁酸 酚酸酯 4 7.597 493.1196 493.1199 0.6 C19H26O15 313*, 169*, 125* 没食子酰二己糖 酚酸糖苷 5 9.907 423.0940 423.0933 −1.7 C19H20O11 333, 303*, 223, 193*, 165 桑橙素-C-葡萄糖苷 黄酮糖苷 6 11.129 483.0798 483.0780 −3.7 C20H20O14 331*, 271, 169*, 125 二没食子酰葡萄糖 酚酸糖苷 7 11.658 183.0301 183.0299 −1.1 C8H8O5 169*, 124* 没食子酸甲酯 酚酸酯 8 12.544 577.1351 577.1352 0.2 C30H26O12 451*, 425*, 407*, 289, 287, 245*, 125 B型原花青素 黄酮 9 13.718 321.0248 321.0252 1.2 C14H10O9 169*, 125* 间双没食子酸 酚酸酯 10 13.991 575.1049 575.1042 −1.2 C26H24O15 333, 303*, 193*, 169*, 125 桑橙素-C-(O-没食子酰)-葡萄糖苷 黄酮糖苷 11 18.186 559.1113 559.1053 −3.6 C26H24O14 407*, 389*, 317*, 287*, 269, 245, 169* 鸢尾酚酮-3-C-(2-O-没食子酰)-葡萄糖苷 黄酮糖苷 12 19.228 197.0460 197.0455 −2.5 C9H10O5 169*, 124* 没食子酸乙酯 酚酸酯 13 19.312 421.0767 421.0776 2.1 C19H18O11 331*, 301*, 271, 259 芒果苷 黄酮糖苷 14 23.048 635.0889 635.0890 0.2 C27H24O18 465*, 313*, 169*, 125 三没食子酰葡萄糖 酚酸糖苷 15 25.515 787.0980 787.0999 2.4 C34H28O22 787, 617*, 465*, 295*, 169 四没食子酰葡萄糖 酚酸糖苷 16 25.769 441.0817 441.0827 2.3 C22H18O10 289*, 245*, 169, 125 表儿茶素没食子酸酯 酚酸酯 17 26.289 787.1024 787.0999 −3.2 C34H28O22 787, 617*, 465*, 295, 169, 125 四没食子酰葡萄糖异构体1 酚酸糖苷 18 26.292 300.9988 300.9989 0.3 C14H6O8 229*, 145* 鞣花酸 酚酸 19 26.737 463.0860 463.0882 4.8 C21H20O10 301*, 300*, 271*, 255, 151* 金丝桃苷 黄酮糖苷 20 26.864 441.0816 441.0827 2.5 C22H18O10 289*, 245*, 203, 125 表儿茶素没食子酸酯异构体1 酚酸酯 21 26.952 431.0983 431.0984 0.2 C21H20O10 341, 311*, 283* 牡荆素 黄酮糖苷 22 27.032 787.1009 787.0999 −1.3 C21H20O12 787, 617*, 465*, 295, 169 四没食子酰葡萄糖异构体2 酚酸糖苷 23 27.262 463.0878 463.0882 0.9 C21H20O12 301*, 300*, 271, 255, 151* 异槲皮素 黄酮糖苷 24 27.673 335.0420 335.0409 −1.0 C15H12O9 183*, 168, 124* 二没食子酸甲酯 酚酸酯 25 28.055 441.0811 441.0827 3.6 C22H18O10 289*, 245*, 203 表儿茶素没食子酸酯异构体2 酚酸酯 26 28.565 939.1117 939.1109 −0.9 C41H32O26 787*, 617*, 465, 169* 五没食子酰葡萄糖 酚酸糖苷 27 29.612 1091.1225 1091.1219 −0.5 C48H36O30 787*, 769, 617*, 169* 六没食子酰葡萄糖 酚酸糖苷 28 30.358 1243.1336 1243.1328 −0.6 C55H40O34 1091*, 939*, 787*, 169* 七没食子酰葡萄糖 酚酸糖苷 注:*表示主要的定性碎片离子。 2.4.1 酚酸的鉴定
芒果核提取物中化合物1和18的母离子[M-H]-分别为m/z 169.0149和300.9988,化合物1的特征性碎片离子m/z 125为母离子失去一个CO2所产生,根据文献鉴定为没食子酸[32],化合物18的特征性碎片离子m/z 229 [M-2CO-H2O-H]-和145 [M-5CO-H2O-H]-,根据文献鉴定为鞣花酸[33]。
2.4.2 酚酸衍生物的鉴定
由于芒果核提取物中大量化合物的碎片离子中有m/z 169和125或124的存在,此类化合物可鉴定为没食子酸衍生物[34],因此芒果核提取物中富含没食子酸衍生物。
化合物2的母离子[M-H]-为m/z 331.0689,碎片离子m/z 271 [M-2CH2O-H]-。碎片离子m/z 169和m/z 125与没食子酸质谱信息一致,故化合物2被鉴定为没食子酰葡萄糖[34]。
化合物6的母离子[M-H]-为m/z 483.0798,碎片离子m/z 331 [M-C7H4O4-H]-失去一个没食子酰基,其余碎片离子与化合物2质谱信息一致,故化合物6被鉴定为二没食子酰葡萄糖[33]。
化合物14的母离子[M-H]-为m/z 635.0890,碎片离子m/z 465 [M-C7H6O5-H]-和m/z 313 [M-C7H6O5-C7H4O4-H]-,其余碎片离子与没食子酸质谱信息一致,故化合物14被鉴定为三没食子酰葡萄糖[33]。
化合物15、17和22的母离子[M-H]-均为787.1009左右,碎片离子m/z 617 [M-C7H6O5-H]-、m/z 465 [M-C7H6O5-C7H4O4-H]-和m/z 295 [M-C7H6O5-2C7H4O4-H]-,其余碎片离子与没食子酸质谱信息一致,因而化合物15、17和22被鉴定为四没食子酰葡萄糖[33]。
化合物26、27和28的母离子[M-H]-分别为m/z 939.1117、1091.1225和1243.1336,且均有m/z 787、617和169等碎片离子,对照文献[34],化合物26、27和28被分别鉴定为五没食子酰葡萄糖、六没食子酰葡萄糖和七没食子酰葡萄糖。
化合物4的母离子[M-H]-为m/z 493.1199,碎片离子m/z 313 [M-C6H10O5-H2O-H]-以及碎片离子m/z 169和m/z 125与没食子酸质谱信息一致,化合物4被鉴定为没食子酰二己糖。
化合物3的母离子[M-H]-为m/z 343.0672,碎片离子m/z 191 [M-C7H4O4-H]-、169 [M-C7H10O5-H]-和125 [M-C7H10O5-CO2-H]-,此化合物被鉴定为没食子酰基奎宁酸[35]。
化合物7和12的母离子[M-H]-分别为m/z 183.0301和197.0460,碎片离子m/z 169 分别为[M7-CH2-H]-和[M12-CH2CH2-H]-,故化合物7和12分别被鉴定为没食子酸甲酯和没食子酸乙酯[34]。
化合物24的母离子[M-H]-为335.0420,其碎片离子m/z 183 [M-C7H4O4-H]-为母离子失去一个没食子酰基,其余碎片离子与化合物7质谱信息一致,故化合物24被鉴定为二没食子酸甲酯[32]。
化合物16、20和25的母离子[M-H]-均为441.0817左右,碎片离子m/z 289 [M-C7H4O4-H]-、245 [M-C7H4O4-CO2-H]-以及没食子酸的特征碎片离子,故化合物16、20和25被鉴定为表儿茶素没食子酸酯[32]。
2.4.3 黄酮及其衍生物的鉴定
化合物8的母离子[M-H]-为m/z 的母离子[M-H]-为m/z 577.1351,碎片离子m/z 451 [M-C6H6O3-H]-, 425 [M-C8H8O3-H]-, 407 [M-C8H8O3-H2O-H]-, 此外m/z 289和287分别是通过QM裂变产生的碎片[M-H(290-H)]-和[M-2H(290-2H)]-,化合物8被鉴定为B型原花青素[33]。
化合物5和10的母离子[M-H]-分别为m/z 423.0940和575.1049,两者母离子间相差152且化合物10的碎片离子中含有m/z 169和125没食子酸的质谱信息,其余碎片离子两者相同,与文献值[35]一致,故化合物5和10分别被鉴定为桑橙素-C-葡萄糖苷和桑橙素-C-(O-没食子酰)-葡萄糖苷[36]。
化合物11的母离子[M-H]-为m/z 559.1113,碎片离子m/z 407 [M-C7H4O4-H]-为母离子失去一个没食子酰基所产生,389 [M-C7H6O5-H]-为母离子失去一个没食子酸所产生;另外,碎片离子m/z 317 [M-C7H4O4-C3H6O3-H]-和287 [M-C7H4O4-C4H8O4-H]-均对应葡萄糖苷部分的损失;根据已有的文献报道,化合物11被鉴定为鸢尾酚酮-3-C-(2-O-没食子酰)-葡萄糖苷[36]。
化合物13的母离子[M-H]-为m/z 421.0767,碎片离子m/z 259 [M-C6H10O5-H]-为母离子失去一个己糖苷所产生,碎片离子m/z 331[M-C3H6O3-H]-和301[M-C4H8O4-H]-均对应糖苷部分的损失,m/z 271 [M-C4H8O4-CH2O-H]-,参照文献化合物13被鉴定为芒果苷[36-37]。
化合物19和23的母离子[M-H]-均为m/z 463.0860左右,且碎片离子也是完全一致,碎片离子m/z 301[M-C6H10O5-H]-为母离子失去一个己糖苷所产生和151为黄酮类化合物特有的RDA碎片,进一步跟标准品比对后确认化合物19和23分别为金丝桃苷和异槲皮素[37]。
化合物21的母离子[M-H]-为431.0983,碎片离子m/z 341 [M-C3H6O3-H]-和311 [M-C4H8O4-H]-均对应葡萄糖苷部分的损失,m/z 283 [M-C4H8O4-CHO-H]-,并与标准品比对后确认化合物21是牡荆素。
3. 结论
本研究探索了不同品种芒果核总酚、总黄酮、水解单宁、缩合单宁以及抗氧化活性之间的差异,并对其多酚类物质进行了鉴定。结果表明:实验中选取的市售4种芒果的芒果核,紫花芒核在总酚、总黄酮、水解单宁和缩合单宁均为最高,分别达到193.77 mg GAE/g d.w.、25.58 mg RT/g d.w.、27.63 mg GAE/g d.w.和23.17 mg CE/g d.w.。体外抗氧化实验中,DPPH·清除能力和总抗氧化能力上,象牙芒核和紫花芒核基本上无明显差异,其次是三年芒核和玉芒核,而ABTS+·清除能力上,紫花芒核提取物的ABTS+·清除能力最强,约是其他3种的2倍。在Fe3+还原能力上差异较大,以紫花芒核最高。所测8个指标之间均呈现正相关,其中总酚和水解单宁与其他指标均存呈现较高的显著水平,而所选取的四个品种也存在较大差异,易于区分。通过UPLC-Tripe TOF-MS/MS共鉴定出28种多酚及其衍生物,包括2种酚酸、8种酚酸酯、10种酚酸糖苷、7种黄酮糖苷和1种黄酮。总体来说,芒果核中含有较多酚类物质,其含量较高,抗氧化能力也较强。在一定程度上为芒果的副产品加工提供科学理论依据。
-
表 1 不同品种芒果核中总酚、总黄酮、水解单宁和缩合单宁的含量
Table 1 The contents of total phenols, total flavonoids, hydrolyzed tannins and condensed tannins in mango kernels from different cultivars
种类 总酚(mg GAE/g d.w.) 总黄酮(mg RT/g d.w.) 水解单宁(mg GAE/g d.w.) 缩合单宁(mg CE/g d.w.) 象牙芒核 176.70±4.48b 15.24±0.98b 26.72±0.52ab 5.61±0.27c 玉芒核 118.55±5.59c 8.23±0.75c 22.68±0.59c 2.34±0.16d 紫花芒核 193.77±3.65a 25.58±1.91a 27.63±1.32ab 23.17±0.55a 三年芒核 175.02±2.49b 22.69±1.37a 25.23±1.46b 18.40±0.72b 注:GAE为没食子酸,RT为芦丁,CE为儿茶素。同一列不同小写字母表示具有显著差异(P<0.05),表2同。 表 2 不同芒果核提取物体外抗氧化活性分析
Table 2 Analysis of antioxidant activity of different mango kernel extracts in vitro
种类 DPPH·清除能力
(mg VC/g d.w.)ABTS+·清除能力
(mg VC/g d.w.)Fe3+还原能力
(mg VC/g d.w.)总抗氧化能力
(mmol Fe2+/g d.w.)象牙芒核 108.17±2.69a 387.07±21.88b 352.62±2.93a 52.55±2.50a 玉芒核 50.15±1.12c 309.69±7.07c 178.41 ±1.44d 35.99±3.31c 紫花芒核 108.66±3.19a 618.17±27.03a 300.65±7.71b 50.29±1.51a 三年芒核 89.64±2.78b 277.98±9.82d 222.54±5.44c 45.35±2.25b 表 3 芒果核提取物中总酚、总黄酮、水解单宁、缩合单宁与体外抗氧化活性的相关性分析
Table 3 Correlation analysis of total phenols, total flavonoids, hydrolyzed tannins, condensed tannins and antioxidant activities in vitro of mango kernel extracts
总酚 总黄酮 水解单宁 缩合单宁 DPPH· ABTS+· Fe3+还原力 总抗氧化能力 总酚 1 0.886** 0.927** 0.767** 0.952** 0.596* 0.723** 0.898** 总黄酮 1 0.748** 0.959** 0.733** 0.540 0.357 0.619* 水解单宁 1 0.630* 0.951** 0.722** 0.844** 0.940** 缩合单宁 1 0.582* 0.561 0.169 0.448 DPPH· 1 0.589* 0.879** 0.978** ABTS·+ 1 0.533 0.532 Fe3+还原力 1 0.937** 总抗氧化能力 1 注:**表示极显著,P<0.01;*表示显著,P<0.05。 表 4 芒果核多酚类物质各评价指标主成分分析
Table 4 Principal component analysis of each evaluation index of mango kernels polyphenols
评价指标 主成分 1 2 总酚 0.39606 0.0716 总黄酮 0.34011 0.45525 水解单宁 0.39988 −0.09835 缩合单宁 0.2914 0.61036 DPPH· 0.39206 −0.16605 ABTS+· 0.29045 0.08844 Fe3+还原力 0.32194 −0.5311 总抗氧化能力 0.3754 −0.29656 特征值 6.159 1.278 方差贡献率(%) 76.987 15.97 累计贡献率(%) 76.987 92.957 表 5 芒果核提取物中多酚的鉴定结果
Table 5 Identification of phenolic compounds of mango kernel extracts
编号 保留时间 [M-H]−(m/z) 误差
(ppm)分子式 ESI 二级质谱主要的碎片离子
(m/z)鉴定组分 类别 测定值 理论值 1 4.512 169.0149 169.0142 −3.8 C7H6O5 125*, 79 没食子酸 酚酸 2 4.656 331.0689 331.0671 −5.4 C13H16O10 271*, 169*, 125* 没食子酰葡萄糖 酚酸糖苷 3 5.502 343.0672 343.0671 −0.3 C14H16O10 191*, 169*, 125* 没食子酰奎宁酸 酚酸酯 4 7.597 493.1196 493.1199 0.6 C19H26O15 313*, 169*, 125* 没食子酰二己糖 酚酸糖苷 5 9.907 423.0940 423.0933 −1.7 C19H20O11 333, 303*, 223, 193*, 165 桑橙素-C-葡萄糖苷 黄酮糖苷 6 11.129 483.0798 483.0780 −3.7 C20H20O14 331*, 271, 169*, 125 二没食子酰葡萄糖 酚酸糖苷 7 11.658 183.0301 183.0299 −1.1 C8H8O5 169*, 124* 没食子酸甲酯 酚酸酯 8 12.544 577.1351 577.1352 0.2 C30H26O12 451*, 425*, 407*, 289, 287, 245*, 125 B型原花青素 黄酮 9 13.718 321.0248 321.0252 1.2 C14H10O9 169*, 125* 间双没食子酸 酚酸酯 10 13.991 575.1049 575.1042 −1.2 C26H24O15 333, 303*, 193*, 169*, 125 桑橙素-C-(O-没食子酰)-葡萄糖苷 黄酮糖苷 11 18.186 559.1113 559.1053 −3.6 C26H24O14 407*, 389*, 317*, 287*, 269, 245, 169* 鸢尾酚酮-3-C-(2-O-没食子酰)-葡萄糖苷 黄酮糖苷 12 19.228 197.0460 197.0455 −2.5 C9H10O5 169*, 124* 没食子酸乙酯 酚酸酯 13 19.312 421.0767 421.0776 2.1 C19H18O11 331*, 301*, 271, 259 芒果苷 黄酮糖苷 14 23.048 635.0889 635.0890 0.2 C27H24O18 465*, 313*, 169*, 125 三没食子酰葡萄糖 酚酸糖苷 15 25.515 787.0980 787.0999 2.4 C34H28O22 787, 617*, 465*, 295*, 169 四没食子酰葡萄糖 酚酸糖苷 16 25.769 441.0817 441.0827 2.3 C22H18O10 289*, 245*, 169, 125 表儿茶素没食子酸酯 酚酸酯 17 26.289 787.1024 787.0999 −3.2 C34H28O22 787, 617*, 465*, 295, 169, 125 四没食子酰葡萄糖异构体1 酚酸糖苷 18 26.292 300.9988 300.9989 0.3 C14H6O8 229*, 145* 鞣花酸 酚酸 19 26.737 463.0860 463.0882 4.8 C21H20O10 301*, 300*, 271*, 255, 151* 金丝桃苷 黄酮糖苷 20 26.864 441.0816 441.0827 2.5 C22H18O10 289*, 245*, 203, 125 表儿茶素没食子酸酯异构体1 酚酸酯 21 26.952 431.0983 431.0984 0.2 C21H20O10 341, 311*, 283* 牡荆素 黄酮糖苷 22 27.032 787.1009 787.0999 −1.3 C21H20O12 787, 617*, 465*, 295, 169 四没食子酰葡萄糖异构体2 酚酸糖苷 23 27.262 463.0878 463.0882 0.9 C21H20O12 301*, 300*, 271, 255, 151* 异槲皮素 黄酮糖苷 24 27.673 335.0420 335.0409 −1.0 C15H12O9 183*, 168, 124* 二没食子酸甲酯 酚酸酯 25 28.055 441.0811 441.0827 3.6 C22H18O10 289*, 245*, 203 表儿茶素没食子酸酯异构体2 酚酸酯 26 28.565 939.1117 939.1109 −0.9 C41H32O26 787*, 617*, 465, 169* 五没食子酰葡萄糖 酚酸糖苷 27 29.612 1091.1225 1091.1219 −0.5 C48H36O30 787*, 769, 617*, 169* 六没食子酰葡萄糖 酚酸糖苷 28 30.358 1243.1336 1243.1328 −0.6 C55H40O34 1091*, 939*, 787*, 169* 七没食子酰葡萄糖 酚酸糖苷 注:*表示主要的定性碎片离子。 -
[1] PANDEY K B, RIZVI S I. Plant polyphenols as dietary antioxidants in human health and disease[J]. Oxidative Medicine and Cellular Longevity,2009,2(5):270−278. doi: 10.4161/oxim.2.5.9498
[2] WABOI M P, SUNIL K, NITIN K, et al. Physicochemical characteristics, bioactive compounds and industrial applications of mango kernel and its products: A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(5):2421−2446. doi: 10.1111/1541-4337.12598
[3] 张影, 夏晓彤, 黄桂莲, 等. 常见热带水果芒果果皮中果胶的提取[J]. 广东化工,2021,48(3):44−45. [ZHANG Y, XIA X T, HUANG G L, et al. Extraction of pectin from mango peel of common tropical fruit[J]. Guangdong Chemical Industry,2021,48(3):44−45. doi: 10.3969/j.issn.1007-1865.2021.03.019 [4] 李日旺, 黄国弟, 苏美花, 等. 我国芒果产业现状与发展策略[J]. 南方农业学报,2013,44(5):875−878. [LI R W, HUANG G D, SU M H, et al. Present situation and development strategy of mango industry in China[J]. Journal of Southern Agriculture,2013,44(5):875−878. doi: 10.3969/j:issn.2095-1191.2013.5.875 [5] TORRES-LEON C, ROJAS R, CONTRERAS-ESQUIVEL J C, et al. Mango seed: Functional and nutritional properties[J]. Trends in Food Science & Technology,2016,55:109−117.
[6] AUGUSTIN M A, LING E T. Composition of mango seed kernel[J]. Pertanika,1987,10(1):53−59.
[7] WUERSCH P, HOOD L F. Structure of starch from mango seed[J]. Starch/Staerke,1981,33(7):217−221. doi: 10.1002/star.19810330702
[8] 杨巍巍, 邓航, 李娇, 等. 植物多酚化合物抗氧化损伤研究进展[J]. 现代食品,2020,22(16):74−78. [YANG W W, DENG H, LI J, et al. Research progress on antioxidant damage of plant polyphenols[J]. Modern Food,2020,22(16):74−78. [9] 康超, 李燕, 段振华, 等. 芒果核酚类物质提取工艺优化及其抗氧化活性研究[J]. 食品研究与开发,2017,38(5):47−51. [KANG C, LI Y, DUAN Z H, et al. Optimization of extraction process and antioxidant activity of phenolic compounds from mango kernel[J]. Food Research and Development,2017,38(5):47−51. doi: 10.3969/j.issn.1005-6521.2017.05.011 [10] LI H, XIA J, YANG L, et al. Plant polyphenols: Antioxidant capacity and application in animal production[J]. Chinese Journal of Animal Nutrition,2013,25(11):2529−2534.
[11] MIRZA B, CROLEY C R, AHMAD M, et al. Mango (Mangifera indica L.): A magnificent plant with cancer preventive and anticancer therapeutic potential[J]. Critical Reviews in Food Science and Nutrition,2021,61(13):2125−2151. doi: 10.1080/10408398.2020.1771678
[12] WENG W, ZHANG Q, LI S, et al. Research progress in antiviral effect and mechanism of plant polyphenols[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(12):6236−6240.
[13] FU S L, WU T T, WU C H, et al. Antioxidation and antibacterial mechanisms of plant polyphenols and application in food industry[J]. Food Industry,2016,37(6):242−246.
[14] KITTIPHOOM S. Utilization of mango seed[J]. International Food Research Journal,2012,19(4):1325−1335.
[15] 高云涛, 付艳丽, 李正全, 等. 超声与双水相体系耦合提取芒果核多酚及活性研究[J]. 食品与发酵工业,2009,35(9):164−167. [GAO Y T, FU Y L, LI Z Q, et al. Ultrasonic and aqueous two-phase system coupling extraction of mango polyphenols and activity research[J]. Food and Fermentation Industry,2009,35(9):164−167. [16] LUO B F, HUANG Z J, SUN M F, et al. Study on microwave-assisted extraction of mango polyphenol from mango nucleolus[J]. Food Research and Development,2015,36(1):37−39.
[17] CHEN Y J, SHENG Z W, SHI R C, et al. Antioxidant activities of ethanol extracts from three varieties of mango seeds[J]. Food Science,2011,32(9):8−13.
[18] 黄祉健, 阮玉凤, 罗宝芳, 等. 微波辅助提取芒果核多酚及其抑菌活性的研究[J]. 食品工业科技, 2014, 35(12): 295-298. HUANG Z J, RUAN Y F, LUO B F, et al. Microwave-assisted extraction of polyphenols from mango seeds and their antibacterial activities [ J ]. Food Industry Technology, 2014, 35(12) : 295-298.
[19] 杨郑州, 陆雪梅, 谢晓娜. 芒果多酚含量及抗氧化能力的测定[J]. 安徽农学通报,2017,23(11):142−143, 170. [YANG Z Z, LU X M, XIE X N. Determination of polyphenol content and antioxidant capacity of mango[J]. Anhui Agronomy Bulletin,2017,23(11):142−143, 170. doi: 10.3969/j.issn.1007-7731.2017.11.053 [20] 冯晓翎, 曹诗瑜, 徐晓瑜, 等. 11个鲜食葡萄品种总酚含量和抗氧化活性的评价[J]. 食品工业科技,2019,40(6):68−75. [FENG X L, CAO S Y, XU X Y, et al. Evaluation of total phenol content and antioxidant activity of 11 fresh grape varieties[J]. Food Industry Science and Technology,2019,40(6):68−75. [21] 白雪莲, 沈淑雅, 陈怀玉, 等. 微波辅助提取芒果皮黄酮工艺研究[J]. 农产品加工,2015,3(6):29−32. [BAI X L, SHEN S Y, CHEN H Y, et al. Microwave assisted extraction of flavonoids from mango peel[J]. Agricultural Products Processing,2015,3(6):29−32. [22] 王瑶. 元宝枫果实成熟过程中主要成分测定及抗氧化能力研究[D]. 咸阳: 西北农林科技大学, 2019. WANG Y . Determination of main components and antioxidant capacity of Acer truncatum during fruit ripening [D]. Xianyang: Northwest University of Agriculture and Forestry Science and Technology, 2019.
[23] CHANG X X, YE Y T, PAN J P, et al. Comparative assessment of phytochemical profiles and antioxidant activities in selected five varieties of wampee (Clausena lansium) fruits[J]. International Journal of Food Science & Technology,2018,53(12):2680−2686.
[24] 杨希娟, 党斌, 樊明涛. 溶剂提取对青稞中不同形态多酚组成及抗氧化活性的影响[J]. 食品科学,2018,39(24):239−248. [YANG X J, DANG B, FAN M T. Effects of solvent extraction on the composition and antioxidant activity of different forms of polyphenols in highland barley[J]. Food Science,2018,39(24):239−248. doi: 10.7506/spkx1002-6630-201824036 [25] 刘瑞, 于章龙, 孙元琳, 等. 黑小麦芽抗氧化活性成分提取及其抗氧化能力研究[J]. 食品工业,2021,42(7):134−138. [LIU R, YU Z L, SUN Y L, et al. Extraction of antioxidant active components from black wheat sprouts and their antioxidant capacity[J]. Food Industry,2021,42(7):134−138. [26] 张怡评, 杨婷, 洪专, 等. 青钱柳多酚提取工艺及抗氧化活性[J]. 食品工业,2021,42(6):212−216. [ZHANG Y P, YANG T, HONG Z, et al. Polyphenol extraction process and antioxidant activity of Cyclocarya paliurus[J]. Food Industry,2021,42(6):212−216. [27] 许鹏, 谭德锦, 宋海云, 等. 3个芒果品种的性状对比试验[J]. 中国热带农业,2016,72(5):55−57. [XU P, TAN D J, SONG H Y, et al. Comparative experiment on characters of three mango varieties[J]. China Tropical Agriculture,2016,72(5):55−57. doi: 10.3969/j.issn.1673-0658.2016.05.016 [28] LV Q Z, LONG J T, GONG Z F, et al. Current state of knowledge on the antioxidant effects and mechanisms of action of polyphenolic compounds[J]. Natural Product Communications,2021,16(7):1−13.
[29] 李瑞娟, 梁锦, 王丹, 等. 不同品种猕猴桃汁抗氧化成分及体外抗氧化活性比较[J/OL]. 食品工业科技: 1−12 [2021-09-16]. https://doi.org/10.13386/j.issn1002-0306.2021050119. LI R J, LIANG J, WANG D, et al. Comparison of antioxidant components and in vitro antioxidant activity of different varieties of kiwifruit juice [J/OL]. Science and Technology of Food Industry: 1−12 [2021-09-16]. https://doi.org/10.13386/j.issn1002-0306.2021050119.
[30] 杨倩雨, 郑浩, 李志强, 等. 油橄榄果实经济性状随成熟度的变化[J/OL]. 中国油脂: 1−13 [2021-09-08]. https://doi.org/10.19902/j.cnki.zgyz.1003-7969.210288. YANG Q Y, ZHENG H, LI Z Q, et al. Changes of economic characters of olive fruit with maturity [J/OL]. Chinese Oil: 1−13 [2021-09-08]. https://doi.org/10.19902/j.cnki.zgyz.1003-7969.210288.
[31] 王丽艳, 王鑫淼, 荆瑞勇, 等. 不同品种亚麻籽营养成分分析与品质综合评价[J]. 食品与机械,2021,37(7):26−32. [WANG L Y, WANG X M, JING R Y, et al. Nutrient composition analysis and quality comprehensive evaluation of different varieties of flaxseed[J]. Food and Machinery,2021,37(7):26−32. [32] BALLESTEROS-VIVAS D, ALVAREZ-RIVERA G, JOHANNA M S, et al. An integrated approach for the valorization of mango seed kernel: Efficient extraction solvent selection, phytochemical profiling and antiproliferative activity assessment[J]. Food Research International,2019:126.
[33] LIU P Z, LI L L, SUN X T, et al. Characterisation of phenolics in fruit septum of Juglans regia Linn. by ultra performance liquid chromatography coupled with orbitrap mass spectrometer[J]. Food Chemistry,2019,286:669−677. doi: 10.1016/j.foodchem.2019.02.054
[34] ANAYA-LOYOLA M A, GARCIA-MARIN G, GARCIA-GUTIERREZ D G, et al. A mango (Mangifera indica L.) juice by-product reduces gastrointestinal and upper respiratory tract infection symptoms in children[J]. Food Research International,2020:136.
[35] MOHSEN E, YOUNIS I Y, FARAG M A. Metabolites profiling of Egyptian Rosa damascena Mill. flowers as analyzed via ultra-high-performance liquid chromatography-mass spectrometry and solid-phase microextraction gas chromatography-mass spectrometry in relation to its anti-collagenase skin effect[J]. Industrial Crops and Products,2020:155.
[36] DORTA E, GONZALEZ M, GLORIA L M, et al. Screening of phenolic compounds in by-product extracts from mangoes (Mangifera indica L.) by HPLC-ESI-QTOF-MS and multivariate analysis for use as a food ingredient[J]. Food Research International,2014,57:51−60. doi: 10.1016/j.foodres.2014.01.012
[37] 覃洁萍, 邓家刚, 冯钰锜, 等. 有机质谱分析在芒果苷原料药微量杂质结构鉴定中的应用[J]. 质谱学报,2008,29(4):218−225. [QIN J P, DENG J G, FENG Y K, et al. Application of organic mass spectrometry in the identification of trace impurities in mangiferin API[J]. Journal of Mass Spectrometry,2008,29(4):218−225.







 下载:
下载:
 下载:
下载:



