Extraction, Acetylation Modification and Structure Characterization of Hemicelluloses from Corncob
-
摘要: 以玉米芯为原料提取半纤维素,并对所提取的玉米芯半纤维素进行乙酰化改性。采用超声辅助碱法提取玉米芯半纤维素,浓硫酸(H2SO4)和单质碘(I2)共催化玉米芯半纤维素进行乙酰化改性;采用红外光谱(IR)、热重分析(TGA)和核磁共振光谱(NMR)对玉米芯半纤维素及其乙酰化产物进行表征。玉米芯半纤维素得率和提取率分别为33.7%和81.0%,其中半纤维素含量为85.3wt%,乙酰化产物产率和取代度(DS)分别为84.6%和1.27。超声辅助有效缩短了碱法提取玉米芯半纤维素的时间,且玉米芯半纤维素得率和提取率均得到提高。H2SO4和I2是半纤维素乙酰化改性的高效共催化体系,IR和NMR结果表明半纤维素被成功改性,改性产物中存在乙酰基,TGA分析表明乙酰化产物热稳定性增加,且DS值适中,有望进一步用于制备可生物降解的食品包装材料。Abstract: Hemicellulose was extracted from corncob and further modified by acetylation. Ultrasonic-assisted alkali method was employed for the extraction, in which sulfuric acid (H2SO4) and elemental iodine (I2) were used as co-catalyst for the acetylation of hemicellulose, respectively. Corncob hemicellulose and its acetylated products were characterized by infrared spectroscopy (IR), thermogravimetric analysis (TGA) and nuclear magnetic resonance (NMR). The yield and extraction rate of corncob hemicellulose were 33.7% and 81.0%, and the hemicellulose content reached 85.3wt%. The acetylation of corncob hemicellulose gave 84.6% yield and 1.27 degree of substitution (DS), respectively. The separation of hemicellulose from corncob using alkali method was effectively shortened by ultrasonic assistance, and the yield and extraction rate of corncob hemicellulose were improved. Concentrated sulfuric acid (H2SO4) and elemental iodine (I2) were effective co-catalyst for the acetylation of corncob hemicellulose. The results of IR and NMR showed that hemicelluloses were acetylated successfully, and TGA revealed that the thermal stability of the acetylated hemicellulose was improved. Moreover, the DS value of the acetylated product was moderate. Therefore, the acetylated product is expected to be used to prepare biodegradable materials for food packaging.
-
Keywords:
- ultrasonic assistance /
- corncob /
- hemicellulose /
- alkaline extraction /
- acetylation /
- structure characterization
-
木质纤维素是地球上含量最丰富的生物质资源,主要由纤维素、半纤维素和木质素组成,其中,半纤维素是仅次于纤维素的天然碳水化合物[1-2]。由于具有来源丰富、可再生、可生物降解和绿色环保等优点,半纤维素已逐渐显示出重要的应用前景。
酸碱法、蒸汽爆破、水热萃取、溶剂萃取、超声以及微波辅助等方法都已被用于半纤维素的提取[3-4],其中,碱抽提法是提取半纤维素的常用方法。Lopez等[5]采用氢氧化钠(NaOH)溶液处理大麦秸秆,半纤维素提取率达到56%。Peng等[6]采用NaOH溶液逐步提取竹子半纤维素,分离得到7种半纤维素组分,总提取率达到80.1%。玉米芯是一种来源广泛的农作物秸秆,半纤维素含量较高,通常为35wt%~40wt%,碱法提取玉米芯半纤维素也得到了广泛研究。罗兰萍等[7]采用NaOH溶液提取玉米芯半纤维素,得率为28.2%。尽管碱法提取半纤维素已经取得了较好的结果,提取率、纯度和聚合度均较高,且半纤维素的结构能够得到较好地保留,但提取条件较为苛刻,腐蚀性较强。
超声波辅助法具有高效、低能耗、环境友好及分离条件温和等优点。与传统提取方法相比,采用超声辅助可以提高半纤维素的提取率且提取条件相对温和。超声波辅助碱法已被用于半纤维素的提取,Sun等[8]研究了超声波辅助碱法提取小麦秸秆半纤维素,与传统碱法提取相比,半纤维素产率提高了1.8%,所得半纤维素具有更高的纯度及热稳定性。Xie等[9]采用超声波辅助碱法提取甘蔗渣半纤维素,在超声处理28 min,KOH浓度为3.7%,半纤维素产率为23.1%,与未采用超声辅助的提取过程相比,半纤维素产率提高了3.24%。
由于半纤维素富含羟基,因而具有极强的亲水性,力学性能较差,在一定程度上限制了其应用。利用半纤维素分子链上的羟基与酸酐和酰氯等发生酰化反应可以改善半纤维素的性质并拓展其用途,N,N-二甲基甲酰胺(DMF)/氯化锂(LiCl)是半纤维素乙酰化的常见反应体系。Sun等[10]以4-二甲胺基吡啶为催化剂,在DMF/LiCl体系中研究了天然半纤维素与乙酸酐反应,制备了取代度(Degree of substitution,DS)介于0.74~1.49的半纤维素乙酸酯。Xu等[11]以N-溴代丁二酰亚胺为催化剂,采用微波法研究了麦秆半纤维素与酰氯反应,产物DS值为1.34。在上述乙酰化反应中,半纤维素没有发生明显降解,产物的热稳定性得以提高,有利于拓展半纤维素的应用范围,但反应体系复杂,产物产率不高。
以玉米芯为原料,采用超声辅助碱法提取玉米芯半纤维素,并进一步对所提取的玉米芯半纤维素进行乙酰化改性及结构表征。以半纤维素(85wt%木聚糖)为模型化合物优化改性条件,构建半纤维素乙酰化的高效催化体系。在此基础上研究玉米芯半纤维素的乙酰化性能,探索分离提取玉米芯半纤维素及其改性的高效途径,为进一步利用半纤维素制备可降解包装材料提供基础。
1. 材料与方法
1.1 材料与仪器
半纤维素(85wt%木聚糖)、单质碘(I2) 阿拉丁生化科技股份有限公司;玉米芯 取自武汉周边农村;去离子水 自制;甲苯、无水乙醇、浓硫酸(H2SO4,98wt%)、亚氯酸钠(NaClO2)、氢氧化钠(NaOH)、乙酸和乙酸酐等 均为分析纯,国药集团化学试剂有限公司。
SE750高速粉碎机 永康市圣象电器有限公司;赛默飞is50红外光谱仪 美国Bruker公司;Perkin Elmer热分析仪 美国Perkin Elmer公司;Bruck-DRX 400核磁共振仪 美国Varian公司;LGJ-10C冷冻干燥机 四环福瑞科仪科技发展有限公司、XO -5200DTS超声波清洗器 南京先欧仪器制造有限公司。
1.2 实验方法
1.2.1 玉米芯半纤维素的提取
参照文献[12]对玉米芯进行脱杂处理,得到脱杂玉米芯,按照表1的实验条件提取玉米芯半纤维素。将2 g脱杂玉米芯和40 mL 0.7wt% NaClO2溶液(固液比为1:20,g/mL)300 W超声,加入装有回流冷凝管和滴液漏斗的250 mL烧瓶中,用0.3 mL乙酸调节pH至4.0。将烧瓶置于80 ℃水浴中,搅拌反应,然后滴加40 mL 0.7wt% NaClO2溶液,并用乙酸调节至pH为4.0,继续搅拌反应。反应完成后,冷却至室温,5000 r/min离心10 min,弃去上层清液,用蒸馏水洗涤沉淀至中性,冷冻干燥10 h,即得综纤维素。
表 1 玉米芯半纤维素的提取条件Table 1. Conditions of extracting hemicelluloses from corncob序号 NaClO2处理前
超声时间(h)NaClO2处理
时间(h)NaOH处理前
超声时间(h)NaOH处理
时间(h)1 0 2 0 2 2 0 2 0 4 3 0 2 0 5 4 0.5 1 0 4 5 0.5 2 0 4 6 0 2 0.5 2 7 0 2 0.5 4 8 0.5 1 0.5 2 将所得到的综纤维素加入到6wt% NaOH的溶液(固液比为1:25,g/mL)中,300 W超声,60 ℃搅拌反应,冷却至室温,抽滤,用乙酸调节滤液至pH为5.5,然后加入3倍体积的无水乙醇,静置30 min,有沉淀析出,离心,回收固体,用50 mL 70wt%乙醇洗涤2次,冷冻干燥10 h,即得玉米芯半纤维素。参照文献测定纤维素含量[13]、半纤维素含量[13-14]、木质素含量[15]和灰分含量[14]。
1.2.2 半纤维素的乙酰化改性
1.2.2.1 半纤维素的乙酰化改性反应
向100 mL烧瓶中加入1 g半纤维素和2.5 mL乙酸,60 ℃加热5 min。将混合物迅速冷却至25 ℃,相继加入10 mL乙酸酐和催化剂,加热至60 ℃,继续搅拌反应6 h,反应完成后,冷却至室温。向反应混合物中加入2.5 mL饱和亚硫酸钠溶液,搅拌至反应液由黑色变成无色为止。加入150 mL 95%乙醇,5000 r/min离心10 min,收集沉淀物,用95%乙醇洗涤,冷冻干燥10 h,即得乙酰化半纤维素,参照文献[16]测定其DS值。
1.2.2.2 半纤维素乙酰化改性的单因素实验
以乙酰化半纤维素的产率和DS值为指标进行单因素实验。单催化体系中单独采用H2SO4或I2作催化剂,考察H2SO4或I2用量对半纤维素乙酰化改性的影响。半纤维素与乙酸酐的配比为1:10(g/mL),反应温度为60 ℃,反应时间为6 h,采用H2SO4作催化剂时,用量分别为80、90、100、110、120 µL;采用I2作催化剂时,用量分别为0.025、0.050、0.075、0.090、0.100 g。共催化体系中同时加入H2SO4和I2作催化剂,考察I2的用量对半纤维素乙酰化改性的影响。H2SO4用量为100 µL,半纤维素与乙酸酐的配比为1:10(g/mL),反应温度为60 ℃,反应时间为6 h,I2的用量分别为0.025、0.030、0.040、0.050、0.060、0.075、0.100 g。
1.2.3 得率、提取率及产率计算
1.2.3.1 玉米芯半纤维素得率的计算
玉米芯半纤维素的得率按照式(1)进行计算:
得率(%)=m1m0×100 (1) 式中:m1:提取的玉米芯半纤维素量,g;m0:脱杂玉米芯的加入量,g。
1.2.3.2 玉米芯半纤维素提取率的计算
玉米芯半纤维素的提取率按照式(2)进行计算:
提取率(%)=得率×玉米芯半纤维素中的半纤维素含量脱杂玉米芯中的半纤维素含量 (2) 1.2.3.3 乙酰化半纤维素产率的计算
乙酰化半纤维素的产率按照式(3)进行计算:
产率(%)=132m2216m×100 (3) 式中:m:半纤维素加入量,g;m2:乙酰化半纤维素的实际生成量,g;132:半纤维素结构单元的分子量,g/mol;216:乙酰化半纤维素结构单元的分子量,g/mol。
1.3 产物表征
1.3.1 玉米芯及其衍生物的红外光谱(Infrared spectroscopy,IR)表征
IR表征在Thermo Fisher is50型红外光谱仪上进行,采用KBr压片,扫描范围为4000~400 cm−1。
1.3.2 玉米芯半纤维素及其改性产物的热重分析(Thermogravimetric analysis,TGA)
TGA在Perkin热重分析仪上进行,将被测样品于105 ℃干燥2 h,以空白氧化铝坩埚为参比,氮气为保护气体,升温速率为10 ℃/min,从室温加热到700 ℃。
1.3.3 玉米芯半纤维素及其改性产物的核磁共振(Nuclear magnetic resonance, NMR)表征
1H NMR和13C NMR表征在Bruck-DRX 400 NMR核磁共振波谱仪上进行,取50 mg被测样品溶于1 mL D2O中,在25 ℃的条件下,采用400和100 MHz分别测定1H NMR和13C NMR。
1.4 数据处理
以上实验均重复三次,取平均值,经Office Excel 2010软件进行整理,采用SPSS 22.0进行显著性分析(P>0.05表示影响不显著,P<0.05表示影响显著)、Origin 8.0软件作图。
2. 结果与分析
2.1 玉米芯的组成
测定了玉米芯以及脱杂玉米芯的组成,结果如图1所示。图1表明,玉米芯中的半纤维素含量较高,与纤维素含量相近,分别为33.0wt%和33.2wt%,经过抽提后,半纤维素、纤维素、木质素和灰分等组分的含量均略有增加,这是由于在抽提过程中脱除了可溶性杂质[17],其中,半纤维素含量由33.0wt%升高至35.5wt%。
2.2 超声辅助提取半纤维素
首先研究了两步碱法提取玉米芯半纤维素,结果如表2所示。采用0.7wt% NaClO2溶液和6wt% NaOH溶液依次对玉米芯进行处理,玉米芯半纤维素得率和半纤维素含量(纯度)分别为29.8%和81.7wt%。与脱杂玉米芯相比,玉米芯半纤维素的组成发生了明显变化,纤维素、木质素和灰分含量较低,分别为5.6wt%、4.2wt%和2.3wt%,而半纤维素的含量达到81.7wt%。将第二步反应时间由2 h延长至4 h,玉米芯半纤维素得率和半纤维素含量均略有升高,分别增加至31.7%和85.4wt%。此后,继续延长反应时间,半纤维素的得率及组成基本保持不变。
表 2 超声辅助碱法提取玉米芯半纤维素Table 2. Extraction of hemicelluloses from corncob by ultrasonic-assisted alkaline method序号 碱处理时间(h) 半纤维素 半纤维素组成(wt%) 第一步 第二步 得率(%) 提取率(%) 半纤维素含量 纤维素含量 木质素含量 灰分含量 1 2 2 29.8±0.6 68.6±0.8 81.7±1.2 5.6±0.2 4.2±0.2 2.3±0.2 2 2 4 31.7±0.3 76.3±1.4 85.4±1.3 2.7±0.1 3.0±0.3 2.4±0.1 3 2 5 31.8±0.5 76.3±1.2 85.2±0.6 2.8±0.3 2.9±0.1 2.4±0.2 4 1 4 31.9±0.2 76.5±1.1 85.1±0.8 3.0±0.2 2.8±0.2 2.2±0.1 5 2 4 30.5±0.5 73.2±0.9 85.2±1.1 2.8±0.1 2.7±0.1 2.2±0.2 6 2 2 33.2±0.3 77.9±1.3 83.3±1.4 3.7±0.2 3.2±0.3 2.6±0.1 7 2 4 32.7±0.4 78.2±1.5 84.9±0.9 4.1±0.2 4.3±0.1 2.8±0.3 8 1 2 33.7±0.4 81.0±1.2 85.3±1.4 2.9±0.1 3.1±0.1 2.1±0.1 在两步碱法的基础上采用超声辅助提取玉米芯半纤维素,考察了超声辅助对半纤维素得率、提取率及组成的影响。首先保持第二步碱处理的时间4 h不变,在第一步碱处理前超声0.5 h。表2的结果表明,与未超声相比,在第一步碱处理时间为1 h时,玉米芯半纤维素得率和含量基本保持不变,而当提取条件与未超声相同时,半纤维素得率反而有所降低,由31.7%下降至30.5%,表明较长的提取时间可能促进了半纤维素的水解。表2的结果还表明,在第二步碱处理前超声处理0.5 h,将第二步碱处理时间由4 h缩短至2 h,玉米芯半纤维素的得率反而升高,由31.7%增加至33.2%。当在两步碱处理前均进行超声处理时,第一步和第二步碱处理时间分别为1 h和2 h时,玉米芯半纤维素的得率和含量分别为33.7%和85.3wt%,半纤维素提取率达到81.0%。与未采用超声相比,得率和提取率增加,而提取时间明显缩短。这些结果表明,采用超声辅助处理可以有效缩短碱处理时间。
2.3 半纤维素的改性
2.3.1 半纤维素的单催化体系
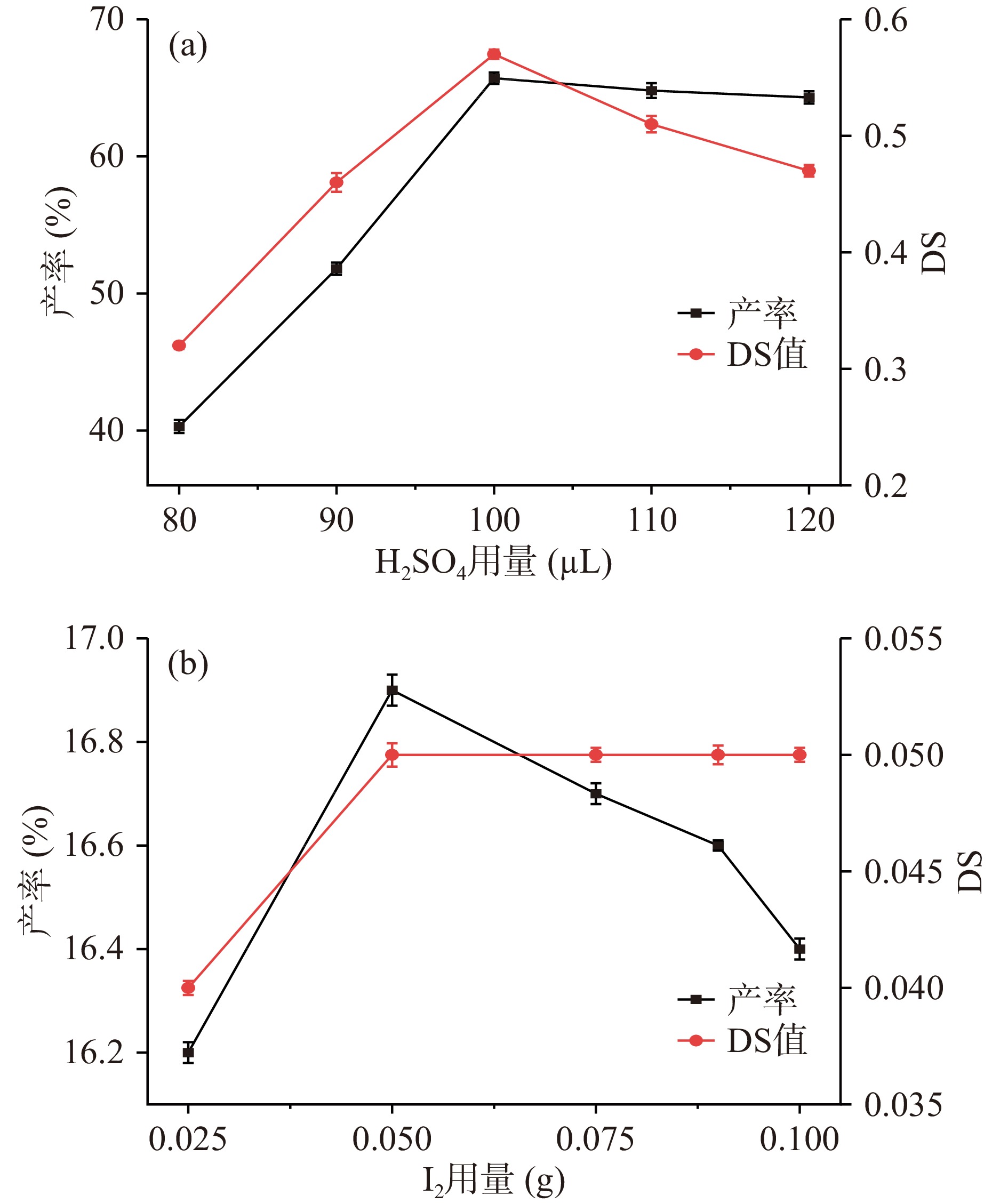
H2SO4是半纤维素乙酰化的常见催化剂,因此,首先考察了H2SO4用量对半纤维素模型化合物木聚糖的乙酰化过程的影响,结果如图2所示。图2a结果表明,H2SO4用量对产率的影响较为明显,随着H2SO4用量的增加,乙酰化产物的产率和DS值均呈现先增加后降低的趋势,并在H2SO4用量为100 μL时达到最大。此后,继续增大H2SO4用量,产率和DS值开始逐渐降低。由图2a可以看出,H2SO4不能有效催化半纤维素的乙酰化,产物产率和DS值均较低,分别在40.3%~65.7%和0.32~0.57的范围内小幅变化。
I2也被用作乙酰化反应的催化剂[18],图2b的结果表明,当采用I2单独作催化剂时,乙酰化半纤维素模型化合物木聚糖的DS值极低,均在0.05左右,不存在明显差异。此外,乙酰化产物的产率也较低,在I2用量为0.05 g时,产物产率相对较大,但也仅为16.9%。改变I2的用量,DS值几乎没有变化。图2结果表明,无论是采用H2SO4还是I2单独作催化剂,两者均不能有效催化半纤维素的乙酰化改性。
2.3.2 半纤维素的共催化体系
进一步研究了H2SO4和I2共催化半纤维素模型化合物木聚糖的乙酰化,结果如图3所示。当H2SO4用量为100 µL时,乙酰化半纤维素的产率和DS值随着I2用量的增加而升高,并在I2用量为0.05 g时达到最大,产物产率和DS值分别为85.7%和1.33,较H2SO4和I2单独作催化剂时均有大幅提高,表明H2SO4和I2间存在协同催化作用。此后,继续增加I2用量,产物产率和DS值反而降低,当I2用量增加至0.10 g时,产率和DS值已分别降至75.0%和0.6,这可能是由于过量的催化剂引起乙酰化产物发生降解所致[19]。
2.3.3 验证试验
在半纤维素(85wt%木聚糖)模型化合物乙酰化改性基础上,进一步采用H2SO4和I2共催化超声辅助碱法提取的玉米芯半纤维素的乙酰化改性,在两者用量分别为100 µL和0.05 g时,乙酰化产物的产率和DS值分别为84.6%和1.27,与半纤维素模型化合物的85.7%和1.33十分接近,表明超声辅助碱法所提取的玉米芯半纤维素也具有良好的乙酰化性能,进一步证实超声辅助碱法是提取半纤维素的有效方法,也为玉米芯半纤维素的进一步高值化利用提供了基础。
2.4 产物表征
2.4.1 玉米芯及其衍生物的IR表征
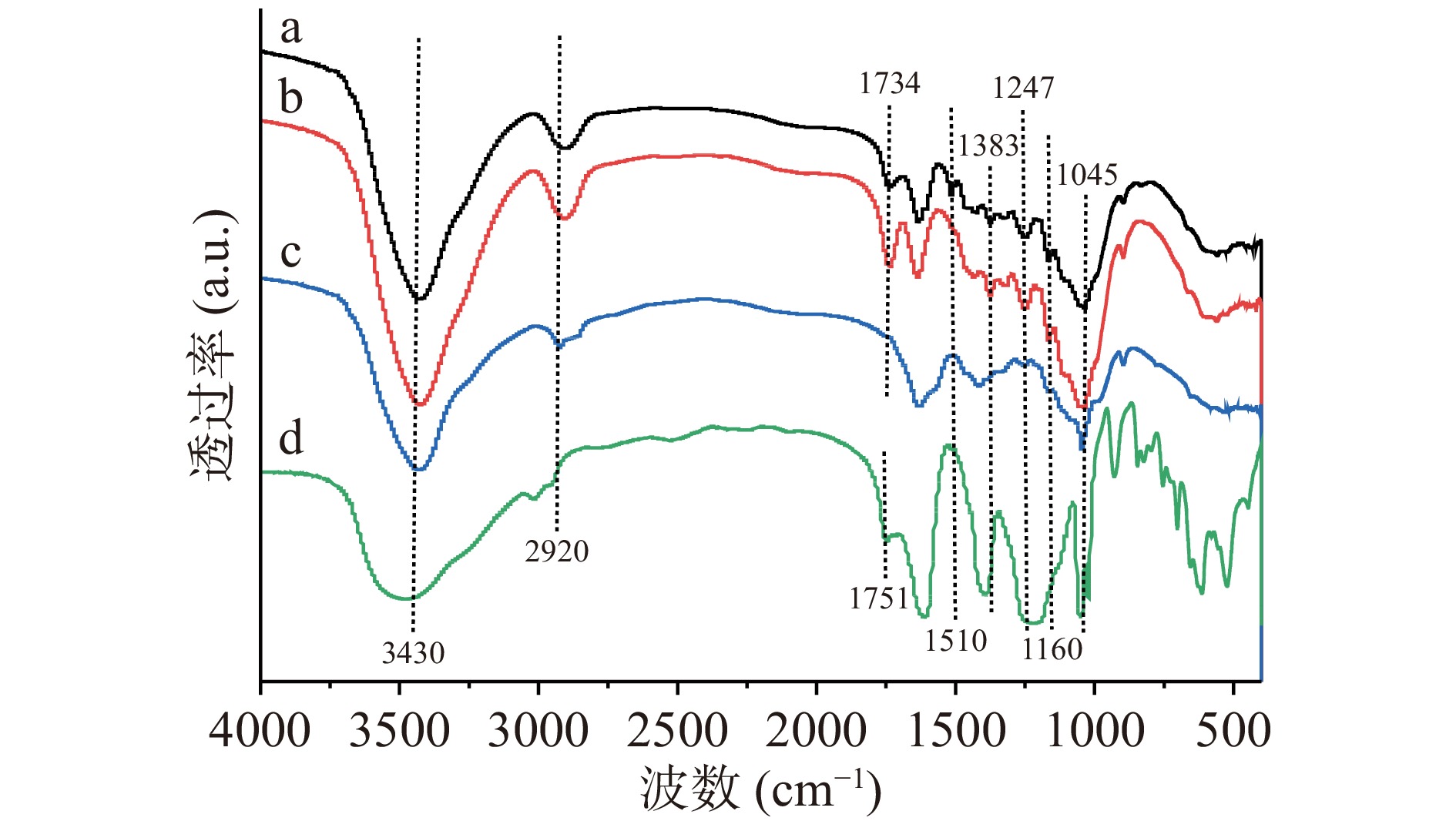
玉米芯及其衍生物的IR谱图如图4所示。在脱杂玉米芯的IR谱图(曲线a)中,3430和2920 cm−1处的吸收峰分别是由分子内-OH的伸缩振动和C-H键的不对称伸缩振动引起的;1734和1045 cm−1处的吸收峰归属于半纤维素的典型特征吸收峰,对应于木聚糖脂族C=O和吡喃糖环C-O-C的伸缩振动[20];1510 cm−1处的吸收峰归属于木质素中的芳族C-C伸缩振动[21],1160 cm−1处的吸收峰是由纤维素的C-O-C伸缩振动引起的[22]。在综纤维素的IR谱图(曲线b)中,1510 cm−1处的吸收峰几乎完全消失,表明所提取的综纤维素几乎不含木质素,与木质素实现了有效分离。在玉米芯半纤维素的IR谱图(曲线c)中,半纤维素在1045 cm−1处的特征吸收峰强度明显增加,但并未观察到1734 cm−1处的特征峰,这是由于采用强碱溶液对综纤维素进行处理时,半纤维素的乙酰基会发生脱落,导致了该特征峰的消失[23-24]。此外,1510和1160 cm−1处分别归属于木质素和纤维素的特征吸收峰几乎完全消失,表明所提取的半纤维素纯度较高,几乎不含木质素和纤维素。与玉米芯半纤维素相比,在玉米芯半纤维素乙酰化产物的IR谱图(曲线d)中,3430 cm−1附近的-OH伸缩振动明显减弱,表明部分-OH参与了反应;此外还观察到了对应于酯键的特征吸收峰,在1751 cm−1处出现了C=O的伸缩振动峰,而1383和1247 cm−1处分别归属于C-C和C-O的特征吸收峰也增强,这些结果均证实了玉米芯半纤维素乙酰化反应的发生[25]。
2.4.2 玉米芯半纤维素及改性产物的TG分析
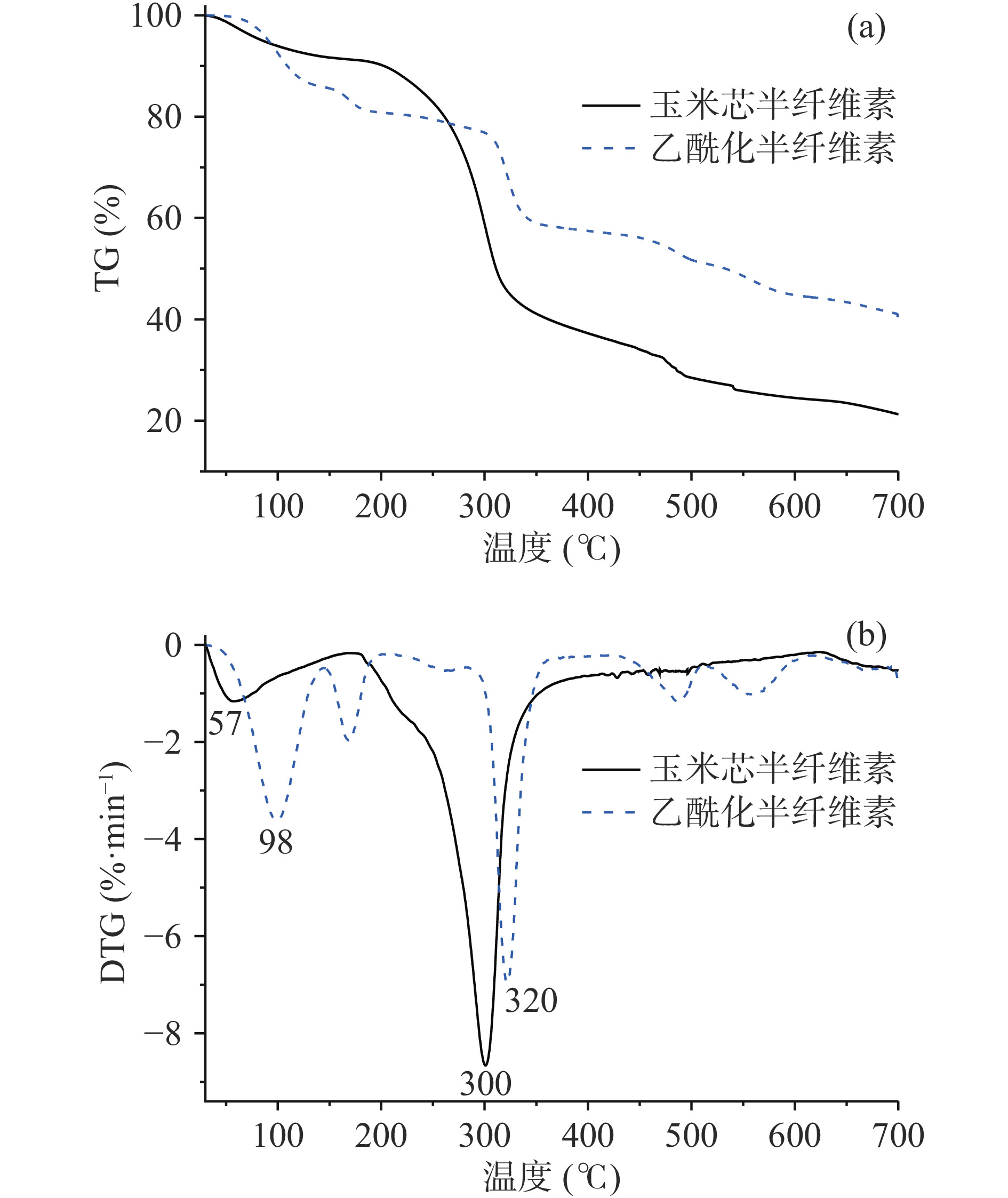
对玉米芯半纤维素及其改性产物进行了TG分析,TG和热导(DTG)曲线分别如图5所示。由图5a可以看出,玉米芯半纤维素的失重大致分为三个阶段:在180 ℃之前,只有少量的失重,失重率为8.9%,在此过程中主要是失去物理吸附水及低沸点杂质[25];样品的主要失重范围在180~600 ℃之间,这是由于半纤维素糖单元断裂分解成小分子气体及大分子可冷凝挥发组分所引起的[26];在600 ℃以后只有少量失重,可能是由于深度热裂解所致,剩余少量的残留物可能为灰分等无机杂质[24]。乙酰化玉米芯半纤维素的主要失重范围在200~700 ℃之间,失重率约为40%。当温度超过700 ℃时,仍有约40%的残留量,这可能是由于样品中剩余部分逐步形成石墨结构,同时可能还含有一部分无机杂质[26]。
由图5b可知,玉米芯半纤维素的DTG曲线中出现两个明显的降解峰,分别对应水分和半纤维素分解所产生的易挥发组分的析出,降解温度分别为57和300 ℃,最大热解失重速率发生在300 ℃。乙酰化玉米芯半纤维素的DTG曲线中也出现了对应于水分和乙酰化玉米芯半纤维素分解所产生的易挥发组分的析出,降解温度分别为98和320 ℃。与玉米芯半纤维素相比,乙酰化玉米芯半纤维素的分解温度升高,表明改性产物的热稳定性增加[27]。
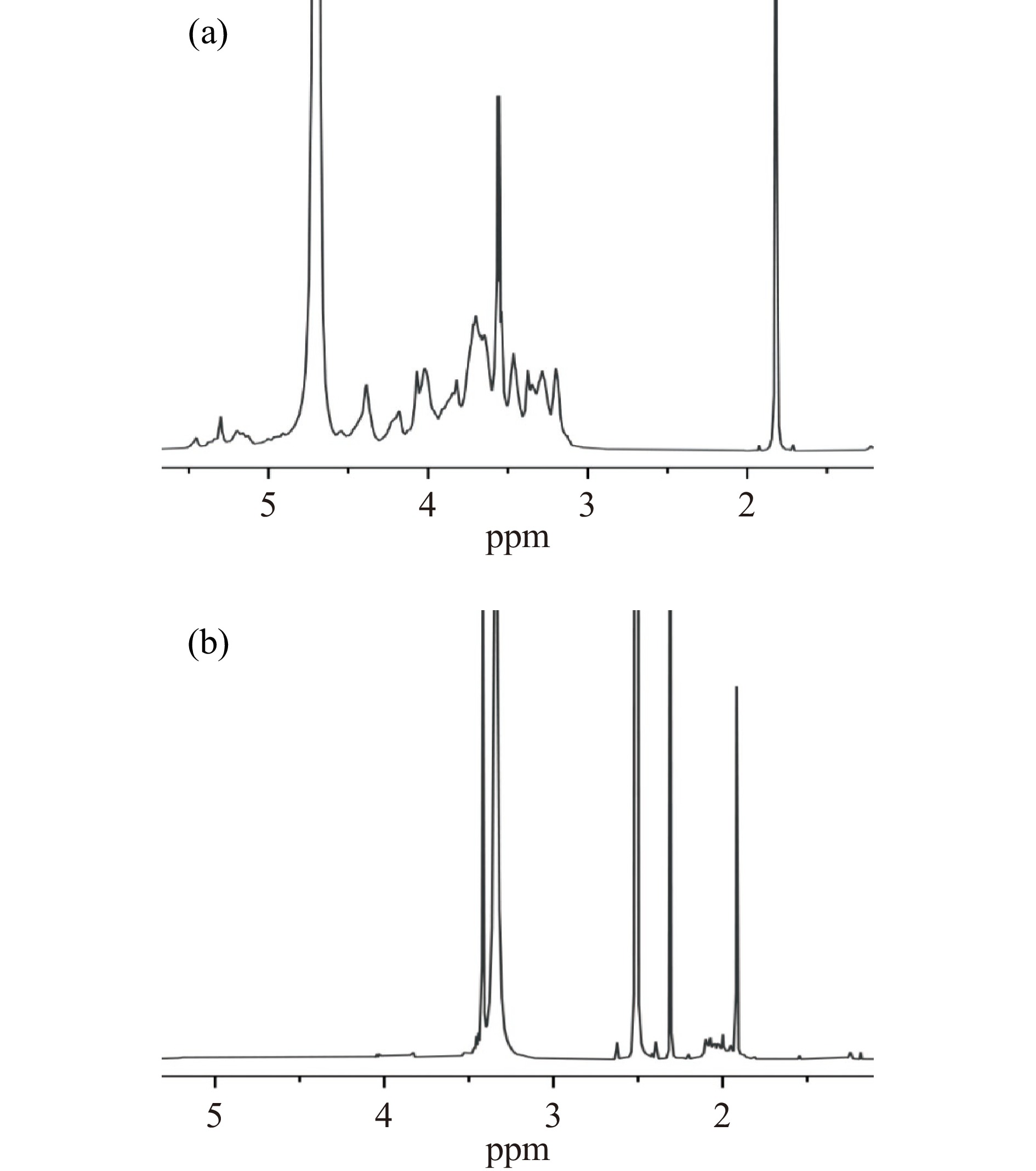
2.4.3 玉米芯半纤维素及改性产物的NMR表征
玉米芯半纤维素及其改性产物的1H NMR如图6所示。在图6a中,3.20~5.30 ppm是L-呋喃阿拉伯糖、D-吡喃木糖以及4-O-甲基-α-D-葡萄糖醛酸的质子信号峰。5.30 ppm处是连接在木糖C-3位上的阿拉伯糖的质子(H-1)信号峰[28]。4.38、3.84、3.82、3.46和3.10 ppm处分别对应于木糖单元中H-1、H-5、H-4、H-3及H-2位的信号峰。3.65、3.54、3.29和3.19 ppm处分别对应于4-O-甲基-α-D-葡萄糖醛酸中H-3、H-2、-OCH3中的H和H-4的信号峰,其中3.54 ppm处信号峰表明4-O-甲基-α-D-葡萄糖醛酸连接在木糖C-2位置[28]。5.16 ppm处的共振峰是由α-D-呋喃阿拉伯糖基的端基质子产生的,表明木糖骨架的C-2和C-3位置发生了侧链取代[29]。1.82 ppm处可能是半纤维素中甲基和亚甲基的质子信号峰,4.70 ppm处的强峰则可能是由残留溶剂D2O产生的[30]。由图6b可知,在改性半纤维素的1H NMR谱图中,除了半纤维素的特征信号峰外,在2.00 ppm处还出现了归属于乙酰基的质子信号峰[19],结合图4的IR结果可知,半纤维素的乙酰基在碱处理过程发生脱落,表明该乙酰基来自乙酰化反应。
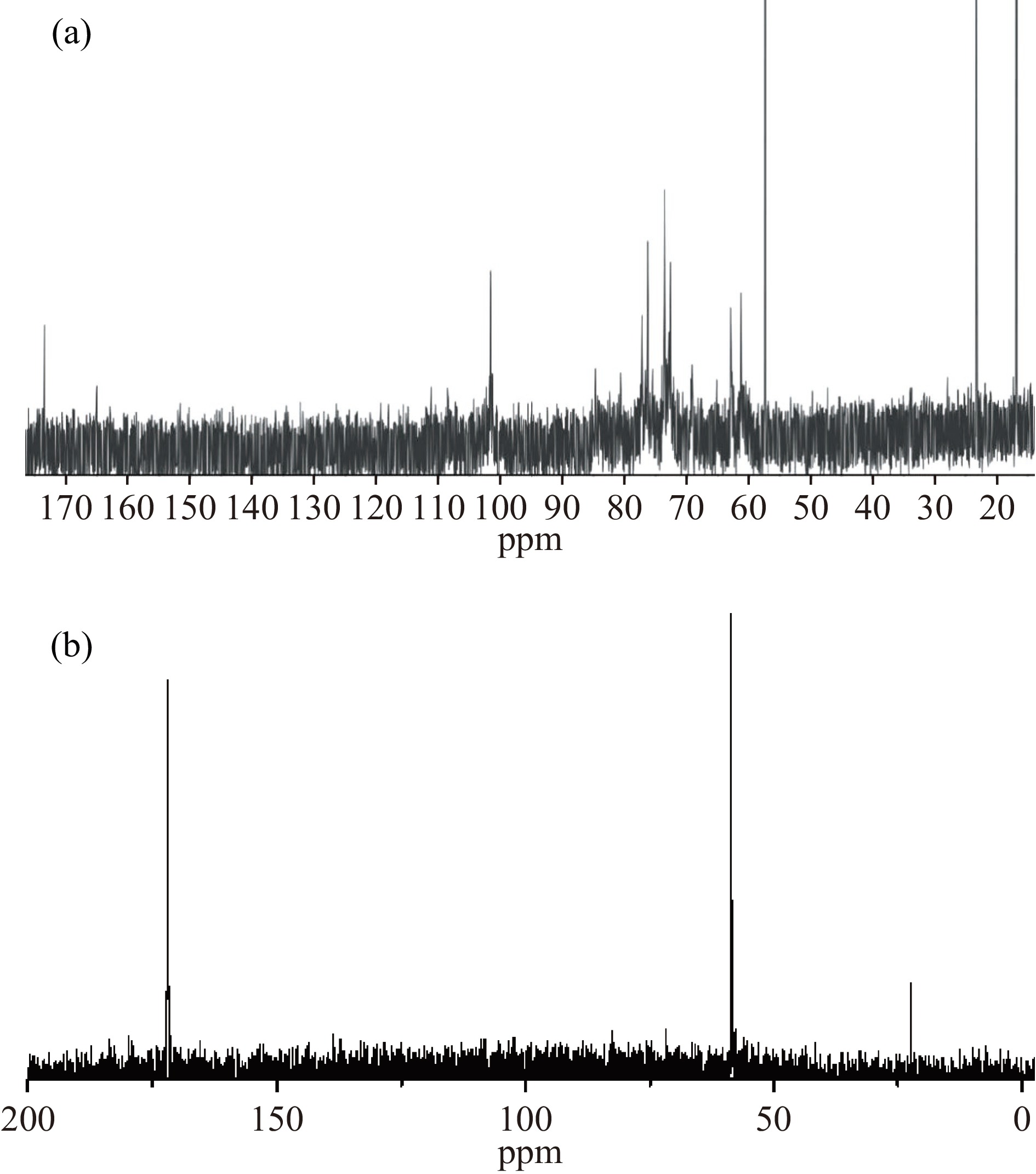
玉米芯半纤维素及其改性产物的13C NMR如图7所示。在101.62、76.29、73.61、72.66和62.90 ppm处的信号峰分别对应于β-D-吡喃木糖的C-1、C-4、C-3、C-2和C-5的信号峰。其中,101.62 ppm处的信号峰表明木糖单元以β-糖苷键连接形成半纤维素的主链。105.51、84.5、82.9、80.57和61.26 ppm处的信号峰分别对应于L-呋喃阿拉伯糖C-1、C-4、C-3、C-2和C-5位。此外,在59.29 ppm处为-OCH3的C信号峰,来自于4-O-甲基-葡萄糖醛酸[31]。在图7a中,未观察到20.0 ppm附近乙酰基的信号峰,表明在碱法提取半纤维素的过程中乙酰基发生了脱落,与IR和1H NMR的结果一致。而由图7b可以看出,在20.9和171.9 ppm处分别出现了乙酰基的甲基C及羰基C的峰信号[26],表明玉米芯半纤维素发生了乙酰化反应。IR和NMR的结果表明,碱法提取的玉米芯半纤维素是以β-D-吡喃木糖形成的木聚糖为主链,在木糖基的C-3位上连有L-呋喃阿拉伯糖基和C-2位上连接着4-O-甲基-葡萄糖醛酸的多聚糖。
3. 结论
采用超声辅助碱法是提取玉米芯半纤维素的有效途径,与未采用超声相比,碱处理时间缩短,玉米芯半纤维素的得率和纯度均明显升高,分别由29.8%升至33.7%和81.7wt%升至85.3wt%,半纤维素提取率达到81.0%。构建了半纤维素乙酰化的高效共催化体系,在H2SO4和I2共催化作用下,玉米芯半纤维素具有良好的乙酰化性能,乙酰化产物的产率和DS值分别为84.6%和1.27,较单独采用H2SO4或I2作催化明显增加。IR、TGA和NMR的结果表明,酯化改性成功地将乙酰基引入到了玉米芯半纤维素分子中,并且乙酰化半纤维素的热稳定性增加,为拓展半纤维素的用途提供了基础。
-
表 1 玉米芯半纤维素的提取条件
Table 1 Conditions of extracting hemicelluloses from corncob
序号 NaClO2处理前
超声时间(h)NaClO2处理
时间(h)NaOH处理前
超声时间(h)NaOH处理
时间(h)1 0 2 0 2 2 0 2 0 4 3 0 2 0 5 4 0.5 1 0 4 5 0.5 2 0 4 6 0 2 0.5 2 7 0 2 0.5 4 8 0.5 1 0.5 2 表 2 超声辅助碱法提取玉米芯半纤维素
Table 2 Extraction of hemicelluloses from corncob by ultrasonic-assisted alkaline method
序号 碱处理时间(h) 半纤维素 半纤维素组成(wt%) 第一步 第二步 得率(%) 提取率(%) 半纤维素含量 纤维素含量 木质素含量 灰分含量 1 2 2 29.8±0.6 68.6±0.8 81.7±1.2 5.6±0.2 4.2±0.2 2.3±0.2 2 2 4 31.7±0.3 76.3±1.4 85.4±1.3 2.7±0.1 3.0±0.3 2.4±0.1 3 2 5 31.8±0.5 76.3±1.2 85.2±0.6 2.8±0.3 2.9±0.1 2.4±0.2 4 1 4 31.9±0.2 76.5±1.1 85.1±0.8 3.0±0.2 2.8±0.2 2.2±0.1 5 2 4 30.5±0.5 73.2±0.9 85.2±1.1 2.8±0.1 2.7±0.1 2.2±0.2 6 2 2 33.2±0.3 77.9±1.3 83.3±1.4 3.7±0.2 3.2±0.3 2.6±0.1 7 2 4 32.7±0.4 78.2±1.5 84.9±0.9 4.1±0.2 4.3±0.1 2.8±0.3 8 1 2 33.7±0.4 81.0±1.2 85.3±1.4 2.9±0.1 3.1±0.1 2.1±0.1 -
[1] HOSSEINI S E, WAHID M A. Hydrogen production from renewable and sustainable energy resources: Promising green energy carrier for clean development[J]. Renewable and Sustainable Energy Reviews,2016,57(5):850−866.
[2] 刘明华. 生物质的开发与利用[M]. 北京: 化学工业出版社, 2012. LIU Minghua. Development and utilization of biomass[M]. Bejing: Chemical Industry Press, 2012.
[3] CHEN H, LIU J, CHANG X, et al. A review on the pretreatment of lignocellulose for high-value chemicals[J]. Fuel Processing Technology,2017,160:196−206. doi: 10.1016/j.fuproc.2016.12.007
[4] AREVALO-GALLEGOS A, AHMAD Z, ASGHER M, et al. Lignocellulose: A sustainable material to produce value-added products with a zero waste approach-A review[J]. International Journal of Biological Macromolecules,2017,99(6):308−318.
[5] LOPEZ S D, TISSOT M, DELMAS M. Integrated cereal straw valorization by an alkaline pre-extraction of hemicellulose prior to soda-anthraquinone pulping. Case study of barley straw[J]. Biomass & Bioenergy,1996,10(4):201−211.
[6] PENG P, PENG F, BIAN J, et al. Isolation and structural characterization of hemicellulose from the bamboo species Phyllostachys incarnata Wen[J]. Carbohydrate Polymers,2011,86(2):883. doi: 10.1016/j.carbpol.2011.05.038
[7] 罗兰萍, 李翔. 玉米芯半纤维素的制备及表征[J]. 粮食与油脂,2020,33(6):88−91. [LUO Lanping, LI Xiang. Preparation and characterization of corncob hemicellulose[J]. Cereals & Oils,2020,33(6):88−91. doi: 10.3969/j.issn.1008-9578.2020.06.024 [8] SUN R C, TOMKINSON J. Characterization of hemicelluloses obtained by classical and ultrasonically assisted extractions from wheat straw[J]. Carbohydrate Polymers,2002,50(3):263−271. doi: 10.1016/S0144-8617(02)00037-1
[9] XIE Y, GUO X, MA Z. Efficient extraction and structural characterization of hemicellulose from sugarcane bagasse pith[J]. Polymers,2020,12(3):608−620. doi: 10.3390/polym12030608
[10] SUN R C, FANG J M, TOMKINSON J, et al. Acetylation of wheat straw hemicelluloses in N, N-dimethylacetamide/LiCl solvent system[J]. Industrial Crops & Products,1999,10(3):209−218.
[11] XU F, JIANG J X, SUN R C, et al. Rapid esterification of wheat straw hemicelluloses induced by microwave irradiation[J]. Carbohydrate Polymers,2008,73(4):612−620. doi: 10.1016/j.carbpol.2008.01.002
[12] FAN G, WANG M, LIAO C, et al. Islation of cellulose from rice straw and its conversion into cellulose acetate catalyzed by phosphotungstic acid[J]. Carbohydrate Polymers,2013,94(1):71−76. doi: 10.1016/j.carbpol.2013.01.073
[13] 李雅丽, 刘娟, 高锦红. 农作物秸秆的热值及纤维素含量分析[J]. 化学与生物工程,2016,33(9):67−70. [LI Yali, LIU Juan, GAO Jinhong. Analysis of calorific value and cellulose content of crop straw[J]. Chemistry & Bioengineering,2016,33(9):67−70. doi: 10.3969/j.issn.1672-5425.2016.09.016 [14] WANG J Z, WANG Y X, FENG L I, et al. Determination of cellulose, hemicellulose and lignin in corn stalk[J]. Shandong Food Ferment,2010,3:44−47.
[15] 纪楷滨. 烟梗木质素的含量测定方法研究及结构表征[D]. 广州: 华南理工大学, 2013. JI Kaibin. Study on content determination method and structural characterization of lignin in tobacco stem[D]. Guangzhou: South China University of Technology, 2013.
[16] RAN B, BERGLUND J, VILAPLANA F, et al. The degree of acetylation affects the microbial degradability of mannans[J]. Polymer Degradation and Stability,2016,133(nov.):36−46.
[17] 张冰. 不同竹龄慈竹半纤维素和LCC的结构表征[D]. 北京: 北京林业大学, 2016. ZHANG Bing. Structural characterization of hemicellulose and LCC of neosinocalamus affinis at different ages[D]. Beijing: Beijing Forestry University, 2016.
[18] REN J L, SUN R C, LIU C F, et al. Acetylation of wheat straw hemicelluloses in ionic liquid using iodine as a catalyst[J]. Carbohydrate Polymers,2007,70(4):406−414. doi: 10.1016/j.carbpol.2007.04.022
[19] AYOUB A, VENDITTI R A, PAWLAK J J, et al. Development of an acetylation reaction of switchgrass hemicellulose in ionic liquid without catalyst[J]. Industrial Crops & Products,2013,44:306−314.
[20] LIU R, DU J, ZHANG Z, et al. Preparation of polyacrylic acid-grafted-acryloyl/hemicellulose (PAA-g-AH) hybrid films with high oxygen barrier performance[J]. Carbohydrate Polymers,2019,205(3):83−88.
[21] HUANG Y, WANG Z, WANG L, et al. Analysis of lignin aromatic structure in wood fractions based on IR spectroscopy[J]. Journal of Wood Chemistry and Technology,2016,36(5):377−382. doi: 10.1080/02773813.2016.1179325
[22] El-SAKHAWY M, KAMEL S, SALAMA A, et al. Preparation and infrared study of cellulose based amphiphilic materials[J]. Cellulose Chemistry and Technology,2018,52(3-4):193−200.
[23] 李蕊, 杨桂花, 吕高金, 等. 玉米秸秆半纤维素的逐级分离及其结构表征[J]. 中国造纸学报,2017,32(3):1−6. [LI Rui, YANG Guihua, LÜ Gaojin, et al. Separation and characterization of hemicelluloses of corn stalks[J]. Transactions of China Pulp and Paper,2017,32(3):1−6. doi: 10.11981/j.issn.1000-6842.2017.03.1 [24] LIAN H F, LING Y M, YA Y L, et al. Comparative study of water-soluble and alkali-soluble hemicelluloses extracted by hydrothermal pretreatment[J]. Paper & Biomaterials,2017,2(1):1−9.
[25] ABURTO J, THIEBAUD S, ALRIC I, et al. Properties of octanoated starch and its blends with polyethylene[J]. Carbohydrate Polymers,1997,34(1):101−112.
[26] 于庆雪. 玉米芯中半纤维素的水热法预提取及农林生物质半纤维素制备膜材料的研究[D]. 济南: 齐鲁工业大学, 2018. YU Qingxue. Corncob hemicelluloses with hot water extraction method and production of films prepared from agricultural and forestry biomass hemicelluloses[D]. Jinan: Qilu University of Technology, 2018.
[27] FANG J M, SUN R C, TOMKINSON J, et al. Acetylation of wheat straw hemicellulose B in a new non-aqueous swelling system[J]. Carbohydrate Polymers,2000,41(4):379−387. doi: 10.1016/S0144-8617(99)00102-2
[28] 黄曹兴, 何娟, 闵斗勇, 等. 毛竹竹青和竹黄半纤维素的提取与结构表征[J]. 林产化学与工业,2015,35(5):29−36. [HUANG Caoxing, HE Juan, MIN Douyong, et al. Isolation and characterization of hemicellulose from moso bamboo green and bamboo yellow[J]. Chemistry and Industry of Forest Products,2015,35(5):29−36. doi: 10.3969/j.issn.0253-2417.2015.05.006 [29] 李赫龙. 作物秸秆木质素和半纤维素的分离纯化及结构表征[D]. 杨凌: 西北农林科技大学, 2016. LI Helong. Isolation and structure characterization of lignin and hemicellulose from crop straw[D]. Yangling: Northwest A&F University, 2016.
[30] TELEMAN A, TENKANEN M, JACOBS A, et al. Characterization of O-acetyl-(4-O-methylglucurono) xylan isolated from birch and beech[J]. Carbohydrate Research,2002,337(4):373−377. doi: 10.1016/S0008-6215(01)00327-5
[31] GABRIELII I, GATENHOLM P, GLASSER W G, et al. Separation characterization and hydrogel-formation of hemicellulose from aspen wood[J]. Carbohydrate Polymers,2001,43(4):367−374.





 下载:
下载:




 下载:
下载:
