Effect of Ultra High Pressure on the Structure of Whey Protein Concentrate and Functional Analysis of Simulated Digestion Products in Vitro
-
摘要: 本研究旨在对超高压处理作用于乳清浓缩蛋白后结构的影响进行验证,通过体外模拟消化探究其进入人体消化过程后功能性的变化。通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)、圆二色谱、荧光光谱及紫外吸收光谱分析超高压对乳清浓缩蛋白结构的影响,再通过SDS-PAGE、粒度及Zeta电位分析其体外模拟消化后乳清浓缩蛋白分子变化,再对其体外模拟消化产物进行抗氧化性分析(ABTS+自由基清除率、DPPH自由基清除率及Fe3+还原力测定法)及对动物双歧杆菌BB-12的增殖效果的研究,确定最佳超高压条件及探究其消化前后功能性变化。结果表明,超高压处理对于乳清浓缩蛋白的三级结构有明显影响,在600 MPa、30 min对其三级结构的改变最大,而对于其一、二级结构的影响并不明显;证明在肠消化完成后乳清浓缩蛋白被完全水解为小分子肽或氨基酸,且超高压处理对于其胃消化后的分子量并无显著影响,与未消化样品无明显差异;随着体外模拟消化过程的进行,乳清浓缩蛋白粒度先减少后增大,Zeta电位绝对值先减小后增大;随着压力和时间的增加,未消化的乳清浓缩蛋白抗氧化性逐渐增强,胃消化和肠消化后的样品抗氧化性先增强后减弱;且未消化的样品在500 MPa、15 min促进双歧杆菌BB-12生长的效果最好,胃消化后的样品在200 MPa 30 min、300 MPa 30 min对其生长有促进效果,肠消化后的样品均对其生长有抑制作用。本研究结果为超高压技术应用乳品工业提供了进一步的理论基础。Abstract: The purpose of this study was to verify the effect of ultra-high pressure treatment on the structure of whey protein concentrate, and to explore its functional changes after entering the human digestive process through simulated digestion in vitro. The effects of ultra-high pressure on the structure of whey protein concentrate were analyzed by SDS-polyacrylamide gel electrophoresis (SDS-PAGE), circular dichroism, fluorescence spectrum and ultraviolet absorption spectrum. Then, the molecular changes of whey protein concentrate after simulated digestion in vitro were analyzed by SDS-PAGE, particle size and Zeta potential. Then the antioxidant activity of its simulated digestion products in vitro (ABTS+ free radical scavenging rate, DPPH free radical scavenging rate and Fe3+ reducing power) and the proliferation effect of animal Bifidobacterium BB-12 were studied to determine the optimal ultra-high pressure conditions and explore the functional changes before and after digestion. The results showed that, UHP treatment had a significant effect on the tertiary structure of whey protein concentrate, and the 600 MPa for 30 min had the greatest change in the tertiary structure, but the effect on the primary or secondary structure of protein was not significant. The whey protein concentrate was completely hydrolyzed into small peptides or amino acids after intestinal digestion, and the ultrahigh pressure treatment had no significant effect on the molecular weight of the stomach after digestion, and there was no significant difference between the whey protein and the undigested sample. With the simulated digestion process in vitro, the particle size of whey protein concentrate first decreased and then increased, and the absolute value of Zeta potential first decreased and then increased, the antioxidant activity of undigested whey protein concentrate gradually increased with the increasing of pressure and time, the antioxidant activity of samples after gastric digestion and intestinal digestion firstly increased and then decreased with the increase of pressure and time, and the effect of undigested samples on promoting the growth of Bifidobacterium Bb-12 at 500 MPa for 15 min was the best. The samples after gastric digestion could promote its growth at 200 MPa for 30 min and 300 MPa for 30 min, and the samples after intestinal digestion could inhibit its growth. The results of this study would provide a further theoretical basis for the application of ultra-high pressure technology in dairy industry.
-
乳清蛋白是指酪蛋白在pH=4.6沉降出来的一类蛋白质,其中包含多种功能性蛋白质,如β-乳球蛋白、α-乳白蛋白、免疫球蛋白、牛血清白蛋白等。乳清蛋白除了包括此类的营养性蛋白质外,还具有许多优良特性,如较好的溶解度、发泡能力、持水能力和乳化特性[1]。乳清浓缩蛋白(whey protein concentrate,WPC)是一种通过超滤技术从干酪工业的副产物中分离纯化出的乳清蛋白[2],WPC的蛋白质含量通常在34%~82%[3],成分除蛋白质外还包含有乳糖、乳脂肪、矿物质等[4],它更加利于人体的消化与吸收,并且其浓缩了乳中的绝大多数营养成分[5]。近年来,针对蛋白质的研究大多集中在化学改性上,但化学改性就必然涉及到新物质的生成,因此对于原有蛋白的性质不能较好地把控,而物理改性相较化学改性对于原有物质本身破坏不大,更加利于进行基础研究工作。超高压或者高静水压技术(High hydrostatic pressure,HHP)作为21世纪食品加工领域中的高新物理改性技术[6],是一种不同于传统杀菌工艺的新型冷杀菌技术,其普遍含义是在100~1000 MPa的压力下对装于弹性包装的液体介质食品物料进行处理,它主要依据的是帕斯卡原理,从而将压力均匀地传到流体介质的各个方向。超高压技术不仅具有杀菌效率高、能耗低等优点[7],更为重要的是它相较传统杀菌工艺对于食品中的营养成分或功能性分子具有较大程度地保留。例如,超高压处理不会对食品成分中的蛋白质大分子和维生素、色素等小分子的共价键造成影响,仅会对一些作用力较弱的非共价键产生影响[8];超高压处理可以使绝大多数食物中的食源性微生物灭活,通过加压、稳压以及卸压过程压力的膨胀受力作用,并且钝化相关的氧化酶,从而使食品的货架期相应地延长[9]。
将超高压技术应用于牛乳中相关蛋白质的研究内容已有许多,但超高压对于WPC的研究仍停留在结构及加工特性上,或仅探究超高压对于乳清蛋白自身功能性(抗氧化、降血压等)的影响,但功能性的探究不能仅仅停留在某一种食品在未进入人体的状态,最终要探究的是这种食品进入人体后的相应功能。人体或动物学试验成本较高、风险较大、安全性难以估测,且有时会在伦理上存在争议[10]。体外模拟消化是在建立一种模拟口腔消化过程、胃消化过程以及肠道消化过程模型的基础上对食品进行消化的手段,这种基于消化模型所建造的体外消化系统不仅操作简单、方便、快捷,并且相对花费少、可重现性高[11],不用考虑伦理等相关问题。体外模拟消化方案已逐渐被用作分析各种食品来源的不同生物活性成分在消化过程中的变化过程。目前,对于体外模拟消化的模型还没有完全统一,国内外研究者在进行食品方面的相关研究时采用的体外模拟消化方案不尽相同。本研究参考的是一种应用于食品的体外模拟消化国际共识,来源于世界范围内200多名从事消化领域的相关科学家所搭建的国际网络[12],此方案在所在后文的方法一栏中会有详细地介绍。
本研究对WPC进行超高压处理和体外模拟消化处理,一方面研究超高压对WPC中蛋白的结构影响,另一方面研究基于超高压改性后WPC的体外模拟消化产物的相关功能性,以期望探究出经高压改性后的WPC进入人体后相应功能性的变化。通过体外模拟消化系统及相关功能性分析,为今后评估和应用超高压技术处理WPC提供一定的理论基础,为相关企业利用超高压技术进行牛乳工业化生产提供一定的技术参数。
1. 材料与方法
1.1 材料与仪器
乳清浓缩蛋白(WPC80) 加拿大安格普公司;胃蛋白酶1:10000、胰蛋白酶1:250 北京索莱宝科技有限公司;2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 上海阿拉丁生化科技股份有限公司;SDS-聚丙烯酰胺凝胶电泳试剂 上海碧云天生物技术有限公司;考马斯亮蓝R250 依势久生物科技有限公司;氯化钾、磷酸二氢钾、碳酸氢钠、氯化钠、六水合氯化镁、三氯乙酸、过硫酸钾、乙酸钠、无水乙醇、铁氰化钾、氯化铁、二水合氯化钙、冰乙酸 天津天力化学试剂有限公司;双歧杆菌培养基 青岛高科技工业园海博生物技术有限公司。
超高压设备(HPP.W1-600/0.5) 天津华泰森淼生物工程技术股份有限公司;ZQPW-70型全温振荡培养箱 天津市莱玻特瑞仪器设备有限公司;圆二色色谱仪 英国应用光物理公司;F-7100型荧光分光光度计 日本日立公司;粒度及Zeta电位分析仪 英国马尔文仪器有限公司;Bioscreen Cpro 全自动生长曲线分析仪 Finland OY Growth Curves;3K 15 高速冷冻离心机 德国默克Sigma公司;紫外可见光分光光度计 南京菲勒仪器有限公司;SCIENTZ-18N型冷冻干燥机 宁波新芝生物科技股份有限公司;DW-86L388J -80度医用超低温冰箱 青岛海尔股份有限公司;生物分子定量扫描仪 美国LICOR公司。
1.2 实验方法
1.2.1 超高压处理
配制质量浓度10 mg/mL的WPC溶液,分别称取13份20 mL的WPC溶液置于聚乙烯袋中并真空密封包装,用网罩套紧将其放入超高压处理腔中,用蒸馏水注入至规定的刻度线,将超高压设备操作系统设置为自动加压与瞬时卸压。处理压力分别为100、200、300、400、500、600 MPa,处理时间为15、30 min,未经高压处理的WPC溶液为空白对照。将处理后的WPC样品分为两份,即一份10 mL,其中一份作为蛋白质结构测定,另一份作为体外模拟消化样品。将空白对照与超高压处理后的WPC溶液保存于−80 ℃超低温冰箱中。
1.2.2 超高压处理后WPC中蛋白结构分析
1.2.2.1 荧光光谱分析
参考Sun等[13]方法,将空白对照与不同处理压力和时间的WPC样品稀释至质量浓度0.2 mg/mL,设置激发波长292 nm,发射波长300~450 nm,激发和发射狭缝宽度5 nm,PMT电压500 V,扫描速度1200 nm/min,对WPC样品的荧光强度进行分析。
1.2.2.2 紫外吸收光谱分析
参考何晓叶等[14]方法,将空白对照与不同处理压力和时间的WPC样品稀释至质量浓度为1 mg/mL,以蒸馏水作为按照,测定样品在190~400 nm范围的吸光度。
1.2.2.3 圆二色性光谱分析
参考叶钰等[15]方法,将空白对照与不同处理压力和时间的WPC样品稀释至质量浓度0.2 mg/mL,加入至专用的石英比色皿中。设定圆二色性光谱仪测定条件:扫描范围为190~250 nm,波长分辨率为0.1 nm,扫描速度为100 nm/min,基线稳定性为0.02 mdeg//h,取3次扫描结果的平均值。采用圆二色谱解析软件CDNN 2.1对扫描结果进行分析,计算和拟合出WPC样品二级结构中α-螺旋、β-折叠、β-转角及无规则卷曲的相对含量。
1.2.2.4 SDS-聚丙烯酰胺凝胶电泳测定(SDS-PAGE)
将经不同压力和时间处理后的WPC样品与SDS-PAGE蛋白上样缓冲液(5×)1:4(V/V)混合均匀,沸水浴加热5 min,制备蛋白上样样品;按照配方配制15%分离胶、5%浓缩胶,将彩色预染蛋白Marker和WPC蛋白上样样品分别加入到预制的上样槽中,设定电泳仪初始电压为80 V,待样品进入分离胶时,将电压调至120 V,当样品迁移至接近分离胶底部时,停止电泳。参考中国药典2020年版中SDS-PAGE法步骤,按照相应配方配制固定液、染色液、脱色液及保存液,用考马斯亮蓝染色法将电泳凝胶片进行固定与染色,用脱色液将凝胶片脱色至凝胶背景透明后,将其贮存在保存液中。用生物分子定量扫描仪对透明凝胶片进行拍照,用Image Studio Ver 5.2凝胶图像分析软件对其进行分析。
1.2.3 超高压处理后WPC的体外模拟消化及功能分析
1.2.3.1 体外模拟消化模型
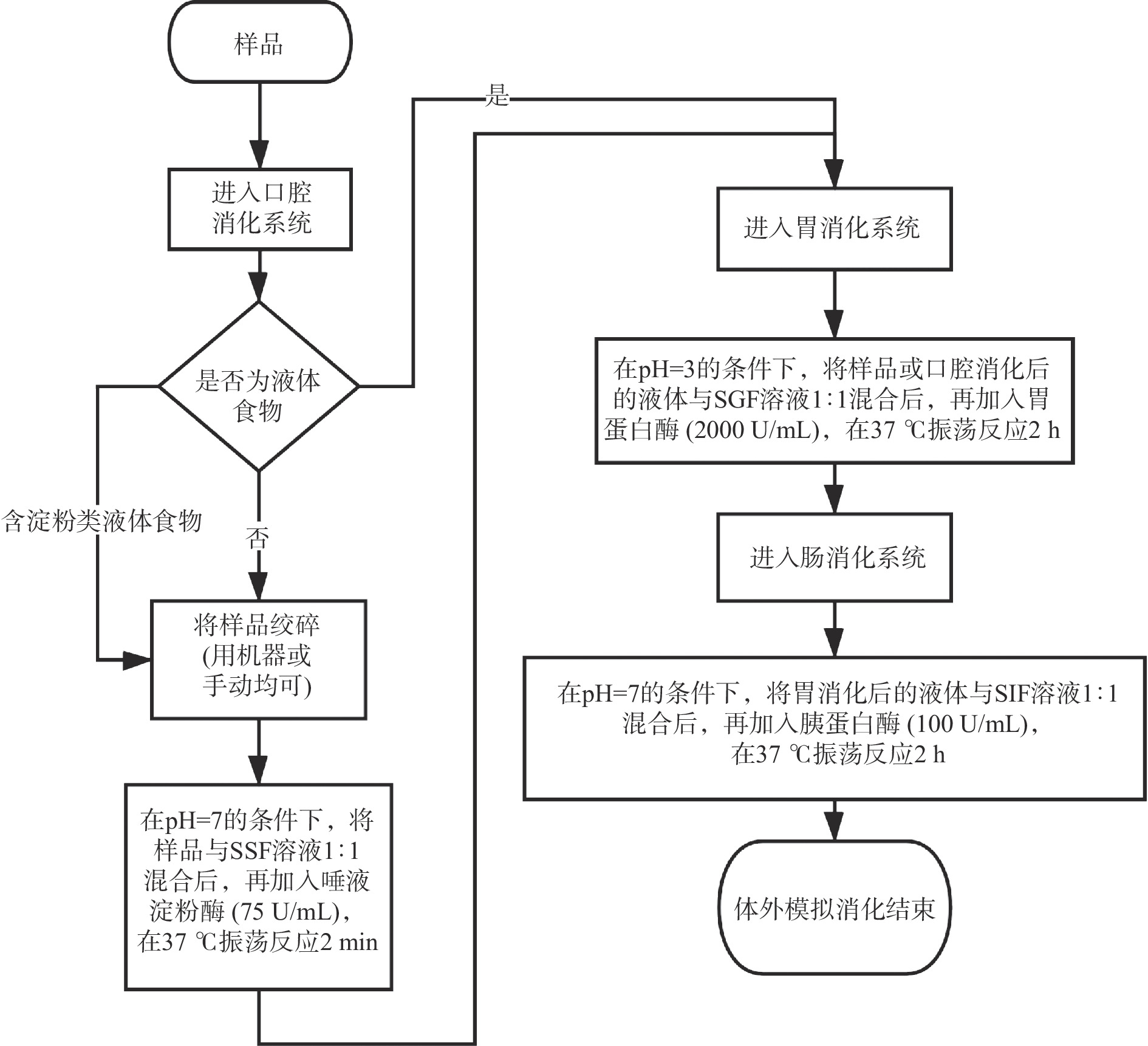
本研究的体外模拟消化模型是参考Minekus等[16]构建的国际共识的基础上稍加修改后制定的,此方法主要包括三种模拟消化液体:模拟唾液(Simulated Salivary Fluid,SSF)、模拟胃液(Simulated Gastric Fluid,SGF)、模拟肠液(Simulated Intestinal Fluid,SIF),三种模拟消化液的具体配方见表1,该消化方案的简要流程图见图1。根据方案流程图可知,本研究的WPC样品属于液体蛋白,因此不需要进行口腔消化阶段,即进行模拟胃消化和肠消化,因此本研究只需配制SGF和SIF即可。根据模拟消化液配方配制出6种缓冲溶液,并将6种溶液混合均匀,用蒸馏水补足至400 mL,制成1.25倍的浓缩消化液。
表 1 体外模拟消化液配方Table 1. Formula of simulated digestive solution in vitro成分 储备液浓度(mol/L) SSF体积(mL) SGF体积(mL) SIF体积(mL) KCl 0.5 15.1 6.9 6.8 KH2PO4 0.5 3.7 0.9 0.8 NaHCO3 1 6.8 12.5 42.5 NaCl 2 − 11.8 9.6 MgCl2(H2O)6 0.15 0.5 0.4 1.1 (NH4)2CO3 0.5 0.06 0.5 − 模拟胃消化阶段:将10 mL超高压处理后的WPC样品与8 mL SGF、4 mg胃蛋白酶(10000 U/mg)、5 μL 0.3 mol/L CaCl2混合均匀,用1 mol/L 盐酸将酸碱度降至pH=3,根据试验实际中和pH所需盐酸的量,用蒸馏水将整体消化液体补至20 mL,将混合后的样品胃消化液放入振荡培养箱中,在37 ℃、135 r/min振荡消化2 h。胃消化阶段完成后,将样品消化液分成两份,即一份10 mL,其中一份作为胃消化液进行后续功能性分析,并立即以6000 r/min离心5 min,上清液即为样品液,最终将样品放入−80 ℃超低温冰箱中保存,另一份留作后续肠消化阶段的样品。
模拟肠消化阶段:将10 mL胃消化阶段完成后的样品与8 mL SIF、8 mg胰蛋白酶(250 U/mg)、牛胆盐0.0814 g、20 μL 0.3 mol/L CaCl2混合均匀,用1 mol/L NaOH溶液将酸碱度调至pH=7,根据试验实际中和pH所需NaOH溶液的量,用蒸馏水将整体消化液体补至20 mL,将混合后的样品肠消化液放入振荡培养箱中,在37℃、135 r/min振荡培养2 h,肠消化阶段完成后,立即以6000 r/min离心5 min,上清液即为样品液,最终将样品放入−80 ℃超低温冰箱中保存。
1.2.3.2 SDS-PAGE聚丙烯酰胺电泳测定
将胃消化阶段样品与肠消化阶段样品进行SDS-PAGE聚丙烯酰胺凝胶电泳测定,方法同1.2.2.4。
1.2.3.3 粒度及Zeta电位分析
首先将粒度与电位分析仪切换至粒度测定模式,设定扫描次数50次、单从扫描时间10 s、测量最终结果3次,将样品摇匀后加入四面透光的比色皿中进行粒度测定;将分析仪切换至Zeta电位测定模式,设定扫描次数100次、测量最终结果3次,将样品摇匀后加入含有电极的比色皿中进行Zeta电位测定。
1.2.3.4 ABTS+自由基清除率测定
参考Ozgen等[17]方法,称取0.0066 g ABTS溶解于40 mL蒸馏水中,配制成7.0 mmol/L ABTS溶液;取0.0066 g过硫酸钾溶解于10 mL蒸馏水中,配制成2.45 mmol/L过硫酸钾溶液;将二者混合均匀,室温避光放置14 h,称取0.3281 g乙酸钠溶解于200 mL蒸馏水配制20 mmol/L乙酸钠溶液,在波长734 nm处用该乙酸钠溶液将放置后的ABTS与过硫酸钾混合液的吸光度稀释至0.70±0.01。取3 mL该溶液与20 μL样品混合,在室温条件下放置6 min后,在波长734 nm处测定吸光度值,以不加样品液为对照组,计算ABTS+自由基清除率。
ABTS+自由基清除率(%)=A−A0A×100 式中:A为对照组的吸光度,A0为样品的吸光度。
1.2.3.5 DPPH自由基清除率测定
参考Liu等[18]方法,称取0.0016 g DPPH溶解于40 mL无水乙醇中,配制成0.1 mmol/L DPPH醇溶液,取1.5 mL该溶液与1.5 mL样品充分混匀,在室温条件下暗反应30 min,在波长517 nm处测定样品的吸光度,将上述样品溶液替换成蒸馏水即为空白对照组,还需测定在该波长下样品本身的吸光度。
DPPH自由基清除率(%)=(1−A1−A2A3)×100 式中:A1为样品的吸光度,A2为样品本身的吸光度,A3为空白对照组的吸光度。
1.2.3.6 FRAP(Fe3+还原力)测定
参考Liu等[19]方法,称取WPC样品溶液0.5 mL、2.5 mL 0.2 mol/L 磷酸二氢钾缓冲溶液、2.5 mL 10 mg/mL 铁氰化钾溶液,将三种溶液混合均匀,在50 ℃条件下水浴20 min后急速冷却,冷却后加入2.5 mL 0.1 g/ml三氯乙酸溶液,然后将混合物在离心力1000×g的条件下离心10 min。离心后取上清液2.5 mL,与2.5 mL蒸馏水、0.5 mL 0.1%氯化铁溶液混合均匀,室温条件下放置10 min后,在波长700 nm处测定其吸光度,以吸光度数值表征抗氧化能力。
1.2.3.7 不同压力和处理时间的WPC及其消化产物对双歧杆菌BB-12的增殖作用
参考李梦寒[20]的方法,将经高压处理的WPC消化产物冷冻干燥,获得经体外模拟消化后的WPC冻干粉,分别用灭菌后的双歧杆菌培养基配制成质量浓度10 mg/mL的蛋白液,再用0.22 μm滤器将蛋白液过滤,作为无菌的离心管中作为培养的母液,将母液灭菌后分别放入试管中,以4%的比例接种培养24 h后的双歧杆菌BB-12菌液,混匀后以每孔200 μL接入100孔蜂窝板中,参考Brennan等[21]方法,利用Bioscreen C 全自动生长曲线仪测定该研究内容下的生长曲线,每组实验结果平行测定三次。
1.3 数据处理
本研究内容中所有的实验数据均至少是三次平行实验数据的平均值,实验结果以平均值±标准偏差来表示。数据处理采用SPSS Statistics 25的单因素方差分析和Duncan多重比较法进行分析,以P<0.05表示数据存在显著差异,采用Origin 2018和Excel 2019软件对图表进行绘制。
2. 结果与分析
2.1 超高压处理对WPC中蛋白结构的影响
目前,研究表明超高压对于不同源蛋白质的结构均有一定的影响。步营等[22]探究了超高压对蓝蛤酶解液蛋白质结构的影响,结果表明超高压处理破坏了蓝蛤蛋白质三、四级结构,使蛋白质的空间结构发生改变。杜丽娜[23]研究了超高压处理对于荞麦13S球蛋白结构的影响,发现高压处理会改变了芳香族氨基酸残基的微环境,使蛋白质的三级结构发生改变,且二级结构中α-螺旋和β-折叠逐渐向β-转角和无序结构方向转变。赵飞[24]发现超高压处理会使大豆蛋白的二、三级结构发生变化。本研究通过对上述研究方法的汇总,对WPC中蛋白的结构进行分析。
2.1.1 超高压处理对WPC中蛋白的三级结构的影响
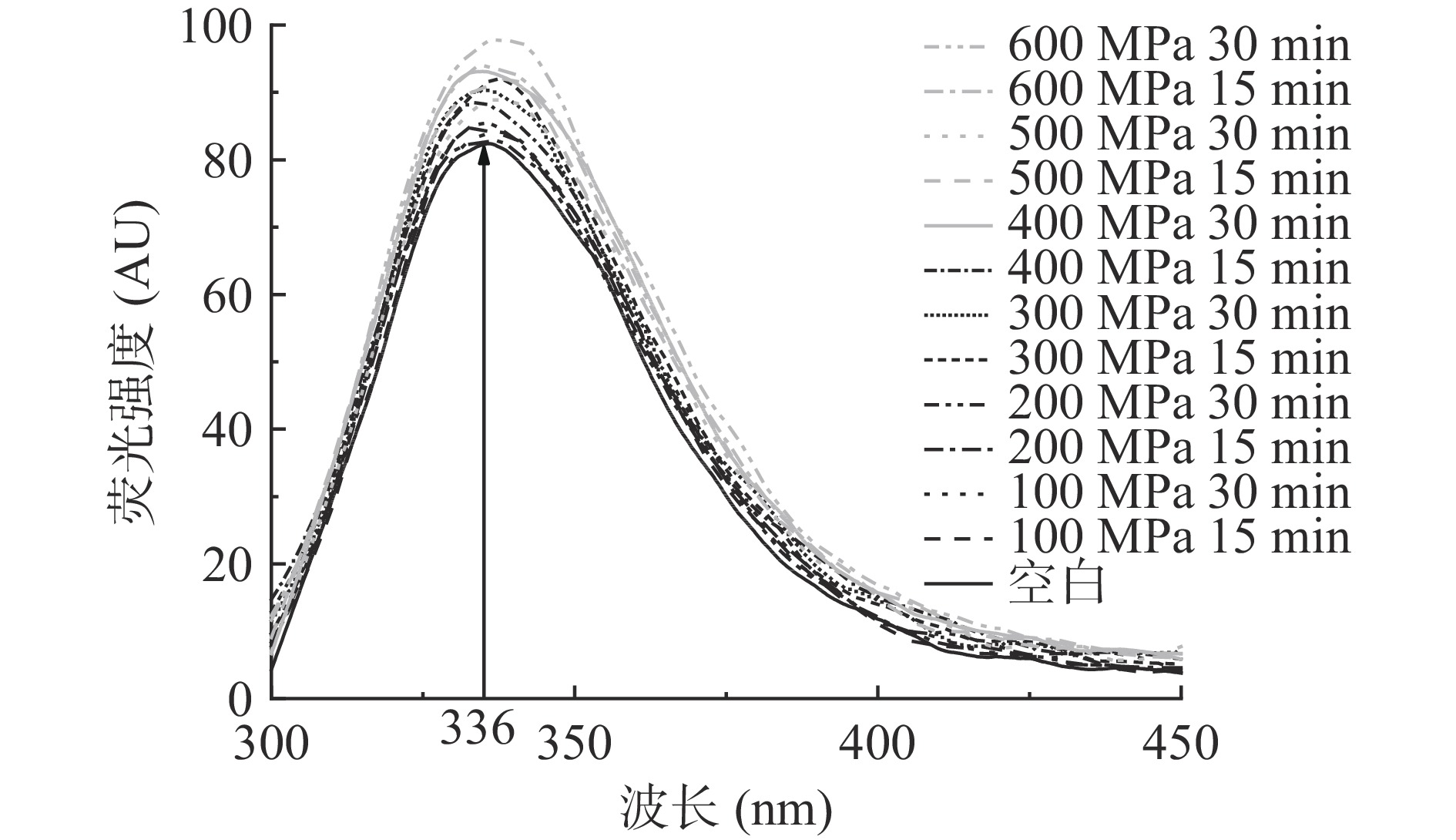
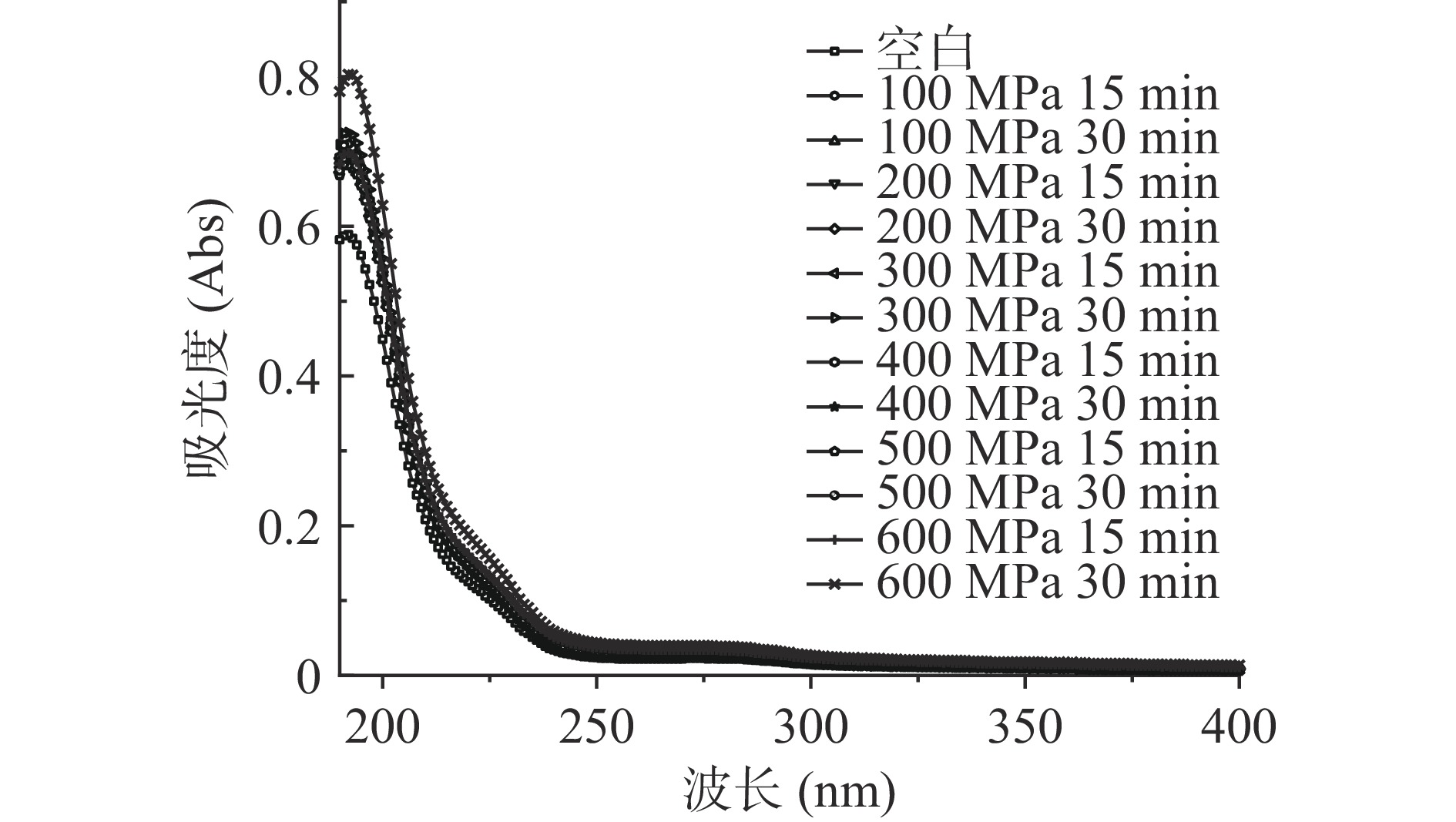
由于蛋白质分子中含有三种可以发射荧光的氨基酸——色氨酸、酪氨酸、苯丙氨酸,因此三种氨基酸可以作为内源性荧光探针预测蛋白质结构[25-26]。如图2可知,空白对照与经超高压处理后的WPC中蛋白的最大荧光强度波长均在波长336 nm附近。随着处理压力增大,WPC样品的荧光强度逐渐增强;处理时间30 min较15 min对荧光强度增强的程度更大。说明WPC中蛋白随着处理压力和时间增加,蛋白质分子三级结构展开,原本被致密结构包裹的发色氨基酸被释放出来。由于上述三种氨基酸残基中的苯环还有共轭双键,因此蛋白质也具有吸收紫外光的性质,荧光光谱与紫外吸收光谱的作用基团基本一致,因此二者均可对蛋白质三级结构进行分析,且结果可以相互印证[27]。如图3可知,当处理压力600 MPa、时间30 min时,WPC样品最大吸光度最高,其余的超高压处理条件相较空白对照均可增强其吸光度,这同样说明超高压处理可以使WPC中蛋白发生变性,暴露出更多的内部氨基酸残基。
2.1.2 超高压处理对WPC中蛋白的二级结构的影响
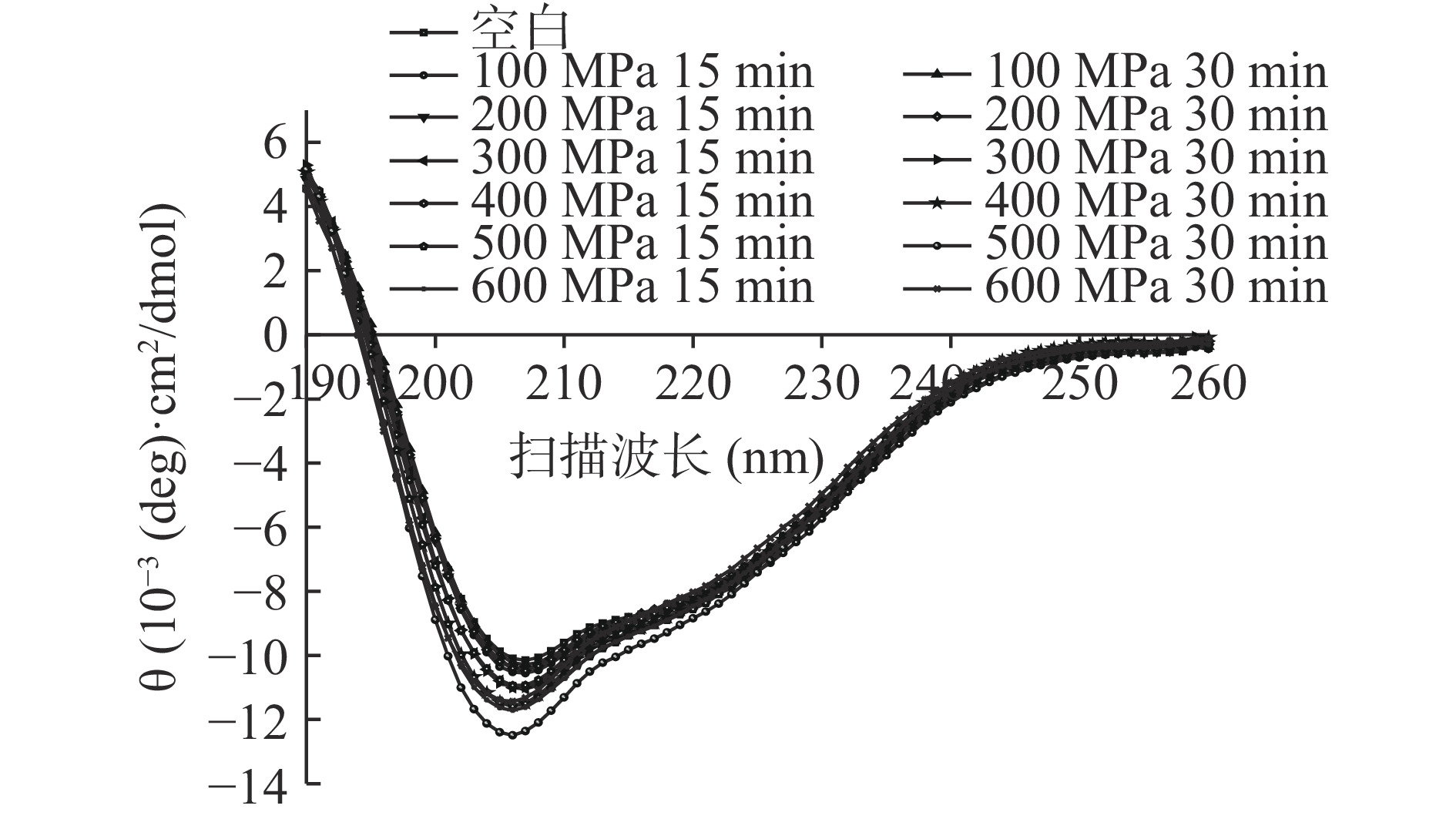
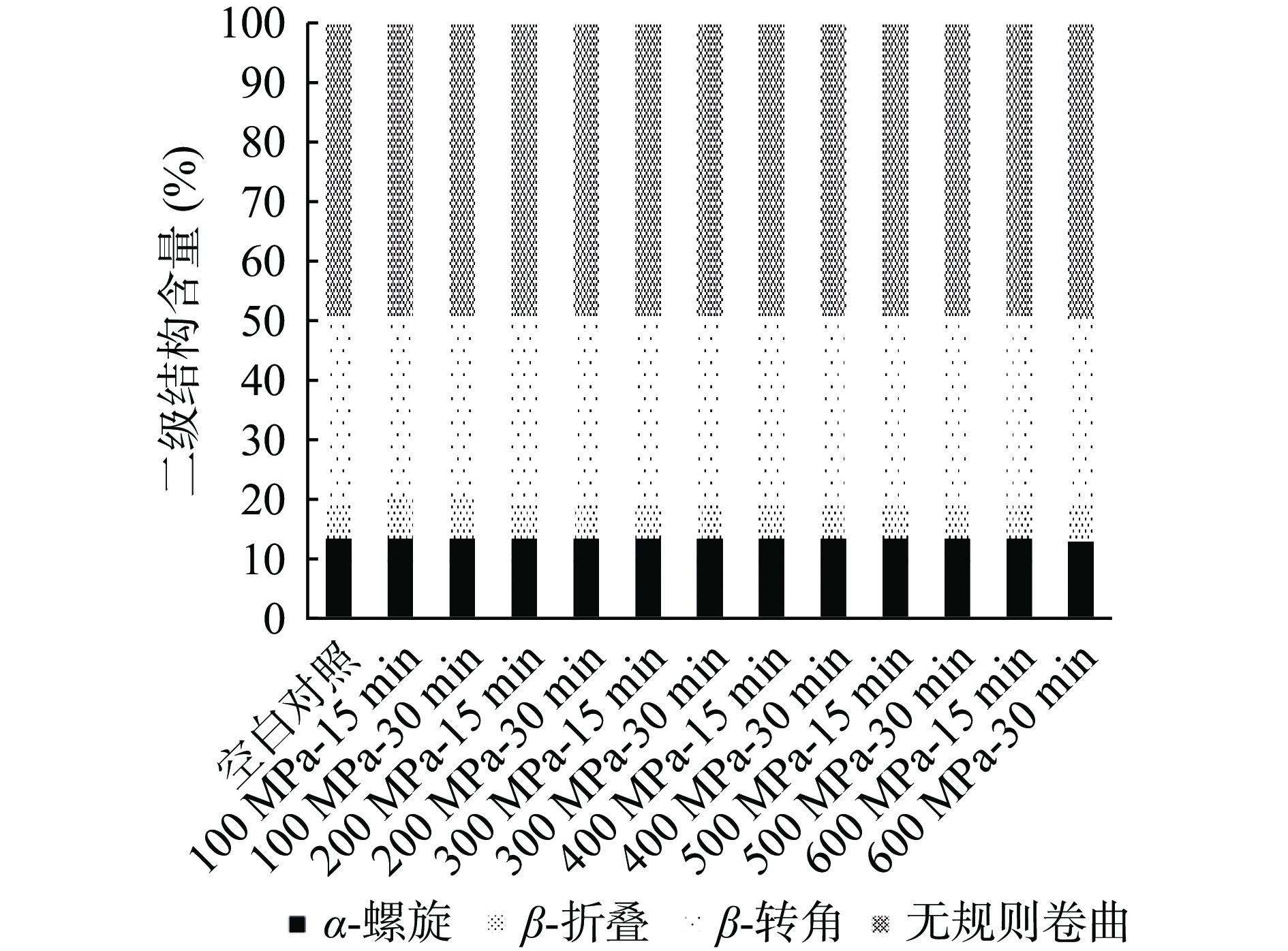
圆二色光谱法是一种分析蛋白质二级结构的有力工具,尤其在研究复杂状态下的蛋白质结构时,可以较好地分析蛋白质的二级结构[28]。由图4可知,未超高压处理与超高压处理后的WPC中蛋白在209和222 nm波长处有负峰,表明样品蛋白的二级结构以β-螺旋结构为主。通过超高压处理与未超高压的样品曲线进行对比后发现,经超高压处理的样品曲线整体垂直向下偏移,说明超高压处理改变了其相应的二级结构,且在处理压力500 MPa、时间30 min时,超高压对于样品二级结构的影响最为显著。通过CNDD 2.1圆二色谱专用分析软件,如图5可知,超高压处理对于样品二级结构含量影响并不明显,所有含量比例均近乎保持一致,可能是由于样品发生了结构的复性,Tao等[29]的研究表明,在一定超高压处理压力和时间后,样品将在很短时间内回复原本具有的状态。
2.1.3 超高压处理对WPC中蛋白的一级结构的影响
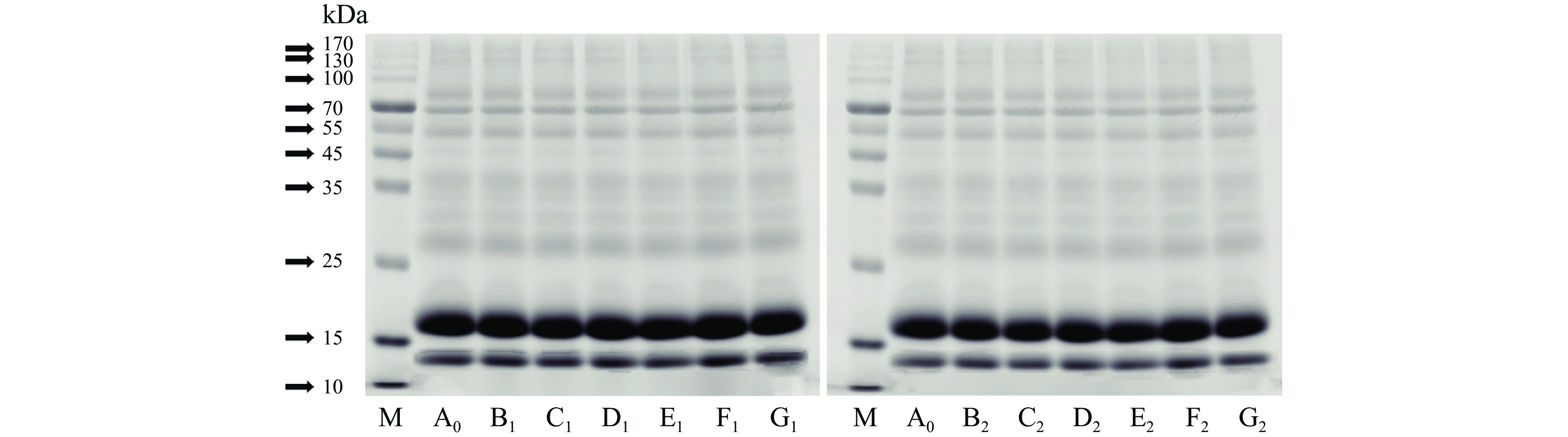
经不同处理压力和时间的WPC中蛋白电泳特性如图6所示,两条颜色较深的电泳条带分别集中在10~15 kDa、15 kDa附近。根据WPC中蛋白的组成可知,10~15 kDa间的条带是α-乳白蛋白(分子量约为14.2 kDa),15~25 kDa间的条带是β-乳球蛋白(分子量约为18.4 kDa)。另有一些颜色较浅的条带集中在25~35 kDa、70 kDa附近,可能是一些酪蛋白和牛血清白蛋白。通过不同处理压力和时间WPC中蛋白条带对比,各条带无明显差异,表明超高压处理不会改变WPC蛋白分子量。此结果与孙颜君等[30]的研究结果相同,孙颜君等研究了超高压处理(压力300 MPa和600 MPa,时间10 min)对WPC中蛋白分子量的影响,结果发现在设定的超高压处理条件下不会改变其蛋白分子量。本研究进一步说明,其它的超高压处理条件(压力100、200、300、400、500和600 MPa,时间15和30 min)同样不会对WPC中蛋白分子量造成显著性影响。
2.2 超高压处理对WPC体外模拟消化产物的分子量和功能性分析
目前,乳清蛋白的功能性集中在乳清蛋白肽中,乳清蛋白生物活性肽功能性主要包括三个方面,分别是抗菌肽、抗氧化肽、降血压肽。Alio等[31]对羊乳清蛋白进行酶解处理,得到的酶解产物分别可以对大肠杆菌和蜡状芽孢杆菌达到较好地抑菌效果,并将抑菌效果较好地肽片段进行分离纯化。Martina等[32]对乳清蛋白进行水解,并将其水解产物进行5 kDa超滤处理,从其渗透物种并鉴定出抗氧化肽MPI。Pan等[33]对乳清蛋白水解产物进行研究,分离纯化并鉴定出降血压肽LL,对其降血压机制也进一步进行研究。李梦寒等[34]前期通过体外和体内动物试验研究了不同浓度的α-乳白蛋白对肠道菌群的影响,证明不同浓度的α-乳白蛋白均能维持或促进肠道益生菌繁殖,中、低浓度蛋白效果更好;对肠道中潜在有害菌起到抑制作用,高、中浓度蛋白效果更好。本研究通过对WPC体外模拟消化前后分子量、粒度及Zeta电位的分析,对消化前后抗氧化性的变化及对双歧杆菌BB-12的增殖作用的研究,探究了WPC体外模拟消化前后的功能性变化。
2.2.1 超高压处理对WPC体外模拟消化产物分子量的影响
经不同处理压力和时间WPC模拟胃消化产物的电泳特性如图7所示,与图2(未消化的WPC)对比可知,在胃消化阶段进行的2 h过程中,WPC的分子量未发生明显的改变,说明WPC在胃消化阶段并未发生显著性降解;除胃蛋白酶在35 kDa显示的条带外,所有处理条件下的WPC样品的条带基本一致,因此超高压处理对于WPC模拟胃消化产物的一级结构无显著性影响。
经不同处理压力和时间WPC模拟最终消化产物的电泳特性如图8所示,与图7(胃消化的WPC)对比可知,在肠消化阶段进行的2 h过程中,除了胰蛋白酶在25 kDa附近显示的条带外,WPC的电泳条带完全消失,表明WPC在经过胃和肠消化阶段降解完全,其主要的大分子蛋白完全被酶解消化;不同处理压力和时间的WPC最终消化产物的电泳条带并无显著性差异,说明超高压处理对于WPC模拟最终消化产物的一级结构无显著影响。
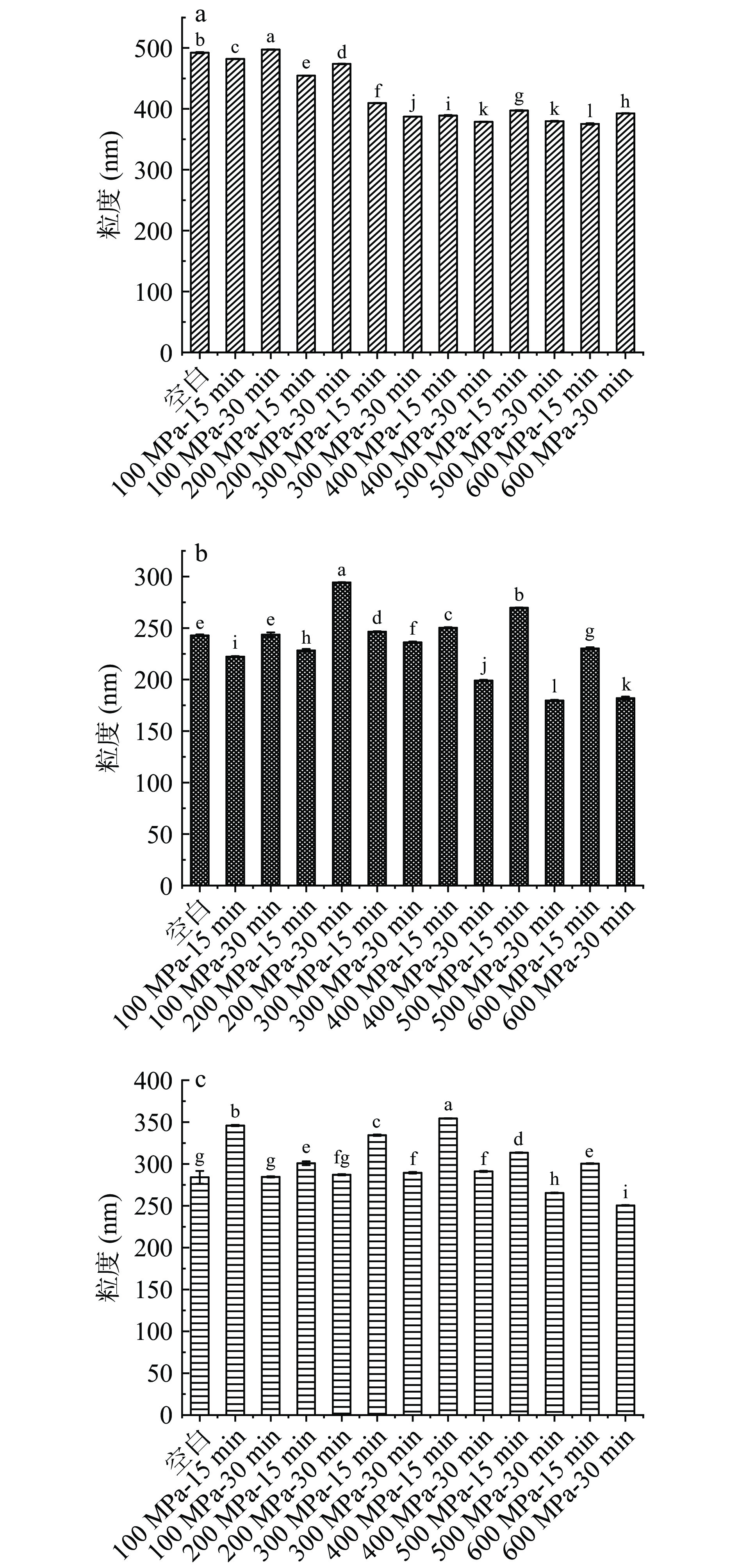
2.2.2 超高压处理后的WPC体外模拟消化粒度的变化
通过对比图9(a、b、c),超高压处理后的WPC在进行体外模拟胃消化后粒度减小,而在进行模拟肠消化后,其粒度增大。逐个分析未消化处理、体外模拟消化处理粒度变化后发现,未消化的样品在100 MPa、30 min时,粒度最大;在600 MPa、15 min时,粒度最小;随着压力增大至300 MPa,再增加压力粒度基本维持不变,这说明高压可以改变WPC的粒度,但当压力增至一定程度,WPC的粒度不会发生显著性改变(P>0.05)。胃消化样品在200 MPa、30 min时,粒度最大;在500 MPa、30 min时,粒度最小。胃+肠消化样品在400 MPa、15 min时,粒度最大;在600 MPa、30 min时,粒度最小。
![]() 图 9 未消化处理样品(a)、体外模拟胃消化处理样品(b)及胃+肠消化处理样品(c)在不同处理条件下粒度的变化注:不同小写字母表示差异显著(P<0.05);图10同。Figure 9. Changes of particle size of undigested sample (a), in vitro model gastric digestion sample (b) and gastric + intestinal digestion sample (c) under different treatment conditions
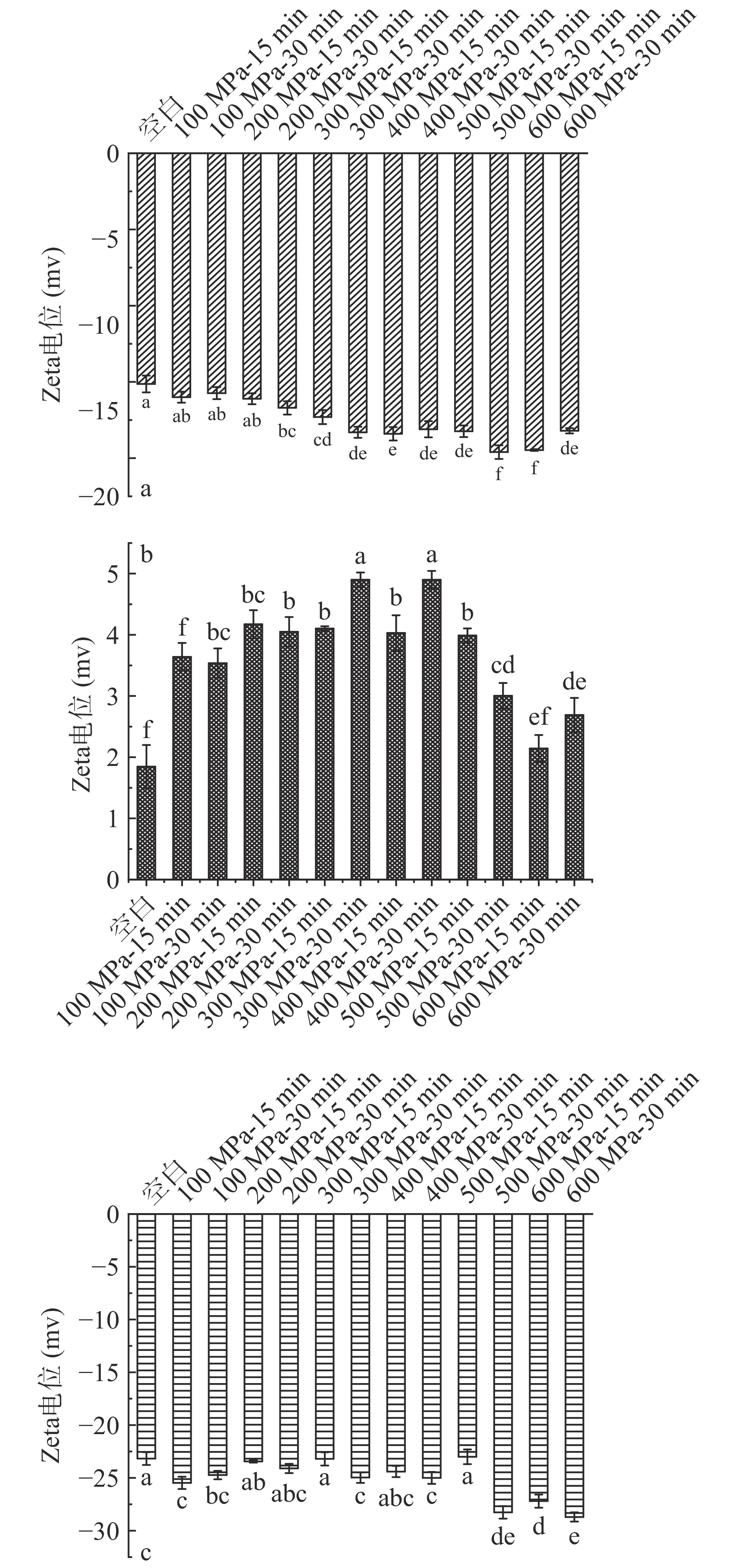
图 9 未消化处理样品(a)、体外模拟胃消化处理样品(b)及胃+肠消化处理样品(c)在不同处理条件下粒度的变化注:不同小写字母表示差异显著(P<0.05);图10同。Figure 9. Changes of particle size of undigested sample (a), in vitro model gastric digestion sample (b) and gastric + intestinal digestion sample (c) under different treatment conditions2.2.3 超高压处理后的WPC体外模拟消化Zeta电位的变化
Zeta电位的变化可以用来评价颗粒间的稳定性,电位的绝对值越高,颗粒间的静电斥力就越大,聚集程度越小,代表溶液的稳定性越高[35]。对比图10(a、b、c)可知,经超高压处理后的WPC的Zeta电位的绝对值随着体外模拟消化过程的进行,先减小后增大,最终Zeta电位的绝对值高于未消化的WPC样品。其结果可以与上述样品平均粒度分析相互对应。未消化的样品在500 MPa、30 min时,Zeta电位绝对值最大,代表此时样品最稳定。且随着压力的增大,大部分样品的Zeta电位绝对值逐渐增大,这可能是因为超高压改变其蛋白的高级结构,使其中带电荷的自由基团游离出来,从而增大了Zeta电位的绝对值[36]。胃消化样品的Zeta电位绝对值的大体趋势是随着压力增加,先增大再减少。胃+肠消化样品的Zeta电位均高于肠消化样品,这可能是由于肠道中的胆盐等离子增强了整体溶液的离子强度,使样品的Zeta电位绝对值增大[37]。
2.2.4 超高压处理对WPC及其体外模拟消化产物抗氧化性的影响
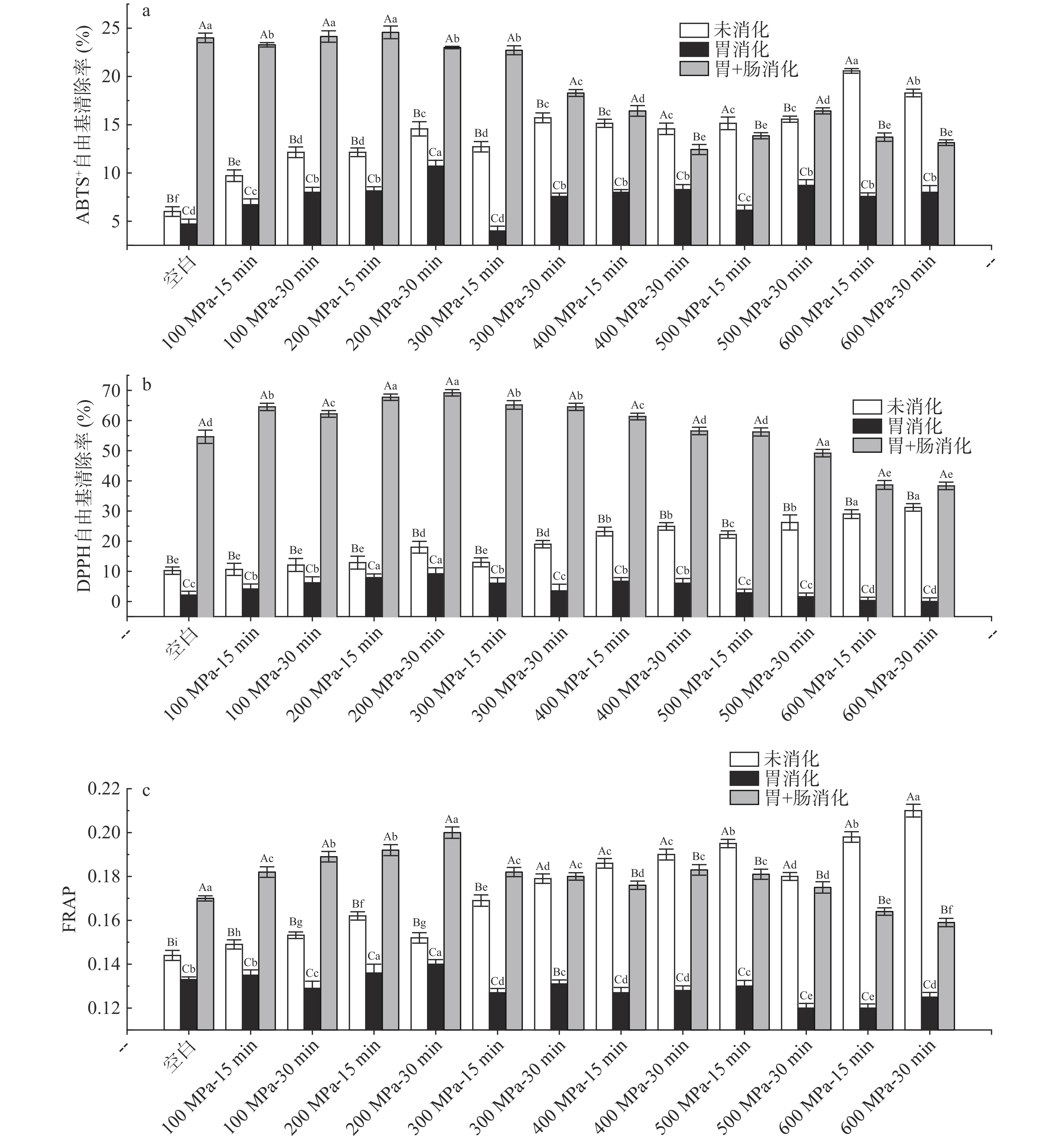
许多研究表明超高压可以改变或改良食品的抗氧化性能。庞佳坤等[38]研究了乳清蛋白在压力200、400及600 MPa情况下处理一定时间后抗氧化性的变化,证明超高压处理会改变乳清蛋白的抗氧化性;王娇[39]研究了超高压作用下对蜂王浆体外消化产物的影响,证明在300 MPa、10 min时胃蛋白酶酶解液的DPPH自由基清除率最高;赵越[40]的研究证明高压处理能增强发酵乳的羟基自由基清除能力;朱金艳[41]的研究表明,超高压处理能有效地保留蓝莓汁中总抗氧化性,且在压力为350 MPa时效果最好。但一个完整的肽想要在人体中发挥其抗氧化性能,不能仅仅只看它自身的抗氧化性,因为在肽进入人体达到目标器官之前,有可能被体外多种酶分解为氨基酸,其抗氧化功能会因此受到影响[42]。所以,要考量乳清蛋白肽在进入身体后的抗氧化性变化,需对其体外模拟消化产物进行分析研究。本研究通过三种不同机制的抗氧化分析方法(ABTS、DPPH及FRAP)对超高压处理后WPC消化前后的抗氧化变化进行分析。
ABTS+自由基清除率是评价肽的抗氧化性的方法之一。如图11(a)所示,未消化的WPC样品随着压力的增加,其ABTS+自由基清除率增强,但在600 MPa、30 min时有所下降;胃消化后的WPC样品随着压力的增加,其ABTS+自由基清除率先增加后减少,在200 MPa、30 min时达到最大值,而后随着压力的增加,其ABTS+自由基清除率先减少后趋于稳定;胃+肠消化后的样品ABTS+自由基清除率与胃消化阶段后的样品趋势基本一致,其在200 MPa、15 min时达到最大值。这说明胃消化阶段相较肠消化阶段对WPC样品的ABTS+自由基清除率影响大。
DPPH自由基清除率也被广泛用作抗氧化性能的测定。如图11(b)所示,随着压力的增加,未消化样品的DPPH自由基清除率逐渐增加,在600 MPa、30 min时达到最大值;胃消化后的样品的DPPH自由基清除率先增加后减少,在200 MPa、30 min达到最大值。胃+肠消化后的样品的DPPH自由基清除率先增加后减少,在200 MPa、30 min达到最大值。
FRAP法是根据铁氰化钾的还原性进行抗氧化性测量。如图11(c)所示,未消化样品随着压力的增加,其还原力大致呈上升趋势;胃消化后的样品随着压力的增加,其趋势不明显,但在200 MPa、30 min有最大值;胃+肠消化后的样品随着压力的增加,其趋势为先增加后减小,并在200 MPa、30 min有最大还原力。
通过对比三种测定方法分析结果,三种方法的结果大体一致,结果表明未消化的WPC样品随着压力和时间的增加,其抗氧化性增强,这可能是由于随着超高压强度和时间的增加,蛋白质三级结构展开,其中一些的抗氧化氨基酸成分如疏水性成分被释放出来,增加了其抗氧化性;WPC样品在胃消化和肠消化阶段完成后随着压力和时间的增加,其抗氧化性先增加后减弱,在压力200 MPa时达到最大值,这可能是由于随着超高压强度和时间的增加,当小于200 MPa的压力时,WPC中蛋白的部分酶切位点暴露出来,容易被消化酶分解为抗氧化肽,进而增加其抗氧化活性;当大于200 MPa的压力时,高压会使原有分解抗氧化肽的酶切位点发生改变或破坏,从而降低其抗氧化活性。相比未消化的样品,胃消化后的WPC样品抗氧化性降低,胃+肠消化后的WPC样品升高。这可能是由于加入胃蛋白酶后,原有的抗氧化蛋白成分被逐步分解或破坏,进而降低了其抗氧化活性[43]。且由2.2.1电泳结果可知,胃+肠消化后的样品中大分子蛋白被完全分解,蛋白质完全转化为小分子肽,一些研究显示,蛋白肽的分子量越小其抗氧化性越强,因此相较未消化样品增强了其抗氧化活性[44]。
2.2.5 超高压处理后的WPC体外模拟消化产物对双歧杆菌BB-12的增殖作用
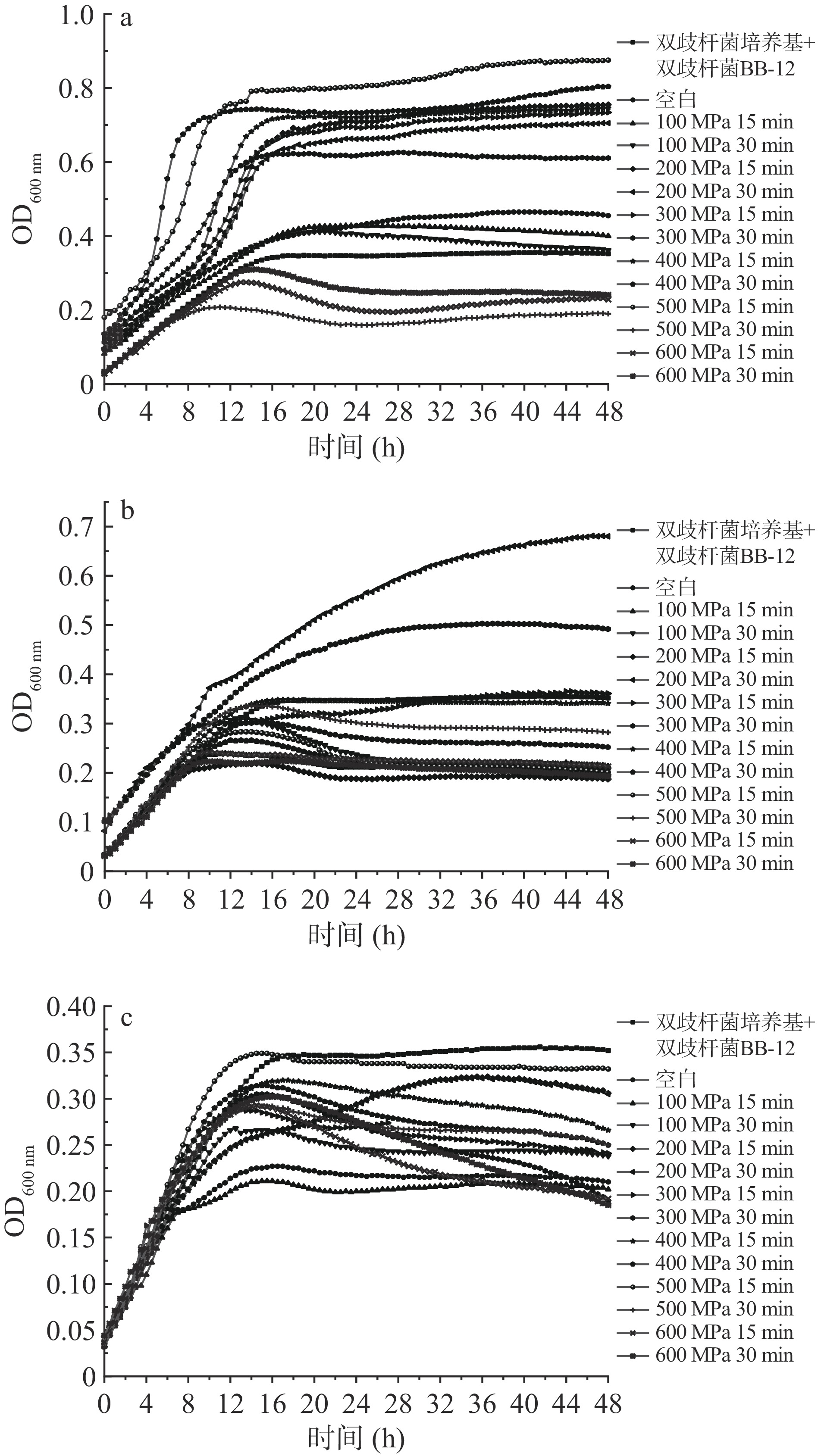
白英等[45]的研究表明不同分子量的乳清蛋白水解物对乳酸菌均有增菌作用;Lucas等[46]的研究表明,一定分子量范围的乳清蛋白水解肽对于嗜热链球菌的增长均有明显的促进作用;本研究团队前期研究表明,一定浓度的α-乳白蛋白对双歧杆菌BB-12有促进作用[34]。本文通过超高压对WPC改性后再进行体外模拟消化得到其消化水解物,分析不同高压处理条件对双歧杆菌BB-12的增殖作用,结果如下:
如图12(a)所示,通过与只加入双歧杆菌培养基和双歧杆菌BB-12的曲线对比,未消化的WPC样品在600 MPa 15 min、600 MPa 30 min、500 MPa30 min对于双歧杆菌BB-12有抑制其生长的作用。其余条件下处理均有促进双歧杆菌BB-12生长的作用,在500 MPa、15 min时促进效果最好。而相较未经超高压处理的空白对照,在100 MPa、15 min和100 MPa、30 min时对双歧杆菌BB-12促进生长的效果均低于空白对照,这说明当对WPC样品超高压处理的压力低于100 MPa时,对于双歧杆菌BB-12的促进效果不明显。这可能是由于经超高压处理后,蛋白质的结构在一定程度上被打开,WPC蛋白颗粒表面积增加,进而在一定程度上可增加双歧杆菌BB-12对WPC的利用率[47]。
如图12(b)所示,通过与只加入双歧杆菌培养基和双歧杆菌BB-12的曲线对比,胃消化后的WPC样品仅在200 MPa 30 min、300 MPa 30 min对于双歧杆菌BB-12有明显的促进其生长的作用,而其余处理条件(包括空白对照)对于双歧杆菌BB-12均有抑制其生长的作用,这说明当经高压处理的WPC样品进入人体胃消化系统后,只在上述个别处理条件下可以促进双歧杆菌BB-12生长,而其余条件均抑制其生长。
如图12(c)所示,通过与只加入双歧杆菌培养基和双歧杆菌BB-12的曲线对比,胃+肠消化后的所有WPC样品均对双歧杆菌BB-12有抑制其生长的作用,但与未经高压的空白对照进行对比可发现,处理条件除了100 MPa、15 min,其余条件对于抑制其生长的作用均有一定的抵消或削弱。这说明当WPC样品进入肠道消化时,不论是否进行超高压处理对双歧杆菌BB-12均有抑制其生长的作用,但一定压力和时间的处理条件下可以相对减弱其抑制生长的程度。这可能是由于在WPC进入肠消化系统后,WPC蛋白被分解为一些小分子抗菌肽,因而抑制其生长;而超高压处理可能会在一定程度上破坏其蛋白质的空间结构和酶切位点,进而影响抗菌肽的产生,因此可相对减弱其抑制程度[48]。
3. 结论
通过研究证实,一是超高压处理对于WPC中蛋白质的三级结构有一定的影响,随着压力和时间的增加,原有的三级结构展开,发色氨基酸被释放出来,荧光和紫外吸收强度增强,在600 MPa、30 min改变程度最大,但对一、二级结构无显著性影响;二是超高压处理对于其体外模拟消化产物(包括胃和肠消化阶段)的分子量均无显著性影响,且相较未消化样品,胃+肠消化后WPC中蛋白降解完全;三是超高压处理对其体外模拟消化产物的抗氧化性有显著性影响,随着压力和时间的增加,其体外模拟消化产物(包括胃和肠消化阶段)的抗氧化性先增大后减小,在200 MPa时达到最大抗氧化活性,且超高压处理对于双歧杆菌BB-12的增殖作用同样也有一定影响,胃消化产物在200 MPa 30 min、300 MPa 30 min对于其生长有促进效果,其余压力条件均为抑制效果,胃+肠消化产物均对其生长有抑制作用,但在一定压力和时间条件下可以抵消其部分的抑制效果。这可能是由于体外模拟消化过程中胃蛋白酶与胰蛋白酶将WPC中蛋白水解为小分子肽或氨基酸,改变了其蛋白的结构及相关性质,从而影响了WPC的功能性质,需要今后进一步探究。本研究为超高压技术应用乳品工业提供了一定的参数与理论基础,并为后续深入探究WPC在体内的消化过程中的功能性提供了科学依据。
-
图 9 未消化处理样品(a)、体外模拟胃消化处理样品(b)及胃+肠消化处理样品(c)在不同处理条件下粒度的变化
注:不同小写字母表示差异显著(P<0.05);图10同。
Figure 9. Changes of particle size of undigested sample (a), in vitro model gastric digestion sample (b) and gastric + intestinal digestion sample (c) under different treatment conditions
表 1 体外模拟消化液配方
Table 1 Formula of simulated digestive solution in vitro
成分 储备液浓度(mol/L) SSF体积(mL) SGF体积(mL) SIF体积(mL) KCl 0.5 15.1 6.9 6.8 KH2PO4 0.5 3.7 0.9 0.8 NaHCO3 1 6.8 12.5 42.5 NaCl 2 − 11.8 9.6 MgCl2(H2O)6 0.15 0.5 0.4 1.1 (NH4)2CO3 0.5 0.06 0.5 − -
[1] AMMAR I, GHARSALLAH H, BRAHIM A B, et al. Optimization of gluten-free sponge cake fortified with whey protein concentrate using mixture design methodology[J]. Food Chemistry,2020,343:128.
[2] JMMD O V, ALTAMURA D, HERRERA M L, et al. Physical and structural properties of whey protein concentrate-corn oil-TiO2 nanocomposite films for edible food-packaging[J]. Food Packaging and Shelf Life,2020,26:100.
[3] 耿浩, 刘悦, 梁新婷, 等. 热诱导对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响[J]. 中国食品学报,2016,16(8):71−77. [GENG H, LIU Y, LIANG X T, et al. Effect of heat induction on emulsification and stability of whey protein concentrate and protein isolate[J]. Chinese Journal of Food,2016,16(8):71−77. [4] 王超, 曹传爱, 蔡浚泽, 等. 热处理乳清浓缩蛋白乳化体系储藏稳定性研究[J]. 食品研究与开发,2017,38(23):6−12. [WANG C, CAO C A, CAI J Z, et al. Study on storage stability of heat treated whey protein concentrate emulsion system[J]. Food Research and Development,2017,38(23):6−12. doi: 10.3969/j.issn.1005-6521.2017.23.002 [5] 孙亚婷, 蒋姗姗, 曹宋宋, 等. 聚合乳清浓缩蛋白对发酵乳饮料稳定性的影响[J]. 中国食品学报,2018,18(3):157−162. [SUN Y T, JIANG S S, CAO S S, et al. Effect of polymerized whey protein concentrate on the stability of fermented milk beverage[J]. Chinese Journal of Food,2018,18(3):157−162. [6] 徐容. 浅谈二十一世纪食品工业新技术的应用[C]//上海食文化, 2006: 111−114. XU R. On the application of new technologies in the food industry in the 21st century [C]// Shanghai Food Culture, 2006: 111−114.
[7] 陈启航, 文丽华, 陈小娥, 等. 超高压辅助脱壳对虾夷扇贝肌原纤维蛋白生化特性及结构的影响[J]. 食品科学,2021,42(11):102−107. [CHEN Q H, WEN L H, CHEN X E, et al. Effects of ultra-high pressure assisted shelling on biochemical characteristics and structure of myofibrillar protein of shrimp scallop[J]. Food Science,2021,42(11):102−107. doi: 10.7506/spkx1002-6630-20200603-040 [8] 胡志和, 赵旭飞, 鲁丁强, 等. 超高压结合温热处理对脱脂乳透光率和粒径及蛋白溶解性的影响[J/OL]. 食品科学: 1−18[2021-08-29]. http://h-s.kns.cnki.net.neau.vpn358.com/kcms/detail/11.2206.ts.20201207.1017.010.html. HU Z H, ZHAO X F, LU D Q, et al. Effects of ultra-high pressure combined with warm heat treatment on light transmittance, particle size and protein solubility of skimmed milk [J/OL]. Food Science: 1−18 [2021-08-29]http://h-s.kns.cnki.net.neau.vpn358.com/kcms/detail/11.2206.ts.20201207.1017.010.html.
[9] 姜姝, 腾军伟, 刘振民, 等. 超高压处理对再制奶油干酪质构、流变学特性及微观结构的影响[J]. 食品科学,2021,42(5):84−91. [JIANG S, TENG J W, LIU Z M, et al. Effects of ultra-high pressure treatment on texture, rheological properties and microstructure of processed cream cheese[J]. Food Science,2021,42(5):84−91. [10] 陈壁, 黄勇桦, 张建平, 等. 体外模拟胃肠道消化和结肠发酵对长黑青稞多酚生物有效性和抗氧化活性的影响[J]. 食品科学,2020,41(21):28−35. [CHEN B, HUANG Y H, ZHANG J P, et al. Effects of simulated gastrointestinal digestion and colonic fermentation on polyphenol bioavailability and antioxidant activity of changhei highland barley in vitro[J]. Food science,2020,41(21):28−35. doi: 10.7506/spkx1002-6630-20191027-300 [11] 李斌, 张继月, 耿丽娟, 等. 软枣猕猴桃在体外模拟消化过程中酚类物质及抗氧化活性的变化规律[J/OL]. 食品科学: 1−14[2021-08-29]. http://h-s.kns.cnki.net.neau.vpn358.com/kcms/detail/11.2206.TS.20210315.1638.029.html. LI B, ZHANG J Y, GENG L J, et al. Changes of phenolic substances and antioxidant activity of soft jujube kiwifruit during simulated digestion in vitro [J/OL]. Food Science: 1−14 [2021-08-29]http://h-s.kns.cnki.net.neau.vpn358.com/kcms/detail/11.2206.TS.20210315.1638.029.html.
[12] DIDIER D, ALESSANDRA B, ANDRE B, et al. An international network for improving health properties of food by sharing our knowledge on the digestive process[J]. Food Digestion,2011,2(1-3):23−25. doi: 10.1007/s13228-011-0011-8
[13] SUN C, Dai L, LIU F, et al. Dynamic high pressure microfluidization treatment of zein in aqueous ethanol solution[J]. Food Chemistry,2016,210(1):388−395.
[14] 何晓叶, 任爽, 郑伊琰, 等. 不同缓冲体系下超高压处理对乳铁蛋白结构及理化性质的影响[J]. 中国食品学报,2021,34(5):174−184. [HE X Y, REN S, ZHENG Y Y, et al. Effects of ultra-high pressure treatment on the structure and physicochemical properties of lactoferrin under different buffer systems[J]. Chinese Journal of Food,2021,34(5):174−184. [15] 叶钰, 高金燕, 陈红兵, 等. 超声波加工对蛋清蛋白质结构和凝胶特性的影响[J]. 食品科学,2018,39(21):45−52. [YE Y, GAO J Y, CHEN H B, et al. Effects of ultrasonic processing on protein structure and gel properties of egg white[J]. Food Science,2018,39(21):45−52. doi: 10.7506/spkx1002-6630-201821007 [16] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food—an international consensus[J]. Food & Function,2014,5(6):1113−1124.
[17] OZGEN M, REESE R N, TULIO A Z, et al. Modified 2, 2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2'-diphenyl-1-picrylhydrazyl (DPPH) methods.[J]. Journal of Agricultural and Food Chemistry,2006,54(4):151.
[18] LIU Q, KONG B H, YOU L L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry,2009,118(2):403−410.
[19] LIU Q, KONG B H, HAN J C, et al. Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J]. Food Structure,2014,1(2):145−154. doi: 10.1016/j.foostr.2013.11.004
[20] 李梦寒. α-乳白蛋白对肠道菌群的影响[D]. 哈尔滨: 东北农业大学, 2019. LI M H. Effect of α-lactalbumin on intestinal flora [D]. Harbin: Northeast Agricultural University, 2019.
[21] BRENNAN C A, NAKATSU G, GALLINI C C A, et al. Aspirin modulation of the colorectal cancer-associated microbe Fusobacterium nucleatum[J]. Microbiology,2021,12(2):47.
[22] 步营, 何玮, 胡显杰, 等. 超高压对蓝蛤酶解液风味及其蛋白质结构的影响[J]. 食品科学技术学报,2021,39(1):104−116. [BU Y, HE W, HU X J, et al. Effect of ultra high pressure on flavor and protein structure of enzymatic hydrolysate of blue clam[J]. Journal of Food Science and Technology,2021,39(1):104−116. [23] 杜丽娜. 超高压处理对荞麦13S球蛋白结构与功能特性的影响[D]. 上海: 上海应用技术大学, 2020. DU L N. Effects of ultra high pressure treatment on the structure and functional properties of buckwheat 13S globulin [D]. Shanghai: Shanghai University of applied technology, 2020.
[24] 赵飞. 物理预处理对大豆分离蛋白结构和理化性质的影响机制[D]. 泰安: 山东农业大学, 2019. ZHAO F. Effect mechanism of physical pretreatment on structure and physicochemical properties of soybean protein isolate [D]. Tai'an: Shandong Agricultural University, 2019.
[25] LI M, MA Y, MICHAEL O. Ngadi. Binding of curcumin to β-lactoglobulin and its effect on antioxidant characteristics of curcumin[J]. Food Chemistry,2013,141(2):1504−1511. doi: 10.1016/j.foodchem.2013.02.099
[26] CHICON R, LOPEZ R, ALONSO E, et al. Proteolytic pattern, antigenicity, and serum immunoglobulin E binding of β-lactoglobulin hydrolysates obtained by pepsin and high-pressure treatments[J]. Journal of Dairy Science,2008,91(3):928−938. doi: 10.3168/jds.2007-0657
[27] 何晓叶, 任爽, 郑伊琰, 等. 不同缓冲体系下超高压处理对乳铁蛋白结构及理化性质的影响[J]. 中国食品学报,2021,21(5):174−184. [HE X Y, REN S, ZHENG Y Y, et al. Effects of ultra-high pressure treatment on the structure and physicochemical properties of lactoferrin under different buffer systems[J]. Chinese Journal of Food,2021,21(5):174−184. [28] LEE S, KIM S H, JO Y, et al. Conformation transition kinetics of silk fibroin in aqueous solution explored using circular dichroism spectroscopy[J]. ChemistrySelect,2021,6(8):1735−1740. doi: 10.1002/slct.202004180
[29] TAO Z, BO J, MING M, et al. Combined effects of high-pressure and enzymatic treatments on the hydrolysis of chickpea protein isolates and antioxidant activity of the hydrolysates[J]. Food Chemistry,2012,135(3):904−912. doi: 10.1016/j.foodchem.2012.05.097
[30] 孙颜君, 李志刚, 莫蓓红, 等. 超高压处理对浓缩乳清蛋白80加工性质和蛋白结构的影响[J]. 食品工业科技,2015,36(12):78−82,86. [SUN Y J, LI Z G, MO B H, et al. Effect of ultra high pressure treatment on processing properties and protein structure of concentrated whey protein 80[J]. Food Industry Science and Technology,2015,36(12):78−82,86. [31] ALI O, HANAN A. G, MAHMOUD A H, et al. Antibacterial peptides generated by Alcalase hydrolysis of goat whey[J]. LWT-Food Science and Technology,2016,65(5):480−486.
[32] MARTINA B O, RICHARD J, et al. Antioxidant effects of enzymatic hydrolysates of whey protein concentrate on cultured human endothelial cells[J]. International Dairy Journal,2014,36(2):128−135. doi: 10.1016/j.idairyj.2014.01.013
[33] PAN D, CAO J, GUO H, et al. Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry,2012,130(1):121−126. doi: 10.1016/j.foodchem.2011.07.011
[34] 李梦寒, 王志勇, 盛雪, 等. 基于16S rRNA技术分析α-乳白蛋白对大鼠肠道菌群的影响[J]. 食品科学,2020,41(6):164−171. [LI M H, WANG Z Y, SHENG X, et al. Analysis based on 16S rRNA technology α- Effect of lactalbumin on intestinal flora of rats[J]. Food Science,2020,41(6):164−171. [35] 朱秀清, 王源, 朱颖, 等. 大豆脑磷脂对汉麻分离蛋白Pickering乳液的形成及其性质的影响[J/OL]. 食品工业科技: 1−11[2021-07-23]. https://doi.org/10.13386/j.issn1002-0306.2021020124. ZHU X Q, WANG Y, ZHU Y, et al. Effects of soybean phosphatidylcholine on the formation and properties of hemp isolate Pickering emulsion [J/OL]. Food Industry Technology: 1-11[2021-07-23].https://doi.org/10.13386/j.issn1002-0306.2021020124.]
[36] JU M, ZHU G, HUANG G, et al. A novel pickering emulsion produced using soy protein-anthocyanin complex nanoparticles[J]. Food Hydrocolloids,2019,99:105.
[37] 王笑涵, 姜卉, 吴海涛, 等. 大黄鱼卵分离蛋白乳液的构筑及其体外消化规律[J]. 食品科学,2020,41(18):8−13. [WANG X H, JIANG H, WU H T, et al. The construction and in vitro digestion of rhubarb egg protein isolate emulsion[J]. Food Science,2020,41(18):8−13. doi: 10.7506/spkx1002-6630-20190914-167 [38] 庞佳坤, 郑远荣, 刘振民, 等. 超高压对乳清分离蛋白结构和抗氧化活性的影响[J]. 食品与发酵工业,2020,46(4):72−77. [PANG J K, ZHENG Y R, LIU Z M, et al. Effects of ultra-high pressure on the structure and antioxidant activity of whey protein isolate[J]. Food and Fermentation Industry,2020,46(4):72−77. [39] 王娇. 超高压处理对蜂王浆品质特性的影响[D]. 兰州: 甘肃农业大学, 2020. WANG J. Effect of ultra high pressure treatment on quality characteristics of royal jelly[D]. Lanzhou: Gansu Agricultural University, 2020.
[40] 赵越. 超高压处理对Lactobacillus delbrueckii QS306发酵乳ACE抑制活性及品质的影响[D].呼和浩特:内蒙古农业大学, 2020. ZHAO Y. Effects of ultra high pressure treatment on ACE inhibitory activity and quality of Lactobacillus delbrueckii QS306 fermented milk [D] Agricultural University of Inner Mongolia: Hohhot, 2020.
[41] 朱金艳. 高静水压对蓝莓汁品质影响及杀菌机理研究[D]. 沈阳: 沈阳农业大学, 2018. ZHU J Y. Study on the effect of high hydrostatic pressure on the quality of blueberry juice and its sterilization mechanism[D]. Shenyang: Shenyang Agricultural University, 2018.
[42] 王贝贝, 于哲, 李强, 等. 模拟胃肠消化对羊皮胶原肽抗氧化活性的影响及其消化保护分析[J/OL]. 食品科学: 1-15[2021-08-29]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210430.1550.024.html. WANG B B, YU Z, LI Q, et al. Effect of simulated gastrointestinal digestion on antioxidant activity of sheep skin collagen peptide and its digestive protection[J/OL]. Food Science: 1-15 [2021-08-29]http://kns.cnki.net/kcms/detail/11.2206.TS.20210430.1550.024.html.
[43] TANG B Z, TAI P H, HUA B L, et al. The Structure-activity relationship of the antioxidant peptides from natural proteins[J]. Molecules (Basel, Switzerland),2016,21(1):72. doi: 10.3390/molecules21010072
[44] 马思彤, 刘静波, 张婷, 等. 体外模拟胃肠消化及碱性蛋白酶处理后蛋清肽抗氧化活性差异及肽序列解析[J]. 食品科学,2020,41(21):122−129. [MA S T, LIU J B, ZHANG T, et al. Antioxidant activity difference and peptide sequence analysis of egg white peptides after simulated gastrointestinal digestion and alkaline protease treatment in vitro[J]. Food Science,2020,41(21):122−129. [45] 白英, 殷佳棋, 兰秀芬, 等. 乳清蛋白水解物对产胞外多糖L. paracasei LX5的促生长作用研究[J]. 中国乳品工业,2021,49(2):14−18,23. [BAI Y, YIN J Q, LAN X F, et al. Study on the growth promoting effect of whey protein hydrolysate on the production of extracellular polysaccharide L. paracasei LX5[J]. China Dairy Industry,2021,49(2):14−18,23. [46] LUCAS A, SODINI I, MONNET C, et al. Probiotic cell counts and acidification in fermented milks supplemented with milk protein hydrolysates[J]. International Dairy Journal,2004,14(1):47−53. doi: 10.1016/S0958-6946(03)00147-X
[47] RIVALAIN N, ROQUAIN J, DEMAZEAU G. Development of high hydrostatic pressure in biosciences: Pressure effect on biological structures and potential applications in Biotechnologies[J]. Biotechnology Advances,2010,28(6):659−672. doi: 10.1016/j.biotechadv.2010.04.001
[48] PELLEGRINI A, THOMAS U, BRAMAZ N, et al. Isolation and identification of three bactericidal domains in the bovine alpha-lactalbumin molecule[J]. Biochimica et Biophysica Acta (BBA) - General Subjects,1999,1426(3):439−448. doi: 10.1016/S0304-4165(98)00165-2
-
期刊类型引用(2)
1. 迟晓君,王璇,张大鹏,翟梦尧,张瑞杰,韦新彤,孙文君. 黄粉虫蛋白粉成分分析及体外模拟消化功效评价. 山东农业大学学报(自然科学版). 2023(05): 683-690 .  百度学术
百度学术
2. 丛海花,常珂欣,朱嘉雯,逯晓燕,周倩,耿文豪,杨天. 酶解褐藻寡糖对扇贝肌原纤维蛋白体外消化特性的影响. 肉类研究. 2022(12): 7-14 .  百度学术
百度学术
其他类型引用(8)





 下载:
下载:




 下载:
下载:



