Protective Effect of Polygonatum odoratum Polysaccharides on A7r5 Cell Senescence Induced by D-Galactose
-
摘要: 目的:研究玉竹多糖(Polygonatum odoratum polysaccharides,POP)对D-半乳糖(D-galactose,D-gal)诱导大鼠胸大动脉平滑肌细胞(A7r5)衰老的保护作用。方法:采用水提醇沉法提取POP,并通过苯酚-硫酸法测得POP中总糖含量。应用D-gal建立A7r5细胞衰老模型,采用MTT法、β-gal染色、活性氧(ROS)、JC-1染色法检测POP对D-gal诱导A7r5细胞衰老的保护作用。结果:POP多糖得率为8.23%,总糖含量为76.48%±0.036%。MTT结果显示POP在400 μg/mL处理A7r5细胞24 h可促进细胞增殖,细胞存活率为174.89%±3.30%。40 mg/mL D-gal处理A7r5细胞48 h可降低细胞存活率至65.93%±1.63%。POP浓度为100 μg/mL时对D-gal诱导A7r5细胞存活率下降的保护作用最为显著,与对照组相比细胞存活率可达到226.87%±12.58%(P<0.001)。POP可减少D-gal诱导A7r5细胞产生的β-半乳糖苷酶(SA-β-gal)含量,抑制衰老细胞中ROS水平,增加JC-1荧光染色阳性细胞数,保护线粒体膜电位稳定。结论:POP可以抑制氧化应激,抑制D-gal诱导A7r5细胞衰老,具有良好的体外抗衰老作用。Abstract: Objective: The protective effect of Polygonatum odoratum polysaccharides (POP) on D-galactose (D-gal) induced senescence in rat aortic smooth muscle cells (A7r5) was investigated. Methods: Firstly, the POP was extracted by the water extraction and alcohol precipitation methods. Next, the phenol concentrated sulfuric acid method was applied to further measure the total sugar content of POP. In addition, the A7r5-senescent cell model was established by the D-galactose treatment. Finally, the MTT assay, β-galactosidase staining, reactive oxygen species (ROS) staining as well as JC-1 staining were applied to further detect the protective effect of POP in A7r5-senescent cells induced by D-galactose. Results: This study found an yield of POP was 8.23% and its total sugar content was 76.48%±0.036%. As a result, the MTT assay showed the viability of the A7r5 cells was increased to 174.89%±3.30% after 24 h treatment by 400 μg/mL of POP, while it was decreased to 65.93%±1.63% after 48 h treatment by 40 mg/mL of D-galactose. Interestingly, when a concentration of POP was 100 μg/mL, this study had found the most significant protective effect in A7r5-senescent cells induced by D-galactose, which increased its cell viability to 226.87%±12.58% as compared with the control group (P<0.001). Additionally, POP decreased the total β-galactosidase, inhibited its ROS levels, increased the number of positive cells after JC-1 staining, as well as protected the stability of mitochondrial membrane potential in A7r5 cells induced by D-galactose. Conclusion: POP had a potential role in the suppression of oxidative stress and cellular senescence in A7r5 cells induced by D-galactose, which could further support its anti-aging effects in vitro.
-
随着人口老龄化的增加,探索衰老的相关分子机制已成为现代科学研究的一个重要研究热点[1-2]。衰老是由氧化应激[3]引起或在正常条件下生物发育成熟后,一个缓慢的自身机能减退以及结构和功能逐渐退化的过程[4-5]。衰老过程中,细胞形态变化与分子水平改变往往渐进性影响健康,因此衰老与疾病和死亡密切相关[6]。大多数正常细胞的分裂能力是有限的,细胞停止分裂后就进入衰老状态,因此衰老细胞被认为是机体衰老的重要原因[7]。
玉竹(Polygonatum odoratum),为百合科黄精属多年生植物的干燥根茎,呈圆柱形,种类各异。为我国传统中药材,并记载在《神农本草经》中。玉竹主要化学成分包括多糖、类固醇、蒽醌、生物碱、皂苷、维生素等[8],已被证明在治疗与年龄有关的疾病如糖尿病、肺病、疲劳和消化不良的临床实践中非常有效,玉竹不仅具有药用价值,还具有食用价值,被列为药食同源性物品[9-10]。许多中草药中的多糖成分已被证明具有抗衰老活性,并引起抗衰老领域专家越来越大的兴趣[11]。多糖是玉竹根中最主要的活性成分,目前有很多关于玉竹多糖(Polygonatum odoratum polysaccharides,POP)的药理作用、自由基清除及其抗氧化活性的研究[12-14]。李化强等[15]研究表明POP对DPPH·、
本研究应用水提醇沉的方法提取POP,并用Sevag法去除多糖中的蛋白质。应用D-gal作用于大鼠胸大动脉平滑肌细胞(A7r5)建立细胞衰老模型,研究POP对D-gal诱导A7r5细胞衰老的保护作用,为POP的抗衰老基础研究及抗衰老食品的研发提供理论依据。
1. 材料与方法
1.1 材料与仪器
玉竹干燥根茎 长白山特色植物种植地;大鼠胸大动脉平滑肌细胞(A7r5) 北京北纳创联生物技术研究院;乙醇 辽宁泉瑞试剂有限公司;氯仿 天津凯信化学工业有限公司;苯酚、硫酸、正丁醇 国药集团化学试剂有限公司;D-氨基半乳糖胺(D-gal) 北京金泰宏达生物科技有限公司;DMSO、维生素E(VE) 美国Sigma公司;MTT 美国Amresco公司;DMEM培养液、胎牛血清 美国Gibco公司;胰蛋白酶 美国Invitrogen公司;BCA蛋白浓度测定试剂盒、细胞衰老β半乳糖苷酶(SA-β-gal)试剂盒、JC-1线粒体膜电位检测试剂盒 碧云天生物科技有限公司。
Z323K低温高速离心机、Infinite M200 PRO酶标仪 美国Beckman公司;TDL-5-R低速离心机 上海安亭科学仪器厂;EZ585台式冻干机 美国SIM公司;MCO-18AICUVL-PC二氧化碳培养箱 日本Panasonic公司;MDF-U4086S −80 ℃超低温冰箱 日本SANYO公司;CLRSS II TYPE B2超净工作台 北京HDL公司;TH4-200倒置荧光显微镜、FV1200激光共聚焦显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 POP的提取与纯化
目前提取POP的方法有超声波辅助法、超声波辅助酶法、水提醇沉法等。其中超声波辅助法可破坏植物细胞的细胞壁易影响多糖结构[18-19]。本实验采用简单、易操作、提取率高的水提醇沉法提取玉竹粗多糖,经查阅多篇文献,现已确定水提醇沉法提取黑龙江源POP可获得最佳提取率为7.93%,其选择的提取条件为温度80 ℃,时间2 h,固液比1:15 g/mL[20]。在本研究中,在该条件基础上进行多次预实验,优化POP提取条件,发现POP提取条件在料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下进行煎煮,可得到最佳提取率,故我们选用该条件进行POP的提取。首先称取玉竹根茎300 g,研磨打碎,按上述实验条件进行提取,反复三次后合并三次的提取液,而后进行浓缩至700 mL。将浓缩液3500 r/min离心10 min,去除沉淀。用分液漏斗缓慢滴入无水乙醇直至乙醇含量达到90%。4 ℃冰箱静置过夜,次日取出后3500 r/min离心,去上清,沉淀物用无水乙醇洗脱,干燥后得到玉竹粗多糖。
将玉竹粗多糖溶于蒸馏水中配置成5%的糖溶液,放置于−80 ℃冰箱过夜,次日取出置于水浴箱中溶解,12000 r/min离心弃沉淀,反复冻融直至无沉淀离出。将氯仿和正丁醇以4:1的比例配制混合液进行Sevag,取多糖溶液与氯仿、正丁醇混合液按1:4混合,震荡1 h,4000 r/min离心15 min,此时离心管内会出现三层,上层为糖溶液,中间层为变性蛋白,下层为有机试剂,收取最上层的糖溶液,反复Sevag直至无变性蛋白析出。把Sevag后的糖溶液加入3500 Da的透析袋中,置于流水下24 h,最后将透析24 h后的多糖溶液收集到平皿中,在22 mT、−102.8 ℃条件下冻干,得到POP。POP得率计算公式:
(1) 式中:M1为提取出的POP的质量,g;M2为玉竹原材料质量,g。
1.2.2 POP总糖含量测定
本实验应用苯酚-硫酸法测定POP中总糖含量,目前已有研究测量其含量为75.23%[21]。首先配制葡萄糖标准液使其浓度为100 μg/mL,然后将其稀释为0、10、20、40、60、80、100 μg/mL浓度梯度的葡萄糖溶液,分别取葡萄糖标准液0、0.1、0.2、0.4、0.6、0.8、1 mL于试管中,用蒸馏水定容至1 mL,将POP配制成100 μg/mL的糖溶液1 mL,在不同浓度梯度的葡萄糖溶液及POP溶液中依次加入6%苯酚溶液0.5 mL,浓硫酸2.5 mL,振荡,沸水浴10 min,然后冷却至室温,490 nm处测得吸光度值。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,计算POP中总糖含量。
1.2.3 A7r5细胞活力测定
1.2.3.1 POP对A7r5细胞增殖的影响
将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,设置对照组,25、50、100、200、400、800 μg/mL POP处理组,每组6个平行实验,置于37 ℃、5% CO2培育箱孵育过夜。次日用上述浓度梯度的POP溶液处理细胞24 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:
(2) 式中:A处理组为不同浓度POP处理后测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.3.2 D-gal对A7r5细胞增殖的影响
将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,根据查阅文献得到D-gal致细胞衰老模型的适宜浓度梯度[22-23],对本实验的处理浓度及处理时间进行条件摸索。设置对照组,5、10、20、40、80 mg/mL D-gal处理组,每组6个平行实验,至于37 ℃、5% CO2培育箱孵育过夜。次日用上述浓度梯度的D-gal处理细胞24和48 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:
(3) 式中:A处理组为不同浓度D-gal处理后测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.3.3 POP对D-gal处理A7r5细胞增殖的影响
将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,设置对照组、D-gal模型组、POP处理组,每组6个平行实验。置于37 ℃、5% CO2培育箱孵育过夜。待细胞长到适宜的密度后,首先用25、50、100、200、400、800 μg/mL POP处理细胞5 h后,将模型组和处理组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:
(4) 式中:A处理组为不同浓度POP处理组及D-gal模型组测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.4 POP对D-gal诱导A7r5细胞内指标的影响
1.2.4.1 A7r5细胞内SA-β-gal活性的测定
将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以1.1×105 cells/孔接种于6孔板中,设置对照组、D-gal模型组、POP处理组和VE阳性对照组,每组3个平行实验。至于37 ℃、5% CO2培育箱孵育过夜。次日先用100 μg/mL POP和100 μg/mL VE处理细胞5 h后,将模型组、POP处理组和阳性对照组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后用β-半乳糖苷酶染色试剂盒进行染色,首先用PBS清洗1次,加入染色固定液每孔1 mL,37 ℃、5% CO2培育箱固定15 min,然后用PBS清洗3次,每次3 min,清洗完毕后加入染色液A 10 μL/孔、染色液B 10 μL/孔、染色液C 930 μL/孔、X-Gal溶液50 μL/孔,而后将培养皿封闭放入无CO2培养箱中孵育过夜。倒置荧光显微镜对细胞进行拍照,以评估POP对D-gal诱导A7r5细胞内SA-β-gal活性的影响。
1.2.4.2 A7r5细胞产生活性氧(ROS)的测定
为检测D-gal诱导A7r5细胞内活性氧的产生,应用ROS试剂盒进行染色。细胞培养方法同1.2.4.1。将处理后细胞中的培养液去除,加入PBS清洗1次,以1:2000的比例用无血清的DMEM稀释DCFH-DA,每孔加入1 mL DCFH-DA稀释液使其细胞表面充分覆盖,37 ℃细胞培养箱孵育20 min后去除稀释液,用无血清的DMEM清洗3次,3 min/次。荧光显微镜观察各组细胞染色的荧光强度,研究POP对ROS产生的影响。
1.2.4.3 A7r5细胞线粒体膜电位的测定
为了检测POP对D-gal诱导A7r5细胞线粒体膜电位变化的影响,采用线粒体膜电位试剂盒(JC-1)以JC-1为荧光探针检测细胞的线粒体膜电位变化。将6孔板内每孔滴入200 μL培养液,将高压灭菌后的盖玻片缓慢放入6孔培养皿中使盖玻片与培养皿底部贴合,培养A7r5细胞后,以11×104 cells/孔接种于6孔板中,每孔缓慢滴入2 mL细胞培养液。设置对照组、D-gal模型组、POP处理组和VE阳性对照组,每组3个平行实验。至于37 ℃、5% CO2培育箱孵育过夜。次日先用100 μg/mL POP和100 μg/mL VE处理细胞5 h后,将模型组、处理组和阳性对照组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后用线粒体膜电位试剂盒进行染色,首先PBS清洗1次,加入1 mL培养液再加入1 mL JC-1染色工作液,充分混合后放入CO2培养箱孵育20 min,然后用JC-1染色缓冲液(×1)4 ℃冰浴洗涤2次,最后每孔加入2 mL培养液,将有细胞覆盖的盖玻片用针头取出,封片在激光共聚焦显微镜下进行观察拍照。
1.3 数据处理
数据进行处理与统计学分析应用GraphPad Prism 6.01,试验结果均为3次平行试验所得,数据以均值±标准差(
2. 结果与分析
2.1 POP的提取及测定
300 g玉竹根茎按照料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下煎煮浓缩,醇沉、sevag提取POP共24.68 g,POP得率为8.23%。
苯酚-硫酸法测得POP总糖含量,根据葡萄糖标准曲线,得到线性回归方程y=0.007x+0.0162,R2=0.9923。POP浓度为100 μg/mL时吸光度为0.52,根据公式得POP的总糖含量为76.48%±0.036%。
2.2 POP对A7r5细胞增殖的影响
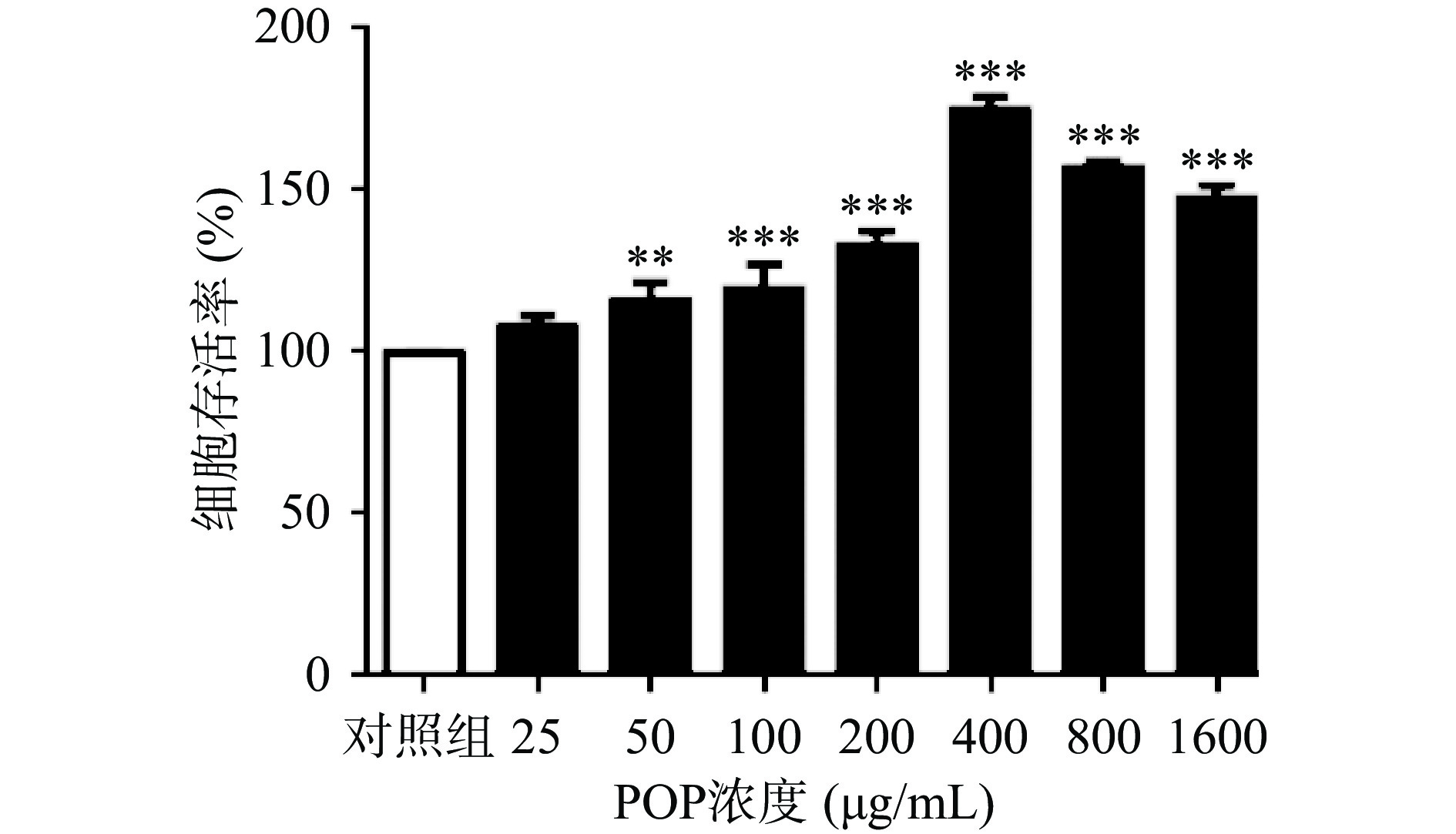
MTT检测POP对A7r5细胞活力的影响,如图1,实验表明25、50、100、200、400、800、1600 μg/mL浓度梯度的POP处理A7r5细胞24 h后,POP呈剂量依赖性提高细胞活力,促进细胞增殖,当浓度为400 μg/mL时,POP对A7r5细胞促增值作用最强,细胞存活率为174.89%±3.30%(P<0.001,n=3)。
![]() 图 1 POP对A7r5细胞存活率的影响注:与对照组相比,*表示P<0.05;**表示P<0.01;***表示P<0.001(n=3);图2同。Figure 1. Effect of POP on the survival of A7r5 cells
图 1 POP对A7r5细胞存活率的影响注:与对照组相比,*表示P<0.05;**表示P<0.01;***表示P<0.001(n=3);图2同。Figure 1. Effect of POP on the survival of A7r5 cells2.3 D-gal对A7r5细胞增殖的影响
MTT实验表明,图2A为不同浓度D-gal处理A7r5细胞24 h,与对照组相比,80 mg/mL D-gal刺激A7r5细胞24 h,细胞存活率约为56.95%±2.78%(P<0.001,n=3)。图2B为不同浓度D-gal处理A7r5细胞48 h,与对照组相比,40 mg/mL D-gal刺激A7r5细胞48 h细胞存活率约为65.93%±1.63%(P<0.001,n=3)。D-gal呈剂量依赖性诱导A7r5细胞存活率下降。考虑到D-gal浓度过高会导致细胞凋亡或死亡的不可逆性损伤,此时的细胞损伤量是研究体外细胞衰老的最适剂量与时间。因此,本实验选用40 mg/mL D-gal处理48 h进行构建A7r5细胞衰老模型。
2.4 POP对D-gal处理A7r5细胞增殖的影响
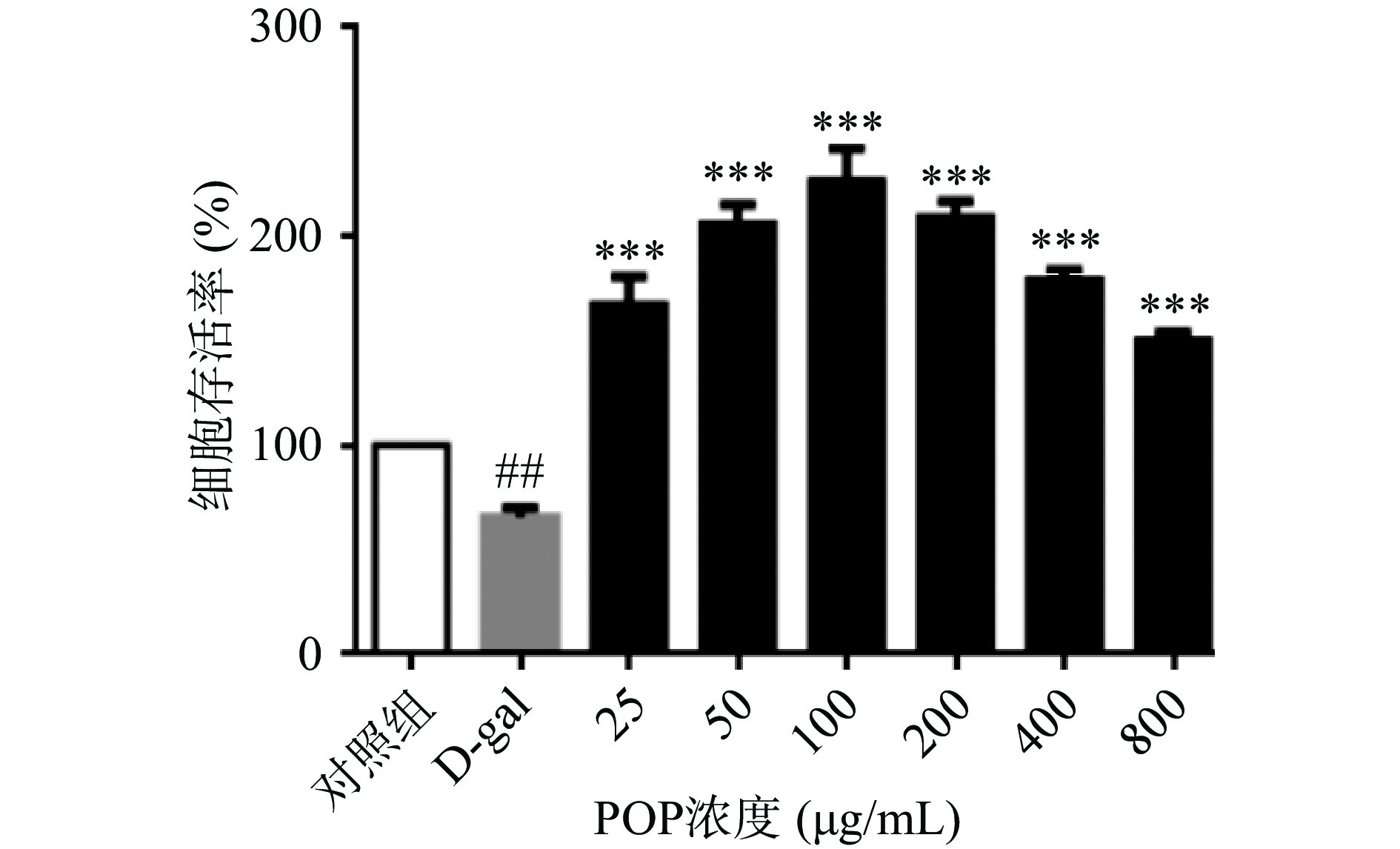
MTT实验结果表明,如图3,与对照组相比,D-gal组诱导A7r5细胞存活率下降(P<0.001,n=3);与D-gal组相比,在加入25~800 μg/mL浓度梯度的POP 5 h后,加入40 mg/mL D-gal处理48 h后,均可促进细胞增殖。浓度为100 μg/mL时POP对D-gal诱导A7r5细胞存活率下降的保护作用最为显著,细胞存活率为226.87%±12.58%(P<0.001,n=3)。因此,本实验选用浓度为100 μg/mL的POP及相应浓度的VE阳性对照进行后续细胞染色的研究。
2.5 POP对A7r5细胞内SA-β-gal产生的影响
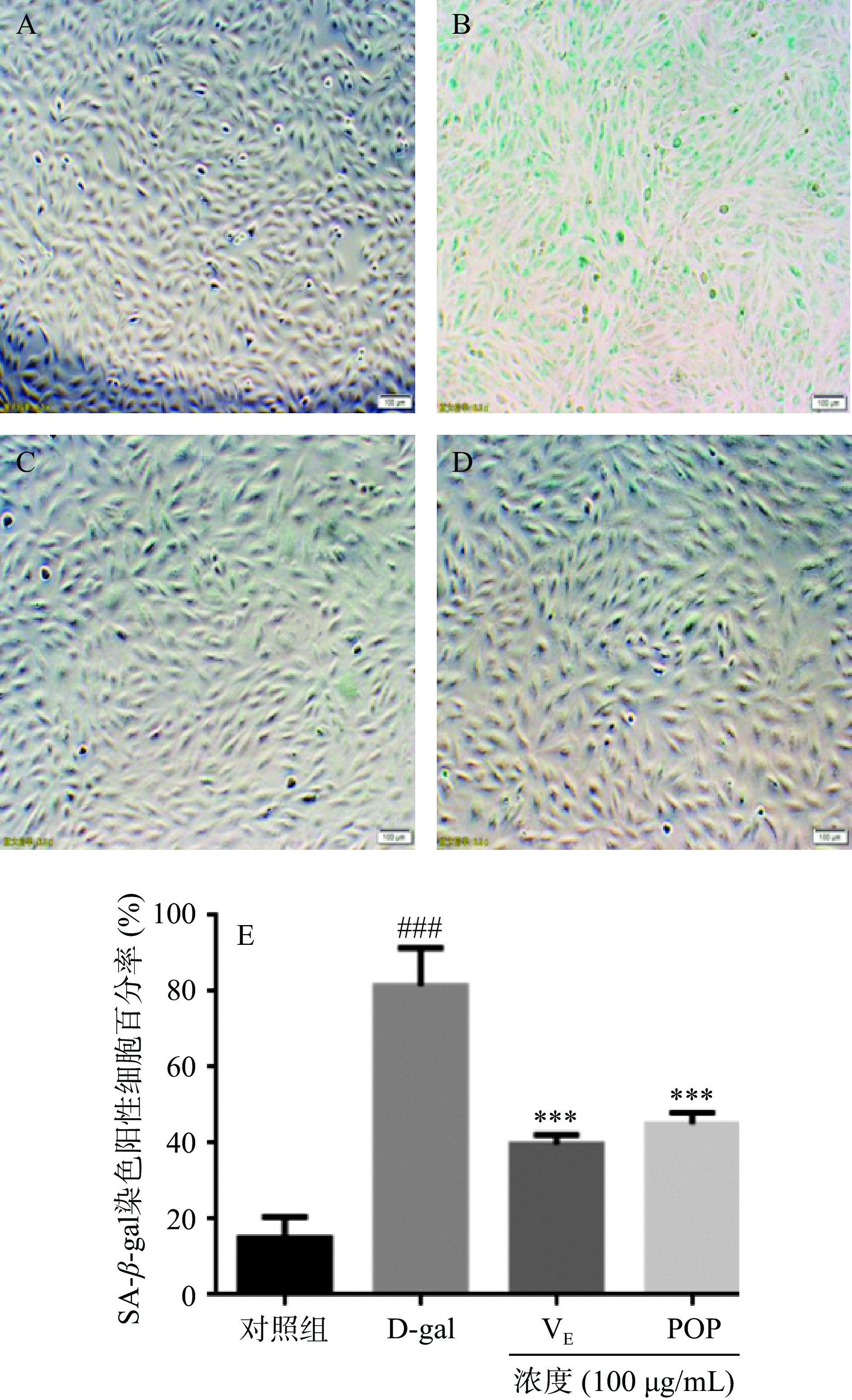
对D-gal及POP处理A7r5细胞后所产生的衰老相关SA-β-gal进行检测,如图4A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP组(100 μg/mL)细胞的SA-β-gal染色情况,图4E为SA-β-gal染色阳性细胞计数分析。染色结果表明,与对照组相比经D-gal处理的模型组SA-β-gal表达水平明显增加,SA-β-gal染色阳性细胞百分比为81.33%±8.17%(P<0.001,n=3)。100 μg/mL POP处理组及VE阳性对照组处理后,图4C~D中SA-β-gal催化下生成的蓝色产物明显减少,SA-β-gal染色阳性细胞百分比分别为44.67%±2.49%、39.67%±2.05%。实验结果表明,D-gal诱导细胞发生衰老,且POP有效降低了D-gal刺激A7r5细胞产生SA-β-gal的表达情况(P<0.01,n=3)。
2.6 POP对D-gal诱导A7r5细胞产生ROS的抑制作用
如图5A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP组(100 μg/mL)细胞的ROS荧光染色情况,图5E为ROS染色的荧光强度细胞计数分析,与对照组相比,模型组中阳性细胞数增多,ROS染色阳性细胞荧光强度为75.15%±3.70%(P<0.001,n=3)荧光强度明显增强。结果表明A7r5细胞经D-gal处理后ROS水平升高。与模型组相比,VE阳性对照组和POP处理组中细胞染色阳性细胞数减少,ROS染色阳性细胞荧光强度分别为27.41%±1.96%、25.41%±2.58%,荧光强度明显下调(P
<0.001,n=3)。细胞内的酯酶可以将本身没有荧光的探针DCFH-DA水解。活性氧可将水解产物DCFH氧化为有荧光的DCF,从而利用荧光强度反应活性氧水平。实验结果表明,POP可以有效抑制D-gal诱导的A7r5细胞中ROS的表达水平。 2.7 POP对A7r5细胞线粒体膜电位的影响
应用线粒体膜电位检测试剂盒(JC-1)对D-gal刺激A7r5细胞的线粒体膜电位变化进行检测。如图6A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP组(100 μg /mL)、图6E为JC-1染色的荧光强度细胞计数分析。通过共聚焦显微镜检测JC-1时可以参考观察其它荧光时的设置,通过PI通道可观察到聚合物(JC-1 aggregates)红色荧光,FITC通道可观察到JC-1单体(JC-1 monomer)绿色荧光。并对不同通道的红绿荧光进行Merge。通过红绿荧光颜色的转变可知线粒体膜电位的变化。染色结果表明,与对照组相比,经D-gal处理的模型组JC-1染色的红色荧光强度为18.74%±2.96%(P<0.001,n=3),此时JC-1多为单体,绿色荧光强于红色荧光,表明线粒体膜电位降低。与模型组相比,100 μg/mL POP处理组及VE阳性对照组处理后,JC-1在线粒体的基质中聚集形成聚合物,绿色荧光强度减弱,红色荧光强度升高分别为41.78%±3.24%、51.48%±4.69%,线粒体膜电位升高。结果表明POP对D-gal诱导的A7r5衰老细胞线粒体膜电位具有保护作用。
3. 讨论
随着老龄化社会的到来,衰老相关疾病阿尔茨海默病、2型糖尿病、骨质疏松、动脉粥样硬化等可严重影响人群健康。因此,抗衰老的研究也成为衰老研究领域的热点。本研究采用水提醇沉法提取传统中草药玉竹根中的多糖活性成分,在料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下POP得率可达到8.23%,测得所提取的POP总糖含量为76.48%±0.036%。通过β-gal染色法、活性氧染色法、JC-1染色法深入探讨POP体外抗衰老的生物学过程。
D-gal致衰老模型的生化指标和生理指标均与自然衰老相似,并广泛用于抗衰老的研究[24]。目前有很多研究应用D-gal构建衰老模型,诱使ROS累积产生氧化应激[25-26]。Liu等[27]应用D-gal诱导心肌细胞衰老,影响心肌细胞内SA-β-gal活性、ROS的产生及MDA含量。本研究成功构建D-gal诱导A7r5细胞衰老模型,并进一步证实POP可呈剂量依赖性增强A7r5细胞活性,且浓度在100 μg/mL时可显著保护D-gal诱导的A7r5细胞存活率下降,维持细胞正常活性。蒋春茂等[28]的研究证实POP浓度为1250 μg/mL时可增强T淋巴细胞的活性,并增强脂多糖刺激后脾脏B淋巴细胞的活性。王迦琦等[29]研究表明植物中多糖成分具有提高细胞存活率,保护细胞氧化损伤的能力。
衰老细胞通常在pH6.0时有高酶活性的SA-β-gal,目前SA-β-gal已被证实与衰老密切相关[30]。SA-β-gal作为一种溶酶体水解酶,是目前应用最广泛的细胞衰老生物标志物[31]。吴爽等[32]的研究中表明衰老的人皮肤成纤维细胞中SA-β-gal活性显著升高。本研究检测不同组别A7r5细胞中SA-β-gal活性的变化,与模型组相比,POP可降低D-gal诱导的A7r5细胞中SA-β-gal活性。因此POP可以减少衰老细胞中SA-β-gal的产生。
D-gal可诱导细胞代谢及特异性酶的改变,半乳糖合成酶可将D-gal氧化产生大量自由基,并使ROS水平增加,导致DNA稳定性遭到破坏进而诱导氧化应激反应,损伤细胞,改变细胞膜的成分,从而诱导细胞衰老[33-34]。ROS在细胞生物学中发挥重要的作用,它们主要来源于线粒体[35-36]。ROS的产生可以引发氧化应激[37],从而导致线粒体功能紊乱。细胞衰老与线粒体功能障碍有很大的联系。许梦然等[38]证实植物中草药中的多糖成分可有效抑制ROS水平,保护及线粒体膜电位稳定。但目前还未有关于POP抑制氧化应激保护线粒体膜电位的研究。应用线粒体膜电位的变化反应其线粒体功能的稳定性,在线粒体膜电位较高时,JC-1聚集在线粒体的基质中形成聚合物产生红色荧光。在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体产生绿色荧光[39-40]。我们的研究证实,与模型组相比,POP可使D-gal诱导的A7r5细胞中ROS水平明显降低,抑制氧化应激,此时JC-1多为聚合体形式红色荧光增强,线粒体膜电位升高。因此POP可抑制细胞内ROS的产生,抑制线粒体膜电位下降使线粒体膜电位稳定,从而保护D-gal诱导的A7r5细胞衰老。
4. 结论
多糖为玉竹中最主要成分,毒副作用小,具有药食同源的功效。本研究应用简单、易操作、得率高的水提醇沉法提取POP。并将所提取纯化的POP作用于A7r5细胞研究其对D-gal刺激A7r5细胞损伤的保护作用。细胞实验表明POP可有效地促进细胞增殖,增强细胞活力,抑制D-gal诱导A7r5细胞存活率下降,减少D-gal诱导A7r5细胞衰老时SA-β-gal的产生。POP可降低经D-gal诱导后A7r5细胞中ROS的荧光强度,抑制氧化应激保护线粒体膜电位稳定,从而抑制细胞衰老。在今后的研究中,本实验将针对其生物学分子机制,更深入地研究POP的抗衰老作用机制,为POP的应用及抗衰老食品的研发领域提供理论依据。
-
图 1 POP对A7r5细胞存活率的影响
注:与对照组相比,*表示P<0.05;**表示P<0.01;***表示P<0.001(n=3);图2同。
Figure 1. Effect of POP on the survival of A7r5 cells
-
[1] KUČEROVÁ Z, RÁC M, MIKULÍK J, et al. The anti-senescence activity of cytokinin arabinosides in wheat and arabidopsis is negatively correlated with ethylene production[J]. Int J Mol Sci,2020,21(21):8109. doi: 10.3390/ijms21218109
[2] CHO E G, CHOI S Y, KIM H, et al. Panax ginseng-derived extracellular vesicles facilitate anti-senescence effects in human skin cells: An eco-friendly and sustainable way to use ginseng substances[J]. Cells,2021,10(3):486. doi: 10.3390/cells10030486
[3] GAMBINO V, DE M G, VENEZIA O, et al. Oxidative stress activates a specific p53 transcriptional response that regulates cellular senescence and aging[J]. Aging Cell,2013,12:435−445. doi: 10.1111/acel.12060
[4] POROPATICH K, FONTANAROSA J, SAMANT S, et al. Cancer immunotherapies: Are they as effective in the elderly?[J]. Drugs Aging,2017,34(8):567−581. doi: 10.1007/s40266-017-0479-1
[5] LARA J, SHERRATT M J, REES M. Aging and anti-aging[J]. Maturitas,2016,93:1−3. doi: 10.1016/j.maturitas.2016.08.020
[6] HERNANDEZ S A, NEHME J, DEMNRIA M. Hallmarks of cellular senescence[J]. Trends Cell Biol,2018,28:436−453. doi: 10.1016/j.tcb.2018.02.001
[7] GURAU F, BALDNOI S, PRATTICHIZZO F, et al. Anti-senescence compounds: A potential nutraceutical approach to healthy aging[J]. Ageing Res Rev,2018,46:14−31. doi: 10.1016/j.arr.2018.05.001
[8] ZHAO P, ZHAO C C, LI X, et al. The genus Polygonatum: A review of ethnopharmacology, phytochemistry and pharmacology[J]. J Ethnopharmacol,2018,214:274−291. doi: 10.1016/j.jep.2017.12.006
[9] 赵容, 许亮, 谢明, 等. 中药玉竹的本草考证[J]. 中国实验方剂学杂志,2017,15:227−234. [ZHAO R, XU L, XIE M, et al. Textual research of Polygonati odorati rhizoma[J]. Chinese Journal of Experimental Traditional Medical Formulae,2017,15:227−234. [10] CUI X W, WANG S Y, CAO H, et al. A review: The bioactivities and pharmacological applications of Polygonatum sibiricum polysaccharides[J]. Molecules,2018,23(5):1170. doi: 10.3390/molecules23051170
[11] 桑野, 李晓光, 张昌浩, 等. 国内植物多糖的研究及发展趋势[J]. 吉林医药学院学报,2017,38(6):455−457. [SANG Y, LI X G, ZHANG C H, et al. Research and development trend of domestic plant polysaccharides[J]. Journal of Jilin Medical College,2017,38(6):455−457. [12] 余江南, 姜慧妍, 徐遥, 等. 玉竹多糖的结构及其生物活性研究进展[J]. 现代食品科技,2018,34(8):273−282,144. [YU J N, JIANG H Y, XU Y, et al. Research progress on the structure and biological activity of Polygonatum odoratum polysaccharides[J]. Modern Food Science and Technology,2018,34(8):273−282,144. [13] 李耀光, 曹珂, 罗灿选. 玉竹多糖的组成及其体外抗氧化活性研究[J]. 食品工业,2018,39(5):184−186. [LI Y G, CAO K, LUO C X. Study on the composition of Polygonatum odoratum polysaccharide and its in vitro antioxidant activity[J]. Food Industry,2018,39(5):184−186. [14] 宁慧, 李会宁, 杨培君. 玉竹多糖的抗氧化作用研究[J]. 陕西理工学院学报(自然科学版),2013,29(6):59−65. [NING H, LI H N, YANG P J. Study on the antioxidant effect of Polygonatum odoratum polysaccharides[J]. Journal of Shaanxi Institute of Technology (Natural Science Edition),2013,29(6):59−65. [15] 李化强, 吴菲菲, 龙艳珍, 等. 湘玉竹多糖的体外抗氧化活性研究[J]. 食品安全质量检测学报,2017,8(8):3062−3067. [LI H Q, WU F F, LONG Y Z, et al. Study on the in vitro antioxidant activity of the polysaccharides from Xiangyu bamboo[J]. Journal of Food Safety and Quality Inspection,2017,8(8):3062−3067. doi: 10.3969/j.issn.2095-0381.2017.08.037 [16] 彭壮, 李弘, 彭莎, 等. 玉竹多糖对D-半乳糖诱导的衰老小鼠认知障碍的改善[J]. 中华中医药学刊,2020,38(11):8. [PENG Z, LI H, PENG S, et al. Polygonatum odoratum polysaccharides improve cognitive impairment in D-galactose-induced aging mice[J]. Chinese Journal of Traditional Chinese Medicine,2020,38(11):8. [17] LI B, WU P P, FU W W, et al. Polygonatum sibiricum the role and mechanism of miRNA-1224 in the polysaccharide regulation of bone marrow-derived macrophages to osteoclast differentiation[J]. Rejuvenation Res,2019,22:420−430. doi: 10.1089/rej.2018.2126
[18] 仇宏伟. 超声波辅助酶法提取玉竹多糖工艺研究[J]. 青岛农业大学学报(自然科学版),2020,37(1):38−42,52. [CHOU H W. Study on the technology of ultrasonic-assisted enzymatic extraction of polysaccharides from Polygonatum odoratum[J]. Journal of Qingdao Agricultural University (Natural Science Edition),2020,37(1):38−42,52. [19] 李素红, 王昭曦, 姜晓坤, 等. 超声波辅助法提取玉竹多糖工艺优化研究[J]. 东北农业科学,2018,43(3):61−64. [LI S H, WANG Z X, JIANG X K, et al. Study on the optimization of extraction technology of Polygonatum odoratum polysaccharides assisted by ultrasonic[J]. Northeast Agricultural Sciences,2018,43(3):61−64. [20] 陈银霞. 玉竹粗多糖水提醇沉法提取工艺的优化[J]. 黑龙江畜牧兽医,2013(17):138−139. [CHEN Y X. Optimization of the extraction process of Polygonatum odoratum crude polysaccharide by water extraction and alcohol precipitation[J]. Heilongjiang Animal Science and Veterinary Medicine,2013(17):138−139. [21] 刘玉凤, 李霞, 许丽丽, 等. 玉竹多糖含量测定及其生物活性研究[J]. 时珍国医国药,2015,26(11):2589−2591. [LIU Y F, LI X, XU L L, et al. Determination of polysaccharides of Polygonatum odoratum and its biological activity[J]. Lishizhen Medicine and Materia Medica,2015,26(11):2589−2591. [22] 张倩倩, 刘丽骏, 徐盼, 等. D-半乳糖诱导正常人口腔黏膜角质形成细胞衰老的研究[J]. 中华老年口腔医学杂志,2020,18(6):337−341. [ZHANG Q Q, LIU L J, XU P, et al. D-galactose induces senescence of normal human oral mucosal keratinocytes[J]. Chinese Journal of Geriatric Stomatology,2020,18(6):337−341. [23] 乔巨慧, 刘颖, 邢欣, 等. 人参多糖对D-半乳糖诱导的PC12细胞拟老化模型自噬和相关信号通路的影响[J]. 中药材,2020(10):2519−2525. [QIAO J H, LIU Y, XING X, et al. The effect of ginseng polysaccharides on autophagy and related signal pathways in PC12 cell aging model induced by D-galactose[J]. Chinese Medicinal Materials,2020(10):2519−2525. [24] 曾立, 向荣. 基于D-半乳糖致衰老鼠模型的抗衰老药物研究进展[J]. 邵阳学院学报(自然科学版),2018,15(6):108−116. [ZENG L, XIANG R. Research progress of anti-aging drugs based on D-galactose-induced aging mouse model[J]. Journal of Shaoyang University (Natural Science Edition),2018,15(6):108−116. [25] WANG J, LIU L, DING Z J, et al. Exogenous NAD postpones the D-gal-induced senescence of bone marrow-derived mesenchymal stem cells via Sirt1 signaling[J]. Antioxidants (Basel),2021,10(2):254. doi: 10.3390/antiox10020254
[26] AHMAD S, KHAN A, ALI W, et al. Fisetin rescues the mice brains against D-galactose-iduced oxidative stress, neuroinflammation and memory impairment[J]. Front Pharmacol,2021,12:612078. doi: 10.3389/fphar.2021.612078
[27] LIU R Y, MENG J, LOU D F. Adiponectin inhibits D-gal-induced cardiomyocyte senescence via AdipoR1/APPL1[J]. Mol Med Rep,2021,24(4):719. doi: 10.3892/mmr.2021.12358
[28] 蒋春茂, 陈晓兰, 陆广富, 等. 不同中药多糖体外对鸡外周血和脾脏淋巴细胞增殖能力的比较[J]. 江苏农业学报,2015,31(1):106−111. [JIANG C M, CHEN X L, LU G F, et al. Comparison of the proliferation of chicken peripheral blood and spleen lymphocytes in vitro by polysaccharides from different Chinese medicines[J]. Jiangsu Journal of Agriculture,2015,31(1):106−111. doi: 10.3969/j.issn.1000-4440.2015.01.016 [29] 王迦琦, 许梦然, 高婧文, 等. 北虫草多糖提取工艺优化及其细胞氧化损伤保护作用[J]. 食品工业科技,2020,41(13):141−147. [WANG J Q, XU M R, GAO J W, et al. Optimization of the extraction process of Cordyceps militaris polysaccharides and its protective effect on cell oxidative damage[J]. Science and Technology of Food Industry,2020,41(13):141−147. [30] DONG R C, WANG X H, WANG L, et al. Yangonin inhibits ethanol-induced hepatocyte senescence via miR-194/FXR axis[J]. Eur J Pharmacol,2020,890:173653.
[31] 刘琪梦. 线粒体靶向的苯硫酚荧光探针、衰老相关β—半乳糖苷酶荧光探针的构建以及生物成像研究[D]. 西安: 西北大学, 2019. LIU Q M. The construction of thiophenol fluorescent probes targeting mitochondria and the construction of senescence-related β-galactosidase fluorescent probes and bioimaging research[D]. Xi’an: Northwest University, 2019.
[32] 吴爽, 李学锋, 王秋彤, 等. 发酵黄芪对人胚肺二倍体成纤维细胞增殖及衰老相关蛋白表达的影响[J]. 长春中医药大学学报,2020,36(4):676−679. [WU S, LI X F, WANG Q T, et al. Effects of fermented Astragalus on the proliferation and senescence-related protein expression of human embryonic lung diploid fibroblasts[J]. Journal of Changchun University of Traditional Chinese Medicine,2020,36(4):676−679. [33] 邢玉芝. D-半乳糖诱导生物体衰老与细胞衰老模型的实验研究[D]. 成都: 四川大学, 2006. XING Y Z. Experimental study of D-galactose-induced biological senescence and cellular senescence model[D]. Chengdu: Sichuan University, 2006.
[34] SUN K, YANG P, ZHAO R, et al. Matrine attenuates D-galactose-induced aging-related behavior in mice via inhibition of cellular senescence and oxidative stress[J]. Oxid Med Cell Longev,2018:7108604.
[35] SCHERLINGER M, TSOKOS G. Reactive oxygen species: The Yin and Yang in (auto-) immunity[J]. Autoimmun Rev,2021:102869.
[36] GREFTE S, KOOPMAN W J H. Live-cell assessment of reactive oxygen species levels using dihydroethidine[J]. Methods Mol Biol,2021,2275:291−299.
[37] HE F L, LIU Q, JING M Y, et al. Toxic mechanism on phenanthrene-induced cytotoxicity, oxidative stress and activity changes of superoxide dismutase and catalase in earthworm (Eisenia foetida): A combined molecular and cellular study[J]. J Hazard Mater,2021,418:126302. doi: 10.1016/j.jhazmat.2021.126302
[38] 许梦然, 王迦琦, 高婧雯, 等. 北五味子多糖提取工艺优化及其对LPS刺激巨噬细胞线粒体膜电位的保护作用[J]. 食品工业科技,2020,41(20):33−40. [XU M R, WANG J A, GAO J W, et al. Optimization of the extraction process of Schisandra chinensis polysaccharide and its protective effect on LPS stimulated macrophage mitochondrial membrane potential[J]. Science and Technology of Food Industrial,2020,41(20):33−40. [39] 官福新, 周露露, 张宸豪, 等. JC-1单染法检测CCCP对内皮细胞线粒体膜电位的影响[J]. 吉林医药学院学报,2014,35(5):324−326. [GUAN F X, ZHOU L L, ZHANG C H, et al. JC-1 single staining method to detect the effect of CCCP on endothelial cell mitochondrial membrane potential[J]. Journal of Jilin Medical College,2014,35(5):324−326. [40] 宋兴瑰. 促排卵周期未成熟卵母细胞体外成熟的发育潜能研究及其线粒体膜电位检测[D]. 济南: 山东大学, 2015. SONG X G. Study on the developmental potential of immature oocytes in ovulation induction cycle and detection of mitochondrial membrane potential[D]. Jinan: Shandong University, 2015.












 下载:
下载:



 下载:
下载:
