Research Progress on Preparation and Application in Food Industry of Bone Collagen
-
摘要: 骨是动物屠宰后的主要副产物,富含胶原蛋白。本文首先介绍了骨胶原蛋白的制备过程(骨原料的预处理与骨胶原蛋白的提取、分离、纯化),然后从骨胶原蛋白的结构与性质等方面综述了其在食品中的应用(功能性食品和食品包装),旨在为高效利用骨胶原蛋白提供研究思路。Abstract: Bone is the main by-product of animal after slaughtering and is rich in collagen. First, the preparation of bone collagen, involved pretreatment of bone raw materials, extraction, isolation and purification of bone collagen, are introduced. Then its application in food industry including functional food and food packaging, are reviewed in this article from the aspects of structure and properties of bone collagen. This paper will provide ideas for the efficient utilization of animal bone collagen.
-
Keywords:
- bone collagen /
- preparation /
- food industry /
- application
-
我国是畜牧业和渔业大国,据国家统计局统计,2019年我国畜禽肉产量达7758.78万吨,鱼类产量达3746.9万吨。骨是动物屠宰后的主要副产物,按照畜禽骨占畜禽肉产量的20%[1],鱼骨占鱼类产量的10%来计算[2],仅2019年,我国骨副产物产量就达1900万吨,产量巨大。但目前骨主要被加工为动物饲料、骨粉等,其深加工利用率与经济附加值均较低[3]。
骨中胶原蛋白含量丰富,胶原蛋白占骨蛋白的80%~90%[4]。骨胶原蛋白从宏观到微观的结构如图1所示,骨胶原蛋白主要为Ⅰ型胶原蛋白[5],并且具有特殊的三螺旋结构,这种结构使骨胶原蛋白具有良好的生物相容性、生物降解性与较低的免疫原性。从骨中提取、分离、纯化的骨胶原蛋白其生物相容性与降解性较好,免疫原性较低,具有极高的开发利用价值,可作为功能物质与营养成分广泛应用于功能性食品与食品包装中。在功能性食品中,骨胶原蛋白可用于减少脂肪摄入、补钙、降血压、美白抗衰等;在食品包装方面,可用于制作胶原蛋白肠衣、可食用膜、涂层等。因此,本文从骨胶原蛋白的制备(骨原料的预处理与骨胶原蛋白的提取、分离、纯化)及其在食品中的应用等方面展开综述,以期为高效利用骨胶原蛋白提供研究思路。
1. 骨胶原蛋白的制备
骨胶原蛋白的制备主要有3个步骤:骨原料的预处理、骨胶原蛋白的提取与骨胶原蛋白的分离纯化。
1.1 骨原料的预处理
动物骨中不仅含有胶原蛋白,还含有脂肪、矿物质和其他杂质。因此在提取胶原蛋白前,要先除去骨中的杂蛋白、脂肪和钙等物质,以确保所提胶原蛋白的品质。骨原料中的杂蛋白可以通过氢氧化钠(NaOH)、氯化钠(NaCl)等来去除,脂肪可以通过正丁醇、异丙醇、正己烷、乙醚、石油醚等有机溶剂来去除,钙可以通过乙二胺四乙酸(EDTA)、乙二胺四乙酸二钠(EDTA-2Na)、盐酸等来去除。吴婷[7]通过研究正己烷、乙醚、正丁醇的脱脂效果和EDTA、盐酸的脱钙效果,确定了牦牛骨的最佳预处理工艺为:先用0.1 mol/L NaOH溶液震摇6 h除去杂蛋白,再用10%正己烷震摇3 d脱脂,最后用0.25 mol/L EDTA震摇3 d脱钙。
1.2 骨胶原蛋白的提取
骨胶原蛋白的提取原理是通过物理或化学方法来改变骨胶原蛋白的存在环境,从而将骨胶原蛋白从其他成分中分离出来[8]。骨胶原蛋白的提取方法有酸法、酶法、水热法、热压法和碱法等。酸法虽然可以最大限度地保留骨胶原蛋白的三螺旋结构,但酸法得率较低,且酸液会残留在所提胶原蛋白中,同时还会污染环境、腐蚀设备;碱法不仅得率较低,还会破坏骨胶原蛋白的三螺旋结构;水热法易导致胶原蛋白变性;热压法需要专业的加压设备;酶法虽然存在酶解不彻底、易产生小分子肽等问题,但酶法不会破坏骨胶原蛋白的三螺旋结构,并且得率较高,还能有效缩短提取时间、减少环境污染,是目前较为常用的提取方法。由于单一提取方法均存在一定的缺陷,因此,在提取过程中也会将不同提取方法与超声波、高压、高压脉冲电场等结合使用以获得更好的提取效果。
1.2.1 酸法
酸法主要是利用低浓度的酸破坏盐键和Schiff键,从而使胶原纤维溶解[9]。常用的酸有盐酸(HCl)[6]、乙酸(CH3COOH)[10]和柠檬酸(C6H8O7)[11]等。吴缇等[11]将斑点叉尾鮰鱼骨以1:30(w/v)的料液比溶于0.1 mol/L柠檬酸溶液中以提取鱼骨胶原蛋白,并对提取到的蛋白进行SDS-PAGE电泳分析,结果表明:所提蛋白有α1、α2、β三条链,是典型的Ⅰ型胶原蛋白,此时斑点叉尾鮰鱼骨胶原蛋白的得率为11.87%。不同来源骨胶原蛋白酸法提取介质与得率见表1。酸法可以最大程度地保留骨胶原蛋白的三螺旋结构,但会破坏部分氨基酸(如色氨酸、丝氨酸和酪氨酸)的结构,同时酸液会腐蚀设备,而且产品的得率较低,具有一定的局限性[12]。
表 1 不同来源骨胶原蛋白酸法提取介质与得率Table 1. Acid extraction medium and yield of bone collagen from different sources来源 提取介质 得率/提取率(%) 牛骨 0.01 mol/L盐酸 2.80[13] 牛骨 0.5 mol/L乙酸 3.00[13] 鸡骨 0.5 mol/L乙酸 5.36[14] 大眼金枪鱼骨 0.5 mol/L乙酸 0.10[15] 鲤鱼骨 0.5 mol/L乙酸 1.06[16] 斑点叉尾鮰鱼骨 0.1 mol/L柠檬酸 11.87[11] 黄鲷骨 0.5 mol/L乙酸 40.10*[17] 日本花鲈骨 0.5 mol/L乙酸 40.70*[17] 鲣鱼骨 0.5 mol/L乙酸 42.30*[17] 金枪鱼骨 0.5 mol/L乙酸 43.50*[17] 红牙鳞鲀骨 0.5 mol/L乙酸 50.00*[18] 香鱼骨 0.5 mol/L乙酸 53.60*[17] 注:未标*表示得率;*表示提取率。表2同。 1.2.2 酶法
酶法提取是在胶原蛋白的非螺旋区域添加特定的蛋白酶,以促进肽键的降解[19]。常用的酶有胃蛋白酶、木瓜蛋白酶、菠萝蛋白酶和胰蛋白酶等,其中,胃蛋白酶能在N端的3/4处将骨胶原蛋白切断,与其他蛋白酶相比,胃蛋白酶能更为完整地保留骨胶原蛋白的三螺旋结构和生物活性,因此更常用于骨胶原蛋白的提取[20]。但由于骨胶原蛋白对胶原蛋白酶以外的蛋白酶有抵抗作用,因此酶法大多与酸法结合使用,以促进骨胶原蛋白的溶解。王晓军等[21]分别采用酸法(0.5 mol/L乙酸)和酶法(1.6%胃蛋白酶-0.5 mol/L乙酸溶液)提取牦牛骨胶原蛋白并对其进行理化性质分析。结果表明酸法得率是2.24%,酶法得率是3.32%。这两种骨胶原蛋白三螺旋结构完整,均在230 nm波长左右出现最大紫外吸收峰,均保留了较为完整的纤维网状结构,都为典型的Ⅰ型胶原蛋白。综合来看,这两种方法所提胶原蛋白在理化特性上并无太大差别,但酶法提取的胶原蛋白得率较高。叶韬等[22]用胃蛋白酶-乳酸溶液提取罗非鱼骨胶原蛋白,获得的最佳工艺条件为:pH2.6、温度30 ℃、料液比为1:30(g/mL)、加酶量200 U/g、提取时间24 h,此时罗非鱼骨胶原蛋白的得率为12.76%。HIDAYAT等[23]研究了木瓜蛋白酶浓度与磷酸浓度对罗非鱼骨明胶成胶特性的影响,发现用1.5%木瓜蛋白酶-6%磷酸提取的骨胶原蛋白在70 ℃水浴4 h后可获得凝胶强度与粘度较好的明胶。不同来源骨胶原蛋白酶法提取介质与得率见表2。酶法不会破坏骨胶原蛋白的三螺旋结构,能获得生物活性较好的骨胶原蛋白,并且还能有效缩短提取时间、减少环境污染、降低能耗,是目前较为常用的骨胶原蛋白提取方法。
表 2 不同来源骨胶原蛋白酶法提取介质与得率Table 2. Enzymatic extraction medium and yield of bone collagen from different sources1.2.3 水热法
水热法可分解胶原蛋白的共价交联键和酰胺键,其产物具有较高的溶解性,也可称其为明胶[28]。AL-KAHTANI等[29]通过响应面法优化出骆驼骨明胶的最佳制备工艺为温度72 ℃、pH5.3、时间2.5 h,此时骆驼骨明胶的得率最高为21.33%,并测定出骆驼骨明胶的凝胶强度为205.74 g,符合食品用明胶凝胶强度为125~250 g的要求,是一种较为理想的明胶。TAHERI等[30]向多齿蛇鲻骨中加入其质量3倍的蒸馏水,然后将其在60 ℃下抽提12 h获得多齿蛇鲻骨明胶,此时骨明胶的得率为8.95%,凝胶强度为(135±7.9)g。水热法虽然可以提取骨胶原蛋白,但由于骨胶原蛋白耐热性较差,当提取温度过高时,可能会破坏骨胶原蛋的结构。
1.2.4 热压法
热压法不引入酸、碱、盐等化学物质,产品得率较高。樊晓盼等[31]采用高温高压浸提技术从牛骨中提取骨胶原蛋白,研究了在0.2 MPa下料液比、浸提温度和浸提时间对骨胶原蛋白提取率的影响,并优化出最佳工艺条件为料液比1:4(g/mL),温度133 ℃,时间4 h,此时提取率可达64.73%。热压法需要专业加压设备,在企业中应用更为广泛。
1.2.5 碱法
肽键在碱性环境中极易水解,从而使胶原纤维溶解、膨胀[32]。常用的碱有氧化钙、氢氧化钠和碳酸钠等。MORIMURA等[33]发现pH12的NaOH溶液能有效提取黄尾鱼骨胶原蛋白。碱法提取工艺简单、成本低,但容易引起胶原蛋白变性。当肽键水解严重时,会发生氨基酸消旋现象,产生D型和L型氨基酸消旋混合物,其中,大多数D型氨基酸有毒,甚至有致突变、致畸、致癌的风险[34],因此用碱法提取骨胶原蛋白时,一定要控制好肽键的水解程度。
酸法、酶法、水热法、热压法和碱法等的提取效果有差异,所以研究人员在实际研究或生产过程中,会将不同的提取方法与超声波、高压、高压脉冲电场等结合以获得更好的提取效果。高压脉冲电场通过对食品施加高电压的短脉冲而对食品进行处理,具有处理时间短、能耗低、连续可操作性较强的优点[35]。HE等[36]利用高压脉冲电场协同酶法提取鲢鱼骨胶原蛋白,确定出最佳工艺条件为胃蛋白酶添加量1%、料液比1:10(g/mL)、电场强度20 kV/cm、脉冲数8,此时得率为16.13 mg/mL,并发现高压脉冲技术能使胶原蛋白的α螺旋和β转角部分转变为β折叠与无规卷曲,使样品颗粒由分散、无序变得均匀、有序。李红霞等[37]利用超高压生物反应器,采用超高压协同酶法提取猪腿骨胶原蛋白,研究了在150 MPa下,木瓜蛋白酶、胰蛋白酶、菠萝蛋白酶、胃蛋白酶对猪骨胶原蛋白得率的影响,结果表明,木瓜蛋白酶在温度45 ℃、pH5.0、酶添加量0.3%、料液比1:7(g/mL)的条件下,猪骨胶原蛋白得率最佳为8.98%。超声波能促进浸提物向提取剂的扩散,严秋萍等[38]采用超声波辅助柠檬酸法提取齐口裂腹鱼骨胶原蛋白,并对提取到的蛋白进行紫外光谱扫描、SDS-PAGE电泳等分析,结果显示最佳工艺条件为:超声波预处理时间20 min,料液比1:75(g/mL),提取温度30 ℃,提取时间48 h,此时胶原蛋白得率为6.91%;提取到的蛋白在220~232 nm范围内有一个较强的吸收峰,有α1、α2和β三条链,是典型的Ⅰ型胶原蛋白。
1.3 骨胶原蛋白的分离纯化
骨胶原蛋白粗提液除含有胶原蛋白外,还含有剩余的溶剂和蛋白裂解的肽。因此想要得到高纯度的骨胶原蛋白,就需要对粗提液进行纯化。纯化的方法有盐析法、透析法、离心法、色谱法、电泳法等。传统情况下,骨胶原蛋白的纯化是将盐析、离心和透析相结合。GAO等[39]向羊骨胶原蛋白粗提液中先添加氯化钠进行盐析,然后将盐析悬浊液10000 r/min离心30 min,再将沉淀用0.5 mol/L乙酸复溶,最后将复溶液用0.1 mol/L冰醋酸透析1 d,蒸馏水透析2 d,以纯化羊骨胶原蛋白。上述为骨胶原蛋白分离纯化比较常用的步骤,但由于时间过长、速度过慢、操作复杂、会产生大量的废水等原因,无法满足较大规模的生产。
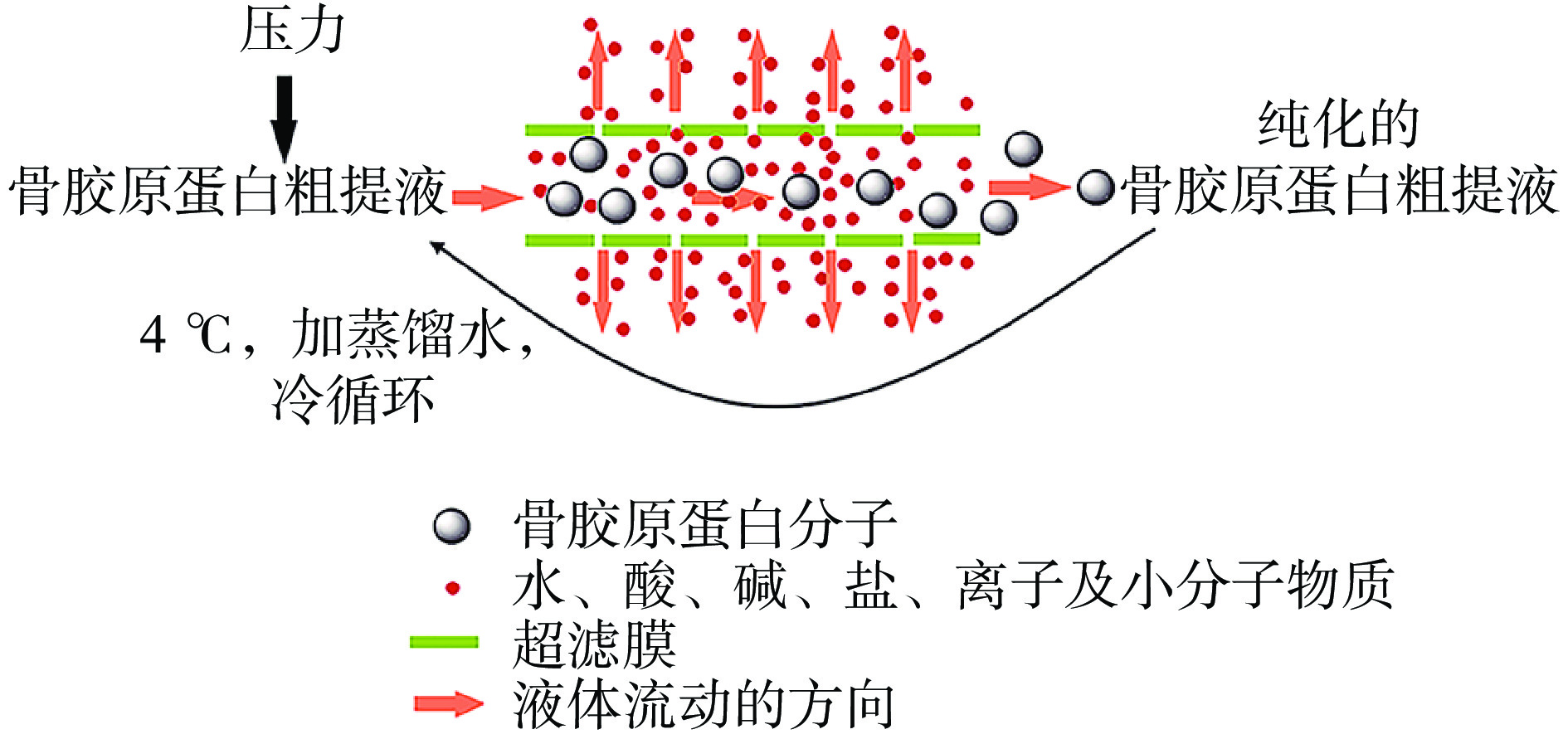
近年来,超滤分离技术因其操作条件温和、不会破坏热敏性胶原蛋白的结构而吸引了众多研究者的目光。超滤分离技术以压力为动力,可有效截留大分子,而小分子可以自由通过。超滤可以缩短纯化的操作和步骤,骨胶原蛋白粗提液在一定压力下会循环通过超滤膜,小分子物质会从超滤膜的空隙中流出,骨胶原蛋白相对分子量较大,会一直保留在超滤膜内,从而达到纯化骨胶原蛋白粗提液的目的,纯化原理如图2所示。SHEN等[40]以合成聚丙烯腈和亲水改性聚丙烯腈为原料,采用经典的水相转化工艺制备了亲水性好、污染度低的超滤膜,该膜可以有效地纯化和浓缩胶原蛋白。陈思谨[41]将亲水超滤技术应用于胶原蛋白的纯化,使纯化时间由原来的1~3 d缩短到3 h以内,纯化量从不足1 L提高到一次可处理45 L,这为骨胶原蛋白提取的产业化提供了新思路。与传统分离纯化工艺相比,超滤工艺可以大大缩短分离纯化时间,减少废水排放,具有设备简单、占地面积小、操作简便、选择性高、能耗低等优点[42]。并且由于其工艺条件温和,在处理过程中不添加任何化学试剂、不加热,因此不会引起温度、pH的变化,更不会造成胶原蛋白变性,更便于后续胶原蛋白的应用。
2. 骨胶原蛋白在食品中的应用
骨胶原蛋白营养价值高,有良好的生物相容性、生物降解性[44],在许多食品中可作为功能物质和营养成分,在功能性食品中,骨胶原蛋白可用于减少脂肪摄入、补钙、降血压、美白抗衰;在食品包装方面,骨胶原蛋白可用于制作胶原蛋白肠衣、可食用膜、涂层等。
2.1 在功能性食品中的应用
骨胶原蛋白及其水解物致敏性低、可吸收性好,近年来在功能性食品中应用普遍。骨胶原蛋白通过模拟脂肪的口感来替代部分脂肪,以降低脂肪摄入量;同时骨胶原多肽通过与钙螯合来促进钙吸收,以高效补钙;通过抑制体内血管紧张素转换酶(ACE)的活性,来降低机体血压;通过提高皮肤的持水力、减少黑色素的生成来实现皮肤的美容抗衰。
2.1.1 减少脂肪摄入
脂肪是三大营养素之一,能提供人体所需的热量与必需脂肪酸;同时它也是食品的重要组成部分,能赋予食品良好的质构、风味与口感。但过量摄入脂肪会引发糖尿病、高血压、心脑血管等疾病[45],然而直接降低食品中的脂肪含量会使食品品质变差。研究表明骨胶原蛋白经过热处理后,分子中的疏水基团会暴露在分子表面,能够模拟脂肪的疏水特性;骨胶原蛋白经过微粒化处理后,其粒径可以小于10 μm,能够模拟脂肪润滑、奶油状的感官特征[46]。经过热处理与微粒化处理的骨胶原蛋白能在降低食品中脂肪用量的前提下,不破坏食品原有的质构、风味与口感,已成为近些年低脂食品开发的研究热点。ATAIE等[47]发现,当鳙鱼骨明胶替代40%蛋黄酱中的脂肪时,蛋黄酱的热量值、白度最低,硬度、粘附性、弹性、乳液稳定性均最佳。YEO等[48]研究了20%鸭脚骨明胶凝胶(w/w)替代不同比例(50%、62.5%、75%)法兰克福香肠中的脂肪,对香肠的成分、蒸煮损失、色泽、质构、感官评价的影响。研究结果表明:当20%鸭脚骨明胶凝胶(w/w)替代75%法兰克福香肠中的脂肪时,香肠的水分含量最高、蒸煮损失最低,硬度、弹性、内聚性、咀嚼性最佳,总体可接受度与普通法兰克福香肠最为相近。
2.1.2 补钙
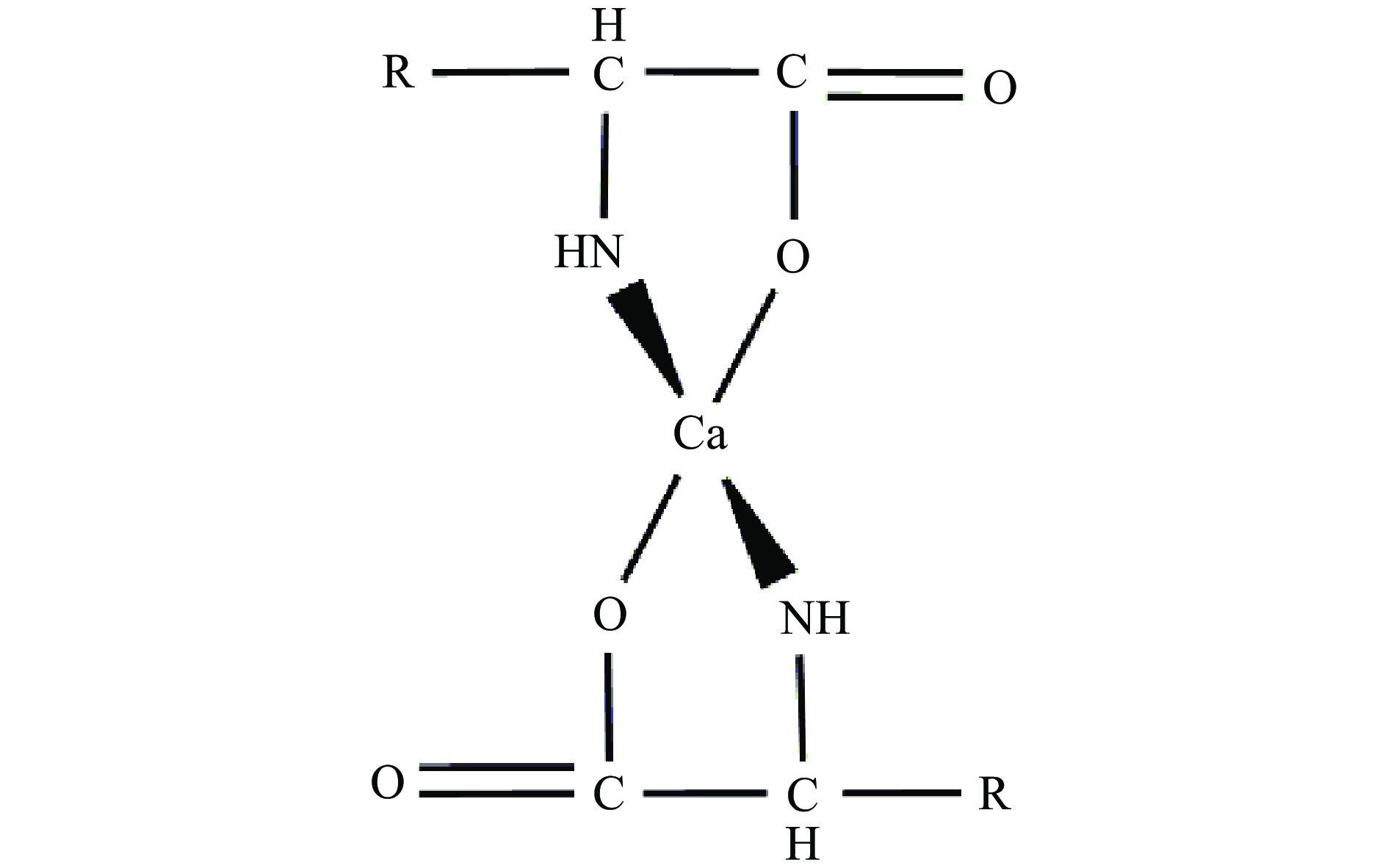
钙是人体必需的一种微量元素,在细胞代谢、骨骼生长、神经传导中发挥着重要的作用[49]。缺钙会引发骨质疏松、高血压、肾结石等疾病[50]。营养调查显示,我国人均每日钙摄入量仅为推荐摄入量的50%左右,因此补钙就成为了人们的研究焦点之一。现在市面上的补钙产品主要有无机盐钙(碳酸钙)、有机盐钙(葡萄糖酸钙)与有机酸钙(甘氨酸钙),但这三种补钙剂均存在着一定程度的毒副作用[51]。骨胶原多肽的羧基氧原子和氨基氮原子可以螯合钙[52],形成骨胶原多肽-钙螯合物,其结构式如图3所示。该螯合物克服了现有补钙剂吸收率低、存在副作用的缺点,具有溶解度好、吸收率高等优点,已成为补钙剂的最佳选择。WU等[53]通过单因素实验和响应面试验确定了猪骨胶原多肽螯合钙的最佳制备条件为肽钙质量比4.5:1,温度50 ℃,时间40 min,此时钙螯合率达到78.38%,并发现该螯合物的钙保留率会随着温度的升高而下降,但仍保持在85%以上,热稳定性较好,还用Caco-2细胞单层模型研究了肽-钙螯合物对钙吸收的影响,结果表明,肽-钙螯合物与CaCl2对照组相比,通过增加钙运输量、逆转磷酸盐和植酸盐对钙吸收的抑制作用,可以显著改善Caco-2细胞单层中钙的转运,促进人体对钙的吸收。WANG等[54]采用胃蛋白酶、木瓜蛋白酶酶解-保加利亚乳杆菌发酵法制备了游离钙含量较高的绵羊骨胶原多肽,然后向胶原多肽中添加无水乙醇来制备肽钙螯合物。首先通过响应面法确定了酶解液发酵的最佳条件为:葡萄糖添加量3%,接种量6%,发酵时间24.5 h,温度37 ℃,pH6.5,此时游离钙含量为2212.58 mg/100 g,钙螯合量为(42.57%±0.09%)。同时发现,肽-钙螯合物的钙保留率在30~80 ℃范围内均保持在80%以上,耐热性较好;在体外模拟胃肠道消化过程中,肽-钙螯合物经过胃蛋白酶消化后,钙含量仍在87.3%以上,这表明绵羊骨胶原多肽-钙螯合物在模拟胃肠道环境中稳定,可以促进钙的吸收。
2.1.3 降血压
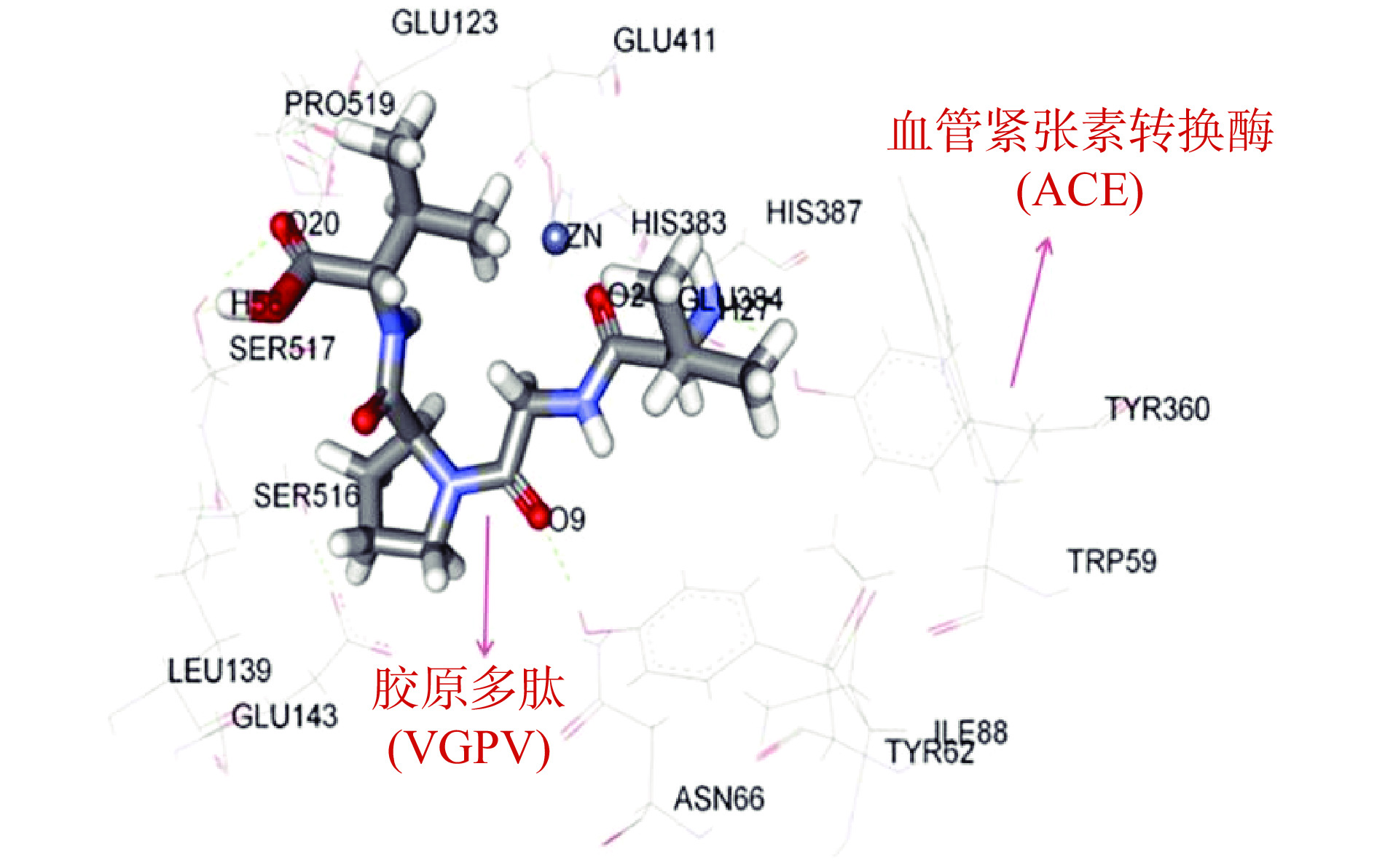
血管紧张素转换酶(ACE)能使血管收缩、机体血压升高[56]。ACE抑制物能使机体血压维持稳定,避免血压升高。研究表明,含有脯氨酸、羟脯氨酸、亮氨酸、赖氨酸的多肽具有较高的ACE抑制活性[57]。胶原蛋白中的脯氨酸、羟脯氨酸总含量约为25%,精氨酸、赖氨酸总含量接近8%[58],因此胶原多肽具有显著的ACE抑制作用。牛胶原多肽(VGPV)通过与ACE的Tyr62、Arg124、Tyr360和Ser517形成氢键来发挥作用,胶原多肽(VGPV)与ACE的分子对接如图4所示。CHENG等[59]先用碱性蛋白酶酶解鸡腿骨获得鸡腿骨胶原多肽——一种非竞争性混合抑制剂,然后用LC/MS/MS法从鸡腿骨胶原多肽中鉴定出10个具有较强ACE抑制活性的多肽,这些多肽减少了自发性高血压大鼠的高血压和心血管肥大的发生。魏庭浩[60]确定了胰蛋白酶酶解猪骨胶原蛋白的最佳条件为温度50 ℃、pH7.5、底物浓度6%、酶底比8000 U/g、水解时间6 h,此时水解度为10.34%,ACE抑制率为65.92%,并且也发现分子量较小的猪骨胶原多肽经过胃肠道消化酶处理后活性仍然较高,更容易通过胃肠道吸收进入血液循环,更可能在体内发挥降血压的作用。
2.1.4 美白抗衰
骨胶原多肽具有良好的生物相容性,能渗透到皮肤中,被皮肤充分吸收。骨胶原多肽富含甘氨酸、丝氨酸等保湿因子和羧基、羟基等亲水基团,可以有效减少皮肤的水化损失,使皮肤保湿;骨胶原多肽的酪氨酸残基通过与皮肤中的酪氨酸竞争酪氨酸酶结合位点,来抑制黑色素的生成,使皮肤美白[62];骨胶原多肽会在皮肤表面形成一层极薄的膜层,从而使皱纹舒展[63]。SONG等[64]发现口服牛骨胶原多肽通过修复胶原纤维,能够提高胶原含量和抗氧化酶的活性,从而改善皮肤松弛,延缓皮肤衰老。PHIPPS等[65]的研究显示,当皮肤受到紫外线辐射后,鸡胸软骨胶原多肽能提高皮肤的弹性,减少皮肤水化损失,收紧皮肤皱纹,有效延缓皮肤衰老。
2.2 食品包装
骨胶原蛋白有良好的成膜性、生物降解性与生物相容性[66],可用于制备胶原蛋白肠衣、可食用膜与涂层等食品包装材料。
2.2.1 胶原蛋白肠衣
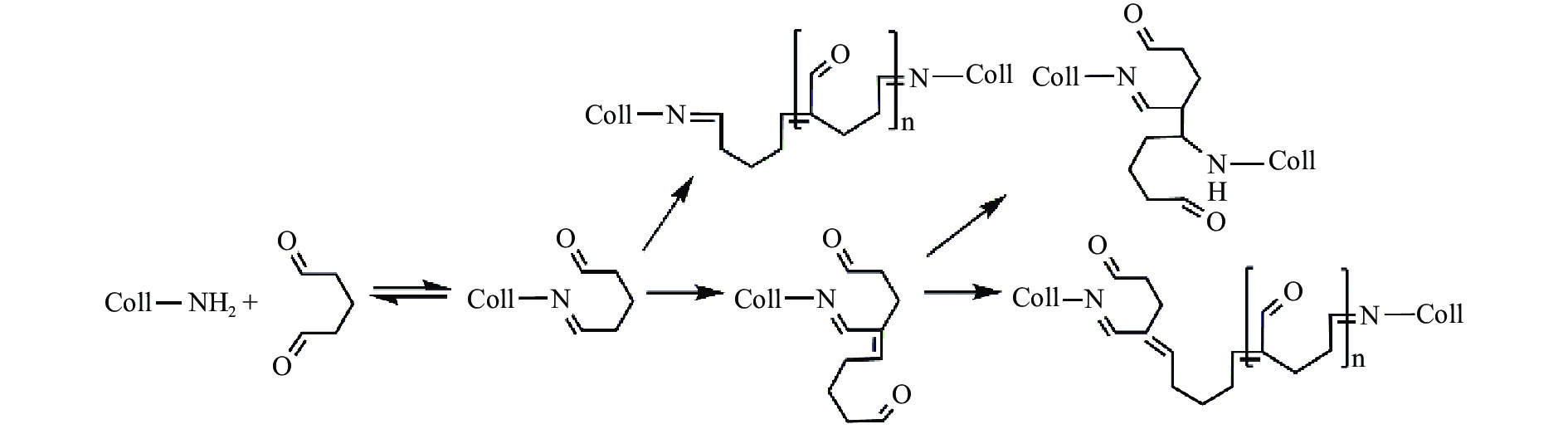
肠衣不仅能使肠类食品成型,也能延缓肠类食品的蛋白氧化、脂肪氧化等,从而保证肠类食品的品质、延长肠类食品的货架期,已成为目前市场上需求量最大的食品包装材料之一。肠衣可分为天然肠衣与人造肠衣。天然肠衣因来源受限、成本高、生产不易控制等原因,已不适用于标准化与机械化生产,于是研究者们开始研发人造肠衣。人造肠衣发展至今可分为塑料肠衣、纤维素肠衣和胶原蛋白肠衣等。其中,胶原蛋白肠衣成本低、口感好、抗拉伸强度高、透气性好、透明度高、生产易控、适合工业化生产[67],已成为应用最广的可食性人造肠衣。然而,胶原蛋白肠衣在肉馅填充过程中会破裂、在熏蒸过程中会变形[68]。向胶原蛋白肠衣中添加醛类[69]、金属离子[70]、角蛋白[71]、碳二亚胺[72]、单宁酸[73]、京尼平[74]等物质,可有效改善胶原蛋白肠衣的机械性能,解决胶原蛋白肠衣在加工过程中的破裂及变形。其中,戊二醛交联效果好、成本低,已成为一种广泛使用的交联剂。戊二醛的醛基能与胶原蛋白的ε-氨基发生反应,从而交联胶原蛋白肠衣,其反应机理如图5所示。CHEN等[69]用戊二醛交联胶原蛋白肠衣,发现戊二醛提高了胶原蛋白肠衣的杨氏模量与抗拉伸强度,使肠衣具有更好的机械强度与抗变形能力。
2.2.2 可食用膜
天然骨胶原蛋白呈卷曲状,酸、碱或热处理会使肽链舒展、疏水基团和巯基暴露,从而形成新的二硫键,最终形成具有均匀立体网状结构的薄膜,骨胶原蛋白的成膜原理简图如图6所示。骨胶原蛋白可食用膜阻水、阻氧及阻油脂特性良好,可以较大程度地维持食品原有的质构、风味,从而确保食品品质、延长食品货架期。但是,单一骨胶原蛋白膜由于抗拉伸强度低、水蒸气透过量大、水蒸气透过系数高、抗菌和抗氧化性能较差等原因[76],难以广泛用于食品包装,因此需要对其进行改性处理。胶原蛋白膜的改性方法主要有物理改性(如热处理[77]、紫外线照射[78]、γ-射线辐照[79])、化学改性(如醛[80]、亚胺[81]、酯[82])、酶法改性(如谷氨酰胺转氨酶[83]、酪氨酸酶[84])和天然高分子改性等(如壳聚糖[85]、双醛淀粉[86]、海藻酸钠[87])。由于物理改性交联效果较差、酶法改性成本较高、化学交联剂存在一定毒性,因此安全性好、价格低廉且交联效果明显的天然化合物,如壳聚糖、双醛淀粉、海藻酸钠等,已成为骨胶原蛋白膜改性的研究热点。改性后,骨胶原蛋白膜的力学性能、阻挡性能、抗菌性能和抗氧化性能会有所改善,用其包装食品能延缓食品的脂质氧化、蛋白氧化与微生物生长,从而延长食品保质期。SHAKILA等[88]用壳聚糖与丁香精油分别交联石斑鱼骨明胶膜,发现与单一石斑鱼骨明胶膜相比,壳聚糖与丁香精油均显著提高了明胶膜的抗菌性能,降低了明胶膜的水溶性与水蒸气透过率,使其更适合应用于食品。XIONG等[89]的研究指出壳聚糖与没食子酸能显著提高三文鱼骨明胶膜的抗氧化性能,而丁香精油则能显著提高三文鱼骨明胶膜的抗菌性能。改性后的骨胶原蛋白膜可用于食品的保鲜。吴京蔚等[90]用牛骨胶原蛋白膜包裹酱牛肉,发现该复合膜能有效延缓酱牛肉的脂质氧化,延长其保质期。
2.2.3 涂层材料
将骨胶原蛋白溶液涂于食品表面,能抑制食品发生蛋白质氧化、脂质氧化,从而延长食品货架期。SHAKILA等[88]发现丁香精油-石斑鱼骨明胶涂层能使沙丁鱼排在4 ℃下的保质期从4 d延长到8 d。XIONG等[89]的研究指出三文鱼骨明胶/壳聚糖/没食子酸/丁香油涂层可有效抑制三文鱼鱼片的变色、pH变化、脂质和蛋白质的氧化以及微生物的生长,从而达到保鲜三文鱼鱼片的目的。
3. 结语
本文首先综述了骨胶原蛋白的制备过程,骨原料经过除杂蛋白、除脂、除钙后,才可用于骨胶原蛋白的提取,提取方法有酸法、酶法、水热法、热压法和碱法等,其中,酶法不会破坏骨胶原蛋白的三螺旋结构,且得率较高,提取时间较短,已成为目前较为常用的骨胶原蛋白提取方法。提取得到的骨胶原蛋白溶液中除含胶原蛋白外还含有溶剂和肽等杂质,因此要经过盐析、透析、离心、超滤等分离纯化过程,才可获得纯度较高的骨胶原蛋白。骨胶原蛋白具有良好的生物相容性、生物降解性,较低的致敏性,可应用在功能性食品与食品包装中,在功能性食品中,骨胶原蛋白可用于减少脂肪摄入、补钙、降血压、美白抗衰;在食品包装方面,骨胶原蛋白可用于制作胶原蛋白肠衣、可食用膜、涂层。
近年来,疯牛病、口蹄疫和禽流感的暴发使骨胶原蛋白的提取原料从常见的牛、羊、猪等动物逐渐转为安全指数较高的水生动物和高原条件下生长的动物。从骨中提取的胶原蛋白营养价值与应用价值极高,然而,骨胶原蛋白由于提取率低、提取工艺复杂、分离纯化效率不高等原因,目前的工业化程度仍然较低,因此,改进提取工艺、提高分离纯化效率,将是今后骨胶原蛋白制备的重要研究方向。另外,目前的应用研究也大多停留在实验室阶段,尚未进行工业化生产与市场化开发,这就需要研究人员将实验室研发与工业化生产相结合,只有这样,骨胶原蛋白才能更好地发挥资源优势、实现自身价值、减少环境污染,为国民经济、人民生活和环境保护做出贡献。
-
表 1 不同来源骨胶原蛋白酸法提取介质与得率
Table 1 Acid extraction medium and yield of bone collagen from different sources
来源 提取介质 得率/提取率(%) 牛骨 0.01 mol/L盐酸 2.80[13] 牛骨 0.5 mol/L乙酸 3.00[13] 鸡骨 0.5 mol/L乙酸 5.36[14] 大眼金枪鱼骨 0.5 mol/L乙酸 0.10[15] 鲤鱼骨 0.5 mol/L乙酸 1.06[16] 斑点叉尾鮰鱼骨 0.1 mol/L柠檬酸 11.87[11] 黄鲷骨 0.5 mol/L乙酸 40.10*[17] 日本花鲈骨 0.5 mol/L乙酸 40.70*[17] 鲣鱼骨 0.5 mol/L乙酸 42.30*[17] 金枪鱼骨 0.5 mol/L乙酸 43.50*[17] 红牙鳞鲀骨 0.5 mol/L乙酸 50.00*[18] 香鱼骨 0.5 mol/L乙酸 53.60*[17] 注:未标*表示得率;*表示提取率。表2同。 表 2 不同来源骨胶原蛋白酶法提取介质与得率
Table 2 Enzymatic extraction medium and yield of bone collagen from different sources
-
[1] 范丽森, 孙亚军, 赵伟. 畜禽骨加工及其余料利用工艺的研究进展[J]. 现代食品,2019(20):110−112. [FAN Lisen, SUN Yajun, ZHAO Wei. Research progress on bone processing and utilization of livestock and poultry[J]. Modern Food,2019(20):110−112. FAN Lisen, SUN Yajun, ZHAO Wei. Research progress on bone processing and utilization of livestock and poultry[J]. Modern Food, 2019(20): 110-112.
[2] TOPPE J, ALBREKTSEN S, HOPE B, et al. Chemical composition, mineral content and amino acid and lipid profiles in bones from various fish species[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2007,146(3):395−401.
[3] 周小翠, 靳国锋, 金永国, 等. 畜禽骨蛋白水解及多肽螯合钙研究进展[J]. 肉类研究,2015(8):31−36. [ZHOU Xiaocui, JIN Guofeng, JIN Yongguo, et al. Current status and progress of studies on protein hydrolysis of livestock and poultry bones and peptide chelated calcium[J]. Meat Research,2015(8):31−36. ZHOU Xiaocui, JIN Guofeng, JIN Yongguo, et al. Current status and progress of studies on protein hydrolysis of livestock and poultry bones and peptide chelated calcium[J]. Meat Research, 2015(8): 31-36.
[4] 李桂星. 羊骨素及其衍生化产品提取制备工艺研究[D]. 北京: 北京林业大学, 2012. LI Guixing. Study on extraction, preparation of sheep bone extracts and its derivative products[D]. Beijing: Beijing Forestry University, 2012.
[5] IKOMA T, KOBAYASHI H, TANAKA J, et al. Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J]. International Journal of Biological Macromolecules,2003,32(3-5):199−204. doi: 10.1016/S0141-8130(03)00054-0
[6] CAO S, WANG Y, XING L, et al. Structure and physical properties of gelatin from bovine bone collagen influenced by acid pretreatment and pepsin[J]. Food and Bioproducts Processing,2020,121:213−223. doi: 10.1016/j.fbp.2020.03.001
[7] 吴婷. 牦牛骨胶原蛋白提取纯化及结构解析[D]. 兰州: 甘肃农业大学, 2017. WU Ting. Study on the extraction, purification and structure analysis of collagen from yak bone[D]. Lanzhou: Gansu Agricultural University, 2017.
[8] 樊世芳, 王利强, 游柳青, 等. 鱼鳞胶原蛋白的研究进展[J]. 包装工程,2014,35(23):6−12. [FAN Shifang, WANG Liqiang, YOU Liuqing, et al. Research progress in fish scale collagen[J]. Packaging Engineer,2014,35(23):6−12. FAN Shifan, WANG Liqiang, YOU Liuqing, et al. Research progress in fish scale collagen[J]. Packaging Engineer, 2014, 35(23): 6-12.
[9] HOU P Z, REGENSTEIN J M. Optimization of extraction conditions for pollock skin gelatin[J]. Journal of Food Science,2004,69(5):C393−C398.
[10] FERRARO V, GAILLARD-MARTINIE B, SAYD T, et al. Collagen type I from bovine bone. Effect of animal age, bone anatomy and drying methodology on extraction yield, self-assembly, thermal behavior and electrokinetic potential[J]. International Journal of Biological Macromolecules,2017,97:55−66. doi: 10.1016/j.ijbiomac.2016.12.068
[11] 吴缇, 陈舜胜. 斑点叉尾鮰鱼骨胶原蛋白的提取与特性研究[J]. 食品工业科技,2009,30(3):263−266. [WU Ti, CHEN Shunsheng. Study on extraction and characteristics of the collage from channel catfish bone[J]. Science and Technology of Food Industry,2009,30(3):263−266. WU Ti, CHEN Shunsheng. Study on extraction and characteristics of the collage from channel catfish bone[J]. Science and Technology of Food Industry, 2009, 30(3): 263-266.
[12] CHEN J, LI L, YI R, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology,2016,66:453−459. doi: 10.1016/j.lwt.2015.10.070
[13] 刘丽莉. 牛骨降解菌的筛选及其发酵制备胶原多肽螯合钙的研究[D]. 武汉: 华中农业大学, 2010. LIU Lili. Rearch on screening the bovine bone-degraded bacteria and preparation of collagen-derived polypeptides chelated calcium by fermentation[D]. Wuhan: Huazhong Agricultural University, 2010.
[14] 岳鉴颖. 鸡骨蛋白凝胶特性研究及应用[D]. 北京: 中国农业科学院, 2017. YUE Jianying. Study of gel properties and application of chicken bone protein[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[15] AHMED R, HAQ M, CHUN B S. Characterization of marine derived collagen extracted from the by-products of bigeye tuna (Thunnus obesus)[J]. International Journal of Biological Macromolecules,2019,135:668−676. doi: 10.1016/j.ijbiomac.2019.05.213
[16] DUAN R, ZHANG J, DU X, et al. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio)[J]. Food Chemistry,2009,112(3):702−706. doi: 10.1016/j.foodchem.2008.06.020
[17] NAGAI T, SUZUKI N. Isolation of collagen from fish waste material-skin, bone and fins[J]. Food Chemistry,2000,68(3):277−281. doi: 10.1016/S0308-8146(99)00188-0
[18] MURALIDHARAN N, SHAKILA R J, SUKUMAR D, et al. Skin, bone and muscle collagen extraction from the trash fish, leather jacket (Odonus niger) and their characterization[J]. Journal of Food Science and Technology,2013,50(6):1106−1113. doi: 10.1007/s13197-011-0440-y
[19] 梁健华, 赖俏荣, 梁杏. 酶法提取对牛胶原蛋白性质及端肽切除的影响[J]. 食品科技,2018,43(10):166−173. [LIANG Jianhua, LAI Qiaorong, LIANG Xing. Effects of enzymatic extraction on the properties of bovine collagen and removal of terminal peptide[J]. Food Science and Technology,2018,43(10):166−173. LIANG Jianhua, LAI Qiaorong, LIANG Xing. Effects of enzymatic extraction on the properties of bovine collagen and removal of terminal peptide[J]. Food Science and Technology, 2018, 43(10): 166-173.
[20] 胡颀, 步婷婷, 于松峰, 等. 牛骨源胶原蛋白肽的制备及其生理活性研究进展[J]. 食品工业科技,2020,41(15):357−364. [HU Qi, BU Tingting, YU Songfeng, et al. Research progress on preparation and biological activity of bovine bone collagen peptides[J]. Science and Technology of Food Industry,2020,41(15):357−364. HU Qi, BU Tingting, YU Songfeng, et al. Research progress on preparation and biological activity of bovine bone collagen peptides[J]. Science and Technology of Food Industry, 2020, 41(15): 357-364.
[21] 王晓军, 吴婷, 贾伟, 等. 酸法和酶法提取牦牛骨胶原蛋白的特性分析[J]. 食品科学,2018,39(12):101−106. [WANG Xiaojun, WU Ting, JIA Wei, et al. Comparative analysis of collagen extracted from yak bones using acidic and enzymatic treatment[J]. Food Science,2018,39(12):101−106. doi: 10.7506/spkx1002-6630-201812016 WANG Xiaojun, WU Ting, JIA Wei, et al. Comparative analysis of collagen extracted from yak bones using acidic and enzymatic treatment[J]. Food Science, 2018, 39(12): 101-106. doi: 10.7506/spkx1002-6630-201812016
[22] 叶韬, 林琳, 张晓霞, 等. 罗非鱼骨胶原蛋白质的提取及其性质[J]. 食品与生物技术学报,2015,34(3):302−310. [YE Tao, LIN Lin, ZHANG Xiaoxia, et al. Extraction and characterization of collagen from tilapia bone[J]. Journal of Food Science and Biotechnology,2015,34(3):302−310. YE Tao, LIN Lin, ZHANG Xiaoxia, et al. Extraction and characterization of collagen from tilapia bone[J]. Journal of Food Science and Biotechnology, 2015, 34(3): 302-310.
[23] HIDAYAT G, DEWI E N, RIANINGSIH L. Characteristics of bone gelatin tilapia (Oreochromis niloticus) processed by using hydrolysis with phosphoric acid and papain enzyme[J]. Journal Pengolahan Hasil Perikanan Indonesia,2016,19(1):69−78. doi: 10.17844/jphpi.v19i1.11698
[24] 刘丽莉, 马美湖, 杨协力. 牛骨Ⅰ型胶原蛋白提取及结构表征[J]. 食品科学,2010,31(2):87−91. [LIU Li1i, MA Meihu, YANG Xie1i. Extraction and characterization of type Ⅰ collagen from bovine bone[J]. Food Science,2010,31(2):87−91. LIU Li1i, MA Meihu, YANG Xie1i. Extraction and characterization of type Ⅰ collagen from bovine bone[J]. Food Science, 2010, 31(2): 87-91.
[25] 乌日古莫乐. 吉尔利阁蒙古牛骨胶原蛋白的提取及理化特性研究[D]. 呼和浩特: 内蒙古农业大学, 2015. WU Rigumole. Study on extraction of collagen from Gi Er Li Go Mongolia bovine bone and its physical and chemical properties[D]. Hohhot: Inner Monogolia Agricultural University, 2015.
[26] WANG H, LIANG Y, WANG H, et al. Physical-chemical properties of collagens from skin, scale, and bone of grass carp (Ctenopharyngodon idellus)[J]. Journal of Aquatic Food Product Technology,2014,23(3):264−277. doi: 10.1080/10498850.2012.713450
[27] 段宙位, 申铉日, 陈秀明, 等. 罗非鱼尾胶原蛋白的提取与鉴定[J]. 食品科学,2012,33(6):59−64. [DUAN Zhouwei, SHEN Xuanri, CHEN Xiuming, et al. Extraction and identification of collagen from tilapia tail[J]. Food Science,2012,33(6):59−64. DUAN Zhouwei, SHEN Xuanri, CHEN Xiuming, et al. Extraction and identification of collagen from tilapia tail[J]. Food Science, 2012, 33(6): 59-64.
[28] CHEN G, CHENG L, XU H, et al. Functions of different yak bone peptides[J]. International Journal of Food Properties,2011,14(5):1136−1141. doi: 10.1080/10942911003592753
[29] AL-KAHTANI H A, JASWIR I, ISMAIL E A, et al. Structural characteristics of camel-bone gelatin by demineralization and extraction[J]. International Journal of Food Properties,2017,20(11):2559−2568. doi: 10.1080/10942912.2016.1244543
[30] TAHERI A, ABEDIAN A M, GILDBERG A, et al. Extraction and physicochemical characterization of greater lizardfish (Saurida tumbil) skin and bone gelatin[J]. Journal of Food Science,2009,74(3):160−165. doi: 10.1111/j.1750-3841.2009.01106.x
[31] 樊晓盼, 张伯男, 张甜, 等. 响应面法优化热压浸提牛骨蛋白提取工艺[J]. 天津农学院学报,2019,24(2):58−62. [FAN Xiaopan, ZHANG Bonan, ZHANG Tian. Optimization high-temperature and high-pressure extraction process of bovine bone protein using response surface methodology[J]. Journal of Tianjin Agricultural University,2019,24(2):58−62. FAN Xiaopan, ZHANG Bonan, ZHANG Tian. Optimization high-temperature and high-pressure extraction process of bovine bone protein using response surface methodology[J]. Journal of Tianjin Agricultural University, 2019, 24(2): 58-62.
[32] 于小栋. 牦牛骨胶原蛋白肽的制备及其功能特性研究[D]. 西宁: 青海师范大学, 2019. YU Xiaodong. Preparation and functional properties of Yak bone collagen peptide[D]. Xining: Qinghai Normal University, 2019.
[33] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process for utilization of collagen from livestock and fish waste[J]. Process Biochemistry,2002,37(12):1403−1412. doi: 10.1016/S0032-9592(02)00024-9
[34] 黄石溪. 草鱼不同部位胶原蛋白的提取及特性研究[D]. 长沙: 湖南农业大学, 2013. HUANG Shixi. Studies on extraction and characterization of collagen from different parts of grass carp[D]. Changsha: Hunan Agricultural University, 2013.
[35] DELLAROSA N, FRONTUTO D, LAGHI L, et al. The impact of pulsed electric fields and ultrasound on water distribution and loss in mushrooms stalks[J]. Food Chemistry,2017,236:94−100. doi: 10.1016/j.foodchem.2017.01.105
[36] HE G, YAN X, WANG X, et al. Extraction and structural characterization of collagen from fishbone by high intensity pulsed electric fields[J]. Journal of Food Process Engineering,2019,42(6):13214.
[37] 李红霞, 王安琪, 杨德庆, 等. 超高压酶解提取猪腿骨胶原蛋白[J]. 皮革科学与工程,2016,26(4):20−25. [LI Hongxia, WANG Anqi, YANG Deqing, et al. Enzymatic extraction of collagen from pig bone under ultrahigh pressure[J]. Leather Science and Engineering,2016,26(4):20−25. LI Hongxia, WANG Anqi, YANG Deqing, et al. Enzymatic extraction of collagen from pig bone under ultrahigh pressure[J]. Leather Science and Engineering, 2016, 26(4): 20-25.
[38] 严秋萍, 邬应龙, 李月娥, 等. 齐口裂腹鱼骨胶原蛋白超声波辅助提取工艺及其特性研究[J]. 食品与机械,2017,33(12):154−159. [YAN Qiuping, WU Yinglong, LI Yuee, et al. Ultrasonic-assisted extraction process and characteristics analysis of collagen from schizothorax prenatu bone[J]. Food and Machinery,2017,33(12):154−159. YAN Qiuping, WU Yinglong, LI Yuee, et al. Ultrasonic-assisted extraction process and characteristics analysis of collagen from schizothorax prenatu bone[J]. Food and Machinery, 2017, 33(12): 154-159.
[39] GAO L, WANG Z, Zheng L I, et al. The characterization of acid and pepsin soluble collagen from ovine bones (Ujumuqin sheep)[J]. Journal of Integrative Agriculture,2018,17(3):704−711. doi: 10.1016/S2095-3119(17)61751-9
[40] SHEN J, LI D, JIANG F, et al. Purification and concentration of collagen by charged ultra filtration membrane of hydrophilic polyacrylonitrile blend[J]. Separation and Purification Technology,2009,66(2):257−262. doi: 10.1016/j.seppur.2009.01.002
[41] 陈思谨. 海洋红鼓鱼鱼鳞中Ⅰ型胶原蛋白的高效制备技术及其结构研究[D]. 南京: 南京中医药大学, 2019. CHEN Sijin. Studies on high efficient preparation technology and its structure of type Ⅰ collagen from scales of red drum fish (Sciaenops ocellatus)[D]. Nanjing: Nanjing University of Chinese Medicine, 2019.
[42] SCUTARIU R E, BATRINESCU G, NECHIFOR G, et al. Separation of the collagen protein by ultrafiltration: Effects of concentration on the membrane's characteristics[J]. Polymer Engineering & Science,2020,60(10):2487−2495.
[43] 刘雯恩, 周艳芳, 范志强, 等. 优化Ⅰ型胶原蛋白的纯化工艺[J]. 精细化工,2019,36(5):850−855, 874. [LIU Wenen, ZHOU Yanfang, FAN Zhiqiang, et al. Optimization of purification process of collagen type Ⅰ[J]. Fine Chemicals,2019,36(5):850−855, 874. LIU Wenen, ZHOU Yanfang, FAN Zhiqiang, et al. Optimization of purification process of collagen type Ⅰ[J]. Fine Chemicals, 2019, 36(5): 850-855, 874.
[44] ARUMUGAM G K S, SHARMA D, BALAKRISHNAN R M, et al. Extraction, optimization and characterization of collagen from sole fish skin[J]. Sustainable Chemistry and Pharmacy,2018,9:19−26. doi: 10.1016/j.scp.2018.04.003
[45] MCNEILL S, VAN E M E. Red meat in global nutrition[J]. Meat Science,2012,92(3):166−173. doi: 10.1016/j.meatsci.2012.03.014
[46] HADNAĐEV M, HADNAĐEV T D, DOKIĆ L, et al. Physical and sensory aspects of maltodextrin gel addition used as fat replacers in confectionery filling systems[J]. LWT-Food Science and Technology,2014,59(1):495−503. doi: 10.1016/j.lwt.2014.04.044
[47] ATAIE M J, SHEKARABI S P H, JALILI S H. Gelatin from bones of bighead carp as a fat replacer on physicochemical and sensory properties of low-fat mayonnaise[J]. Journal of Microbiology, Biotechnology and Food Sciences,2021,2021:979−983.
[48] YEO E J, KIM H W, HWANG K E, et al. Effect of duck feet gelatin on physicochemical, textural, and sensory properties of low-fat frankfurters[J]. Korean Journal for Food Science of Animal Resources,2014,34(4):415. doi: 10.5851/kosfa.2014.34.4.415
[49] BASS J K, CHAN G M. Calcium nutrition and metabolism during infancy[J]. Nutrition,2006,22(10):1057−1066. doi: 10.1016/j.nut.2006.05.014
[50] ASLAM M N, VARANI J. The western-style diet, calcium deficiency and chronic disease[J]. Nutrition & Food Sciences,2016,6(3):1000496.
[51] 刘静. 牦牛骨胶原多肽螯合钙的制备研究[D]. 雅安: 四川农业大学, 2016. LIU Jing. Preparation of yak bone collagen peptide chelating calcium[D]. Ya’an: Sichuan Agricultural University, 2016.
[52] BI J, WANG X, ZHOU Y, et al. Preparation and characterization for peptide-chelated calcium of deer bone[J]. Food Science and Technology Research,2018,24(4):717−728. doi: 10.3136/fstr.24.717
[53] WU W, HE L, LIANG Y, et al. Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J]. Food Chemistry,2019,284:80−89. doi: 10.1016/j.foodchem.2019.01.103
[54] WANG X, ZHANG Z, XU H, et al. Preparation of sheep bone collagen peptide-calcium chelate using enzymolysis-fermentation methodology and its structural characterization and stability analysis[J]. RSC Advances,2020,10(20):11624−11633. doi: 10.1039/D0RA00425A
[55] 夏松养, 谢超, 霍建聪, 等. 鱼蛋白酶水解物的钙螯合修饰及其功能活性[J]. 水产学报,2008,32(3):471−477. [XIA Songyang, XIE Chao, HUO Jiancong, et al. Calcium chelation modification and functional activity of fish protease hydrolysates[J]. Journal of Fisheries of China,2008,32(3):471−477. XIA Songyang, XIE Chao, HUO Jiancong, et al. Calcium chelation modification and functional activity of fish protease hydrolysates[J]. Journal of Fisheries of China, 2008, 32(3): 471-477.
[56] 刘少华. 鹿角盘胶原蛋白的提取及血管紧张素转化酶(ACE)抑制肽活性研究[D]. 长春: 吉林农业大学, 2015. LIU Shaohua. A study on extracting technology of collagen with antler base and ace inhibitory activity[D]. Changchun: Jilin Agricultural University, 2015.
[57] ICHIMURA T, YAMANAKA A, OTSUKA T, et al. Antihypertensive effect of enzymatic hydrolysate of collagen and Gly-Pro in spontaneously hypertensive rats[J]. Bioscience, Biotechnology, and Biochemistry,2009,73(10):2317−2319. doi: 10.1271/bbb.90197
[58] 张莹, 王宏艳, 马良, 等. 猪皮胶原ACE抑制肽的纯化与鉴定[J]. 现代食品科技,2016(8):115−122. [ZHANG Ying, WANG Hongyan, MA Liang, et al. Purification and identification of ACE inhibitory peptides from porcine skin collagen[J]. Modern Food Science and Technology,2016(8):115−122. ZHANG Ying, WANG Hongyan, MA Liang, et al. Purification and identification of ACE inhibitory peptides from porcine skin collagen[J]. Modern Food Science and Technology, 2016(8): 115-122.
[59] CHENG F Y, WAN T C, LIU Y T, et al. Determination of angiotensin-I converting enzyme inhibitory peptides in chicken leg bone protein hydrolysate with alcalase[J]. Animal Science Journal,2010,80(1):91−97.
[60] 魏庭浩. 猪骨胶原多肽的制备及其血管紧张素转换酶抑制活性的研究[D]. 雅安: 四川农业大学. WEI Tinghao. Preparation and study on angiotensin-Ⅰ-converting enzyme inhibitory activities of porcine collagen polypeptide[D]. Ya’an: Sichuan Agricultural University.
[61] RAFIEE M, JAVAHERI M. A theoretical study of benzaldehyde derivatives as tyrosinase inhibitors using Ab initio calculated NQCC parameters[J]. Molecular Biology Research Communications,2015,4(3):151.
[62] FU Y, YOUNG J F, RASMUSSEN M K, et al. Angiotensin I-converting enzyme-inhibitory peptides from bovine collagen: Insights into inhibitory mechanism and transepithelial transport[J]. Food Research International,2016,89:373−381. doi: 10.1016/j.foodres.2016.08.037
[63] FAN L, ZOU S, GE H, et al. Preparation and characterization of hydroxypropyl chitosan modified with collagen peptide[J]. International Journal of Biological Macromolecules,2016,93:636−643. doi: 10.1016/j.ijbiomac.2016.07.093
[64] SONG H, ZHANG S, ZHANG L, et al. Effect of orally administered collagen peptides from bovine bone on skin aging in chronologically aged mice[J]. Nutrients,2017,9(11):1209. doi: 10.3390/nu9111209
[65] PHIPPS K R, LEE H Y, KIM H, et al. Oral administration of a novel hydrolyzed chicken sternal cartilage extract (BioCell Collagen®) reduces UVB-induced photoaging in mice[J]. Journal of Functional Foods,2020,68:103870. doi: 10.1016/j.jff.2020.103870
[66] HOSSEINI S F, REZAEI M, ZANDI M, et al. Preparation and functional properties of fish gelatin-chitosan blend edible films[J]. Food Chemistry,2013,136(3-4):1490−1495. doi: 10.1016/j.foodchem.2012.09.081
[67] REIMOLD F, NOTHNAGEL C, THIEMIG F. Suitability of casing material for fermented sausages used at unsteady climate conditions[J]. Fleischwirtschaft,2010,90(12):87−92.
[68] ADZALY N Z, JACKSON A, KANG I, et al. Performance of a novel casing made of chitosan under traditional sausage manufacturing conditions[J]. Meat Science,2016,113:116−123. doi: 10.1016/j.meatsci.2015.11.023
[69] CHEN C, LIU F, YU Z, et al. Improvement in physicochemical properties of collagen casings by glutaraldehyde cross-linking and drying temperature regulating[J]. Food Chemistry,2020,318:126404. doi: 10.1016/j.foodchem.2020.126404
[70] MA Y, WANG W, WANG Y, et al. Metal ions increase mechanical strength and barrier properties of collagen-sodium polyacrylate composite films[J]. International Journal of Biological Macromolecules,2018,119:15−22. doi: 10.1016/j.ijbiomac.2018.07.092
[71] WU X, LIU A, WANG W, et al. Improved mechanical properties and thermal-stability of collagen fiber based film by crosslinking with casein, keratin or SPI: Effect of crosslinking process and concentrations of proteins[J]. International Journal of Biological Macromolecules,2018,109:1319−1328. doi: 10.1016/j.ijbiomac.2017.11.144
[72] HU Y, LIU L, DAN W, et al. Synergistic effect of carbodiimide and dehydrothermal crosslinking on acellular dermal matrix[J]. International Journal of Biological Macromolecules,2013,55:221−230. doi: 10.1016/j.ijbiomac.2013.01.009
[73] 张义. 不同交联剂对胶原蛋白可食膜性能的影响[D]. 天津: 天津科技大学, 2016. ZHANG Yi. Influences of different crosslinking agents on properties of edible collagen film[D]. Tianjin: Tianjin University of Science and Technology, 2016.
[74] KHOR E. Methods for the treatment of collagenous tissues for bioprostheses[J]. Biomaterials,1997,18(2):95−105. doi: 10.1016/S0142-9612(96)00106-8
[75] 顾其胜, 蒋丽霞. 胶原蛋白与临床医学[M]. 上海: 第二军医大学出版社, 2003: 69-83. GU Qisheng, JIANG Lixia. Collagen-based biomaterials in clinical medicine[M]. Shanghai: Second Military Medical University Press, 2003: 69-83.
[76] JEON E Y, CHOI B H, JUNG D, et al. Natural healing-inspired collagen-targeting surgical protein glue for accelerated scarless skin regeneration[J]. Biomaterials,2017,134:154−165. doi: 10.1016/j.biomaterials.2017.04.041
[77] 张琳琳, 陈俊, 翁武银. 热处理对罗非鱼皮酸溶性胶原性质的影响[J]. 食品科学,2017,38(5):80−85. [ZHANG Linlin, CHEN Jun, WENG Wuyin. Effect of thermal treatment on the properties of acid-soluble collagen from tilapia skin[J]. Food Science,2017,38(5):80−85. doi: 10.7506/spkx1002-6630-201705013 ZHANG Linlin, CHEN Jun, WENG Wuyin. Effect of thermal treatment on the properties of acid-soluble collagen from tilapia skin[J]. Food Science, 2017, 38(5): 80-85. doi: 10.7506/spkx1002-6630-201705013
[78] WANG W, ZHANG Y, YE R, et al. Physical crosslinkings of edible collagen casing[J]. International Journal of Biological Macromolecules,2015,81:920−925. doi: 10.1016/j.ijbiomac.2015.09.032
[79] MAGDA J, CHO S H, STREITMATTER S, et al. Effects of gamma rays and neutron irradiation on the glucose response of boronic acid-containing “smart” hydrogels[J]. Polymer Degradation and Stability,2014,99:219−222. doi: 10.1016/j.polymdegradstab.2013.11.002
[80] USHARANI N, JAYAKUMAR G C, KANTH S V, et al. Molecular understanding of collagen stabilization: Interaction of valeraldehyde with collagen[J]. Journal of Macromolecular Science, Part A,2012,49(8):666−673. doi: 10.1080/10601325.2012.697038
[81] 岳程飞, 丁长坤, 李璐, 等. 碳化二亚胺/羟基丁二酰亚胺交联改性胶原蛋白纤维制备及其性能[J]. 纺织学报,2020,41(3):1−7. [YUE Chengfei, DING Changkun, LI Lu, et al. Carbodiimide/hydroxysuccinimide crosslinking modification and properties of collagen fibers[J]. Journal of Textile Research,2020,41(3):1−7. YUE Chengfei, DING Changkun, LI Lu, et al. Carbodiimide/hydroxysuccinimide crosslinking modification and properties of collagen fibers[J]. Journal of Textile Research, 2020, 41(3): 1-7.
[82] CHU C, DENG J, MAN Y, et al. Evaluation of nanohydroxyapaptite (nano-HA) coated epigallocatechin-3-gallate (EGCG) cross-linked collagen membranes[J]. Materials Science and Engineering: C,2017,78:258−264. doi: 10.1016/j.msec.2017.04.069
[83] CHEN R N, HO H O, SHEU M T. Characterization of collagen matrices crosslinked using microbial transglutaminase[J]. Biomaterials,2005,26(20):4229−4235. doi: 10.1016/j.biomaterials.2004.11.012
[84] JUS S, STACHEL I, SCHLOEGL W, et al. Cross-linking of collagen with laccases and tyrosinases[J]. Materials Science and Engineering: C,2011,31(5):1068−1077. doi: 10.1016/j.msec.2011.03.007
[85] HOU C, GAO L, WANG Z, et al. Mechanical properties, thermal stability, and solubility of sheep bone collagen-chitosan films[J]. Journal of Food Process Engineering,2020,43(1):13086.
[86] SIONKOWSKA A, MICHALSKA-SIONKOWSKA M, WALCZAK M. Preparation and characterization of collagen/hyaluronic acid/chitosan film crosslinked with dialdehyde starch[J]. International Journal of Biological Macromolecules,2020,149:290−295. doi: 10.1016/j.ijbiomac.2020.01.262
[87] WANG Z, HU S, WANG H. Scale-up preparation and characterization of collagen/sodium alginate blend films[J]. Journal of Food Quality,2017,2017:1−10.
[88] SHAKILA R J, JEEVITHAN E, ARUMUGAM V, et al. Suitability of antimicrobial grouper bone gelatin films as edible coatings for vacuum-packaged fish steaks[J]. Journal of Aquatic Food Product Technology,2016,25(5):724−734. doi: 10.1080/10498850.2014.921658
[89] XIONG Y, KAMBOJ M, AJLOUNI S, et al. Incorporation of salmon bone gelatine with chitosan, gallic acid and clove oil as edible coating for the cold storage of fresh salmon fillet[J]. Food Control,2021,125:107994. doi: 10.1016/j.foodcont.2021.107994
[90] 吴京蔚, 王玉田, 查恩辉. 可食用膜制备及在酱牛肉保鲜中应用的研究[J]. 食品工业科技,2012,33(4):353−356. [WU Jingwei, WANG Yutian, ZHA Enhui. Edible membrane preparation and application in sauce beef preservation research[J]. Science and Technology of Food Industry,2012,33(4):353−356. WU Jingwei, WANG Yutian, ZHA Enhui. Edible membrane preparation and application in sauce beef preservation research[J]. Science and Technology of Food Industry, 2012, 33(4): 353-356.
[91] 包俊青. 基于明胶的人造肠衣制备与应用研究[D]. 无锡: 江南大学, 2019. BAO Junqing. The preparation and application of artificial casing based on gelatin[D]. Wuxi: Jiangnan University, 2019.






 下载:
下载:

 下载:
下载:
