Effect of Osmotic Method on Cell Structure and Quality of Vacuum Freeze-dried Mango
-
摘要: 为探索渗透方式对冻干芒果细胞结构及品质的影响,本实验以玉芒为原料,在环境温度(20、30 ℃)下采用蔗糖固态渗透(SSD)、液态渗透(LOD)方式处理芒果后再进行真空冷冻干燥,通过测定渗透方式处理后芒果鲜样可溶性固形物、细胞形态以及分析冻干芒果的弹性模量、孔隙度、细胞壁结构、色泽以及VC、总酚、β-胡萝卜素保留率指标的变化。结果表明:固态渗透芒果可溶性固形物增加量高于液态渗透,液态渗透处理的芒果细胞形态与鲜样(CK)无明显差异,固态渗透随蔗糖添加量的增加可溶性固形物含量和细胞形态皱缩程度增加;固态渗透减少细胞间孔隙度提高芒果弹性模量;傅里叶变换红外光谱结果表明O-H的伸缩震动吸收峰,随着蔗糖添加量的增加,吸收峰强度逐渐增加;低蔗糖固态渗透有利于维持芒果色泽;在环境温度20和30 ℃条件下固态渗透处理的真空冷冻芒果VC和总酚的保留率高于液态渗透,其中固态渗透SSD20的VC和总酚保留率最高分别为37.75%、33.37%;固态渗透SSD20处理的真空冷冻芒果的β-胡萝卜素保留率高于液态渗透LOD30,但固态渗透随蔗糖添加量的增加,β-胡萝卜素的保留率逐渐下降。本研究结果发现低蔗糖固态渗透可以有效提高真空冷冻芒果的综合品质,为改善芒果干燥制品品质提供理论参考。Abstract: This study aimed to explore the effect of osmotic methods on the cell structure and quality of freeze-dried mango. This experiment uses jade as the raw material, mango was treated by solid osmotic (SSD) and liquid osmotic (LOD) at 20 and 30 ℃, and then vacuum freeze-dried. By measuring the soluble solids and cell morphology of fresh mango samples after osmosis treatment, and analyzing the changes of elastic modulus, porosity, cell wall structure, color and VC, total phenols, and β-carotene retention index of freeze-dried mangoes. The results showed that the increasing of soluble solids in solid osmotic mango was higher than that in liquid osmotic. There was no significant difference between the cell morphology of liquid osmotic mango and fresh sample (CK). The content of soluble solids and the shrinkage degree of cell morphology increased with the increasing of sucrose, the solid osmotic reduced the intercellular porosity and increased the elastic modulus of mango. Moreover, results of infrared spectroscopy showed that the stretching vibration absorption peak of O-H increased with the increasing of sucrose content. Low sucrose solid osmotic helps to maintain the color of mango. The retention rates of VC and total phenol in solid osmotic were higher than those in liquid osmotic at ambient temperature of 20 and 30 ℃, and the highest retention rates of SSD20 VC and total phenol in solid state infiltration were 37.75% and 33.37%, respectively. The retention rate of β-carotene in vacuum freeze-dried mango SSD20 treated with solid osmotic treatment was higher than that of liquid osmotic treatment LOD30, but the retention rate of β-carotene decreases gradually with the increasing of sucrose supplementation in solid osmotic treatment. The results of this study showed that low sucrose solid osmotic could effectively improve the comprehensive quality of vacuum freeze-dried mango, which would provide a theoretical reference for improving the quality of dried mango products.
-
Keywords:
- mango /
- solid osmotic /
- liquid osmotic /
- cell structure /
- quality
-
芒果(Mangifera indica L.)属漆树科、芒果属常绿乔木,是世界第二大热带水果[1-2],芒果中含有丰富的营养化合物,如维生素C、β-胡萝卜素和酚类物质[3]。新鲜芒果水分含量高,是典型的跃变型水果,在采收之后仍然会存在生理变化,后熟之后会迅速软烂,并且采收季节通常多为夏季,极易腐败变质。糖渍是果蔬加工过程中常用的预处理渗透方式,糖渍包括糖水液浸渍法(液态渗透)和固体糖干法糖渍(固态渗透)。液态渗透是一种将果蔬浸入渗透溶液中的渗透方法;固态渗透是一种直接将固体渗透剂加在果蔬表面的渗透方法[4]。目前,国内外关于糖渍渗透的研究多有报道,但主要集中在联合液态渗透方式,主要有真空渗糖、微波渗糖和超声渗糖等[5-6]。邓茹月等[7]研究表明真空糖渍能更好的保存刺梨中的营养成分。徐乾达等[8]研究发现糖渍能显著提高玫瑰花提取物的自由基清除活性并对花色苷的种类和含量有明显影响。刘佳新[9]发现经过浸糖处理后能显著提高压差膨化黄桃片的弹性模量,且细胞间孔隙度更加紧密。干燥脱水是果蔬加工过程中较为常见的一种方式,主要有热风干燥、微波干燥、真空冷冻干燥。真空冷冻干燥可以保持物料的形态和营养物质[10]。张晓敏[11]研究发现渗透-真空冷冻干燥能改善产品品质,延长保质期。张莉会等[12]研究发现蔗糖结合超声预处理能提高真空冷冻联合热风干燥草莓片品质及抗氧化活性。以上研究主要集中在液态渗透对真空冷冻干燥产品品质的影响,关于固态渗透在冷冻干燥方面的研究报道较少,有关固态渗透和液态渗透对真空冷冻芒果品质影响的对比研究,还未见报道。
本实验在环境温度20和30 ℃条件下通过不同渗透方式处理芒果,再对其进行真空冷冻干燥,从而探究渗透方式对真空冷冻干燥芒果可溶性固形物得率、细胞形态、弹性模量、孔隙度、细胞结构、色泽以及营养物质保留率的影响,旨在为改善芒果加工产品品质提供理论依据。
1. 材料与方法
1.1 材料与仪器
芒果 果产地越南 杨凌润美农业发展有限公司;蔗糖 南京市苏果超市;偏磷酸、无水乙醇、碳酸钠、正己烷、丙酮、甲苯、氢氧化钾、甲醇、硫酸钠、二甲苯 分析纯,国药集团化学试剂有限公司;福林酚 BR,上海麦克林生化科技有限公司;正磷酸、甲基叔丁基醚、甲醇 色谱纯,Tedia公司;FAA固定液 北京百旺通达科技有限公司;PAS染色液 武汉赛维尔生物科技有限公司。
FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;16KR台式高速冷冻离心机 湖南可成仪器设备有限公司;1200高效液相色谱仪 美国安捷伦科技有限公司;UV-6300型紫外-可见分光光度计 上海美谱达仪器有限公司;CM-700d型分光测色色差计 日本柯尼卡美能达公司;ZX-27型傅里叶变换红外光谱仪 德国Bruker公司;CT3 25K型质构仪 美国博勒飞公司;NIKON ECLIPSE E100正置光学显微镜 日本尼康。
1.2 实验方法
1.2.1 样品处理
挑选果皮微黄、可溶性固形物含量在11~15°Brix,成熟度相近、无机械损伤的玉芒,清洗、去皮、切块,果块大小 2 cm×2 cm×1 cm。固态渗透处理:将挑选的芒果切分成大小一致的芒果块,分装在形状一致的玻璃瓶中,每瓶100 g。每瓶加入芒果块质量20%的蔗糖(20 g,SSD20)、30%的蔗糖(30 g,SSD30)、40%的蔗糖(40 g,SSD40),用玻璃棒搅拌均匀。液态渗透处理:将挑选的芒果切分成大小一致的芒果块浸没在装有质量浓度为30%蔗糖溶液(通过预实验结果及查阅相关文献选取)的玻璃瓶中,每瓶 100 g,固液比1:3(LOD30)。本实验模拟企业冬季和夏季生产环境温度,将样品分别置于温度20和30 ℃条件下糖渍。在糖渍渗透48 h后取样,用蒸馏水快速冲洗样品表面,并用吸水纸吸干表面水分,样品预冻后经真空冷冻干燥,保存备用。真空冷冻干燥流程具体如下:当冷阱温度达到−35 ℃时,将预冻的芒果样品放入冻干仓。待冷阱温度降至−40 ℃时开启真空泵,真空压力下降到50 Pa时,启动辐射板加热程序,当芒果样品与辐射板油温持平,真空冷冻干燥过程结束。
1.2.2 可溶性固形物的测定
不同渗透方式糖渍渗透48 h后,在室温环境下,采用PAL-1迷你数显折射仪测定芒果可溶性固形物含量,结果以%计。
1.2.3 细胞结构学观察
采用细胞壁过碘酸雪夫(PAS)染色方法[13],将渗透处理的芒果取长约5 mm的薄块,加入8 mL FAA固定液于离心管中固定,制成石蜡切片。切片脱蜡至水,依次用二甲苯和75%乙醇冲洗。浸入0.5%高碘酸水溶液中,氧化15 min后经纯水浸洗3次,每次约10 s。切片入雪夫试剂中避光染色30 min,流水冲洗5 min。用苏木素染色30 s,自来水洗。经分化、返蓝后用流水冲洗。依次用无水乙醇和二甲苯脱水5 min,经透明后用中性树胶封片。扫描切片用正置光学显微镜采集图像,利用CaseViewer进行分析。
1.2.4 弹性模量E测定
将不同渗透处理后进行冷冻干燥的芒果样品,用游标卡尺测量其厚度并按照编号记录;将芒果块置于黑色桌面并在旁边放置1 cm×1 cm的白色纸片(作为标尺),从正上方拍摄照片采集图像以便计算受力面积。每个样品取10个冻干芒果块,样品面积计算使用matlab软件,输入特定程序便可得出样品受力面积。采用TA.XT-plus CT3质构分析仪进行测定,将样品平放放在质构仪操作台上选用TA4/1000探头,无夹具,测试类型为压缩测试,目标值为样品厚度50%,触发点符合为10 g,测试速度为1 mm/s。经过压缩测试之后直接得到时间-位移-负荷(载荷)数据。
σ=G×g100A (1) 式中:σ:应力,单位面积所受到的垂直于该面的力;G:负荷,单位为g;g:重力系数,为9.8 N/kg;A:样品的横切面面积,单位为cm2。
ε=ΔLL×100 (2) 式中:
ε:应变,样品在压缩测试过程中的厚度改变量与原始厚度之比,%; ΔL :位移或距离(厚度改变量),单位为mm;L:样品压缩前原始厚度,单位为mm。弹性模量、粘性指数与应力应变的关系为:σ=Eε+dεp (3) 式中:E:弹性模量,单位kPa;p:粘性指数;d:粘弹性参数,单位kPa。
使用SPSS带入上述公式用非线性回归分析方法进行参数估计,得到弹性模量E。
1.2.5 孔隙度测定
参照Zielinska等[14]的方法,体积密度(密度)是质量与体积的比值,将不同渗透处理后进行冷冻干燥的芒果块样品研磨成粉,备用。准确称量50 mL标准比重瓶的重量,将无水甲苯放入比重瓶中,擦净表面溢出的液体后称重;取2.000 g左右样品放入空比重瓶中并称重,将无水甲苯放入装有样品的比重瓶中,称重。
ρ0=0.864×(W3−W1)W2+(W3−W1)−W4 (4) 式中:ρ0—颗粒密度(g/cm3);W1—比重瓶重量(g);W2—比重瓶和甲苯的重量(g);W3—样品和比重瓶的重量(g);W4—样品、甲苯和比重瓶的重量(g)。
ε=(1−ρρ0)×100 (5) 式中:ε—孔隙度,%;ρ—体积密度;ρ0—颗粒密度。
1.2.6 傅里叶变换红外光谱分析
将不同渗透处理后进行冷冻干燥的芒果样品研磨成粉称取2 mg,进行波数为400~4000 cm−1的红外光谱扫描,分辨率4 cm−1,累计扫描32 次。
1.2.7 冻干芒果色泽测定
采用色差仪测定不同渗透处理后进行冷冻干燥的芒果样品的色泽指标L*值、a*值、b*值,鲜样(CK)色泽指标为L0*值、a0*值、b0*值,总色差△E用于指明色泽整体变化程度,计算见下式:
ΔE=√(L*−L*0)2+(a*−a*0)2+(b*−b*0)2 (6) 每个处理取6个冻干芒果块,结果取其平均值。
1.2.8 冻干芒果VC保留率的测定
1.2.8.1 VC的提取
参照刘胜辉等[15]、刘霞等[16]的方法稍作修改,将不同渗透处理后进行冷冻干燥的芒果样品研磨成粉,称取1.0 g芒果粉于50 mL离心管中,加入10 mL 4 ℃预冷的0.25%的偏磷酸浸提,在4 ℃条件下10000 r/min离心10 min,取上清液,上清液经微孔滤膜(水系,0.45 μm)过滤后待测。
1.2.8.2 HPLC测定VC条件
色谱柱为ZORBAX 300SB-C18(4.6 mm×250 mm,5 μm),流动相设置为0.03 mol/L正磷酸,流速为0.8 mL/min,柱温25 ℃,检测波长240 nm,进样量为20 μL,根据标准曲线计算样品中VC的含量。
1.2.8.3 VC的保留率计算
参照汪小聘等[17]的方法,抗坏血酸保留率计算见下式:
VC保留率(%)=CC0×100 (7) 式中:C0为未渗透冻干芒果VC含量(mg/g dw);C为渗透处理冻干芒果VC含量(mg/g dw)。
1.2.9 冷冻干燥芒果总酚保留率的测定
1.2.9.1 总酚的提取
参照李静等[18]的方法,将不同渗透处理后进行冷冻干燥的芒果块样品研磨成粉,称取1.0 g芒果粉于50 mL离心管中,用加入12.5 mL 70%乙醇溶液,30 ℃超声30 min后,9000 r/min离心5 min,取上清液待测。
1.2.9.2 总酚的保留率计算
参照王俊涛等[4]的方法,总酚保留率计算见下式:
总酚保留率(%)=CC0×100 (8) 式中:C0为未渗透冻干芒果总酚含量(mg/g dw);C为渗透处理冻干芒果总酚含量(mg/g dw)。
1.2.10 冷冻干燥芒果类胡萝卜素保留率的测定
1.2.10.1 类胡萝卜素的提取
参照孙明奇[19]、Zepka等[20]方法并稍作修改,将不同渗透处理后进行冷冻干燥的芒果块样品研磨成粉,准确称取1 g芒果粉于10 mL离心管中,加入3 mL(V(正己烷):V(乙醇):V(丙酮):V(甲苯)=10:6:7:7)混合提取液,静置3~4 h,加入1 mL 40% KOH-甲醇溶液,摇匀后置于暗处25 ℃皂化16 h,将皂化液转入到10 mL离心管中,加入3 mL正己烷,再加入3 mL 10%硫酸钠溶液,离心,收集上层溶液,氮气吹干,用1 mL甲醇溶解,涡旋振荡,溶液经微孔滤膜(有机系,0.45 μm)待HPLC分析。
1.2.10.2 类胡萝卜素的HPLC条件
色谱柱为YMC-C30(4.6 mm×250 mm,5 μm)检测样品中类胡萝卜素的含量,流动相A为V(甲醇):V(MTBE):V(水)=70:25:5、流动相B为V(MTBE):V(甲醇):V(水)=85:10:5,设置进样量为20 μL、柱温为25 ℃、流速为0.6 mL/min,根据标准曲线计算样品中类胡萝卜素的含量。
1.2.10.3 类胡萝卜素的保留率计算
类1.2.8.3。
1.3 数据处理
以上所有试验重复三次,各试验结果均以“平均值(means)±标准差(SD)”表示。采用SPSS26.0软件进行Duncan比较分析,在0.05水平上进行显著性检验,采用Office Excel 2019进行数据处理,使用Origin2019b软件进行作图。
2. 结果与分析
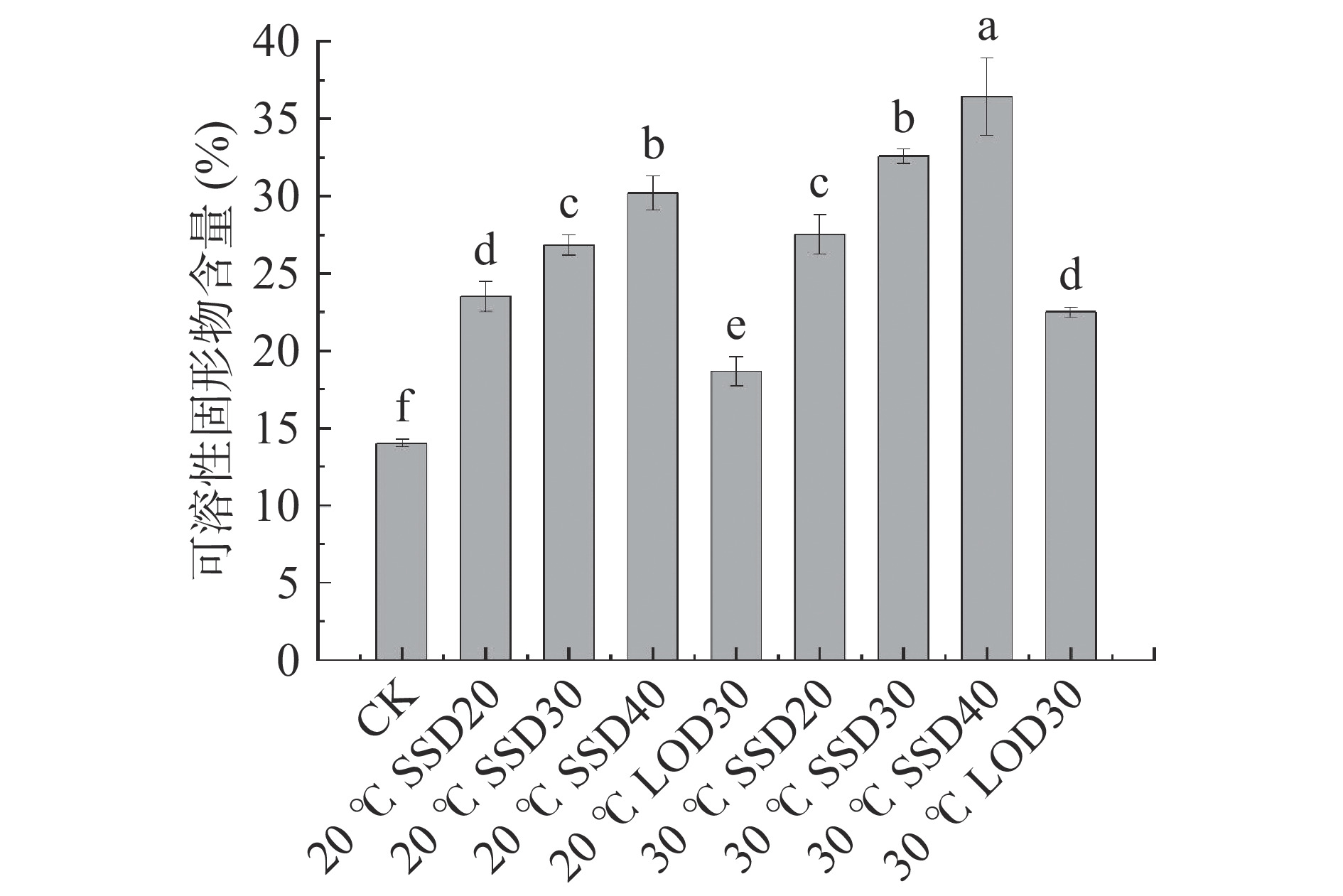
2.1 渗透方式对芒果可溶性固形物的影响
由图1可以看出,不同渗透方式处理对芒果可溶性固形物含量影响显著(P<0.05)。不同渗透方式处理的芒果可溶性固形物含量都显著高于鲜样(P<0.05),这是因为渗透处理组的渗透压高于芒果内部组织的渗透压,导致渗透溶液的蔗糖在渗透压的驱动力的影响下,向芒果内部扩散。同一渗透方式下环境温度20 ℃的可溶性固形物含量显著低于30 ℃(P<0.05),这是因为提高温度可加快物质传递速率。同一环境温度下,不同渗透方式可溶性固形物含量趋势为:SSD40>SSD30>SSD20>LOD30。
2.2 渗透方式对芒果细胞形态的影响
渗透处理芒果PAS染色图如图2所示,可以看出20 ℃ LOD30和30 ℃ LOD30处理的芒果细胞形态和CK鲜样的细胞形态差异不显著,可能是液态渗透糖浓度低芒果失水少,且芒果块排出的水分降低了糖水液浓度,使芒果块细胞内外处于平衡状态,导致其细胞形态无明显变化。固态渗透处理的芒果细胞形态和液态渗透相比有一定程度的皱缩,可能是固态渗透初期芒果水分流出溶解蔗糖,此时可近似看成饱和糖液,因此其失水率高于液态渗透,其渗透处理的芒果细胞形态皱缩程度比液态渗透显著,且固态渗透随着蔗糖添加量和温度的增加,细胞形态皱缩程度增加。
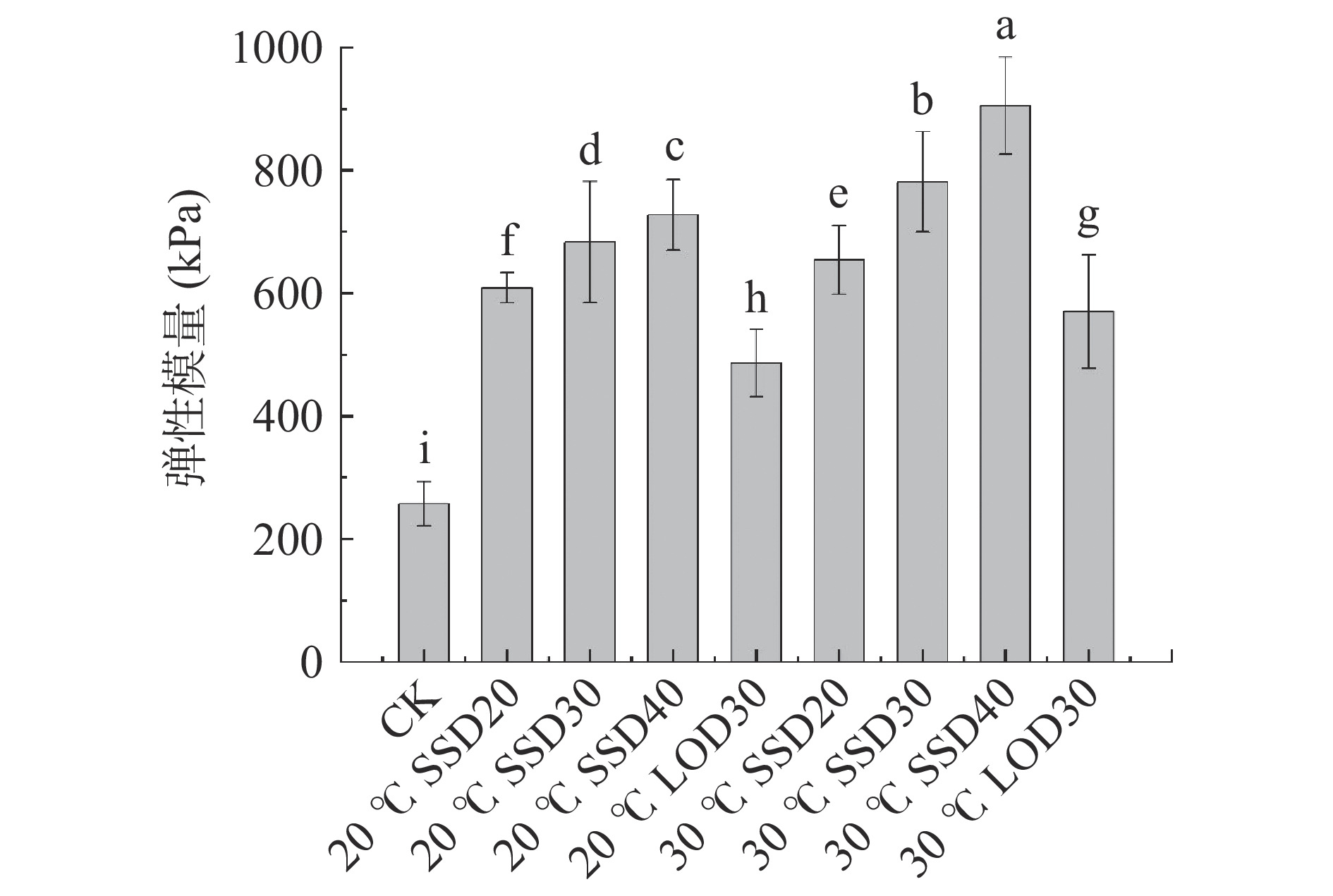
2.3 渗透方式对冷冻干燥芒果弹性模量E的影响
弹性模量E是反映材料在外力的作用下抵抗变形能力的指标,其值越大说明给抵抗外力变形能力越大[9]。图3所示,经过渗透处理的真空冷冻芒果弹性模量都相对CK(未浸渍)鲜样的弹性模量显著增加(P<0.05),其中30 ℃ SSD40处理的芒果弹性模量最大,说明其抵抗外力变形能力最大,这可能是SSD40蔗糖添加量最多,且提高温度加快物质传递,随着渗透的进行,使芒果内部可溶性固 形物增加最多,增强了芒果的结构密度,细胞形态随糖渍的进行发生皱缩程度最大,加强了芒果的组织强度。
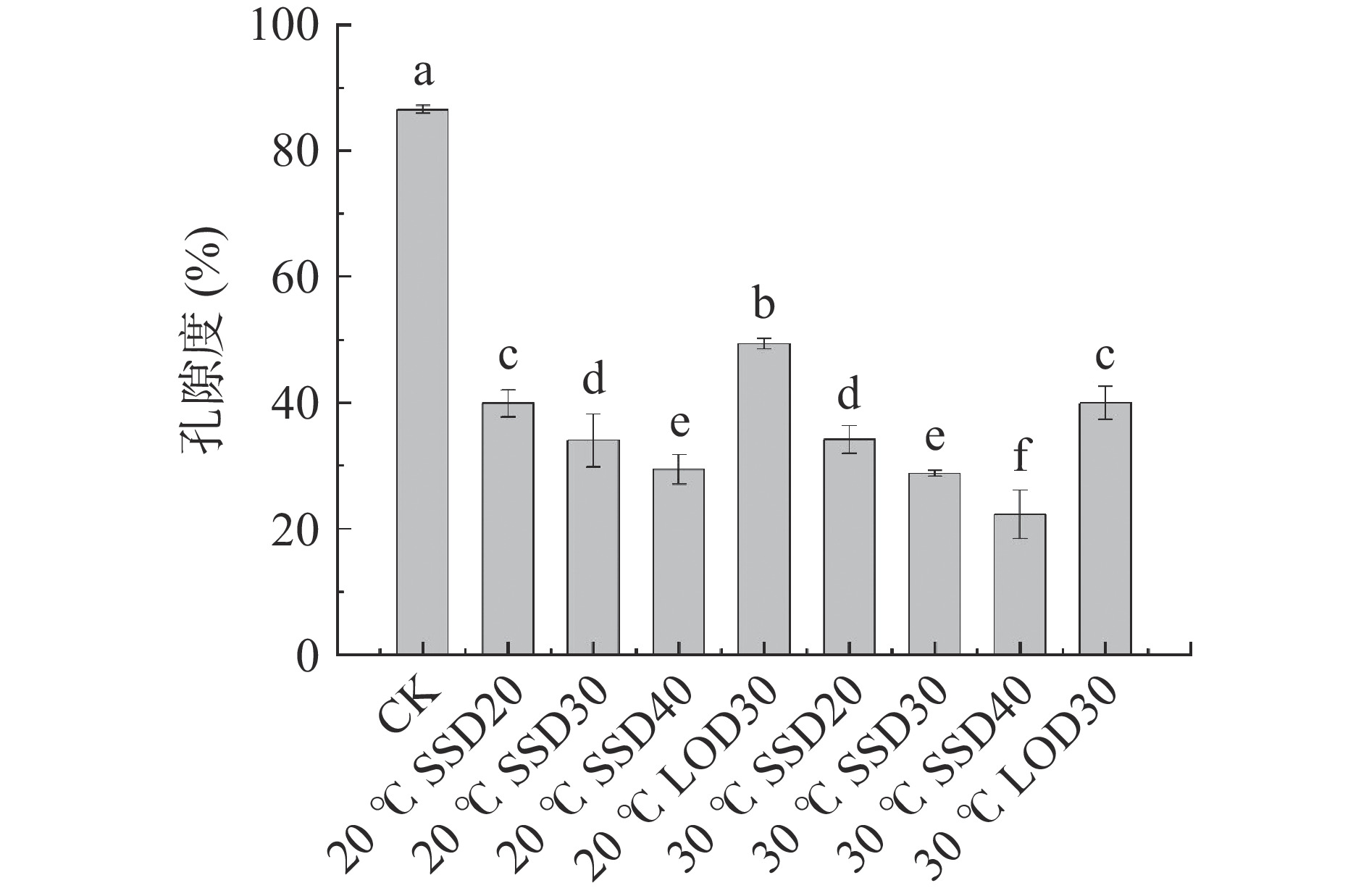
2.4 渗透方式对冷冻干燥芒果孔隙度的影响
孔隙度是描述真空冷冻芒果质构特征的重要指标,其值越大表示样品中孔隙空间体积越大[21]。图4所示,经过渗透处理的真空冷冻芒果孔隙度都相对CK(未浸渍)鲜样的弹性模量显著降低(P<0.05),这可能是由于渗透破坏了细胞结构,使芒果收缩,且在渗透过程中,蔗糖浸入芒果内部增加了固形物含量填充在细胞间隙减少了孔隙度。其中30 ℃ SSD40处理的芒果块孔隙度最小,为22.29%,这可能是SSD40蔗糖添加量最多,且提高温度加快物质传递,随着渗透的进行,使芒果内部可溶性固形物增加最多,其孔隙度最低。
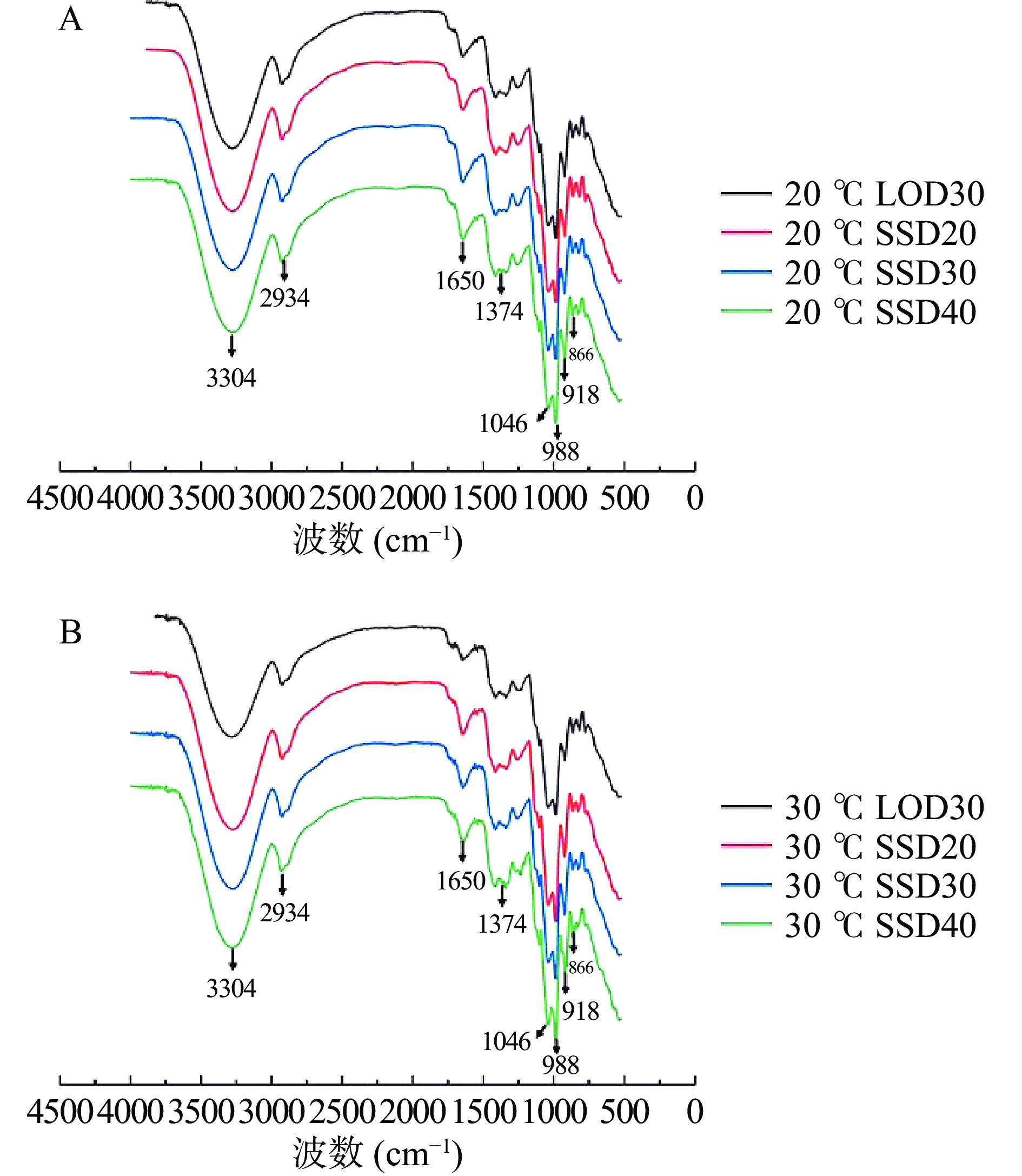
2.5 渗透方式对冷冻干燥芒果细胞壁结构的影响
傅里叶变换红外光谱通过特征基团所引起的吸收峰强度变化来表征细胞壁结构的变化[22]。图5为渗透处理的真空冷冻芒果细胞壁的傅里叶变换红外光谱图。由图可知,在3304 cm−1附近的峰为细胞壁中羟基O-H的伸缩震动吸收峰,随着蔗糖添加量的增加,此处的吸收峰强度逐渐增加,主要是由于蔗糖和细胞壁组分之间氢键的形成[22],在2934 cm−1附近的峰为细胞壁中CH2基团的C-H键伸缩振动吸收峰,在1374 cm−1附近的峰为C-H弯曲振动,这3个峰是糖类特征性吸收峰[23]。在1650 cm−1附近的吸收峰为羧基特征吸收峰,在1046 cm−1附近的吸收峰为C-O伸缩振动,表明存在CO-H和C-O-C键[24]。环境温度20和30 ℃条件下渗透方式处理芒果的傅里叶变换红外光谱的谱型之间差异不明显,说明温度对芒果细胞壁官能团影响较小。
2.6 渗透方式对冷冻干燥芒果色泽的影响
色泽是芒果品质评价的指标之一,它直接影响产品的感官品质[25]。渗透方式处理的真空冷冻芒果色泽变化结果如表1所示,跟CK(鲜样)对比渗透方式处理芒果的L*、a*、b*值都有所下降。在环境温度20和30 ℃下固态渗透SSD20的L*、a*、b*值高于液态渗透LOD30,但是差异不显著(P>0.05);固态渗透随蔗糖添加量的增加芒果的L*值逐渐降低,a*值变化不显著(P>0.05),同一蔗糖添加量在环境温度20和30 ℃的b*值差异不显著(P>0.05),△E值差异显著(P<0.05)。渗透处理的芒果色泽变化的原因可能是由于在一定蔗糖浓度范围内,芒果的色泽接近鲜样,当蔗糖添加量超过一定范围时,美拉德反应可能占据了主导,同时一些酶促褐变的参与会降低芒果色泽[22,26]。
表 1 渗透方式对冷冻干燥芒果色泽的影响Table 1. Effect of osmotic method on the color of freeze-drying mango渗透方式 L* a* b* △E CK 75.10±3.14a 6.19±0.68a 43.74±0.56a − 20 ℃ LOD30 70.47±1.02b 3.86±0.33b 31.86±2.34b 13.00±2.31e 20 ℃ SSD20 72.40±1.78ab 4.03±0.61b 35.14±2.88b 9.47±2.63f 20 ℃ SSD30 65.96±1.69c 3.82±0.68b 27.40±2.45cd 18.95±2.29c 20 ℃ SSD40 59.52±2.22e 3.73±0.49b 25.87±1.76d 23.94±2.51b 30 ℃ LOD30 66.22±0.56c 3.62±0.21b 30.91±0.46bc 15.82±0.67d 30 ℃ SSD20 66.18±1.55c 3.78±0.29b 35.01±2.24b 12.84±1.81e 30 ℃ SSD30 63.05±0.35d 3.41±0.22b 27.07±0.79cd 20.77±0.72c 30 ℃ SSD40 54.99±2.56f 3.39±0.08b 24.53±1.54d 28.05±1.32a 注:小写英文字母不同表示同列数据差异显著(P<0.05);表2同。 2.7 渗透方式对冷冻干燥芒果营养物质保留率的影响
真空冷冻干燥能够较好地保留果蔬中的营养成分和风味[27],由表2可知,相同环境温度下不同渗透处理方式对冷冻干燥芒果VC、总酚保留率有显著影响(P<0.05),且呈相同趋势,即SSD20>SSD30>SSD40>LOD30,可能是在渗透过程中芒果细胞内外的浓度差产生渗透压,驱使渗透剂渗入到芒果内部使其不断失水。植物细胞膜作为一层非选择性地半透膜,在渗透脱水的过程中,芒果内部的VC、总酚会随水分子转移到细胞外[28]。在渗透脱水过程,固态渗透随蔗糖添加量的增加,失水率越高,VC、总酚随水分子溶出越多[29-30],故不同固态渗透处理条件下的冻干芒果VC、总酚的保留率趋势为SSD20>SSD30>SSD40。液态渗透较固态渗透VC、总酚保留率低可能是液态渗透的芒果长时间浸泡在糖水液中,芒果组织疏松,导致更多的VC、总酚溶出,且固态渗透糖液浓度比液态渗透浓度高,黏度大,使得芒果细胞内的营养物质流失受阻,故液态渗透条件下的冻干芒果VC、总酚保留率最低。同一渗透方式下30 ℃条件下的VC、总酚保留率低于20 ℃的保留率,可能是提高温度加快物质传递,芒果失水更多,VC、总酚溶出更多,冻干芒果VC、总酚保留率低。
表 2 渗透处理对冷冻干燥芒果VC、总酚、β-胡萝卜素保留率的影响(%)Table 2. Effect of osmotic treatment on the retention rate of freeze-dried mango VC, total phenols and β-carotene (%)渗透方式 VC保留率 总酚保留率 β-胡萝卜素保留率 20 ℃ LOD30 29.38±1.92e 23.06±2.65f 42.84±0.84b 20 ℃ SSD20 37.75±1.82a 33.37±1.02a 56.11±3.51a 20 ℃ SSD30 34.55±1.49b 30.72±1.63b 19.49±3.88c 20 ℃ SSD40 32.31±1.88d 26.56±1.51d 18.40±3.22c 30 ℃ LOD30 23.55±2.09g 20.57±1.48 42.45±3.96b 30 ℃ SSD20 33.47±2.25c 32.55±1.97a 55.59±3.47a 30 ℃ SSD30 29.23±1.59e 29.14±1.36c 18.91±2.07c 30 ℃ SSD40 26.24±1.28f 25.18±1.06 14.82±2.07c 芒果果肉含量最丰富的类胡萝卜素是β-胡萝卜素[31]。20 ℃的保留率略高于30 ℃的保留率,可能是提高温度会使β-胡萝卜素遭受热裂解反应而发生降解。相同环境温度下不同渗透方式处理的冻干芒果的β-胡萝卜素保留率趋势为SSD20>LOD30>SSD30>SSD40,可能是新鲜果蔬中的β-胡萝卜素是以晶体形态存在于细胞有色体的类囊体膜上,并与膜蛋白结合,由于细胞的完整结构和脂蛋白等物质的保护而具有较高的稳定性[32],但芒果在渗透过程中,可能细胞壁、细胞膜、类囊体膜等结构被破坏,从而造成β-胡萝卜素保留率下降。液态渗透LOD30处理的芒果,因长时间浸泡在糖液中可能导致细胞结构的降解[33],固态渗透SSD20因蔗糖添加量少,芒果被排出的水分少,使其不能完全浸泡在糖水液中,从而对芒果细胞结构破坏小,所以β-胡萝卜素保留率高于液态渗透LOD30,但随着蔗糖添加量的增加,芒果失水增加,且高浓度的蔗糖加剧对细胞结构的破坏,β-胡萝卜素保留率降低。
3. 结论
本论文分别在环境温度20和30 ℃下探究渗透方式对真空冷冻芒果可溶性固形物含量、细胞形态、弹性模量、孔隙度、细胞结构、色泽及营养物质的影响。结果发现,固态渗透随着蔗糖添加量和环境温度的增加可溶性固形物含量和细胞形态皱缩程度增加,冻干芒果组织结构弹性模量增加,蔗糖将水作为载体均匀的扩散到芒果块内部,吸附在细胞间隙使冻干芒果孔隙度减小。环境温度20和30 ℃条件下渗透方式处理芒果的傅里叶变换红外光谱的谱型之间差异不明显。液态渗透处理的冻干芒果色泽以及营养物质保留率低于固态渗透处理,但随着固态渗透蔗糖添加量的增加色泽逐渐变差,营养物质保留率逐渐下降,说明固态渗透方式下低质量分数蔗糖生产的冻干芒果品质好。综上,真空冷冻干燥的芒果块品质变化与渗透方式息息相关,从感官品质、营养健康等方面综合考虑,真空冷冻干燥芒果可优选固态渗透SSD20作为渗透预处理方式。
-
表 1 渗透方式对冷冻干燥芒果色泽的影响
Table 1 Effect of osmotic method on the color of freeze-drying mango
渗透方式 L* a* b* △E CK 75.10±3.14a 6.19±0.68a 43.74±0.56a − 20 ℃ LOD30 70.47±1.02b 3.86±0.33b 31.86±2.34b 13.00±2.31e 20 ℃ SSD20 72.40±1.78ab 4.03±0.61b 35.14±2.88b 9.47±2.63f 20 ℃ SSD30 65.96±1.69c 3.82±0.68b 27.40±2.45cd 18.95±2.29c 20 ℃ SSD40 59.52±2.22e 3.73±0.49b 25.87±1.76d 23.94±2.51b 30 ℃ LOD30 66.22±0.56c 3.62±0.21b 30.91±0.46bc 15.82±0.67d 30 ℃ SSD20 66.18±1.55c 3.78±0.29b 35.01±2.24b 12.84±1.81e 30 ℃ SSD30 63.05±0.35d 3.41±0.22b 27.07±0.79cd 20.77±0.72c 30 ℃ SSD40 54.99±2.56f 3.39±0.08b 24.53±1.54d 28.05±1.32a 注:小写英文字母不同表示同列数据差异显著(P<0.05);表2同。 表 2 渗透处理对冷冻干燥芒果VC、总酚、β-胡萝卜素保留率的影响(%)
Table 2 Effect of osmotic treatment on the retention rate of freeze-dried mango VC, total phenols and β-carotene (%)
渗透方式 VC保留率 总酚保留率 β-胡萝卜素保留率 20 ℃ LOD30 29.38±1.92e 23.06±2.65f 42.84±0.84b 20 ℃ SSD20 37.75±1.82a 33.37±1.02a 56.11±3.51a 20 ℃ SSD30 34.55±1.49b 30.72±1.63b 19.49±3.88c 20 ℃ SSD40 32.31±1.88d 26.56±1.51d 18.40±3.22c 30 ℃ LOD30 23.55±2.09g 20.57±1.48 42.45±3.96b 30 ℃ SSD20 33.47±2.25c 32.55±1.97a 55.59±3.47a 30 ℃ SSD30 29.23±1.59e 29.14±1.36c 18.91±2.07c 30 ℃ SSD40 26.24±1.28f 25.18±1.06 14.82±2.07c -
[1] LI L, HONG X W, XIAO W M, et al. Transcriptional mechanism of differential sugar accumulation in pulp of two contrasting mango (Mangifera indica L.) cultivars[J]. Genomics,2020,112:4505−4515. doi: 10.1016/j.ygeno.2020.07.038
[2] SULISTYAWATI I, DEKKER M, FOGLIANO V, et al. Osmotic dehydration of mango: Effect of vacuum impregnation, high pressure, pectin methylesterase and ripeness on quality[J]. LWT-Food Science and Technology,2018,98:179−186. doi: 10.1016/j.lwt.2018.08.032
[3] PAN Xin, WU Jihong, ZHANG Wentao, et al. Effects of sugar matrices on the release of key aroma compounds in fresh and high hydrostatic pressure processed Tainong mango juices[J]. Food Chemistry,2021:338.
[4] 王俊涛, 滕建文, 韦保耀, 等. 不同渗透方式对芒果脱水效率和品质的影响[J]. 食品科学,2020(10):225−236. [WANG J T, TENG J W, WEI B Y, et al. Effects of different infiltration methods on mango dehydration efficiency and quality[J]. Food Science,2020(10):225−236. [5] 盛金凤, 李丽, 孙健, 等. 不同渗糖方式对芒果果脯品质及组织细胞的影响[J]. 现代食品科技,2014,30(6):202−206. [SHENG J F, LI L, SUN J, et al. Effects of different sugar penetrating methods on the quality and tissue cells of mango preserved fruit[J]. Modern Food Technology,2014,30(6):202−206. [6] 李兴武, 章黎黎. 渗糖方式对脆红李果脯品质及香气的影响[J]. 食品研究与开发,2017,38(21):79−84. [LI X W, ZHANG L L. The effect of sugar infiltration methods on the quality and aroma of crisp red plum[J]. Food Research and Development,2017,38(21):79−84. doi: 10.3969/j.issn.1005-6521.2017.21.016 [7] 邓茹月, 曾海英, 叶双全, 等. 真空糖渍对刺梨果脯品质及风味的影响[J]. 食品与机械,2014,30(4):220−223. [DENG R Y, CENG H Y, YE S Q, et al. Effect of vacuum sugaring on the quality and flavor of candied cili[J]. Food and Machinery,2014,30(4):220−223. [8] 徐乾达, 陈琳, 何强, 等. 糖渍处理对玫瑰花醇提取物自由基清除活性的影响[J]. 包装工程,2020,41(11):17−24. [XU Q D, CHEN L, HE Q, et al. Effect of sugar treatment on free radical scavenging activity of rose flower alcohol extract[J]. Packaging Engineering,2020,41(11):17−24. [9] 刘佳新. 浸渍预处理调控黄桃膨化脆片质地结构的研究[D]. 沈阳: 沈阳农业大学, 2019. LIU J X. Study on adjusting the texture and structure of yellow peach puffed and crispy slices by dipping pretreatment[D]. Shenyang: Shenyang Agricultural University, 2019.
[10] 郭树国, 蒋爱国, 王艳丽. 基于品质和能耗的猕猴桃真空冷冻干燥工艺优化[J]. 食品研究与安全,2016,37(4):108−112. [GUO S G, JIANG A G, WANG Y L. Optimization of vacuum freeze drying process of kiwi fruit based on quality and energy consumption[J]. Food Research and Safety,2016,37(4):108−112. [11] 张晓敏. 板栗渗透脱水及联合干燥技术研究[D]. 武汉: 华中农业大学, 2012. ZHANG X M. Research on osmotic dehydration and combined drying technology of chestnut[D]. Wuhan: Huazhong Agricultural University, 2012.
[12] 张莉会, 廖李, 汪超, 等. 超声和渗透预处理对干燥草莓篇品质及抗氧化活性的影响[J]. 现代食品科技,2018,34(12):196−203. [ZHANG L H, LIAO L, WANG C, et al. Effect of ultrasonic and osmotic pretreatment on the quality and antioxidant activity of dried strawberry[J]. Modern Food Technology,2018,34(12):196−203. [13] 王晓燕. 真空微波干燥对胡萝卜和南瓜果胶特性及类胡萝卜素生物利用率的影响[D]. 南京: 南京农业大学, 2018. WANG X Y. Effect of vacuum microwave drying on the characteristics of carrot and pumpkin pectin and the bioavailability of carotenoids [D]. Nanjing: Nanjing Agricultural College, 2018.
[14] ZIELINSKA M, SADOWSKI P, BLASZCZAK W. Freezing thawing and microwave-assisted drying of blueberries (Vaccinium corymbose L.)[J]. LWT-Food Science and Technology,2015,62(1):555−563. doi: 10.1016/j.lwt.2014.08.002
[15] 刘胜辉, 臧小平. 高效液相色谱法测定水果中的抗坏血酸[J]. 生命科学仪器,2005,3(4):38−40. [LIU S H, ZANG X P. Determination of ascorbic acid in fruits by high performance liquid chromatography[J]. Life Science Instruments,2005,3(4):38−40. doi: 10.3969/j.issn.1671-7929.2005.04.009 [16] 刘霞, 江宁, 刘春泉, 等. 不同干燥方式对黑毛豆仁品质的影响[J]. 食品科学,2011,32(18):59−62. [LIU X, JIANG N, LIU C Q, et al. Effects of different drying methods on the quality of black soybean kernels[J]. Food Science,2011,32(18):59−62. [17] 汪小娉, 宋江峰, 李大婧, 等. 真空微波干燥对南瓜主要类胡萝卜素的影响[J]. 食品科学,2016,37(21):91−96. [WANG X P, SONG J F, LI D J, et al. Effect of vacuum microwave drying on main carotenoids of pumpkin[J]. Food Science,2016,37(21):91−96. doi: 10.7506/spkx1002-6630-201621016 [18] 李静, 聂继云, 毋永龙. Folin-Ciocalteus法测定马铃薯中的总多酚[J]. 中国马铃薯,2014,28(1):27−30. [LI J, NIE J Y, WU Y L. Determination of total polyphenols in potatoes by Folin-Ciocalteus method[J]. Chinese potato,2014,28(1):27−30. doi: 10.3969/j.issn.1672-3635.2014.01.008 [19] 孙明奇. 柑橘果皮类胡萝卜素提取鉴定及其在果皮成熟储藏中变化规律研究[D]. 武汉: 华中农业大学, 2007. SUN M Q. Study on the extraction and identification of citrusp eel carotenoids and their variation laws in the ripening storage[D]. Wuhan: Huazhong Agricultural University, 2007.
[20] ZEPKA L Q, MERCADANTE A Z. Degradation compounds of carotenoids formed during heating of a simulated cashew apple juice[J]. Food Chemistry,2009,117(1):28−34. doi: 10.1016/j.foodchem.2009.03.071
[21] 魏秋羽. 芋头脆片热风联合真空微波干燥研究研究[D]. 南京: 南京师范大学, 2016. WEI Q Y. Study on hot air combined with vacuum microwave drying of taro crisps[D]. Nanjing: Nanjing Normal University, 2016.
[22] 刘春菊, 王海鸥, 牛丽影, 等. 蔗糖调控对气流膨化黄桃片微观结构及品质的影响[J]. 食品科学,2020,41(11):113−120. [LIU C J, WANG H O, NIU L Y, et al. The effect of sucrose control on the microstructure and quality of air-expanded yellow peach slices[J]. Food Science,2020,41(11):113−120. doi: 10.7506/spkx1002-6630-20190419-254 [23] 李安琪, 黄晓君, 聂少平, 等. 动态高压微射流处理对红芸豆多糖基本结构特征、流变性质和固体形貌的影响[J]. 食品科学,2020,41(11):97−102. [LI A Q, HUANG X J, NIE S P, et al. Effect of dynamic high-pressure micro-jet treatment on the basic structural characteristics, rheological properties and solid morphology of red kidney bean polysaccharides[J]. Food Science,2020,41(11):97−102. doi: 10.7506/spkx1002-6630-20191021-220 [24] KAC̆URÁKOVÁ M, CAPEK P, SASINKOVÁ V, et al. FT-IR study of plant cell wall model compounds: pectic polysaccharides and hemicelluloses[J]. Carbohydrate Polymers,2000,43(2):195−203. doi: 10.1016/S0144-8617(00)00151-X
[25] 杨华, 杨性民, 孙金才. 不同干燥方式对西兰花蔬菜粉品质的影响[J]. 中国食品学报, 2013, 13(7): 152−158. YANG H, YANG X M, SUN J C. Effects of different drying methods on the quality of broccoli vegetable meal. Chinese Journal of Food Science, 2013, 13(7): 152−158.
[26] WANG R, ZHANG M, MUJUMDAR A S. Effect of osmotic dehydration on microwave freeze-drying characteristics and quality of potato chips[J]. Drying Technology,2010,28(6):798−806. doi: 10.1080/07373937.2010.482700
[27] 马有川, 毕金峰, 易建勇, 等. 预冻对苹果片真空冷冻干燥特性及品质的影响[J]. 农业工程学报,2020,36(18):241−250. [MA Y C, BI J F, YI J Y, et al. Effect of pre-freezing on the vacuum freeze-drying characteristics and quality of apple slices[J]. Journal of Agricultural Engineering,2020,36(18):241−250. doi: 10.11975/j.issn.1002-6819.2020.18.029 [28] 刘哲, 诸梦洁, 向露, 等. 利用糖渍液加工枇杷膏的工艺条件与品质[J]. 浙江农业学报,2020,32(3):510−517. [LIU Z, ZHU M J, XIANG L, et al. Processing conditions and quality of loquat paste using sugar-stained liquid[J]. Journal of Zhejiang Agriculture,2020,32(3):510−517. doi: 10.3969/j.issn.1004-1524.2020.03.17 [29] 王俊涛. 固体糖渍对芒果脱水传质和品质的影响研究[D] . 广西: 广西大学, 2020. WANG J T. Study on the effect of solid sugar on mango dehydration mass transfer and quality[D]. Guangxi: Guangxi University, 2020.
[30] KUCNER A, KLEWICKI R, SJKA M. The influence of selected osmotic dehydration and pretreatment parameters on dry matter and polyphenol content in highbush blueberry (Vaccinium corymbose L.) fruits[J]. Food and Bioprocess Technology,2013,6(8):2031−2047. doi: 10.1007/s11947-012-0997-0
[31] 马玉华, 马小卫, 武红霞, 等. 不同类型芒果果肉类胡萝卜素、香气和糖酸品质分析[J]. 热带作物学报,2015,36(12):2283−2290. [MA Y H, MA X W, WU H X, et al. Analysis of carotenoids, aroma, sugar and acid quality of different types of mango pulp[J]. Acta Tropical Crops,2015,36(12):2283−2290. doi: 10.3969/j.issn.1000-2561.2015.12.028 [32] 吴佳, 樊金玲, 朱文学, 等. 不同干燥方式对胡萝卜β-胡萝卜素含量的影响[J]. 农产品加工(学刊),2013(5):22−24. [WU J, FAN J L, ZHU W X, et al. The effect of different drying methods on the β-carotene content of carrots[J]. Agricultural Products Processing (Journal),2013(5):22−24. [33] MAURO M A, DE QUERIOZ TAVARES D, MENEGALLI F C. Behavior of plant tissue in osmotic solutions[J]. Journal of Food Engineering,2003,56(1):1−15. doi: 10.1016/S0260-8774(02)00107-3
-
期刊类型引用(2)
1. 张莉,刘禹,毛鹏煜,陈一萌,尹翔东,高礼红. 不同杧果品种对杧果酵素品质的影响. 食品研究与开发. 2024(09): 16-21 .  百度学术
百度学术
2. 吕莹,陈芹芹,李旋,胡佳星,毕金峰. 干燥对果蔬加工色泽影响的研究进展. 食品科学. 2023(13): 368-377 .  百度学术
百度学术
其他类型引用(3)














 下载:
下载:

 下载:
下载:
