The Optimization of the Preparation Process of Antioxidative Active Peptide from the Enzymatic Hydrolysate of Pacific Saury (Cololabis saira) by Response Surface Methodology
-
摘要: 采用酶解法从秋刀鱼肌肉中提取抗氧化活性肽,以水解度(DH)、TCA-可溶性肽含量、DPPH自由基清除率、Fe3+还原力、·OH清除率以及O2−·清除率为指标,从六种商业用酶中(中性蛋白酶、碱性蛋白酶、风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胰蛋白酶)筛选出最适蛋白酶。以料液比、酶添加量、酶解时间、温度、pH五个因素进行单因素实验,选取影响酶解显著的三个因素进行响应面优化。并对最优条件下的酶解液进行分子量分布的测定和游离氨基酸含量的测定。结果显示:最适蛋白酶为中性蛋白酶。三因素对酶解液抗氧化活性的影响大小为料液比>酶添加量>酶解时间,秋刀鱼抗氧化活性肽的最佳制备工艺为料液比为1:2.67(质量体积比,g/mL)、酶添加量为0.60%、酶解时间为4.04 h、温度为50 ℃、pH7.0,在此条件下制得的酶解液DPPH自由基清除率为92.33%,Fe3+还原力为0.711(20 mg/mL),与预测值无显著性差异(P>0.05)。可见,采用响应面法优化酶解工艺制备的秋刀鱼抗氧化活性肽具有较高的抗氧化活性。最佳酶解工艺条件下制得的酶解液中,分子量<3000 Da的组分占97.87%。共检测出16种游离氨基酸,其中必需氨基酸占总氨基酸含量的39.79%,抗氧化活性氨基酸占总氨基酸含量的37.01%。本文为秋刀鱼的高值化利用和多肽类功能性食品的开发提供了一定的参考。Abstract: The antioxidative peptides were prepared from the muscle of Pacific saury by enzymatic hydrolysis. Based on the degree of hydrolysis(DH), the content of TCA-soluble peptide, DPPH free radical scavenging rate, Fe3+ reducing power, ·OH radical scavenging rate and O2−· radical scavenging rate, the optimal protease was selected from six kinds of commercial enzyme(neutral protease, alkaline protease, flavour protease, papain, bromelain and trypsin). Single factor experiments were carried out with five factors: Solid-liquid ratio, the amount of enzyme, enzymatic hydrolysis time, temperature and pH, and three factors (solid-liquid ratio, the amount of enzyme and enzymatic hydrolysis time) were selected to optimize the response surface methodology (RSM). And the molecular weight distribution and free amino acid content of the hydrolysate were determined under the optimal conditions. The results showed that the optimal protease was neutral protease. The influence of three factors on the antioxidant activity of the enzymatic hydrolysate were the solid-liquid ratio> the amount of enzyme> enzymatic hydrolysis time. The optimal preparation processes of the antioxidative active peptide were determined as follows: the solid-liquid ratio was 1:2.67 (mass-volume ratio, g/mL), the amount of enzyme was 0.60%, enzymatic hydrolysis time was 4.04 h, temperature was 50 ℃, and pH7.0. Under these conditions, DPPH free radical scavenging rate and Fe3+ reducing power were 92.33% and 0.711 (20 mg/mL), respectively, which were no significant difference with the predicted value (P>0.05). It could be seen that the antioxidative peptide peptide optimized by response surface methodology had high antioxidant activity. Under the optimal conditions, 97.87% of the components with molecular weight less than 3000 Da were the main components of the hydrolysate. A total of 16 kinds of free amino acids were detected, among which essential amino acids accounted for 39.79% and antioxidant active amino acids accounted for 37.01% of the total amino acids. This study provided some reference for the utilization of high value and the development of peptides functional food of Pacific saury.
-
秋刀鱼(Cololabis saira)隶属于颌针鱼目(Beloniformes)、竹刀鱼科(Scomberesocidae)、秋刀鱼属(Cololabis Gill),是中上层鱼类,主要分布于北太平洋海域[1-2],中国则主要分布在山东东岸和黄海两个海域。近年来我国秋刀鱼年渔获量达到9万吨左右[3]。随着捕获量的增加,秋刀鱼的加工利用逐渐引起人们的关注。MORI等[4]首次从秋刀鱼鱼鳞中纯化鉴定出Ⅰ型胶原蛋白。陈建文等[5]发现秋刀鱼酶解产物中含有大量具有较高营养价值的氨基酸,具有良好的营养保健功能。赵谋明等[6]应用响应面法优化分析了酶解秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺条件。
海洋鱼蛋白源抗氧化活性肽可以通过不同的途径清除外源性和内源性自由基,且具有结构复杂、种类多、活性强和副作用少等优势。目前,抗氧化活性肽有多种制备方法[7-10]。蛋白酶水解法与其它方法相比,条件温和、成本较低、过程可控且副产物较少,目前被广泛应用[11-12]。从鱼皮明胶酶解液中分离纯化出的Gly-Pro-Y型和X-Hyp-Gly型肽段具有较高的抗氧化活性,且能够显著改善DSS诱导的小鼠结肠炎的临床症状[13]。从蓝鳍金枪鱼头酶解液中分离纯化出的三种肽段(Trp-Glu-Gly-Pro-Lys、Gly-Pro-Pro和Gly-Val-Pro-Leu-Thr),经测定具有较高的抗氧化活性[14]。
鉴于此,本文以秋刀鱼肌肉为原料,采用酶解法制备抗氧化活性肽。首先从六种商用蛋白酶中筛选出合适的蛋白酶,在此基础上,通过单因素实验和响应面试验方法对秋刀鱼酶解制备抗氧化活性肽的工艺进行优化,并对最优条件下制得的酶解液进行分子量分布的测定和游离氨基酸含量的测定。以期为秋刀鱼高值化利用和多肽类功能性食品的开发提供一定的依据。
1. 材料与方法
1.1 材料与仪器
冷冻秋刀鱼 购于山东青岛果蔬馨旗舰店,去头、去尾、去内脏、去骨,清洗干净后,绞成肉糜,备用;中性蛋白酶(20万 U/g)、碱性蛋白酶(20万 U/g) 合肥博美生物科技有限责任公司;风味蛋白酶(3万 U/g)、胰蛋白酶(25万 U/g)、木瓜蛋白酶(80万 U/g)、菠萝蛋白酶(60万 U/g)、维生素C(抗坏血酸)、1,10-菲罗啉 Solarbio(索莱宝)公司;1,1-二苯基-2-三硝基苯肼(DPPH) 福州飞净生物科技有限公司;七水合硫酸亚铁、焦性没食子酸 国药集团化学试剂有限公司;过氧化氢(30%) 天津市天力化学试剂有限公司;铁氰化钾 福晨(天津)化学试剂有限公司;三氯乙酸、FeCl3 上海阿拉丁生化科技股份有限公司。
TH2-82A双功能数显恒温振荡器 上海梅香仪器有限公司;UV-2550紫外-可见分光光度计、LC-20A型高效液相色谱仪 日本岛津公司;SORVALL Stratos型冷冻高速离心机 美国Thermo公司;MSl05DU型分析天平、PL602-L型电子天平 梅特勒-托利多仪器(上海)有限公司;FE-20FiveEasy Plus pH计 梅特勒-托利多仪器有限公司;JB-1A磁力搅拌器 上海仪电科学仪器股份有限公司;FreeZone2.5型真空冷冻干燥机 美国Labconco公司;L-8900型全自动氨基酸分析仪 HITACHI公司。
1.2 实验方法
1.2.1 秋刀鱼基本成分的测定
水分的测定:参考GB5009.3-2016《食品安全国家标准 食品中水分的测定》。
灰分的测定:参考GB5009.4-2016《食品安全国家标准 食品中灰分的测定》。
蛋白质的测定:参考GB5009.5-2016《食品安全国家标准 食品中蛋白质的测定》。
脂肪的测定:参考GB5009.6-2016《食品安全国家标准 食品中脂肪的测定》。
1.2.2 蛋白酶的筛选
秋刀鱼酶解液工艺制作流程:秋刀鱼肉糜→加去离子水→调节至最适pH→酶解→灭酶→离心→抽滤→酶解液→冷冻干燥→冻干粉。
选择六种酶制剂对秋刀鱼肉糜进行酶解,酶解条件见表1。酶解结束后,于100 ℃水浴加热20 min灭酶,然后在4 ℃,8000 r/min条件下离心10 min,取上清液抽滤去除悬浮物及残渣,得到酶解液。综合考察水解度(DH)、TCA-可溶性肽含量以及抗氧化活性等指标,筛选出合适的蛋白酶。
表 1 蛋白酶的酶解条件Table 1. Enzymatic hydrolysis conditions of proteases名称 料液比(g/mL) 酶添加量(%) 酶解时间(h) 温度(℃) pH 中性蛋白酶 1:3 0.4 4 50 7.0 碱性蛋白酶 1:3 0.4 4 50 9.0 风味蛋白酶 1:3 0.4 4 50 7.0 胰蛋白酶 1:3 0.4 4 40 8.0 木瓜蛋白酶 1:3 0.4 4 40 6.0 菠萝蛋白酶 1:3 0.4 4 40 6.5 1.2.3 单因素实验
固定因素水平为料液比为1:3 g/mL,酶添加量为0.4%,酶解时间为4 h,温度为50 ℃,pH7.0。通过测定酶解液的DH、DPPH自由基清除率和Fe3+还原力来研究料液比(1:1、1:2、1:3、1:4、1:5 g/mL)、酶添加量(0.2%、0.4%、0.6%、0.8%、1.0%)、酶解时间(2、3、4、5、6 h)、温度(40、45、50、55、60 ℃)和pH(6.0、6.5、7.0、7.5、8.0)对秋刀鱼酶解工艺的影响。
1.2.4 响应面试验
在单因素实验的基础上,以料液比、酶添加量、酶解时间三个因素进行响应面试验设计,以DPPH自由基清除率和Fe3+还原力为指标,优化秋刀鱼制备抗氧化活性肽的最佳酶解工艺。响应面试验因素水平表见表2。
表 2 响应面试验因素水平设计Table 2. Factors and levels of response surface experiment因素 水平 −1 0 1 A料液比(g/mL) 1:2 1:3 1:4 B酶添加量(%) 0.4 0.6 0.8 C 酶解时间(h) 3 4 5 1.2.5 DH的测定
秋刀鱼酶解液中氨基酸态氮含量的测定参考GB5009.235-2016《食品安全国家标准 食品中氨基酸态氮的测定》,总氮含量的测定参考GB5009.5-2016《食品安全国家标准 食品中蛋白质的测定》,根据式(1)计算DH。
DH(%)=氨基酸态氮含量总氮含量×100 (1) 1.2.6 TCA-可溶性肽含量的测定
参考朱均旺等[15]的研究方法并稍作修改,吸取5 mL秋刀鱼酶解液,加入等体积15% TCA,混合均匀,于室温静置30 min后离心(4 ℃,5000 r/min,15 min),吸取1 mL上清液,加入3 mL双缩脲,室温下静置10 min后,在540 nm下测量样品吸光值,按照回归方程y=0.052x+0.023(R2=0.9924)计算TCA-可溶性肽含量。
1.2.7 DPPH自由基清除率的测定
参考XIE等[16]的研究方法并稍作修改,准确称取7.92 mg DPPH,使用95%乙醇定容至100 mL;取2 mL秋刀鱼酶解液(20 mg/mL),加入2 mL DPPH,在517 nm下测量吸光值A1;对照组1取2 mL秋刀鱼酶解液,加入2 mL 95%乙醇,在517 nm下测量吸光值A2;对照组2取2 mL DPPH,加入2 mL蒸馏水,在517 nm下测量吸光值A3;调零组取2 mL蒸馏水,加入2 mL 95%乙醇;室温下避光静置30 min,按式(2)计算样品的清除率。
清除率(%)=[1−(A1−A2A3)]×100 (2) 1.2.8 Fe3+还原力的测定
参考LI等[17]的研究方法并稍作修改,将2 mL磷酸盐缓冲液(0.2 mol/L pH6.6)、2 mL 1%铁氰化钾以及2 mL秋刀鱼酶解液(20 mg/mL)混合均匀,置于50 ℃水浴中平衡20 min,加入2 mL 10% TCA,4 ℃、3000 r/min,离心10 min,取2 mL上清液,加入2 mL蒸馏水和0.4 mL 0.1%三氯化铁,10 min后在700 nm下测量吸光值。
1.2.9 ·OH清除率的测定
参考陈秋娟等[18]的研究方法并稍作修改,将1 mL 1,10-菲罗啉溶液(2.5 mmol/L)、1 mL PBS(20 mmol/L,pH7.4)与1 mL蒸馏水,混合均匀,加入1 mL FeSO4(2.5 mmol/L)与1 mL H2O2(20 mmol/L),37 ℃水浴平衡90 min,在536 nm下测量吸光值,记为A1;空白组使用1 mL蒸馏水代替H2O2,记为A0;样品组使用1 mL样品溶液(20 mg/mL)代替蒸馏水,记为A2;按式(3)计算样品的清除率。
清除率(%)=A2−A1A0−A1×100 (3) 1.2.10 O2−·清除率的测定
参考宋春艳等[19]的研究方法并稍作修改,取2 mL Tris-HCl(150 mmol/L,pH8.0)与0.6 mL样品溶液(20 mg/mL)混合均匀,25 ℃预热20 min,加入0.4 mL焦性没食子酸(1.2 mmol/L),25 ℃水浴平衡20 min,在325 nm下测量吸光值,记为A11;对照组1使用等量蒸馏水代替焦性没食子酸,记为A10;对照组2使用等量蒸馏水代替样品,记为A01;空白组分别使用等量蒸馏水代替样品和焦性没食子酸,记为A00;按式4计算样品的清除率。
清除率(%)=A11−A10A01−A00×100 (4) 1.2.11 秋刀鱼酶解液分子量分布的测定
参考GB31645-2018《食品安全国家标准 胶原蛋白肽》。准确称取1.00 g酶解液冻干粉,用1 mL流动相溶解,高速离心,取上清液进样检测。检测条件为色谱柱型号:Shodex Asahi pak GS-320 HQ No.R2870036,流动相:乙腈:水:三氟乙酸(40:60:0.05),流速:0.5 mL/min,柱温箱:30 ℃,检测波长:220 nm,各标准品分子量:MW12500、MW6500、MW1450、MW451、MW189。
1.2.12 秋刀鱼酶解液游离氨基酸含量的测定
参考陈剑岚[20]的研究方法并稍作修改。准确称取2.00 g秋刀鱼酶解液冻干粉,加入15 mL 15%的TCA,混合均匀,静置2 h,在4 ℃、10000 r/min条件下离心15 min,取上清液5 mL,用3 mol/L NaOH将pH调为2.0,定容至10 mL,经0.22 µm微孔滤膜过滤后上机检测。
氨基酸自动分析仪条件:色谱柱(4.6 mm I.D.×60 mm);分离树脂:阳离子交换树脂;柱温:57 ℃;检测波长:570 nm;管路一缓冲液流速:0.4 mL/min;管路二缓冲液流速:0.35 mL/min;反应液:茚三酮;进样量:20 µL。
1.3 数据处理
每组数据平行测定3次,采用Excel 2016和IBM SPSS Statistics 22.0进行处理,结果采用均值±标准差形式,均值比较采用ANOVA中的Duncan法进行比较,取95%置信度(P<0.05)。采用Origin 2018软件进行数据绘图。Box-Behnken试验设计和响应面方差分析采用软件Design-Expert 8.0.6。
2. 结果与分析
2.1 秋刀鱼的基本组成成分
由表3可知,秋刀鱼肌肉中水分含量约为60.32%,灰分含量约为1.02%,蛋白质含量约为18.12%,脂肪含量约为20.48%。由此可见,秋刀鱼是一种高蛋白质、高脂肪含量的鱼类。这与叶旭昌等[21]的研究结果相似但稍有差异,可能是由于秋刀鱼的生长环境和年龄的差异所致。
表 3 秋刀鱼的基本组成成分Table 3. The basic components of Pacific saury组成成分 水分(%) 灰分(%) 蛋白质(%) 脂肪(%) 含量 60.32±0.66 1.02±0.04 18.12±0.84 20.48±0.32 2.2 蛋白酶的筛选
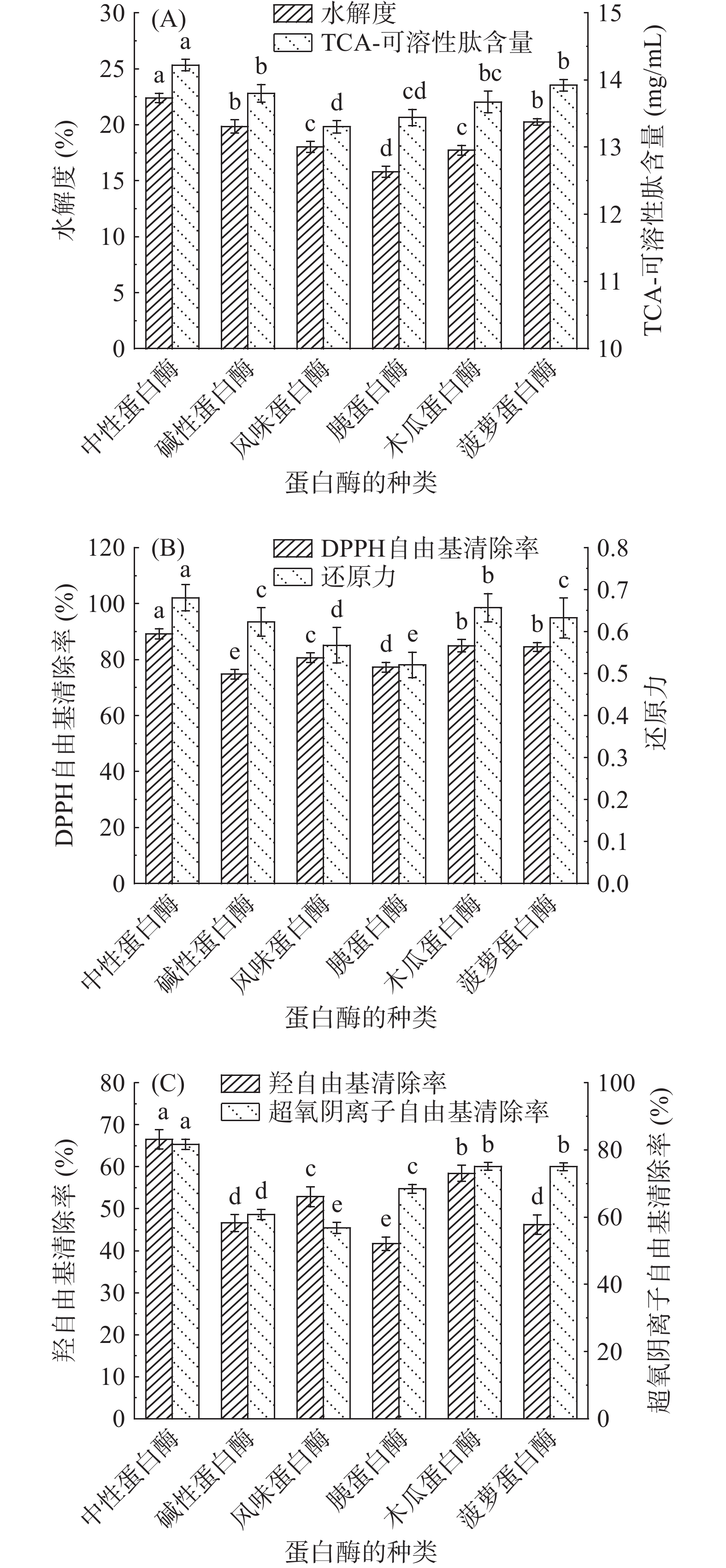
酶解可以将蛋白质水解成小分子物质,DH是衡量酶解效果的重要指标之一[22]。由图1(A)可知,中性蛋白酶处理组DH达22.4%,显著高于其它处理组(P<0.05),而胰蛋白酶处理组DH最低,为15.8%。这是因为中性蛋白酶酶切位点较为广泛,能够酶解R1为Ala、Leu、Val、Tyr、Phe和Trp残基的肽键[23],而胰蛋白酶是一种Ser内切酶,只能酶解R1为Arg或Lys残基的肽键[24]。
三氯乙酸(TCA)能够溶解小分子蛋白质或肽段,大分子蛋白质或肽段会在TCA的作用下变成白色沉淀,TCA-可溶性肽含量是表征酶解效果的重要指标[25]。由图1(A)可知,中性蛋白酶处理组TCA-可溶性肽含量达14.22 mg/mL,显著高于其它处理组(P<0.05),风味蛋白酶处理组TCA-可溶性肽含量最低,为13.3 mg/mL。这是因为蛋白质经蛋白酶水解后,以小分子肽或者游离氨基酸的形式存在,因此,DH较高的组分,蛋白质水解较为充分,其TCA-可溶性肽含量也较高[26]。
DPPH自由基清除率是一种常用的测定化合物和食品抗氧化能力的方法。由图1(B)可知,中性蛋白酶处理组DPPH自由基清除率显著高于其它处理组(P<0.05),约为89.2%,碱性蛋白酶处理组DPPH自由基清除率最低,约为74.7%。这与夏吉安等[27]的研究结果相似。
还原力与抗氧化活性之间存在一定的联系,抗氧化剂通过还原作用清除自由基,因此,还原力越强,抗氧化活性越强[28]。由图1(B)可知,中性蛋白酶处理组的Fe3+还原力显著高于其它处理组(P<0.05),为0.68。胰蛋白酶处理组的Fe3+还原力最低,为0.52。这与宁诗文等[29]的研究结果相似。
过量的·OH会对人体产生巨大的危害,它通过电子的转移、夺取氢原子等方式对蛋白质及脂质进行氧化,因此,·OH清除率是评价样品抗氧化强弱的重要指标之一[30]。由图1(C)可知,中性蛋白酶处理组的·OH清除率显著高于其它处理组(P<0.05),为66.5%。胰蛋白酶处理组·OH清除率最低,为41.7%。这与王志等[31]的研究结果相似。
O2−·可导致细胞膜受损,从而引起一系列的有害反应。但在人体中,O2−·在超氧化物歧化酶和过氧化氢酶的催化作用下会生成氧气和水,从而降低其对生物体的损害[32]。由图1(C)可知,中性蛋白酶处理组O2−·清除率为81.7%,显著高于其它处理组(P<0.05)。这与黄典等[33]的研究结果相似。
2.3 单因素实验结果
2.3.1 料液比对秋刀鱼酶解液DH和抗氧化能力的影响
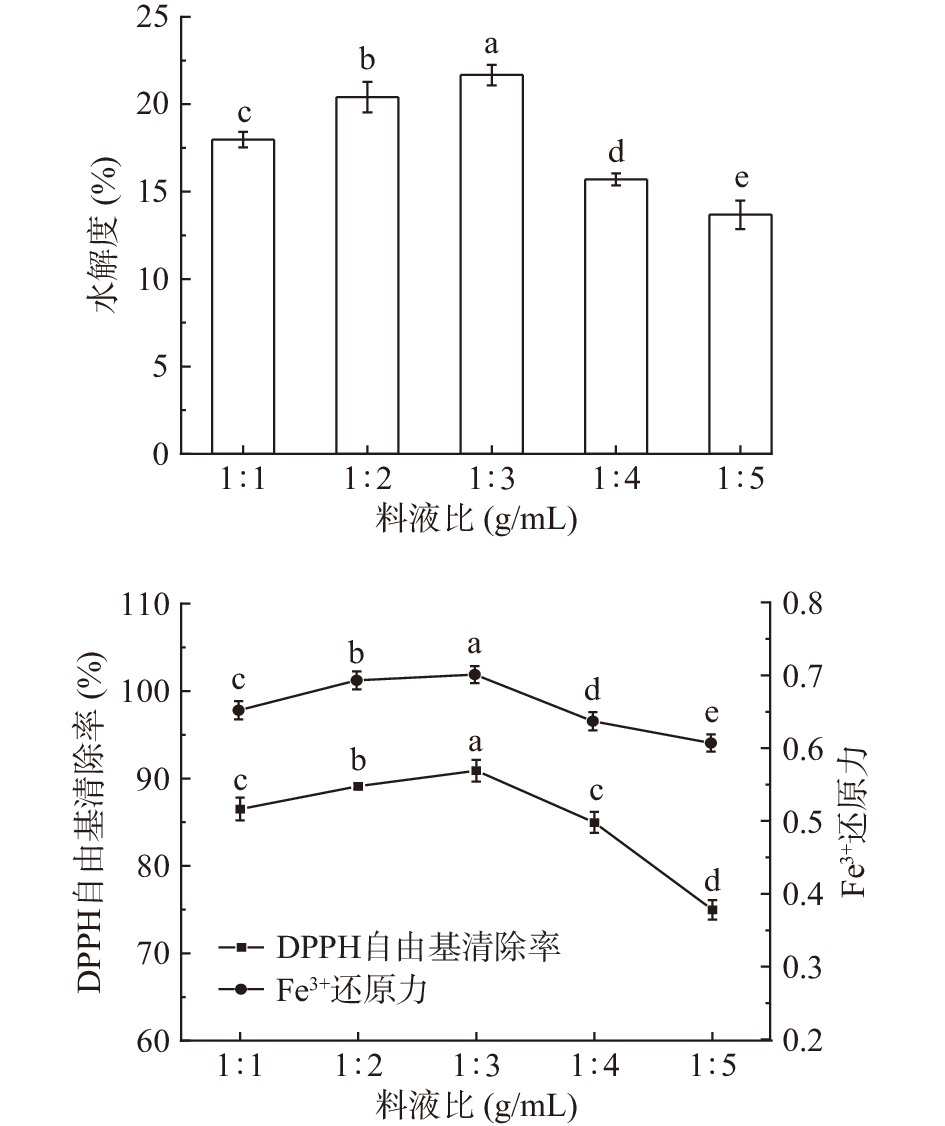
料液比对秋刀鱼酶解液DH和抗氧化能力的影响结果如图2所示。由图2可知,随着料液比的增大,秋刀鱼酶解液DH、DPPH自由基清除率和Fe3+还原力呈先升高后下降的趋势,这是因为随着料液比的增大,底物与酶能够充分接触,从而提高酶解效率。但当反应体系中溶剂含量过高时,底物会被稀释,增大了酶与底物的接触难度,导致体系酶解不完全。综合酶解液的DH和抗氧化能力,选取料液比为1:3进行后续实验。
2.3.2 酶添加量对秋刀鱼酶解液DH和抗氧化能力的影响
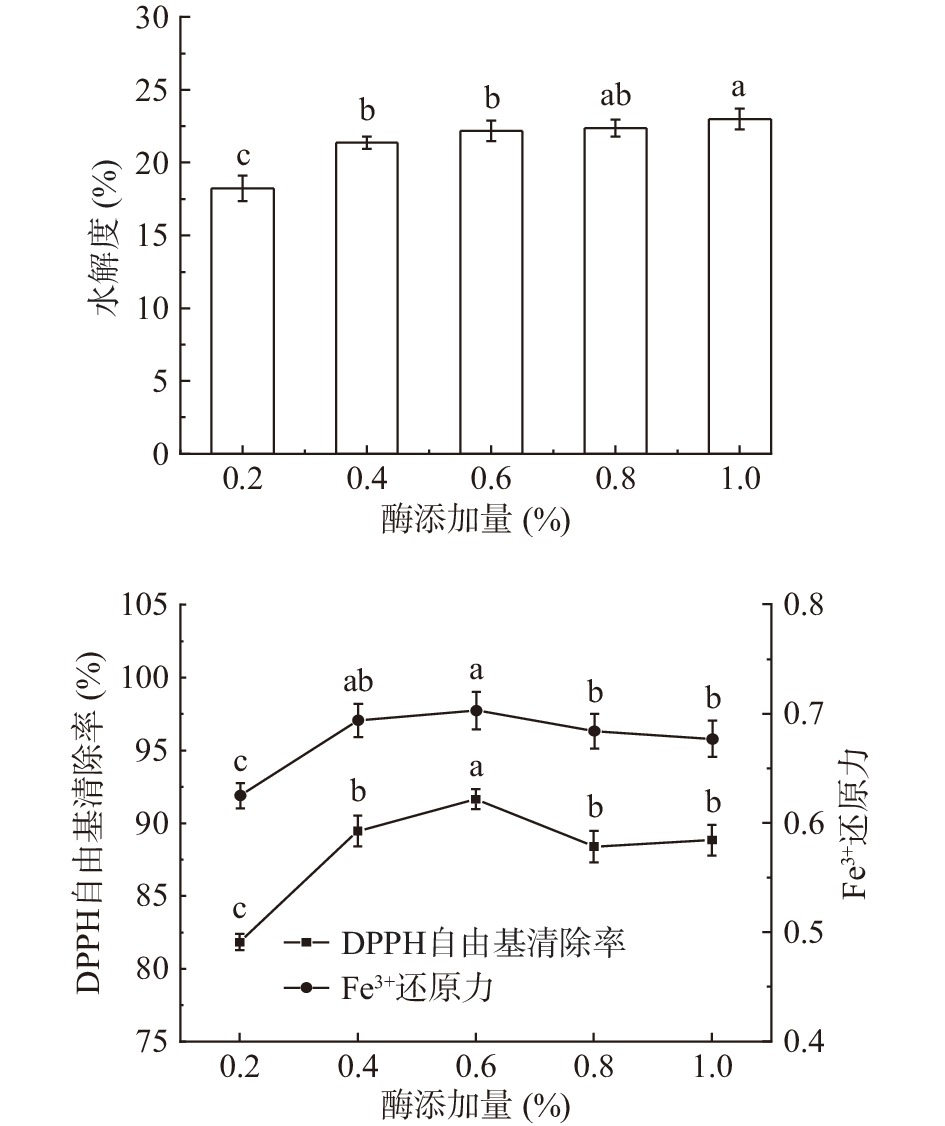
酶添加量对秋刀鱼酶解液DH和抗氧化能力的影响结果如图3所示。由图3可知,随着酶添加量的增加,秋刀鱼酶解液DH呈逐渐上升趋势。酶解液抗氧化能力随着酶添加量的增加先升高后下降。这是因为随着酶添加量的增加,酶与底物接触更加充分,但酶添加量过多时,会使底物发生过度水解,导致酶解液中抗氧化活性肽的降解。综合酶解液的DH和抗氧化能力,选取酶添加量为0.6%进行后续实验。
2.3.3 酶解时间对秋刀鱼酶解液DH和抗氧化能力的影响
酶解时间对秋刀鱼酶解液DH和抗氧化能力的影响结果如图4所示。由图4可知,随着酶解时间的增加,秋刀鱼酶解液DH逐渐升高,DPPH自由基清除率和Fe3+还原力呈现出先升高后降低的趋势。这是因为,随着酶解时间的增加,酶解程度逐渐加深,但酶解时间过长,会导致底物过度水解,造成抗氧化活性肽的过度降解和低活性氨基酸的生成[34]。综合酶解液的DH和抗氧化能力,选取酶解时间为4 h进行后续实验。
2.3.4 温度对秋刀鱼酶解液DH和抗氧化能力的影响
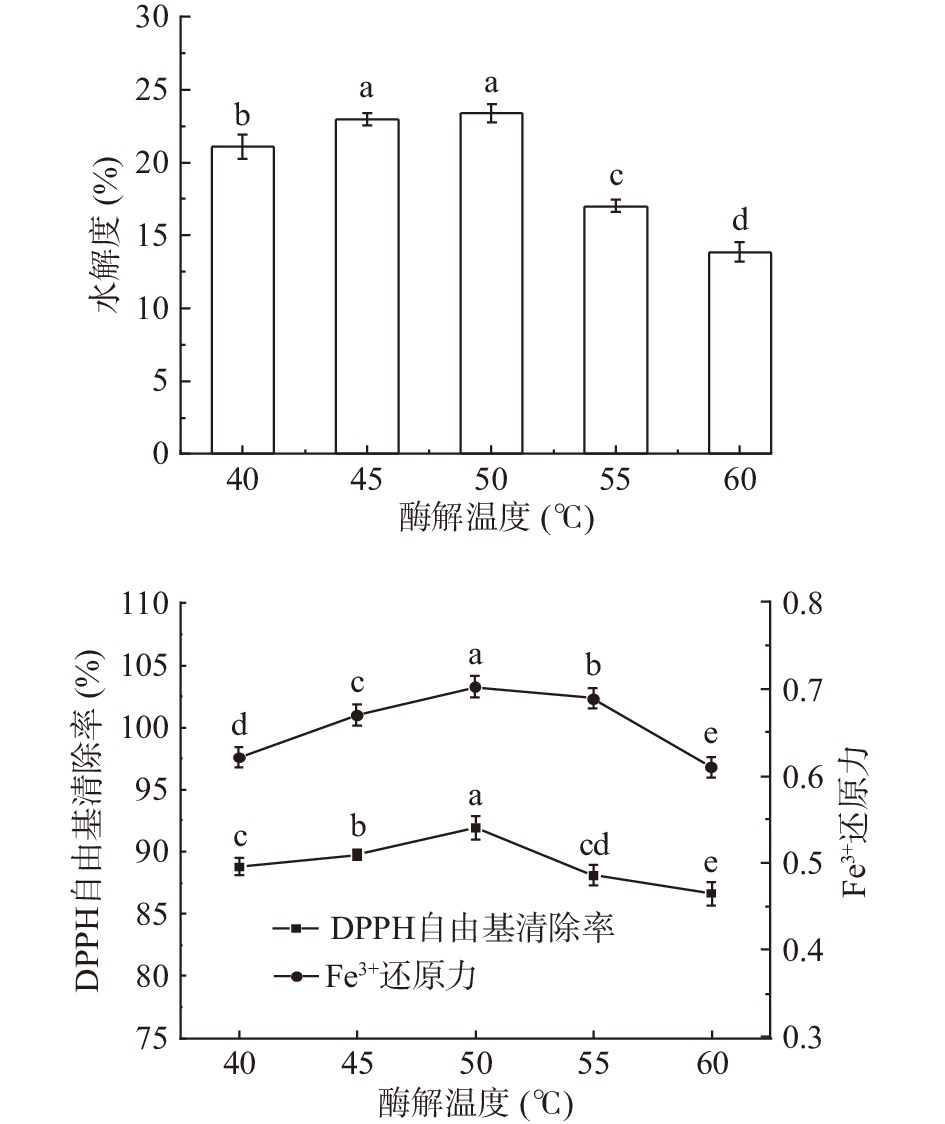
温度对秋刀鱼酶解液DH和抗氧化能力的影响结果如图5所示。由图5可知,随着温度的升高,秋刀鱼酶解液DH和抗氧化能力呈现先升高后降低的趋势。这是因为在一定范围内,随着温度的升高,酶活力开始提高,有利于酶解反应的进行,但温度过高会降低蛋白酶活力。综合酶解液的DH和抗氧化能力,选取温度为50 ℃进行后续实验。
2.3.5 pH对秋刀鱼酶解液DH和抗氧化能力的影响
pH对秋刀鱼酶解液DH和抗氧化能力的影响结果如图6所示。由图6可知,随着pH的增加,秋刀鱼酶解液DH和抗氧化能力呈现先升高后下降的趋势,这是因为pH过高或过低都会破坏蛋白酶活性中心或空间结构[35]。综合酶解液的DH和抗氧化能力,选取pH7.0进行后续实验。
2.4 响应面试验结果
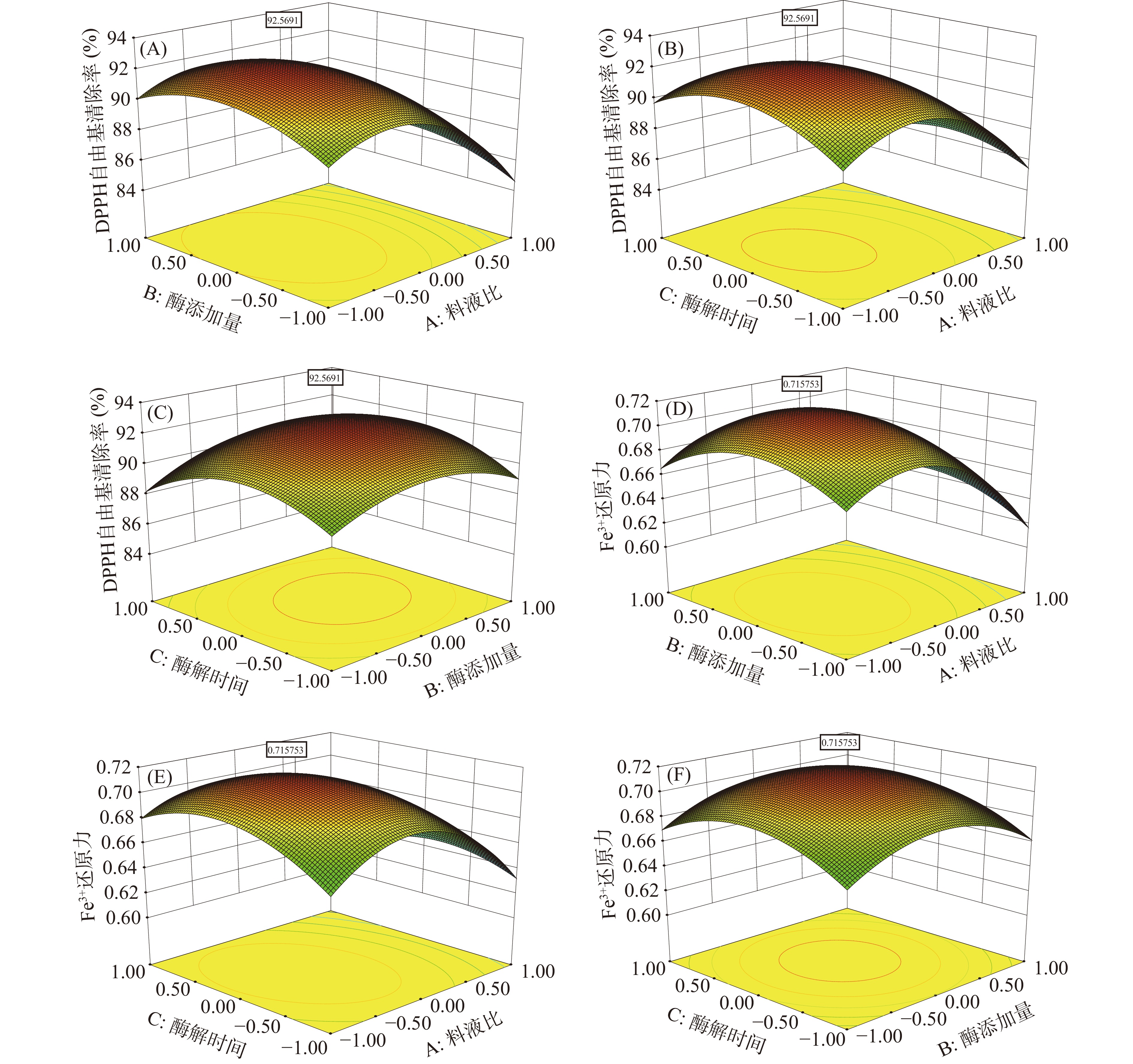
选取料液比(A)、酶添加量(B)、酶解时间(C)3个因素,以DPPH自由基清除率(R1)和Fe3+还原力(R2)为响应值,进行响应面优化试验,分析酶解秋刀鱼制备抗氧化活性肽的最佳工艺条件。试验设计结果见表4。
表 4 响应面分析方案及试验结果Table 4. Program and experimental results of response surface methodology序号 A B C R1DPPH自由基
清除率(%)R2Fe3+
还原力1 0 0 0 92.23 0.709 2 −1 0 1 90.22 0.688 3 1 − 1 0 84.62 0.638 4 0 0 0 92.32 0.721 5 −1 −1 0 88.52 0.666 6 −1 0 −1 89.15 0.662 7 1 0 − 1 84.98 0.625 8 0 −1 −1 89.28 0.67 9 1 0 1 83.88 0.615 10 0 1 1 88.62 0.658 11 0 0 0 90.69 0.711 12 0 1 −1 88.62 0.664 13 0 −1 1 87.86 0.662 14 0 0 0 92.58 0.718 15 0 0 0 91.88 0.703 16 1 1 0 86.15 0.632 17 −1 1 0 90.16 0.665 运用 Design-Expert.V8.0.6软件,对响应值进行回归拟合,得到DPPH自由基清除率(R1)和Fe3+还原力(R2)的回归方程:
R1=92.14−2.3A+0.41B−0.18C−0.028AB−0.54AC+0.36BC−3.16A2−1.62B2−1.92C2
R2=0.71−0.024A+3.75×10−4B+2.5×10−4C+3.75×10−3AB−9×10−3AC+5×10−4BC−0.042A2−0.026B2−0.023C2
由表5可知,模型F值分别为18.35和29.43,“Prob>F”值均小于0.05,表明该二次方程模型显著。失拟项P>0.05,不显著。决定系数R2分别为0.9593和0.9743,说明预测值与实测值之间具有较高的相关性。RAdj2=0.9071和0.9411,说明所选用的二次回归模型是适当的。因此可用该回归方程对试验结果进行预测分析。从表5可以看出,各个因素对DPPH自由基清除率和Fe3+还原力的影响不是简单的线性关系。由F值可知,三个因素对实验结果影响大小依次为料液比>酶添加量>酶解时间。响应面可以直观地反映出各因素之间的交互作用对响应值的影响,曲面的坡度则表示两因素之间交互影响的大小[36]。为了更加直观的表现2个因素同时对DPPH自由基清除率和Fe3+还原力的影响,绘制响应面图(如图7)。由图7可以看出,料液比和酶添加量、料液比和酶解时间、酶添加量和酶解时间的交互作用不显著。经Design Expert 8.0.6软件分析该模型得到的最佳酶解条件为料液比1:2.67、酶添加量0.60%、酶解时间4.04 h、温度50 ℃、pH7.0。在此条件下,计算出酶解液DPPH自由基清除率为92.57%、Fe3+还原力为0.716。
表 5 DPPH自由基清除率和Fe3+还原力的响应面二次模型方差分析Table 5. Analysis of variance for the response surface quadratic model for DPPH free radical scavenging rates and Fe3+ reducing powers响应值 来源 平方和 自由度 均方 F值 P值 显著性 DPPH
自由基
清除率模型 121.47 9 13.5 18.35 0.0005 ** A 42.41 1 42.41 57.66 0.0001 ** B 1.34 1 1.34 1.82 0.2196 C 0.26 1 0.26 0.36 0.5688 AB 3.025×10−3 1 3.025×10−3 4.113 0.9507 AC 1.18 1 1.18 1.6 0.2463 BC 0.5 1 0.5 0.69 0.4351 A2 41.98 1 41.98 57.07 0.0001 ** B2 11.05 1 11.05 15.02 0.0061 ** C2 15.60 1 15.60 21.21 0.0025 ** 残差 5.15 7 0.74 失拟检验 2.26 3 0.75 1.05 0.4632 纯误差 2.88 4 0.72 总误差 126.61 16 Fe3+
还原力模型 0.019 9 2.064×10−3 29.43 <0.0001 ** A 4.56×10−3 1 4.56×10−3 65.02 <0.0001 ** B 1.125×10−6 1 1.125×10−6 0.016 0.9028 C 5×10−7 1 5×10−7 7.129×10−3 0.9351 AB 5.625×10−5 1 5.625×10−5 0.8 0.4002 AC 3.24×10−4 1 3.24×10−4 4.62 0.0687 BC 1×10−6 1 1×10−6 0.014 0.9083 A2 7.278×10−3 1 7.278×10−3 103.77 <0.0001 ** B2 2.754×10−3 1 2.754×10−3 39.27 0.0004 ** C2 2.291×10−3 1 2.291×10−3 32.66 0.0007 ** 残差 4.91×10−4 7 7.014×10−5 失拟检验 2.838×10−4 3 9.458×10−5 1.83 0.2825 纯误差 2.072×10−4 4 5.18×10−5 总误差 0.019 16 注:**表示差异极显著P<0.01。 使用由Design Expert 8.0.6软件计算得到的最优酶解条件对秋刀鱼进行酶解,从而验证响应面法的可行性。工艺参数为:料液比1:2.67、酶添加量0.6%、酶解时间4.04 h、温度50 ℃、pH7.0。在该条件下得到的酶解液的DPPH自由基清除率为(92.33%±0.68%),Fe3+还原力为0.711±0.012,与预测值无显著性差异(P>0.05)。
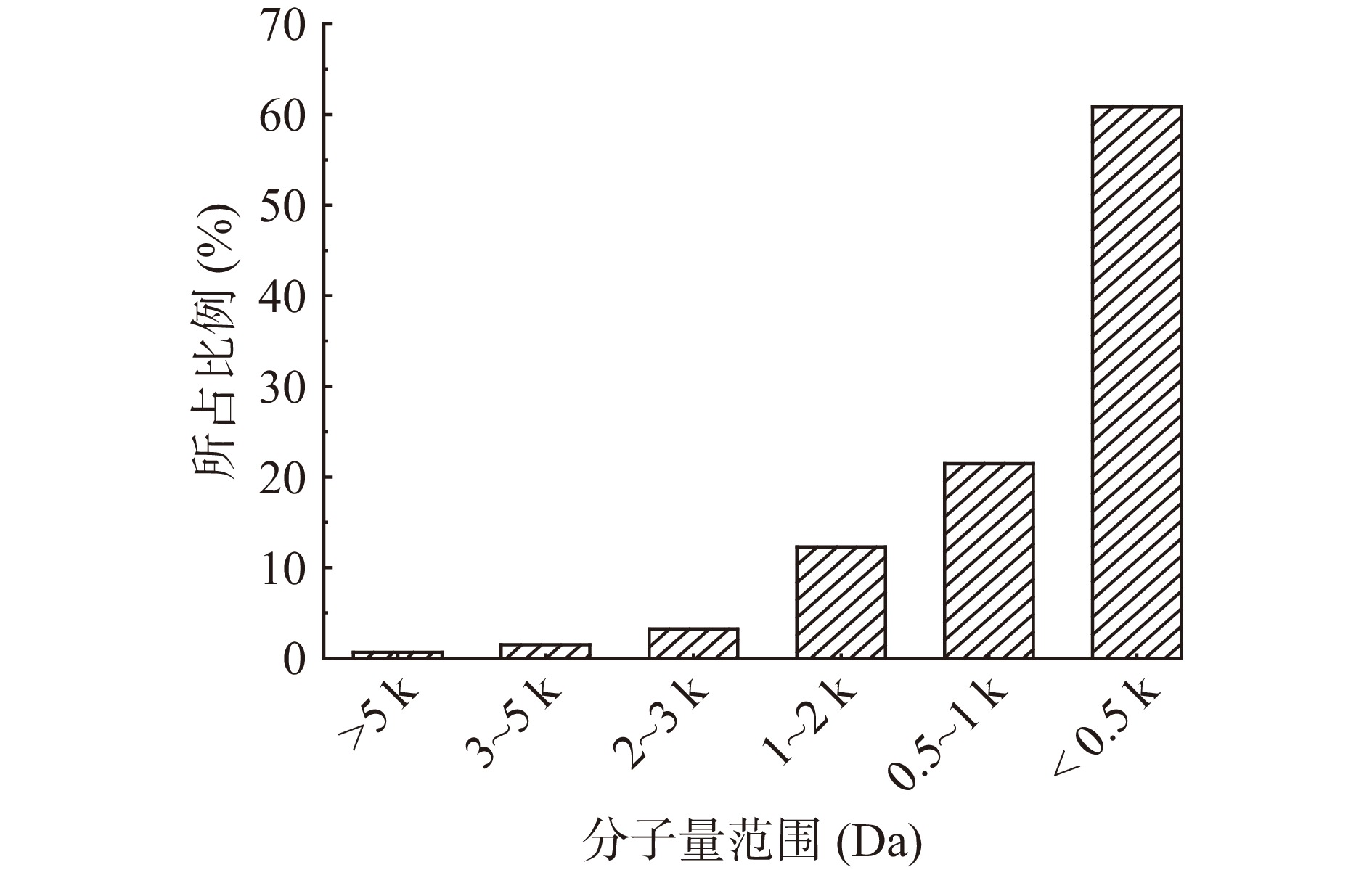
2.5 秋刀鱼酶解液分子量的分布情况
图8为最佳酶解工艺条件下制得的秋刀鱼酶解液分子量的分布情况。由图8可知,酶解液的分子量在<3000 Da范围内的组分占97.87%,这一组分的肽段对酶解液的营养价值和生物活性起着重要的作用[37]。
2.6 秋刀鱼酶解液中游离氨基酸的含量
表6为秋刀鱼酶解液中游离氨基酸的含量。由表6可知,酶解液中共检测到16种游离氨基酸,其中,必需氨基酸含量占39.79%,支链氨基酸占17.21%,抗氧化活性氨基酸占37.01%。组氨酸含量最高,为322.63 mg/100 mL。组氨酸对于婴儿来说属于必需氨基酸,对婴儿的生长发育至关重要。此外,组氨酸能够促进氨基酸与血红蛋白的结合,使肾原性贫血减轻,所以组氨酸也是尿毒症患者的必需氨基酸。可见,秋刀鱼酶解液具有较高的营养保健功能。
表 6 秋刀鱼酶解液中游离氨基酸含量Table 6. Free amino acid contents of Pacific saury hydrolysate氨基酸 氨基酸含量(mg/100 mL) 氨基酸 氨基酸含量(mg/100 mL) 天冬氨酸 55.14±0.19 甲硫氨酸 79.28±0.18 苏氨酸 40.01±0.06 异亮氨酸 167.81±0.05 丝氨酸 28.69±0.02 亮氨酸 44.93±0.02 谷氨酸 78.63±0.14 苯丙氨酸 67.41±0.16 甘氨酸 26.91±0.09 赖氨酸 110.51±0.07 丙氨酸 106.94±0.13 组氨酸 322.63±0.29 半胱氨酸 85.22±0.16 精氨酸 86.24±0.07 缬氨酸 13.79±0.04 脯氨酸 2.26±0.01 氨基酸总量 1316.38 必需氨基酸 523.73(39.79%) 支链氨基酸 226.53(17.21%) 抗氧化活性氨基酸* 487.13(37.01%) 注:*抗氧化活性氨基酸:组氨酸、酪氨酸、半胱氨酸、甲硫氨酸等[38]。 3. 结论
综合DH、TCA-可溶性肽含量和抗氧化活性等指标,从六种商用蛋白酶中筛选出中性蛋白酶作为秋刀鱼酶解用酶。经单因素实验以及响应面分析方法对酶解秋刀鱼制备抗氧化活性肽的工艺条件进行优化,得到最佳工艺参数:料液比为1:2.67、酶添加量为0.60%、酶解时间为4.04 h、温度为50 ℃、pH7.0。在此条件下,酶解液的DPPH自由基清除率为92.33%,Fe3+还原力为0.711(20 mg/mL)各因素对酶解液的抗氧化活性影响大小为料液比>酶添加量>酶解时间。通过测定分子量分布和游离氨基酸含量,发现最优条件下酶解液分子量<3000 Da的组分占97.87%,是酶解液的主要成分。共检测出16种游离氨基酸,其中必需氨基酸占总氨基酸含量的39.79%,抗氧化活性氨基酸占总氨基酸含量的37.01%。本研究为秋刀鱼的高值化利用和多肽类功能性食品的研发提供了参考依据。下一步将会对秋刀鱼酶解液进行分离纯化,并对抗氧化活性较强的组分进行质谱鉴定,以期得到全新的抗氧化活性肽段,丰富抗氧化活性肽的种类。
-
表 1 蛋白酶的酶解条件
Table 1 Enzymatic hydrolysis conditions of proteases
名称 料液比(g/mL) 酶添加量(%) 酶解时间(h) 温度(℃) pH 中性蛋白酶 1:3 0.4 4 50 7.0 碱性蛋白酶 1:3 0.4 4 50 9.0 风味蛋白酶 1:3 0.4 4 50 7.0 胰蛋白酶 1:3 0.4 4 40 8.0 木瓜蛋白酶 1:3 0.4 4 40 6.0 菠萝蛋白酶 1:3 0.4 4 40 6.5 表 2 响应面试验因素水平设计
Table 2 Factors and levels of response surface experiment
因素 水平 −1 0 1 A料液比(g/mL) 1:2 1:3 1:4 B酶添加量(%) 0.4 0.6 0.8 C 酶解时间(h) 3 4 5 表 3 秋刀鱼的基本组成成分
Table 3 The basic components of Pacific saury
组成成分 水分(%) 灰分(%) 蛋白质(%) 脂肪(%) 含量 60.32±0.66 1.02±0.04 18.12±0.84 20.48±0.32 表 4 响应面分析方案及试验结果
Table 4 Program and experimental results of response surface methodology
序号 A B C R1DPPH自由基
清除率(%)R2Fe3+
还原力1 0 0 0 92.23 0.709 2 −1 0 1 90.22 0.688 3 1 − 1 0 84.62 0.638 4 0 0 0 92.32 0.721 5 −1 −1 0 88.52 0.666 6 −1 0 −1 89.15 0.662 7 1 0 − 1 84.98 0.625 8 0 −1 −1 89.28 0.67 9 1 0 1 83.88 0.615 10 0 1 1 88.62 0.658 11 0 0 0 90.69 0.711 12 0 1 −1 88.62 0.664 13 0 −1 1 87.86 0.662 14 0 0 0 92.58 0.718 15 0 0 0 91.88 0.703 16 1 1 0 86.15 0.632 17 −1 1 0 90.16 0.665 表 5 DPPH自由基清除率和Fe3+还原力的响应面二次模型方差分析
Table 5 Analysis of variance for the response surface quadratic model for DPPH free radical scavenging rates and Fe3+ reducing powers
响应值 来源 平方和 自由度 均方 F值 P值 显著性 DPPH
自由基
清除率模型 121.47 9 13.5 18.35 0.0005 ** A 42.41 1 42.41 57.66 0.0001 ** B 1.34 1 1.34 1.82 0.2196 C 0.26 1 0.26 0.36 0.5688 AB 3.025×10−3 1 3.025×10−3 4.113 0.9507 AC 1.18 1 1.18 1.6 0.2463 BC 0.5 1 0.5 0.69 0.4351 A2 41.98 1 41.98 57.07 0.0001 ** B2 11.05 1 11.05 15.02 0.0061 ** C2 15.60 1 15.60 21.21 0.0025 ** 残差 5.15 7 0.74 失拟检验 2.26 3 0.75 1.05 0.4632 纯误差 2.88 4 0.72 总误差 126.61 16 Fe3+
还原力模型 0.019 9 2.064×10−3 29.43 <0.0001 ** A 4.56×10−3 1 4.56×10−3 65.02 <0.0001 ** B 1.125×10−6 1 1.125×10−6 0.016 0.9028 C 5×10−7 1 5×10−7 7.129×10−3 0.9351 AB 5.625×10−5 1 5.625×10−5 0.8 0.4002 AC 3.24×10−4 1 3.24×10−4 4.62 0.0687 BC 1×10−6 1 1×10−6 0.014 0.9083 A2 7.278×10−3 1 7.278×10−3 103.77 <0.0001 ** B2 2.754×10−3 1 2.754×10−3 39.27 0.0004 ** C2 2.291×10−3 1 2.291×10−3 32.66 0.0007 ** 残差 4.91×10−4 7 7.014×10−5 失拟检验 2.838×10−4 3 9.458×10−5 1.83 0.2825 纯误差 2.072×10−4 4 5.18×10−5 总误差 0.019 16 注:**表示差异极显著P<0.01。 表 6 秋刀鱼酶解液中游离氨基酸含量
Table 6 Free amino acid contents of Pacific saury hydrolysate
氨基酸 氨基酸含量(mg/100 mL) 氨基酸 氨基酸含量(mg/100 mL) 天冬氨酸 55.14±0.19 甲硫氨酸 79.28±0.18 苏氨酸 40.01±0.06 异亮氨酸 167.81±0.05 丝氨酸 28.69±0.02 亮氨酸 44.93±0.02 谷氨酸 78.63±0.14 苯丙氨酸 67.41±0.16 甘氨酸 26.91±0.09 赖氨酸 110.51±0.07 丙氨酸 106.94±0.13 组氨酸 322.63±0.29 半胱氨酸 85.22±0.16 精氨酸 86.24±0.07 缬氨酸 13.79±0.04 脯氨酸 2.26±0.01 氨基酸总量 1316.38 必需氨基酸 523.73(39.79%) 支链氨基酸 226.53(17.21%) 抗氧化活性氨基酸* 487.13(37.01%) 注:*抗氧化活性氨基酸:组氨酸、酪氨酸、半胱氨酸、甲硫氨酸等[38]。 -
[1] 花传祥, 高玉珍, 朱清澄, 等. 基于耳石微结构的西北太平洋秋刀鱼(Cololabis saira)年龄与生长研究[J]. 海洋学报,2017,39(10):46−53. [HUA C X, GAO Y Z, ZHU Q C, et al. Age and growth of Pacific saury(Cololabis saira) in the Northwest Pacific Based on otoliths[J]. Acta Oceanologica Sinica,2017,39(10):46−53. [2] TAKASUKA A, NISHIKAWA K, KURODA H, et al. Growth variability of Pacific saury (Cololabis saira) larvae under contrasting environments across the Kuroshio axis: Survival potential of minority versus majority[J]. Fisheries Oceanography,2016,25(4):390−406. doi: 10.1111/fog.12160
[3] 石永闯, 朱清澄, 花传祥, 等. 基于海上实测的秋刀鱼舷提网沉降和提升性能研究[J]. 海洋通报,2018,37(4):459−467. [SHI Yongchuang, ZHU Qingcheng, HUA Chuanxiang, et al. Research on settlement and lifting performance of gunwale net of saberfish based on measured at sea[J]. Marine Science Bulletin,2018,37(4):459−467. doi: 10.11840/j.issn.1001-6392.2018.04.012 [4] MORI H, TONE Y, SHIMIZU K, et al. Studies on fish scale collagen of Pacific saury(Cololabis saira)[J]. Materials Science & Engineering C,2013,33(1):174−181.
[5] 陈建文, 高建华, 钟海明, 等. 秋刀鱼蛋白酶解物的制备及氨基酸评价[J]. 食品研究与开发,2007(9):53−55. [CHEN Jianwen, GAO Jianhua, ZHONG Haiming, et al. Preparation and amino acid evaluation of saury protein hydrolysate[J]. Food Research and Development,2007(9):53−55. doi: 10.3969/j.issn.1005-6521.2007.09.017 [6] 赵谋明, 徐巨才, 刘洋, 等. 秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺优化[J]. 农业工程学报,2015,31(14):291−297. [ZHAO Mouming, XU Jucai, LIU Yang, et al. Optimization of preparation process of xanthine oxidase inhibitor peptide from Cololabis saira[J]. Transactions of the Chinese Society of Agricultural Engineering,2015,31(14):291−297. doi: 10.11975/j.issn.1002-6819.2015.14.040 [7] MADA S B, UGWU C P, ABARSHI M M. Health Promoting effects of food-derived bioactive peptides: A review[J]. International Journal of Peptide Research and Therapeutics,2020,26(2):831−848. doi: 10.1007/s10989-019-09890-8
[8] 柯义强. 发酵法制备牦牛乳酪蛋白抗氧化肽的研究[D]. 兰州: 西北民族大学, 2021. KE Yiqiang. Study on preparation of antioxidant peptides from yak cheese protein by fermentation[D]. Lanzhou: Northwest University for Nationalities, 2021.
[9] JEMIL I, JRIDI M, NASRI R, et al. Functional, antioxidative and antibacterial properties of protein hydrolysates prepared from fish meat fermented by Bacillus subtilis A26[J]. Process Biochemistry,2014,49(6):963−972. doi: 10.1016/j.procbio.2014.03.004
[10] ASSEM F M, ABD E M A M, KASSEM J M, et al. Proteolysis and antioxidant activity of peptic, tryptic and chymotryptic hydrolysate of cow, buffalo, goat and camel caseins[J]. International Journal of Dairy Technology,2018,71(1):236−242. doi: 10.1111/1471-0307.12400
[11] 杨昭, 黄佳佳, 姚玉静, 等. 水解度对牡蛎酶解产物功能特性和抗氧化活性的影响[J]. 食品工业,2021,42(5):134−138. [YANG Zhao, HUANG Jiajia, YAO Yujing, et al. Effect of degree of hydrolysis on functional properties and antioxidative activity of oyster hydrolysates[J]. Food Industry,2021,42(5):134−138. [12] 张晓頔, 张益奇, 朱凯, 等. 三文鱼皮四种蛋白酶酶解物抗氧化活性及功能特性的差异研究[J]. 核农学报,2021,35(6):1402−1409. [ZHANG Xiaodi, ZHANG Yiqi, ZHU Kai, et al. Study on differences in antioxidative activity and functional properties of four protease hydrolysates from salmon skin[J]. Acta Nuclear Agriculture,2021,35(6):1402−1409. doi: 10.11869/j.issn.100-8551.2021.06.1402 [13] DENG Zhao, CUI Chenbin, WANG Yanan, et al. FSGHF3 and peptides, prepared from fish skin gelatin, exert a protective effect on DSS-induced colitis via the Nrf2 pathway[J]. Food & Function,2020,11(1):414−423.
[14] CHI Changfeng, WANG Bin, WANG Yumei, et al. Isolation and characterization of three antioxidative peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) heads[J]. Journal of Functional Foods,2015,12:1−10. doi: 10.1016/j.jff.2014.10.027
[15] 朱均旺, 鞠兴荣, 王立峰, 等. 超声波辅助分步酶解法制备菜籽肽及复合酶筛选[J]. 食品科学,2010,31(13):244−248. [ZHU Junwang, JU Xingrong, WANG Lifeng, et al. Preparation of rapeseed peptides by ultrasonic-assisted stepwise enzymatic hydrolysis and screening of complex enzymes[J]. Food Science,2010,31(13):244−248. [16] XIE Zhengjun, HUANG Junrong, XU Xueming, et al. Antioxidative activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry,2008,111(2):370−376. doi: 10.1016/j.foodchem.2008.03.078
[17] LI Wenfeng, WANG Xu, ZHANG Jing, et al. Multivariate analysis illuminates the effects of vacuum drying on the extractable and nonextractable polyphenols profile of loquat fruit[J]. Journal of Food Science,2019,84(4):726−737. doi: 10.1111/1750-3841.14500
[18] 陈秋娟, 谢微, 罗杨合. 马蹄皮提取液抗氧化的稳定性研究[J]. 食品研究与开发,2017,38(11):9−12. [CHEN Qiujuan, XIE Wei, LUO Yanghe. Study on antioxidative stability of horseshoe bark extract[J]. Food Research and Development,2017,38(11):9−12. doi: 10.3969/j.issn.1005-6521.2017.11.003 [19] 宋春艳, 李彦林, 张蔚, 等. 源于啤酒糟的阿魏酰低聚糖组成及其抗氧化活性分析[J]. 食品工业科技,2019,40(9):1−5,12. [SONG Chunyan, LI Yanlin, ZHANG Wei, et al. Composition and antioxidative activity analysis of feruloyl oligosaccharides derived from beer grains[J]. Science and Technology of Food Industry,2019,40(9):1−5,12. [20] 陈剑岚. 氨基酸自动分析法测定养殖与野生草鱼肉的滋味成分[J]. 现代食品,2020(10):162−163. [CHEN Jianlan. Determination of flavor components of cultured and wild fish by automatic amino acid analysis[J]. Modern Food,2020(10):162−163. [21] 叶旭昌, 刘瑜, 朱清澄, 等. 北太平洋公海秋刀鱼生物学特性初步研究[J]. 上海水产大学学报,2007(3):264−268. [YE Xuchang, LIU Yu, ZHU Qingcheng, et al. Preliminary study on the biological characteristics of Cololabis saira in the North Pacific Ocean[J]. Journal of Shanghai Fisheries University,2007(3):264−268. [22] 徐永霞, 曲诗瑶, 赵洪雷, 等. 鳀鱼蒸煮液及酶解液的风味特性分析[J]. 现代食品科技,2019,35(12):267−275. [XU Yongxia, QU Shiyao, ZHAO Honglei, et al. Flavor characteristics analysis of anchovy cooking liquid and enzymatic hydrolysate[J]. Modern Food Science and Technology,2019,35(12):267−275. [23] 李俊江, 潘道东, 郭宇星, 等. 鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究[J]. 食品科学,2012,33(3):126−130. [LI Junjiang, PAN Daodong, GUO Yuxing, et al. Optimization of proteolysis conditions of goose meat and study on the antioxidative activity of enzymatic hydrolysis products[J]. Food Science,2012,33(3):126−130. doi: 10.7506/spkx1002-6630-201703027 [24] 任海伟, 石菊芬, 蔡亚玲, 等. 响应面法优化超声辅助酶解制备藏系羊胎盘肽工艺及抗氧化能力分析[J]. 食品科学,2019,40(24):265−273. [REN Haiwei, SHI Jufen, CAI Yaling, et al. Optimization of ultrasound-assisted enzymatic hydrolysis for preparation of Tibetan sheep placental peptides by response surface methodology and analysis of antioxidative capacity[J]. Food Science,2019,40(24):265−273. doi: 10.7506/spkx1002-6630-20181101-009 [25] 贺雪华, 李林, 白登荣, 等. 改进型城口腊肉贮藏过程中的品质变化及货架期预测[J]. 食品科学,2017,38(11):249−255. [HE Xuehua, LI Lin, BAI Dengrong, et al. Quality change and shelf life prediction of improved Chengkou bacon during storage[J]. Food Science,2017,38(11):249−255. doi: 10.7506/spkx1002-6630-201711040 [26] WU Wenjia, ZHANG Mengmeng, SUN Chongzhen, et al. Enzymatic preparation of immunomodulatory hydrolysates from defatted wheat germ (Triticum vulgare) globulin[J]. International Journal of Food Science & Technology,2016,51(12):2556−2566.
[27] 夏吉安, 黄凯, 李森, 等. 绿豆抗氧化肽的酶法制备及其抗氧化活性[J]. 食品与生物技术学报,2020,39(10):40−47. [XIA Ji'an, HUANG Kai, LI Sen, et al. Enzymatic preparation of mung bean antioxidative peptide and its antioxidative activity[J]. Journal of Food and Biotechnology,2020,39(10):40−47. doi: 10.3969/j.issn.1673-1689.2020.10.006 [28] 赵谋明, 刘洋, 张佳男, 等. 木糖-草鱼肽美拉德反应产物的抗氧化性[J]. 农业工程学报,2014,30(9):279−286. [ZHAO Mouming, LIU Yang, ZHANG Jianan, et al. Antioxidative properties of Maillard reaction products of xylose-grass peptide[J]. Transactions of the Chinese Society of Agricultural Engineering,2014,30(9):279−286. doi: 10.3969/j.issn.1002-6819.2014.09.035 [29] 宁诗文, 崔珊珊, 尚宏丽. 响应面法优化大黄花鱼肉蛋白水解工艺及多肽抗氧化性研究[J]. 食品工业科技, 2020, 41(13): 219 226 220-225. NING Shiwen, CUI Shanshan, SHANG Hongli. Optimization of the protein hydrolysis process of large yellow croaker fish meat and the antioxidative activity of peptides by response surface methodology[J]. Food Industry Science and Technology, 2020, 41(13): 219 226 220-225.
[30] 王倩. 蜂胶黄酮对小鼠铅中毒的保护作用及其机制研究[D]. 西安: 西北大学, 2020. WANG Qian. Protective effect of propolis flavonoids on lead poisoning in mice and its mechanism[D]. Xi'an: Northwest University, 2020.
[31] 王志, 赵峰, 王珊珊, 等. 大菱鲆鱼皮抗氧化胶原肽的制备及特性分析[J]. 食品安全质量检测学报,2020,11(22):8267−8275. [WANG Zhi, ZHAO Feng, WANG Shanshan, et al. Preparation and characteristics analysis of turbot skin antioxidative collagen peptide[J]. Journal of Food Safety and Quality Testing,2020,11(22):8267−8275. [32] 高原. 海洋乳酸菌抗氧化活性研究[D]. 大连: 大连工业大学, 2016. GAO Yuan. Research on the antioxidative activity of marine lactic acid bacteria[D]. Dalian: Dalian University of Technology, 2016.
[33] 黄典, 高雅, 刘蕾, 等. 蛋白酶水解美味牛肝菌工艺优化及酶解产物的抗氧化活性[J]. 食品工业科技,2021,42(12):209−217. [HUANG Dian, GAO Ya, LIU Lei, et al. Process optimization of protease hydrolysis of Boletus edulis and antioxidative activity of enzymatic hydrolysis products[J]. Science and Technology of Food Industry,2021,42(12):209−217. [34] 綦蕾, 王振宇. 红松松仁抗氧化肽的制备及体外抗氧化活性评价[J]. 食品与发酵工业,2010,36(7):78−82. [QI Lei, WANG Zhenyu. Preparation of Korean pine nuts antioxidative peptides and evaluation of antioxidative activity in vitro[J]. Food and Fermentation Industries,2010,36(7):78−82. [35] FLORENCIA C, ESTEBAN S J, ROSA A M, et al. Anti-inflammatory and antioxidative activities, functional properties and mutagenicity studies of protein and protein hydrolysate obtained from Prosopis alba seed flour[J]. Food Chemistry,2014,161:391−399. doi: 10.1016/j.foodchem.2014.04.003
[36] YU Fangmiao, ZONG Chuhong, JIN Shujie, et al. Optimization of extraction conditions and characterization of pepsin-solubilised collagen from skin of giant croaker(Nibea japonica)[J]. Marine Drugs,2018,16(1):29−40. doi: 10.3390/md16010029
[37] 艾丽奇. 鳕鱼皮胶原蛋白肽的抗皮肤光老化功效及其作用机制研究[D]. 广州: 华南理工大学, 2020. AI Liqi. A study on the anti-aging effect of cod skin collagen peptide and its mechanism[D]. Guangzhou: South China University of Technology, 2020.
[38] 王嘉榕, 滕达, 田子罡, 等. 功能性抗氧化肽制备与机制研究进展[J]. 天然产物研究与开发,2008(2):371−375. [WANG Jiarong, TENG Da, TIAN Zigang, et al. Research progress in preparation and mechanism of functional antioxidant peptides[J]. Natural Products Research and Development,2008(2):371−375. doi: 10.3969/j.issn.1001-6880.2008.02.045 -
期刊类型引用(12)
1. 李敏晶,李丹阳,范梓伊. 响应面优化海星肽-锌螯合物的制备. 农产品加工. 2025(04): 11-14+19 .  百度学术
百度学术
2. 张迎阳,董亚云,邹平,郑文武. 橄榄仁抗氧化肽的分离鉴定及分子对接. 食品与发酵工业. 2024(05): 189-198 .  百度学术
百度学术
3. 王扬铎,苏永昌,王晓燕,施文正,刘智禹. 仿刺参不同部位ACE抑制活性分析及活性肽制备工艺优化. 食品工业科技. 2024(10): 187-197 .  本站查看
本站查看
4. 张薇,李爱琳,李书国. 超声辅助酶解制备大米蛋白黄嘌呤氧化酶活性抑制肽的工艺条件优化. 中国粮油学报. 2024(06): 51-58 .  百度学术
百度学术
5. 叶灏铎,管晓盛,马凤,毛远辉,孙世利,曹庸,苗建银. 英红九号茶蛋白降尿酸肽的酶解制备及不同分子量组分的活性对比. 现代食品科技. 2023(03): 147-155 .  百度学术
百度学术
6. 沈畅华,杨娟,张远红,曾晓房. 双酶酶解鸽胸肉工艺优化及抗氧化性评价. 食品与机械. 2023(04): 163-169 .  百度学术
百度学术
7. 杨宝强,刘生杰. 响应面法优化猴头菇蛋白抗氧化肽工艺及抗运动疲劳活性研究. 粮食与油脂. 2023(05): 142-147 .  百度学术
百度学术
8. 牛金鸽,吴海玥,马世科,闫忠心,王学江,李婧,胡蓉,祁全青. 响应面优化藏羊皮胶原蛋白肽超声辅助提取工艺及其体内抗氧化活性分析. 食品工业科技. 2023(11): 163-170 .  本站查看
本站查看
9. 马凤,叶灏铎,夏珍,徐燕,孙世利,曹庸,苗建银. 英红九号茶蛋白ACE抑制肽的制备、氨基酸组成及不同超滤组分的活性评价. 现代食品科技. 2023(07): 237-245 .  百度学术
百度学术
10. 张艳,江波涛,李莉,王佳辉,王爽,李平,徐婷婷,刘雪松,薛沾枚,吴宪,邱景会. 驴血血红蛋白肽的制备工艺研究. 黑龙江畜牧兽医. 2023(17): 134-138+142 .  百度学术
百度学术
11. 张恒慧,张志军,陈士国,叶兴乾,张国华. 紫苏粕蛋白抗氧化活性肽的制备、分离纯化及序列鉴定. 中国食品学报. 2023(09): 347-355 .  百度学术
百度学术
12. 孙雪芹,廖彭莹,刘华宇,韦金锐,刘舒凌,陈俊,林燕媚,李锦清. 中华鳖肉水溶蛋白酶解工艺优化. 食品科技. 2022(11): 121-128 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:






 下载:
下载:



