Protective Effects and Mechanism of Polysaccharide from Polygonati rhizoma on Behavioral Despair Mice
-
摘要: 目的:探索黄精多糖对急性抑郁模型小鼠的改善作用及机制。方法:将60只ICR小鼠分为正常组、帕罗西汀对照组(10 mg/kg)、黄精多糖低剂量组(100 mg/kg)、黄精多糖中剂量组(200 mg/kg)和黄精多糖高剂量组(400 mg/kg)。预防给予黄精多糖3周后,通过体重监测和空场实验表现,研究黄精多糖对小鼠体重和自主活动的影响;通过悬尾实验和强迫游泳实验,研究黄精多糖对急性抑郁模型小鼠的行为影响;通过分析皮层中5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)和多巴胺(dopamine,DA),血清中肿瘤坏死因子-α(tumor necrosis factor,TNF-α)和白介素-10(interleukin-10,IL-10),海马中色氨酸(Tryptophan,TRP)及其代谢产物5-羟吲哚乙酸(5- hydroxyindolacetic acid,5-HIAA)和3-羟基犬尿氨酸(3-hydroxycaninuric acid,3-HK)等生化指标,探究黄精多糖抗抑郁作用的分子机制。结果:黄精多糖显著缩短了行为绝望模型小鼠在悬尾和强迫小鼠游泳实验中的不动时间(P<0.05);在空场实验中,各组小鼠运动路程和运动时间等自主活动度无显著性差异(P>0.05)。与空白组相比,黄精多糖组(200和400 mg/kg)小鼠脑组织5-HT、DA和NE水平显著升高(P<0.05),血清中TNF-α和IL-10活性降低(P<0.05),海马中TRP和3-HK水平下调(P<0.05)。结论:黄精多糖(200和400 mg/kg)可通过上调急性绝望抑郁模型动物脑内的单胺类神经递质、抑制神经炎性反应和调节色氨酸代谢通路起到改善抑郁的作用。Abstract: Objective: To study the protective effects of polysaccharide from Polygonati rhizoma (PSP) on acute behavioral despair mice and the underlying mechanisms. Methods: A total of 60 ICR mice were randomly divided into the control group, the paroxetine group (10 mg/kg), PSP-low group (100 mg/kg), PSP-medium group (200 mg/kg), and PSP-high group (400 mg/kg). After 3 weeks of administration, the effect of PSP on the body weight and locomotor activity of mice was investigated by body weight and open field. The tail suspension and the forced swimming test were conducted to evaluate the antidepressant effect of PSP. In addition, 5-hydroxytryptamine (5-HT), norepinephrine (NE), dopamine (DA) levels in cortex, tumor necrosis factor (TNF-α), interleukin-10 (IL-10) levels in serum as well as tryptophan (TRP), 5-hydroxyindolacetic acid (5-HIAA) and 3-hydroxycaninuric acid (3-HK) contents in hippocampus of mice were evaluated to explore the molecular mechanism of antidepressant effect. Results: The PSP administration remarkably shortened the immobility time of the behavioral despair model mice both in tail suspension test and forced swimming test (P<0.05), showing the antidepressant activity. At the same time, PSP had no influence on the body weight and locomotor activity of mice (P>0.05). Moreover, PSP (200 and 400 mg/kg) significantly elevated the levels of 5-HT, DA and NE in cortex (P<0.05), decreased the TNF-α and IL-10 release in serum (P<0.05), as well as inhibited the levels of TRP and 3-HK (P<0.05) in hippocampus of mice compared to those of control group. Conclusion: PSP (200 and 400 mg/kg) exerted remarkable antidepressant activity in behavioral despair mice probably by promoting monoamine neurotransmitter release, inhibiting inflammatory cytokines levels, and regulating tryptophan metabolism.
-
抑郁症是一类以长期心情消沉为主的慢性情绪障碍疾病,表现为情绪低落、入睡困难、饮食减少等,更有甚者悲观厌世、有自杀念头,对患者日常生活、工作和学习产生严重影响[1-2]。据世界卫生组织最近的报告,全球已有3.5亿人患此病,占所有疾病人数的7.5%[3]。目前抑郁症的治疗以口服药物为主,如三环类抗抑郁药(tricyclic antidepressant,TCAs)、单胺氧化酶抑制剂(Monoamine Oxidase Inhibitor,MAOI)和选择性5-羟色胺再摄取抑制剂(Selective Serotonin Reuptake Inhibitor,SSIR)等,但其副作用大、治疗昂贵、易产生药物依赖性、易复发等,因此抑郁症的有效预防和治疗是现实难题,也引起科学界的关注[4-5]。近年来有研究陆续报道食疗食补可为抑郁症的防治提供新的思路,如猴头菇[6]、山药[7]、枸杞[8]、苦瓜[9-10]等食材中的多糖成分可有效改善神经功能障碍,具备抗抑郁作用。
随着“健康中国2030”、“国民营养健康计划”等国家战略的开展,结合目前抑郁症防治的重大需求,药食两用资源的抗抑郁功效挖掘和开发利用意义重大。黄精(Polygonati rhizoma)作为一种传统中药,首记载于陶弘景的《名医别录》[11],并于2002年被我国卫生部收录在既是食品又是中药材物质目录中。黄精多糖(Polysaccharide of Polygonati rhizoma, PSP)作为其主要的活性成分,具有抗疲劳[12]、增强免疫[13]、抗炎[14]等生物活性,可通过激活多巴胺(dopamine,DA)合成通路[15]、减轻皮层和海马的病变、改善大脑超微结构[16]、调节海马和皮层氧化应激水平[17]起到改善学习记忆和睡眠等神经功效,但有关黄精多糖抗抑郁的作用及机制探究鲜见相关报道。因此本研究对小鼠预防干预黄精多糖3周后,采用经典的急性诱导行为绝望小鼠抑郁模型评价黄精多糖的抗抑郁活性,检测脑内单胺类神经递质水平、炎症因子含量以及色氨酸代谢相关代谢产物表达水平,以研究黄精多糖抗抑郁的作用机制。
1. 材料与方法
1.1 材料与仪器
SPF级ICR小鼠 60只(雄性,8~9周,18~20 g),由北京维通利华实验动物公司提供,实验小鼠生产许可证号:SCXK(京)2016-0006。本实验遵守动物福利3R原则、符合国际实验动物伦理学要求,并获中国医学科学院药用植物研究所实验动物管理与动物福利委员会(IACUC)的审查批准。小鼠自由饮用食水,实验期间室内温度保持在22~24 ℃,相对湿度保持在55%±10%,保持12 h黑暗/12 h照明的昼夜节律(8:00~20:00亮灯);黄精多糖(纯度70%,批号S27804)、帕罗西汀(批号110429-35-1) 上海源叶生物科技有限公司;5-羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)、去甲肾上腺素(NE)、血清中肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-10(interleukin-10,IL-10)、5-羟吲哚乙酸(5- hydroxyindolacetic acid,5-HIAA)酶联免疫吸附分析(enzyme linked immunosorbent assay,Elisa)试剂盒 南京建成生物工程研究所;3-羟基犬尿氨酸(3-hydroxycaninuric acid,3-HK)、色氨酸(Tryptophan,TRP)Elisa试剂盒 江莱生物有限公司。
5810R高速冷冻离心机 德国Eppendorf公司;M1000 多功能酶标仪 瑞士Tecan公司;KQ-600DV数控超声波清洗器 昆山舒美公司;空场仪(KSYY-OP-V4.0)、悬尾实验仪(KSYY-TS-V3.0)、强迫游泳检测仪器(KSYY-FS-V3.0) 均由中国医学科学院药用植物研究所、中国航天员中心和北京康森益友科技有限公司联合研发。
1.2 实验方法
1.2.1 分组及给药
小鼠适应环境5 d后,根据体重随机分成以下5组,空白对照组(灌胃等体积蒸馏水)、帕罗西汀对照组(灌胃帕罗西汀10 mg/kg),黄精多糖低剂量组(100 mg/kg)、黄精多糖中剂量组(200 mg/kg)和黄精多糖高剂量组(400 mg/kg),每组12只。每天上午9:00灌胃1次,灌胃体积0.1 mL/10 g,每日灌胃直至行为学检测结束。给药3周后依次进行空场实验、悬尾实验和强迫游泳实验。
1.2.2 空场实验
给药第21 d给药1 h后立即开始空场实验,根据本实验室前期建立的方法,对小鼠的自主活动表现及运动情况进行检测[18]。将小鼠面壁边缘放入测试箱内(每次实验从同一位置同一方向放入),适应3 min后进行检测,观察统计小鼠在5 min测试期间内的自主运动情况。每次检测结束后,对小鼠粪便和尿液进行清理,用75%酒精去除气味。
1.2.3 悬尾实验
给药第22 d给药1 h后,参照Zhang等[19]报道的方法,在小鼠尾巴距尾尖部约1~1.5 cm处缠上提前剪好的胶布(胶布约宽5 mm,长6~8 cm),挂在“S”型小铁钩上,使其倒悬体位,其头部距离悬尾箱底面约5~10 cm,小鼠挣扎时使得铁钩上的张力变化,该信号由悬尾箱支架上的传感器接收,系统自动记录小鼠不动时间。小鼠倒挂2 min适应后进行检测,系统对4 min检测期内累计静止时间进行统计(小鼠停止挣扎或静止为不动状态)。每次小鼠试验后,清除粪便尿液并使用75%酒精清除气味。
1.2.4 强迫游泳实验
第23 d给药1 h后,参照Wang等[20]报道的方法并进行改进,使用强迫游泳实验的计算机图像实时检测分析处理系统,设置实验参数、几何形状和照度定标后,将小鼠放入XSC-恒温游泳仪(高20 cm,直径14 cm,水深15 cm,水温23±1 ℃)中适应2 min,适应后,系统立即记录并统计小鼠在4 min内的累计不动时间(以小鼠停止挣扎或呈漂浮状态、四肢有轻微动作以保持头部在水面为不动状态)。每次动物试验后更换水。
1.2.5 体重检测
每3 d称重一次,监测各组小鼠体重变化。
1.2.6 样本采集
实验结束后,小鼠摘眼球采血并处死,在冰上迅速分离皮层、海马等脑组织后存于−80 ℃冰箱备用;血样在室温下静置30 min后,3500 r/min离心15 min取上清液,分装移至EP管,置于−80 ℃保存,留待检测。
1.2.7 生化指标检测
皮层和海马在4 ℃生理盐水中漂洗,除去血液,滤纸拭干,称重后加入组织重量9倍的4 ℃生理盐水制成10%组织匀浆,2500 r/min离心10 min后取上清液进行测定[17-18]。按照 Elisa试剂盒说明书要求检测血清中TNF-α、IL-6和IL-10含量,皮层中5-HT、DA和NE含量,海马中TRP、5-HIAA和3-HK含量。
1.3 数据处理
实验结果采用SPSS22.0软件进行统计学分析,结果表示为均值±标准差(Mean±SD)。进行单因素方差分析(one-way ANOVA),使用最小显著差数法(LSD)多重比较方法比较组间差异,当P<0.05则认为差异具有统计学意义。使用GraphPad Prism 8.0.2软件作图。
2. 结果与分析
2.1 体重变化
体重是机体生长发育的一个重要指标,反映小鼠的生长情况[21]。如表1所示,在实验分组时,各组小鼠的平均体质量基本相同(P>0.05)。与空白组相比,给药7 d后帕罗西汀组出现体重升高趋势,给药14 d后黄精多糖处理组(100、200和400 mg/kg)体重呈上升趋势,但均未呈显著性差异(P>0.05)。实验期间各组小鼠的体质量亦无显著性差异(P>0.05),表明100、200和400 mg/kg的黄精多糖对小鼠的生长发育无不良影响,各组小鼠生长状况良好、活动表现和毛色正常。
表 1 各组小鼠体重变化 (Mean±SD,n=12)Table 1. Body weight of mice in each group (Mean±SD, n=12)组别 第1 d 第7 d 第14 d 第21 d 空白对照组 27.25±1.52a 31.15±2.47a 33.24±2.83a 34.78±3.03a 帕罗西汀对照组 26.90±1.15a 32.31±2.17a 35.17±2.07a 36.86±2.16a 黄精多糖低剂量组 27.17±1.45a 31.38±2.00a 34.05±2.03a 35.70±1.81a 黄精多糖中剂量组 26.79±1.68a 31.45±2.26a 34.53±2.74a 35.91±2.63a 黄精多糖高剂量组 26.82±1.14a 31.91±1.86a 35.01±2.13a 36.66±2.00a 注:同一列相同字母表示差异不显著(P>0.05);表2同。 2.2 黄精多糖对小鼠自主活动的影响
空场实验是检测小鼠在陌生环境内的行为表现及探索行为,反映其自发行为、运动情况及情绪状态,其活动强度用于评价小鼠中枢神经系统的兴奋或抑制状态[22]。如表2所示,在给药黄精多糖3周后进行的空场实验中,与空白组相比,帕罗西汀对照组和各剂量黄精多糖处理组(100、200和400 mg/kg)的总路程、运动路程、运动时间和运动速度无显著性差异(P>0.05),表明黄精多糖并未对小鼠中枢神经系统产生兴奋作用,排除黄精多糖抗抑郁作用的假阳性结果。结合体重变化的结果来看,给药3周黄精多糖并未对小鼠的自主活动产生影响,黄精多糖低毒性、适宜长期食用[23-24]、多靶点作用[25]的特点在本实验中得到体现。
表 2 黄精多糖对小鼠空场自主活动度的影响(Mean±SD,n=12)Table 2. Effects of PSP on open field test of locomotor activity in mice (Mean±SD, n=12)组别 总路程(cm) 运动路程(cm) 运动时间(s) 运动速度(cm/s) 空白对照组 1592.97±270.16a 1236.13±205.39a 82.46±15.81a 19.55±0.78a 帕罗西汀对照组 1660.83±340.23 a 1298.23±379.46a 83.82±19.47a 19.87±0.74a 黄精多糖低剂量组 1752.42±258.37a 1392.65±250.81a 88.29±13.36a 19.86±0.56a 黄精多糖中剂量组 1683.12±269.04 a 1283.43±286.98a 84.60±23.53a 20.08±0.72a 黄精多糖高剂量组 1738.42±355.62 a 1361.34±490.84a 89.31±13.01a 19.88±0.89a 2.3 黄精多糖对小鼠悬尾实验不动时间的影响
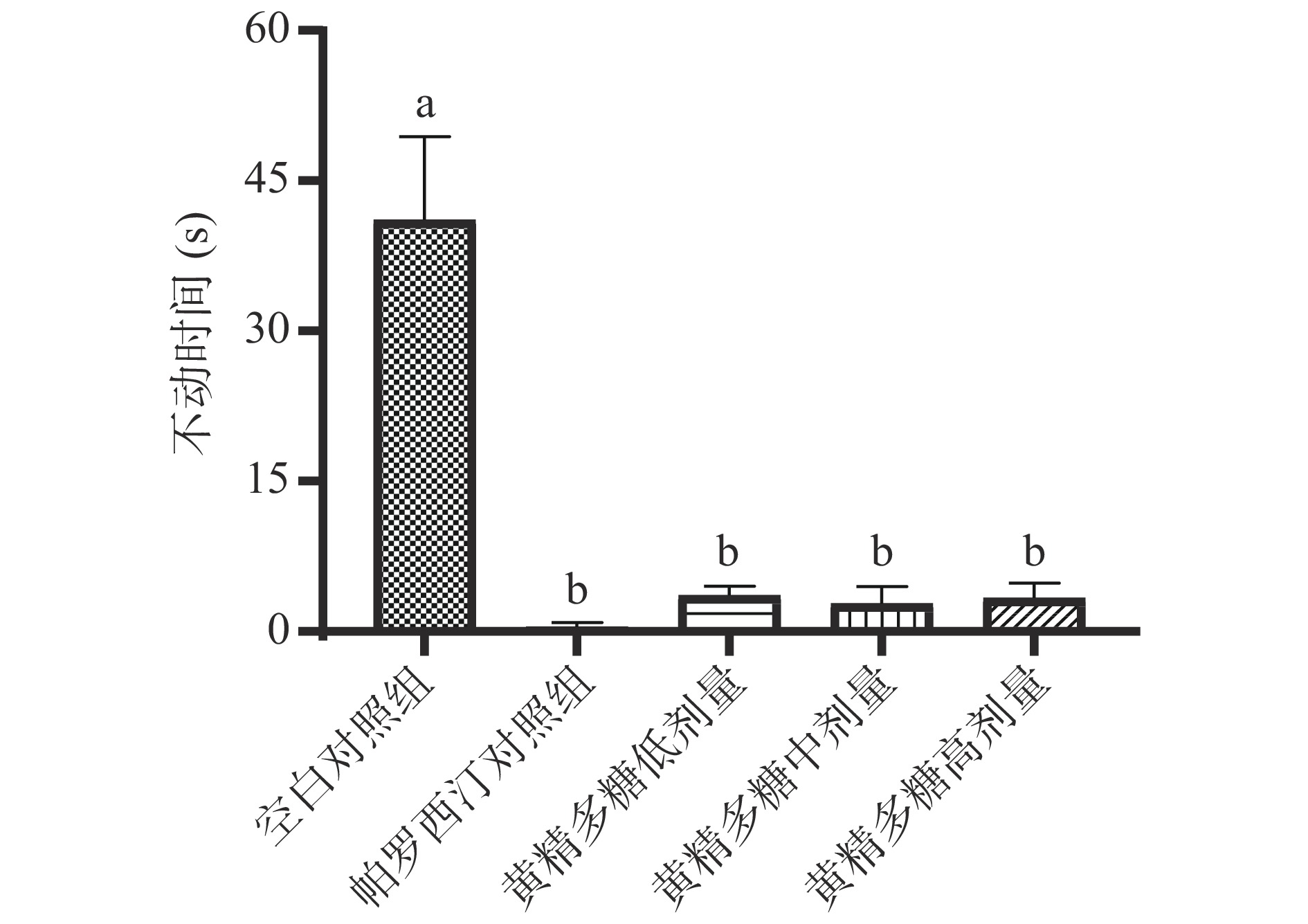
小鼠在强迫悬挂或游泳的应激条件下,经过反复挣扎后的绝望表现即不动状态,不动状态持续的时间是衡量“抑郁样”行为的指标[26]。如图1所示,在给药3周后进行的小鼠悬尾实验中,与空白组比较,帕罗西汀组和黄精多糖处理组(100、200、400 mg/kg)的不动时间分别降低了98.89%、91.19%、93.25%、91.83%,均呈极显著差异(P<0.05),其余组间无差异,表明帕罗西汀和黄精多糖对悬尾所致小鼠急性行为绝望行为具有改善作用。阳性药帕罗西汀是一种选择性五羟色胺再摄取剂(SSRI),能够阻滞5-HT再吸收,提升机体神经突触间隙内浓度,具有高效、强力的抗抑郁作用, 可显著缩短实验中动物的不动时间[27]。
2.4 黄精多糖对小鼠强迫游泳实验不动时间的影响
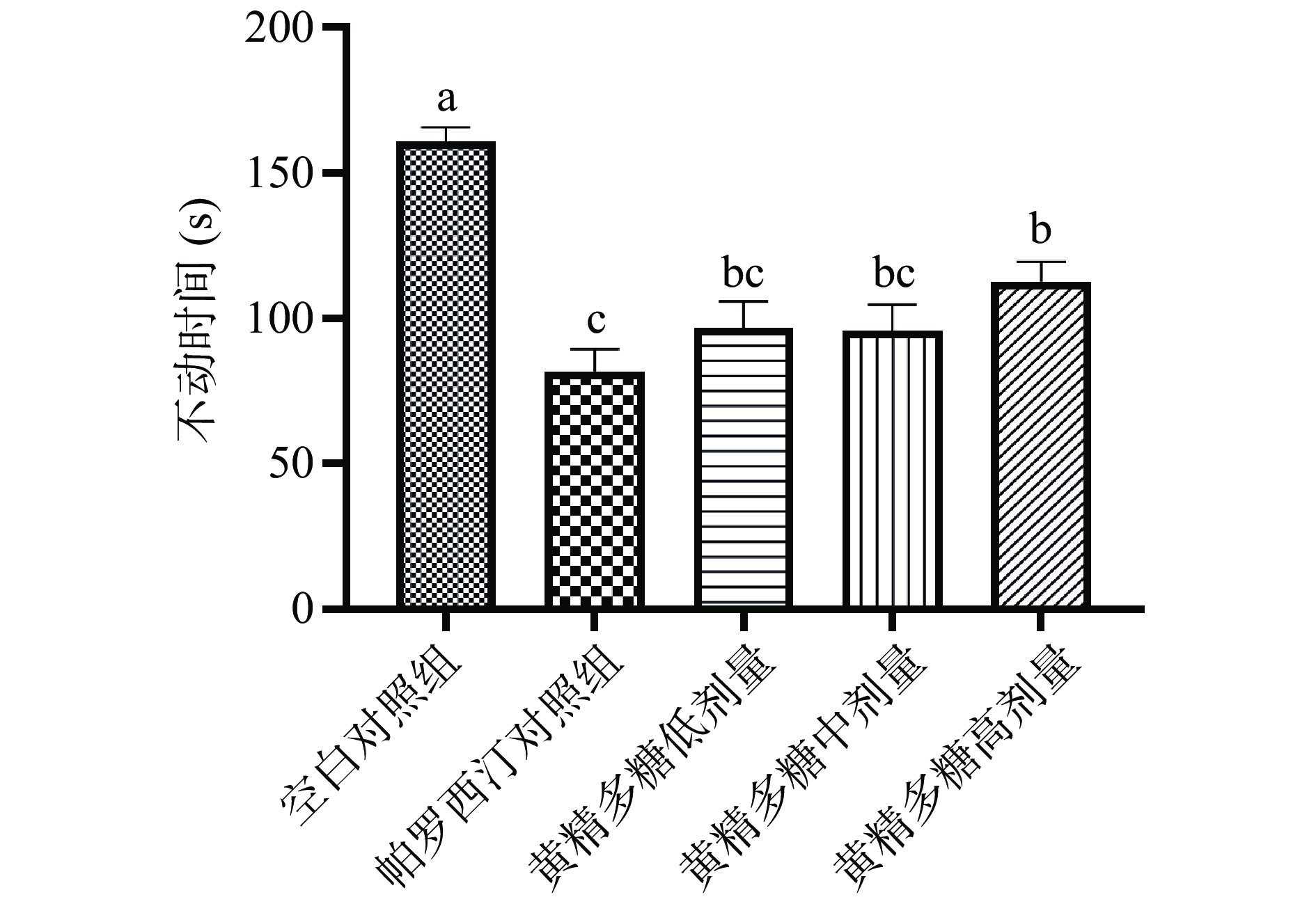
强迫游泳实验原理与悬尾实验类似,通过检测小鼠在强迫应激条件下的不动时间来反映小鼠是否抑郁的行为学实验。如图2所示,与空白组相比,帕罗西汀对照组和黄精多糖处理组(100、200和400 mg/kg)小鼠的不动时间均显著降低(P<0.05),不动时间分别降低了49.42%、39.86%、40.28%、29.96%,说明黄精多糖可改善小鼠在强迫游泳环境中的急性抑郁样行为。
2.5 黄精多糖对急性抑郁小鼠皮层中5-HT、DA、NE的影响
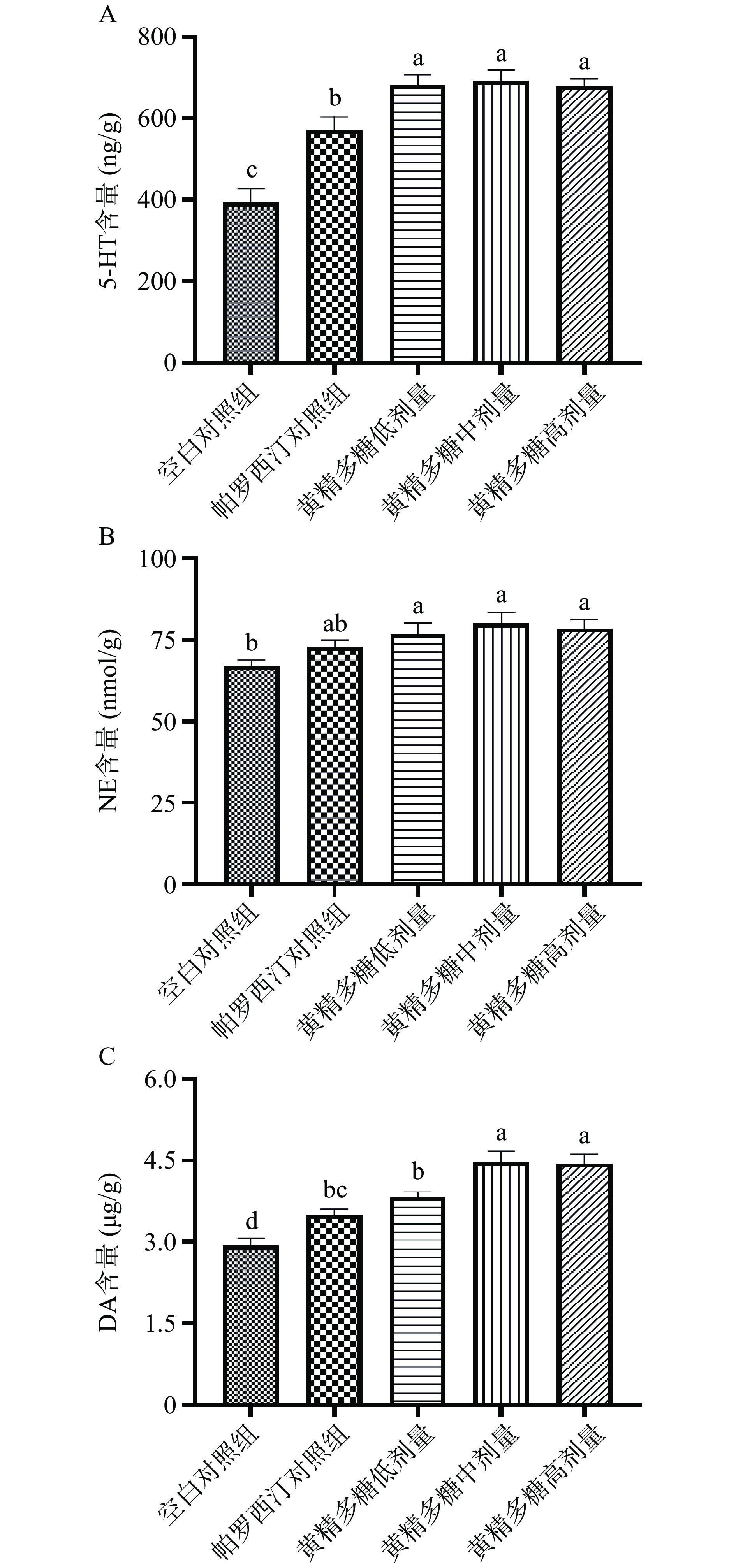
单胺类神经递质假说中,神经细胞突触间隙的单胺类神经递质5-HT、DA和NE浓度的降低是诱导抑郁症发生的主要原因之一[28]。如图3所示,与空白对照组相比,黄精多糖处理组(100、200和400 mg/kg)均显著升高小鼠皮层中5-HT、DA及NE的质量浓度(P<0.05),帕罗西汀组显著提高5-HT和DA质量浓度(P<0.05)。本研究表明黄精多糖组(200和400 mg/kg)可显著提高小鼠皮层的 5-HT、NE 和 DA 水平,表明黄精多糖干预抑郁症状可能通过上调皮层中的单胺类递质的水平有关。此外,帕罗西汀等SSIR可增加单胺神经递质5-HT的浓度,但对NE受体无影响[29],该研究与本实验中神经递质水平的结果一致,即帕罗西汀未引起NE浓度的显著上升。
2.6 黄精多糖对急性抑郁小鼠血清中细胞因子TNF-α、IL-10的影响
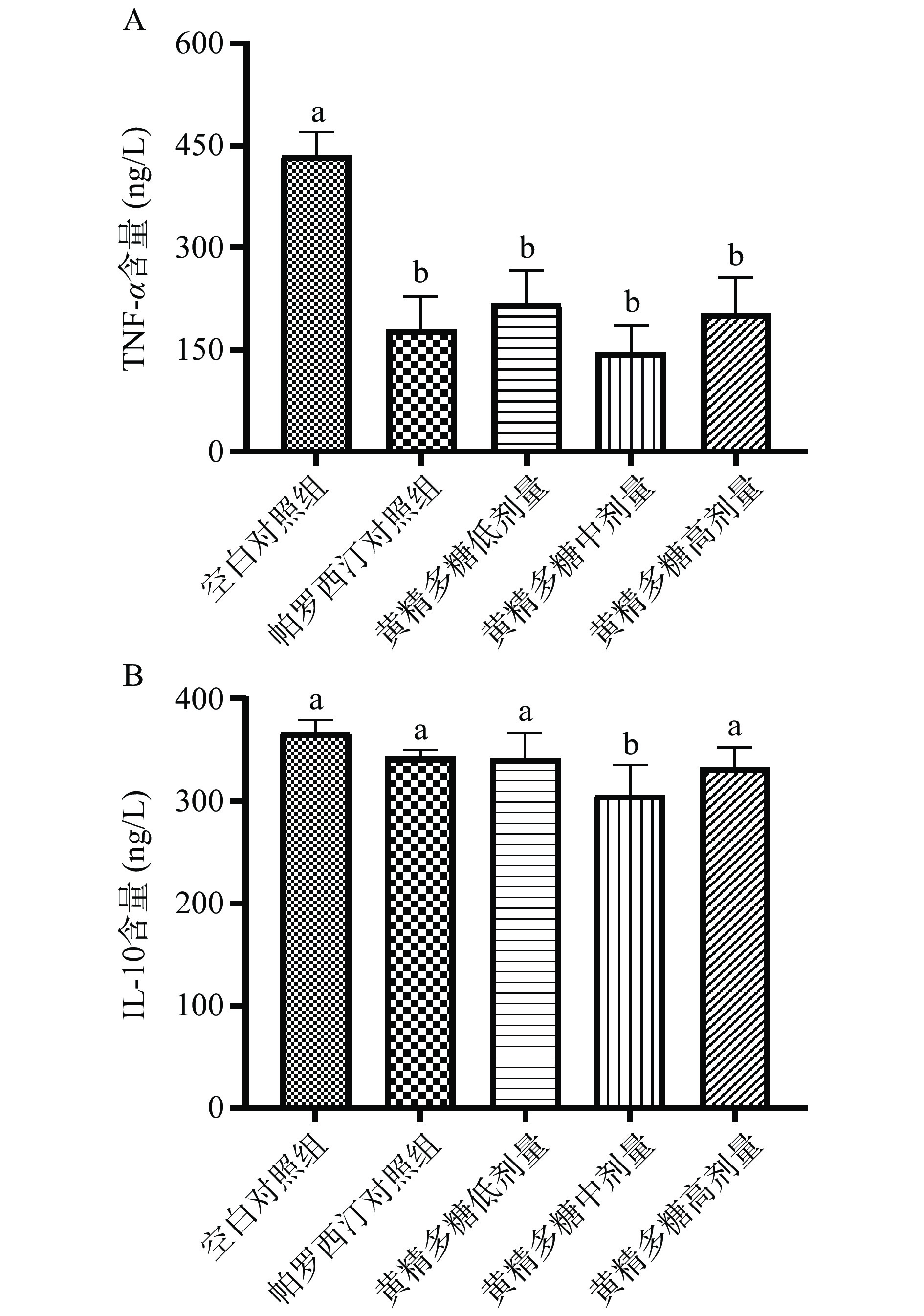
细胞因子的水平也是评价抑郁症的重要指标,向脑室内注射细胞因子可降低大鼠额叶皮质、中脑和纹状体内5-HT含量[30],甚至有些研究认为细胞因子水平与抑郁程度呈正相关[31]。抑郁症引发外周血和中枢神经系统中炎症反应,大量分泌的细胞因子加重抑郁症状,对相关神经回路和神经递质功能造成直接或间接的影响,从而加重不同亚型抑郁症的发展[32-33]。在抑郁症治疗过程中,抗抑郁药物的服用可有效逆转患者外周血清中白介素、肿瘤坏死因子水平的升高[34]。由图4A可知,与空白组相比,帕罗西汀对照组和黄精多糖处理组(100、200和400 mg/kg)小鼠血清中TNF-α浓度显著降低(P<0.05)。如图4B所示,与空白组相比,黄精多糖中剂量组(200 mg/kg)的IL-10含量呈显著性下降(P<0.05),其余组仅呈下降趋势。细胞因子TNF-α与抑郁中快感缺失有直接联系,TNF-α可直接对纹状体多巴胺能活性选择性破坏,以致无快感化;升高的TNF-α持续激活下游细胞因子,进而影响DA、谷氨酸等神经递质、破坏神经元结构,进而起到对抑郁症的影响[33]。陈娟等[35]用黄精多糖灌胃6-羟基多巴胺诱导的帕金森模型大鼠8周后,过氧化物酶体增殖物激活受体-γ (PPAR-γ) 表达上调、炎症反应被抑制,进而促进多巴胺神经元的再生。这与本研究结果有一致之处,因此推测黄精多糖通过下调小鼠血清中TNF-α和IL-10的水平、参与调节小鼠的炎症反应,对神经递质水平和功能起到保护作用,进而预防抑郁。
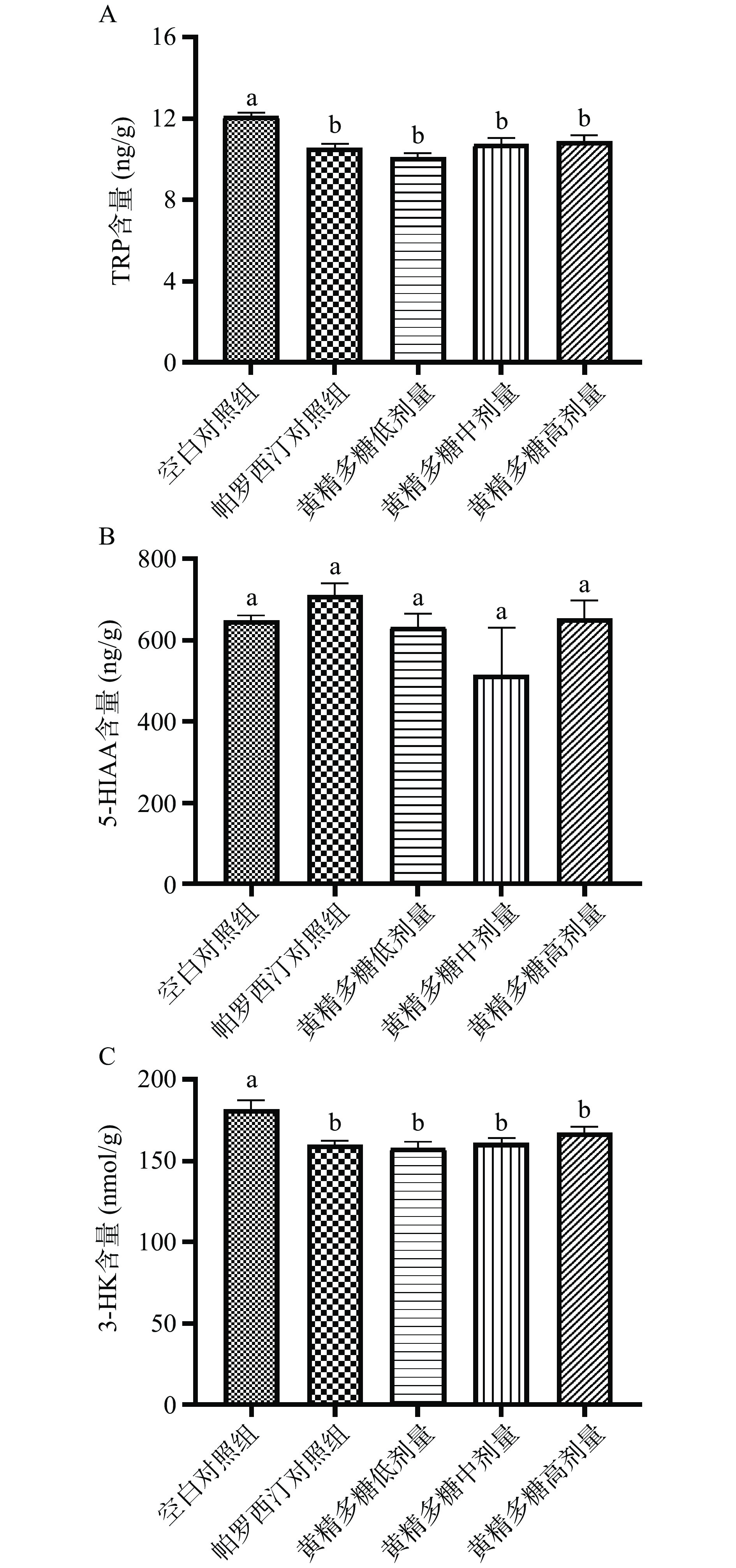
2.7 黄精多糖对急性抑郁小鼠海马中TRP、5-HIAA和3-HK含量的影响
TRP代谢途径在抑郁焦虑等情绪活动中具有重要的作用,具有特定神经活性特性的代谢产物过量或者比例的变化是诱发多种神经精神疾病的原因。如图5A和图5C所示,与空白组相比,帕罗西汀对照组和黄精多糖对照组的TRP及其代谢产物3-HK水平均呈显著性下降(P<0.05)。但在5-HIAA指标中,帕罗西汀对照组和黄精多糖中剂量组仅呈上升趋势,未出现显著性变化(图5B)(P>0.05)。TRP 主要有两条代谢途径,首先可在色氨酸氢化酶(TPH1)的作用下代谢成 5-HT,继而在MAO酶的作用下代谢为 5-HIAA[36]。TRP第二条代谢途径为在吲哚胺-2,3-双加氧酶(IDO)或色氨酸-2,3-双加氧酶(TDO)的作用下生成犬尿氨酸(KYN),进而在犬尿氨酸-3-单氧化酶(KMO)的作用下生成3-羟基犬尿氨酸(3-HK),3-HK可引起氧化应激和产生神经毒性[37]。Li等[38]的研究表明大鼠经不可预测温和刺激(CUMS)5周后出现快感缺失、绝望时间变长等抑郁样行为,并伴随以5-HT和KYN通路紊乱为主的TRP代谢异常。本实验表明,黄精多糖下调小鼠海马中TRP和3-HK水平,结合5-HT水平升高结果,推测黄精多糖可能通过增强TPH1酶活、抑制IDO1酶的活性,进而增加TRP/5-HT通路的代谢。此外,黄精多糖下调了具有神经毒性的3-HK水平,表明TRP/KYN/3-HK通路被抑制。综上,推测黄精多糖可能通过激活TPH1、抑制TDO酶活等途径调节TRP代谢通路,提高脑内神经递质水平、抑制神经毒性物质的产生起到预防抑郁的作用。此外,帕罗西汀可通过上调中枢系统中5-HT的浓度诱导TRP代谢通路被激活,具有神经毒性的3-HK代谢产物的下降表明,TRP/KYN/3-HK代谢通路可能被抑制,这与本实验中黄精多糖的分析结果类似,但具体的作用位点需对犬尿氨酸代谢通路进行进一步研究。
3. 结论
本研究首次使用急性抑郁模型评价黄精多糖的抗抑郁功效,发现黄精多糖灌胃3周可有效缩短小鼠在悬尾和强迫游泳应激条件下的不动时间,具有干预小鼠抑郁样行为的作用。此外,黄精多糖明显升高小鼠脑组织神经递质5-HT、NE和DA含量,降低细胞因子TNF-α和IL-10水平,促进TRP向代谢5-HT代谢并抑制具有神经毒性的TRP/3-HK代谢通路。由此推测,黄精多糖的抗抑郁作用可通过上调神经递质水平和降低炎症来实现,并对TRP代谢具有调节作用。本研究从细胞因子和TRP代谢的角度初步探索了黄精多糖的抗抑郁作用机制,为黄精多糖神经功效挖掘提供新方向。但有关黄精多糖抗抑郁活性和作用机制有待进一步阐明。
-
表 1 各组小鼠体重变化 (Mean±SD,n=12)
Table 1 Body weight of mice in each group (Mean±SD, n=12)
组别 第1 d 第7 d 第14 d 第21 d 空白对照组 27.25±1.52a 31.15±2.47a 33.24±2.83a 34.78±3.03a 帕罗西汀对照组 26.90±1.15a 32.31±2.17a 35.17±2.07a 36.86±2.16a 黄精多糖低剂量组 27.17±1.45a 31.38±2.00a 34.05±2.03a 35.70±1.81a 黄精多糖中剂量组 26.79±1.68a 31.45±2.26a 34.53±2.74a 35.91±2.63a 黄精多糖高剂量组 26.82±1.14a 31.91±1.86a 35.01±2.13a 36.66±2.00a 注:同一列相同字母表示差异不显著(P>0.05);表2同。 表 2 黄精多糖对小鼠空场自主活动度的影响(Mean±SD,n=12)
Table 2 Effects of PSP on open field test of locomotor activity in mice (Mean±SD, n=12)
组别 总路程(cm) 运动路程(cm) 运动时间(s) 运动速度(cm/s) 空白对照组 1592.97±270.16a 1236.13±205.39a 82.46±15.81a 19.55±0.78a 帕罗西汀对照组 1660.83±340.23 a 1298.23±379.46a 83.82±19.47a 19.87±0.74a 黄精多糖低剂量组 1752.42±258.37a 1392.65±250.81a 88.29±13.36a 19.86±0.56a 黄精多糖中剂量组 1683.12±269.04 a 1283.43±286.98a 84.60±23.53a 20.08±0.72a 黄精多糖高剂量组 1738.42±355.62 a 1361.34±490.84a 89.31±13.01a 19.88±0.89a -
[1] ROGERS A H, ZVOLENSKY M J, DITRE J W, et al. Association of opioid misuse with anxiety and depression: A systematic review of the literature[J]. Clinical Psychology Review,2021,84:101978. doi: 10.1016/j.cpr.2021.101978
[2] WANG S, LERI F, RIZVI S J. Anhedonia as a central factor in depression: Neural mechanisms revealed from preclinical to clinical evidence[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry,2021,110:110289. doi: 10.1016/j.pnpbp.2021.110289
[3] MORENO-AGOSTINO D, WU Y T, DASKALOPOULOU C, et al. Global trends in the prevalence and incidence of depression: A systematic review and meta-analysis[J]. Journal of Affective Disorders,2021,281:235−243. doi: 10.1016/j.jad.2020.12.035
[4] WONG V W, HO F Y, SHI N, et al. Lifestyle medicine for depression: A meta-analysis of randomized controlled trials[J]. Journal of Affective Disorders,2021,284:203−216. doi: 10.1016/j.jad.2021.02.012
[5] LA CHANCE L R, RAMSEY D. Antidepressant foods: An evidence-based nutrient profiling system for depression[J]. World Journal of Psychiatry,2018,8(3):97−104. doi: 10.5498/wjp.v8.i3.97
[6] WONG K H, KANAGASABAPATHY G, BAKAR R, et al. Restoration of sensory dysfunction following peripheral nerve injury by the polysaccharide from culinary and medicinal mushroom, Hericium erinaceus (Bull.: Fr. ) Pers. through its neuroregenerative action[J]. Food Science and Technology (Campinas), 2015, 35(4): 712−721.
[7] XIANG Q, ZHOU W Y, HU W X, et al. Neuroprotective effects of Rhizoma dioscoreae polysaccharides against neuronal apoptosis induced by in vitro hypoxia[J]. Experimental and Therapeutic Medicine,2015,10(6):2063−2070. doi: 10.3892/etm.2015.2819
[8] ZHAO W, PAN X, LI T, et al. Lycium barbarum polysaccharides protect against trimethyltin chloride-induced apoptosis via sonic hedgehog and PI3K/Akt signaling pathways in mouse neuro-2a cells[J]. Oxidative Medicine and Cellular Longevity,2016,2016:9826726.
[9] DUAN Z Z, ZHOU X L, LI Y H, et al. Protection of Momordica charantia polysaccharide against intracerebral hemorrhage-induced brain injury through JNK3 signaling pathway[J]. Journal of Receptors and Signal Transduction,2015,35(6):523−529. doi: 10.3109/10799893.2014.963871
[10] GONG J J, SUN F M, LI Y H, et al. Momordica charantia polysaccharides could protect against cerebral ischemia/reperfusion injury through inhibiting oxidative stress mediated c-Jun N-terminal kinase 3 signaling pathway[J]. Neuropharmacology,2015,91:123−134. doi: 10.1016/j.neuropharm.2014.11.020
[11] 陶弘景. 名医别录[M]. 北京: 中国中医药出版社, 2013: 38. TAO H J. Doctors do not record[M]. Beijing: China Press of Traditional Chinese Medicine, 2013: 38.
[12] 韩春杨, 杨明川, 杨孜生, 等. 黄精多糖的提取及其对CCl4致大鼠肝损伤的保护作用[J]. 浙江农业学报,2018,30(4):537−547. [HAN C Y, YANG M C, YANG Z S, et al. Study on extraction of Polygonatum sibiricum polysaccharides and its protective effect on CCl4-induced acute liver injury in rats[J]. Acta Agriculturae Zhejiangensis,2018,30(4):537−547. doi: 10.3969/j.issn.1004-1524.2018.04.03 [13] WANG Y, LIU Y J, LI F E, et al. A Chinese herbal formula shows beneficial effects on comorbid depression and coronary heart disease based on the philosophy of psycho-cardiology[J]. Journal of Herbal Medicine,2020,19:100303. doi: 10.1016/j.hermed.2019.100303
[14] LI L, THAKUR K, LIAO B Y, et al. Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J]. International Journal of Biological Macromolecules,2018,114:317−323. doi: 10.1016/j.ijbiomac.2018.03.121
[15] 成威, 李友元, 邓洪波, 等. 黄精多糖对阿尔茨海默病小鼠海马CA1区突触界面的影响[J]. 临床与病理杂志,2014,34(4):400−404. [CHENG W, LI Y Y, DENG H B, et al. Effect of polygona-polysaccharose on the synaptic interface in hippocampal CAI region of Alzheimer’s mice[J]. Journal of Clinical and Pathological Research,2014,34(4):400−404. doi: 10.3978/j.issn.2095-6959.2014.04.016 [16] 唐伟, 王威, 谭丽阳, 等. 黄精多糖对慢性脑缺血大鼠学习记忆能力及脑组织超微结构影响[J]. 中国中医药科技,2017,24(2):173−176. [TANG W, WANG W, TAN L Y, et al. Effects of Polygonatum polysaccharides on learning and memory and ultrastructure changes of brain tissue in rats with chronic cerebral ischemia[J]. Chinese Journal of Traditional Medical Science and Technology,2017,24(2):173−176. [17] 陆连第, 段伟松, 赵玉, 等. 黄精多糖对血管性痴呆模型大鼠干预作用的实验研究[J]. 中药材,2018,41(9):2212−2215. [LU L D, DUAN W S, ZHAO Y, et al. Intervention effects of Polygonatum polysaccharides in rats model of vascular dementia[J]. Journal of Chinese Medicinal Materials,2018,41(9):2212−2215. [18] 黄红, 陈碧清, 姜宁, 等. 鲜天麻对睡眠干扰诱导小鼠学习记忆障碍的改善作用[J]. 中草药,2020,51(9):2509−2516. [HUANG H, CHEN B Q, JIANG N, et al. Effect of fresh Gastrodia elata Blume on learning and memory impairment induced by sleep disturbance in mice[J]. Chinese Herbal Medicine,2020,51(9):2509−2516. [19] ZHANG L M, QIU Z K, ZHAO N, et al. Anxiolytic-like effects of YL-IPA08, a potent ligand for the translocator protein (18 kDa) in animal models of post-traumatic stress disorder[J]. International Journal of Neuropsychopharmacology,2014,17(10):1659−1669. doi: 10.1017/S1461145714000479
[20] WANG S G, SU G W, ZHANG Q, et al. Walnut (Juglans regia) peptides reverse sleep deprivation-induced memory impairment in rat via alleviating oxidative stress[J]. Journal of Agricultural and Food Chemistry,2018,66(40):10617−10627. doi: 10.1021/acs.jafc.8b03884
[21] SHAH H, SHIN A C. Meal patterns after bariatric surgery in mice and rats[J]. Appetite,2020,146:104340. doi: 10.1016/j.appet.2019.104340
[22] CHEN D, WANG J, XING Y, et al. Behavioral assessment of post-stroke depression and anxiety in rodents[J]. Brain Hemorrhages,2020,1(2):105−111. doi: 10.1016/j.hest.2020.02.004
[23] YELITHAO K, SURAYOT U, LEE J H, et al. RAW264.7 cell activating glucomannans extracted from rhizome of Polygonatum sibiricum[J]. Preventive Nutrition and Food Science,2016,21(3):245−254. doi: 10.3746/pnf.2016.21.3.245
[24] ZHAO P, ZHAO C C, LI X, et al. The genus Polygonatum: A review of ethnopharmacology, phytochemistry and pharmacology[J]. Journal of Ethnopharmacology,2018,214:274−291. doi: 10.1016/j.jep.2017.12.006
[25] CUI X W, WANG S Y, CAO H, et al. A review: The bioactivities and pharmacological applications of Polygonatum sibiricum polysaccharides[J]. Molecules,2018,23(5):1170. doi: 10.3390/molecules23051170
[26] UNAL G, CANBEYLI R. Psychomotor retardation in depression: A critical measure of the forced swim test[J]. Behavioural Brain Research,2019,372:112047. doi: 10.1016/j.bbr.2019.112047
[27] SUMAYA I C, BAILEY D, CATLETT S L. Differential effects of a short-term high-fat diet in an animal model of depression in rats treated with the 5-HT3 receptor antagonist, ondansetron, the 5-HT3 receptor agonist, 2-methyl-5-HT, and the SSRI, fluoxetine[J]. Pharmacology Biochemistry and Behavior,2016,144:78−84. doi: 10.1016/j.pbb.2016.03.005
[28] DUVAL F, MOKRANI M, ERB A, et al. Thyroid axis activity and dopamine function in depression[J]. Psychoneuroendocrinology,2021,128:105219. doi: 10.1016/j.psyneuen.2021.105219
[29] COLLO G, PICH E M. A human translational model based on neuroplasticity for pharmacological agents potentially effective in treatment-resistant depression: Focus on dopaminergic system[J]. Neural Regeneration Research,2020,15(6):1027−1029. doi: 10.4103/1673-5374.270305
[30] ROBERTS C, SAHAKIAN B J, ROBBINS T W. Psychological mechanisms and functions of 5-HT and SSRIs in potential therapeutic change: Lessons from the serotonergic modulation of action selection, learning, affect, and social cognition[J]. Neuroscience & Biobehavioral Reviews,2020,119:138−167.
[31] RAISON C L, CAPURON L, MILLER A H. Cytokines sing the blues: Inflammation and the pathogenesis of depression[J]. Trends in Immunology,2006,27(1):24−31. doi: 10.1016/j.it.2005.11.006
[32] GOLD P W. Endocrine factors in key structural and intracellular changes in depression[J]. Trends in Endocrinology & Metabolism, 2021, 32(4): 212−223.
[33] RENGASAMY M, MARSLAND A, MCCLAIN L, et al. Longitudinal relationships of cytokines, depression and anhedonia in depressed adolescents[J]. Brain, Behavior, and Immunity,2021,91:74−80. doi: 10.1016/j.bbi.2020.09.004
[34] TAUIL C B, DA ROCHA LIMA A D, FERRARI B B, et al. Depression and anxiety in patients with multiple sclerosis treated with interferon-beta or fingolimod: Role of indoleamine 2, 3-dioxygenase and pro-inflammatory cytokines[J]. Brain, Behavior, & Immunity-Health,2020,9:100162.
[35] 陈娟, 李友元, 田伟, 等. 黄精多糖对帕金森病大鼠脑组织中PPAR-γ表达的影响[J]. 现代生物医学进展,2010,10(5):814−817. [CHEN J, LI Y Y, TIAN W, et al. Effect of polygona-polysaccharose (PP) on expression of PPAR-γ in brain tissue of rats with Parkinson disease[J]. Progress in Modern Biomedicine,2010,10(5):814−817. [36] WOLF W A, YOUDIM M B H, KUHN D M. Does brain 5-HIAA indicate serotonin release or monoamine oxidase activity?[J]. European Journal of Pharmacology,1985,109(3):381−387. doi: 10.1016/0014-2999(85)90399-1
[37] ZHANG M D, TAO X, PAN R L, et al. Antidepressant-like effects of cajaninstilbene acid and its related mechanisms in mice[J]. Fitoterapia,2020,141:104450. doi: 10.1016/j.fitote.2019.104450
[38] LI C C, JIANG N, GAN L, et al. Peripheral and cerebral abnormalities of the tryptophan metabolism in the depression-like rats induced by chronic unpredicted mild stress[J]. Neurochemistry International,2020,138:104771. doi: 10.1016/j.neuint.2020.104771
-
期刊类型引用(7)
1. 武玫怡,焦文娟,赵甜甜,刘俊,周芳,刘伟峰,张业辉,南海军,陈晓瑛,黄利华. 高静水压与水煮处理对热带海参品质的影响. 肉类研究. 2025(01): 25-33 .  百度学术
百度学术
2. 王素梅,孟少华,赵建生,赵琳,单吉祥,徐俊涛. 肉制品低钠策略及问题分析. 食品与发酵工业. 2025(07): 405-412 .  百度学术
百度学术
3. 赵宇,丁甜,牛力源,沈默斐,孙宇豪,廖新浴. 自热食品品质提升与安全控制的研究进展. 包装工程. 2024(11): 118-127 .  百度学术
百度学术
4. 周琪,张佳敏,王博,王卫,刘云鹤,钟正国. 肉制品风味形成机制及加工方式对风味影响的研究进展. 西华大学学报(自然科学版). 2024(04): 74-84 .  百度学术
百度学术
5. 陶琦,钟飞,王志文,郑豪. 纳米材料在食品生产和保鲜中的应用. 包装学报. 2024(04): 89-100 .  百度学术
百度学术
6. 郭湘蕾,陈凌利,陈慧,于传龙,王文君. 预制菜生产过程关键加工技术研究进展. 食品科技. 2024(08): 64-71 .  百度学术
百度学术
7. 张顺君,王东亮,陈宏柱,汪雨晗,李新福. 超高压杀菌对酱卤肉制品贮藏期品质的影响. 肉类研究. 2023(12): 54-60 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



